Сучасні аспекти лікування та моніторингу остеоартрозу кистей
Дубкова А.Г., Крилова А.С., Цимбалюк Т.С.
Резюме. Актуальність. Остеоартроз (ОА) суглобів кистей — одна з найчастіших локалізацій за поширенням після ОА колінних суглобів. ОА кистей супроводжується болем, утрудненням стиснення кисті, що призводить до порушення функції кисті — неможливості виконувати звичайні, повсякденні дії — і погіршує якість життя пацієнтів. Мета: виконати огляд літератури та висвітлити сучасні аспекти лікування та моніторингу ОА кистей. Методи: проведено пошук у друкованих і електронних виданнях, наукових пошукових базах Medline та PubMed із застосуванням методів аналізу, порівняння та узагальнення інформаційних даних. Відповідні статті, що стосуються моніторигу та лікування ОА суглобів кистей, ідентифіковані й розглянуті. Результати. У статті подано класифікацію ОА суглобів кистей, дані про поширеність цього захворювання. Наведені класифікаційні критерії, шкали оцінки функції суглобів кисті. Авторами огляду розглянуті сучасні рекомендації Американського коледжу ревматології (American College of Rheumatology — ACR) і Європейської антиревматичної ліги (European League Against Rheumatism — EULAR) з діагностики та лікування ОА суглобів кистей. У статті обговорюються питання медикаментозної терапії ОА суглобів кистей, зокрема можливості застосування хондроїтину сульфату, його механізм дії та плейотропні ефекти. Проаналізовано нові дані щодо призначення біологічної терапії та нові напрямки лікування ОА кистей. Висновки. ОА кистей — актуальна проблема сучасної ревматології, яка ще має багато питань та напрямків, що потребують подальшого дослідження. Застосування хондроїтину сульфату у хворих на ОА кистей сприяє суттєвому зменшенню вираженості больового синдрому, уповільненню прогресування, поліпшенню функціонального стану суглобів і перебігу коморбідних захворювань завдяки його плейотропним ефектам. Представлені нові варіанти таргетної терапії, що ґрунтуються на чіткому розумінні патогенезу ОА, які покращують перебіг захворювання на тваринних моделях. Необхідна подальша оцінка цих методів лікування у пацієнтів з ОА кистей.
DOI: 10.32471/rheumatology.2707-6970.85.16375
Остеоартроз (ОА) — поліетіологічна хвороба, що ініціюється взаємодією генетичних (спадкових) факторів і факторів середовища (механічних, включаючи травматичні, метаболічних), які порушують властивості хрящової клітини і субхондральної кістки, та призводять до розвитку персистуючого запалення у суглобі (реактивного синовіту), внаслідок чого відбуваються деструктивні зміни у суглобовому хрящі та субхондральній кістці, а також ураження всіх суглобових структур (м’язи, зв’язковий апарат, внутрішньосуглобові структури — меніски тощо). Це гетерогенна група захворювань різної етіології з подібними біологічними, морфологічними, клінічними проявами і наслідками, в основі яких лежить ураження всіх компонентів суглоба: хряща, субхондральної кістки, синовіальної оболонки, зв’язок, капсули, навколосуглобових м’язів [12]. Незважаючи на те що ОА суглобів кистей — одна з найчастіших локалізацій за поширеністю після ОА колінних суглобів, менеджмент саме цієї категорії пацієнтів досі залишається актуальною проблемою. ОА кистей супроводжується болем, утрудненням стиснення кисті, що призводить до порушення функції кисті — неможливості виконувати звичайні, повсякденні дії — і погіршує якість життя пацієнтів.
Прийнято виділяти три основні варіанти ОА суглобів кистей:
- ОА міжфалангових суглобів кистей (проксимальних (ПМФС) та дистальних міжфалангових суглобів (ДМФС));
- ОА зап’ястно-п’ясткового суглоба (ЗППС) I пальця;
- ерозивний ОА (ЕОА).
ОА міжфалангових суглобів кистей. Вузликовий остеоартрит (ВОА), при якому клінічно визначаються вузлики у проєкції епіфізів фаланг, які формують ДМФС кистей, — вузлики Гебердена, ПМФС — вузлики Бушара. Характерним є типовий набряк міжфалангових суглобів, який може збільшитися до максимального розміру під час його розвитку. На ранніх стадіях ДМФС можуть стати болючими, еритематозними та мати виражену скутість. Основний патогенез цього процесу включає кісткове збільшення основи міжфалангових суглобів, синовіт і набряк м’яких тканин ураженої ділянки. Зазначимо, що наявність вузлів Гебердена та Бушара може спостерігатися як із супутніми симптомами болю, скутості та порушенням функції, так і без них [21, 35].
ОА суглобів основи великого пальця. Перший ЗППС є відомою локалізацією ОА кисті. Часто спостерігається двобічно і є основною причиною симптоматичного болю в суглобах. Фактори ризику для першого ЗППС включають механічні фактори та професійний анамнез. Частим симптомом є «квадратна» рука. Ця форма часто поєднується і може співіснувати з ВОА кистей [17].
ЕОА. Ерозивний фенотип ОА кисті є особливо агресивною формою ураження кистей. Цей фенотип пов’язаний із виникненням ерозій, особливо у ПМФС та ДМФС. При цьому у суглобах спостерігається центральна ерозія з відповідною характерною деформацією «крила чайки» та остеофітами, що спостерігаються з обох боків суглоба. Важливо виключити інші форми запального артриту при диференційній діагностиці. Лікування та діагностика цієї форми завжди викликає найбільші труднощі у клініцистів [18].
Для діагностики ОА кистей використовують класифікаційні критерії Американської колегії ревматологів (American College of Rheumatology — ACR) та Європейської антиревматичної ліги (European League Against Rheumatism — EULAR). У 1990 р. опубліковано класифікаційні критерії ОА кистей, розроблені ACR [3]. Вони визначають найбільш характерні прояви хвороби та їхню локалізацію, а також ознаки, що свідчать про відсутність запального захворювання суглобів. До найбільш характерних проявів автори критеріїв відносять біль і скутість у кистях, утворення щільних вузликів, а також деформацію суглобів кистей (зміна осі суглоба).
Клінічні критерії (Altman 1990)
1. Біль або скутість.
2. Кісткові розростання ≥2 суглобів з 10 оцінюваних*.
3. <3 припухлих п’ятково-фалангових суглобів (ПФС).
4а. Кісткові розростання, що включають ≥2 ДМФС.
4б. Деформація ≥1 суглоба з 10 оцінюваних*.
Виокремлюють дві групи суглобів (по 10 суглобів у кожній), залучення яких найбільш типове для ОА кистей. Перша група позначається як «10 оцінюваних суглобів». До неї входять ДМФС і ПМФС II і III пальців, а також I ЗППС обох кистей. Друга група включає всі ДМФС. При цьому ДМФС II і III пальців входять як до першої, так і до другої групи. Як ознаку, що дозволяє виключити наявність запального захворювання суглобів, використовують кількість припухлих ПФС. Вона повинна бути <3. Діагноз ОА кистей може бути підтверджений у разі виявлення у хворого трьох обов’язкових і одного додаткового критеріїв. Обов’язковими критеріями є наявність болю або скутості в кистях, щільних вузликів у ділянці ≥2 з 10 вибраних суглобів, кількість припухлих ПФС <3. Додатковими критеріями є наявність щільних вузликів у ділянці ДМФС (вузлики Гебердена) і деформація ≥2 з 10 вибраних суглобів. Виявлення вузликів Гебердена в ділянках II і III ДМФС дозволяє зафіксувати наявність відразу двох критеріїв (одного обов’язкового і одного — додаткового). Критерії ACR мають дуже високу чутливість і специфічність — 92 і 98% відповідно. Незважаючи на це, вони не дозволяють вирішити всі діагностичні проблеми, що виникають у повсякденній практиці. Тому EULAR створена група експертів, яка підготувала у 2010 р. рекомендації з діагностики ОА кистей для практичних лікарів [43]. Ці діагностичні критерії враховують багато аспектів, пов’язаних із захворюванням:
1. Факторами ризику ОА суглобів кистей є жіноча стать, вік старше 40 років, менопауза, сімейний анамнез, надмірна маса тіла, висока мінеральна щільність кісткової тканини, збільшення м’язової сили передпліччя, гіпермобільність суглобів, попереднє ушкодження кисті, підвищене професійне навантаження на суглоби кистей. Рівень доказовості — Ib–IIb, сила рекомендації — 69% (95% довірчий інтервал (ДІ) 54–84%).
2. Типовими симптомами ОА суглобів кистей є біль при русі та незначна ранкова скутість або тугорухливість в одному чи декількох суглобах у будь-який час доби; симптоми зазвичай мають інтермітуючий перебіг і виникають у ДМФС, ПМФС, ЗППС I, II і III пальців. За наявності цих класичних ознак у осіб віком старше 40 років з упевненістю може бути встановлений клінічний діагноз «ОА суглобів кисті». Рівень доказовості — IIb, сила рекомендації — 85% (95% ДІ 77–92%).
3. Типові клінічні ознаки ОА суглобів кистей — вузлики Гебердена і Бушара чи кісткові розростання з деформацією, латеральна девіація міжфалангових суглобів, підвивихи й аддукції (приведення) основи I пальця кисті або без деформації із залученням характерних суглобів — ДМФС, ПМФС, основи I пальця кисті та ПФС I, II і III пальців. Рівень доказовості — Ib–IV, сила рекомендації — 80% (95% ДІ 69–90%).
4. Функціональна недостатність суглобів при ОА кистей може бути такою ж тяжкою, як і при ревматоїдному артриті. Функція суглобів повинна ретельно оцінюватися і контролюватися за допомогою валідованих критеріїв або методик. Рівень доказовості — IIb, сила рекомендації — 57% (95% ДІ 42–73%).
У рекомендаціях наведені такі шкали оцінки функції суглобів кисті:
- Health Assessment Questionnaire (HAQ).
- Arthritis Hand Function Test (AHFT).
- Arthritis Impact Measurement Scale 2 (AIMS2).
- Cochin scale Score for Assessment andquantification of Chronic Rheumatic Affections of the Hands (SACRAH).
- Functional Index for Osteoarthritis of the Hand (FIHOA).
- Australian/Canadian Osteoarthritis Hand Index (AUSCAN).
Health Assessment Questionnaire (HAQ)
Як і при ревматоїдному артриті, функціональний стан хворих оцінюється за допомогою HAQ-DI (Health Assessment Questionnaire Disability Index)
| Тестові запитання | До лікування | Через 1 міс |
|---|---|---|
| І. Одягання і вранішній туалет | ||
| 1. Чи можете застібати ґудзики, шнурувати черевики? | 0 1 2 3 | 0 1 2 3 |
| 2. Чи можете самостійно помити голову? | 0 1 2 3 | 0 1 2 3 |
| ІІ. Вставання | ||
| 3. Чи можете встати зі стільця? | 0 1 2 3 | 0 1 2 3 |
| 4. Чи можете самостійно лягти і встати з ліжка? | 0 1 2 3 | 0 1 2 3 |
| ІІІ. Прийом їжі | ||
| 5. Чи можете розрізати м’ясо ножем? | 0 1 2 3 | 0 1 2 3 |
| 6. Чи можете піднести повну чашку чаю до рота? | 0 1 2 3 | 0 1 2 3 |
| 7. Чи можете відкрити пакет молока? | 0 1 2 3 | 0 1 2 3 |
| IV. Прогулянка | ||
| 8. Чи можете гуляти по рівній місцевості? | 0 1 2 3 | 0 1 2 3 |
| 9. Чи можете піднятися сходами (на 5 сходин)? | 0 1 2 3 | 0 1 2 3 |
| V. Гігієна | ||
| 10. Чи можете самостійно помитись і витертися? | 0 1 2 3 | 0 1 2 3 |
| 11. Чи можете прийняти ванну? | 0 1 2 3 | 0 1 2 3 |
| 12. Чи можете зайти і вийти з туалету? | 0 1 2 3 | 0 1 2 3 |
| VI. Досягання | ||
| 13. Чи можете дотягнутись і взяти з полиці над головою 2-кілограмовий пакет? | 0 1 2 3 | 0 1 2 3 |
| 14. Чи можете нагнутись і підняти з підлоги одяг? | 0 1 2 3 | 0 1 2 3 |
| VII. Стискання | ||
| 15. Чи можете відкрити двері машини? | 0 1 2 3 | 0 1 2 3 |
| 16. Чи можете відкрити закручену банку, яку попередньо відкрили? | 0 1 2 3 | 0 1 2 3 |
| 17. Чи можете відкрити і закрити кран? | 0 1 2 3 | 0 1 2 3 |
| VIII. Мобільність, активність | ||
| 18. Чи можете ходити за покупками? | 0 1 2 3 | 0 1 2 3 |
| 19. Чи можете сісти в машину і вийти з машини? | 0 1 2 3 | 0 1 2 3 |
| 20. Чи можете виконувати домашню роботу (пилососити, працювати у дворі)? | 0 1 2 3 | 0 1 2 3 |
Примітка: 8 категорій. 20 запитань. Кожне оцінюється від 0 до 3.
0 — легко;
1 — з незначними труднощами;
2 — важко, або з допомогою;
3 — не можу.
Для пунктів, де використовуються допоміжні засоби, виставляється 2 бали.
HAQ оцінюється як середнє значення з найгірших за кожною з 8 категорій.
Arthritis Hand Function Test (AHFT)
Тест функції руки Джебсена — Тейлора є одним із найстаріших та найбільш застосовуваних інструментів кількісної оцінки рухової функції кисті. Розроблений у 1969 р. колективом американських дослідників, тест неодноразово витримував перевірку на валідність та надійність. Тест охоплює компоненти з категорій активності та функціонування Міжнародної класифікації функціонування, інвалідності та здоров’я.
Автори намагалися зробити тест максимально практично орієнтованим, тобто таким, що оцінює ефективність виконання завдань, типових для повсякденної діяльності пацієнта. Інструмент складається із семи субтестів, які виконуються на час:
- написання короткого простого речення (24 літери);
- перевертання карток розміром 7,6×11,7 см;
- збирання дрібних предметів (монет, скріпок для паперу та кришечок від пляшки);
- імітація процесу годування;
- складання шашок одна на одну;
- переставляння великих легких предметів (порожніх бляшаних банок);
- переставляння великих важких предметів (бляшаних банок вагою 0,453 кг).
Кожен субтест виконується однією рукою, спершу — недомінуючою, потім — домінуючою. Максимальний час, відведений на виконання одного субтесту, — 120 с.
Характерно, що пацієнтам віком молодше 8 років не проводять субтест «написання речення». Існують також дві модифіковані версії тесту Джебсена — Тейлора, до яких входять 3 та 8 завдань відповідно.
Оцінювання проводять шляхом зіставлення результатів пацієнта з нормативами, встановленими для відповідного віку та статі. Порівнюють як сумарний час за тест, так і результати кожного із семи субтестів окремо. Розрахунок проводять за формулою:
Результат = (нормативний час — час пацієнта)/стандартне відхилення.
Результат, що перевищує 2,0, означає, що пацієнт виконує завдання надто повільно, тобто моторна функція кисті порушена.
Функціональний індекс для ОА кистей (FIHOA)
FIHOA дає оцінку функціональних порушень, пов’язаних з ОА дрібних суглобів, від 0 (відсутність функціональних порушень) до 30 балів (максимальне порушення). Це опитувальний лист, що заповнюється лікарем (або пацієнтом), який складається з 10 запитань, оцінених за 4-бальною шкалою. Загальний бал коливається від 0 до 30, при затвердженому порозі 5 балів можна розрізнити симптоматичних та несимптоматичних пацієнтів.
FIHOA для ОА кистей рук є еквівалентом індексу Лєкєна для ОА кульшового суглоба чи коліна.
1. Чи спроможні ви провернути ключ у замку?
2. Чи спроможні ви нарізати м’ясо на шматки?
3. Чи спроможні ви розрізати тканину чи папір за допомогою ножиць?
4. Чи можете ви підняти повну пляшку з водою однією рукою?
5. Чи можете ви стиснути кисть у кулак?
6. Чи спроможні ви зав’язати вузол?
7. Чи можете ви використовувати викрутку?
8. Чи можете ви застібати ґудзики?
9. Чи можете ви писати тривалий час?
10. Чи змогли б ви потиснути руку без неприємних відчуттів?
Функціональний індекс з оцінки ОА суглобів кистей (AUSCAN)
Оцінка болю впродовж останніх 48 год:
Критерії оцінки
1. У стані спокою (тобто коли ви не користуєтеся руками)?
2. Коли ви міцно тримаєте предмети пальцями рук?
3. Коли ви піднімаєте предмети руками?
4. Коли ви перевертаєте предмети руками?
5. Коли ви стискаєте предмети руками?
Сума
Оцінка скутості:
Критерії оцінки
6. Наскільки гостро ви відчуваєте скутість у кистях своїх рук зранку, відразу після прокидання (упродовж останніх 48 год)?
Сума
Утруднення у повсякденній діяльності:
Критерії оцінки
7. Повертати водопровідний кран (відкрити/закрити)?
8. Повертати круглу дверну чи іншу ручку?
9. Застібати ґудзики?
10. Застібати замки ювелірних прикрас (наприклад годинника, запонок, бус, брошок, браслетів)?
11. Відкривати нову скляну банку?
12. Нести повний ковш однією рукою?
13. Чистити овочі/фрукти від шкірки?
14. Піднімати великі важкі предмети?
15. Викручувати випрану білизну?
Сума
Сумарний індекс AUSCAN
5. У хворих із множинним залученням суглобів кистей підвищується ризик розвитку ОА колінних, кульшових та інших суглобів (генералізований ОА), що необхідно враховувати в діагностичному процесі. Рівень доказовості — IIa–IIb, сила рекомендації — 77% (95% ДІ 62–92%).
6. Визначено підгрупи пацієнтів із множинними факторами ризику, асоціаціями та наслідками, які потребують різних підходів, зокрема з ОА міжфалангових суглобів (з вузликами і без них), ОА I пальця кисті та ЕОА. Рівень доказовості — IIa–IIb, сила рекомендації — 68% (95% ДІ 56–79%).
7. Ерозивне ураження розвивається в міжфалангових суглобах і характеризується такими рентгенологічними змінами: субхондральні ерозії, підвивихи і кісткові анкілози. Початок захворювання зазвичай гострий, супроводжується вираженим болем і функціональною недостатністю суглобів, симптомами запалення (скутість, набряк м’яких тканин, почервоніння, парестезії), невеликим підвищенням рівня C-реактивного білка і несприятливим прогнозом порівняно з неерозивним ОА. Рівень доказовості — IIa–IIb, сила рекомендації — 87% (95% ДІ 81–93%).
9. Оглядова рентгенографія обох кистей у прямій проєкції на одній плівці є золотим стандартом діагностики ОА. Типові ознаки: звуження суглобової щілини, наявність остеофітів, субхондральний склероз і субхондральні кісти. ЕОА характеризується також субхондральними ерозіями. Додаткові інструментальні дослідження показані рідко. Рівень доказовості — Ib–IIb, сила рекомендації — 87% (95% ДІ 81–93%).
10. Лабораторне дослідження крові для діагностики OA кистей не потрібне, але може бути використане для підтвердження або виключення супутніх захворювань. За наявності виражених запальних симптомів і ознак, особливо при ураженні нетипових для ОА суглобів, необхідне дослідження крові для виключення запального артриту. Рівень доказовості — Ib–IIb, сила рекомендації — 78% (95% ДІ 63–92%).
8. Диференційна діагностика ОА кистей зазвичай проводиться із псоріатичним артритом (при якому може бути ураження ДМФС або осьове ураження суглобів), ревматоїдним артритом (переважне залучення до процесу ЗПС, ПМФС і променезап’ясткових суглобів), подагрою (можливе поєднання з ОА), гемохроматозом (особливо при ураженні ЗПС і променезап’ясткових суглобів). Рівень доказовості — Ib–IIb, сила рекомендації — 81% (95% ДІ 73–89%). (рис. 1).
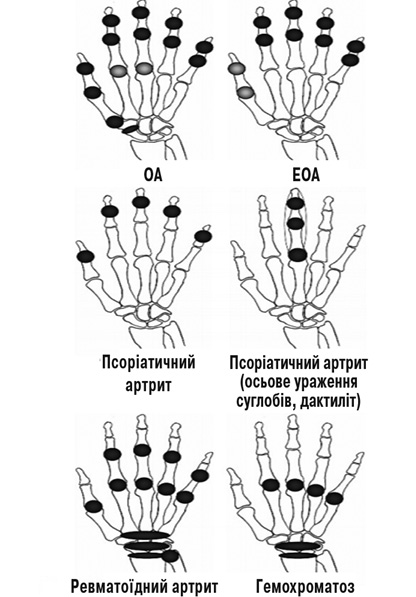
Ерозії при ЕОА можуть виникати до появи типових для ОА кистей вузликів. При цьому зазвичай спостерігається поява центральної ерозії у проксимальному відділі суглоба в поєднанні зі склеротичними змінами дистальної фаланги, що призводить до появи на рентгенівському знімку контурів, що нагадують крила чайки. Для псоріатичного артриту більш характерне формування крайових ерозій дистальної фаланги, що супроводжуються періостальною реакцією. Зміни, які виникають при цьому в ділянці основи дистальної фаланги, за формою схожі на мишачі вуха. Нарешті, ерозії при РА мають зазвичай крайову локалізацію, формуються на тлі навколосуглобового остеопорозу, поєднуються із тривалою ранковою скутістю, підвищенням рівня гострофазових показників і ревматоїдного фактора. При цьому зміни локалізуються в ПМФС і ПФС.
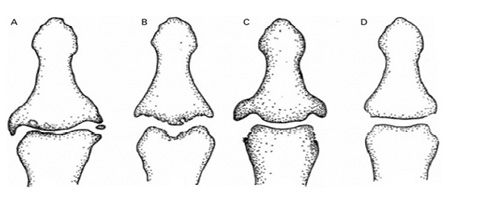
(А) артроз (ОА): вогнищеве звуження, крайовий остеофіт, склероз, остеохондральні тіла;
(B) ерозійний ОА: субхондральна ерозія;
(C) псоріаз: проліферативна крайова ерозія, підвищена щільність кісткової тканини;
(D) ревматоїдний артрит: непроліферативна крайова ерозія, остеопенія.
Терапія ОА суглобів кисті — одна з актуальних і обговорюваних тем. У 2019 р. розроблені Рекомендації щодо ведення ОА переважно для лікарів первинної ланки охорони здоров’я, що включають спрощені критерії діагностики, шляхи надання медичної допомоги та «червоні прапорці» — ситуації, що потребують направлення до фахівця [34] (рис. 3):
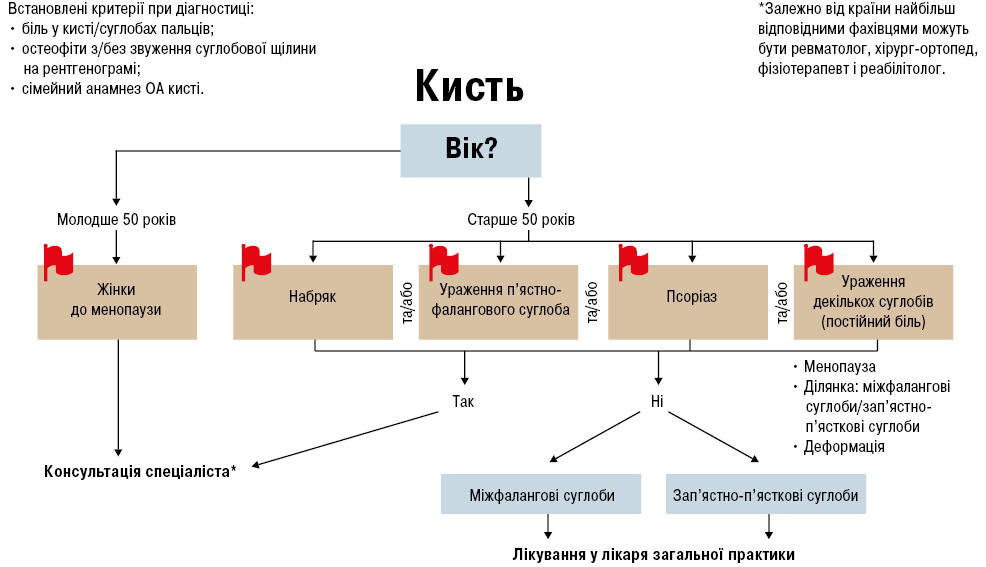
На сьогодні, на жаль, немає ідеального лікування пацієнтів із ОА кистей. Усі настанови і рекомендації далекі від єдиної думки щодо ефективної допомоги. На сьогодні в арсеналі практичного лікаря є рекомендації різних організацій, що займаються вивченням проблеми ОА, серед них — Рекомендації EULAR з менеджменту ОА кистей 2018 р. [20] та Рекомендації ACR 2019 р. [39] з менеджменту ОА суглобів кистей, кульшового і колінного суглоба.
Рекомендації EULAR 2018 р. зручні у використанні і включають всього 10 основних положень (табл. 1):
| № з/п | Рекомендації | Рівень доказовості | Клас рекомендацій | Рівень згоди (0–10) |
|---|---|---|---|---|
| 1 | Необхідне впровадження освітніх програм, спрямованих на навчання ергономічним методикам і використання допоміжних пристосувань, а також на підвищення фізичної активності | 1b | A | 9,3 (1,1) |
| 2 | Кожному пацієнту слід призначати вправи для поліпшення функціональної здатності та збільшення м’язової сили в кистях, що сприяє зниженню інтенсивності болю в них | 1a | A | 9,1 (1,6) |
| 3 | Для зменшення вираженості болю в ЗППС та ОА суглобів основи великого пальця при ОА показано тривале носіння ортезів | 1b | A | 9,3 (1,0) |
| 4 | Локальна терапія краще системної у зв’язку з нижчим ризиком розвитку небажаних явищ. Серед лікарських препаратів для локальної фармакотерапії нестероїдні протизапальні препарати (НПЗП) для місцевого застосування є препаратами вибору | 1b | A | 8,6 (1,8) |
| 5 | Симптоматичні препарати швидкої дії, особливо НПВП, слід призначати для полегшення симптомів захворювання протягом обмеженого часу («на вимогу») | 1a | A | 9,4 (0,9) |
| 6 | Хондроїтину сульфат (ХС) можна застосовувати у пацієнтів з ОА суглобів кистей для зменшення вираження болю і поліпшення функції | 1b | A | 7,3 (2,7) |
| 7 | Внутрішньосуглобові ін’єкції глюкокортикоїдів (ГК) не рекомендовані при ОА суглобів кистей, проте допустиме ін’єкційне введення ГК в міжфалангові суглоби за наявності синовіту | 1a*-1b** | A | 7,9 (2,4) |
| 8 | Пацієнтам з ОА суглобів кистей не показані генно-інженерні біологічні препарати або базисні протизапальні препарати | 1a | A | 8,8 (1,8) |
| 9 | До хірургічних методів лікування у пацієнтів із деформаціями суглобів кистей слід вдаватися лише за неефективності консервативної терапії. Трапецектомія рекомендована при ОА I ЗППС, а артродез/артропластика — при ОА міжфалангових суглобів | 5 | D | 9,4 (1,4) |
| 10 | Пацієнти з ОА суглобів кистей підлягають тривалому спостереженню | 5 | D | 9,5 (1,7) |
У 2019 р. опубліковані рекомендації ACR, в яких пропонуються підходи лікування пацієнтів із ОА залежно від локалізації, зокрема запропоновані методи лікування і ОА кистей. Так, при ОА кистей з нефармакологічних методів настійно рекомендовані (рис. 4): освітні програми для пацієнтів, лікувальна фізкультура (вправи для кистей) і носіння ортеза для ЗПС. Умовні рекомендації стосуються когнітивно-поведінкової терапії; використання кінезіотейпірування для ЗПС і ортезів на інші суглоби кистей; голковколювання (за даними ряду досліджень, цей метод виявляє ефективний анальгезивний ефект); термічних впливів (локальне застосування тепла чи холоду), а також застосування парафіну як додаткового методу теплової терапії.
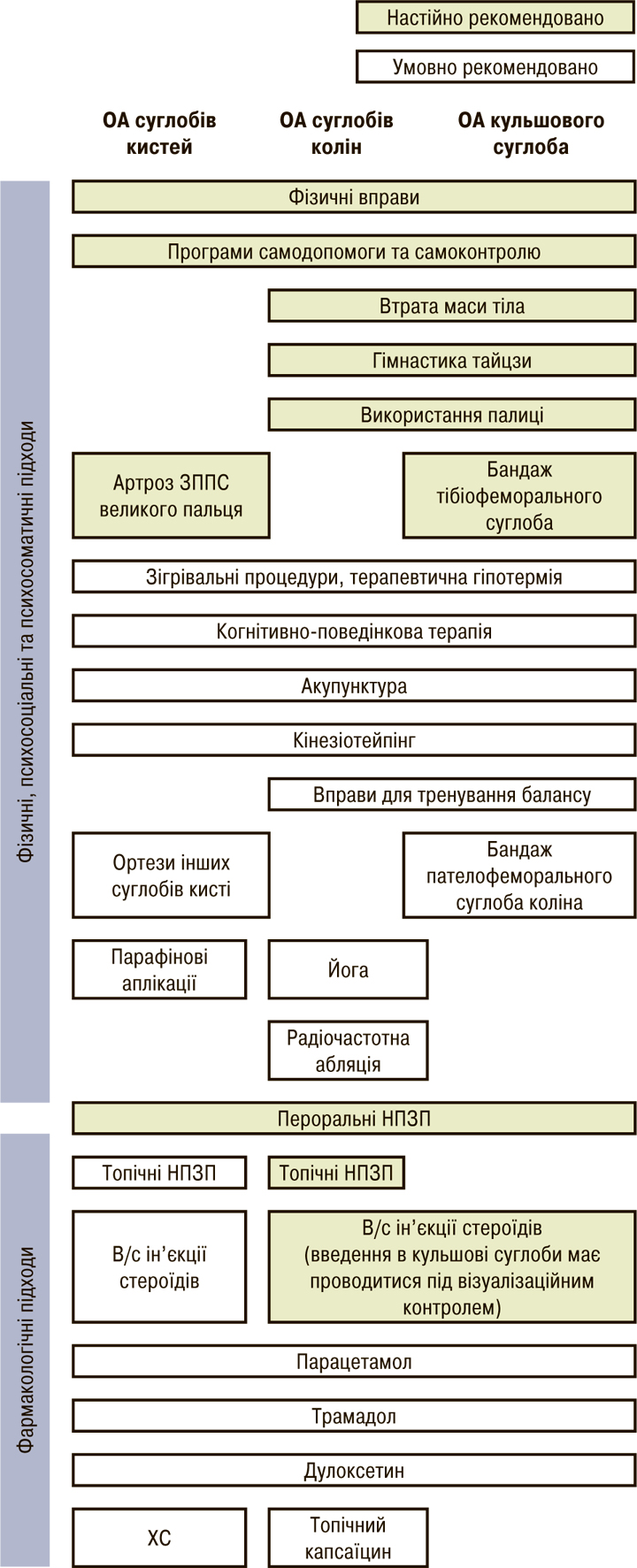
в/с — внутрішньосуглобово.
З фармакологічних препаратів (рис. 4) настійно рекомендовано лише пероральне застосування НПЗП; умовно рекомендовані: застосування ХС; НПЗП для локального користування; внутрішньосуглобові ін’єкції ГК; ацетамінофен; дулоксетин (можливе застосування як окремо, так і в поєднанні з НПЗП); трамадол (призначається пацієнтам із протипоказаннями до застосування НПЗП, у разі неефективності інших методів лікування і відсутності доступних хірургічних варіантів).
Як бачимо, в останніх рекомендаціях EULAR і ACR єдиним рекомендованим препаратом групи симптоматичних повільнодіючих структурно-модифікуючих препаратів (SYSADOA) для лікування пацієнтів з ОА суглобів кисті є ХС.
ХС — гідрофільний сульфатований глікозамінглікан, який складається з довгого нерозгалудженого ланцюга полісахариду з альтернативними одиницями N-ацетилгалактозаміна та глюкуронової кислоти. Компоненти N-ацетилгалактозаміну здебільшого моносульфатовані (зазвичай у 4-й та 6-й позиції). ХС — біологічний полімер, який діє як еластичний поєднувальний матрикс між протеїновими нитками у хрящі [1].
В останні роки отримані результати, які відображають механізми дії ХС [15]. ХС-4, -6 запобігає апоптозу хондроцитів шляхом запобігання активації р38 мітогенактивуючої протеїнкінази, що викликає каскад запалення, підвищує синтез протеогліканів, знижує синтез простагландину E2 (PGE2), металопротеїнази (ММП), інтерлейкіну (IL)-1, -6, -8. Серед його механізмів дії також модуляція протеолітичної активності внаслідок інгібування ММП — стромелізину та колагенази, протизапальний ефект, через інгібування різних запальних факторів IL-1β, NF-kB, IL-6, ММП за рахунок пригнічення iNO-синтази, циклооксигенази (ЦОГ)-2, PGE2, антиоксидантний ефект (зменшення пероксидації ліпідів, фрагментації ДНК, зменшення окиснення білків, зменшення гідроксильних радикалів кисню і супероксидних аніонів). Крім того, він має структурно-модифікуючий вплив на субхондральну кістку через регуляцію співвідношення остеопротегерину/RANKL на остеобластах. ХС стимулює синтез гіалуронової кислоти та підвищення в’язкості розчину гіалуронової кислоти, зберігає запас кальцію у кістках, підвищує регуляцію біосинтезу глікозаміноглікану через остеоцити, стимулює кісткоутворення та здатність до регенерації при кісткових ушкодженнях, через стимуляцію колагену 1-го типу стимулює проліферацію та диференціювання остеобластів [32].
Крім того, в дослідженнях останніх років показано, що застосування ХС може бути корисним і при інших захворюваннях, де NF-kB та NO відіграють також ключову роль у патогенезі [10]. Встановлено, що ХС зменшує активацію NF-kB, що викликається IL-1β у гепатоцитах при гепатиті. ХС знижував маркери системного запалення IL-6 та СРБ, приводив до чіткого зниження проявів атеросклерозу при рестенозі стегнової артерії та зменшував прояви атеросклерозу в аорті [25]. Вивчення впливу ХС на атеросклероз із супутнім артритом in vivo показало, що ХС знижує рівень С-реактивного білка, IL-6, COX-2, NF-kB у плазмі крові та сповільнює прогресування атеросклерозу [16].
Встановлено, що NF-kB відіграє важливу роль у розвитку різної патології ЦНС, зокрема виникненні хвороби Альцгеймера [11]. ХС продемонстрував нейропротекторну дію, яка проявлялася зменшенням кількості фактора некрозу пухлини (ФНП)-α в астроцитах мозку та інгібуванням NF-kB, зменшуючи вираженість запалення та гальмуючи апоптоз нервової тканини [11]. Зменшуючи секрецію ФНП-α та блокуючи транслокацію NF-kB, ХС ефективно захищав від втрати нейронів при експериментальному аутоімунному енцефаломієліті та увеїті [11].
Крім того, встановлено, що при псоріазі 66% псоріатичних бляшок мають підвищену експресію NF-kB. Також гіперекспресія NF-kB спостерігалася в ураженій псоріазом шкірі порівняно з нормальною шкірою. При застосуванні ХС у пацієнтів із гонартрозом відзначено, крім зменшення вираженості болю, покращення фізичних функцій та якості життя, ще й зменшення псоріатичного ураження стоп [11].
Жирова тканина як ендокринний орган синтезує різні прозапальні медіатори і адипокіни, зокрема лептин, які призводять до пошкодження хряща у пацієнтів з ожирінням. Лептин бере участь у підтримці функції імунної системи, має структурну гомологію з IL-6 і С-реактивним білком, стимулює вироблення ФНП-α, білка хемотаксису моноцитів (MCP-1) і активних форм кисню ендотеліоцитами та мононуклеарами [29]. В останні роки стало відомо, що одним із ключових стимулів для регуляції MCP-1 є NF-κB. ХС зменшить інфільтрацію макрофагів у жировій тканині за рахунок зниження експресії адипоцитів та вивільнення MCP-1, а це може зменшити вираженість запалення жирової тканини у відповідь на прозапальні подразники, такі як ліпополісахариди [40].
Крім зазначених плейотропних ефектів, досліджували вплив ХС на рівень сечової кислоти. H.M. Burt і Y.C. Dutt [6] виявили, що ХС і фосфатидилхолін сприяли кристалізації солей моноурату натрію in vitro, що призводило до депонування солей моноурату натрію у тканинах. У цьому дослідженні використана суміш із двох ізомерів ХС, хондроїтин-4-сульфат і хондроїтин-6-сульфат у невідомих пропорціях, і не виключено, що ці два ізомера можуть мати зовсім різний вплив на депонування моноурату натрію. T.C. Laurentі (1964) [26], A.E. Denoble та співавтори (2011) [8] підтвердили, що сечова кислота in vitro була менш розчинна зі збільшенням кількості ХС, звичайного компонента синовіальної рідини при ОА. Не виявлено кореляції між ХС і рівнем сечової кислоти синовіальної рідини, або ХС і градієнтом сечової кислоти в сироватці крові та в синовіальній рідині. Крім того, сам ХС має тваринне походження (тобто багатий на пурини), що також впливає на підвищення сечової кислоти. ХС достовірно підвищував рівень сечової кислоти у хворих на ОА з гіперурикемією за даними дослідження, проведеного на базі КМКЛ № 7 у 2015 р. [2]. Іn vitro ХС зменшив опосередковану кристалами моноурату натрію продукцію цитокінів з активованих макрофагів. Зокрема, IL-1β та ФНП-α знижувалися дозозалежно за допомогою ХС [32].
Таким чином, в літературі наявні дані про зв’язок між застосуванням ХС та підвищенням рівня сечової кислоти, проте складність питання потребує його подальшого вивчення.
Згідно з останніми рекомендаціями АСR 2019 р., виокремлено ряд препаратів, які умовно не рекомендуються, серед них — колхіцин, вітамін D, ГК.
Колхіцин умовно не рекомендується застосовувати пацієнтам з ОА коліна, кульшового суглоба та/або кисті. У двох невеликих дослідженнях припустили знеболювальну користь колхіцину при ОА, але якість даних була низькою. Зауважимо, що в дослідженні 2017 р. встановлено, що лікування колхіцином значно знизило рівень C-реактивного білка (р=0,008) і C-телопептиду колагену І типу синовіальної рідини (р=0,002) у сироватці крові [27]. Високий рівень C-телопептиду колагену І типу в сироватці крові передбачав клінічно значуще (структурне та симптоматичне) прогресування ОА протягом 48 міс [22]. ММР-деградований C-реактивний білок передбачав дебют РА протягом трьох років [5]. Ці результати свідчили про потенціал колхіцину як структурно-модифікуючого препарату повільної дії при ОА. Проте потенційні побічні ефекти, а також лікарські взаємодії, які можуть виникнути при його застосуванні, обмежили його застосування, тому препарат не внесений до рекомендацій.
Показано, що вітамін D є важливим гормоном, який сприяє гомеостазу хряща, а рецептори вітаміну D присутні на самих хондроцитах, а також можливий вплив на метаболізм субхондральної кістки вітаміну D, оскільки його вміст у крові корелював зі зниженням площі субхондральної кістки (відомого фактора ризику ОА колінного суглоба). Деякі клінічні дослідження показали, що низький рівень споживання і низькі рівні вітаміну D в сироватці крові пов’язані з підвищеним ризиком прогресування ОА колінного і кульшового суглобів [9, 28, 30, 31, 33]. Нещодавно у клінічному випробуванні, присвяченому впливу вітаміну D на структуру суглобів зміни у пацієнтів з ОА коліна, оцінених за допомогою магнітно-резонансної томографії (МРТ), встановили, що вітамін D в дозі, достатній для підвищення рівня сироватки крові вище 30 нг/мл, схоже, не має модифікуючої переваги для ОА коліна. Ряд досліджень за участю пацієнтів із ОА продемонстрували незначний ефект при лікуванні вітаміном D, тоді як в інших не виявили жодної користі, а об’єднання даних між дослідженнями дало нульові результати. Крім того, в інших контекстах пропонувалися обмежені та сумнівні переваги для здоров’я від вітаміну D. Препарат не внесений до рекомендацій.
Важлива роль у синтезі хрящової тканини належить також факторам росту TGF-β, IGF-1. Проте період напіврозпаду факторів росту занадто короткий, для того щоб підтримувати терапевтичний ефект [28].
У декількох роботах вивчали ефективність ГК перорально в низьких дозах (3–5 мг/добу), але їх результати досить суперечливі. Так, дослідники відзначали зменшення вираженості болю і значне поліпшення функції, але, як і при внутрішньосуглобовому введенні ГК, при проведенні інструментальних методів дослідження (МРТ і УЗД) не виявлено будь-якого позитивного впливу ГК на синовіальну гіпертрофію та ознаки запалення. У дослідженні HOPE 2018 р. пацієнти отримували 10 мг преднізолону перорально один раз на добу протягом 6 тиж, після чого проводилася 2-тижнева схема зниження дози та 6-тижневе спостереження без лікарських засобів. Виявлено, що лікування 10 мг преднізолону протягом 6 тиж є ефективним та безпечним для пацієнтів з ОАК та ознаками запалення. Таким чином, терапія преднізолоном у низьких дозах може тимчасово полегшити симптоми ОА кистей, проте запалення як напрямок для лікування пацієнтів із ОА кистей із застосуванням ГК потребує подальшого вивчення [19, 23, 24, 42].
Згідно з рекомендаціями АСR 2019 р. настійно не рекомендуються бісфосфонати, гідроксихлорохін, метотрексат і біологічна терапія (інгібітори ФНП і антагоністи рецептора IL).
Є кілька досліджень, що стосуються застосування інгібіторів ФНП у невеликих групах хворих. Так, терапія інфліксимабом протягом 6 міс у пацієнтів з ЕОА кистей не дала суттєвих результатів [14]. У дослідженні 2012 р. встановлено, що адалімумаб достовірно не мав суттєвої різниці порівняно з плацебо при лікуванні ЕОА кистей [41]. Тому ця група препаратів не внесена до рекомендацій.
Великі надії покладали на застосування тоцилізумабу (інгібітора IL-6) при ЕОА кистей. Проте ці сподівання не виправдані, дослідження 2020 р. не показало ефективності цього препарату при ЕОА кистей [36].
Невелика кількість повідомлень стосується застосування при цій патології метотрексату, визнаного базисним препаратом для лікування пацієнтів з РА. Метотрексат не продемонстрував ні зменшення вираженості болю, ні покращення функції у пацієнтів з ЕОА кистей [44].
Становлять інтерес результати застосування анакінри (антагоніст рецептора IL-1) при ОА кистей, підшкірне введення якої у трьох пацієнтів мало позитивний вплив (пацієнти, які отримували щодня підшкірні ін’єкції протягом 3 міс, показали значне зменшення вираженості болю та сумарної функціональної недостатності) [4]. Проте цей препарат теж не ввійшов до рекомендацій.
Бісфосфонати настійно не рекомендується застосовувати пацієнтам з ОА коліна, кульшового суглоба та/або кисті. Хоча в невеликому дослідженні щодо застосування бісфосфонату G. Saviola та співавтори (2012) [38] зробили припущення щодо потенційного анальгезивного ефекту при ОА кистей (в дослідженні клодронат 300 мг вводили внутрішньовенно 7 днів із подальшим введенням 100 мг протягом 14 днів кожні 3 міс, що значно зменшувало вираженість болю у пацієнтів із ОА кистей), більшість даних не свідчать про зменшення вираженості болю та функціональних результатів [7].
Новими напрямками в терапії пацієнтів із ОА кистей можуть стати [13]:
Регенеративна терапія стовбуровими клітинами. Проведено 144 клінічних випробування з метою вивчення терапевтичного впливу стовбурових клітин на пацієнтів із ОА. Спочатку описували трансплантацію мезенхімальних стовбурових клітин шляхом інвазивного підходу (хірургічного втручання). Пізніше — введення в суглоб шляхом інтраартикулярних ін’єкцій).
Інгібітори клітинного циклу. Молекули UBX0101, які впливають на SASP. Клітинне старіння веде до асоційованого зі старінням секреторного фенотипу (SASP), який характеризується порушенням клітинного циклу, посиленим виробленням прозапальних цитокінів тощо).
Окисно-відновні сигнальні шляхи та мітохондріальна дисфункція при ОА. Пошуки шляхів інгібування експресії мітохондріальної каталази, супероксиддисмутази-2 (Sod2), антиоксидантів.
Генна терапія. Рекомбінантний аденоасоційований вірус типу 2/5. Системи доставки, пов’язані з вірусами, мають переваги порівняно з класичними системами доставки, але, очевидно, аспекти безпеки (наприклад імуногенність вектора, коротко- та довгострокові наслідки) потрібно серйозно сприймати й аналізувати, перш ніж розглядати будь-які види генетичної терапії).
Отже, ОА кистей — актуальна проблема сучасної ревматології, яка ще має багато питань та напрямків, що потребують подальшого дослідження.
Список використаної літератури
1. Коваленко В.Н. (2006) Первичный (возрастзависимый, инволюционный) остеоартроз. МОРИОН, Киев, 176 с.
2. Шуба Н.М., Крилова А.С. (2015) Ефективність структурно-модифікувальних препаратів у пацієнтів з остеоартрозом і гіперурикемією. Ортопед., травматол. Протезир., 4: 69–73.
3. Altman R., Alarcn G., Appelrouth D. et al. (1990) The American College of Rheumatology criteria for the classification and reporting of osteoarthritis of the hand. Arthritis Rheum., 33(11): 1601–1610.
4. Bacconnier L., Jorgensen C., Fabre S. et al. (2009) Erosive osteoarthritis of the hand: clinical experience with anakinra. Ann. Rheum. Dis., 68(6): 1078–1079. doi: 10.1136/ ard.2008.094284.
5. Bay-Jensen A.-C., Bihlet A., Byrjalsen I. et al. (2017) Elevated levels of CRPM, an inflammatory biomarker correlating with disease activity in RA, are prognostic of radiographic knee OA. Osteoarthr. Cartil., 25(Suppl. 1): S32.
6. Burt H.M., Dutt Y.C. (1986) Growth of monosodium urate monohydrate crystals: effect of cartilage and synovial fluid components on in vitro growth rates, 45: 858–864.
7. Davis A.J., Smith T.O., Hing C.B., Sofat N. (2013) Are bisphosphonates effective in the treatment of osteoarthritis pain? A meta-analysis and systematic review. PLoS One, 8(9): e72714.
8. Denoble A.E., Huffman K.M., Stabler T.V. (2011) Uric acid is a danger signal of increasing risk for osteoarthritis through inflammasome activation. Proc. Natl. Acad. Sci USA., 108: 2088–2093.
9. Ding C., Cicuttini F., Parameswaran V. et al. (2009) Serum levels of vitamin D, sunlight exposure, and knee cartilage loss in older adults: the Tasmanian older adult cohort study. Arthritis Rheum., 60(5): 1381–1389. doi: 10.1002/art.24486.
10. du Souich P., García A.G., Vergés J., Montell E. (2009) Immunomodulatory and anti-inflammatory effects of chondroitin sulphate. J. Cell. Mol. Med., 13(8A): 1451–1463. doi:10.1111/j.1582–4934.
11. Egea J., García A.G., Verges J. et al. (2010) Antioxidant, anti-inflammatory and neuroprotective actions of chondroitin sulfate and proteoglycans. Osteoarthr. Cartil., 18(1): 24–27.
12. El-Tawil S., Arendt E., Parker D. (2016) Position statement: the epidemiology, pathogenesis and risk factors of osteoarthritis of the knee. J. ISAKOS: Joint Dis. Orthopaed. Sports Med.,1: 219–228.
13. Grässel S., Muschter D. (2020) Recent advances in the treatment of osteoarthritis. Res., 9: F1000.
14. Guler Yuksel M. et al. (2010) Treatment with TNF-α inhibitor infliximab might reduce hand OA in patients with RA. Osteoarth. Cart, 18: 1256–1262.
15. Henrotin Y., Mathy M., Christelle S. (2010) Review: Advances in the Treatment of Osteoarthritis and the Role of Chondroitin Sulphate. Eur. Musculoskelet. Rev., 5(2): 11–17.
16. Herrero-Beaumont G. (2008) Effect of chondroitin sulphate in a rabbit model of atherosclerosis aggravated by chronic arthritis Br. J. Pharmacol, 154: 843–851.
17. Jensen J.C., Sherson, D. (2007) Work-related bilateral osteoarthritis of the first carpometacarpal joints. Occup. Med. (Lond.) 57(6): 456–460.
18. Marshall M. et al. (2013) Erosive osteoarthritis: a more severe form of radiographic hand osteoarthritis rather than a distinct entity? Ann. Rheum. Dis., 74(1): 136–141.
19. Keen H.I., Wakefield R.J., Hensor E.M. et al. (2010) Response of symptoms and synovitis to intra-muscular methylprednisolone in osteoarthritis of the hand: an ultrasonographic study. Rheumatology (Oxford)., 49(6): 1093–1100.
20. Kloppenburg M., Féline P.B., Kroon F.P.B. et al. (2018) 2018 update of the EULAR recommendations for the management of hand osteoarthritis. Ann. Rheum. Dis., 0: 1–9.
21. Kortekaas M.C., Kwok W.Y., Reijnierse M. et al. (2014) Follow-up study of inflammatory ultrasound features in hand osteoarthritis over a period of 3 months: variable as well as constant. Osteoarthr. Cartil., 22(1): 40–43. doi: 10.1016/j.joca.2013.10.015.
22. Kraus V.B., Collins J.E., Hargrove D. et al. (2017) Predictive validity of biochemical biomarkers in knee osteoarthritis: data from the FNIH OA Biomarkers Consortium. Ann. Rheum. Dis., 76(1): 186–195.
23. Kroon F.P.B., Kortekaas M.C., Boonen A. et al. (2019) Results of a 6-week treatment with 10 mg prednisolone in patients with hand osteoarthritis (HOPE): A double-blind, randomised, placebo-controlled trial. Lancet, 394: 1993.
24. Kvien T.K., Fjeld E., Slatkowsky-Christensen B. et al. (2008) Efficacy and safety of a novel synergistic drug candidate, CRx-102, in hand osteoarthritis. Ann. Rheum. Dis., 67(7): 942–948.
25. Largo R., Sánchez-Pernaute O., Marcos M.E. et al. (2008) Chronic arthritis aggravated vascular lessions in rabbits with atherosclerosis/ Artr. Rheum., 56: 283–291.
26. Laurent T.C. (1964) Solubility of sodium urate in the presence of chondroitin-4-sulphate. Nature, 202: 1334.
27. Leung Y.Y., Thumboo J., Wong S.B. et al. (2017) Colchicine effectiveness in symptom and inflammation modification in knee osteoarthritis (colkoa): a randomized controlled trial. Osteoarthr. Cartil., 25: S172–S173.
28. Martel-Pelletier J., Wildi L.M., Pelletier J.P. (2012) Future therapeutics for osteoarthritis. Bone, 51(2): 297–311. doi: 10.1016/j.bone.2011.10.008.
29. Mattu H.S., Randeva H.S. (2013) Role of adipokines in cardiovascular disease. J. Endocrinol., 216(1): T17–36.
30. McAlindon T.E., Dawson-Hughes B., Driban J. et al. (2010) Clinical trial of vitamin D to reduce pain and structural progression of knee osteoarthritis. American College of Rheumatology. Annual Meeting, Atlanta, GA, USA (Abstract 706).
31. Ong J.S., Gharahkhani P., An J. et al. (2018) Vitamin D and overall cancer risk and cancer mortality: a Mendelian randomization study. Hum. Mol. Genet., 27(24): 4315–4322. doi: 10.1093/hmg/ddy307.
32. Orlowsky E.W., Stabler T.V., Montell E. et al. (2014) Monosodium urate crystal induced macrophage inflammation is attenuated by chondroitin sulphate: pre-clinical model for gout prophylaxis? BMC Musculoskelet Dis., 15: 318. doi: 10.1186/1471–2474–15–318.
33. Pilz S., Verheyen N., Grübler M.R. et al. (2016) Vitamin D and cardiovascular disease prevention. Nat. Rev. Cardiol., 13(7): 404–417. doi: 10.1038/nrcardio.2016.73.
34. Planta F., Reginster J.Y., Rannou F. (2019) A new decision tree for diagnosis of osteoarthritis in primary care: international consensus of experts. Aging. Clin. Exp. Res., 31(1): 19–30.
35. Rees F., Doherty S., Hui M. et al. (2012) Distribution of finger nodes and their association with underlying radiographic features of osteoarthritis. Arthritis Care Res. (Hoboken), 64(4): 53–58. doi: 10.1002/acr.21586.
36. Richette P., Latourte A., Sellam J. et al. (2020) Efficacy of tocilizumab in patients with hand osteoarthritis: double blind, randomised, placebo-controlled, multicentre trial. Ann. Rheum. Dis. doi: 10.1136/annrheumdis-2020-218547.
37. Ronca F., Palmieri L., Panicucci P., Ronca G. (1998) Antiinflammatory activity of chondroitin sulfate. Osteoarthr. Cartil., 6: 14–21.
38. Saviola G., Abdi-Ali L., Campostrini L. et al. (2012) Clodronate and hydroxychloroquine in erosive osteoarthritis: A 24-month open randomized pilot study. Mod. Rheumatol., 22(2): 256–263.
39. Sharon L., Kolasinski S.L., Neogi T. et al. (2020) 2019 American College of Rheumatology/Arthritis Foundation Guideline for the Management of Osteoarthritis of the Hand, Hip, and Knee. Arthrit. Care Res., 72(2): 149–162.
40. Stabler T.V., Montell E., Vergés J. et al. (2017) Chondroitin Sulfate Inhibits Monocyte Chemoattractant Protein-1 Release From 3T3-L1 Adipocytes: A New Treatment Opportunity for Obesity-Related Inflammation? Biomarker Insights. Aug. 24. doi:10.1177/1177271917726964.
41. Verburggen G., Wittoek R., Vander C.B. et al. (2012) Tumor necrosis factor blockade for the treatment of erosive osteoarthritis of the interphalangeal finger joints: a double blind, randomized trial on structure modification. Ann. Rheum. Dis., 71(6): 891–898.
42. Wenham C.Y., Hensor E.M., Grainger A.J. et al. (2012) A randomized, double-blind, placebo-controlled trial of low-dose oral prednisolone for treating painful hand osteoarthritis. Rheumatology (Oxford), 51(12): 2286–2294.
43. Zhang W., Doherty M., Leeb B.F. et al. (2009) EULAR evidence-based recommendations for the diagnosis of hand osteoarthritis: report of a task force of ESCISIT. Ann. Rheum. Dis., 68(1): 8–17. doi: 10.1136/ard.2007.084772.
44. Ferrero S., Wittoek R., Allado E. et al. (2019) Methotrexate in Patients with Hand Erosive Osteoarthritis Refractory to Usual Treatments: A Randomized, Double-blind, Placebo-controlled Trial [abstract]. Arthr. Rheum., 71(Suppl. 10).
Современные аспекты лечения и мониторинга остеоартроза кистей
Национальная медицинская академия последипломного образования им. П.Л. Шупика, Киев
Резюме. Актуальность. Остеоартроз (ОА) суставов кистей — одна из самых частых локализаций по распространенности после ОА коленных суставов. ОА кистей сопровождается болью, затруднением сжатия кисти, что приводит к нарушению функции кисти — невозможности выполнять обычные, повседневные действия — и ухудшает качество жизни пациентов. Цель: выполнить обзор литературы и осветить современные аспекты лечения и мониторинга ОА кистей. Методы: проведен поиск в печатных и электронных изданиях, научных поисковых базах Medline и PubMed с применением методов анализа, сравнения и обобщения информационных данных. Соответствующие статьи, касающиеся мониторинга и лечения ОА суставов кистей, идентифицированы и рассмотрены. Результаты. В статье представлена классификация ОА суставов кистей, данные о распространенности этого заболевания. Приведенные классификационные критерии, шкалы оценки функции суставов кисти. Авторами обзора рассмотрены современные рекомендации Американского колледжа ревматологии (American College of Rheumatology — ACR) и Европейской антиревматической лиги (European League Against Rheumatism — EULAR) по диагностике и лечению ОА суставов кистей. В статье обсуждаются вопросы медикаментозной терапии ОА суставов кистей, в частности возможности применения хондроитина сульфата, его механизм действия и его плейотропные эффекты. Проанализированы новые данные о назначении биологической терапии и новые направления лечения ОА кистей. Выводы. ОА кистей является актуальной проблемой современной ревматологии, которая еще имеет много вопросов и направлений, требующих дальнейшего исследования. Применение хондроитина сульфата у больных ОА кистей способствует существенному уменьшению выраженности болевого синдрома, замедлению прогрессирования, улучшению функционального состояния суставов и течения коморбидных заболеваний за счет его плейотропных эффектов. Представлены новые варианты таргетной терапии, основанные на более четком понимании патогенеза ОА, которые улучшают течение заболевания, на животных моделях. Необходима дальнейшая оценка этих методов лечения у пациентов с ОА кистей.
Ключевые слова: остеоартроз, клинические рекомендации, остеоартроз кистей.

Leave a comment