Особливості патогенезу, сучасні аспекти діагностики і лікування комплексного регіонарного больового синдрому
Бур’янов О.А., Омельченко Т.М., Котюк В.В.
Резюме. Проведений аналітичний огляд сучасних уявлень про провідні механізми патогенезу комплексного регіонарного больового синдрому (КРБС), принципи його діагностики та лікування дозволив розробити спосіб комплексного лікування пацієнтів із КРБС І типу із застосуванням патогенетично обґрунтованої комбінації фармакотерапевтичних препаратів Аертал®, Мідокалм, Тебантин®, Осталон® Кальцій-Д, а також методів фізичного і фізіотерапевтичного лікування. Клінічне дослідження ефективності розробленого способу у 56 хворих з діагнозом КРБС І типу на тлі переломів дистального кінця променевої кістки зі зміщенням уламків достовірно (p<0,05) показало його ефективність. Аналіз результатів лікування проводили в динаміці з використанням стандартизованих критеріїв оцінки інтенсивності больового синдрому (шкала ВАШ), невропатичного болю (опитувальник DN4), функціональної активності кисті й кистьового суглоба (опитувальник ABILHAND) і суб’єктивної оцінки лікарем і пацієнтом. У 8-тижневий період лікування в основній групі хворих досягнуто більше ніж трикратне зменшення вираженості больового синдрому за ВАШ порівняно з вихідним станом. При цьому в кінці терміну спостереження вираженість больового синдрому у хворих основної групи була майже вдвічі менша, ніж у пацієнтів групи порівняння. За показником DN4 у 8-тижневий термін в основній групі пацієнтів зникали явища невропатичного болю, тоді як у контрольній групі залишався невропатичний компонент болю. Функціональна активність кистьового суглоба і кисті в основній групі в кінці спостереження відповідала критерію «добре» за шкалою ABILHAND, а в групі порівняння — критерію «задовільно». Оцінка результатів лікування лікарем і пацієнтами хоч і була суб’єктивною, але також показала більш високу ефективність лікування в основній клінічній групі.
Вступ
Проблема болю залишається сьогодні одним із фундаментальних питань медицини. Комплексний регіонарний больовий синдром (КРБС) є одним із найбільш тяжких хронічних больових синдромів і на сьогодні розглядається як варіант хронічного невропатичного болю [7, 8, 11, 13]. За даними різних авторів, на цю патологію страждають від 6 до 16% населення. Найчастіше КРБС виникає в одній з кінцівок, рідше в обличчі. КРБС об’єднує чутливі, рухові й вегетативно-трофічні розлади, які раніше описувалися під назвою «рефлекторна симпатична дистрофія», «каузалгія», «альгонейродистрофія», «синдром Зудека» [1–3, 5, 6, 13]. Останнім часом з’ясувалося, що велика кількість хворих мають як «біль, що підтримується симпатично», так і «симпатично незалежний біль», що й спонукало експертів Міжнародної асоціації з вивчення болю в класифікації больових синдромів у 1994 р. запропонувати термін «КРБС» [13, 20].
Виділяють КРБС I і II типу. КРБС I типу розвивається за відсутності пошкодження периферичного нерва в результаті травми і/або впливу у формі тривалої іммобілізації, як наприклад при накладенні іммобілізаційних пов’язок при забоях, переломах, травмах м’яких тканин кінцівки тощо. КРБС І типу характеризується клінічними проявами, явно диспропорційними величині зовнішнього впливу [16, 17]. КРБС II типу діагностується при пошкодженні периферичного нерва чи однієї з його гілок, що підтверджено даними електронейроміографії, часто супроводжується явищами каузалгії [20].
КРБС трапляється як у дорослих, так і у дітей. Співвідношення чоловіків і жінок приблизно становить 2:3. Існують відмінності в локалізації КРБС у дітей і дорослих. У дорослих страждають частіше верхні, а у дітей — нижні кінцівки.
КРБС може розвиватися внаслідок різноманітних етіологічних факторів: травм центральної та периферичної нервової системи, артриту, тунельної невропатії, дегенеративних і аутоімунних захворювань нервової системи. Істотну роль у виникненні дистрофічного процесу відіграють додаткові етіологічні компоненти, до яких відносять дефекти лікування переломів кісток кінцівок на етапах проведення репозиції та іммобілізації (недостатня анестезія, неправильна репозиція, туга гіпсова пов’язка, тривала іммобілізація) [3–5, 9, 12, 16].
Уперше в 1864 р. американські хірурги S. Mitchell, G. Morchouse і W. Keen у книзі «Вогнепальні рани та інші ушкодження нервів» класично і яскраво описали раніше невідомий симптомокомплекс (пекучий біль у поєднанні з гіперестезією, температурні і трофічні зміни в ураженій кінцівці), який слідував за вогнепальним пошкодженням кінцівок у солдатів під час громадянської війни в США. А в 1900 р. [14] P. Sudeck на 29-му Конгресі Німецького товариства хірургів у Берліні доповів про вторинні зміни в дистальних відділах верхньої кінцівки у вигляді неоднорідного прогресуючого плямистого остеопорозу, виявленого ним рентгенологічно [19].
Больовий синдром при КРБС за своєю природою є невропатичним болем, який представлений двома основними компонентами: спонтанним (стимулонезалежним) болем і викликаною (стимулозалежною) гіпералгезією [5]. Біль є абсолютною ознакою для діагностики КРБС. Він виникає внаслідок різного роду пошкоджень, що зазвичай впливають на тканини кінцівки, але за своїм характером, вираженістю і поширеністю значно перевершує первинне пошкодження. Больовий сидром може мати дві основні характеристики: пекучий біль — відчувається у вигляді печіння, частіше поверхневий, від середньої до високого ступеня інтенсивності, чітко описується пацієнтом; ниючий біль — ниючого характеру, такий що ломить, тягне, частіше відчувається як глибинний, має середній або нижче середнього рівень інтенсивності, пацієнти не можуть дати йому чіткого опису. Ці два типи болю розрізняються за своєю тривалістю: пекучий біль у ⅓ випадків зберігається >6 міс, іноді трансформується в ниючий; первинно ниючий біль після 6 міс від початку захворювання, як правило, не виявляють. У >¾ пацієнтів відзначають спонтанний постійний біль. Біль нерідко виникає відразу після травми, яка зазвичай не пов’язана зі значним ушкодженням нерва. Він може спостерігатися слідом за переломом кісток, пошкодженням м’яких тканин або іммобілізацією, зумовленою вісцеральною патологією. Біль виникає зазвичай протягом 1-го місяця після впливу провокуючого фактора.
Існує два механізми розвитку симпатично зумовленого болю [5–8]. По-перше, після ушкодження периферичного нерва на мембранах пошкоджених та непошкоджених аксонів С-волокон починають з’являтися α-адренорецептори (в нормі на цих волокнах відсутні), чутливі до циркулюючих катехоламінів, що виділяються із закінчень постгангліонарних симпатичних волокон. По-друге, пошкодження нерва також викликає проростання симпатичних волокон у вузол заднього корінця, де вони обплітають у вигляді кошиків тіла чутливих нейронів, і таким чином активація симпатичних закінчень провокує активацію чутливих волокон. Однак не весь спонтанний біль розвивається тільки внаслідок активації первинних ноцицепторів. В основі розвитку спонтанного болю також беруть участь механізми, пов’язані з порушенням процесів гальмування на рівні заднього рогу. Нейрони заднього рогу спинного мозку отримують інформацію від первинних аферентів. Активність нейронів задніх рогів визначається не тільки збудливою периферичної стимуляцією, але й гальмівними впливами, які можуть бути спінальними або низхідними центральними. Ураження периферичного нерва може зменшувати інгібуючий контроль нейронів задніх рогів різними шляхами. Пошкодження нерва веде до зниження концентрації гамма-аміномасляної кислоти (ГАМК), яка має гальмівний вплив, що викликає порушення регуляції ГАМК-ергічних і опіатних рецепторів, розміщених на пресинаптичних мембранах первинних сенсорних нейронів і на постсинаптичних мембранах нейронів заднього рогу. У результаті цих процесів вторинні чутливі аференти позбавляються гальмівних механізмів і починають генерувати патологічну імпульсацію, яка передається у центральну нервову систему навіть за відсутності активності в первинних чутливих аферентах [7, 8].
Другим компонентом невропатичного болю є гіпералгезія. За локалізацією виділяють первинну і вторинну гіпералгезію. Первинна гіпералгезія локалізується в зоні іннервації пошкодженого нерва чи в зоні тканинного пошкодження; вторинна гіпералгезія має більше поширення, що далеко виходить за зону тканинного пошкодження чи зону іннервації пошкодженого нерва. Первинна гіпералгезія пов’язана з місцем ушкодження тканин і виникає в основному у відповідь на подразнення сенсибілізованих внаслідок пошкодження периферичних ноцицепторів. Периферична сенситизація проявляється первинною гіпералгезією, спонтанним болем, в основі яких лежить активація кальцієвих каналів, нечутливих до тетродотоксину, виділення нейрокініну-1 і реакція нейрогенного запалення, що пов’язано з виділенням субстанції Р. Ноцицептори також стають чутливими за рахунок біологічно активних речовин, які вивільняються або синтезуються в місці пошкодження. Цими речовинами є: серотонін, гістамін, нейроактивні пептиди, кініни, брадикінін, а також продукти метаболізму арахідонової кислоти (простагландини та лейкотрієни) і цитокіни. У процес втягується також категорія ноцицепторів, які в нормі неактивні, але активуються після тканинного пошкодження. Внаслідок такої активації збільшується аферентна стимуляція нейронів заднього рогу спинного мозку, що і є основою розвитку вторинної гіпералгезії [5, 9, 10].
Виділяють також два основних комплекси вегетативно-трофічних порушень: перший, коли є багрове або червоне забарвлення шкіри, набряк, гіпертермія, гіпергідроз, прискорений ріст нігтів, може бути прискореним ріст волосся, контрактури спостерігаються в середньому у 60% випадків; другий — забарвлення шкіри біле або синюшне, гіпотермія, гіпо- або ангідроз, гіпотрофія м’яких тканин, дисхромія шкірних покривів, уповільнений ріст нігтів та волосся, контрактура характерна для всіх хворих. Перший комплекс трапляється при тривалості захворювання до 6 міс в середньому у 70% спостережень, другий може розвинутися як в ранні, так і в пізні терміни [1, 2, 5].
Таким чином, зазвичай травма є стартовим фактором, що запускає в дію подальший механізм розвитку КРБС. При КРБС відбувається порушення функції вегетативних центрів, залоз внутрішньої секреції та активності місцевих тканинних гормонів. Це веде до стійких розладів місцевого кровообігу, які на ранній стадії захворювання полягають у нейрогенній вазоконстрикції судин, а також у дилатації прекапілярних сфінктерів. На наступній стадії, яка характеризується функціональним виснаженням симпатичної нервової системи, відбувається нейрогенне падіння тонусу мікросудин (особливо венул). Розвивається судинна дистонія, що веде до порушення проникності стінок капілярів. В ураженому сегменті розвиваються мікроциркуляторні порушення, тканинна гіпоксія і ацидоз. Змінюється іонна рівновага в екстрацелюлярній рідини, що, у свою чергу, призводить до функціональних порушень остеоцитарної агрегації, посиленого розпаду фосфорно-кальцієвих сполук. Усе це зумовлює розвиток лакунарного розсмоктування кістки, що проявляється рентгенологічно у вигляді плямистого остеопорозу, і подразнення чутливих нервових закінчень із виникненням больового синдрому.
Залежно від поширеності при КРБС верхньої кінцівки виділяють три основних клінічних варіанти перебігу: дистальний (синдром Зудека), розповсюджений (синдром плече — кисть Штейнброккера) і проксимальний (шийно-плечовий) [1, 16–19]. Клінічні прояви КРБС вельми демонстративні й характеризуються певною фазністю, яку можна уявити як початок хвороби (больовий синдром і вазомоторні порушення), її «пік» (дистрофічна стадія чи стадія трофічних порушень) і результат (стадія стійкої декомпенсації). Єдиною постійною ознакою початкового періоду КРБС (триває до 4–5 міс від моменту травми) є больовий синдром різного ступеня вираженості. Вазомоторні порушення супроводжуються масивним набряком тильного боку кисті й часто нижньої третини передпліччя, гіперемією, підвищенням температури шкіри. У другій стадії (5–8 міс від початку захворювання) настає поступове зменшення вираженості болю, характерні комбіновані контрактури з вираженим артрогенним компонентом, шкіра стоншується, блідне і атрофується, виникає її глянсовитість, часто гіпертрихоз і гіперкератоз. При проксимальних формах КРБС відбувається залучення у процес м’язово-сухожилкових структур з утворенням вогнищ міоостеофіброзу. На третій стадії (від 8 міс до декількох років) настає атрофія всіх тканин із контрактурами в суглобах змішаного генезу. У тяжких випадках і за відсутності відповідного лікування це призводить до фіброзного анкілозу.
Не існує специфічних методів інструментальної діагностики КРБС. Діагностика ґрунтується на характерних клінічних проявах, типовій стадійності перебігу захворювання та вираженої тенденції до спонтанного одужання [21]. Велике значення надається використанню досить чутливих і специфічних методів діагностики: рентгенологічного дослідження, радіоізотопного сканування і магнітно-резонансної томографії (МРТ) [1, 5, 13, 15]. Останній метод корисний для демонстрації патологічних змін у м’яких тканинах у пацієнтів із КРБС, а одержуване зображення може допомогти у визначенні стадії процесу. Для рентгенологічної картини КРБС дуже характерний плямистий остеопороз, що виявляється зазвичай на 3–4-му тижні від початку захворювання у 80% хворих. При цьому в дистальних відділах передпліччя (гомілки) і фаланг пальців на тлі незміненої кісткової структури з’являються множинні просвітлення без чітких меж. При довгостроковому перебігу процесу вогнищевий остеопороз змінюється дифузним. У 1996 р. запропоновано алгоритм діагностики КРБС (P. Wilson, Ph. Low та співавторами) [20]. Цей алгоритм заснований на суб’єктивних і об’єктивних клінічних ознаках та історії розвитку захворювання. По-перше, діагноз КРБС не може бути встановлений за відсутності болю, оскільки, насамперед, це больовий синдром. Характеристика болю може бути різною. Біль часто описується як пекучий і може бути спонтанним та індукованим у рамках гіпералгезії або алодинії. Спонтанний та індукований біль можуть бути одночасними. Також важливо враховувати анамнез. Захворювання розвивається після пошкодження чи іммобілізації, уражається одна кінцівка, симптоми розвиваються зазвичай у межах 1 міс. Як уже зазначалося, серед характерних скарг виділяється біль (спонтанний або індукований) пекучий поверхневий та/чи глибокий ниючий; гіпералгезія чи алодинія; супутні симптоми: набряк, зміни температури, забарвлення і потовиділення на ураженій кінцівці; трофічні зміни нігтів, волосся, шкіри.
Таким чином, діагноз встановлюється на основі анамнезу, скарг та виявлення характерних клінічних ознак: односторонні гіпералгезія чи алодинія, набряк, вазомоторні зміни, трофічні зміни, порушення моторної функції (можуть включати дистонію і тремор). Рентгенологічний та МРТ-методи дають можливість виявити типові зміни і слугують для підтвердження діагнозу, а також для визначення стадії захворювання.
Зважаючи на складність і багаторівневість патогенезу КРБС, сучасний підхід до його лікування полягає в комплексності застосування фармакологічного і нефармакологічного лікування [13, 20]. Вибір методик і засобів лікування ґрунтується на стадії процесу з урахуванням супутньої соматичної патології та психічного стану пацієнтів. При цьому головне значення має вираженість больового синдрому. На першій стадії больовому синдрому вдається запобігти тільки з використанням комбінованих методик лікування: щадний режим для хворої кінцівки; медикаментозне лікування, блокади та інфільтраційна терапія; фізіотерапевтичне лікування; кріотерапія; психофармакотерапія. На другому етапі найбільш ефективні медикаментозна терапія, рефлексо-, кінезо- і гідрокінезотерапія. На кінцевій стадії терапія має бути спрямована на лікування залишкової ригідності, ущільнення сухожилко-м’язового і капсульно-зв’язкового апарату, грубої дифузної гіпотрофії шкіри, підшкірної жирової клітковини і хоча б часткове відновлення функції ураженої кінцівки. У комплекс лікувальних заходів включається інфільтраційна терапія із застосуванням протеолітичних ферментних препаратів, ультразвукова терапія, грязьові аплікації, радонові ванни. Обґрунтованим є застосування оперативних втручань. При лікуванні КРБС застовують різні анальгетичні засоби та місцеві блокади. Крім того, в комплексну терапію включають антиконвульсанти, антидепресанти, блокатори повільних кальцієвих каналів [1, 5, 12]. Складність лікування полягає в необхідності впливу як на основне ушкодження і больовий синдром, так і на власне дистрофічний процес. Для лікування больового синдрому, крім анальгетиків і транквілізаторів, призначають міорелаксанти, нейротропні препарати і вітаміни групи В.
Анальгетична і протизапальна терапія КРБС включає призначення нестероїдних протизапальних препаратів (НПЗП) і глюкокортикоїдів. Ряд авторів вказують на позитивний результат застосування преднізолону в добовій дозі 60–100 мг строком на 2–4 тиж з подальшим зниженням дози (загальний термін лікування — 2–4 міс) [5, 11]. Вважається, що чим раніше розпочато лікування, тим вираженіший його результат.
Серед багатьох медикаментозних методів лікування одна з головних ролей відводиться НПЗП, ефективність яких доведена в міжнародних, багатоцентрових контрольованих дослідженнях. Однак не всі НПЗП можна рекомендувати для тривалого призначення, особливо у осіб середнього і літнього віку, оскільки одним із частих ускладнень є ерозивно-виразкові ураження шлунково-кишкового тракту, а також підвищений ризик ускладнень з боку серцево-судинної системи. На сьогодні при лікуванні КРБС одним із препаратів вибору є ацеклофенак — оригінальний препарат Аертал фармацевтичної компанії «Ріхтер Гедеон». Ацеклофенак — добре вивчений НПЗП, має широку доказову базу, високий профіль безпеки та виражений протизапальний і знеболювальний ефект. Ацеклофенак — похідне фенілоцтової кислоти, за хімічною будовою близький до диклофенаку. Механізм дії ацеклофенаку, як і інших НПЗП, пов’язаний із пригніченням експресії циклооксигенази (ЦОГ). За даними дослідження P.S. Lindburg та співавторів (2000) встановлено, що ацеклофенак пригнічує активність обох ізоферментів ЦОГ, але переважно експресію ЦОГ-2, наближаючись таким чином до селективних інгібіторів ЦОГ-2 із вираженим знеболювальним та протизапальним ефектами. У дослідженнях M. Grau та співавторів (1991), J.T. Dingle та співавторів (1997), Almirall Prodespharma S.A. (2003) тощо доведено біостимулювальний вплив ацеклофенаку на біосинтетичні процеси у суглобовому хрящі, що зумовлює можливість та розширює показання до його застосування у пацієнтів із дегенеративно-дистрофічними захворюваннями суглобів та хребта.
Враховуючи наявність центрального механізму виникнення больового синдрому при КРБС і невропатичний характер болю, у комплексному лікуванні обґрунтовано застосування антиконвульсантів. Одним з ефективних і безпечних препаратів для лікування пацієнтів цієї групи є габапентин (препарат Тебантин фармацевтичної компанії «Ріхтер Гедеон»). Габапентин подібний за структурою до нейротрансмітеру ГАМК. Є ліпофільною речовиною. Проте його механізм дії відрізняється від такого деяких інших препаратів, що взаємодіють із ГАМК-рецепторами. Габапентин не виявляє ГАМК-ергічних властивостей і не впливає на захоплення та метаболізм ГАМК. Ряд досліджень свідчать про те, що габапентин зв’язується з α2-δ-субодиницею потенціалзалежних кальцієвих каналів і пригнічує потік іонів кальцію, що відіграє важливу роль у виникненні невропатичного болю. Іншими механізмами, що беруть участь у дії габапентину при нейвропатичному болю, є: зменшення глутаматзалежної загибелі нейронів, збільшення синтезу ГАМК, пригнічення вивільнення нейротрансмітерів моноамінової групи. Габапентин у клінічно значущих концентраціях не зв’язується з рецепторами інших поширених препаратів або трансмітерів, на відміну від фенітоїну і карбамазепіну не взаємодіє з натрієвими каналами in vitro, чим зумовлена його відносна безпека для нервової та серцево-судинної систем при лікуванні пацієнтів із невропатичним болем на тлі КРБС.
У комплекс лікування КРБС також включається тривала блокада регіонарних симпатичних гангліїв за допомогою введення новокаїну, лідокаїну. Позитивний вплив у гострій стадії КРБС надає місцеве охолодження. Для цього використовують проточну воду, прокладки з льодом, кріотерапію у вигляді ванн із поступовим зниженням температури води.
Лікування швидкопрогресуючого остеопорозу має поєднувати призначення кальцію і вітаміну D3 із бісфосфонатами (Осталон Кальцій-Д фармацевтичної компанії «Ріхтер Гедеон»).
Одним із важливих моментів при лікуванні КРБС є адекватна міорелаксація, яка досягається як застосуванням фізіотерапевтичного лікування, так і фармакотерапії. Так, ефективним міорелаксуючим препаратом, застосування якого показано як у початковий, так і у віддалений період КРБС, є толперизон — оригінальний препарат Мідокалм фармацевтичної компанії «Ріхтер Гедеон». Мідокалм відноситься до міорелаксантів центральної дії амінокетонової групи. Механізм дії пов’язаний із регуляцією функції каудальної частини ретикулярної формації. При цьому пригнічується підвищена рефлекторна збудливість спинного мозку. Також впливає на периферичні нервові закінчення, є Н-холінолітиком. Толперизон справляє стабілізуючу дію на мембрани у первинних аферентних волокнах і рухових нейронах, що зумовлює вплив на рефлекторну діяльність спинномозкових синапсів. Вторинно уповільнює вихід медіаторів внаслідок гальмування процесу надходження іонів Са у синаптичні структури нервових волокон. Вплив на ретикулоспінальний шлях проявляється в уповільненні процесів збудження. Толперизон знижує експериментально викликані гіпертонус м’язів і ригідність. Полегшує виконання довільних активних рухів. Мідокалм (толперизон) не впливає на кору головного мозку, тим самим не зумовлюючи снодійного чи гальмівного ефекту. Має спазмолітичний і адреноблокуючий ефекти, за рахунок чого поліпшується перфузія тканин. Препарат не має вираженого впливу на функцію нирок та кровотворення.
На функцію кінцівки при КРБС позитивно впливає рано розпочата рухова терапія. Поряд із вправами на релаксацію м’язів хворі виконують вправи, що стимулюють кровообіг, покращують відтік крові, мобілізують суглоби, зміцнюють м’язи. Рухова терапія показана на всіх стадіях захворювання, однак у гострий період вплив здійснюється лише на контралатеральну кінцівку — так звана дзеркальна терапія. При переході у другу стадію рекомендується обережна пасивна гімнастика для суглобів пальців, вишивання та плетіння, що сприяє відновленню координації, з відпрацюванням побутових рухів кінцівкою.
Таким чином, найперспективнішим є комплексний метод терапії КРБС з урахуванням провідних патогенетичних механізмів, що лежать в основі формування захворювання, і сучасних лікарських засобів, що дозволяють у короткий термін значно вплинути на патологічний процес і зменшити страждання пацієнта.
Мета дослідження — клінічна оцінка ефективності комплексного лікування хворих із КРБС І типу на тлі переломів дистального епіметафіза (ДЕМ) променевої кістки із застосуванням патогенетично обґрунтованого фармакотерапевтического комплексу препаратів компанії «Ріхтер Гедеон» Аертал, Мідокалм, Тебантин, Осталон Кальцій-Д.
Об’єкт і методи дослідження
Комплексне клініко-рентгенологічне обстеження та лікування було проведене у 56 хворих із переломами ДЕМ променевої кістки зі зміщенням уламків. У всіх пацієнтів діагностовано КРБС І типу середнього ступеня вираженості у І стадії (до 6 міс) після травми. Переважали хворі жіночої статі, яких було 38 (65%), хворих чоловічої статі було 18 (35%). Середній вік хворих становив 54,3±2,7 року.
Діагноз КРБС І типу встановлювали на підставі анамнезу, скарг на наявність характерного невропатичного больового синдрому, комплексу типових вегетативно-трофічних розладів кінцівки, а також рентгенологічних ознак КРБС. Період розвитку КРБС після травми становив в середньому 3±0,6 тиж та припадав на період іммобілізації. Загальний термін іммобілізації становив у середньому 6±0,3 тиж. Лікування починали одразу після встановлення діагнозу.
При встановленні діагнозу КРБС із метою диференціації невропатичного болю чи визначення наявності його компонентів перед включенням у клінічні групи для всіх хворих застосовували загальноприйнятий опитувальник DN4 (табл. 1).
| Будь ласка, заповніть цей опитувальник, зазначивши галочкою одну відповідь для кожного пункту в 4 питаннях, наведених нижче | |||
| СПІВБЕСІДА З ПАЦІЄНТОМ | |||
| Питання 1: Чи відповідає біль, який відчуває пацієнт, одному або декільком із нижченаведених визначень? | ТАК | НІ | |
| Відчуття печіння | |||
| Хворобливе відчуття холоду | |||
| Відчуття як від ударів струмом | |||
| Питання 2: Чи супроводжується біль одним або декількома з таких симптомів у ділянці її локалізації? | ТАК | НІ | |
| Пощипуванням, відчуттям повзання мурашок | |||
| Поколюванням | |||
| Онімінням | |||
| Свербінням | |||
| ОГЛЯД ПАЦІЄНТА | |||
| Питання 3: Чи локалізований біль у тій же ділянці, де огляд виявляє один або обидва ижченаведені симптоми: | ТАК | НІ | |
| Знижена чутливість до дотику | |||
| Знижена чутливість до поколювання | |||
| Питання 4: Чи можна викликати або посилити біль у ділянці її локалізації: | ТАК | НІ | |
| Провівши в цій ділянці пензликом | |||
| Сума балів (кількість відповідей «Так»): | |||
| Якщо сума становить ≥4 балів, це вказує на те, що біль у пацієнта є невропатичним, або має місце невропатичний компонент болю (при змішаних ноцицептивно-невропатичних больових синдромах) | |||
До основної групи спостереження увійшли 30 хворих на КРБС І типу з больовим синдромом середнього ступеня вираженості, яким у складі комплексного медикаментозного лікування була застосована розроблена нами схема, що включала призначення медикаментів протизапальної, знеболювальної, міорелаксуючої, нейротропної та остеотропної дії. Як зазначалося вище, початок лікування у всіх хворих припав на І стадію захворювання. У групу спостереження були включені пацієнти, які не мали протипоказань до застосування медикаментозних засобів, які входили до схеми лікування. Так, після встановлення діагнозу хворим призначали таке фармакотерапевтичне лікування:
- Препарат Аертал у дозі 100 мг 2 рази на добу після їди протягом 3 тиж, із повторним курсом через 1–2 тиж за необхідності
- Препарат Тебантин шляхом титрування дози до настання задовільного знеболення призначали по 300 мг у 1-шу добу, 600 мг — у 2-гу добу, 900 мг — у 3-тю добу з підтримкою дози 900–1200 мг (в окремих випадках — 1500 мг) на добу щонайменше протягом 2–3 міс до стійкого зникнення больового синдрому
- Мідокалм призначали у дозі 450 мг/добу протягом 3–4 тиж
- З метою зменшення первинної гіпералгезії після припинення постійної іммобілізації місцево застосовували аплікації капсаїцину, який зменшує запас субстанції Р у термінальних відділах сенсорних волокон
- З метою остеотропної дії застосовували препарати кальцію, вітаміну D3 та бісфосфонати за стандартною схемою, зокрема нами застосовувався комбінований препарат Осталон Кальцій-Д
- Крім того, хворим призначали комплекс лікувальної фізіотерапії, в період іммобілізації — «дзеркальну терапію», контрастні водні процедури з місцевим охолодженням, препарати вітамінів групи В.
У групу порівняння увійшли 26 пацієнтів, які лікувалися за традиційними схемами із застосуванням знеболювальних (кетанов), протизапальних препаратів (диклофенак натрію), спазмолітичних місцевих протизапальних гелів, а також із застосуванням комплексу фізіотерапевтичного лікування та остеотропного лікування у зв’язку з наявністю перелому.
Враховуючи те, що розвиток КРБС І типу у хворих із переломами ДЕМ променевої кістки припадав на період постійної іммобілізації, місцеве лікування та комплекс фізіотерапевтичних заходів протягом наступних 2–3 тиж були обмеженими. Ефективність лікування оцінювали у динаміці спостереження у строки після початку лікування, що становили 4 тиж (2±0,3 тиж після припинення постійної іммобілізації) та 8 тиж (6±0,4 тиж після припинення постійної іммобілізації). З метою оцінки інтенсивності больового синдрому застосували візуальну аналогову шкалу (ВАШ). ВАШ (Visual analog pain scale, Huskisson), яка є загальним інструментом оцінки ступеня больового синдрому при багатьох патологічних станах. Вона являє собою горизонтальну лінію з позначками від 0 до 100 мм, початок якої відповідає відсутності больових відчуттів, а закінчення — максимальному болю. Для відповіді на питання про ступінь своїх больових відчуттів пацієнту пропонується відмітити точку на шкалі.
Динаміку зміни вираженості невропатичного болю оцінювали до лікування, через 4 тиж та через 8 тиж від початку лікування за допомогою опитувальника DN4.
Функціональний стан кисті та можливість до самообслуговування оцінювали за допомогою тесту оцінки можливостей кисті [23]. Ця система становить собою опитувальник із 46 питань і є найбільш простим та валідним клінічним інструментом для оцінки функціональних можливостей кисті. Тест застосовується для контролю динаміки відновного лікування у хворих із функціональними та органічними дисфункціями кисті різної етіології. Опитувальник заповнюється лікарем на підставі відповідей пацієнтів. Відповіді ранговані за такими категоріями: 0 балів — неможливо, 1 бал — складно, 2 бали — легко, 3 бали — дуже легко. Отримані результати додаються та перераховуються.
Також за суб’єктивною оцінкою хворих та лікаря аналізували зміну загального самопочуття пацієнта та динаміку вегетативно-трофічних розладів (гіпер- або гіпогідроз, зміна росту волосся та нігтів, підвищення чи зниження локальної температури, вираженість набряку, наявність і стійкість контрактур). З цією метою через 4 та 8 тиж після початку лікування лікар та хворий оцінювали у відсотках динаміку покращання або погіршення загального стану та вираженість вегетативно-трофічних розладів.
Результати дослідження та їх обговорення
Цифровий аналіз результатів лікування хворих у клінічних групах в динаміці спостереження наведено в табл. 2.
| Параметри оцінки | До лікування | Через 4 тиж | Через 8 тиж | ||||
|---|---|---|---|---|---|---|---|
| Група спостереження | |||||||
| основна | порівняння | основна | порівняння | основна | порівняння | ||
| ВАШ, Huskisson** | 81,6±2,1 | 82,3±2,6 | 31,4±1,4 | 42,3±1,2 | 16,3±0,6 | 25,7±0,8 | |
| Середній показник за DN4 (у балах)** | 7,6±0,4 | 7,3±0,3 | 3,9±0,1 | 5,2±0,2 | 2,2±0,5 | 4,1±0,3 | |
| Шкала визначення рівня функціональної активності ABILHAND (у балах)** | — | — | 67,8±3,2 | 53,7±3,4 | 92,8±2,5 | 79,2±2,3 | |
| Оцінка результату лікування лікарем*, % | Неефективно | — | — | — | — | — | — |
| Недостатньо | — | — | — | 11 | — | 9,3 | |
| Задовільно | — | — | 30,9 | 72,6 | 23,2 | 70,4 | |
| Добре | — | — | 64,7 | 16,4 | 58,7 | 20,3 | |
| Відмінно | — | — | 6 | — | 18,1 | — | |
| Оцінка результату лікування пацієнтом*, % | Неефективно | — | — | — | — | — | — |
| Недостатньо | — | — | — | 8,9 | — | 7,6 | |
| Задовільно | — | — | 33,5 | 67,5 | 24,7 | 76,5 | |
| Добре | — | — | 63,5 | 23,6 | 60,2 | 15,9 | |
| Відмінно | — | — | 3 | — | 15,1 | — | |
*p<0,05; **p<0,01 при порівнянні до та після лікування.
Як видно з таблиці, до лікування середній показник інтенсивності больового синдрому у пацієнтів обох груп був зіставним та становив за ВАШ у основній групі 81,6±2,1 та 82,3±2,6 — у групі порівняння. Через 4 тиж після початку лікування в основній групі показник достовірно (p<0,01) знизився у 2,5 раза до 31,4±1,4, а через 8 тиж становив 16,3±0,6, що майже удвічі нижче за попередній. У групі порівняння також спостерігали достовірне зменшення інтенсивності больового синдрому, але ступінь зменшення значно поступався відповідним показникам основної групи. Так, через 4 тиж показник ВАШ у групі порівняння становив 42,3±1,2, зменшившись таким чином у 1,9 раза, а через 8 тиж — 25,7±0,8, зменшившись у 1,6 раза. При цьому через 8 тиж після початку лікування різниця щодо інтенсивності больового синдрому у клінічних групах відрізнялася майже вдвічі, що достовірно доводить високу ефективність застосування схеми лікування у хворих основної групи порівняно з традиційним лікуванням (рис. 1).
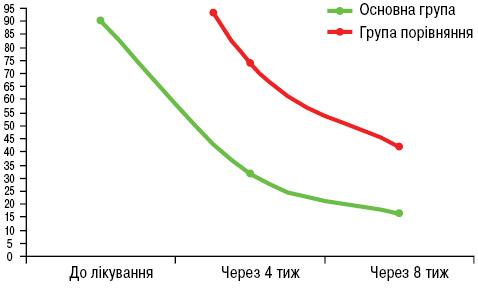
Результати опитування хворих за опитувальником DN4, що проводилося з метою визначення невропатичного больового синдрому, показали, що у всіх пацієнтів больовий синдром за своїми характеристиками відповідав невропатичному болю середнього ступеня (рис. 2).
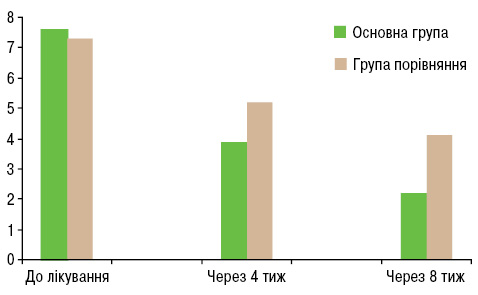
Так, середня кількість балів за DN4 при встановленні діагнозу до початку лікування в основній та контрольній групах була зіставною та становила 7,6±0,4 та 7,3±0,3 бала відповідно. Через 4 тиж лікування в основній групі середня кількість балів за DN4 становила 3,9±0,1, що дозволяло достовірно стверджувати про регрес невропатії, а через 8 тиж на підставі зниження показника DN4 до 2,2±0,5 — про відсутність невропатичності больового синдрому, що залишився. У порівнюваній групі через 4 тиж після початку лікування, за даними опитування DN4, середня сума балів становила 5,2±0,2, а через 8 тиж — 4,1±0,3. І хоча зменшення показників було статистично достовірним, навіть через 8 тиж у хворих групи порівняння залишався невропатичний компонент больового синдрому. Отже, застосування патогенетично обґрунтованої комбінації фармакотерапевтичних засобів Аертал, Мідокалм, Тебантин при лікування КРБС І типу на фоні переломів дистального кінця променевої кістки достовірно дозволяє усунути невропатичний біль при застосуванні у відповідних дозах та у досліджений термін спостереження.
Оцінка результатів лікування за шкалою визначення рівня функціональної активності ABILHAND при спостереженні в основній групі хворих виявила позитивну динаміку, що підтверджена статистично (p<0,01) (рис. 3). Оскільки захворювання розвивалося у пацієнтів на тлі перелому ДЕМ променевої кістки, а початок лікування припадав на період іммобілізації, оцінку до лікування за ABILHAND провести було не можливо. Однак ми мали змогу оцінити динаміку відновлення функціональної активності кисті та кистьового суглоба на етапах спостереження. Так, в основній групі через 4 тиж після початку лікування, а це в середньому 2,5 тиж після зняття іммобілізації, середній показник за ABILHAND становив 67,8±3,2, що відповідало критерію «задовільно». Через 8 тиж (у середньому — 6,5 тиж після припинення іммобілізації) цей показник достовірно зріс до 92,8±2,5 та перейшов у групу із критерієм «добре». У групі порівняння також відзначали позитивну динаміку, але зростання показника активності відбувалося повільно та незначно. Вихідний рівень (через 4 тиж лікування) був значно нижчим порівняно з основною групою і становив 53,7±3,4, відповідаючи критерію «задовільно». Через 8 тиж показник ABILHAND становив 79,2±2,3, при цьому позитивний приріст хоч і був статистично достовірним, але залишився на рівні критерію «задовільно». Таким чином, застосоване лікування в основній групі спостереження дозволило досягти хороших функціональних результатів у межах 8-тижневого періоду лікування, тоді як у групі порівняння вони залишалися на рівні «задовільно».
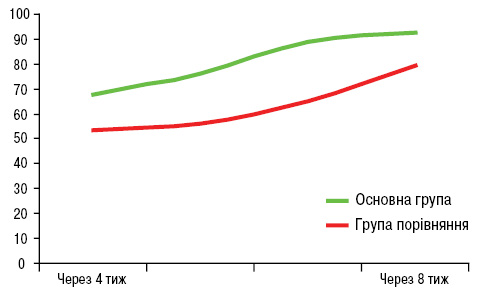
За оцінкою лікаря через 4 тиж в основній групі хворих відмінний клінічний результат відзначено у 2 хворих (6%), добрий — у 64,7%, задовільний — у 30,9%. Хворих з незадовільним результатом або недостатнім ефектом не відмічалося. Через 8 тиж спостерігалася позитивна динаміка перерозподілу результатів лікування, що характеризувалося зростанням відмінних (18,1%) та добрих (58,7%) результатів за рахунок зменшення частки хворих із задовільними (23,2%) результатами. У контрольній групі хворих зафіксована тенденція до аналогічної динаміки перерозподілу результатів, але відмінних результатів ані за оцінкою лікаря, ані за оцінкою пацієнтів у межах терміну спостереження не досягнуто. Так, через 4 тиж за оцінкою лікаря у цій групі відзначено 11% хворих із недостатнім ефектом від лікування, 72,6% — із задовільними результатами та 18,4% — із добрими результатами. Через 8 тиж у цих хворих за оцінкою лікаря спостерігалося покращання результату, але у 9,3% продовжували відзначати недостатній ефект від лікування. Оцінка результатів пацієнтами показала аналогічну динаміку в обох групах хворих, однак частка відмінних та добрих результатів була меншою, що, очевидно, пов’язано з наявністю у хворих депресивного чи пригніченого психічного стану.
Висновки
Виконаний аналітичний огляд сучасних уявлень про провідні механізми патогенезу КРБС, принципи його діагностики та лікування дозволив розробити спосіб комплексного лікування хворих на КРБС І типу із застосуванням патогенетично обґрунтованої комбінації фармакотерапевтичних засобів Аертал, Мідокалм, Тебантин, Осталон Кальцій-Д, а також методів фізичного та фізіотерапевтичного лікування.
Клінічне дослідження ефективності розробленого способу у 56 хворих з діагнозом КРБС І типу на фоні переломів ДЕМ променевої кісти зі зміщенням уламків достовірно (p<0,05) засвідчило його ефективність. Аналіз результатів лікування проводили в динаміці з використанням стандартизованих критеріїв оцінки інтенсивності больового синдрому (шкала ВАШ), невропатичного болю (опитувальник DN4), функціональної активності кисті та кистьового суглоба (опитувальник ABILHAND) та суб’єктивної оцінки лікарем та пацієнтом. У 8-тижневий період лікування в основній групі хворих досягнуто понад трикратного зменшення вираженості больового синдрому за ВАШ порівняно з вихідним станом. При цьому наприкінці терміну спостереження вираженість больового синдрому у хворих основної групи була майже вдвічі меншою, ніж у пацієнтів групи порівняння. За показником DN4 у 8-тижневий термін в основній групі пацієнтів зникали явища невропатичного болю, тоді як у контрольній групі залишався невропатичний компонент болю. Функціональна активність кистьового суглоба та кисті в основній групі наприкінці спостереження відповідала критерію «добре», а в групі порівняння — критерію «задовільно». Оцінка результатів лікування лікарем та пацієнтами хоч і була суб’єктивною, але також засвідчила вищу ефективність лікування в основній клінічній групі.
Таким чином, застосування патогенетично обґрунтованої комбінації фармакотерапевтичних засобів Аертал, Мідокалм, Тебантин у комплексному лікуванні хворих на КРБС І типу на фоні переломів дистального кінця променевої кістки достовірно дозволяє ефективно зменшити інтенсивність больового синдрому, усунути ознаки невропатичного болю та значно покращити функціональну здатність ураженої кінцівки.
Список використаної літератури
-
- 1. Бурьянов А.А. (1990) Посттравматическая дистрофия конечностей (синдром Зудека). Вопросы патогенеза, диагностики и лечения. Автореф. дис. … канд. мед. наук. Харьков, 24 с.
- 2. Данилов А. Б. (1998) Комплексный регионарный болевой синдром. В кн.: Вегетативные расстройства. Под ред. проф. Вейна А.М., Москва, с. 604–615.
- 3. Морозова О. Г. (2009) Комплексный региональный болевой синдром в клинической практике. Здоров’я України., 22(1): 18–21.
- 4. Новиков А.В., Яхно Н.Н. (1994) Синдром рефлекторной симпатической дистрофии. Журн. невропат. и психиатр. им. С.С. Корсакова., 5: 103–107.
- 5. Тутер Н.В. (1998) Комплексный регионарный болевой синдром различной этиологии: клиника, диагностика, лечение. Дис. … канд. мед. наук.
- 6. Amadio P.C., Mackinnon S., Merrit W.H. et al. (1991) Reflex sympathetic dystrophy syndrome: Consensus report of an ad hoc committee of the American Association forand Surgery on the definition of reflex sympathetic dystrophy syndrome. Plast. Reconst. Surg., 87(2): 371–375.
- 7. Netherlands Society of Rehabilitation Specialists. Netherlands Society of Anaesthesiologists (2006) Complex Regional Pain Syndrome type I. Guidelines. 163 р.
- 8. de Rooij A.M., de Mos M., Sturkenboom J.M. et al. (2009) Familial occurrence of Complex Regional Pain Syndrome. European Journal of Pain., 13 (2): 171–177.
- 9. Field S., Warwick D., Bannister G. (1992) Features of algodystrophy after Colles’ fracture. J. Hand Surg. 17B(3): 318–320.
- 10. Geertzen J.H.B., Bruijh H., Bruijn-Kofman A.T., Arendzen J.H. (1994) Reflex sympathetic dystrophy: early treatment and psychological aspects. Arch. Phys. Med. Rehab., 75(4): 442–447.
- 11. Gregerson M. (2010) Complex Regional Pain Syndrome: Simplification on the Horizon. Workers’ Compensation Update, 91: 1–3.
- 12. Harden R., Bruehl S. (2005) Diagnostic criteria: The statistical derivation of the four criterion factors. CRPS: Current Diagnosis and Therapy. Progress in Pain Research and Management. Vol. 32, Edited by P. Wilson, M. Stanton-Hicks, R.N. Harden. Seattle, WA: IASP Press, р. 45–58.
- 13. https://www.revisor.leg.state.mn.us/rules/?id=5221&view=chapter#rule.5221.6305
- 14. Minnesota Administrative Rules. Chapter 5221, Fees For Medical Services. MINN. R. 5221.6305 Complex regional pain syndrome (CRPS); reflex sympathetic dystrophy; and causalgia of the upper and lower extremities. Subp. 1, 2, 3. Minnesota Department of Labor and Industry, August 16, 2010.
- 15. Mitchell S.W. (1872) Injuries of Nerves and Their Consequences. Philadelphia: J. B. Lippincott, 377 р.
- 16. Darbois H., Boyer B., Dubayle P. et al. (1999) MRI findings in reflex sympathetic dystrophy of the foot. Journal de Radiologie. 80(8): 849–854.
- 17. Quisel A., Gill J.M., Witherell P. (2005) Complex regional pain syndrome underdiagnosed: CRPS type 1 is an under-recognized problem in limbs recovering from fracture or immobilized post-stroke. J. Family Practice? 54(6): 524–532.
- 18. Steiman G.S., Ranavaya M. (2005) Complex Regional Pain Syndrome. CRPS Type I: A review for Independent Medical Examiner. Disability Medicine, 5(3): 471–479.
- 19. Steinbrocker O. (1947) The shoulder-hand syndrome. Am. J. Med., 3: 402.
- 20. Sudeck P. (1900) Ueber die akute enzundiche Knochenatrophie. Arch. Klin. Chir., 62: 147.
- 21. Harden R.N., Bruehl S., Perez R.S.G.M. et al. (2010) Validation of proposed diagnostic criteria (the «Budapest Criteria») for Complex Regional Pain Syndrome. Pain.,150 (2): 268–274.
- 22. Bouhassira D., Attal N., Alchaar H. et al. (2005) Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire (DN4). Pain, 114(1–2): 29–36.
- 23. Penta M., Thonnard J.L., Tesio L. (1998) ABILHAND: a Rasch-built measure of manual ability. Arch. Phys. Med. Rehabil., 79(9): 1038–1042.
Особенности патогенеза, современные аспекты диагностики и лечения комплексного регионарного болевого синдрома
Резюме. Проведенный аналитический обзор современных представлений о ведущих механизмах патогенеза комплексного регионарного болевого синдрома (КРБС), принципах его диагностики и лечения позволил разработать способ комплексного лечения пациентов с КРБС І типа с применением патогенетически обоснованной комбинации фармакотерапевтических препаратов Аэртал®, Мидокалм, Тебантин®, Осталон® Кальций-Д, а также методов физического и физиотерапевтического лечения. Клиническое исследование эффективности разработанного способа у 56 больных с диагнозом КРБС І типа на фоне переломов дистального конца лучевой кости со смещением отломков достоверно (p<0,05) показало его эффективность. Анализ результатов лечения проводили в динамике с использованием стандартизированных критериев оценки интенсивности болевого синдрома (шкала ВАШ), невропатической боли (опросник DN4), функциональной активности кисти и кистевого сустава (опросник ABILHAND) и субъективной оценки врачом и пациентом. В 8-недельный период лечения в основной группе больных достигнуто более чем трехкратное уменьшение выраженности болевого синдрома по ВАШ в сравнении с исходным состоянием. При этом в конце срока наблюдения выраженность болевого синдрома у больных основной группы была почти вдвое меньше, чем у пациентов группы сравнения. По показателю DN4 в 8-недельный срок в основной группе пациентов исчезали явления невропатической боли, тогда как в контрольной группе оставался невропатический компонент боли. Функциональная активность кистевого сустава и кисти в основной группе в конце наблюдения соответствовала критерию по шкале ABILHAND «хорошо», а в группе сравнения — критерию «удовлетворительно». Оценка результатов лечения врачом и пациентами хоть и была субъективной, но также показала более высокую эффективность лечения в основной клинической группе.
Ключевые слова: комплексный регионарный болевой синдром, переломы лучевой кости, патогенетическое лечение.
Адреса для листування:
Бур’янов Олександр Анатолійович
01601, Київ, бульв. Тараса Шевченка, 13
Національний медичний університет
ім. О.О. Богомольця
Інформація для професійної діяльності медичних і фармацевтичних працівників
Мідокалм
Мідокалм. Р.п. № UA/7535/01/01, № UA/7535/02/01, № UA/7535/02/02 від 14.01.13 р. Склад. 1 таблетка містить 50 мг чи 150 мг толперизону гідрохлориду; 1 мл розчину містить 100 мг толперизону гідрохлориду та 2,5 мг лідокаїну гідрохлориду. Фармакотерапевтична група. Міорелаксанти з центральним механізмом дії. Код АТС М03В Х04. Показання. Таблетки: м’язова спастичність, включаючи постінсультну спастичність, у разі, коли ін’єкційна форма є методом вибору. Розчин для ін’єкцій: симптоматичне лкування при м’язовому спазмі у дорослих після перенесеного інсульту. Протипоказання. Гіперчутливість до будь-якого з компонентів препарату; міастенія гравіс; період годування грудьми; розчин для ін’єкцій також не завтосовують у дітей. Побічні реакції. М’язова слабкість, головний біль, запаморочення, гіпотензія, порушення сну, нудота, блювання, відчуття дискомфорту в животі; реакції підвищеної чутливості. Виробник. ВАТ «Гедеон Ріхтер», Угорщина.
Тебантин
Р.п. № UA/3421/01/02 від 30.07.2010 р. Склад: 1 капсула містить 300 мг габапентину. Фармакотерапевтична група. Протиепілептичні препарати. Код АТС N03A X12. Фармакологічні властивості. Точний механізм дії невідомий. Габапентин структурно пов’язаний з гамма-аміномасляною кислотою, зв’язується з пептидзв’язаними ділянками вольтажчутливих кальцієвих каналів, внаслідок чого модулює вивільнення нейротрансмітерів. Показання. Лікування при периферичному невропатичному болю (больовій діабетичній невропатії та постгерпетичній невралгії у дорослих); лікування при епілепсії (у ад’ювантній терапії при усуненні парціальних нападів із вторинною генералізацією чи без у дорослих і дітей віком старше 6 років та в монотерапії при парціальних нападах із вторинною генералізацією чи без у дорослих і дітей віком старше 12 років). Застосування. Габапентин можна призначати незалежно від прийому іжі. Протипоказання. Підвищена чутливість до активної речовини чи будь-якого з допоміжних компонентів препарату. Побічні реакції. Лейкопенія, анорексія, підвищення апетиту, сплутаність свідомості та емоційна лабільність, сонливість, запаморочення, атаксія, судоми, гіперкінези, дизартрія, амнезія, тремор, безсоння, головний біль, парестезія, гіпестезія, порушення координації, ністагм, амбліопія, диплопія, артеріальна гіпертензія, бронхіт, фарингіт, блювання, нудота, діарея, біль у животі, диспепсія, запор, сухість у роті чи глотці, метеоризм, набряк обличчя. Виробник. ВАТ «Гедеон Ріхтер», Н-1103, вул. Демреї, 19–21, Будапешт, Угорщина.
Осталон Кальцій-Д
Р.п. № UA/11297/01/01 від 06.01.2011 г. Склад: таблетки алендронової кислоти: 1 таблетка, вкрита оболонкою, містить 70 мг алендронової кислоти (у вигляді 91,35 мг алендронату натрію тригідрату). Таблетки кальцію і вітаміну D3: 1 таблетка, вкрита оболонкою, містить 600 мг кальцію (у вигляді 1500 мг кальцію карбонату) і 400 МО вітаміну D3 (у вигляді 10 мкг колекальциферолу). Фармакотерапевтична група. Бісфосфонати, комбінації. Код АТС. M05B B05. Показання. Лікування при остеопорозі, коли показано застосування таблеток алендронової кислоти і коли необхідно приймати додатково таблетки кальцію і вітаміну D3. Таблетки алендронової кислоти: лікування при остеопорозі в постменопаузальний період з метою запобігання переломам, у тому числі компресійним переломам спинних хребців і головки стегнової кістки; лікування при остеопорозі у чоловіків із метою запобігання переломам. Таблетки кальцію і вітаміну D3: додаткова терапія для лікування при остеопорозі з таблетками алендронової кислоти. Протипоказання. Застосування таблеток Осталон Кальцій-Д противопоказане через таблетки алендронової кислоти при підвищеній чутливості до компонентів препарату, аномалії стравоходу та інших факторах, утруднюючих його прохідність (ахалазія, стриктури); нездатності хворого залишатися у вертикальному положенні (хоча б сидячи) протягом 30 хв; гіпокальціємії; у період вагітності та годування грудьми; дитячий чи підлітковий вік. Таблетки Осталон Кальцій-Д протипоказані через таблетки кальцію і вітаміну D3 при підвищеній чутливості до компонентів препарату; нирковій недостатності; гіперкальціурії; нефролітіазі; застосування препаратів, які містять активний вітамін D; при гіпервітамінозі, зумовленому вітаміном D; первинному гіперпаратиреозі; гіперкальціємії будь-якої етіології. Таблетки Осталон Кальцій-Д, вкриті плівковою оболонкою, містять соєву олію, тому пацієнтам, які страждають на алергію на сою чи арахіс, препарат протипоказаний. Побічні реакції. Таблетки алендронової кислоти по 70 мг: з боку ШКТ — біль у животі, диспепсія, запор, діарея, метеоризм, виразка стравоходу, дьогтеподібні випорожнення (мелена), дисфагія, здуття шлунка, відрижка кислотою та ін.; з боку опорно-рухового апарату — кістковий, м’язовий чи суглобовий біль; з боку нервової системи — головний біль; загальні — шкірний висип, зуд, почервоніння шкіри, алергічні реакції, включаючи кропив’янку та ангіоневротичний набряк; минущі симптоми, які нагадують фазу гострої реакції (міалгія, слабкість, погане самопочуття; рідко — висока температура тіла) та ін.; з боку органів чуття — увеїт, склерит та ін. Таблетки кальцію і вітаміну D3: з боку обміну речовин — гіперкальціємія, гіперкальціурія; з боку ШКТ — запор, метеоризм, нудота, біль у животі, діарея; з боку шкіри та підшкірної клітковини — зуд, висип, кропив’янка.
Виробник. Таблетки кальцію і вітаміну D3: ЗАТ «Берешь Фарма», Н-5005, Солнок, вул. Надьшандор, 39, Угорщина. Таблетки алендронової кислоти: ТОВ «Гедеон Ріхтер Польща», 05-825, Гродзиськ Мазовецький, вул. Кн.Ю. Понятовського, 5, Польща.
Повна інформація про лікарські засоби міститься в інструкціях для медичного застосування.

Leave a comment