Гіперурикемія та подагра: сучасний стан проблеми
Кондратюк В.Є., Тарасенко О.М.
Резюме. У статті наведено дані щодо патогенезу гіперурикемії та подагри, нові класифікаційні критерії подагри Американської колегії ревматологів/Європейської антиревматичної ліги, генетичні аспекти подагри, дієтичні рекомендації та дані щодо урикозуричної терапії.
Зростання захворюваності на подагру за рахунок збільшення екзо- та ендогенних пуринів, зменшення віку дебюту патології, погіршення якості життя та рання інвалідизація хворих, підвищення ризику розвитку кардіальних та нефрологічних захворювань і смертності зумовлює актуальність проблеми подагри [6]. На подагру хворіють до 3% загальної популяції світу, переважно чоловіки у середньому віці та жінки — в похилому. Серед пацієнтів з подагрою співвідношення чоловіків до жінок становить 4:1. Підґрунтям розвитку подагри є гіперурикемія — підвищення рівня сечової кислоти (СК) у крові >360 мкмоль/л (>6 мг/дл), поширеність якої у світі сягає 15–20%, проте її патогенетична роль сьогодні недооцінена, оскільки визначає погіршення серцево-судинного прогнозу [18].
Останнім часом внаслідок нових досягнень у галузі фундаментальних наук розширилися знання щодо особливостей патогенезу і лікування подагри. Знайдено ключові механізми, що включають виявлення як генетичних факторів, так і факторів зовнішнього середовища, що впливають на розвиток подагри, детермінуючи підвищення ризику серцево-судинних подій. Приділяється велика увага пошуку нових лікарських препаратів для лікування пацієнтів як із гострим подагричним артритом, так і з його хронічною формою.
СК в організмі людини в умовах фізіологічних значень рH знаходиться у вигляді моноурату натрію. У людини СК є кінцевим продуктом розпаду пуринів, у інших ссавців вона далі за допомогою урикази розпадається до алантоїну (фермент, що знаходиться переважно в печінці). Ген, що кодує уриказу, протягом еволюції людини піддавався значним мутаціям [16]. Це в результаті привело до того, що рівні СК у людини виявляються значно вищими (240–360 ммоль/л) порівняно із ссавцями (30–50 ммоль/л). Можна припустити, що досить високий рівень СК в організмі людини селективно відібраний протягом її еволюції, оскільки вона має потужні антиоксидантні та імуномодулювальні властивості. З іншого боку, гіперурикемія асоціюється з багатьма захворюваннями у людини, насамперед серцево-судинними (артеріальна гіпертензія, серцева недостатність, інфаркт міокарда, інсульт), цукровим діабетом, хронічною хворобою нирок і несе погіршення прогнозу.
Гомеостаз обміну уратів залежить від балансу між комплексом процесів секреції та екскреції нирковими канальцями та виведенням через шлунково-кишковий тракт (ШКТ). Близько 20–30% СК виводиться через ШКТ та 70–80% нирками. У пацієнтів з первинною гіперурикемією та подагрою відбувається зниження виведення нирками СК [19]. Актуальним є також подальше вивчення механізмів дії та взаємодії фармакологічних препаратів різних груп, які можуть як знижувати (бензбромарон, пробенецид, лозартан, фенофібрат), так і підвищувати рівень СК у крові (діуретики, піразинамід, нікотинат, метотрексат та ін.), особливо в умовах поліморбідності. Постійно триває пошук нових урикозуричних і урикодепресивних препаратів, які мали б безпечний профіль.
Оновлені класифікаційні критерії подагри
У 2015 р. Американською колегією ревматологів (ACR) спільно з Європейською антиревматичною лігою (EULAR) розроблено оновлені класифікаційні критерії подагри (табл. 1) [15]. Новим у цих критеріях є те, що у двох критеріях із трьох категорій за відсутності певного показника віднімають бали від загальної суми балів: 1) відсутність кристалів моноурату натрію (–2 бали) в ураженому суглобі або синовіальній оболонці; 2) якщо рівень СК у крові становить <4 мг/дл (<0,24 ммоль/л) (–4 бали). Якщо наявні такі показники, то це значно знижує вірогідність наявності подагри у пацієнта. Найнижчим балом у кожній групі є 0: рівень СК 4–6 мг/дл (0,24–0,36 ммол/л) відповідає 0 балам; якщо немає рентгенологічної картини, характерної для подагричного артриту — це також 0 балів.
| Критерії класифікації подагри | Категорії | Бали |
| Крок 1: вхідні критерії (застосовуються нижченаведені критерії за наявності вхідних критеріїв) | Щонайменше 1 епізод набряку, болючості та підвищеної чутливості в периферичних суглобах або синовіальній оболонці | |
| Крок 2: достовірні критерії (при їх виявленні можна класифікувати як подагра, без нижченаведених критеріїв) | Наявність кристалів моноурату натрію в суглобі, що турбує, або в синовіальній оболонці (синовіальній рідині), або тофусах | |
| Крок 3: критерії слід використовувати, якщо достовірні критерії не виявлені | ||
| Клінічно | ||
| Типова картина ураження суглоба/синовіальної оболонки під час нападу† | Гомілковостопний суглоб або суглоби склепіння стопи (як частина епізоду моно- чи олігоартриту без залучення першого плеснофалангового суглоба) Залучення першого плеснофалангового суглоба (як частина епізоду моно- чи олігоартриту) |
1 2 |
| Характеристики нападу: – еритема шкіри навколо ураженого суглоба (зі слів хворого чи під час огляду лікарем); – болючість під час пальпації ураженого суглоба; – значні труднощі під час ходьби або неможливість рухів в ураженому суглобі |
Одна характеристика Дві характеристики Три характеристики |
1 2 3 |
| Тривалість нападу: Наявність >2, незалежно від протизапального лікування: – максимальна вираженість болю <24 год; – зникнення симптомів за ≤14 діб; – повністю зникають симптоми між нападами |
Один типовий епізод Повторний типовий епізод |
1 2 |
| Наявність тофусів Проривання чи крейдоподібні підшкірні вузлики, що просвічуються під шкірою, що локалізуються в типових місцях (навколо суглобів, на вушних раковинах, подушечках пальців та в ділянці сухожилків) |
Наявність | 4 |
| Лабораторно | ||
| Рівень СК: визначається уриказним методом. В ідеалі визначати необхідно у пацієнтів, які ще не отримували уратзнижувальну терапію, та через >4 тиж від початку нападу | <4 мг/дл (<240 мкмоль/л)** 6–8 мг/дл (360–<480 мкмоль/л) 8–<10 мг/дл (480–<600 мкмоль/л) ≥10 мг/дл (≥600 мкмоль/л) |
–4 2 3 4 |
| Аналіз синовіальної рідини на виявлення кристалів моноурату натрію ураженого суглоба чи синовіальної рідини (бажано, щоб дослідження проводив лаборант із досвідом) | Відсутність кристалів моноурату натрію | –2 |
| Інструментально | ||
| Наявність депозитів кристалів моноурату натрію при ультразвуковому дослідженні суглоба чи синовії (ультразвуковий критерій «подвійний контур»), чи виявлення кристалів моноурату натрію при дослідженні за допомогою сканера двохенергетичної комп’ютерної томографії*** | Наявність | 4 |
| Рентгенологічні ознаки ураження суглобів при рентгенографії суглобів кистей та/чи стоп (на яких є хоча б одна ерозія) | Наявність | 4 |
*Веб-калькулятор може бути доступний на: http://goutclassificationcalculator.auckland.ac.nz, та на веб-сайтах ACR та EULAR.
†Напад, що включає симптоми набряку, болючості та/чи підвищеної чутливості в периферичних суглобах та сумках.
**Якщо рівень СК <4 мг/дл (<240 мкмоль/л), потрібно відняти 4 бали; якщо рівень СК ≥4–6 мг/дл (≥240—<360 мкмоль/л), потрібно оцінити у 0 балів.
Якщо кристалів моноурату натрію не виявлено у синовіальній рідині, потрібно відняти 2 бали; якщо дослідження синовіальної рідини не проводили, потрібно оцінити в 0 балів.
Якщо інструментальних досліджень не проводили, потрібно оцінити в 0 балів.
Гіперехогенні гетерогенні пошкодження гіалінового хряща, що не залежать від кута ультразвукового променя (псевдопозитивний «подвійний контур» (артефакт) має зникнути при зміні кута ультразвукового променя).
***Зображення мають бути виявлені за допомогою сканера ДЕКТ при 80 та 140 кВт та бути проаналізованими спеціальною програмою для подагри з виявленням «колірних кодів» уратів. Сканування рахується позитивним, якщо виявлено «колірні коди» уратів у суглобах та навколосуглобових тканинах.
Ерозії характеризуються кортикальним розривом зі склеротичним обідком та нависаючими краями, за винятком дистальних міжфалангових суглобів.
Діагноз вважається достовірним, якщо набрано за нижченаведеними критеріями ≥8 балів (максимум — 23).
Генетичні аспекти гіперурикемії та визначення нових транспортерів уратів
Декілька нещодавніх досліджень показали наявність специфічних генетичних локусів, які пов’язані з гіперурикемією та подагрою. Однак зазначимо, що лише незначна частка людей у популяції з гіперурикемією мають подагру. Патогенетичний механізм запалення при подагрі: індукована кристалами моноурату натрію патологічна активність мультипротеїнового комплексу (NLRP3 інфламасоми) призводить до активації інтерлейкіну (IL)-1β — цитокіну, який відіграє основну роль у процесі запалення. Toll-like-рецептори (Toll-подібні рецептори — TLR2–4) вивчають як проміжний крок до продукції пре-IL-1β як попередника активного метаболіту [16, 22].
За останнє десятиліття відкрито рідкий монозиготний характер порушення продукції уратів, асоційований із гіперурикемією, особливостями дебюту подагри в ювенільний період, захворювань нирок, розвитку та прогресування ментальних розладів [24]. Більше того, значних успіхів досягнуто щодо розуміння молекулярних і генетичних основ розвитку гіперурикемії та подагри у дорослих, а також гендерних відмінностей. Генетичні дослідження у хворих на подагру довели чіткий зв’язок частоти наявності гена SLC2A9 з розвитком гіперурикемії. Наявність цього гена детермінує до 5% гіперурикемій (табл. 2). Ген SLC2A9 кодує відомий розчинний транспортер глюкози та фруктози родини 2, 9 білка (відомий як GLUT 9), який відіграє фундаментальну роль у транспортуванні уратів [3]. Дві ізоформи цих транспортерів наявні у клітинах проксимальних канальців: коротка ізоформа міститься в апікальній частині мембрани і довга — в базолатеральній частині мембрани. Наявність фруктози чи глюкози сприяє транспорту уратів цими рецепторами, які врешті протегують реабсорбції уратів проксимальними нирковими канальцями. Хоча бензбромарон інгібує ці транспортери у високих концентраціях, на відміну від інших урикозуричних препаратів, які цієї функції не мають. SLC2A9 також експресований у печінці людини та хондроцитах; роль цих транспортерів в інших органах залишається поки що невідомою.
| Локус | Чи наявний закодований цим локусом білок у ниркових канальцях | Поширеність, % | Асоціація з подагрою |
|---|---|---|---|
| SLC2A9 | Так | 3,53 | Так |
| ABCG2 | Так | 0,57 | Так |
| PDZK1 | Так | 0,19 | Ні |
| SLC17A1 | Так | 0,19 | Так |
| SLC22A11 | Так | 0,19 | Ні |
| SLC16A9 | Так | 0,17 | Ні |
| FCKR | Ні (у клітинах печінки та підшлункової залози) | 0,13 | Ні |
| SLC22A12 | Так | 0,13 | Так |
Інші генетичні регулятори концентрації СК у крові підтверджені та ідентифіковані в генетичному дослідженні, що включало 28 141 учасника європеоїдного походження. Це дослідження включало нещодавно ідентифіковані транспортери уратів, які містяться на апікальній мембрані клітин проксимальних ниркових канальців: підгрупа G (ABCG2), які кодують гени ABCG2, SLC22A12, які, в свою чергу, кодують аніонний обмінник уратів 1 (URAT1); SLC22A11 (містяться на апікальній мембрані клітин проксимальних ниркових канальців, які кодують органічний аніонний транспортер 4 (OAT4) та SLC17A1, що кодують ренальні натрій фосфат транспортери протеїну 1 (NPT1). Окрім SLC2A9, інші генетичні маркери визначають концентрацію СК у сироватці крові у <1% випадків. Більше того, для багатьох генетичних маркерів не продемонстровано асоціацію з подагрою [20, 24].
Серцево-судинні захворювання, гіпертензія та гіперурикемія/подагра
За останні десятиліття збільшилось розуміння та підтвердилася наявність взаємозв’язку між серцево-судинною патологією та гіперурикемією/подагрою. Широкомасштабні проспективні дослідження в популяції, яка має високі кардіоваскулярні ризики, довели, що гіперурикемія є незалежним фактором кардіоваскулярної патології (включаючи всі причини смерті, серцево-судинні події, смертність від інсульту, а також високий ризик у цих хворих виникнення фібриляції передсердь). Одне з таких досліджень показало, що хворі на подагру, які на момент включення не мали кардіоваскулярної патології, порівняно з особами без неї, мають підвищення відносного ризику розвитку 1,28 для загальної та кардіоваскулярної смертності у 1,38 і 1,55 раза відповідно [8]. В експериментальних роботах на тваринах показано, що помірна гіперурикемія призводить до ниркових мікроваскулярних і тубулоінтерстиційних захворювань, активації ренін-ангіотензинової системи, підвищення артеріального тиску (АТ), що коригувалося застосуванням урикозуричної терапії. Ці спостереження підтверджено в іншому дослідженні. У хворих на артеріальну гіпертензію молодого віку застосування урикозуричної терапії призвело до нормалізації АТ. В інших роботах показано несприятливий вплив гіперурикемії на ендотеліальну функцію. Незважаючи на низький рівень запалення, за відсутності гострого подагричного нападу у хворих на хронічну подагру відзначають пришвидшення розвитку атеросклерозу. Малоймовірно, що цей вплив генетично детермінований і відображає взаємозв’язок між гіперурикемією та серцево-судинною патологією, оскільки асоційовані з подагрою гени, такі як SLC2A9, ABCG2 тощо, не асоціювалися із захворюваннями коронарних артерій [20–22].
У дослідженні ARIC серед популяції з 15 792 осіб проводили аналіз кумулятивної частоти розвитку подагри протягом 9 років залежно від наявності генетичної детермінації (SLC22A11, SLC2A9) і використання сечогінних препаратів. Серед обстежених 3524 мали артеріальну гіпертензію, 33% приймали діуретики і у 3,1% розвинулася подагра. Доведено, що пацієнти, генетично схильні до гіперурикемії, мають вищу чутливість до формування подагри у разі лікування тіазидними та петльовими діуретиками, проте цей ефект не реалізовувався в осіб без генетичної схильності [13].
Результати останніх досліджень підтвердили взаємозв’язок між подагрою та гіперурикемією з ризиком розвитку серцево-судинних подій, однак існують дані, що ініціація терапії інгібіторами ксантиноксидази не асоціюється з підвищенням або зниженням кардіоваскулярного ризику порівняно з тими хворими, які її не отримували [11].
Зовнішні фактори, асоційовані з розвитком подагри
Дослідження останніх десятиліть щодо впливу дієтичних факторів відкрили нові погляди на вплив факторів зовнішнього середовища на подагру [19]. Дослідження з концентрації CК та впливу на неї харчування підтвердило, що надмірна маса тіла, ожиріння, вживання пива, спирту, м’яса та морепродуктів, фруктози і цукровмісних напоїв впливає на розвиток подагри (табл. 3). З іншого боку, підтверджені протекторні властивості деяких продуктів (кави, продуктів із низьким вмістом жирів, вітаміну С) та зменшення надмірної маси тіла. Інші дієтичні продукти, такі як чай, вино, дієтичні напої, продукти з високим вмістом жиру та збагачені пуринами овочі, виявилися нейтральними щодо розвитку подагри [4, 5].
Є відомості щодо гіпоурикемічних властивостей вишень та соку з них. Згідно з результатами дослідження, що тривало рік, у пацієнтів із підтвердженою подагрою, які вживали по півсклянки вишневого соку або 10–12 вишень, або вишневий екстракт протягом 2 діб, відзначали менш виражену атаку подагри (у 35% випадків). У пацієнтів, які вживають вишні систематично разом із застосуванням алопуринолу, відзначають на 75% нижчий ризик розвитку гострої подагричної атаки [26].
гіперурикемії та подагри
| Дієтичний фактор | Ризик розвитку подагри | Асоціація з гіперурикемією |
| Пиво Спирт М’ясо Морепродукти Солодкі газовані фруктозовмісні напої Фрукти з високим вмістом фруктози Фруктовий сік |
Зростає Зростає Зростає Зростає Зростає Зростає Зростає |
Позитивна Позитивна Позитивна Позитивна Позитивна Відсутні дані Позитивна |
| Вино (натуральне) Овочі, багаті на пурини Молочні продукти високої жирності Чай (чорний) |
Не впливає Не впливає Не впливає Не впливає |
Негативна Відсутні дані Відсутня Відсутня |
| Молочні продукти низької жирності Кава (регулярний прийом) Кава без кофеїну Вітамін С Вишні, вишневий сік, вишневий екстракт Екстракт зеленого чаю |
Знижує Знижує Знижує Знижує Знижує Знижує |
Негативна Негативна Негативна Негативна Негативна Негативна |
Механізми запалення та роль інфламасоми при гострій подагрі. Багато питань виникає щодо того, як кристали моноурату натрію запускають механізм запалення і як цей процес регулювати. Є багато доказів, що різні клітини беруть участь у гострій запальній реакції з кристалами моноурату натрію, найбільш вивченою є інформація щодо ролі в цьому моноцитів/макрофагів, нейтрофілів та гладких клітин [16, 25]. Контакт між цими клітинами та кристалами моноурату натрію призводить до вивільнення прозапальних медіаторів, таких як оксид азоту, простагландини, прозапальні цитокіни, такі як IL-1β, туморнекротичний фактор (TNF-α). Цей процес відбувається швидко (1–2 дні). Згодом настає фаза спонтанного завершення. Зазначені механізми вивчені лише частково і включають вироблення протизапальних цитокінів, що трансформуються у фактор β. Результати нещодавніх праць розширили наше розуміння щодо ролі продукції IL-1β інфламасомами в реалізації ключового механізму ініціації процесу запалення [2].
Термін «інфламасоми» введено у 2002 р. для опису процесу внутрішньоклітинного протеолітичного комплексу перетворення про-IL-1β в активний IL-1β. Цей комплекс має різні форми, однак типові інфламасоми складаються з каспази-1, білка апоптозу та білка нуклеотидзв’язаного олігомерного домену, збагаченого лейцином, та пуринового домену. Ці субстрати, на відміну від IL-1β, включають IL-18 та, можливо, IL-33, цитокіни, які відносяться до сім’ї IL-1. Збагачений лейцином та пуринами домен як компонент є високочутливим. Екзо- та/або ендогенний сигнал про небезпеку генерується під час інфекції, запускаючи процес активації каспаз. Ідентифіковані три інфламасоми: NLRP1, NLPR3 та інтерлейкінконвертуючі ензими протеаз. У контексті подагри та кристал-індукованого запалення NLPR3 мають найбільше значення [1, 14] (рисунок).
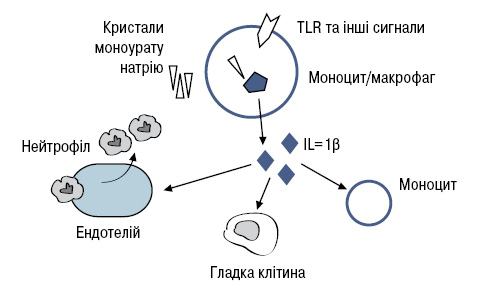
Медичний інтерес до інфламасом спричинений ідентифікацією мутації в гені як молекулярної основи спадкової умови аутозапалення, що на сьогодні відомий як кріопіринасоційований періодичний синдром. Результатом мутації є дизрегуляція продукції IL-1β, що є основою активності NLPR3 і впливає на такі клінічні прояви, як лихоманка, артрит, висипання, ураження центральної та периферичної нервової системи. Зазначені відомості підтверджено результатами досліджень, у яких лікування інгібіторами IL-1 виявилося ефективним щодо контролю за симптомами захворювання. Слід зазначити, що кристали моноурату натрію та фосфатні кристали активують макрофагами синтез IL-1β інфламасомою NLPR3. За відсутності компонентів цього комплексу секреція IL-1β блокується, що також регулює запалення при подагрі. У низці досліджень при різних видах патології доведено, що інфламасоми відіграють важливу роль у патогенезі захворювань із запальним компонентом [20, 25].
Відкриття інфламасом ставить перед нами такі запитання: як інфламасоми регулюються та чи має це клінічні прояви та наслідки? Внутрішньоклітинні медіатори включені до контролю за інфламасомами, але молекулярні шляхи, які їх взаємопов’язують, повністю ще не вивчені. Вивільнення калію з клітин, що призводить до змін концентрації внутрішньоклітинного кальцію, може зумовлювати активацію NLRP3-інфламасом. Одна гіпотеза передбачає, що реактивація кисню призводить до контактування клітин із небезпечними сигналами, які можуть бути проміжною сходинкою, оскільки інгібітори реактивації кисню знижують активність каспази-1 та вивільнення IL-1β. Інші дослідження свідчать про те, що тиреодоксин (білок, що сприяє відновленню рибонуклеотидів у дезоксирибонуклеотиди) теж може відігравати в цьому свою роль. Баланс між багатьма шляхами у механізмі регуляції пояснює епізодичність нападів подагри у пацієнтів, які мають її інтервальну форму (навіть за наявності кристалів моноурату натрію в суглобах), симптоми в міжнападні періоди можуть бути мінімальними [16, 17].
Незважаючи на велику кількість медіаторів запалення, що вивільняються клітинами при їх контакті з кристалами моноурату натрію, цікавить питання: чи є між ними ієрархія? З’явилися докази, що IL-1β знаходиться десь на вершині цього ієрархічного ряду, на відміну від інших медіаторів запалення, які виділяються вторинно. На підтримку цієї гіпотези свідчить праця, в якій кристали моноуратів натрію вводили мишам із дефіцитом IL-1R1, і не було нейтрофільної інфільтрації. У незначній кількості досліджень виявлено, що інгібіція TNF-α ефективна при терапії хронічної подагри. Не було жодних досліджень із приводу IL-6 та інгібіторів хемокінів in vivo. Ми передбачаємо, що ініціальним тригером між кристалами моноурату натрію та клітинами є комплекс моноцит/макрофаг, що призводить до секреції IL-1 (в основному β, не виключається і роль α), які втягують у запальний процес й інші клітини, що розширює локальну відповідь тканин. У результаті відбувається швидкий викид медіаторів запалення, що має клінічну маніфестацію. У фазу завершення запального процесу макрофаги вивільнюють β-трансформуючий фактор росту. Необхідні подальші дослідження для вивчення цих механізмів.
Особливості терапії при подагрі
Лікування хворих на подагру має бути комплексним, включаючи нефармакологічні та фармакологічні методи. Лікарю слід враховувати рівень СК (із подальшим моніторуванням його), форму і стадію подагри, рентгенологічну стадію та ступінь функціональної недостатності суглобів, вік пацієнта, супутню патологію та особливості її фармакотерапії. Ключовим аспектом у лікуванні є «жорстке» дотримання дієти, зменшення маси тіла при ожирінні.
КОНСЕНСУС ЕКСПЕРТІВ ЩОДО ЛІКУВАННЯ ПОДАГРИ, ПОСТІЙНИЙ КОМІТЕТ З МІЖНАРОДНИХ КЛІНІЧНИХ ДОСЛІДЖЕНЬ (ESCISIT, EULAR, 2013)
1. Ідентифікація кристалів має бути виконана для встановлення діагнозу подагри; якщо це неможливо, діагноз подагри може бути підтверджений наявністю класичних клінічних ознак (гострий артрит І плеснофалангового суглоба, тофуси, швидка відповідь на колхіцин) і/або виявленням характерних ознак при виконанні комп’ютерної томографії (рівень доказовості IIb).
2. У пацієнтів із подагрою та/чи гіперурикемією необхідно визначити ниркову функцію і рекомендувати оцінку факторів кардіоваскулярного ризику (рівень доказовості IIс).
3. Поєднання немедикаментозних та фармакологічних засобів має бути адаптоване відповідно до:
- специфічних чинників ризику — рівня СК у крові, характеру попередніх нападів;
- клінічного періоду — гострий напад, інтермітуюча, хронічна тофусна подагра (Іb);
- загальних чинників ризику — віку, статі, ожиріння, вживання алкоголю, ліків (які підвищують рівень СК), взаємодії лікарських препаратів.
4. Пацієнтам слід рекомендувати здоровий спосіб життя, включаючи зменшення маси тіла, регулярне виконання фізичних вправ, відмову від тютюнопаління, відмову від зайвого прийому алкоголю і підсолоджених цукром напоїв (рівень доказовості IV).
5. Корекція супутніх захворювань (артеріальна гіпертензія, цукровий діабет) і чинників ризику (гіперліпідемія) (рівень доказовості Іb).
6. Мета лікування — рівень СК у сироватці крові <0,36 ммоль/л (<6 мг/дл), відсутність атак подагричного артриту і розсмоктування тофусів; моніторинг має включати контроль рівня СК у сироватці крові, частоти нападів артриту і розмірів тофусів (рівень доказовості IIb).
7. При гострому нападі подагри необхідно призначати колхіцин у низькій дозі (<2 мг/добу), нестероїдні протизапальні препарати (НПЗП) і/або глюкокортикоїди (ГК) (внутрішньосуглобово, перорально чи внутрішньом’язово залежно від супутніх захворювань і ризику несприятливих реакцій) (рівень доказовості Ib).
8.Гіпоурикемічна терапія показана пацієнтам із рецидивом гострих атак, артропатією, тофусами чи рентгенографічними ознаками подагри (IV).
9. Алопуринол має бути препаратом першої лінії уратзнижувальної терапії; як альтернатива можуть бути застосовані урикозурики (бензбромарон, пробенецид) або фебуксостат. Пробенецид і сульфіпіразон можуть бути застосовані у пацієнтів із непорушеною функцією нирок (ІІа), але вони протипоказані у разі сечокам’яної хвороби (ІІb). Бензбрамарон можна призначати окремим хворим із помірно вираженою нирковою недостатністю, але при його застосуванні існує невисокий ризик прояву гепатотоксичності (рівень доказовості Іb).
10. Уриказу у монотерапії необхідно розглядати лише у хворих із тяжкою подагрою, в яких усі інші форми терапії неефективні чи протипоказані (рівень доказовості IIb).
11. У пацієнтів із легкою та помірною нирковою недостатністю алопуринол може бути застосований при моніторингу несприятливих реакцій, з призначенням низької початкової дози (50–100 мг) і титруванням кожні 2 тиж до досягнення цільового рівня СК у сироватці крові. Фебуксостат і бензбромарон — альтернативні препарати, які можуть бути застосовані без регулювання дози (рівень доказовості IV).
12. Для зникнення тофусів слід забезпечити стійкий рівень СК у сироватці крові (<0,30 ммоль/л); оперативне лікування необхідне лише в деяких випадках (компресія нервів або інших м’яких тканин, розвиток інфекційних ускладнень (рівень доказовості — IIb).
13. У разі призначення уратзнижувальної терапії пацієнт має бути проінструктований про можливий ризик загострення артриту. Профілактику слід проводити за допомогою колхіцину (<1,2 мг/д), а за наявності протипоказань або при поганій переносимості можуть бути застосовані НПЗП або ГК у низьких дозах з одночасним призначенням за необхідності гастропротекторних препаратів. Тривалість профілактики залежить від індивідуальних особливостей пацієнта (рівень доказовості V).
14. У хворих на подагру, які приймають сечогінні препарати, доцільно їх відмінити (рівень доказовості IV). Для корекції артеріальної гіпертензії та гіперліпідемії слід розглянути питання про застосування лозартану (рівень доказовості ІІb) і фенофібрату (рівень доказовості Іb) відповідно, які зумовлюють незначно виражену урикозуричну дію.
15. Фармакологічне лікування при безсимптомній гіперурикемії для профілактики подагри, захворювань нирок або кардіоваскулярних подій не рекомендоване (рівень доказовості IIb).
За даними EULAR, цільовий рівень СК у крові (<6 мг/л — у хворих без тофусів та <5 мг/л — у хворих із тофусами) досягається лише у 35–45% пацієнтів, які приймають алопуринол у стандартних дозах [10, 17].
Лікування при подагрі має такі основні напрямки: купірування гострої подагричної атаки, профілактика гострих подагричних атак (ініціація уратзнижувальної терапії) та тривала уратзнижувальна терапія як лікування хронічної подагри.
Понад 40 років основним препаратом у лікуванні пацієнтів із подагрою залишається алопуринол — інгібітор ксантиноксидази [7]. Найраціональнішим лікування алопуринолом є за наявності таких патологічних станів:
- у разі вираженої гіперурикемії (рівень СК >600 мкмоль/л);
- за наявності тофусів;
- при супутній хронічній нирковій недостатності;
- при вторинній подагрі;
- у разі гострої сечокислої нефропатії, що є ускладненням фармако- чи радіотерапії пухлин;
- у хворих із уратним нефролітіазом.
Слід враховувати, що ініціація уратзнижувальної терапії призводить до перерозподілу моноурату натрію, яке може підвищувати ризик загострення подагри. Повільне титрування уратзнижувальної терапії зменшує ризик загострення подагри. У дебюті терапії рекомендується приймати хворим колхіцин по 500 мг 1 або 2 рази на добу або застосовувати НПЗП у низьких дозах (наприклад напроксен по 250 мг 2 рази на добу) до 6 міс. За наявності протипоказань або їх неефективності можна призначити ГК (преднізолон) у низьких дозах, НПЗП [12].
У разі недосягнення цільового рівня СК у пацієнта з подагрою на фоні лікування алопуринолом, як альтернатива може бути застосовано фебуксостат (селективний інгібітор ксантиноксидази) у дозі від 80 до 240 мг/добу. Позитивною особливістю фебуксостату є те, що його можна призначати пацієнту з м’яким та помірним зниженням функції нирок. Доведено, що фебуксостат зумовлює дозозалежний ефект: у дозі 80 мг/добу знижує рівень СК ефективніше, ніж у дозі 40 мг/добу. Окрім того, препарат виявився ефективнішим, ніж алопуринол, у стандартних дозах (300 мг/добу) [2, 10]. За профілем безпеки алопуринол і фебуксостат подібні, але в деяких випадках відзначали порушення функції печінки при лікуванні останнім.
Іншим досягненням є відкриття рекомбінантної урикази — ензиму, що руйнує СК до алантоїну. Цей ензим відсутній в організмі людини та приматів, знижує рівень СК у крові швидко після внутрішньовенного введення. Однак у цього ензиму короткий період напівжиття, що потребує повторних введень для підтримки тривалого ефекту. Враховуючи, що це чужорідний білок, його застосування може провокувати алергічні реакції, особливо при повторних уведеннях. Враховуючи такі ефекти, була відкрита інша форма урикази — пеглотиказа з довшим періодом напівжиття (10–12 діб, на відміну від 10 год). Вона значно ефективніша у зниженні СК і в дослідженнях показала значне зменшення розмірів тофусів, застосовується внутрішньовенно, однак має несприятливий профіль безпеки, що потребує особливих умов використання: в стаціонарі з досвідченим персоналом [22]. За умови тяжкої форми подагри, нефективності або протипоказань до першої лінії урикозуричних препаратів можливе застосування пеглотикази (8 мг внутрішньовенно кожні 2–4 тиж), проте її не слід комбінувати з іншими препаратами цієї групи.
Пробенецид — урикозуричний препарат — альтернатива інгібіторам ксантиноксидази, застосовується при збереженій функції нирок. Його можна поєднувати в терапії з алопуринолом та фебуксостатом. Початкова доза 500 мг/добу і максимальна — 3 г/добу.
У разі недосягнення цільового рівня СК при прийомі алопуринолу або фебуксостату додають лезинурад (препарат, який виявляє подвійний механізм дії — урикозуричний і урикодепресивний) у дозі 200–400 мг 1 раз на добу. Лезинурад є селективним інгібітором реабсорбції СК. Препарат блокує URAT1 — транспортер органічних аніонів, тим самим сприяючи виведенню СК з організму. В одному з досліджень показано, що в разі монотерапії фебуксостатом в дозі 40 і 80 мг/добу в 67 та 56% хворих досягнуто зниження рівня СК <6 мг/дл. При поєднаній терапії фебуксостатом 40 і 80 мг/добу із лезинурадом 400 і 600 мг/добу — зниження рівня СК <5 мг/дл реєстрували в усіх хворих при хорошій переносимості [9, 16]. Метою таких клінічних досліджень (CLEAR1 і CLEAR2) була оцінка ефективності й безпеки застосування лезинураду (200 або 400 мг 1 раз на добу) разом з алопуринолом при лікуванні пацієнтів, які не відповідають на терапію тільки алопуринолом. Так, через 6 міс терапії частка хворих із рівнем урикемії <6,0 мг/дл була значно більшою у групі, яка отримувала комбіноване лікування (незалежно від денної дози лезинураду), ніж серед тих, хто приймав лише алопуринол. Найчастішими побічними ефектами лезинураду були ринофарингіт і артралгія.
Відкриття інфламасом дало поштовх до вивчення препаратів, які інгібують IL-1 при гострій подагрі. Доведена ефективність таких інгібіторів IL: анакінра (антагоніст рецепторів IL-1, що інгібує активність як IL‑1α, так і IL‑1β), канакінумаб (анти IL‑1β моноклональне антитіло), кінерет (IL-Ra), ринолацепт (IL-1 Trap). Канакінумаб високоспецифічний до IL-1β, блокує рецептори до IL-1, застосовується у тому разі, якщо НПЗП або колхіцин протипоказані, а також при толерантності до них. Результати досліджень свідчать, що анакінра — ефективна при купіруванні гострих атак подагри, в той час як ринолацепт приводив до зменшення вираженості болю та запалення у хворих на хронічну подагру. Канакінумаб виявився ефективним як при гострому, так і при хронічному подагричному артриті, знижуючи ризик рецидиву в міжнападний період [23]. Результатом дослідження щодо ефективності канакінумабу та тріамцинолону при лікуванні гострої подагри був кращий ефект канакінумабу. Канакінумаб застосовують у дозі >50 мг/добу протягом 16 тиж для запобігання атакам подагричного артриту [24].
Слід враховувати критерії ефективності базисної терапії: 1) досягнення цільового рівня СК або зниження урикемії до субнормальних цифр за 6 міс лікування; 2) зникнення (чи ослаблення) атак гострого артриту; 3) зменшення вдвічі тривалості гострого періоду хвороби (сумарно протягом 1 року); 4) зникнення, розм’якшення тофусів, відсутність появи нових; 5) покращення екскреторної функції нирок, відсутність прогресування нефролітіазу; 6) зникнення чи зменшення вираженості явищ сечового синдрому (у разі його попереднього існування).
Враховуючи молекулярні, генетичні аспекти патогенезу подагри та гіперурикемії, майбутні дослідження мають сфокусуватися на пошук нових уратзнижувальних агентів, для яких мішенню буде SLC2A9. Алгоритмізована терапія хворих на подагру базуватиметься на аналізі, з одного боку, характеру супутньої патології, з іншого, генетичних маркерів транспорту уратів і особливостей геному, який визначатиме прогноз і ефективність лікування подагри. Важливим є подальша ідентифікація генів, що детермінують схильність до розвитку подагри, особливо у пацієнтів із гіперурикемією і при застосуванні різних груп фармакологічних препаратів з метою її запобігання.
Список використаної літератури
- 1. Agostini L., Martinon F., Burns K. et al. (2004) NALP3 forms an IL-1beta-processing inflammasome with increased activity in Muckle-Wells autoinflammatory disorder. Immunity, 20(3): 319–325.
- 2. Becker M.A., Schumacher H.R., Wortmann H.I. et al. (2005) Febuxostat compared with allopurinol in patients with hyperuricemia and gout. N. Engl. Med., 353: 2450–2461.
- 3. Caulfied M.J., Munroe P.B., O’Neill D. et al. (2008) SLC2A9 is a high capacity urate transporter in humans. PLoS Med., 5: e197.
- 4. Choi H.K., Atkinson K., Karlson E.W. et al. (2005) Obesity, weight change, hypertension, diuretic use, and risk of gout in men: the health professionals follow up study. Arch. Intern. Med., 165: 742–748.
- 5. Choi H.K., Atkinson K., Karlson E.W. et al. (2004) Alcohol intake and risk of incident gout in men: a prospective study. Lancet., 363: 1277–1281.
- 6. Choi H.K., Сurhan G. (2007) Independent impact of gout on mortality and risk for coronary heart disease. Circulation, 116: 894–900.
- 7. Dalbeth N., Kumar S., Stamp L. et al. (2006) Dose adjustment of allopurinol according to creatinine clearance does not provide adequate control of hyperuricemia in patients with gout. J. Rheumatol., 33(1): 646–650.
- 8. Dalbeth N., Merriman T. (2009) Crystal ball gazing: new therapeutic targets for hyperuricaemia and gout. Rheumatology, 48(3): 222–226.
- 9. Fleischmann R., Kerr B., Yeh L.T. et al. RDEA594–111 Study Group (2014) Pharmacodynamic, pharmacokinetic and tolerability evaluation of concomitant administration of lesinurad and febuxostat in gout patients with hyperuricaemia. Rheumatology (Oxford)., 53(12): 2167–2174.
- 10. Huang X., Du H., Gu J. et al. (2014) An allopurinol-controlled, multicenter, randomized, double-blind, parallel between-group, comparative study of febuxostat in Chinese patients with gout and hyperuricemia. Int. J. Rheum. Dis., 17(6): 679–686.
- 11. Kim S.C., Schneeweiss S., Choudhry N. et al. (2015) Effects of xanthine oxidase inhibitors on cardiovascular disease in patients with gout: a cohort study. Am. J. Med., 128(6): 653–655.
- 12. Latourte A., Bardin T., Richette P. (2014) Prophylaxis for acute gout flares after initiation of urate-lowering therapy. Rheumatology (Oxford), 53(11): 1920–1927.
- 13. McAdams-De Marco M.A., Maynard J.W., Baer A.N. et al. (2013) A urate gene-by-diuretic interaction and gout risk in participants with hypertension i results from ARIC study. Ann. Rheum. Dis., 72(5): 701–706.
- 14. Martinon F., Mayor A., Tschopp J. (2009) The Inflammasomes: Guardians of the Body ANRV371-IY27–09 ARI, Hyperuricemia and gout: state of the art and future perspectives. Ann. Rheum. Dis., 69: 1738–1743.
- 15. Neogi T., Jansen T., Dalbeth N. et al. (2015) Gout Classification Criteria. An American College of Rheumatology/European League Against Rheumatism Collaborative Initiative Arthritis & Rheumatology, 67(10): 2557–2568.
- 16. Oda M., Satta Y., Takenaka O. (2002) Loss of urate oxidase activity in hominoids and its evolutionary implications. Mol. Biol. Evol., 19(5): 640–653.
- 17. Reinders M.K., Haagsma C., Jansen T.L. et al. (2009) A randomised controlled trial on the efficacy and tolerability with dose escalation of allopurinol 300–600 mg/day versus benzbromarone 100–200 mg/day in patients with gout. Ann. Rheum. Dis., 68: 892–897.
- 18. Sivera F., Andres M., Carmone L. et al. (2014) Multinational evidence-based recommendations for the diagnosis and management of gout: integrating systematic literature review and expert opinion of a broad panel of rheumatologists in the 3-e initiative. Ann. Rheum. Dis., 73(2): 328–335.
- 19. So A., Thorens B. (2010) Uric acid transport and disease. J. Clinical Investigation., 120(6): 1791–1799.
- 20. Stark K., Reinhard W., Neureuther K. et al. (2008) Association of common polymorphisms in GLUT9 gene with gout but not with coronary artery disease in a large case-control study. PLoS ONE, 3: e1948.
- 21. Stark K., Reinhard W., Grassl M. et al. (2009) Common polymorphisms influencing serum uric acid levels contribute to susceptibility to gout, but not to coronary artery disease. PLoS ONE, 4: e7729.
- 22. Sundy J.S., Becker M.A., Baraf H.S. et al. (2008) Reduction of plasma urate levels follow-up, treatment with multiple doses of pegloticase in patients with treatment failure gout: results of a phase II randomized study. Arthritis Rheum., 58: 2882—2891.
- 23. Terkeltaub R., Sundy J.S., Schumacher H.R. et al. (2009) The interleukin 1 inhibitor rilonacept in treatment of chronic gout arthritis: results of placebo-controlled, monosequence crossover, non — randomised, single-blind pilot study. Ann. Rheum. Dis., 68: 1613–1617.
- 24. van der Harst P., Bakker S.J., de Boer R.A. et al. (2010) Replication of the five novel loci for uric acid concentrations and potential mediating mechanisms. Hum. Mol. Geres., 19: 387–395.
- 25. Martin W.J., Walton M., Harper J. (2009) Resident macrophages initiating and driving inflammation in a monosodium urate monohydrate crystal-induced murine peritoneal model of acute gout. Arthritis Rheum., 60(1): 281–289.
- 26. Zhang Y., Tuhina Neogi T., Chen C. et al. (2012) Cherry Consumption and the Risk of Recurrent Gout Attacks. Arthritis Rheum., 64(12): 4004–4011.
Гиперурикемия и подагра: современное состояние проблемы
Резюме. В статье приведены данные о патогенезе гиперурикемии и подагры, новые классификационные критерии подагры Американской коллегии ревматологов/Европейской антиревматической лиги, генетические аспекты подагры, диетические рекомендации и данные по урикозурической терапии.
подагра, гиперурикемия, генетические аспекты, урикозурическая терапия.
Адреса для листування:
Кондратюк Віталій Євгенович
01601, Київ, бульв. Тараса Шевченка, 13
Національний медичний університет
імені О.О. Богомольця,
кафедра внутрішньої медицини № 2
E-mail: kondratyuk-vital@mail.ru

Leave a comment