ВИПАДОК ДІАГНОСТИКИ ДІУРЕТИК-ІНДУКОВАНОЇ ТОФУСНОЇ ПОДАГРИ У ЖІНКИ У ПРЕМЕНОПАУЗАЛЬНИЙ ПЕРІОД
Головач І.Ю., Чіпко Т.М., Лазоренко О.О. , Власенко А.М. , Матійко В.М.
Резюме. У статті наведено опис випадку діагностики вторинної подагри, що розвинулася у пацієнтки у пременопаузальний період у зв’язку із хронічним зловживанням діуретиками. Пацієнтка приймала щоденно фуросемід у дозі 40–80 мг/добу протягом останніх 6 років з метою зменшення маси тіла. Унаслідок такого нераціонального прийому діуретиків розвинулася стійка гіперурикемія, пов’язана з посиленням канальцевої реабсорбції та зниженням секреції уратів, а в подальшому —дебютувала тофусна подагра з вираженим суглобовим синдромом. Тофусний артрит розвинувся через 2 роки від початку прийому діуретиків, швидко прогресував і призвів до розвитку тяжкого суглобового синдрому. У статті проаналізовано механізми розвитку вторинної подагри при зловживанні діуретиками чи їх нераціональному застосуванні.
Подагра — це системне тофусне захворювання, що характеризується відкладанням у різних тканинах кристалів моноурату натрію та розвитку у зв’язку з цим мікрокристалічного запалення у осіб з гіперурикемією, зумовленою генетичними та/чи зовнішніми факторами [1]. Гіперурикемія належить до біохімічних ознак і слугує необхідною умовою розвитку подагри. Концентрація сечової кислоти в рідинних середовищах організму визначається співвідношенням швидкостей її продукції та елімінації. Вона утворюється при окисненні пуринових основ, що мають екзогенне чи/і ендогенне походження. Приблизно ⅔ сечової кислоти виводиться із сечею (300–600 мг/добу), а біля ⅓ — через травний тракт, де зрештою руйнується бактеріями [10]. Стійка гіперурикемія може бути зумовлена підвищеною швидкістю продукції сечової кислоти, зниженою екскрецію із сечею та поєднанням цих причин [2]. Гіперурикемію, а відтак і подагру, можна поділити на метаболічну і ниркову. При метаболічній подагрі підвищена продукція сечової кислоти, а при гіперурикемії ниркового походження — знижена її екскреція нирками. Втім, чітко розмежувати метаболічний і нирковий тип гіперурикемії не завжди можливо. Вторинною гіперурикемією чи вторинною подагрою називають випадки, коли вони розвиваються як симптоми іншого захворювання або внаслідок прийому деяких фармакологічних засобів.
Необхідно зазначити, що численні лікарські препарати здатні викликати гіперурикемію, а відтак і подагру, через різні патогенетичні механізми. У табл. 1 міститься перелік лікарських препаратів, що викликають гіперурикемію та потребують або відміни, або обережного застосування у пацієнтів із метаболічним синдромом і підвищеним рівнем сечової кислоти у крові. Проте найбільш вивчений механізм розвитку вторинної подагри і гіперурикемії — у діуретиків [5, 13].
У нашій клінічній практиці мав місце випадок діагностики вторинної подагри у жінки віком 50 років (при дебюті подагри у 46 років) у пременопаузальний період, яка розвинулася на ґрунті нераціонального і тривалого прийому діуретиків.
Таблиця 1
Перелік речовин, в тому числі лікарських препаратів, що викликають вторинну гіперурикемію
|
АлкогольХлорталідон
Триамтерен Фуросемід Тіазидні діуретики Етамбутол |
ЛеводопаРибоксин
Етакридинова кислота Нікотинова кислота (>3 мг/добу) Саліцилати (<100 мг/добу) Піразинамід |
До стаціонару була госпіталізована жінка М., 50 років, зі скаргами на виражений біль у суглобах верхніх і нижніх кінцівок, скутість, особливо в суглобах кистей, значне припухання суглобів кистей і стоп, їх деформацію за рахунок тофусів, частина з яких запалюється і періодично розкривається. Пацієнтка також скаржиться на виражену слабкість, субфебрильну температуру тіла, зниження працездатності.
З анамнезу відомо, що вперше біль у дрібних суглобах рук почала турбувати 3–4 роки назад, а особливо швидкий розвиток хвороби спостерігається впродовж останніх 2 років із формуванням численних тофусів у ділянках суглобів кистей, стоп, ліктьових суглобів, їх періодичне запалення, самостійне розкриття з виділенням сметанкоподібної рідини. Епізоди запалення суглобів мають рецидивний характер, за останні 2 роки артрит набув рис хронічного, без «світлих» проміжків ремісій. Неодноразово лікувалася стаціонарно в ревматологічних відділеннях без особливого ефекту, суглобовий синдром неухильно прогресував, з’являлися нові вогнища відкладення сечової кислоти. При попередніх обстеженнях у пацієнтки реєструвалися різко підвищені концентрації сечової кислоти у сироватці крові (600–700 мкмоль/л). Наявність тофусів, артрит і гіперурикемія дозволили встановити діагноз подагри і подагричного артриту. Пацієнтці було призначено алопуринол у дозі 300 мг/добу, який вона приймала вкрай нерегулярно. Больовий синдром хвора усувала застосуванням нестероїдних протизапальних препаратів та народними методами (компреси на суглоби, ванночки з відварами лікарських рослин тощо).
В анамнезі простудні захворювання. Алергологічний анамнез не обтяжений. Менструації припинилися 9 міс тому, клімактеричних проявів не відзначає. Таким чином, подагричний артрит дебютував у пременопаузальний період.
При об’єктивному обстеженні встановлено: пацієнтка адекватного відживлення. Маса тіла — 60 кг, зріст — 1,64 м. Індекс маси тіла =22,3 кг/м2. Шкірні покриви звичайного забарвлення, чисті. Дрібні суглоби і м’які тканини обох кистей різко набряклі, шкіра над пальцями і зап’ястком натягнута до блиску, суглоби гарячі на дотик, почервонілі, будь-які пасивні й активні рухи різко болючі та суттєво обмежені. Рухи у проксимальних міжфалангових суглобах обох кистей відсутні. Обсяг рухів в обох променевозап’ясткових суглобах різко обмежений. Кулак 50% з обох сторін. У ділянці міжфалангових суглобів проксимальних і дистальних виявляються численні тофуси різних розмірів. Над деякими з них шкіра витончена і запалена, крізь шкіру видніються білуваті скупчення. Сліди множинних нориць на кистях і стопах, що на цей час загоїлися, через які в минулому виділявся вміст тофусів. Рухи у дрібних суглобах кистей різко обмежені, болючі. Рухи в дрібних суглобах обох ступень також різко обмежені й болючі. Бурсит обох ліктьових суглобів. Колінні суглоби ззовні не змінені, рухи болючі, обмежене розгинання і згинання. Тофуси у великій кількості розташовані в зоні дрібних суглобів кистей і стоп, у ділянці сумки ліктьового суглоба з обох сторін, скупчення кристалів сечової кислоти просвічується крізь шкіру на ділянках пальців, долонях і стопах (рис. 1– 3). В інших ділянках тофусів не виявлено.
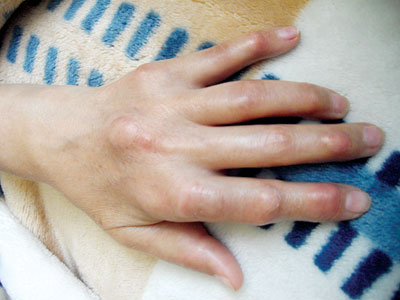
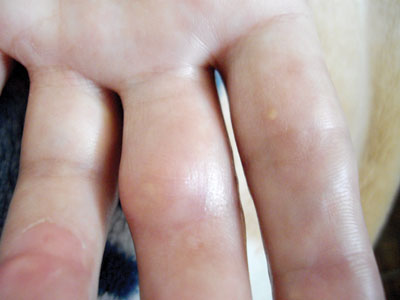
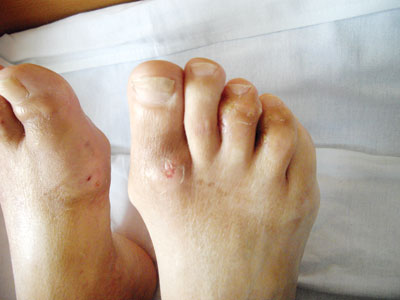
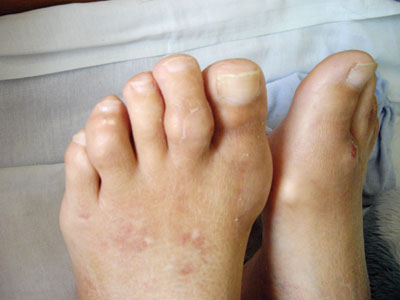
М’язи не болючі, м’язова сила в кінцівках збережена. Щитоподібна залоза не збільшена. У легенях на всьому протязі везикулярне дихання, ЧДР — 17/хв. Межі серця не розширені. Серцеві тони ритмічні, звучність збережена, патологічні шуми і зміни тонів не вислуховуються. ЧСС — 67/хв. АТ — 115/70 мм рт. ст. Живіт при пальпації м’який неболючий. Печінка по краю реберної дуги неболюча. Селезінка не досягається, перкуторно на рівні ІХ–ХІ ребра по передній аксилярній лінії. Відрізки кишечника неболючі, при пальпації без особливостей. Нирки не пальпуються. Симптом поколочування по поперековій ділянці безболісний. Дізуричних явищ не відмічає. Сечовипускання вільне, об’єм добової сечі 2800–3000 мл. Набряків на нижніх кінцівках не відзначає. Пульсація на артеріях стоп збережена.
Лабораторні обстеження виявили синдром гіперурикемії поряд зі зниженням екскреції сечової кислоти нирками, а також запальний синдром.
Загальний аналіз крові від 06.05.2011 р. — еритроцити 3,45·1012/л, гемоглобін 104 г/л, лейкоцити 11,4·109/л, тромбоцити 440·109/л, паличкоядерні 12%, сегментоядерні 70%, еозинофіли 1,5%, базофіли 0,5%, лімфоцити 12%, моноцити 4%, ШОЕ 46 мм/год.
Біохімічний аналіз крові від 06.05.2011 р. — загальний білок 65 г/л, сечовина 6,6 ммоль/л, креатинін 124 мкмоль/л, сечова кислота 447 мкмоль/л, білірубін загальний 17,7 мкмоль/л, лужна фосфатаза 304 од./л, АлАТ 13 од./л, АсАТ 12 од./л, ГГТП 46 од./л, калій 4,7 ммоль/л, натрій 137 ммоль/л, холестерин загальний 4,8 ммоль/л, β-ліпопротеїди 52 од., тригліцериди 0,65 ммоль/л, сироваткове залізо 8,2 мкм, кальцій загальний 2,02 ммоль/л, КФК 16 од./л (норма 20–179 од./л), ревматоїдний фактор негативний, СРБ >0,6, глюкоза 4,4 ммоль/л.
При визначенні концентрації сечової кислоти в динаміці реєстрували її підвищені рівні — 519 та 460 мкмоль/л.
Загальний аналіз сечі від 06.05.2011 р.: кількість 240 мл, колір жовтий, прозора, питома вага 1010, рН слабкокисла, білок — 0,05 г/л, глюкоза не виявлена, лейкоцити 1–3 в полі зору, епітелій плаский поодинокий в полі зору.
Екскреція сечової кислоти із сечею від 11.05.2011р. — 1,02 ммоль/л (різко знижена).
Швидкість клубочкової фільтрації: CKD-EPI: 43 мл/хв/1,73м2; MDRD: 42 мл/хв/1,73м2; за Кокрофт-Голт: 44 мл/хв.
Ультразвукове дослідження органів черевної порожнини від 10.05.2011 р. — печінка розмірами: передньозадній розмір правої долі 140 мм; косий вертикальний розмір 165 мм. Паренхіма підвищеної ехогенності. Вогнищевих змін не виявлено. Внутрішньопечінкові жовчні протоки не розширені. Ворітна вена 10 мм. Печінкові вени 7 мм. Жовчний міхур розмірами 80х22 мм. Стінки 2 мм. Позапечінкові жовчеві протоки: загальна печінкова протока 5 мм (на рівні воріт печінки). Підшлункова залоза товщиною в проекції голівки 21 мм, тіла 14 мм, хвоста 16 мм, паренхіма підвищеної ехогенності. Контур хвилястий. Панкреатична протока не розширена. Селезінка розмірами 137х55 мм. Паренхіма середньої ехогенності. Селезінкова вена 6 мм. Нирки типово розташовані. Розміри: права нирка 95х48 мм; ліва нирка 102х50 мм. Паренхіма товщиною у правій нирці 13 мм, у лівій 13 мм, слабкодиференційована, значно деформована за рахунок рубцевих тяжів, петрифікатів. Чашково-мискові сегменти обох нирок не розширені. Конкрементів не виявлено. При допплєрографії архітектура судин нирок збережена в обох нирках, при знятті спектра з aa. segmentаles правої нирки ІР становить 0,72, лівої — 0,74. Швидкісні показники знижені. Магістральні судини черевної порожнини: нижня порожниста вена 19 мм. Лімфатичні утвори заочеревинного простору не візуалізуються. Вільної рідини в черевній порожнині не виявлено.
Висновок: ознаки подагричної нефропатії, вторинно зморщеної правої нирки.
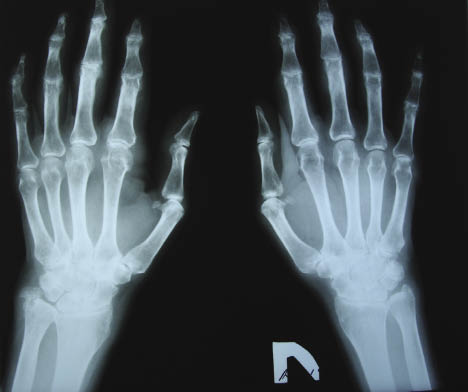
Рентгенографія кистей (рис. 4) виявила ознаки деструктивного артриту суглобів кісток, множинні узури, множинні симптоми «пробійника». Відзначається різке звуження суглобової щілини впритул до її відсутності в усіх п’ястковофалангових, проксимальних і дистальних міжфалангових суглобах. Крайові узури в ділянці ІІ проксимального міжфалангового суглоба лівої кисті, IV проксимального міжфалангового суглоба лівої кисті та інших,численні симптоми «пробійника», найбільш виражені в головці проксимальної метакарпальної кістки IV пальця справа, головці ІІ п’ясткової кістки пальця справа. Остеопороз кісток зап’ястка, головок п’ясткових і метакарпальних кісток. Анкілоз променевозап’ясткових суглобів і суглобів зап’ястка.
Динамічна сцинтиграфія нирок від 17.05.2011 р. (99m-Tc-технемаг-70МБк), променеве навантаження на нирки 1,90 мЗв — за даними комп’ютерного аналізу ниркових гістограм, секреторна ємність лівої нирки в 5 разів зменшена порівняно з правою. Швидкість секреторно-екскреторних процесів порушена з обох сторін, особливо зліва: гістограма лівої нирки наближається до «афункціонального» типу. Справа: Тmax = 5,4’; до 20’ виведено 42% РФП. Характер екскреції справа нерівномірний, відзначені сечоводно-мискові рефлекси. ЕНП лівої нирки 74,1 мл/хв, ЕНП правої нирки — 324,1 мл/хв.
На сцинтиграмі: нирки розташовані в типовому місці, права — звичайної форми і розмірів (6,4х11,5 см), контури нирки нерівні, накопичення РФП інтенсивне, нерівномірне, розширений сечовід у верхній третині. Ліва нирка зменшена (4,4х8,0 см), деформована, контури її нерівні, нечіткі, накопичення РФП низьке.
Висновок. Сповільнення функції правої нирки. Значне порушення функції лівої нирки, вірогідно, вторинно зморщена нирка.
Зважаючи на швидке прогресування артриту, численні тофуси, високу активність, а також дебют подагри у жінки у пременопаузальний період, що є нетиповим для класичної подагри, було здійснено ретельний аналіз історії хвороби та збір анамнезу. Серед лабораторних показників відзначено факт гіперурикемії на тлі гіпоурикурії, що вказувало на нирковий механізм розвитку подагри.
З’ясовано, що в родині пацієнтки ніхто не хворів на подагру, мати страждала на остеоартроз. Зловживання алкоголем категорично заперечує, контакт із токсичними речовинами, зокрема із свинцем, пацієнтка також заперечує. Проте встановлено факт зловживання сечогінними препаратами. Упродовж останніх 6 років пацієнтка щоденно приймала 1–2–3 таблетки фуросеміду з метою схуднення. Дійсно, в перший рік прийому діуретиків пацієнтка схудла на 5–7 кг. Більше масу тіла не набирала, але з метою підтримання нормальної маси тіла продовжувала прийом діуретиків щоденно по 1–2 таблетці фуросеміду. При цьому будь-яких медичних показань для тривалого щоденного прийому салуретиків у пацієнтки не було. Встановлено хронологічний порядок виникнення симптомів подагричного артриту. Так, появу болю у суглобах з їх припуханням пацієнтка відзначила 2 роки поспіль від початку прийому сечогінних, ще через 1 рік з’явилися численні тофуси в зоні суглобів кистей і стоп, артрит набув рецидивуючого характеру з високою активністю. Таким чином, ретроспективно встановлено факт необґрунтованого зловживання діуретиками, що призвело до гіперурикемії та швидкого розвитку тофусної подагри. На момент огляду пацієнтка продовжувала приймати сечогінні препарати.
Переконання у необхідності припинення прийому діуретиків вимагали численних роз’яснювальних бесід щодо патофізіологічного зв’язку між застосуванням діуретиків і розвитком подагри.
Після всебічного обстеження пацієнтці вставлено діагноз:
Вторинна подагра, діуретик-індукована, тяжкий перебіг. Хронічний тофусний артрит, рецидивуючий перебіг, стадія ІІІ, ФНС ІІ. Бурсит обох ліктьових суглобів. Численні тофуси м’яких тканин та суглобів кистей і ступень. ХХН ІІІ ст. Подагрична нефропатія (інтерстиціальний нефрит, вторинна зморщена права нирка). ХНН І ст.
Пацієнтці було модифіковано лікування вторинної подагри з акцентом на застосування урикозуричних засобів та відміну діуретичної терапії:
- Негайна відміна сечогінних препаратів
- Дотримання протиподагричної дієти (стіл № 6 за Певзнером)
- Адекватний водневий режим — вживання 2 л лужних мінеральних вод щодня
- Алопуринол — 300 мг/добу, зважаючи на гіперурикемію
- Пребенецид — 500 мг 2 рази на добу до нормалізації показників екскреції сечової кислоти із сечею (1 міс)
- Протизапальна терапія: метилпреднізолон 12 мг щодня зранку 15 днів з подальшим зниженням дози до повної відміни
- Диклофенак натрію 75 мг 1 раз на добу + диклофенак натрію 3,0 мл внутрішньом’язово 1 раз на добу 7 днів.
Лікування діуретиками і особливо зловживання ними є однією з найчастіших причин розвитку вторинної гіперурикемії і подагри [4, 13]. Асоціація між прийомом діуретиків і розвитком подагри у клінічній медицині відома з 1958 р. з робіт B. Oren та співавторів [9]. Вперше цей ефект був зазначений для тіазидних діуретиків, пізніше — і для петльових [8]. У ретроспективному когортному дослідженні продемонстровано двократне зростання ризику розвитку подагри та необхідність застосування протиподагричних засобів у пацієнтів, які приймали тіазидні діуретики [3]. В іншому дослідженні встановлено більш сильну залежність між розвитком подагри у пацієнтів із гіпертензією та застосуванням петльових діуретиків, ніж тіазидних [12].
Екскреція уратів залежить від клубочкової фільтрації, канальцевої реабсорбції і секреції. Сечова кислота, вочевидь, повністю фільтрується у клубочках і реабсорбується у проксимальних канальцях, тобто підпадає під пресекреторну реабсорбцію. У дистальних відділах проксимальних канальців урати секретуються, а ще нижче відбувається постсекреторна реабсорбція (рис. 5). Незважаючи на те що певна частка уратів може реабсорбуватися і у висхідному коліні петлі Генле, і у збиральній трубочці, ці зони вважаються менш важливими з кількісних позицій.
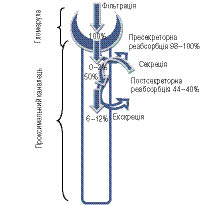
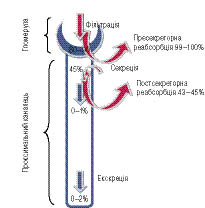
Механізми затримки сечової кислоти нирками при застосуванні діуретиків добре вивчені [6, 9, 14]. Зменшення об’єму циркулюючої плазми крові шляхом застосування сечогінних препаратів призводить до посилення канальцевої реабсорбції сечової кислоти, а також до зниження її фільтрації. При гіперурикемії, пов’язаній із прийомом діуретиків, має значення й зниження секреції сечової кислоти (рис. 6). Непрямі залежності між натрієм і уратами надзвичайно важливі з клінічних позицій, оскільки гіповолемія (частково через підвищення продукції ангіотензину ІІ) асоціюється з відповідним зростанням реабсорбції натрію у проксимальних канальцях [7]. Підвищення активності натрій-водневого обміну за таких умов може потім зумовлювати зростання урато-водневого обміну і з цих причин зміни реабсорбції уратів [6].
Проблема розвитку вторинної подагри актуальна для хворих із застійною серцевою недостатністю, які вимушені постійно приймати діуретики у зв’язку з набряковим синдромом. Не менш важливим є раціональне застосування діуретиків у пацієнтів із гіпертензією. Для них суттєво зростає ризик розвитку вторинної подагри через зниження секреції, фільтрації та посилення реабсорбції уратів, що ускладнює перебіг основного захворювання — артеріальної гіпертензії, ішемічної хвороби серця, серцевої недостатності та потребує додаткового призначення урикозуретиків і урикодепресантів. Але тривалий прийом діуретиків з метою зменшення маси тіла демонструє, до яких серйозних наслідків для здоров’я може призвести самолікування і безконтрольний прийом сечогінних препаратів.
Отже, описаний клінічний випадок демонструє, що нераціональний прийом діуретиків здатний призвести до суттєвих порушень пуринового обміну із розвитком стійкої гіперурикемії та тяжкої тофусної подагри.
ЛІТЕРАТУРА
- Барскова В.Г., Елисеев М.С. (2010) В помощь молодому ревматологу: на приеме больной с подагрическим артритом. Соврем. ревматология, 3: 53–57.
- Проценко Г.О., Бойчук Н.С. (2007) Моніторинг тривалого лікування хворих на подагру. Укр. ревматол. журн., 4(30): 30–33.
- Gurwitz J.H., Kalish S.C., Bohn R.L. et al. (1997) Thiazide diuretics and the initiation of anti-gout therapy. J. Clin. Epidemiol., 50: 953–959.
- Hunter D., York M., Chaisson C. et al. (2006) Recent Diuretic Use and the Risk of Recurrent Gout Attacks: The Online Case-Crossover Gout Study. J. Rheumatol., 33(7): 1–5.
- Jacobs J.W., Bijlsma J.W. (2007) Gout and diuretics; still an issue. Ned. Tijdschr. Geneeskd., 151(8): 458–460.
- Kahn A.M. (1988) Effect of diuretics on the renal handling of urate. Semin. Nephrol., 8: 305.
- Kahn A.M. (1989) Indirect coupling between sodium and urate transport in the proximal tubule. Kidney Int., 36: 378.
- Laragh J.H., Cannon P.J., Stason W.B. et al. (1966) Physiologic and clinical observations on furosemide and ethacrynic acid. Ann. NY Acad. Sci., 139: 453–465.
- Oren B., Rich M., Belle M. (1958) Chlorothiazide (Diuril) as a hyperuricacidemic agent. JAMA, 168: 2128–2129.
- Rott K.T., Agudelo C.A. (2003) Gout. JAMA, 289: 2857–2860.
- Spieker L.E., Ruschitzka F.T., Lüscher T.F. et al. (2001) The management of hyperuricemia and gout in patients with heart failure. Eur. J. Heart Failure, 4 (4): 403–410.
- Waller P.C., Ramsay L.E. (1989) Predicting acute gout in diuretic-treated hypertensive patients. J. Hum. Hypertens., 3: 457–461.
- Wordsworth B.P., Mowat A.G. (1985) Rapid development of gouty tophi after diuretic therapy. J. Rheumatol., 12: 376–377.
- Yu T., Berger L., Sarkozi L. et al. (1981) Effects of diuretics on urate and calcium excretion. Arch. Intern. Med., 141: 915–919.
СЛУЧАЙ ДИАГНОСТИКИ ДИУРЕТИК-ИНДУЦИРОВАННОЙ ТОФУСНОЙ ПОДАГРЫ У ЖЕНЩИНЫ в ПРЕМЕНОПАУЗАЛЬНый период
Резюме. В статье представлено описание случая диагностики вторичной подагры, развившейся у пациентки в пременопаузальный период в связи с хроническим злоупотреблением диуретиками. Пациентка принимала ежедневно фуросемид в дозе 40–80 мг/сут в течение последних 6 лет с целью уменьшения массы тела. В результате такого нерационального приема диуретиков развилась стойкая гиперурикемия, связанная с усилением канальцевой реабсорбции и снижением секреции уратов, а в последствии — дебютировала тофусная подагра с выраженным суставным синдромом. Тофусный артрит развился через 2 года от начала приема диуретиков, быстро прогрессировал и привел к развитию тяжелого суставного синдрома. В статье проанализированы механизмы развития вторичной подагры при злоупотреблении диуретиками или их нерациональном применении.
подагра, тофусный артрит, диуретик, подагрическая нефропатия, диуретик-индуцированная подагра.
Адреса для листування:
Головач Ірина Юріївна
03680, Київ, вул. Академіка Заболотного, 21, корп. ІІІ
Клінічна лікарня «Феофанія», відділення ревматології, нефрології і внутрішньої патології
E-mail: golovachirina@yandex.ru

Leave a comment