Вплив сульфату заліза на стан прооксидантно-антиоксидантної системи у хворих на залізодефіцитну анемію на тлі ревматоїдного артриту
Ватутин Н.Т. 1, Смирнова А.С. 1, Шевелек А.Н.1, Комарова Е.Б. 2
- 1Донецький національний медичний університет ім. Максима Горького
- 2ГУ «Луганский государственный медицинский университет»
Резюме. Резюме. У дослідженні проведено порівняльне вивчення рівнів малонового діальдегіду та каталази у осіб із ревматоїдним артритом та залізодефіцитною анемією до початку та після лікування сульфатом заліза. Зроблено висновок про те, що нормалізація рівня гемоглобіну під впливом сульфату заліза супроводжується зниженням активності перекисного окиснення ліпідів, а їх недостатня ефективність асоціюється зі збереженням прооксидантно-антиоксидантного дисбалансу.
Ревматоидный артрит (РА) — хроническое заболевание, характеризующееся развитием воспалительного процесса синовиальной оболочки и формированием костно-деструктивных изменений суставов, в патогенезе которого значительную роль играет активация процессов перекисного окисления липидов (ПОЛ), дезорганизация антирадикальной защиты и развитие оксидантного стресса (Cheng M.L. et al., 2005; Мікулець Л.В., Волошин О.І., 2011). В свою очередь, оксидантный стресс может приводить к повреждению синовиальных клеток, разрушению хряща и эрозии костной ткани. Железодефицитная анемия (ЖДА), развивающаяся у 30–70% больных РА, также сопровождается активацией процессов свободнорадикального окисления, что усугубляет тяжесть суставного процесса (Коваленко В.М. та співавт., 2010). При этом применение у таких больных препаратов железа, с одной стороны, способствует коррекции анемии, а с другой — может приводить к еще большей активации ПОЛ. Однако состояние прооксидантно-антиоксидантной системы у пациентов с ЖДА на фоне РА и ее изменение на фоне терапии препаратами сульфата железа изучены недостаточно.
Цель исследования — изучить влияние сульфата железа на состояние прооксидантно-антиоксидантной системы у больных ЖДА на фоне РА.
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
Под наблюдением находились 42 пациентки (средний возраст — 43±9 лет), болеющих РА на протяжении 3–15 лет (9±6 лет). У 24 из них (1-я группа) диагностирована ЖДА (ВОЗ, 2001), остальные (2-я группа) имели нормальный уровень гемоглобина. У 20 (86%) больных была анемия легкой степени тяжести — уровень гемоглобина — 112,8±3,6 г/л (1-я группа), у остальных — средней — уровень гемоглобина — 86,4±2,1 г/л (1б группа). В контрольную группу вошли 20 практически здоровых лиц (женщины 43±8 лет с гемоглобином 137,4±8,2 г/л).
Все больные РА принимали метотрексат в средней дозе 9,6±2,4 мг/нед в сочетании с фолиевой кислотой. Стероидные гормоны периодически получали 25 (62,5%), из них в средней дозе — 19,8±6,8 мг/сут (в пересчете на преднизолон). Эпизодически по требованию применяли нестероидные противовоспалительные препараты. Для лечения при ЖДА назначали сульфат железа (при легкой степени тяжести — 60–100 мг/сут элементарного железа, при средней — 200 мг/сут) до нормализации уровня гемоглобина (≥120 г/л), но не более чем на 2 мес (WHO, 2001). После нормализации концентрации гемоглобина проводимую терапию продолжали еще в течение 3 мес в дозе 60–100 мг/сут для восстановления депо железа в организме.
Исходно у всех больных и лиц контрольной группы, а также через 2 мес у больных 1-й группы после лечения сульфатом железа определяли уровень продукта ПОЛ — малонового диальдегида (МДА) и фермента антиоксидантной системы (АОС) — каталазы, а также еженедельно регистрировали повышение гемоглобина.
Забор крови пациентов для определения общеклинического анализа выполняли натощак из локтевой вены вакутайнером с К2EDTA (1 мг на 1 мл крови). Концентрацию гемоглобина определяли согласно инструкции на автоматическом гематологическом анализаторе «ABX Pentra 80» («Horiba АВХ diagnostics», Франция) с использованием комплекта тест-систем анализатора.
Вторичный продукт ПОЛ — МДА определяли спектрофотометрически: 1 мл плазмы крови смешивали с 1 мл 0,6% раствора тиобарбитуровой кислоты в присутствии 1 мл 30% раствора трихлоруксусной кислоты. Затем кипятили 15 мин на водяной бане, охлаждали, центрифугировали 15 мин при скорости 3000 об./мин. После этого образец фотометрировали при λ=532 нм. Расчет содержания МДА выполнялся по формуле:
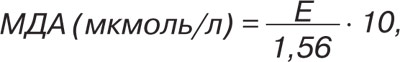
где Е — экстинкция исследуемой пробы.
Состояние АОС оценивали по активности каталазы в крови, определяя скорость утилизации перекиси водорода в реакционной смеси, в которую вносили биологический материал (сыворотку крови), содержащий фермент: 0,1 мл сыворотки крови инкубировали с 2 мл 0,03% раствора перекиси водорода в течение 10 мин при температуре 20 ˚С. Затем добавляли 1 мл 4% раствора молибдата аммония, центрифугировали 30 мин при скорости 5000 об./мин. После этого образец фотометрировали при λ=410 нм. Расчет активности каталазы выполняли по формуле:
![]()
где ∆Е=Ех–І0, Ех — экстинкция контрольной пробы, Е0 — экстинкция исследуемой пробы, 1332 — коэффициент пересчета. Обеспечение условий для оптимизации сопоставления и воспроизводимости результатов исследования достигали путем взятия крови у всех обследованных натощак, после 12-часового голодания, до еды и приема назначенных лекарственных средств.
Обработку результатов исследования выполняли на персональном компьютере с использованием пакета статистического анализа «MedStat». Для проверки распределения на нормальность использовали критерии W Шапиро — Уилка. При нормальном распределении данные приводили в виде среднее ± стандартное отклонение (М±s). Для сравнения средних двух независимых выборок, соответствующих нормальному закону распределения, использовали парный и непарный t-критерии Стьюдента. Корреляционные связи между парами количественных признаков при нормальном их распределении оценивали с помощью коэффициента линейной корреляции Пирсона (r). Во всех случаях проверки гипотез различия считались достоверными при р<0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Исходно у больных обеих клинических групп содержание МДА было достоверно (p<0,05) больше (1-я группа — 3,7±0,3; 2-я — 3,2±0,2 мкмоль/л), а уровень каталазы — ниже (1-я группа — 43,2±3,6; 2-я — 47,4±2,8 мккат/л) аналогичных показателей у здоровых лиц (1,85±0,48 мкмоль/л; 53,5±18,4 мккат/л). При этом указанные различия были более выражены у пациентов с анемией, причем повышение концентрации МДА и снижение уровня каталазы ассоциировались с более высокой степенью ее тяжести (табл. 1).
| Показатель | Исходно | ||
|---|---|---|---|
| 1-я группа | 2-я группа | ||
| 1а | 1б | ||
| МДА, мкмоль/л | 3,8±0,5* | 4,2±0,8 | 3,2±0,2 |
| Каталаза, мккат/л | 44,8±6,5* | 40,2±2,8 | 47,4±2,8 |
Различие между: *1а и 2-й группой (р<0,05); 1б и 2-й группой (р<0,05); подгруппами 1а и 1б (р<0,05).
Результаты статистического анализа свидетельствовали о том, что концентрация гемоглобина отрицательно коррелировала с уровнем МДА (r=–0,35; р<0,05) и положительно — с уровнем каталазы (r=+0,32; р<0,05).
Через 2 мес основной терапии у всех больных подгруппы 1а концентрация гемоглобина нормализовалась (124,1±3,7 г/л), что сопровождалось снижением уровня МДА, который стал сопоставим с показателем пациентов 2-й группы, в то время как уровень каталазы не изменился (табл. 2). У пациентов подгруппы 1б уровень гемоглобина не достиг нормы (113,2±5,8 г/л), при этом статистически значимых изменений ни МДА, ни каталазы не произошло.
| Показатель | Исходно | После терапии препаратами железа | ||
|---|---|---|---|---|
| 1а группа | 1б группа | 1а группа | 1б группа | |
| МДА, мкмоль/л | 3,8±0,5* | 4,2±0,8 | 3,2±0,4* | 4,1±0,6 |
| Каталаза, мккат/л | 44,8±6,5 | 40,2±2,8 | 44,4±5,8 | 40,2±2,6 |
*Различие в 1а подгруппе до и после лечения (р<0,05).
Таким образом, результаты проведенного нами исследования свидетельствуют о том, что у больных РА наблюдается активация процессов ПОЛ, особенно при наличии ЖДА, в то время как АОС угнетается. Кроме того, повышение уровня МДА и снижение концентрации каталазы у больных ассоциируется с более высокой степенью тяжести анемии. Вместе с тем, нормализация уровня гемоглобина на фоне применения препаратов железа сопровождается снижением активности ПОЛ, а их недостаточная эффективность ассоциируется с сохранением прооксидантно-антиоксидантного дисбаланса.
Известно, что при гипоксии (в том числе гемической) происходит активация процессов свободнорадикального окисления (Видиборець С.В., 1999). Так, в ряде исследований (Коган А.Х. и соавт., 1991; Дадали Ю.В. и соавт., 2000; Вишівська О.А. та співавт., 2004) у пациентов с ЖДА выявлело повышение уровня МДА и снижение уровней витамина Е, каталазы, глутатионпероксидазы и супероксиддисмутазы. Результаты нашего исследования также показали, что у больных РА и ЖДА происходит значительное усиление процессов ПОЛ и угнетение АОС, прогрессирующее по мере повышения степени тяжести анемии, что подтверждается наличием отрицательной корреляционной связи между уровнями продуктов ПОЛ и гемоглобина. Такая активация ПОЛ, вероятно, связана с тканевой гипоксией, а отсутствие адекватной реакции АОС — с хроническим характером процесса. При этом на фоне нормализации уровня гемоглобина происходит снижение активности ПОЛ, что подтверждается и рядом других исследований (Gurbuz N. et al., 2004; Kamanli A. et al., 2004).
Несмотря на то что сульфат железа является прооксидантом, полученная нами динамика показателей МДА свидетельствует о снижении активности ПОЛ на фоне его приема, что может быть обусловлено нормализацией уровня гемоглобина, которая сопровождается снижением процессов свободнорадикального окисления (Kurtoglu E. et al., 2003; Dyoretskii L.I. et al., 2006).
ВЫВОДЫ
1. У больных РА отмечается активация ПОЛ и угнетение АОС, которые наиболее выражены при наличии у них ЖДА.
2. Нормализация уровня гемоглобина под влиянием сульфата железа сопровождается снижением активности ПОЛ, а их недостаточная эффективность ассоциируется с сохранением прооксидантно-антиоксидантного дисбаланса.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
- Видиборець С.В. (1999) Дослідження ефективності кверцетину у комплексному лікуванні хворих із залізодефіцитною анемією. Ліки, 3: 132–136.
- Вишівська О.А., Загородний М.І., Горчакова Н.О. та ін. (2004) Клініко-фармакологічні властивості флавоноїду кверцетину. Ліки, 2: 8–12.
- Дадали Ю.В., Дадали В.А., Макаров В.Г. (2000) Квантово-химический подход к антиоксидантной активности некоторых природых антиоксидантов. В кн.:Актуальные проблемы создания новых лекарственных препаратов природного происхождения. Материалы IV Междунар. съезда, 29 июня — 1июля 2000 г., Великий Новгород, с. 135–143.
- Коваленко В.М., Кузьміна Г.П., Маркова О.Я. (2010) Імовірність розвитку цитокін-медійованого анемічного синдрому у хворих на ревматоїдний артрит. Укр. ревматол. журн., 2: 33–38.
- Коган А.Х., Ершов В.И., Алекперова Г.Р. (1991) Состояние свободнорадикальных процессов при железодефицитных анемиях. Терапевт. арх., 63(7): 85–88.
- Мікулець Л.В., Волошин О.І. (2011) Вплив комплексного лікування з використанням кверцетину на добову організацію показників антиоксидантної і прооксидантної системи крові у хворих на ревматоїдний артрит. Буковин. мед. вісн., 15(2): 58.
- Cheng M.L., Ho H.Y., Tseng H.C. et al. (2005) Antioxidant deficit and enhanced susceptibility to oxidative damage in individuals with different forms of alphathalassaemia. Br. J. Haematol, 128(1): 119–127.
- Dyoretskii L.I., Zaspa E.A., Lityitskii P.F. et al. (2006) Free radical processes in patients with iron deficiency anaemia treated with iron medication. Ter. Arkh., 78: 52–57.
- Gurbuz N., Yalcin O., Aksu T.A. et al. (2004) The relationship between the enzyme activity, lipid peroxidation and red blood cells deformability in hemizygous and heterozygous glucose-6-phosphate dehydrogenase deficient individuals. Clin. Hemorheol. Microcirc, 31(3): 235–242.
- Iron Deficiency Anaemia: Assessment, Prevention and Control. World Health Organization (2001)ReportoftheWHO/UNICEF/UNUConsultation.Geneva, 2001.
- Kamanli A., Naziroğlu M., Aydilek N. et al. (2004) Plasma lipid peroxidation and antioxidant levels in patients with rheumatoid arthritis. Cell. Biochem. Funct., 22(1): 53–57.
- Kurtoglu E., Ugor A., Baltaci A. K. et al. (2003) Effect of iron supplementation on oxidative stress and antioxidant status in iron deficiency anemia. Biol. Trace Elem. Res., 96(3): 117–124.
Адрес для переписки:
Ватутин Николай Тихонович
83003, Донецк, просп. Ильича, 16
Донецкий национальный медицинский
университет им. Максима Горького,
кафедра внутренней медицины № 1
E-mail: a.smyrnova@mail.ru

Leave a comment