КРИТЕРІАЛЬНИЙ І НЕКРИТЕРІАЛЬНИЙ АНТИФОСФОЛІПІДНИЙ СИНДРОМ: КОНЦЕПТУАЛЬНІ ПИТАННЯ ДІАГНОСТИКИ
Головач І.Ю., Чіпко Т.М., Лазоренко О.О.
Резюме. Обґрунтування. Антифосфоліпідний синдром (АФС) — придбана аутоімунна тромбофілія, яка характеризується розвитком рецидивуючих тромбозів судин будь-якого калібру і типу або акушерською патологією і обов’язковим виявленням стійко позитивних антифосфоліпідних антитіл. АФС традиційно поділяється на первинний і вторинний. Для діагностики захворювання використовуються міжнародні критерії 2006 р. АФС може бути діагностований за наявності однієї клінічної і однієї лабораторної ознаки. Однак класифікаційні критерії для АФС викликають дискусії зі збільшенням кількості пацієнтів з неповними критеріями, або клінічними проявами, що не входять до класифікаційних критеріїв. Складається враження, що певні пацієнти, які не відповідають цим критеріям, можуть бути неадекватно виключені з діагнозу АФС. Методи дослідження. На підставі літературних даних у статті наведені сучасні уявлення щодо виділення профілів пацієнтів, які не повністю відповідають міжнародним критеріям АФС, однак характеризуються високим ризиком тромбозів. У статті наведена характеристика запропонованих експертами 4 профілів пацієнтів з «некритеріальним АФС». Ці групи пацієнтів умовно названі «серонегативний АФС», «клінічний некритеріальний АФС», «неповний лабораторний АФС» та «лабораторний некритеріальний АФС». Висновки. Ця категоризація може дозволити здійснити більш однорідний дослідницький підхід до АФС, що дасть змогу зробити універсальні висновки щодо встановлення діагнозу АФС та лікування пацієнтів цих груп.
DOI: 10.32471/rheumatology.2707-6970.85.16436
Антифосфоліпідний синдром (AФС) є аутоімунним системним захворюванням, що характеризується рецидивуючими тромботичними подіями та/або патологією вагітності, асоційованою з наявністю антифосфоліпідних антитіл (aФЛ-АТ) [15]. Критерії діагнозу АФС представлені в табл. 1.
Таблиця 1. Переглянуті критерії (2006) для антифосфоліпідного синдрому [18]
| Клінічні критерії | Визначення |
|---|---|
| 1. Судинний тромбоз | Один або кілька епізодів тромбозу венозних, артеріальних або дрібних внутрішньорганних судин будь-якої локалізації. Тромботична подія має бути підтвердженою за допомогою інструментальних методів або морфологічно |
| 2. Акушерська патологія | а) Один або більше непояснених епізодів смерті морфологічно нормального плода на або після 10-го тижня вагітності, з нормальною морфологією плода, що задокументовано при ультразвуковому або патоморфологічному дослідженні плода;
або b) один або більше епізодів передчасних пологів морфологічно нормального новонародженого до 34-го тижня вагітності внаслідок еклампсії або тяжкої прееклампсії, яку діагностовано на підставі стандартних критеріїв або діагностичних ознак плацентарної недостатності; або с) три або більше непояснених спонтанних аборти поспіль на терміні до 10 тиж вагітності при відсутності у матері анатомічних і гормональних порушень і при виключенні хромосомних причин по материнській або батьківській лінії |
| Лабораторні критерії | Визначення |
| 1. Вовчаковий антикоагулянт | У плазмі крові міститься вовчаковий антикоагулянт, виявлений 2 або більше разів протягом принаймні 12 тиж, при проведенні дослідження на підставі рекомендацій Міжнародного товариства з вивчення тромбозів і гемостазу |
| 2. Антитіла до кардіоліпіну IgG або IgM | Наявні в плазмі або сироватці крові в середньому або високому титрі (>40 ОД/л) або більше 99 процентилів двічі з інтервалом не менше 12 тиж відповідно до стандартизованого ІФА |
| 3. Антитіла до β2-глікопротеїну I IgG або IgM | Наявні в плазмі або сироватці крові в титрі більше 99 процентилів двічі з інтервалом не менше 12 тиж відповідно до стандартизованого ІФА |
Примітка. ІФА — імуноферментний аналіз
Діагноз певного АФС встановлюється за умов наявності у пацієнта хоча б одного клінічного і одного лабораторного критеріїв згідно з діагностичними Сіднейськими критеріями АФС (див. табл. 1) [18]. Важливе значення має тривалість наявності позитивних результатів лабораторних тестів, оскільки висловлені припущення щодо можливого транзиторного підвищення титру aФЛ-АТ, які не мають патогенетичного зв’язку з АФС. Безсимптомне носійство аФЛ-АТ не є рідкістю в клінічній практиці, що призводить до гіпердіагностики АФС, тому в Сіднейських критеріях інтервал між повторними дослідженнями подовжений до 12 тиж. Отже, діагноз АФС є не правомірним, якщо між результатами позитивних тестів на aФЛ-АТ і клінічними ознаками є інтервал менше 12 тиж та/або більше 5 років.
Відповідно до діагностичних критеріїв діагноз АФС може бути встановлений за наявності однієї клінічної ознаки (тромбоз або втрата плода) і одного із серологічних маркерів: IgG або IgM антитіл до кардіоліпіну (аКЛ), IgG або IgM антитіл до β2-глікопротеїну 1 (аβ2-ГП1) або вовчакового антикоагулянту (ВА), що виявляються двічі з проміжком 12 тиж [30]. Залежно від числа позитивних тестів на аФЛ хворі із АФС стратифікуються за наступними категоріями: I — виявлення більше ніж одного лабораторного маркера (у будь-якій комбінації); IIа — тільки ВА; IIb — тільки аКЛ; IIc — тільки аβ2-ГП1. Для включення в число серологічних маркерів АФС інших показників, таких як антитіла до протромбіну, комплексу протромбін-фосфатидилсерин, анексину та ін., потрібні подальші дослідження, оскільки на сьогодні їх клінічна значущість не доведена. Це стосується і IgA-аКЛ, IgA аβ2-ГП1 [18].
Умовно виділяють первинний і вторинний АФС, асоційований з іншими аутоімунними захворюваннями, найчастіше із системним червоним вовчаком (СЧВ). Для АФС характерний високий ризик рецидиву тромбозів і акушерської патології, що асоціюється з характеристиками гіперпродукції аФЛ [29], а саме з підвищенням концентрації (позитивністю) одного, двох або трьох типів аФЛ, їх рівнями (низько позитивний, помірно позитивний і високо позитивний) і «стійкістю» виявлення антитіл при повторних дослідженнях (в межах 12 тиж). Високий ризик рецидиву тромбозів (незважаючи на антикоагулянтну терапію) відмічають у пацієнтів із «потрійною позитивністю» за аФЛ-АТ (ВА + аКЛ + анти-β2-ГП1), «подвійною позитивністю» за аФЛ-АТ (у будь-якій комбінації) і позитивністю за ВА в двох і більше дослідженнях [17, 27, 28]. Частота рецидиву тромбозів при АФС становить 16,6%, а розрахунковий ризик рецидиву — 3,3% на одного пацієнта на рік [9], а у хворих із «потрійною позитивністю» за аФЛ — 12,2% (95% довірчий інтервал (ДІ) 9,6–14,8) через 1 рік; 26,1% (95% ДІ 22,3–29,9) — через 5 років і 44,2% (95% ДІ 38,6–49,8) — через 10 років [21]. У нелікованих пацієнтів з АФС ймовірність повторних тромбозів коливається в межах 19–29% на рік [17]. АФС — це гетерогенне захворювання, залежно від клінічного фенотипу якого визначаються ризик розвитку тромбозів і ступінь необхідної гіпокоагуляції [11; 19]. Більшою мірою ризик повторного тромбозу залежить від профілю аФЛ-АТ [2, 17].
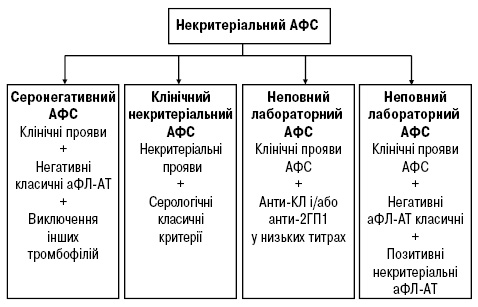
Існують стани, при яких у подальшому розвивається оклюзія судини — сітчасте ліведо або неврологічні прояви — хореєформні гіперкінези, мієлінізуючі прояви, що імітують розсіяний склероз, аФЛ-опосередкована тромбоцитопенія, втрата плода, аваскулярний некроз кісток тощо [1, 2, 4]. Будь-які з цих станів можуть передувати розвитку достовірного АФС. На сьогодні обґрунтовано виділяють ймовірний АФС або преАФС [7]. Цей діагноз може бути верифікований у пацієнтів з високими або середніми рівнями аФЛ-АТ у крові і з такими ознаками, як тромбоцитопенія або ураження клапанів серця (неінфекційне), або сітчасте ліведо, або нефропатія, але без тромбозу, акушерської патології та за відсутності іншого альтернативного захворювання. V. Pengo у своїх роботах [19; 20; 21] підкреслює, що часто класифікаційні критерії АФС не відповідають діагностичним. На практиці діагноз АФС часто встановлюється на підставі тільки одного позитивного тесту (інші 2 або не досліджені, або негативні). За останніми даними, ізольована позитивність за аКЛ-АТ (анти-β2-ГПI і ВА негативні) не асоціюється з тромбозами. Тому експерти пропонують виділяти діагностичні варіанти АФС: достовірний, ймовірний і малоймовірний [20]. Водночас класифікаційні критерії АФС викликають жваві дискусії, оскільки збільшується кількість пацієнтів, які не відповідають повністю цим критеріям і хибно виключаються з групи хворих на АФС. У зв’язку з цим запропонований термін «некритеріального» АФС, який об’єднує пацієнтів, що не мають повних класифікаційних критеріїв АФС [22] (рисунок).
Серонегативний АФС (СН-АФС) був спочатку визначений як «пацієнти з мігренню, інсультом, кількома попередніми викиднями, тромбоцитопенією та сітчастим ліведо, тести яких на аФЛ-АN є категорично негативними» [16]. Пізніше J.L. Rodriguez-Garcia зі співавторами [23] описали СН-АФС як наявність основних клінічних проявів АФС (тромбоз судин та/або патологія вагітності) та негативне тестування на аФЛ-АТ у двох окремих випадках, але що вимагає додатково наявності принаймні двох «некритеріальних» проявів: сітчасте ліведо, феномен Рейно, мігрень, когнітивна дисфункція, судоми, хорея, ураження білої речовини за даними магнітно-резонансної томографії (МРТ) головного мозку, подібні до розсіяного склерозу, хвороба мітрального клапана, хвороба аортального клапана, один або два спонтанні аборти до 10 тиж вагітності та тромбоцитопенія.
Нарешті, у 2015 р. робоча група з клінічних особливостей АФС на 14-му Міжнародному технічному конгресі з антифосфоліпідних антитіл визначила пацієнтів з СН-АФС як таких, що постійно демонструють типові клінічні прояви, що відповідають критеріям діагнозу АФС (Саппоро/Сідней), що супроводжується «некритеріальними» проявами лабораторного АФС та виключенням інших тромбофілій [5].
Таблиця 2. «Некритеріальні» прояви антифосфоліпідного синдрому (адаптовано нами за [22])
| НЕАКУШЕРСЬКІ ПРОЯВИ | |
|---|---|
| Великі | |
| АФС нефропатія | Хвороба клапанів серця |
| Ліведо сітчасте | Тромбоцитопенія |
| Хорея | Поперечний мієліт |
| Тромбоз поверхневих вен | |
| Малі | |
| Amaurosis fugas | Ураження білої речовини мозку на МРТ |
| Когнітивне зниження | Позитивний тест Кумбса |
| Гемолітична анемія | Асептичні некрози кісток |
| Мігрень | Псевдорозсіяний склероз |
| Легенева гіпертензія | Феномен Рейно |
| Шкірні виразки | Сенсоневральна приглухуватість |
| Судоми | Крововиливи на шкірі |
| АКУШЕРСЬКІ ПРОЯВИ | |
| Пізня затримка внутрішньоутробного розвитку (після 34-го тижня) | |
| Пізня прееклампсія (після 34-го тижня) | |
| Відшарування плаценти | |
| Плацентарна гематома | |
| Передчасні пологи (>34-го — <37-го тижня) | |
| Післяпологова прееклампсія | |
| Дві або більше незрозумілі in vitro невдачі запліднення | |
| Два незрозумілих спонтанних аборти <10 тиж | |
Більшість експертів погоджуються з необхідністю виключення спадкових причин тромбофілій при СН-АФС (наприклад фактор V Лейдена, мутація протромбіну G20210A, білок С, білок S та дефіцит антитромбіну), однак вказують, що їх наявність може визначатися у пацієнтів із АФС. Водночас наявність цих маркерів не завжди може пояснити різноманітну клінічну картину, що відмічається при АФС [8]. При визначенні класичних «критеріальних» аФЛ-АТ необхідно враховувати умови, які здатні знизити їх титри: нефротичний синдром, прийом глюкокортикоїдів, тяжкі порушення функції печінки, а також недотримання рекомендованого терміну для визначення аФЛ-АТ (12 тиж) [22].
Таким чином, СН-АФС охоплює пацієнтів із клінічними проявами АФС, які відповідають класифікаційним критеріям, а також з «некритеріальними» ознаками (табл. 2) та із стійко негативними «критеріальними» аФЛ-АТ. Таким пацієнтам рекомендується провести визначення «некритеріальних» аФЛ-АТ, що дозволить перекваліфікувати частку цих пацієнтів у групу «лабораторний некритеріальний АФС».
«Некритеріальні» антифосфоліпідні антитіла представлені в табл. 3.
Таблиця 3. «Некритеріальні» антифосфоліпідні антитіла, що можуть виявлятися при антифосфоліпідному синдромі
Критеріальні антифосфоліпідні антитіла
|
Некритеріальні антифосфоліпідні антитіла
|
Клінічний некритеріальний АФС та клінічні прояви «без критеріїв» викликають жваві дискусії. Такі клінічні прояви включають, насамперед, ураження шкіри у вигляді сітчастого ліведо (livedo reticularis), виразки шкіри, тромбоцитопенію, тромбоз поверхневих вен, гемолітичну анемію, позитивний тест Кумбса, нефропатію, ураження серцевих клапанів, легеневу гіпертензію, аваскулярні некрози кісток, мігрень, раптову втрату зору (amaurosis fugax), хорею, когнітивні порушення, судоми, поперечний мієліт та зміни на МРТ,що імітують розсіяний склероз [5, 14, 25]. Доповіді 14-го Міжнародного конгресу з питань технічної групи щодо антифосфоліпідних антитіл стосовно клінічних ознак АФС закінчилися рекомендацією щодо включення певних проявів (тромбоцитопенія, АФС-нефропатія, ураження клапанів серця, livedo reticularis, хорея та поперечний мієліт) як частину перегляду критеріїв АФС [5]. У Міжнародному консенсусі 2006 р. в заяві про оновлення класифікаційних критеріїв АФС згадується пропозиція терміну «ймовірний АФС» (не прийнятий комітетом), щоб включити пацієнтів, які відповідають клінічним вимогам АФС, але мають позитивні тести тільки на «некритеріальні аФЛ-АТ», а також пацієнтів з «некритеріальними» клінічними проявами і виявленням класичних аФЛ-АТ (подвійна чи потрійна позитивність). Пізніше було запропоновано для охоплення таких пацієнтів термін «пре-АФС» [7].
Випадки «некритеріальних» проявів акушерського АФС потребують окремого розгляду. Серія публікацій повідомляє про включення до реєстру EUROAPS епізодів акушерської патології, пов’язаних з АФС, та з «некритеріальними» проявами АФС [6]. До таких проявів, що не знайшли відображення в Сіднейській класифікації, відносять пізню недоношеність, один або два послідовних викидні до 10 тиж гестації, пізній гестоз, пізню внутрішньоутробну затримку росту, гематому плаценти, відшарування плаценти, післяпологову прееклампсію та 2 або більше незрозумілі невдачі запліднення in vitro. Експерти схиляються до думки, що до профілю «клінічний некритеріальний АФС» мали б увійти жінки з «некритеріальними» акушерськими проявами — принаймні з одним акушерським або одним великим неакушерським критерієм або двома «некритеріальними» акушерськими плюс лабораторними критеріями АФС [22].
Наступна група охоплює пацієнтів з неповним лабораторним АФС. Різні дослідження проаналізували роль антитіл до кардіоліпіну (низького титру) (анти-КЛ) та антитіл до β2-глікопротеїну I (анти-β2-ГПI), особливо у жінок з клінічними ознаками акушерського АФС. Отримані суперечливі результати: вони варіюють від більш високої частки успішних вагітностей у пацієнток з «низьким титром» порівняно з пацієнтами з «високим титром» аФЛ-АТ [26] до відсутності різниці у результатах [24]. Узагальнюючи наявну інформацію та проведені дослідження, більшість дослідників схиляються до думки, що до групи «неповний лабораторний АФС» слід віднести осіб із клінічними ознаками, що відповідають критеріям АФС плюс 2 або більше визначення (принаймні 12 тиж між визначеннями) анти-КЛ між 95-м і 99-м процентилями та/або 2 чи більше визначення (з інтервалом щонайменше 12 тиж) антитіл до β2-ГПI між 95-м і 99-м процентилями. Крім того, пропонується перевірити наявність «некритеріальних» аФЛ-АТ.
Термін «некритеріальний лабораторний АФС» охоплює пацієнтів із проявами клінічних критеріїв АФС (тромботичні та/або акушерські) та з негативними або в низькому титрі критеріальних аФЛ-АТ, а також з позитивними «некритеріальними» аФЛ-АТ.
За сучасними уявленнями, аФЛ-АТ є не тільки серологічним маркером, а й важливим патогенетичним медіатором, що викликає розвиток основних клінічних проявів АФС — тромбозу, акушерської патології, цитопеній тощо. У цілому аФЛ-АТ мають здатність впливати на більшість процесів, що становлять основу регуляції гемостазу, а їх порушення призводить до гіперкоагуляції [3].
Поки незрозуміло, які фактори (генетичні та/або пов’язані з довкіллям) призводять до утворення аФЛ-АТ, а також чому тільки у певних осіб з аФ-АТ розвиваються клінічні прояви АФС. Вважають, що природний імунітет має вирішальне значення в механізмі розвитку АФС у двох різних фазах: 1) фаза ініціації (або імунологічна) і 2) ефекторна (патологічна) фаза [10].
Незважаючи на більш високий ризик тромбозу та акушерської патології у жінок з аФЛ-АТ, у багатьох пацієнтів, особливо з однією позитивністю за аФЛ-АТ, ніколи не розвиваються клінічні прояви. Це вказує на правомочність «гіпотези подвійного удару», тобто генерація аФЛ-АТ є необхідною, але недостатньою умовою для розвитку клінічних проявів. Другий «удар» чітко не окреслений, але передбачається, що запалення, інфекція або інші протромботичні тригери зумовлюють розвиток цих проявів [13]. Крім того, відомо, що аФЛ-позитивні пацієнти мають ряд традиційних факторів ризику тромбозу, включаючи куріння та ожиріння [12].
Таким чином, дослідження вказують на значну клінічну і серологічну гетерогенність АФС, існування багатьох клінічних проявів, що не вкладаються в традиційні критерії діагнозу АФС, водночас характеризуються високим ризиком розвитку ускладнень. У даний час пропонується виділення наступних профілів пацієнтів, що згруповані під широким терміном «некритеріальний АФС».
«Серонегативний АФС»: пацієнти з клінічними проявами, що відповідають міжнародним критеріям АФС (2006), з наявністю клінічних ознак, що не відповідають критеріям (принаймні один акушерський або один основний неакушерський або дві незначні неакушерські) з постійно негативними аФЛ-АТ (принаймні 2 визначення з інтервалом 12 тиж) та виключення інших тромбофілій, які б виправдовували дану клінічну картину.
«Клінічний некритеріальний АФС»: пацієнти з «некритеріальними» проявами (принаймні один акушерський або один великий неакушерський або 2 незначних неакушерських), плюс позитивний результат аФЛ-АТ, що відповідають класифікаційним критеріям.
«Неповний лабораторний АФС»: пацієнти з клінічними проявами, що відповідають міжнародним критеріям АФС (2006) плюс 2 або більше визначення (з інтервалом не менше 12 тиж) анти-КЛ між 95 та 99 процентилями та/або двох або більше визначень (з інтервалом щонайменше 12 тиж) антитіл до β2-ГП I між 95-м та 99-м процентилями.
«Лабораторний некритеріальний АФС»: пацієнти з клінічними проявами, що відповідають АФС, з критеріями від’ємного/низького титру аФЛ-АТ плюс позитивні результати тестування на «некритеріальні» аФЛ-АТ.
Утім важливість і прогностичну значущість виділених профілів пацієнтів ще необхідно встановити.
Список використаної літератури
- 1. Головач И.Ю., Егудина Е.Д., Рекалов Д.Г. (2019) Поражение почек на фоне антифосфолипидного синдрома. Почки. 8(3): 22–34. doi: dx.doi.org/10.22141/2307–1257.8.3.2019.176455.
- 2. Головач І.Ю., Єгудіна Є.Д. (2019) Кардіоваскулярні маніфестації у пацієнтів з антифосфоліпідним синдромом: питання діагностики та менеджменту. Артеріальна гіпертензія. 5–6 (67–68): 35–44. doi: dx.doi.org/10.22141/2224–1485.5–6.66–67.2019.186046.
- 3. Решетняк Т.М., Чельдиева Ф.А., Нурбаева К.C. та ін. (2020) Антифосфолипидный синдром: диагностика, механизм развития, вопросы терапии. Тромбоз, гемостаз и реология. 4: 4–21. DOI: 10.25555/THR.2020.4.0940.
- 4. Решетняк Т.М., Нурбаева К.С. (2020) Прямые оральные антикоагулянты при антифосфолипидном синдроме. Научно-практическая ревматология. 58(6):т708–715. doi: 10.47360/1995-4484-2020-708-715.
- 5. Abreu M.M., Danowski A., Wahl D.G., et al. (2015) The relevance of «non-criteria» clinical manifestations of antiphospholipid syndrome: 14th International Congress on Antiphospholipid Antibodies Technical Task Force Report on Antiphospholipid Syndrome Clinical Features. Autoimmun. reviews. 14: 401–414. doi: 10.1016/j.autrev.2015.01.002.
- 6. Alijotas-Reig J., Esteve-Valverde E., Ferrer-Oliveras R., et al. (2019) Comparative study of obstetric antiphospholipid syndrome (OAPS) and non-criteria obstetric APS (NC-OAPS): report of 1640 cases from the EUROAPS registry. Rheumatology (Oxford). 59(6): 1306–1314. doi: 10.1093/rheumatology/kez419.
- 7. Asherson R.A. (2006) New subsets of the antiphospholipid syndrome in 2006: «PRE-APS» (probable APS) and microangiopathic antiphospholipid syndromes («MAPS»). Autoimmun. reviews.6: 76–80. doi: 10.1016/j.autrev.2006.06.008.
- 8. Berman H., Ugarte-Gil M.F., Espinosa G. et al. (2013) Can inherited thrombophilia modulate the clinical phenotype of patients with antiphospholipid syndrome? Clin. Exp. Rheum., 31: 926–932.
- 9. Cervera R., Serrano R., Pons-Estel G.J. et al. (2015) Morbidity and mortality in the antiphospholipid syndrome during a 10-year period: A multicentre prospective study of 1000 patients. Ann. Rheum. Dis. 74(6): 1011–1018. DOI: 10.1136/ annrheumdis-2013-204838.
- 10. Chighizola C.B., Raschi E., Borghi M.O. et al. (2015) Update on the pathogenesis and treatment of the antiphospholipid syndrome. Curr. Opin. Rheumatol. 27(5): 476–82. DOI: 10.1097/BOR.0000000000000200.
- 11. Cohen H., Efthymiou M., Isenberg D. A. (2018) Use of direct oral anticoagulants in antiphospholipid syndrome. J. Thromb. Haemost. 16(6): 1028–1039. DOI: 10.1111/jth.14017.
- 12. da Silva F.F., Levy R.A., de Carvalho J.F. (2014) Cardiovascular risk factors in the antiphospholipid syndrome. J. Immunol. Res.: 621270. DOI: 10.1155/2014/621270.
- 13. Erkan D., Salmon J., Lockshin M. (2017) Antiphospholipid syndrome. In: Kelley and Firestein’s textbook of rheumatology. Eds. G.S. Firestein I.B. McInnes, J.R. O’Dell. Philadelphia: Elsevier, 1389–1399.
- 14. Garcia D., Erkan D. (2018) Diagnosis and management of the antiphospholipid syndrome. NEJM. 378: 2010–2110. doi: 10.1056/NEJMra1705454.
- 15. George D., Erkan D. (2009) Antiphospholipid syndrome. Prog Cardiovasc Dis. 52(2): 115–125. doi: 10.1016/j.pcad.2009.06.005.
- 16. Hughes G.R.V., Khamashta M.A. (2003) Seronegative antiphospholipid syndrome. Ann Rheum Dis.62: 1127–1127. doi: 10.1177/0961203319826358.
- 17. Kearon C., Parpia S., Spencer F.A. et al. (2018) Antiphospholipid antibodies and recurrent thrombosis after a first unprovoked venous thromboembolism. Blood. 131(19): 2151–2160. DOI: 10.1182/blood-2017-09-805689.
- 18. Miyakis S., Lockshin M.D., Atsumi T. et al. (2006) International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J. Thromb. Haemost.: 295–306. DOI: 10.1111/j.1538–7836.2006.01753.x.
- 19. Pengo V., Ruffatti A., Legnani C. et al. (2011) Incidence of a first thrombembolic event in asymptomatic carriers of high-risk antiphospholipid antibody profile: A multicenter prospective study. Blood. 118(17): 4714–4718. DOI: 10.1182/blood-2011-03-340232.
- 20. Pengo V. (2013) Classification criteria of thrombotic APS. 9th Meeting of the European Forum on Antiphospholipid Antibodies. Medycyna praktyczna (Krakow). 46: 16–17.
- 21. Pengo V., Ruffatti A., Legnani C. et al. (2010) Clinical course of high-risk patients diagnosed with antiphospholipid syndrome/ J Thromb Haemost. 8: 237–242. dx.doi.org/10.1111/j.1538–7836.2009.03674.x.
- 22. Pires da Rosa G., Bettencourt P., Rodríguez-Pintó I. et al. (2020). «Non-criteria» antiphospholipid syndrome: A nomenclature proposal. Autoimmun. Rev. 19(12): 102689. doi:10.1016/j.autrev.2020.102689
- 23. Rodriguez-Garcia J.L., Bertolaccini M.L., Cuadrado M.J. et al. (2012) Clinical manifestations of antiphospholipid syndrome (APS) with and without antiphospholipid antibodies (the so-called ‘seronegative APS’). Ann Rheum Dis.71: 242–244. doi: 10.1136/annrheumdis-2011–200614.
- 24. Ruffatti A., Favaro M., Calligaro A. еt al. (2019) Management of pregnant women with antiphospholipid antibodies. Expert Rev Clin Immunol. 15: 347–358. doi: 10.1080/1744666X.2019.1565995.
- 25. Sciascia S., Amigo M.-C., Roccatello D., Khamashta M. (2017) Diagnosing antiphospholipid syndrome: ‘extra-criteria’ manifestations and technical advances. Nat. Rev. Rheumatol., 13: 548–560. doi: 10.1038/nrrheum.2017.124.
- 26. Simchen M.J., Dulitzki M., Rofe G. et al. (2011) High positive antibody titers and adverse pregnancy outcome in women with antiphospholipid syndrome. Acta Obstet. Gynecol. Scand., 90: 1428–1433. doi: 10.1111/j.1600–0412.2011.01236.x.
- 27. Taraborelli M., Reggia R., Dall’Ara F. et al. (2017) Long-term outcome of patients with primary antiphospholipid syndrome: A retrospective multicenter study. J Rheumatol. 44(8): 1165–1172. DOI: 10.3899/jrheum.161364.
- 28. Tektonidou M.G., Andreoli L., Limper M. et al. (2019) EULAR recommendations for the management of antiphospholipid syndrome in adults. Ann. Rheum. Dis., 78(10): 1296–1304. DOI: 10.1136/annrheumdis-2019–215213.
- 29. Volkov I., Seguro L., Leon E.P. et al. (2020) Profiles of criteria and non-criteria anti-phospholipid autoantibodies are associated with clinical phenotypes of the antiphospholipid syndrome. Auto Immun Highlights. 11(1): 8. DOI: 10.1186/s13317-020-00131-3.
- 30. Wilson W.A., Gharavi A.E., Koike T. et al.(1999) International consensus statement on preliminary classification criteria for definite antiphospholipid syndrome: report of an international workshop. Arthritis Rheum. 42(7): 1309–11. DOI: dx.doi. org/10.1002/1529–0131(199907)42:7%3C1309::AID-ANR1%3E3.0.CO;2-F.
КРИТЕРИАЛЬНЫЙ И НЕКРИТЕРИаЛЬНЫЙ АНТИФОСФОЛИПИДНЫЙ СИНДРОМ: КОНЦЕПТУАЛЬНЫЕ ВОПРОСЫ ДИАГНОСТИКИ
Клиническая больница «Феофания» Государственного управления делами, Киев
Резюме. Обоснование. Антифосфолипидный синдром (АФС) — приобретенная аутоиммунная тромбофилия, которая характеризуется развитием рецидивирующих тромбозов сосудов любого калибра и типа или акушерской патологией и обязательным выявлением стойко позитивных антифосфолипидных антител. АФС традиционно разделяют на первичный и вторичный. Для диагностики заболевания используются международные критерии 2006 г. АФС может быть диагностирован при наличии одного клинического и одного лабораторного признака. Однако классификационные критерии АФС вызывают дискуссии с увеличением количества пациентов с неполными критериями или клиническими проявлениями, не входящими в классификационные критерии. Создается впечатление, что определенные пациенты, которые не соответствуют этим критериям, могут быть неадекватно исключены из диагноза АФС. Методы исследования. На основании литературных данных в статье приведены современные представления о выделении профилей пациентов, которые не полностью соответствуют международным критериям АФС, однако характеризуются высоким риском тромбозов. В статье приведена характеристика предложенных экспертами четырех профилей пациентов с «некритериальным АФС». Эти группы пациентов условно названы «серонегативный АФС», «клинический некритериальный АФС», «неполный лабораторный АФС» и «лабораторный некритериальный АФС». Выводы. Подобная категоризация позволяет осуществить более однородный исследовательский подход к АФС, а также позволит сделать универсальные выводы относительно установления диагноза АФС и лечения этих групп пациентов.
Ключевые слова: антифосфолипидный синдром, антифосфолипидные антитела, тромбоз, критерии.
Адреса для листування:
Головач Ірина Юріївна — доктор медичних наук, професор, заслужений лікар України, керівник центру ревматології, остеопорозу та імунобіологічної терапії Клінічної лікарні «Феофанія» ДУС, Київ
03423, Київ, вул. Заболотного, 21
golovachirina@gmail.com
ORCID iD: https://orcid.org/0000–0002–6930–354X

Leave a comment