ЮВЕНІЛЬНИЙ СИСТЕМНИЙ ЧЕРВОНИЙ ВОВЧАК. ЩО ВАРТО ПАМ’ЯТАТИ РЕВМАТОЛОГУ ДОРОСЛОЇ СЛУЖБИ?
Резюме. Обґрунтування. Ювенільний системний червоний вовчак (юСЧВ) — тяжке рідкісне мультисистемне аутоімунне/аутозапальне захворювання із дебютом симптомів до 18-річного віку, що уражує будь-яку систему органів, призводить до їх пошкодження, спричиняючи розвиток непрацездатності та/або смерті. Серед пацієнтів із системним червоним вовчаком (СЧВ), хворі на юСЧВ становлять 15–20%. Методи дослідження. На підставі літературних даних у статті наведені сучасні уявлення щодо етіології та патогенезу, описано гетерогенність клінічних проявів та перебігу юСЧВ; висвітлені основні труднощі у діагностиці, зокрема розробці діагностичних критеріїв. Представлена порівняльна характеристика існуючих класифікаційних критеріїв у популяції хворих на юСЧВ. Терапевтичні стратегії у разі юСЧВ переважно екстрапольовані з дорослої популяції хворих. У роботі наведена сучасна терапевтична тактика при юСЧВ, в тому числі із застосуванням препаратів біологічної терапії. Висновки. Мультисистемність ураження, характерна для юСЧВ, зумовлює потребу у курації пацієнта із залученням мультидисциплінарної команди, а не лише дитячого ревматолога, та потребує дотримання визначених принципів спадкоємності із дорослою ревматологічною службою при переході пацієнтів.
DOI: 10.32471/rheumatology.2707-6970.84.16287
ВСТУП
Ювенільний системний червоний вовчак (юСЧВ) — тяжке рідкісне мультисистемне аутоімунне/аутозапальне захворювання із дебютом симптомів до 18-річного віку, що вражає будь-яку систему органів, призводить до їх пошкодження, спричиняючи розвиток непрацездатності та/або смерті (Charras A. et al., 2021).
ЕПІДЕМІОЛОГІЯ
Захворюваність на юСЧВ є варіабельною і становить 0,36–2,5/100 тис., а поширеність — 1,89–34,1/100 тис. населення відповідно. У структурі пацієнтів із системним червоним вовчаком (СЧВ) хворі на юСЧВ становлять 15–20% (Hedrich C.M. et al., 2017; Smith E.M.D. et al. 2019). Віковий пік дебюту симптомів юСЧВ — 12,6 року (Watson L. et al., 2012), уражує частіше дівчат і молодих жінок (співвідношення 4,7–5,6:1,0), хоча гендерна перевага осіб жіночої статі серед дітей менш виражена порівняно з дорослими (Ambrose N. et al., 2016). У той же час навіть серед дитячого населення у разі СЧВ розподіл за статтю варіює. Зокрема, у віці до 5 років юСЧВ виникає приблизно в однаковому співвідношенні у хлопчиків та дівчаток (Zulian F. et al., 2008).
Підвищення рівнів захворюваності та смертності, пов’язаних з юСЧВ порівняно із СЧВ у дорослих, зумовлені більш тяжким перебігом процесу, вищою активністю хвороби, потребою в агресивній терапевтичній тактиці (зокрема, дозах глюкокортикоїдів (ГК) та імуносупресантів) (Ambrose N. et al., 2016). Встановлено, що при СЧВ порівняно із загальною популяцією стандартизований коефіцієнт смертності (СКС) є вищим (СКС — 2,2 для всіх вікових груп), у той же час у пацієнтів із юСЧВ показник СКС перевищує норму приблизно втричі (СКС 6,5) (Chen Y.M. et al., 2014). Серед найпоширеніших причин летального наслідку варто відзначити інфекційні ускладнення, хвороби нирок, злоякісні новоутворення й ураження судин. Проте структура причин смертності змінюється і залежить від тривалості хвороби. Зокрема, у пацієнтів із раннім дебютом і, відповідно, більш тривалим перебігом юСЧВ, зростає роль передчасного розвитку атеросклерозу, що, в свою чергу, асоціюється із підвищенням ризику розвитку і смертності від серцево-судинних ускладнень.
Встановлення діагнозу та курація хворих із юСЧВ утруднені через суттєву гетерогенність клінічних проявів хвороби, особливостей прогресування процесу, відповіді на терапію і тяжкості статусу в цілому: в одних пацієнтів відмічають легкий варіант перебігу, у інших розвиваються життєвозагрожувальні клінічні прояви (Watson L. et al., 2012).
Варіабельність патогенетичних механізмів між віковими групами і більша роль генетичних факторів у розвитку юСЧВ підтверджуються наявністю родинних кластерів, певної етнічної схильності і залежності від віку окремих клінічних і лабораторних проявів (Smith E.M.D et al., 2019). Цей факт підтверджений у дослідженні J.S. Massias та співавторів за участю 418 пацієнтів із юСЧВ, в якому продемонстровано, що підлітки із юСЧВ (віком 14–18 років) набирали більшу кількість балів за класифікаційними критеріями Американського коледжу ревматологів (АCR) та мали більш високу активність ураження шкіри, слизових оболонок, опорно-рухового апарату, нирок, серцево-судинної та дихальної систем (p<0,05) порівняно з хворими на юСЧВ у препубертаті (віком ≤7 років) та перипубертаті (віком 8–13 років). Підлітки із юСЧВ (віком >13 років) відрізнялися від молодших вікових груп (пре-/перипубертат) за серологічними паттернами: більш частою серопозитивністю за антинуклеарними антитілами (AНA) та вищими титрами анти-dsDNA (p<0,05). В той же час у наймолодшій віковій групі пацієнтів порівняно з пацієнтами старшого віку, рідше виявляли лейкопенію (р=0,002), тромбоцитопенію (p=0,004) та/або низький рівень комплементу (p=0,002). Результати цього дослідження підтверджують гіпотезу, що пацієнти із дебютом симптомів юСЧВ у підлітковому віці демонструють більш «класичний» фенотип СЧВ.
Отже, у різних вікових групах активуються різні патогенетичні механізми, що, в тому числі, є основою розвитку нетипових проявів юСЧВ у пацієнтів молодших вікових груп.
ОСНОВИ ЕТІОЛОГІЇ ТА ПАТОГЕНЕЗУ
Генетичні чинники відіграють центральну роль у патофізіології юСЧВ. Проте мутації одного гена викликають юСЧВ або СЧВ-подібне захворювання лише у 1–4% пацієнтів. Таким чином, у більшості пацієнтів із юСЧВ дебют симптомів зумовлений дією тригерів навколишнього середовища, зокрема, впливу ультрафіолетового опромінення, окремих лікарських засобів, інфекційних агентів тощо (Watson L.F.G.a.M.B., 2011).
Дисрегуляція імунної реакції викликає активацію різних ланок вродженого і набутого імунітету, що призводить до вивільнення прозапальних цитокінів, активації ефекторних Т-клітин, продукції аутоантитіл і циркулюючих імунних комплексів, що, в свою чергу, спричиняє запалення тканин і пошкодження органів, визначаючи клінічні прояви СЧВ (Midgley A. et al., 2014) (рисунок).
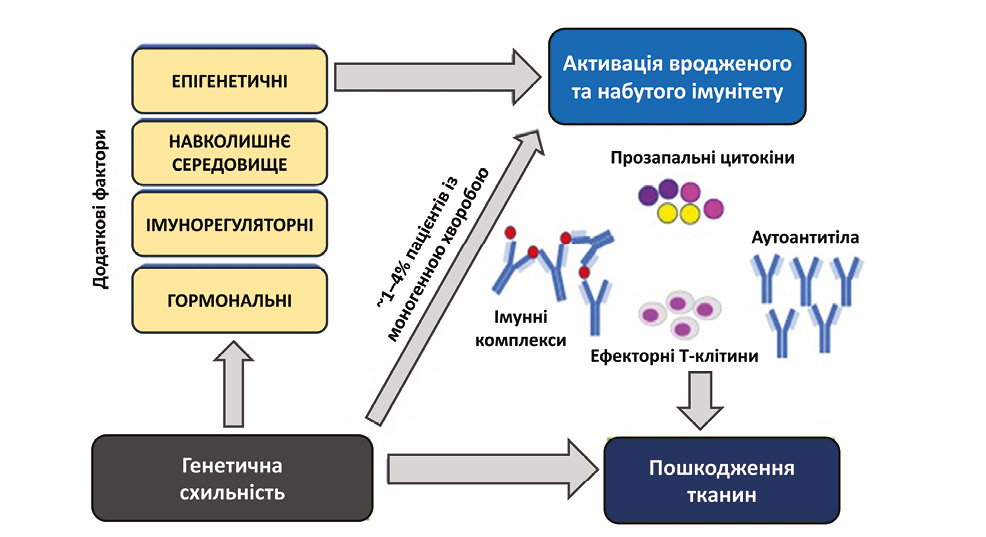
Як уже зазначалося, найпереконливішим доказом ролі генетичних факторів при юСЧВ є так звані «моногенні» СЧВ-подібні стани. Встановлено, що мутації в окремих генах призводять до підвищення рівня експресії інтерферону I типу та розвитку системного запалення. У свою чергу, дефіцит комплементу асоціюється із накопиченням імунних комплексів і розвитком «вторинних» реакцій інтерферону I. Незважаючи на те що глибше розуміння основ патогенезу моногенних СЧВ-подібних станів надало цінну інформацію про патофізіологію СЧВ, мутації в окремих генах відмічають у меншості хворих на юСЧВ (Alarcon-Segovia D. et al., 2005). Так, дослідження у генетично ідентичних однояйцевих близнюків встановило, що захворюваність на СЧВ в них коливається в межах 25–40%, що, з одного боку, чітко доводить роль генетичних чинників у патофізіології процесу, а з іншого — підтверджує важливість ролі додаткових тригерів для дебюту симптоматики у більшості пацієнтів (Rahman A., Isenberg D.A., 2008).
Останнім часом суттєвий прогрес намітився у визначенні генів та геномних ділянок, які зумовлюють схильність до СЧВ (Cui Y. Et al., 2013). Це так звані «алелі ризику», що залучені у численні імунні процеси (табл. 1), включаючи роль у запаленні і формуванні імунних комплексів, активацію В- і Т-лімфоцитів, передачу сигналів нейтрофілам та моноцитам, активацію Toll-like рецепторів (TLR) та інтерферону (Tsokos G.C. et al., 2016; Hedrich C.M. et al., 2017). Проте значна частка цих «алелів ризику» не є специфічними і виявляються при інших аутоімунних хворобах (зокрема, ревматоїдному артриті та ювенільному ідіопатичному артриті), підтверджуючи спільність патофізіологічних молекулярних механізмів серед окремих аутоімунних розладів (Cui Y. еt al., 2013).
Таблиця 1. Перелік найбільш вивчених генів, причетних до розвитку моногенного СЧВ та СЧВ-подібних хвороб
| Гени | Напрямок впливу | Асоційовані стани |
|---|---|---|
| ACP5 | Метаболізм та процесинг нуклеїнових кислот | Спондилоенхондродисплазія |
| ADAR | Метаболізм та процесинг нуклеїнових кислот | Синдром Айкарді — Гутьєреса |
| C1Q, C1R, C1S, C2, C3, C4 | Активація комплементу
Імунний кліренс |
СЧВ-подібна хвороба |
| DNASE1
DNASE1L3 RNASEH2A, B &C SAMHD1 |
Метаболізм та процесинг нуклеїнових кислот | Синдром Айкарді — Гутьєреса
Вовчак обмороження |
| FASFASLG | Апоптоз | Аутоімунний лімфопроліферативний синдром |
| IFIH1 | Метаболізм та процесинг нуклеїнових кислот | Синдром Айкарді — Гутьєреса |
| PEPD | Імунний кліренс | СЧВ-подібний стан |
| TREX1 | Зниження кліренсу хроматину
Активація експресії інтерферону типу І |
Родинний вовчак обмороження
Близько 20% прогресує у СЧВ |
| TMEM173 | Метаболізм та процесинг нуклеїнових кислот | Синдром SAVІ (STING-асоційована васкулопатія з дебютом у дитячому віці) |
На сьогодні відомо 876 генів, що асоційовані з розвитком СЧВ (gaad.medgenius.info/diseases), серед яких понад 150 генів-предикторів як асоційованих з HLA, так і не асоційованих (гени, що кодують манозозв’язувальний лектин, фактор некрозу пухлин (ФНП) і його рецептори, рецептори до ІЛ-6, IgG, білки теплового шоку, компоненти комплементу тощо) (Lu G. еt al., 2018).
ENCODE–енциклопедією ДНК проаналізовано 280 хроматинасоційованих протеїнів: 171 фактор транскрипції та 37 факторів регуляції, і встановлено, що з юСЧВ асоційовані 6 кластерів, що сприяють формуванню різних за фенотипом імунокомпетентних клітин. З усього переліку найбільше значення мають гени інтерферонів, наростання експресії яких виявлено не лише на моноцитах, дендритних клітинах, але й на Т-цитотоксичних клітинах та природних кілерах, що прогностично асоціюються з розвитком СЧВ (Partridge E.C. et al., 2020; Nehar-Behlaid D. et al., 2020; van Nostrand E.L. et al., 2020).
Варто зауважити, що так звані генетичні варіанти юСЧВ прийнято виділяти окремо, і до них належать хвороби із класичним менделівським успадкуванням:
1. Інтерферонопатії (мутації янус-кінази, TLR7, TLR9, РНКази нейтрофілів, ДНКази, STІNG-мутації).
2. Патологія системи комплементу (С1q>С4>С2).
3. Патологія трансдукційного сигналу лімфоцитів (вади протеїнкінази Сδ).
Слід зазначити, що варіанти генетично зумовленого юСЧВ демонструють переважно серонегативні результати за АНА і анти-dsДНК, розвиваються у дітей раннього віку, частіше відмічаються у хлопчиків і мають визначені клінічні відмінності.
ОСОБЛИВОСТІ КЛІНІЧНОЇ КАРТИНИ
Як зазначено у визначенні, юСЧВ — мультисистемне запальне захворювання зі значною варіабельністю клінічних проявів і перебігу. Тому своєчасне виявлення є важливою і непростою задачею навіть порівняно із СЧВ у дорослих. Крім того, незважаючи на узгоджене використання спільних класифікаційних критеріїв, юСЧВ за клінічною симптоматикою відрізняється від СЧВ у дорослих. Зокрема, у дітей багато клінічних проявів (виразкові вади слизової оболонки ротової порожнини, лихоманка, артралгії, головний біль, зменшення маси тіла) можуть бути неспецифічними і зумовленими іншими причинами.
Для юСЧВ типовим є ураження окремих органів-мішеней, а саме: залучення у запальний процес нирок. Люпус-нефрит виникає у 80% хворих на юСЧВ, при цьому у 19% процес прогресує у термінальну стадію ниркової недостатності (Watson L. et al., 2012; Al-Mayouf S.M. et al., 2017; Samanta M. et al., 2017). Іншим частим проявом юСЧВ порівняно із СЧВ у дорослих є ураження нервової системи із розвитком різноманітних нейропсихіатричних проявів: головного болю, психозів, когнітивної дисфункції та цереброваскулярних порушень (Benseler S.M., Silverman E.D., 2007). Типовими для юСЧВ є гематологічні прояви, а саме — гемолітична анемія, лімфопенія та тромбоцитопенія (Livingston B. et al., 2011; Watson L. et al., 2012), а також ураження шкіри і слизових оболонок: висип у зоні вилиць, фотосенсибілізація, виразки слизової оболонки ротової порожнини, васкуліт шкіри (Smith E.M.D. et al., 2019 b). Ураження ШКТ виявляється гепатоспленомегалією (15–74%), аутоімунним гепатитом, панкреатитом, серозитом, порушенням моторики стравоходу та неспецифічним болем у животі. Встановлено, що частота артриту, нефриту, неврологічних проявів негативно корелює із віком у дебюті захворювання (Gomes R.C. et al., 2016; Abdwani R. et al., 2019).
Мультисистемність ураження, що характерна для юСЧВ, зумовлює потребу у курації пацієнта не лише ревматологом, а й залучення інших фахівців: дерматологів, нефрологів, гематологів, неврологів, рентгенологів, імунологів, гастроентерологів, кардіологів, ендокринологів та інфекціоністів. Мультидисциплінарна команда може залучатися на будь-якому етапі, починаючи з моменту встановлення діагнозу, включаючи періоди загострення чи на етапі розвитку ускладнень. Останнім часом у провідних підліткових клініках у менеджмент юСЧВ активно впроваджуються консультації психолога задля оцінки ступеня нервово-психічних, когнітивних та поведінкових порушень. Таке скринінгове обстеження є важливим для осіб підліткового віку з огляду на визначений зв’язок когнітивної дисфункції з поганою академічною успішністю (Frittoli R.B. et al., 2016).
КЛАСИФІКАЦІЙНІ КРИТЕРІЇ
Незважаючи на суттєве покращення за останні 50 років показників виживаності у хворих на СЧВ, занепокоєння викликає своєрідне плато щодо рівнів виживаності за останні 30 років (Mak A. et al., 2012), а також достовірно вищі рівні смертності у пацієнтів із юСЧВ порівняно з дорослими хворими на СЧВ (Yurkovich M. et al., 2014).
З метою вирішення цієї ситуації у 2013 р. започаткований проєкт SHARE задля розробки міжнародних рекомендацій на основі даних доказової медицини щодо діагностики, моніторингу і підходів до терапії ювенільних ревматичних хвороб. У червні 2017 р. опубліковані 25 загальних рекомендацій щодо юСЧВ та окремо 10 щодо нейропсихічних проявів юСЧВ, окремо опубліковані рекомендації щодо люпус-нефриту (ЛН) (Groot N. et al., 2017a) та антифосфоліпідного синдрому (Groot N. et al.,2017b), основною метою яких були розробка, вдосконалення та гармонізація пацієнторієнтованої допомоги серед медичних центрів у всій Європі (Dolezalova P. et al., 2019).
Гетерогенність проявів і перебігу СЧВ викликає труднощі у розробці діагностичних критеріїв, які до цього часу відсутні. Наразі впроваджено класифікаційні критерії, основною метою яких є визначення гомогенної популяції пацієнтів для включення у клінічні дослідження (табл. 2).
Таблиця 2. Наявні класифікаційні критерії СЧВ
| АСR-1997 | SLICC-2012 | EULAR/ACR-2019 | |
|---|---|---|---|
| Критерій включення | Відсутній | Відсутній | Позитивність за АНА |
| Кількість критеріїв | 11 критеріїв | 17 критеріїв:
11 клінічних 6 імунологічних |
10 доменів із критеріями:
7 клінічних доменів 3 імунологічні домени |
| Оцінка | Кожен критерій — 1 бал | Кожен критерій — 1 бал | Вагомість критерію в кожному домені |
| Класифікація як СЧВ | ≥4 бали | ≥4 бали (включаючи 1 клінічний та 1 імунологічний критерій)
Або ЛН- та/АНА- чи анти-dsDNA-позитивність |
Позитивність за АНА та ≥10 балів та наявність щонайменше одного клінічного критерію |
Першочергово були розроблені класифікаційні критерії ACR, переглянуті у 1997 р. (Hochberg М.С., 1997). Враховуючи рівні їх чутливості, у 2012 р. за ініціативою Systemic Lupus International Collaborating Clinics (SLICC) запропоновані інші класифікаційні критерії, що являють собою поєднання клінічних та імунологічних ознак, а також дають можливість класифікувати пацієнтів із ЛН за даними нефробіопсії за умови наявності АНА або анти-dsDNA і у разі відсутності інших клінічних критеріїв (Petri M. et al., 2012). Дослідження у популяції пацієнтів із юСЧВ демонстрували високу чутливість, проте низьку специфічність зазначених критеріїв порівняно з критеріями АСR-1997 (Sag E. et al., 2014; Ines L. et al., 2015; Lythgoe H. et al., 2017). Проте наразі саме вони рекомендовані до використання у популяції пацієнтів із юСЧВ (Groot N. et al., 2017).
Нещодавно за спільною ініціативою ACR і Європейської протиревматичної ліги (European Alliance of Associations for Rheumatology — EULAR) розроблені та затверджені нові класифікаційні критерії, які вимагають як першочерговий критерій включення пацієнта наявність позитивного результату АНА (Hep-2, у титрі). Однак зазначені критерії наразі не валідизовані, а є об’єктом вивчення при юСЧВ (Aringer M., Dorner T., 2018; Johnson S.R. et al., 2019). Зокрема, з метою визначення чутливості та специфічності нових класифікаційних критеріїв у хворих на юСЧВ опубліковано декілька досліджень.
Так, A. Rodrigues Fonseca та співавтори (2019) провели порівняльний аналіз трьох наявних класифікаційних критеріїв ACR-1997, SLICC-2012, EULAR/ACR-2019 за участю 122 хворих на юСЧВ та 89 осіб групи контролю (пацієнти з іншими ревматичними хворобами та позитивним результатом АНА). Встановлено, що нові класифікаційні критерії EULAR/ACR-2019 зі зрізом у межі ≥10 балів на першому візиті пацієнта демонстрували рівні специфічності 67,4%, що є нижчими порівняно з відповідними показниками для критеріїв ACR-1997 (83,2%) та SLICC-2012 (80,9%). Рівень чутливості EULAR/ACR-2019 критеріїв був вищим порівняно з ACR-1997 (87,7% vs 70.5%), проте нижчим порівняно із SLICC-2012 (89,3%) відповідно. Використання альтернативного показника межі зрізу ≥13 балів для EULAR/ACR-2019 класифікаційних критеріїв призводило до достовірного покращення як рівнів специфічності, так і позитивної прогностичної цінності у хворих на юСЧВ.
У дослідження N. Aljaberi та співавторів (2020) включено 112 пацієнтів віком 2–21 років (як із юСЧВ, так і з СЧВ у дорослих) та 105 осіб групи контролю віком 1–19 років (з іншими системними хворобами сполучної тканини та ідіопатичними запальними міопатіями). У якості золотого стандарту був визначений діагноз СЧВ, встановлений ревматологом. Згідно з отриманими даними критерії EULAR/ACR-2019 демонстрували достовірно вищі показники чутливості (85% vs 72%, р=0,023) та рівнозначну специфічність (83% vs 87%, р=0,456) порівняно з критеріями ACR-1997.
Отже, насправді, з одного боку EULAR/ACR-2019 критерії дозволяють формувати більш гомогенні когорти пацієнтів для клінічних випробувань, але, з іншого, їх використання приховує певні ризики у разі виявлення хворих на СЧВ, які мають негативний результат за АНА, що є більш типовим для юСЧВ. Відповідно, дані пацієнти можуть не підпадати під спостереження ревматологічною службою, що є неприйнятним.
ПІДХОДИ ДО ТЕРАПІЇ
юСЧВ — відносно рідкісне захворювання, тому достовірних рандомізованих клінічних досліджень вкрай недостатньо, а стратегії терапії переважно екстрапольовані з дорослої популяції хворих. Більшість лікарських засобів, що призначаються хворим на юСЧВ, не є таргетними, однак є токсичними з доведеною здатністю спричиняти небажані явища (Hedrich C.M. et al., 2017; Smith E.M.D. et al., 2019), що особливо важливо у настільки вразливому дитячому та підлітковому віці.
Традиційні імуномодулюючі засоби
1. Глюкокортикоїди (ГК).
ГК залишаються основою терапії СЧВ і зазвичай застосовуються протягом тривалого періоду як у разі юСЧВ, так і при СЧВ у дорослих. У той же час підходи та дозові режими, які призначаються, суттєво відрізняються між окремими центрами/клініцистами (Brunner H.I. et al., 2009). Так, при легкому і перебігу середнього ступеня тяжкості використовуються переважно пероральні форми ГК у низьких дозах; у випадку тяжкого СЧВ — високі дози як пероральних, так і парентеральних ГК. Основна тенденція застосування ГК у дітей полягає у призначенні високих доз, у тому числі внутрішньовенно у вигляді пульс-терапії, з подальшим переходом на низькі підтримувальні дозові режими ГК.
Варто зауважити, що тривала терапія ГК, яка починається в дитячому віці, є причиною ранніх (психоз, безсоння, депресія, гіперліпідемія, гіперглікемія, гіпертензія) та відтермінованих (остеопороз, остеонекроз, серцево-судинні захворювання, катаракта, цукровий діабет, ожиріння) небажаних явищ. 80% стійких уражень внутрішніх органів через 15 років після встановлення діагнозу пов’язуються саме із застосуванням ГК. Пероральна доза преднізолону ≥ 6 мг/добу підвищує ступінь ушкодження органів-мішеней на 50%. Пероральна підтримувальна доза 10 мг/добу збільшує вираженість серцево-судинних уражень в 2,4 раза, а 20 мг/добу підвищують ризик серцево-судинних подій у 5 разів відповідно (Groot N. et al., 2017b).
Доведено, що навіть порівняно з дорослою популяцією хворих на СЧВ, пацієнти із юСЧВ мають підвищений ризик не лише відомих стероїдасоційованих небажаних явищ (Heshin-Bekenstein M. et al., 2019), а суттєво зростає ризик серйозних інфекційних ускладнень (Singh J.A. et al., 2016).
Враховуючи це, одним із сучасних напрямків терапії СЧВ є пошук стероїдзнижувальних засобів. У цьому контексті великі сподівання покладаються на препарати імунобіологічної терапії. У багатьох клінічних дослідженнях саме імплементація стероїдзнижувального ефекту як прагматичної альтернативної первинної кінцевої точки продемонструвало достовірну різницю в ефективності серед пацієнтів, яким призначалась імунобіологічна терапія (белімумаб, табалумаб, епратузумаб) порівняно із групою плацебо (Oon S. et al., 2018). Напрямок оцінки зниження дози ГК на фоні інноваційної терапії як індикатор якості лікування може опосередковано відображати покращення контролю над активністю хвороби. Отже, фокус на зниження дози і моніторинг токсичності ГК у когорті хворих на юСЧВ є перспективним і виправданим напрямком подальших досліджень.
2. Гідроксихлорохін (ГХ).
Хоча остаточно механізм дії ГХ не визначений, він рекомендований усім пацієнтам із юСЧВ (Hollander M.C. et al., 2013; Groot N. et al., 2017). Вважається, що ГХ впливає на фагоцитоз, міграцію лейкоцитів та знижує експресію TLR (Kuznik A. et al., 2011). Прийом ГХ асоціюється зі сприятливим впливом у разі активного СЧВ: покращує віддалені наслідки у хворих на юСЧВ вже у дорослому віці (Lim L.S.H. et al., 2017; Groot N., et al., 2019); асоціюється зі зниженням загальних показників смертності (Mok C.C. et al., 2018), зменшує кількість загострень і запобігає прогресуючому ушкодженню нирок у разі ЛН (Pons-Estel G.J. et al., 2009). ГХ виявляє сприятливий плейотропний ефект, що включає профілактику метаболічних порушень (дебют цукрового діабету (Chen Y.M. et al., 2015), зміни ліпідного спектра (Durcan L. et al., 2016), асоціюється зі зменшенням товщини комплексу інтима-медіа як сурогатного маркера атеросклерозу (Ammirati E. et al., 2014) та зниження ризику тяжких інфекцій (Rua-Figueroa I. et al., 2017).
Найбільше занепокоєння, пов’язане з терапією ГХ, викликає ймовірний негативний вплив на сітківку, особливо виражений серед пацієнтів молодого віку. Широке впровадження чутливих методів скринінгу для виявлення впливу на сітківку (зокрема спектральної оптичної когерентної томографії), а також результати останніх досліджень довели, що поширеність ГХ-асоційованої ретинопатії є вищою, ніж вважалося раніше (1,6–8,0% vs 0,4–1,9%) (Jorge A. et al., 2018). І цей факт є важливим, оскільки наразі дана ретинопатія вважається незворотною, а ризик токсичності ГХ зростає за умови довшої тривалості терапії: <1% ризику при терапії до 5 років, 2% при тривалості терапії до 10 років, стрімко зростаючи до 20% при тривалості терапії більше 20 років. Серед основних факторів ризику ГХ-асоційованої ретинопатії виділяють: 1) застосування дози >5 мг/кг/добу; 2) захворювання нирок (Melles R.B., Marmor M.F., 2014). Відповідно до існуючих рекомендацій в дитячому та підлітковому віці у разі юСЧВ показане проведення щорічного офтальмологічного скринінгу (Hollander M.C. et al., 2013; Groot N. et al., 2017а), і вимоги до нього є більш інтенсивними порівняно з рекомендаціями для дорослих хворих на СЧВ (Ding H.J. et al., 2016).
3. Традиційні синтетичні хворобомодифікуючі антиревматичні препарати (сХМАРП).
Застосування сХМАРП при юСЧВ проводиться з метою імуномодулюючого впливу, а також для реалізації стероїдзнижувальної стратегії.
Азатіоприн (АЗА) — пролікарський засіб, аналог пурину, що перетворюється після активації на 6-меркаптопурин. АЗА пригнічує як синтез ДНК, так і проліферацію лімфоцитів (Sahasranaman S., 2008). На сьогодні не проводилося рандомізованих клінічних досліджень, які б специфічно оцінювали ефективність АЗА при юСЧВ (Thorbinson C. et al., 2016). Препарат застосовується переважно при легкому/помірному ступені активності процесу або у якості підтримувальної терапії у разі тяжких клінічних проявів СЧВ. Враховуючи сприятливий профіль безпеки, АЗА рекомендований дорослим та особам старшого підліткового віку при плануванні вагітності (Gordon C. et al., 2018).
Метотрексат застосовується переважно як альтернатива АЗА у разі домінування ураження шкіри, слизових оболонок, а також симптоматики з боку опорно-рухового апарату (Sakthiswary R., Suresh E., 2014). Проте доказова база щодо ефективності монотерапії метотрексатом при юСЧВ є недостатньою (Ravelli A. et al., 1998).
Мофетилу мікофенолат (ММФ) в більшості випадків призначається у разі середнього чи високого ступеня активності СЧВ, за наявності гематологічних, нейропсихічних проявів, ураження серцево-судинної системи та нирок. Інший напрямок — за наявності легкого/помірного ступеня тяжкості клінічних проявів, рефрактерних до інших терапевтичних стратегій.
У дослідженні J. Ordi-Ros та співавторів (2017) проводилося пряме порівняння ММФ із АЗА (на фоні стабільного дозування антималярійних препаратів та ГК) у 240 дорослих пацієнтів із СЧВ із переважним ураженням опорно-рухового апарату та шкірно-слизовими проявами, з яких у 30% відмічали кардіореспіраторні прояви. Встановлено, що серед пацієнтів, які отримували ММФ, достовірно більша кількість досягали стану ремісії вже через 3 та 24 міс спостереження. Крім того, у групі ММФ відмічалися менша кількість загострень і більш сприятливий профіль безпеки. Проведення схожого за дизайном клінічного дослідження у хворих на юСЧВ було б вкрай інформативним.
Циклофосфамід застосовується у разі залучення у процес життєвоважливих органів чи життєвозагрожуючих станів, коли потрібно досягнути швидкого контролю над активністю хвороби (зокрема при неврологічних проявах, системному васкуліті, ЛН) (Bertsias G.K. et al., 2012; Mina R. et al., 2012; Barile-Fabris L. et al., 2014). Ризики, зумовлені прийомом циклофосфаміду (безпліддя, розвиток злоякісних пухлин, інфекційні ускладнення тощо), призвели до більшої прихильності клініцистів до ММФ як його альтернативи.
На сьогодні відсутні дані масштабних рандомізованих клінічних досліджень (РКД) при юСЧВ, які б вивчали режими індукції ремісії та підтримувальної терапії при ЛН ІІІ/IV класу, наявні лише окремі обсерваційні дослідження. Зокрема, в британській когорті пацієнтів із юСЧВ у реальній клінічній практиці з метою індукції ремісії ММФ призначався значно частіше порівняно із циклофосфамідом, демонструючи при цьому зіставну ефективність між групами (Smith E. et al., 2019).
Імунобіологічна терапія
1. Ритуксимаб (RTX) — анти-CD20 біологічний агент, що пригнічує В-клітини (проте не впливає на плазматичні клітини) (Taylor R.P., Lindorfer M.A., 2007). Наразі саме RTX є препаратом імунобіологічної терапії, який найчастіше призначається при юСЧВ, відіграючи важливу роль у терапії станів, рефрактерних до індукційної терапії препаратами 1-ї лінії, або у разі розвитку небажаних явищ внаслідок альтернативних терапевтичних підходів. Варто зазначити, що жодного РКД з метою вивчення ефективності та безпеки RTX у дітей не проводилося. У той же час наявна доказова база демонструє обнадійливі результати щодо його ефективності. Так, у 2 дослідженнях вивчали роль RTX для індукційної терапії у дітей із проліферативним ЛН (Basu B. et al., 2017; Hogan J., et al., 2018). А систематичний огляд (Peterknecht E. et al., 2018), що включав 5 ретроспективних когортних досліджень (Ale’ed A. et al., 2014; Dale R.C. et al., 2014; Olfat M. et al., 2015; Tambralli A. et al., 2015; Watson L., et al., 2015), 2 клінічних випадки (Trachana M. et al., 2013; Reis J. et al., 2016) та 1 пілотне дослідження (Lehman T.J. et al., 2014), оцінив перспективність застосування RTX загалом у 191 пацієнта із юСЧВ. RTX найчастіше призначався у разі активного захворювання, рефрактерного до ГК та/або синтетичних ХМАРП. 6 із 8 проаналізованих досліджень продемонстрували достовірне покращення за динамікою стандартизованих індексів активності (зокрема SLEDAI, BILAG, ECLAM) на фоні терапії RTX із тривалістю більшості досліджень ≥12 міс (Trachana M. et al., 2013; Lehman T.J. et al., 2014; Ale’ed A., et al., 2014; Dale R.C. et al., 2014; Olfat M. et al., 2015; Tambralli A. et al., 2015; Watson L. et al., 2015; Reis J. et al., 2016).
На фоні додавання RTX 6 із 8 досліджень продемонстрували достовірний стероїдзнижувальний вплив до 21–100%. Крім того, лікування RTX асоціювалося з покращенням лабораторних показників, включаючи гіпокомплементемію і вплив на титри анти-dsDNA. У одній із когорт, в якій проводився прицільний аналіз гематологічного синдрому, встановлено, що на фоні терапії RTX у 96% пацієнтів в середньому протягом 48 (14–103) діб нормалізувався рівень тромбоцитів та/або гемоглобіну (Olfat M. et al., 2015). У 5 із 8 досліджень у хворих з ЛН продемонстровано нормалізацію сироваткового рівня альбуміну, рівня креатиніну та співвідношення протеїн/креатинін у сечі.
2. Белімумаб — моноклональне антитіло, що на підставі даних ІІ, ІІІ фази клінічних досліджень є єдиним схваленим до застосування у дорослих пацієнтів із активним СЧВ. Основною мішенню впливу белімумабу є стимулятор В-клітин (Blys). Постмаркетинговий аналіз даних клінічних досліджень першочергово припускав, що пацієнти із серологічно активним захворюванням (підвищеним титром анти-dsDNA та/або низьким рівнем комплементу) відповідають на терапію белімумабом краще, проте дані подальших обсерваційних досліджень та реальна клінічна практика не підтвердили залежність відповіді від серологічної активності СЧВ (Fanouriakis A. et al., 2018; Fanouriakis A., Bertsias G.,2019). Доведено, що саме белімумаб є ефективним засобом зниження активності СЧВ, частоти/рівнів загострень, а також дає можливість знизити дозу ГК.
Лише в одному клінічному дослідженні — PLUTO (Pediatric Lupus Trial of Belimumab Plus Background Standard Therapy) проводилася оцінка ефективності белімумабу (10 мг/кг маси тіла) у комбінації зі стандартною терапією у 93 пацієнтів із юСЧВ. Згідно з отриманими даними відповіді на лікування за індексом (SRI-4) у групі белімумабу було достовірно більше порівняно з групою плацебо. Основні вторинні кінцеві точки, включаючи відповідь за PRINTO/ACR 30 та 50, а також стійке покращення за індексом SRI у групі белімумабу виявлялися набагато частіше порівняно з групою плацебо. Тяжкі загострення у групі белімумабу відмічали на 62% рідше порівняно з групою плацебо (Ruperto N. et al., 2019).
НАПРЯМКИ ПОДАЛЬШИХ ДОСЛІДЖЕНЬ
Тенденція останнього часу полягає в тому, що у хворих на СЧВ все більше уваги приділяється профілактиці та лікуванню коморбідних станів, пов’язаних безпосередньо із СЧВ чи його лікуванням. Особлива увага приділяється оцінці серцево-судинного ризику, шкідливих звичок (зокрема паління), ожиріння, гіпертензії, цукрового діабету, гіперліпідемії, рівнів гомоцистеїну, тривалого застосування ГК, рівня антифосфоліпідних антитіл, вітаміну D, остеопорозу та ризику злоякісних новоутворень (Bichile Т., Petri M., 2014). Наприклад, атеросклероз все частіше визначається як хронічний запальний стан, який у випадку юСЧВ може бути зумовлений цілим рядом факторів: наявністю циркулюючих імунних комплексів, активацією комплементу, наявністю антифосфоліпідних антитіл, прийомом ГК, порушенням обміну ліпідів та дисфункцією ендотелію (Haque S. et al., 2010). Іншими несприятливими наслідками юСЧВ є розвиток незворотної ниркової недостатності та підвищення серцево-судинного ризику, причому за наявності спільних факторів ризику, що можуть одночасно негативно впливати як на нирки, так і на серцево-судинну систему. Отже, метою подальших досліджень має стати визначення клінічно значущих як субклінічних станів, так і явної супутньої патології задля запобігання несприятливому віддаленому прогнозу.
Потреба у більш ретельному вивченні юСЧВ та покращенні спадкоємності між педіатричною та дорослою ревматологічними службами визначена АСR, спеціалісти якої резюмували ті особливості, які мають бути донесені дорослим ревматологам стосовно юСЧВ (табл. 3) та запропонований формат окремого медичного резюме для пацієнтів, що перебувають на етапі зміни служб (www.rheumatology.org/Practice-Quality/Pediatric-to-Adult-Rheumatology-Care-Transition).
Таблиця 3. Основні факти про юСЧВ, які варто пам’ятати ревматологу дорослої служби
| Позиція | Роз’яснення |
|---|---|
| У кожного п’ятого пацієнта із СЧВ хвороба діагностується у дитячому чи підлітковому віці | |
| юСЧВ має більш агресивний перебіг порівняно із СЧВ у дорослих | Діти та підлітки із СЧВ мають тенденцію до більшого залучення та тяжчого ураження органів-мішеней. Порівняно із СЧВ у дорослих, у разі юСЧВ уражуються ЦНС, нирки, розвивається термінальна стадія хвороби нирок, а перебіг хвороби характеризується вищими рівнями госпіталізації. Пацієнти з юСЧВ мають вищу активність захворювання, більше прямих і непрямих витрат, аніж дорослі хворі на СЧВ. У пацієнтів із юСЧВ частіше розвивається синдром активації макрофагів, «цитокінового шторму», що характеризуються лихоманкою і поліорганною недостатністю |
| юСЧВ характеризується вищими рівнями смертності порівняно із СЧВ у дорослих | Незважаючи на меншу кількість супутніх станів порівняно з дорослими, підлітки із СЧВ мають вдвічі вищий рівень смертності |
| Ускладнення, зумовлені хворобою та лікуванням, починаються у дитячому та підлітковому віці | У хворих на СЧВ сурогатні маркери атеросклерозу (потовщення комплексу інтима-медіа) виявляють вже у підлітковому віці. Рано дебютує зниження мінеральної щільності кісткової тканини. Хворі на юСЧВ мають особливий ризик ураження кісткової тканини, оскільки пік кісткової маси досягається в підлітковому віці. Отже, пацієнти із юСЧВ вже з раннього віку потребують профілактики і лікування гіпертензії, дисліпідемії, остеопенічного синдрому. Оскільки СЧВ і його лікування підвищують ризик інфекцій, важливим напрямком курації є проведення регулярної вакцинації |
| Підлітки та особи молодого віку часто не готові до самозабезпечення | Підлітки та особи молодого віку не мають достатньою мірою розвинених навичок самоуправління і самозабезпечення, що призводить до нерегулярних візитів у клініку, нерегулярного прийому препаратів. Особливу увагу слід звертати на стан репродуктивного здоров’я, профілактику серцево-судинних ускладень та прийом препаратів із врахуванням фармакологічної взаємодії |
Патофізіологія юСЧВ є складною і суттєво відрізняється в окремих пацієнтів, осіб різної статі, у різних вікових групах, що асоціюється із розвитком варіабельних і непередбачуваних фенотипів хвороби, непрогнозованої відповіді на терапію та несприятливим прогнозом. Доведено, що порівняно із СЧВ у дорослих, пацієнти з юСЧВ суттєво відрізняються у розподілі за статтю, тяжкістю перебігу хвороби, недостатньою відповіддю на терапію. Аналогічно до інших запальних захворювань, юСЧВ може бути стратифікований у так званому запальному спектрі від аутозапального стану до аутоімунного захворювання, являючи собою, з одного боку, моногенні аутозапальні порушення, з іншого — хворобу з класичним перебігом. Ідентифікація алелів ризику та визначення їх ролі у патогенезі юСЧВ є основою персоніфікованого, таргетного підходу до терапії, і саме це обґрунтовує потребу у проведенні подальших широкомасштабних досліджень, присвячених менеджменту хворих із юСЧВ задля покращення рівня надання медичної допомоги та віддалених наслідків хвороби.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- 1. Abdwani R., Abdalla E., Al-Zakwani I. (2019) Unique characteristics of prepubertal onset systemic lupus erythematosus, Int. J. Pediatr., 95370650.
- 2. Ale’ed A., Alsonbul A., Al-Mayouf S.M. (2014) Safety and efficacy of combined cyclophosphamide and rituximab treatment in recalcitrant childhood lupus, Rheumatol. Int. 34 (4): 529–533.
- 3. Aljaberi N., Nguyen K., Strahle C., Merritt A., Mathur A., Brunner H.I. (2020) The performance of the new 2019-EULAR/ACR classification criteria for systemic lupus erythematosus in children and young adults. Arthritis Care Res (Hoboken).
- 4. Ammirati E. et al. (2014) Cardiometabolic and immune factors associated with increased common carotid artery intima-media thickness and cardiovascular disease in patients with systemic lupus erythematosus, Nutr. Metab. Cardiovasc. Dis. 24 (7): 751–759.
- 5. Ambrose N., Morgan T.A., Galloway J. et al. (2016) Differences in disease phenotype and severity in SLE across age groups. Lupus. 2016.
- 6. Ammirati E. et al. (2014) Cardiometabolic and immune factors associated with increased common carotid artery intima-media thickness and cardiovascular disease in patients with systemic lupus erythematosus, Nutr. Metab. Cardiovasc. Dis. 24 (7): 751–759.
- 7. Aringer M., Dorner T. (2018) Systemic lupus erythematosus (SLE) — new classificationcriteria, Dtsch. Med. Wochenschr. 143 (11): 811–814.
- 8. Barile-Fabris L., Hernandez-Cabrera M.F., Barragan-Garfias J.A. (2014) Vasculitis in systemic lupus erythematosus, Curr. Rheumatol. Rep. 16 (9): 440.
- 9. Basu B., Roy B., Babu B.G. (2017) Efficacy and safety of rituximab in comparison with common induction therapies in pediatric active lupus nephritis, Pediatr. Nephrol. 32 (6): 1013–1021
- 10. Benseler S.M., Silverman E.D. (2007) Neuropsychiatric involvement in pediatric systemic lupus erythematosus, Lupus 16 (8): 564–571.
- 11. Bertsias G.K. et al. (2012) Joint European League Against Rheumatism and European Renal Association-European Dialysis and Transplant Association (EULAR/ERA-EDTA) recommendations for the management of adult and paediatric lupus nephritis, Ann. Rheum. Dis. 71 (11): 1771–1782.
- 12. Bichile Т., Petri M. (2014) Prevention and management of co-morbidities in SLE, Presse Med. 43 (6 Pt 2) (2014) e187–e195.
- 13. Brunner H.I., Klein-Gitelman M.S., Ying J. et al. (2009) Corticosteroid use in childhood-onset systemic lupus erythematosus-practice patterns at four pediatric rheumatology centers. Clin. Exp. Rheumatol.; 27(1): 155–162.
- 14. Charras A., Smith E., Hedrich C.M. (2021) Systemic lupus erythematosus in children and young people Current Rheumatology Reports 23: 20.
- 15. Chen Y.M., Lin C.H., Chen H.H. et al. (2014) Onset age affects mortality and renal outcome of female systemic lupus erythematosus patients: a nationwide populationbased study in Taiwan. Rheumatology (Oxford); 53(1): 180–5.
- 16. Chen Y.M. et al., (2015) Hydroxychloroquine reduces risk of incident diabetes mellitus in lupus patients in a dose-dependent manner: a population-based cohort study, Rheumatology (Oxford) 54 (7): 1244–1249.
- 17. Cui Y., Sheng Y., Zhang X. (2013) Genetic susceptibility to SLE: recent progress from GWAS, J. Autoimmun. 41; 25–33.
- 18. Dale R.C. et al. (2014) Utility and safety of rituximab in pediatric autoimmune and inflammatory CNS disease, Neurology 83 (2): 142–150.
- 19. Ding H.J. et al. (2016) Hydroxychloroquine-related retinal toxicity, Rheumatology (Oxford) 55 (6): 957–967.
- 20. Dolezalova P. et al. (2019) The European network for care of children with paediatric rheumatic diseases: care across borders, Rheumatology (Oxford) 58 (7): 1188–1195.
- 21. Durcan L. et al. (2016) Longitudinal evaluation of lipoprotein variables in systemic lupus erythematosus reveals adverse changes with disease activity and prednisone and more favorable profiles with hydroxychloroquine therapy, J. Rheumatol. 43 (4): 745–750.
- 22. Gomes R.C. et al. (2016) Features of 847 childhood-onset systemic lupus erythematosus patients in three age groups at diagnosis: a Brazilian Multicenter Study, Arthritis Care Res (Hoboken) 68 (11): 1736–1741.
- 23. Fanouriakis A. et al., (2018) Low disease activity-irrespective of serologic status at baseline-associated with reduction of corticosteroid dose and number of flares in patients with systemic lupus erythematosus treated with belimumab: a real-life observational study, Semin. Arthritis Rheum. 48 (3): 467–474.
- 24. Fanouriakis A., Bertsias G. (2019) Changing paradigms in the treatment of systemic lupus erythematosus, Lupus Sci. Med. 6 (1): e000310.
- 25. Frittoli R.B. et al., (2016) Association between academic performance and cognitive dysfunction in patients with juvenile systemic lupus erythematosus, Rev Bras Reumatol Engl Ed 56 (3): 252–257.
- 26. Groot N. et al. (2017) European evidence-based recommendations for the diagnosis and treatment of childhood-onset lupus nephritis: the SHARE initiative, Ann. Rheum. Dis., 76 (12): 1965–1973.
- 27. Groot N. et al. (2017b) European evidence-based recommendations for diagnosis and treatment of paediatric antiphospholipid syndrome: the SHARE initiative, Ann. Rheum. Dis., 76 (10): 1637–1641.
- 28. Groot N. et al. (2019) Long-term clinical outcomes in a cohort of adults with childhoodonset systemic lupus Erythematosus, Arthritis Rheumatol., 71 (2): 290–301.
- 29. Hedrich C.M., Smith E.M.D., Beresford M.W. (2017) Juvenile-onset systemic lupus erythematosus (jSLE) — pathophysiological concepts and treatment options. Best Pract. Res. Clin. Rheumatol.; 31(4): 488–504.
- 30. Haque S. et al. (2010) Risk factors for clinical coronary heart disease in systemic lupus erythematosus: the lupus and atherosclerosis evaluation of risk (LASER) study, Rheumatol. 37 (2): 322–329.
- 31. Heshin-Bekenstein M., Trupin L., Yelin E. et al. (2019) Longitudinal disease- and steroid-related damage among adults with childhood-onset systemic lupus erythematosus. Semin Arthritis Rheum.; 49(2): 267–272.
- 32. Hochberg М.С. (1997) Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus, Arthritis Rheum., 40 (9): 1725.
- 33. Hogan J. et al. (2018) Combination therapy of rituximab and mycophenolate mofetil in childhood lupus nephritis, Pediatr. Nephrol. 33 (1): 111–116.
- 34. Hollander M.C. et al. (2013) International consensus for provisions of quality-driven care in childhood-onset systemic lupus erythematosus, Arthritis Care Res (Hoboken) 65(9): 1416–1423.
- 35. Gordon C. et al. (2018) The British Society for Rheumatology guideline for the management of systemic lupus erythematosus in adults, Rheumatology (Oxford) 57 (1): e1–e45.
- 36. Groot N.D., Shaikhani D., Teng Y.K.O. et al. (2019) Long-Term Clinical Outcomes in a Cohort of Adults With Childhood-Onset Systemic Lupus Erythematosus. Arthritis Rheumatol. 71(2): 290–301.
- 37. Jorge A. et al. (2018) Hydroxychloroquine retinopathy — implications of research advances for rheumatology care, Nat. Rev. Rheumatol. 14 (12): 693–703.
- 38. Johnson S.R. et al. (2019) Use of consensus methodology to determine candidate items for systemic lupus erythematosus classification criteria, J. Rheumatol. 46 (7): 721–726.
- 39. Ines L. et al. (2015) Classification of systemic lupus erythematosus: Systemic Lupus International Collaborating Clinics Versus American College of Rheumatology Criteria. A comparative study of 2,055 patients from a real-life, international systemic lupus erythematosus cohort, Arthritis Care Res (Hoboken) 67 (8): 1180–1185.
- 40. Kuznik A. et al. (2011) Mechanism of endosomal TLR inhibition by antimalarial drugs and imidazoquinolines, J. Immunol. 186 (8): 4794–4804.
- 41. Lehman T.J. et al. (2014) Prolonged improvement of childhood onset systemic lupus erythematosus following systematic administration of rituximab and cyclophosphamide, Pediatr. Rheumatol. Online J .,12: 3.
- 42. Lim L.S.H. et al. (2017) From childhood to adulthood: the trajectory of damage in patients with juvenile-onset systemic lupus erythematosus, Arthritis Care Res (Hoboken) 69 (11): 1627–1635.
- 43. Livingston B., Bonner A., Pope J. (2011) Differences in clinical manifestations between childhood-onset lupus and adult-onset lupus: a meta-analysis, Lupus 20 (13): 1345–1355.
- 44. Lu G., Hao X., Wei-Hua Chen W-H., Shijie Mu S. (2018) GAAD: A Gene and Autoimmiune Disease Association Database. Genomics Proteomics Bioinformatics, Aug;16(4):252–261.
- 45. Lythgoe H., et al. (2017) Evaluation of the ACR and SLICC classification criteria in juvenile- onset systemic lupus erythematosus: a longitudinal analysis, Lupus 26 (12): 1285–1290.
- 46. Mak A., et al. (2012) Global trend of survival and damage of systemic lupus erythematosus: meta-analysis and meta-regression of observational studies from the 1950s to 2000s, Semin. Arthritis Rheum. 41 (6): 830–839.
- 47. Massias J.S., Smith E.M.D., Al-Abadi E., Armon K., Bailey K., Ciurtin C. et al. (2020) Clinical and laboratory characteristics in juvenile-onset systemic lupus erythematosus across age groups. Lupus.; 29(5):474–81.
- 48. Melles R.B., Marmor M.F., (2014) The risk of toxic retinopathy in patients on long-term hydroxychloroquine therapy, JAMA Ophthalmol 132 (12): 1453–1460.
- 49. Midgley A., Watson L., Beresford M.W. (2014) New insights into the pathogenesis and management of lupus in children, Arch. Dis. Child. 99 (6) (2014) 563–567.
- 50. Mina R., et al. (2012) Consensus treatment plans for induction therapy of newly diagnosed proliferative lupus nephritis in juvenile systemic lupus erythematosus, Arthritis Care Res (Hoboken) 64 (3): 375–383.
- 51. Mok C.C. et al. (2018) Effect of immunosuppressive therapies on survival of systemic lupus erythematosus: a propensity score analysis of a longitudinal cohort, Lupus 27 (5): 722–727.
- 52. Mok C.C. (2015) Mycophenolate mofetil for lupus nephritis: an update, Expert. Rev. Clin. Immunol. 11 (12): 1353–1364.
- 53. Nehar-Belaid D., Hong S., Marches R. (2020) Mapping systemic lupus erythematosus heterogeneity at the single-cell level Nat Immunol. Sep;21(9):1094–1106.
- 54. Olfat M., Silverman E.D., Levy D.M. (2015) Rituximab therapy has a rapid and durable response for refractory cytopenia in childhood-onset systemic lupus erythematosus, Lupus 24 (9): 966–972.
- 55. Oon S., Huq M., Godfrey T., Nikpour M. (2018) Systematic review, and meta-analysis of steroid-sparing effect, of biologic agents in randomized, placebo-controlled phase 3 trials for systemic lupus erythematosus. Semin Arthritis Rheum.;48(2):221–239.
- 56. Ordi-Ros J. et al.(2017) Enteric-coated mycophenolate sodium versus azathioprine in patients with active systemic lupus erythematosus: a randomised clinical trial, Ann. Rheum. Dis. 76 (9): 1575–1582.
- 57. Partridge E.С., Chhetri S.B., Prokop J.W. et al. (2020) Occupancy maps of 208 chromatin-associated proteins in one human cell type. Nature, 583 (7818). pp. 720–728.
- 58. Peterknecht E., Keasey M.P., Beresford M.W. (2018) The effectiveness and safety of biological therapeutics in juvenile-onset systemic lupus erythematosus (JSLE): a systematic review, Lupus 27 (13) (2018) 2135–2145.
- 59. Petri M. et al. (2012) Derivation and validation of the Systemic Lupus International Collaborating Clinics classification criteria for systemic lupus erythematosus, Arthritis Rheum. 64 (8): 2677–2686.
- 60. Pons-Estel G.J. et al. (2009) Protective effect of hydroxychloroquine on renal damage in patients with lupus nephritis: LXV, data from a multiethnic US cohort, Arthritis Rheum. 61 (6) (2009) 830–839.
- 61. Rahman A., Isenberg D.A. (2008) Systemic lupus erythematosus, N. Engl. J. Med. 358 (9), 929–939.
- 62. Ravelli A. et al. (1998) Methotrexate therapy in refractory pediatric onset systemic lupus erythematosus, J. Rheumatol. 25 (3): 572–575.
- 63. Reis J., Aguiar F., Brito I. (2016) Anti CD20 (Rituximab) therapy in refractory pediatric rheumatic diseases, Acta Reumatol. Port. 41 (1) (2016) 45–55.
- 64. Rodrigues Fonseca A., Felix Rodrigues M.C., Sztajnbok F.R et al. (2019) Comparison among ACR1997, SLICC and the new EULAR/ACR classification criteria in childhood-onset systemic lupus erythematosus. Adv Rheumatol. 2019;59(1):20.
- 65. Rua-Figueroa I. et al. (2017) Incidence, associated factors and clinical impact of severe infections in a large, multicentric cohort of patients with systemic lupus erythematosus, Semin. Arthritis Rheum. 47 (1): 38–45.
- 66. Ruperto N. et al. (2019) THE PLUTO STUDY: INTRAVENOUS BELIMUMAB IN CHILDREN WITH SYSTEMIC LUPUS ERYTHEMATOSUS Annals of the Rheumatic Diseases 78: 764–765.
- 67. Sag E. et al. (2014) Performance of the new SLICC classification criteria in childhood systemic lupus erythematosus: a multicentre study, Clin. Exp. Rheumatol. 32 (3): 440–444.
- 68. Sahasranaman S., Howard D., Roy S. (2008) Clinical pharmacology and pharmacogenetics of thiopurines, Eur. J. Clin. Pharmacol. 64 (8): 753–767.
- 69. Sakthiswary R., Suresh E. (2014) Methotrexate in systemic lupus erythematosus: a systematic review of its effcacy, Lupus 23 (3): 225–235
- 70. Samanta M. et al. (2017) Childhood lupus nephritis: 12 years of experience from a developing country’s perspective, Eur J Rheumatol 4 (3): 178–183.
- 71. Singh J.A. et al. (2016) Risk of serious infections with immunosuppressive drugs and glucocorticoids for lupus nephritis: a systematic review and network meta-analysis, BMC Med. 14 (1): 137
- 72. Smith E.M.D., Lythgoe H., Midgley A. et al. (2019 a) Juvenile-onset systemic lupus erythematosus: update on clinical presentation, pathophysiology and treatment options. Clin Immunol.;209:108274
- 73. Smith E.M.D., Lythgoe H., Hedrich C.M. (2019 b) Vasculitis in juvenile-onset systemic lupus erythematosus, Front. Pediatr. 7: 149.
- 74. Smith E. et al. (2019) Outcomes following mycophenolate mofetil versus cyclophosphamide induction treatment for proliferative juvenile-onset lupus nephritis, Lupus 28 (5): 613–620.
- 75. Tambralli A. et al. (2015) Safety and effcacy of rituximab in childhood-onset systemic lupus erythematosus and other rheumatic diseases, J. Rheumatol. 42 (3): 541–546.
- 76. Taylor R.P., Lindorfer M.A. (2007) Drug insight: the mechanism of action of rituximab in autoimmune disease—the immune complex decoy hypothesis, Nat Clin Pract Rheumatol 3 (2) (2007) 86–95.
- 77. Trachana M. et al., (2013) Safety and effcacy of rituximab in refractory pediatric systemic lupus erythematosus nephritis: a single-center experience of Northern Greece, Rheumatol. Int. 33 (3): 809–813.
- 78. Thorbinson C. et al. (2016) Pharmacological management of childhood-onset systemic lupus erythematosus, Paediatr Drugs 18 (3): 181–195.
- 79. Tsokos G.C. et al. (2016) New insights into the immunopathogenesis of systemic lupus erythematosus, Nat. Rev. Rheumatol. 12 (12): 716–730.
- 80. Van Nostrand E.L., Freese P., Pratt G.A. (2020) A large-scale binding and functional map of human RNA-binding proteins. Nature; 583 (7818):711–719.
- 81. Watson L., Leone V., Pilkington C., Tullus K., Rangaraj S., McDonagh J.E., et al. (2012) Disease activity, severity, and damage in the UK juvenile-onset systemic lupus erythematosus cohort. Arthritis Rheum.;64(7):2356–65
- 82. Watson L., F.G.a.M.B. (2011) Diagnosis and management of juvenile-onset SLE, Paediatr. Child Health 21 (12): 539–545
- 83. Watson L. et al., (2015) The indications, effcacy and adverse events of rituximab in a large cohort of patients with juvenile-onset SLE, Lupus 24 (1): 10–17.
- 84. Watson L. et al. (2012) Disease activity, severity, and damage in the UK Juvenile-Onset Systemic Lupus Erythematosus Cohort, Arthritis Rheum. 64 (7) (2012) 2356–2365.
- 85. Yurkovich M. et al. (2014) Overall and cause-specific mortality in patients with systemic lupus erythematosus: a meta-analysis of observational studies, Arthritis Care Res (Hoboken) 66 (4): 608–616.
- 86. Zulian F. et al. (2008) Severe clinical course of systemic lupus erythematosus in the first year of life, Lupus 17 (9): 780–786.
Ювенильная системная красная волчанка. О чем стоит помнить ревматологу взрослой службы?
Резюме. Обоснование. Ювенильная системная красная волчанка (юСЧВ) — тяжелое редкое мультисистемное аутоиммунное/аутовоспалительное заболевание с дебютом симптомов до 18-летнего возраста, поражает любую систему органов, приводит к их повреждению, вызывая развитие нетрудоспособности и/или смерти. Среди пациентов с системной красной волчанкой (СКВ) больные юСЧВ составляют 15–20%. Методы исследования. На основании литературных данных в статье приведены современные представления об этиологии и патогенезе, описана гетерогенность клинических проявлений и течения юСЧВ; освещены основные трудности в диагностике, в частности разработке диагностических критериев. Представлена сравнительная характеристика существующих классификационных критериев в популяции больных юСЧВ. Терапевтические стратегии в случае юСЧВ преимущественно экстраполированы из взрослой популяции больных. В работе приведена современная терапевтическая тактика при юСЧВ, в том числе с применением препаратов биологической терапии. Выводы. Мультисистемность поражения, характерная для юСЧВ, обусловливает необходимость в курации пациента с привлечением мультидисциплинарной команды, а не только детского ревматолога, и требует соблюдения определенных принципов преемственности со взрослой ревматологической службой при переходе пациентов.
Ключевые слова: ювенильная системная красная волчанка, особенности, клинические симптомы, диагностика, терапия, прогноз.
Адреса для листування:
Білявська Юлія Вікторівна
ДУ ННЦ «Інститут кардіології
імені акад. М.Д.Стражеска» НАМНУ, м. Київ
E-mail: iuliia.biliavska@gmail.com

Leave a comment