РОЛЬ ДІЄТИЧНИХ ФАКТОРІВ У РОЗВИТКУ ТА МОДИФІКАЦІЇ ПЕРЕБІГУ СИСТЕМНОГО ЧЕРВОНОГО ВОВЧАКА
Резюме. Системний червоний вовчак (СЧВ) — одне з найтяжчих системних захворювань сполучної тканини, що розвивається частіше у молодих жінок і дівчат, хоча може виникати в будь-якому віці. Хворі на СЧВ, як і раніше, мають високий ризик смерті (в 3 рази вищий, ніж у загальній популяції). Основою покращення прогнозу при СЧВ вважаються рання діагностика, інтенсифікація базисної терапії та мінімізація дози глюкокортикоїдів (ГК), активне призначення гідроксихлорохіну, контроль побічних ефектів ГК та імуносупресантів, застосування імунобіологічних препаратів, оцінка серцево-судинного ризику та лікування серцево-судинних захворювань. Однак останніми роками з’являються публікації про можливий вплив стану харчування та окремих інгредієнтів їжі на перебіг захворювання. Серед компонентів продуктів харчування вивчається значення насичених і ненасичених жирів, вітамінів, антиоксидантів, алкоголю, продуктів, багатих на клітковину. Найпереконливішу інформацію стосовно можливого впливу на активність та перебіг СЧВ отримано щодо вітаміну D, риб’ячого жиру, алкоголю, зеленого чаю, харчової солі. Саме аналізу літературних даних щодо цих питань присвячено нашу оглядову роботу.
DOI: 10.32471/rheumatology.2707-6970.84.16128
УДК 616–018.2:612.017.1]-036.12–092–036.1:613.24
Системний червоний вовчак (СЧВ) — одне з найтяжчих системних захворювань сполучної тканини, що розвивається частіше у молодих жінок і дівчат, хоча може виникати в будь-якому віці. Хворі на СЧВ, як і раніше, мають високий ризик смерті (в 3 рази вищий, ніж у загальній популяції). Основою покращення прогнозу при СЧВ вважаються рання діагностика, інтенсифікація базисної терапії та мінімізація дози глюкокортикоїдів (ГК), активне призначення гідроксихлорохіну, контроль побічних ефектів ГК та імуносупресантів, застосування імунобіологічних препаратів, оцінка серцево-судинного ризику та лікування серцево-судинних захворювань. Однак останніми роками з’являються публікації про можливий вплив стану харчування та окремих інгредієнтів їжі на перебіг захворювання. Серед компонентів продуктів харчування вивчається значення насичених і ненасичених жирів, вітамінів, антиоксидантів, алкоголю, продуктів, багатих на клітковину. Найпереконливішу інформацію стосовно можливого впливу на активність та перебіг СЧВ отримано щодо вітаміну D, риб’ячого жиру, алкоголю, зеленого чаю, харчової солі. Саме аналізу літературних даних щодо цих питань присвячено нашу оглядову роботу.
Системний червоний вовчак (СЧВ) — хронічне системне захворювання сполучної тканини невідомої етіології, яке розвивається на тлі генетично зумовлених порушень імунорегуляторних процесів і характеризується порушеннями толерантності до аутоантигенів клітинних ядер, цитоплазми й мембран з утворенням аутоантитіл до цих структур, розвитком імунокомплексного запалення та ураженням багатьох органів і систем. При цьому захворюванні можуть уражуватися практично всі органи та системи, прогностично найбільш несприятливим є залучення в процес нирок і центральної нервової системи. За даними метааналізу A. Mak та співавторів (2012) в період 1950–2000 рр. загальний прогноз хворих на СЧВ значно покращився: 5-річна виживаність зросла з 75 до 95%, а 10-річна — з 63 до 91%. Проте підвищення виживаності досягло плато і за останні 2 десятиліття жодних істотних змін в показниках виживаності хворих не відмічено. Причини смерті хворих на СЧВ підрозділяються на ті, які пов’язані з активністю захворювання, ті, які є результатом лікування, та коморбідні стани. Висока активність СЧВ, інфекції, серцево-судинні події та злоякісні новоутворення — найпоширеніші причини смерті серед хворих на СЧВ (Abu-Shakra М., Novack V., 2012). Для СЧВ характерним є бімодальний розподіл смертності: рання (протягом перших 5 років), спричинена активністю СЧВ та інфекційними ускладненнями, та пізня (через 5–10 років від дебюту захворювання), зумовлена в основному серцево-судинними подіями. До факторів, що визначають несприятливий життєвий прогноз при СЧВ, належать негроїдна раса, низький соціально-економічний рівень життя, ураження нирок, антифосфоліпідний синдром, тромбоцитопенія, високі індекси активності (SLEDAI) та ураження (SLICC) тощо.
Системне запалення, терапія глюкокортикоїдами (ГК) і знижена фізична активність можуть підвищити схильність до накопичення жирів, що призводить до зростання рівня прозапальних цитокінів, які можуть викликати загострення СЧВ і підвищити ризик розвитку цукрового діабету, артеріальної гіпертензії, ішемічної хвороби серця. З іншого боку, ці пацієнти можуть недоїдати через прийом імуносупресантів та інших лікарських засобів, які викликають неприємні шлунково-кишкові симптоми, що знижують апетит (Lanna C.C.D. et al., 2008). Крім того, пацієнти з СЧВ перебувають у групі високого ризику зниження мінеральної щільності кісткової тканини, анемії, високого рівня у плазмі крові гомоцистеїну (Shah M. et al., 2004).
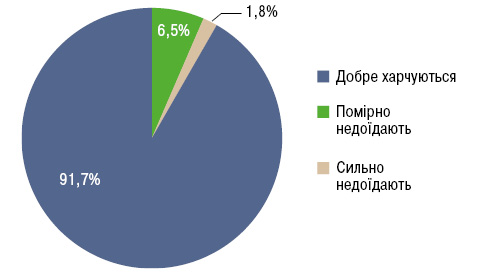
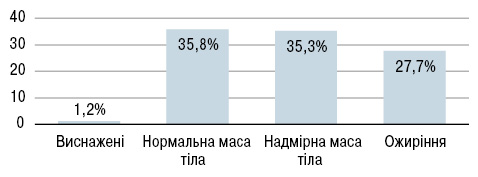
Досить цікавими є результати вивчення загального стану харчування у хворих на СЧВ (Borges M.C. et al., 2012) за суб’єктивною глобальною оцінкою (SGA) та індексом маси тіла (ІМТ). Опитувальник SGA складається з питань про останні зміни маси тіла, шлунково-кишкові симптоми, харчові звички. Прийом їжі оцінювали за напівкількісним опитувальником характеру харчування. Згідно з отриманими результатами (за SGA) 91,7% пацієнтів харчуються добре, 6,5% — помірно недоїдають і 1,8% — сильно недоїдають (рис. 1). Лише 1,8% пацієнтів повідомили про прийом їжі 1–2 рази на день, 75,9% — про 3–4 прийоми їжі, 22,3% — приймали їжу 5–6 разів протягом дня. Серед обстежених 63% мали надмірну масу тіла (ІМТ=25–29,9 кг/м2) або ожиріння (ІМТ≥30 кг/м2), виснаженими (ІМТ≤18,5 кг/м2) були лише 1,2% (рис. 2). Середній ІМТ становив 27,24±5,42 кг/м2.
У 67,2% пацієнтів з нормальною масою тіла і у 75% з надмірною масою тіла або ожирінням енергетична цінність їжі була меншою, ніж енергетичні потреби. Споживання кальцію було недостатнім (<1000 мг/добу) у 92,9% пацієнтів, заліза (<15 мг/добу) — у 36,7% пацієнтів, прийом вітаміну В12 був адекватним (2,4 мкг/добу) лише у половини хворих. Виявлено недостатнє вживання овочів, фруктів і молочних продуктів, тоді як споживання олій і цукрів перевищувало норму (табл. 1).
Таблиця 1. Щоденний прийом компонентів їжі хворими на СЧВ (Borges M.C. et al., 2012)
| Порцій на добу (М, в дужках — діапазон) | Рекомендовано | |
|---|---|---|
| Зернові | 5,8 (4,5–6,8) | 5–9 |
| Овочі | 1,4 (0,6–2,0) | 4–5 |
| Фрукти | 1,4 (0,5–2,0) | 3–5 |
| М’ясо | 1,5 (1,0–2,0) | 1–2 |
| Mолочні продукти | 1,3 (0,4–1,9) | 3 |
| Бобові | 1,3 (1,0–2,0) | 1 |
| Oлії | 3,8 (2,4–4,6) | 1–2 |
| Цукри | 3,4 (0,8–5,0) | 1–2 |
Отже, як випливає з результатів дослідження, більшість хворих на СЧВ харчуються нераціонально. Насамперед це стосується недостатнього споживання кальцію, заліза, вітаміну В12, молочних продуктів і продуктів, багатих на клітковину, а також надмірного споживання жирів і вуглеводів. При цьому енергетична цінність їжі є нижчою від енергетичних потреб. Це наводить на думку, що причиною надмірної маси тіла чи ожиріння у хворих на СЧВ є не надмірне харчування, а його незбалансованість і, ймовірно, недостатня фізична активність, прийом ГК.
Кілька досліджень проводилося для вивчення впливу дієтичних факторів на ризик виникнення СЧВ.
Антиоксиданти, як відомо, захищають тканини від ушкоджень активними формами кисню, що генеруються активованими макрофагами, моноцитами і гранулоцитами, пригнічують активність цитокінів, таких як фактор некрозу пухлини-α (ФНП-α). На мишачих моделях СЧВ додавання до харчового раціону антиоксидантів, у тому числі β-каротину, α-токоферолу, аскорбінової кислоти і селену, призводило до зниження рівня аутоантитіл і підвищувало виживаність (Weimann B.J., Weiser H., 1992). На мишачих моделях показано, що ретиноєва кислота (похідна вітаміну А) інгібує утворення прозапальних Т-хелперів і сприяє продукції протизапальних Т-регуляторних клітин при аутоімунних захворюваннях (Elias K.M., et al., 2008). Відносно мало відомо про вплив споживання антиоксидантів на ініціацію СЧВ у людини. У дослідженні G.W. Comstock та співавторів (1997) проаналізовано зразки сироватки крові за 2–15 років до розвитку СЧВ. Виявилося, що у преморбідних зразках крові рівні α-токоферолу, β-каротину, ретинолу були нижчими, ніж у групі контролю. За даними масштабного проспективного когортного дослідження за участю більше 180 000 жінок (Costenbader K.H. et al., 2010) не отримано жодних доказів зв’язку між надходженням антиоксидантів з харчовими продуктами/добавками і ризиком виникнення СЧВ. Отже, на відміну від результатів експериментальних досліджень, дані про взаємозв’язок між споживанням антиоксидантів та розвитком СЧВ у людини поки що залишаються суперечливими.
Останніми роками з’являється все більше інформації про імуномодулюючу дію вітаміну D. Гормонально активна форма вітаміну D є посередником імунологічних ефектів шляхом зв’язування з ядерними рецепторами вітаміну D (VDR), які наявні в клітинах імунної системи, в основному в моноцитах, активованих макрофагах, NK-клітинах, Т- і В-клітинах, дендритних клітинах (ДК). Більше того, зрілі ДК здатні до локальної генерації активного метаболіту 1,25-D з вітаміну D3 (Arnson Y. et al., 2007). Гормонально активний вітамін D здатен інгібувати диференціацію і дозрівання ДК, диференціацію В-клітин, Т-клітинну проліферацію, секрецію інтерлейкіну-12 (IЛ-12) і ФНП-α, тоді як продукція ІЛ-10 залишається на тому ж рівні (Di Rosa M. et al., 2011).
За результатами дослідження L.T. Hiraki та співавторів (2012) не виявлено асоціації між споживанням вітаміну D в підлітковому віці і ризиком виникнення СЧВ у зрілому віці. Отже, навіть тривале недостатнє надходження вітаміну D не є фактором ризику розвитку СЧВ.
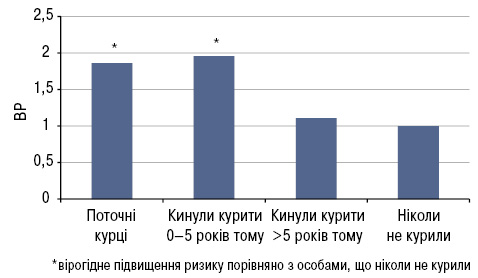
Дещо несподівані результати отримали японські дослідники, які вивчали вплив багатих кофеїном напоїв та алкоголю на можливість виникнення СЧВ (Kiyohara C. et al., 2014). Встановлено, що ризик розвитку СЧВ підвищують вживання чорного чаю (відношення ризиків (ВР) 1,88; 95% довірчий інтервал (ДІ) 1,03–3,41) та кави (ВР 1,57; 95% ДІ 0,95–2,61). Натомість цієї асоціації не виявлено стосовно зеленого чаю, а незначне/помірне вживання алкоголю майже на 70% знижувало ризик розвитку хвороби (ВР 0,33; 95% ДІ 0,20–0,55). Цією ж групою дослідників продемонстровано, що протекторний ефект щодо ризику виникнення СЧВ не залежить від типу алкогольного напою (Kiyohara C. et al., 2012). Принаймні ці закономірності є справедливими для жінок-японок, оскільки в деяких попередніх роботах авторів з інших країн впливу алкоголю на розвиток СЧВ не відмічено (Ghaussy N.O. et al., 2001; Formica M.K. et al., 2003). Принагідно слід відзначити майже одностайність висновків багатьох дослідників щодо високовірогідної асоціації куріння з підвищеним ризиком розвитку СЧВ (ВР за даними різних авторів коливається від 1,60 до 6,69), причому цей вплив зростає при збільшенні стажу куріння і зберігається незалежно від глибини затягування тютюновим димом (Kiyohara C. et al., 2012). Це підтверджується результатами недавнього дослідження М. Barbhaiya та співавторів (2018): курці мають підвищений ризик розвитку СЧВ порівняно з особами, які ніколи не курили (ВР 1,86; 95% ДІ 1,14–3,04), причому цей ризик підвищується вдвічі при тривалості куріння більше 20 років. Жінки зі стажем куріння більше 10 пачко-років мали вищий ризик розвитку СЧВ, ніж ті, що ніколи не курили (ВР 1,60; 95% ДI 1,04–2,45). Але через 5 років після припинення куріння ризик СЧВ перестає бути підвищеним порівняно з особами, що ніколи не курили (ВР 1,11; 95% ДI 0,69–1,79) (рис. 3). Цікаво, що на цій же когорті жінок (Національна служба охорони здоров’я Великобританії — NHS) продемонстровано, що здорове харчування (відповідно до 2010 Alternative Healthy Eating Index) пов’язане з нижчим ризиком розвитку ревматоїдного артриту (РА) у жінок віком молодше 55 років, особливо серопозитивного варіанту (Hu Y. et al., 2017).
За результатами дослідження S. Reid та співавторів (2021) куріння у хворих на СЧВ асоціювалося з підвищенням ризику розвитку інфаркту міокарда (ВР 1,96; 95% ДІ 1,09–3,55), при цьому вираженість цього впливу значно збільшувалася у носіїв однієї (ВР 2,72; 95% ДІ 1,24–6,00) або двох (ВР 8,27; 95% ДІ 1,48–46,27) алелей ризику rs11889341 STAT4 (перетворювач сигналів та активатор транскрипції 4). Крім того, у курців, що були носіями алелі ризику rs11889341 STAT4, відмічено підвищений ризик розвитку люпус-нефриту (ВР 1,47; 95% ДІ 1,06–2,03).
Варто зазначити, що при РА вживання алкоголю та куріння мають схожий вплив на ризик виникнення захворювання, як і при СЧВ. Згідно з результатами недавнього когортного дослідження L. Hedenstierna та співавторів (2021), вживання алкоголю асоціювалося із зниженням ризику РА на 30% (ВР 0,69; 95% ДІ 0,55–0,86) з достовірним дозозалежним ефектом. Натомість куріння асоціювалося з підвищенням ризику РА (ВР 2,80; 95% ДІ 1,96–4,01), проте вираженість цього впливу зменшувалася при супутньому вживанні алкоголю (ВР 1,45; 95% ДІ 1,21–1,74). До речі, останніми роками активно вивчають вплив алкоголю не тільки на ризик виникнення, але й на активність ревматологічних захворювань. Так, у проспективному дослідженні M. Turk та співавторів (2021) аналізували вплив вживання алкоголю на активність запальних артритів (РА, псоріатичний артрит, анкілозивний спондиліт). Виявлено, що хворі чоловічої статі вживали алкоголь у достовірно більшій кількості (6 (1–12) одиниць/тиждень), ніж жінки (2 (0–6) одиниць/тиждень) (р<0,001). Вживання алкоголю >15 одиниць/тиждень асоціювалося з низькою активністю захворювання (ВР 6,2; 95% ДІ 3,6–8,8; p=0,05). Після корекції за статтю ця асоціація втрачалася, проте після корекції за вживанням алкоголю зберігався достовірний вплив чоловічої статі на ремісію захворювання (ВР 6,1; 95% ДІ 3,2–11,8; p<0,0001).
Значна кількість досліджень довела вплив окремих компонентів їжі на активність і перебіг СЧВ. Зокрема, встановлено зв’язок між сироватковим рівнем вітаміну D і активністю захворювання (Petri M. et al., 2013). У табл. 2 наведено дані кількох попередніх досліджень щодо взаємозв’язку між рівнем вітаміну D та активністю СЧВ, всі вони свідчать про наявність такої залежності.
Taблиця 2. Результати досліджень зв’язку активності СЧВ з рівнем вітаміну D (Petri M. et al., 2013)
| Автори дослідження | Рік | Кількість пацієнтів з СЧВ | Оцінка активності СЧВ | Вірогідність зв’язку |
|---|---|---|---|---|
| Borba V.Z. et al. | 2009 | 36 | SLEDAI | р = 0,0005 |
| Amital H. et al. | 2010 | 378 | SLEDAI | р = 0,018 |
| Bonakdar Z.S. et al. | 2011 | 40 | BILAG | р = 0,001 |
| Yeap S.S. et al. | 2011 | 38 | SLEDAI | р = 0,033 |
Примітка. SLEDAI — Systemic Lupus Erythematosus Disease Activity Index, BILAG — British Isles Lupus Assessment Group.
У кількох дослідженнях останніх років уточнено взаємозв’язок між рівнем вітаміну D й активністю захворювання у пацієнтів з СЧВ. Статус вітаміну D в організмі оцінюють переважно за сироватковим рівнем 25(OH)Д — основного метаболіту вітаміну D, наявного в крові. Існують дві основні форми 25(OH)D — холекальциферол (вітамін D3) та ергокальциферол (вітамін D2). Вітамін D3 утворюється головним чином у шкірі під дією ультрафіолетових променів і в незначній кількості надходить з їжею тваринного походження (риб’ячий жир, печінка, яєчний жовток), тоді як джерелом D2 слугує тільки рослинна їжа. Концентрація 25(OH)D відображає вміст обох цих компонентів.
Згідно з результатами дослідження S.M. Attar (2013), середній рівень 25(OH)D у хворих на СЧВ був зниженим і становив 23,9 нг/мл при нормі 30–80 нг/мл. У 87% хворих була недостатність 25(OH)D, серед них 48% мали рівень 25(OH)D <25 нг/мл. Недостатність 25(OH)D виявлено у 90% пацієнтів з активним СЧВ і у 85% пацієнтів з неактивним захворюванням. Середні величини цього метаболіту становили 22,3 нг/мл у пацієнтів з активною хворобою проти 25,0 нг/мл у пацієнтів з неактивним СЧВ. У осіб, позитивних за антитілами до двоспіральної ДНК (анти-дсДНК), рівень 25(OH)D був у середньому вдвічі нижчим порівняно з хворими, у яких ці антитіла не виявляли чи результат був сумнівним. Відмічені негативна кореляція між 25(OH)D і титром анти-дсДНК та позитивна кореляція між 25(OH)D та активністю комплементу C4.
K. Sumethkul та співавтори (2013) досліджували асоціацію між концентрацією вітаміну D і вовчаковим нефритом (ВН) шляхом визначення рівнів 25(ОН)D у хворих з неактивним СЧВ, активним СЧВ без ВН і активним СЧВ із ВН. Середній рівень 25(OH)D в 1-й групі становив 28,3 нг/мл, у 2-й — 26,7, у 3-й — 19,9 нг/мл. Дефіцит вітаміну D виявлено в 11,1% пацієнтів 1-ї групи, 22,2% — 2-ї та 55,6% — 3-ї групи. Отже, хворі на СЧВ з ВН мають значно нижчий рівень вітаміну D порівняно з хворими з неактивним СЧВ і активним СЧВ без ВН.
Визначено кілька чинників, що можуть призвести до дефіциту вітаміну D у хворих на СЧВ: уникнення сонячного світла для запобігання загостренням; зниження синтезу 1,25(OH)2D при ВН внаслідок зниження активності 1α-гідроксилази; прийом препаратів, таких як ГК, гідроксихлорохін і протисудомні засоби, які прискорюють метаболізм 25(OH)D; наявність аутоантитіл до вітаміну D (Le Goaziou M.F. et al., 2011).
На відміну від інших вітамінів, надходження вітаміну D з їжею (яйця, риба, молочні продукти) забезпечує лише близько 100 МО з рекомендованих 600 МО/добу (Lane N.E., 2010). Тому рекомендованими є препарати вітаміну D: ергокальциферол (D2) та холекальциферол (D3). Дослідження показали, що вітамін D3 підвищує рівень сироваткового 25(ОН)D ефективніше, ніж вітамін D2. Отже, вітамін D3 є кращою формою для клінічного застосування (Armas L.A. et al., 2004).
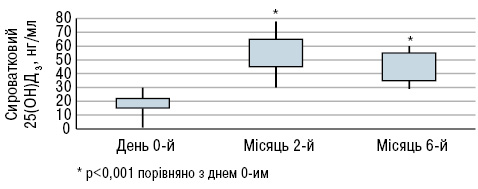
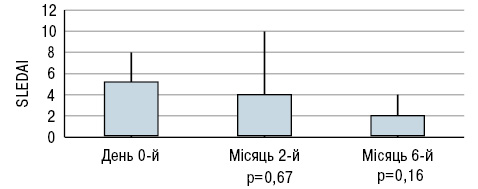
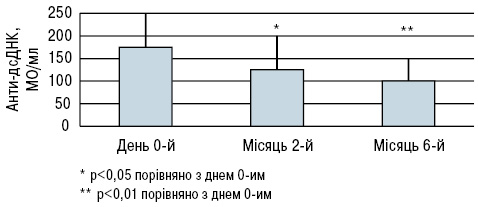
Під час дослідження B. Terrier та співавторів (2012) 20 пацієнтів з СЧВ і гіповітамінозом D приймали 100 000 МО холекальциферолу на тиждень протягом 4 тиж, потім 100 000 МО холекальциферолу на місяць протягом 6 міс. Рівні сироваткового 25(ОН)D різко зросли з 18,7±6,7 в день 0-й до 51,4±14,1(p<0,001) на 2-й місяць і 41,5±10,1 нг/мл (p<0,001) на 6-й місяць (рис. 4), тоді як рівні кальцію і фосфору в крові істотно не змінилися. Активність захворювання за SLEDAI знизилася з 2,9±2,5 в день 0-й до 2,6±2,5 на 2-й місяць і 1,9±1,8 (зміни недостовірні) на 6-й місяць (рис. 5). Рівень фракції комплементу С3 залишався стабільним протягом періоду спостереження, тоді як рівень анти-дсДНК знизився з 177±63 в день 0-й до 124±67 (p<0,05) на 2-й місяць і 103±36 МО/мл (p<0,01) на 6-й місяць (рис. 6).
Вплив вітаміну D на співвідношення й абсолютне число лімфоцитів периферичної крові показаний на рис.7–9. Так, вітамін D3 індукує збільшення кількості CD4+ і CD3+ Т-клітин, зменшення CD19+ В-клітин пам’яті (p<0,05) (Terrier B. et al., 2012).
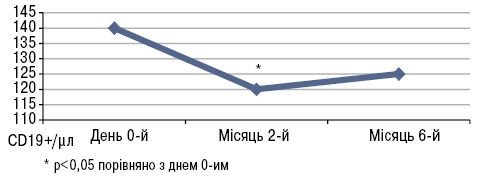
Згідно з результатами дослідження регулярне вживання добавок вітаміну D сприяє зниженню активності захворювання, збільшенню CD4+ і CD3+ Т-клітин, зниженню рівня анти-дсДНК.
Отже, існує зворотний кореляційний зв’язок між рівнем вітаміну D й активністю СЧВ, і усунення дефіциту цього вітаміну супроводжується зниженням активності захворювання. Тому визначення концентрації вітаміну D і, за потреби, призначення холекальциферолу є невід’ємними складовими ведення хворих на СЧВ.
Останніми роками з’являється все більше публікацій про антиоксидантну дію сухого червоного вина, до складу якого входить ресвератрол. Ресвератрол є природною поліфенольною сполукою, що міститься у значній кількості в шовковиці, арахісі, винограді, червоному вині (Renaud S., de Lorgeril M. 1992; Nakata R. et al., 2012). Ресвератрол викликав значний дослідницький інтерес у зв’язку з виявленням його кардіопротекторних властивостей (Bradamante S. et al., 2004; Csiszar A. et al., 2009). Вживання червоного вина частково пояснює «французький парадокс» — низький рівень захворюваності на ішемічну хворобу серця у Франції (Kopp P., 1998). Доведено також протизапальну, імунорегуляторну, антиоксидантну і ліпідорегулюючу дію ресвератролу (Bereswill S. et al., 2010). Крім того, дослідження показали, що ресвератрол може інгібувати декілька експериментальних аутоімунних захворювань, у тому числі колаген-індукований артрит, енцефаломієліт, коліт і діабет (Imler T.J., Petro T.M., 2009). Ресвератрол є активатором білка SIRT1, дефіцит якого призводить до розвитку аутоімунного синдрому у мишей, що проявляється високим титром антинуклеарних антитіл в сироватці, осадженням імуноглобулінів у нирках і розвитком імунокомплексного гломерулонефриту (Zhang J. et al., 2009). Показано, що ресвератрол може модулювати запальні гени і сигнальні транскрипційні фактори, які відіграють вирішальну роль у патогенезі СЧВ (Nakata R. et al., 2012).
Дослідники Пекінського університету вивчали вплив ресвератролу на перебіг пристан-індукованого вовчака на мишачих моделях (Wang Z.-W. et al., 2014). Виявлено нижчий рівень протеїнурії (p<0,05) та менш виражене ураження клубочків нирок у мишей, яким вводили ресвератрол, порівняно з модельною контрольною групою (рис. 10).
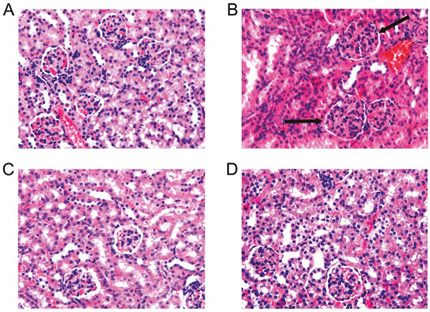
Ступінь осадження IgG та IgM (рис. 11) в нирках у мишей, яким вводили ресвератрол, був значно нижчим, ніж у модельної контрольної групи (p<0,05). Це свідчить, що ресвератрол знижує інтенсивність пристан-індукованого нефриту.
Також встановлено, що ресвератрол здатен інгібувати проліферацію В-клітин in vitro (p<0,0001; рис. 12). При культивуванні за наявності ресвератролу виявлено зниження продукції IgG, IgM і IgA (p<0,0001). Також виявили інгібуючу дію ресвератролу на проліферацію CD4+ клітин та індукцію їх апоптозу in vitro (p<0,05).
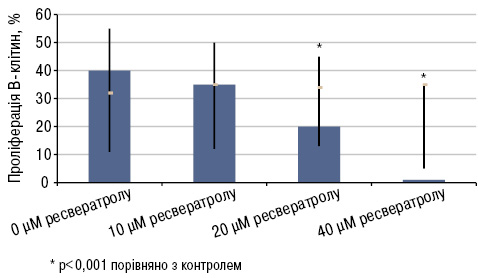
Оскільки CD4+ Т-клітини і В-клітини тісно пов’язані з патогенезом СЧВ (Hoffman R.W., 2004), а ресвератрол чинить інгібуючу дію на CD4+ Т-клітини і В-клітини (Zou T. et al., 2013), а також знижує інтенсивність люпус-нефриту, можна припустити, що ресвератрол може бути корисним при лікуванні хворих на СЧВ.
Вивчався також вплив омега-3 жирних кислот, які є потужними антиоксидантами, а тому їх недостатність може бути пов’язана з оксидативним стресом, запаленням, активністю захворювання і втомою, яка турбує 86% хворих на СЧВ (Zonana-Nacach A. et al., 2000). Проведено рандомізоване контрольоване дослідження для оцінки впливу додаткового постачання омега-3 жирних кислот шляхом вживання риб’ячого жиру на ступінь втоми, якість життя та активність захворювання (Arriens C. et al., 2015). Оцінка проводилася за шкалами RAND Short Form-36 (RAND SF-36), Fatigue Severity Scale (FSS), SLE Disease Activity Index (SLEDAI), Physician Global Assessment (PGA).
Оцінка за шкалами енергія/втомлюваність (Energy/fatigue subscale of Rand SF-36) та емоційне благополуччя (Emotional well-being) показала тенденцію до поліпшення в групі хворих, що вживали риб’ячий жир, порівняно з групою плацебо (p>0,05; рис. 13).
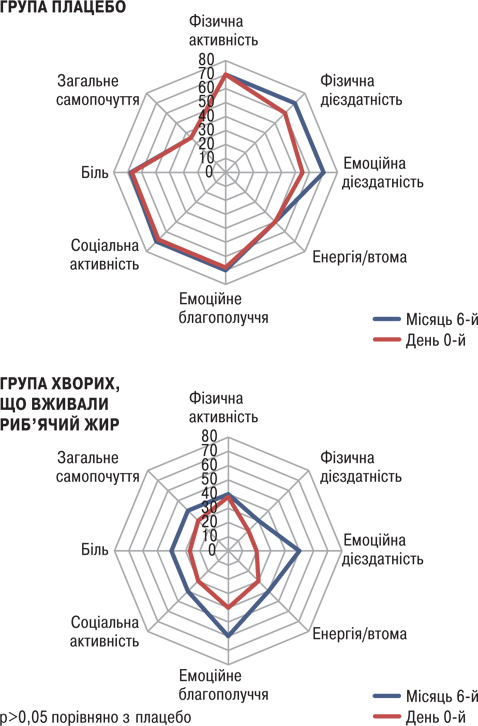
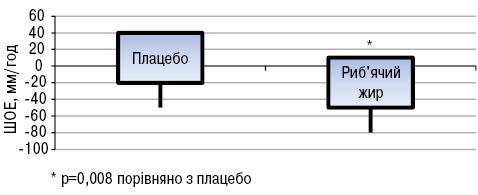
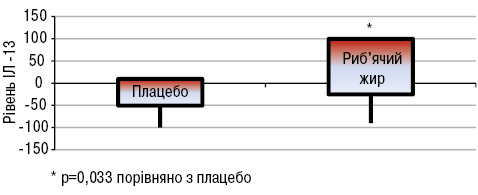
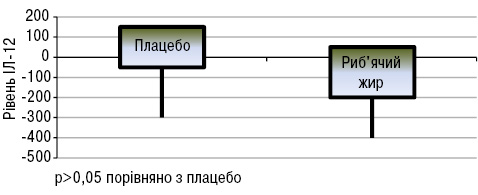
Зміни FSS були дуже схожими в обох групах. При оцінці активності захворювання встановлено, що у пацієнтів, які вживали риб’ячий жир, виявлено зниження загальної активності хвороби за PGA порівняно з групою плацебо (p<0,05). Натомість зміни SELENA-SLEDAI не вказували на значну різницю між двома групами. Виявлено значно нижчі рівні швидкості осідання еритроцитів (ШОЕ) (p<0,05) в групі хворих, що вживали риб’ячий жир, порівняно з групою плацебо (рис. 14). Що стосується цитокінів/хемокінів/факторів росту, то у хворих, що вживали риб’ячий жир, відмічали підвищення рівня IЛ-13 (p<0,05; рис. 15) та тенденцію до зниження рівня IЛ-12 (p>0,05; рис. 16).
Експериментальні дослідження показали, що омега-3 жирні кислоти можуть підвищувати рівень адипонектину за рахунок впливу на фактор транскрипції рецептора проліферації пероксисом (PPAR) (Banga A. et al., 2009). Доведено, що дефіцит адипонектину у мишачих моделей СЧВ призводить до більш тяжкого перебігу хвороби порівняно з контрольною групою (Parker J. et al., 2011). Натомість при дефіциті лептину знижувалася інтенсивність T- і В-клітинноопосередкованого запалення в різних моделях захворювань (Wislowska M. et al., 2008). За даними M.A.B. Lozovoy та співавторів (2015), у хворих на СЧВ, які вживали риб’ячий жир протягом 4 міс, підвищувався рівень адипонектину (p<0,05; рис.17) та знижувався рівень лептину (p<0,05; рис.18), тоді як не виявлено жодних відмінностей у рівнях адипонектину і лептину у хворих на СЧВ, які не вживали риб’ячого жиру.
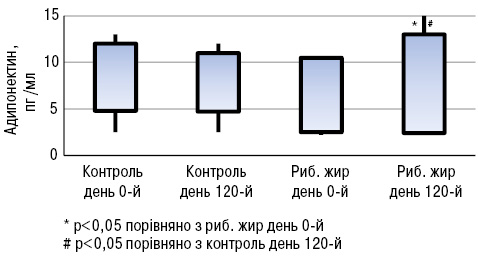
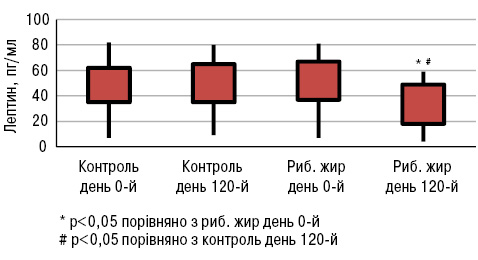
Отже, ці дослідження доводять позитивний вплив вживання риб’ячого жиру на якість життя хворих на СЧВ: зменшення втоми і болю, покращення фізичної та емоційної дієздатності. Крім того, знижується рівень прозапальних цитокінів і лептину, а рівень протизапальних цитокінів та адипонектину підвищується.
Слід враховувати, що на якість емоційного здоров’я хворих на СЧВ може також впливати прийом ГК. Доведено, що прийом навіть низьких доз ГК (≤7,5 мг/добу) асоціюється з порушенням емоційного здоров’я (насамперед за рахунок тривожності та депресії) у хворих на СЧВ, у тому числі з низькою активністю захворювання (Miyawaki Y. et al., 2021).
Останніми роками внаслідок зміни харчових звичок і популярності фаст-фуду значно збільшилася кількість вживаної солі. Середнє споживання солі на добу у світі коливається у діапазоні 9–12 г, тоді як для задоволення добової потреби в натрії достатньо 3,75 г (Sigaux J. et al., 2018). Все більше досліджень вивчають вплив харчової солі на перебіг аутоімунних захворювань (Sharif K. et al., 2018). Зокрема, доведено (Scrivo R. et al., 2017), що у хворих на СЧВ при режимі харчування з обмеженим вживанням солі (<5 г/добу) значно знижувалася кількість T-хелперів 17 (р=0,01) та збільшувалася кількість регуляторних T-клітин (р=0,02), а також знижувався рівень ІЛ-9 (р=0,03). І навпаки, на мишачих моделях СЧВ продемонстровано, що надмірне вживання солі призводило до прогресування пошкодження клубочків нирок, підвищення рівня протеїнурії, анти-дсДНК, TGF-β і співвідношення Th17/Treg, що супроводжувалося зниженням показників виживаності (Yang X. et al., 2015). Отже, хворим на СЧВ варто обмежити вживання солі до рекомендованого рівня <5 г/добу.
За результатами рандомізованого контрольованого дослідження Z. Shamekhi та співавторів (2017) доведено позитивний вплив вживання екстракту зеленого чаю на перебіг СЧВ за рахунок зниження активності захворювання (р<0,004), покращення якості життя (р<0,006) та загального самопочуття (р<0,01). За даними P. Khajehdehi та співавторів (2012), споживання куркуми знижує рівень протеїнурії, гематурії та систолічний артеріальний тиск у пацієнтів з люпус-нефритом.
Як певне узагальнення даних про роль харчових інгредієнтів в модифікації активності СЧВ може розглядатися дослідження шведських фахівців (Lourdudoss C. et al., 2016) з вивчення зв’язку між характером харчування та інтенсивністю терапії ГК як непрямого показника активності СЧВ. Більше споживання вітаміну D з продуктами харчування достовірно асоціювалося з більшою потребою у терапії ГК (ВР 2,70–2,85; 95% ДІ 1,00–8,11). Але коли в аналіз внесли поправку на прийом препаратів вітаміну D і кальцію, ця асоціація перестала бути статиcтично значущою. Отже, протекторний ефект вітаміну D у пацієнтів з СЧВ залишається під питанням. Помірне вживання алкоголю, навпаки, асоціювалося з меншою потребою в терапії ГК (ВР 0,28–0,39; 95% ДІ 0,10–0,98). Це співпадає з результатами попередніх досліджень, в яких показано, що помірне вживання алкоголю знижує ризик розвитку СЧВ. Споживання продуктів, багатих на β-каротин, поліненасичені жирні кислоти і вітамін В6, було зворотно пов’язане з підтриманням/підвищенням дози ГК (ВР 0,29–0,30; 95% ДІ 0,10–0,90), що вказує на можливі протекторні ефекти цих нутрієнтів (антиоксидантний, протизапальний) у патогенезі СЧВ. Загальна калорійність раціону асоціювалася з вищими дозами ГК (>5 і >7,5 мг/добу), що автори дослідження пояснюють властивістю ГК посилювати апетит та їх анаболічним ефектом.
Отже, це дослідження підтвердило, що споживання вітаміну D не зменшує потребу в ГК. Натомість β-каротин, жирні кислоти і вітамін B6 можуть сприяти зниженню дози ГК. Зворотний зв’язок між споживанням алкоголю і прийомом ГК добре співвідноситься з даними про зв’язок між помірним споживанням алкоголю і зниженням ризику розвитку СЧВ. Зв’язок між більшою кількістю споживаної їжі і більш високими дозами ГК може бути зумовлений впливом ГК на підвищення апетиту.
ВИСНОВКИ
Cтан харчування і прийому їжі у пацієнтів з CЧВ може втручатися в хід захворювання, а також підвищувати чи знижувати ризик його виникнення. Зокрема, вживання кави і чорного чаю у великій кількості може підвищити ризик виникнення СЧВ, а вживання алкоголю у невеликій кількості — знизити. Регулярне вживання холекальциферолу і риб’ячого жиру не тільки покращує якість життя хворих, а й сприяє зниженню активності захворювання, затримує прогресування атеросклерозу. Сухе червоне вино, шовковиця, арахіс, виноград є корисними для хворих на СЧВ за рахунок імунорегуляторної, антиоксидантної і нефропротекторної дії ресвератролу. Вживання зеленого чаю покращує якість життя і знижує активність захворювання у хворих на СЧВ, а споживання куркуми знижує рівень протеїнурії та гематурії при люпус-нефриті. Натомість вживання солі хворим на СЧВ рекомендовано обмежити до 5 г/добу.
Отже, корекція харчування у хворих на СЧВ має важливе значення, оскільки таким чином можна пом’якшити перебіг захворювання й уникнути виникнення ускладнень з боку серцево-судинної, сечовидільної й опорно-рухової систем.
Список використаної літератури
- 1. Al M., Ng L., Tyrrell P., Bargman J. et al. (2009) Adipokines as novel biomarkers in paediatric systemic lupus erythematosus. Rheumatology, 48(5): 497–501.
- 2. Armas L.A., Hollis B.W., Heaney R.P. (2004) Vitamin D2 is much less effective than vitamin D3 in humans. J. Clin. Endocrinol. Metab., 89(11): 5387–5391.
- 3. Arnson Y., Amital H., Shoenfeld Y. (2007) Vitamin D and autoimmunity: new aetiological and therapeutic considerations. Ann. Rheum. Dis., 66(9): 1137–1142.
- 4. Arriens C., Hynan L.S., Lerman R.H. et al. (2015) Placebo-controlled randomized clinical trial of fish oil’s impact on fatigue, quality of life, and disease activity in Systemic Lupus Erythematosus. Nutrition Journal, 14(82).
- 5. Attar S.M., Siddiqui A.M. (2013) Vitamin D Deficiency in Patients with Systemic Lupus Erythematosus. Oman Medical Journal, 28(1): 42–47.
- 6. Banga A., Unal R., Tripathi P. et al. (2009) Adiponectin translation is increased by the PPARy agonists pioglitazone and ω-3 fatty acids. Am. J. Physiol. Endocrinol. Metab., 296(3): 480–489.
- 7. Barbhaiya M., Tedeschi S.K., Lu B. et al. (2018) Cigarette smoking and the risk of systemic lupus erythematosus, overall and by anti-double stranded DNA antibody subtype, in the Nurses’ Health Study cohorts. Annals of the Rheumatic Diseases, 77: 196–202.
- 8. Bello K.J., Fang H., Fazeli P. et al. (2013) Omega-3 in SLE: a double- blind, placebo-controlled randomized clinical trial of endothelial dysfunction and disease activity in systemic lupus erythematosus. Rheumatol Int., 33(11): 2789–2796.
- 9. Bereswill S., Munoz M., Fischer A. et al. (2010) Anti-inflammatory effects of resveratrol, curcumin and simvastatin in acute small intestinal inflammation. PLoS One 5, 5(12): e15099.
- 10. Borges M.C., Santos F.M.M., Telles R.W. et al. (2012) Nutritional status and food intake in patients with systemic lupus erythematosus. Nutrition, 28(11–12): 1098–1103.
- 11. Bradamante S., Barenghi L., Villa A. (2004) Cardiovascular protective effects of resveratrol. Cardiovasc Drug Rev., 22(3): 169–188.
- 12. Comstock G.W., Burke A.E., Hoffman S.C. (1997) Serum concentrations of alpha tocopherol, beta carotene, and retinol preceding the diagnosis of rheumatoid arthritis and systemic lupus erythematosus. Ann Rheum Dis., 56(5): 323–325.
- 13. Costenbader K.H., Kang G.H., Karlson E.W. (2010) Antioxidant Intake and Risks of Rheumatoid Arthritis and Systemic Lupus Erythematosus in Women. American Journal of Epidemiology, 172(2): 205–216.
- 14. Csiszar A., Labinskyy N., Olson S. et al. (2009) Resveratrol prevents monocrotaline-induced pulmonary hypertension in rats. Hypertension, 54(3): 668–675.
- 15. Cutillas-Marco E., Morales-Suárez-Varela M., Marquina-Vila A. et al. (2010) Serum 25-hydroxyvitamin D levels in patients with cutaneous lupus erythematosus in a Mediterranean region. Lupus, 19(7): 810–814.
- 16. Denny M.F. (2010) A distinct subset of proinflammatory neutrophils isolated from patients with systemic lupus erythematosus induces vascular damage and synthesizes type I IFNs. The Journal of Immunology, 184(6): 3284–3297.
- 17. Detsky A.S., Mclaughlin J.R., Baker J.P. et al. (1987) What is subjective global assessment of nutritional status?. JPEN, 11(1): 8–13.
- 18. Di Rosa M., Malaguarnera M., Nicoletti F. et al. (2011) Vitamin D3: a helpful immuno-modulator. Immunology, 134(2): 123–139.
- 19. Elias K.M., Laurence A., Davidson T.S. et al. (2007) Retinoic acid inhibits Th17 polarization and enhances FoxP3 expression through a Stat-3/Stat-5 independent signaling pathway. Blood, 111(3): 1013–1020.
- 20. Elkan A.C., Anania C., Gustafsson T. et al. (2012) Diet and fatty acid pattern among patients with SLE: associations with disease activity, blood lipids and atherosclerosis. Lupus, 21(13): 1405–1411.
- 21. Hedenstierna L., Bellocco R., Ye W. et al. (2021) Effects of alcohol consumption and smoking on risk for RA: results from a Swedish prospective cohort study. RMD Open, 7: e001379.
- 22. Hiraki L.T., Munger K.L., Costenbader K.H. et al. (2012) Dietary Intake of Vitamin D during Adolescence and Risk of Adult onset Systemic Lupus Erythematosus and Rheumatoid Arthritis. Arthritis Care & Research, 64(12): 1829–1836.
- 23. Hoffman R.W. (2004) T cells in the pathogenesis of systemic lupus erythematosus. Clin Immunol., 113(1): 4–13.
- 24. Hu Y., Sparks J.A., Malspeis S. et al. (2017) Long-term dietary quality and risk of developing rheumatoid arthritis in women. Annals of the Rheumatic Diseases, 76: 1357–1364.
- 25. Imler T.J., Petro T.M. (2009) Decreased severity of experimental autoimmune encephalomyelitis during resveratrol administration is associated with increased IL−17+IL−10+ T cells, CD4(−) IFN-gamma+ cells, and decreased macrophage IL-6 expression. Int. Immunopharmacol., 9(1): 134–143.
- 26. Khajehdehi P., Zanjaninejad B., Aflaki E. et al. (2012) Oral supplementation of turmeric decreases proteinuria, hematuria, and systolic blood pressure in patients suffering from relapsing or refractory lupus nephritis: a randomized and placebo-controlled study. J. Ren. Nutr., 22(1): 50–7.
- 27. Kiyohara C., Washio M., Horiuchi T. et al. (2012) Cigarette smoking, alcohol consumption, and risk of systemic lupus erythematosus: a case-control study in a Japanese population. The Journal of Rheumatology, 39(7): 1363–1370.
- 28. Kiyohara C., Washio M., Horiuchi T. et al. (2014) Modifying effect of N-acetyltransferase 2 genotype on the association between systemic lupus erythematosus and consumption of alcohol and caffeine-rich beverages. Arthritis Care&Research, 66(7): 1048–1056.
- 29. Kopp P. (1998) Resveratrol, a phytoestrogen found in red wine. A possible explanation for the conundrum of the “French paradox”?. Eur. J. Endocrinol., 138(6): 619–620.
- 30. Lane N.E. (2010) Vitamin D and Systemic Lupus Erythematosus: Bones, Muscles, and Joints. Current Rheumatology Reports, 12(4): 259–263.
- 31. Le Goaziou M.F., Contardo G., Dupraz C. et al. (2011) Risk factors for vitamin D deficiency in women aged 20–50 years consulting in general practice: a cross-sectional study. Eur. J. Gen. Pract., 17(3): 146–152.
- 32. Lourdudoss C., Hafström I., Frostegård J. et al. (2016) The association between diet and glucocorticoid treatment in patients with SLE. Lupus Sci. Med., 3(1): e000135.
- 33. Lozovoy M.A.B., Simão A.N.C., Morimoto H.K. et al. (2015) Fish Oil N-3 Fatty Acids Increase Adiponectin and Decrease Leptin Levels in Patients with Systemic Lupus Erythematosus. Marine Drugs, 13(2): 1071–1083.
- 34. Maruotti N., Cantatore F.P. (2010) Vitamin D and the immune system. The Journal of Rheumatology, 37(3): 491–495.
- 35. McMahon M., Skaggs B.J., Sahakian L. et al. (2011) High plasma leptin levels confer increased risk of atherosclerosis in women with systemic lupus erythematosus, and are associated wirth inflammatory oxidesed lipids. Annals of the Rheumatic Diseases, 70(9): 1619–1624. Nakata R., Takahashi S., Inoue H. (2012) Recent advances in the study on resveratrol. Biol Pharm Bull., 35(3): 273–279.
- 36. Miyawaki Y., Shimizu S., Ogawa Y. et al. (2021) Association of glucocorticoid doses and emotional health in lupus low disease activity state (LLDAS): a cross-sectional study. Arthritis Res Ther 23, 79.
- 37. Nossent J. (2007) Current causes of death in systemic lupus erythematosus in Europe, 2000–2004: relation to disease activity and damage accrual. Lupus, 16(5): 309–317.
- 38. Parker J., Menn-Josephy H., Laskow B. et al. (2011) Modulation of lupus phenotype by adiponectin deficiency in autoimmune mouse models. J. Clin. Immunol., 31(2): 167–173.
- 39. Petri M., Bello K.J., Fang H. et al. (2013) Vitamin D in SLE: Modest Association with Disease Activity and Urine Protein-to-Creatinine Ratio. Arthritis & Rheumatology, 65(7): 1865–1871.
- 40. Reid S., Hagberg N., Sandling J.K. et al. (2021) Interaction between the STAT4 rs11889341 (T) risk allele and smoking confers increased risk of myocardial infarction and nephritis in patients with systemic lupus erythematosus. Ann. Rheum. Dis.; 0:1–7.
- 41. Renaud S., de Lorgeril M. (1992) Wine, alcohol, platelets, and the French paradox for coronary heart disease. Lancet, 339(8808): 1523–1526.
- 42. Scrivo R., Massaro L., Barbati C. et al. (2017) The role of dietary sodium intake on the modulation of T helper 17 cells and regulatory T cells in patients with rheumatoid arthritis and systemic lupus erythematosus. PLoS One, 12(9): e0184449.
- 43. Shah M., Adams-Huet B., Kavanaugh A. et al. (2004) Nutrient intake and diet quality in patients with systemic lupus erythematosus on a culturally sensitive cholesterol lowering dietary program. J. Rheumat., 31: 71–75.
- 44. Shamekhi Z., Amani R., Habibagahi Z. et al. (2017) A Randomized, Double-blind, Placebo-controlled Clinical Trial Examining the Effects of Green Tea Extract on Systemic Lupus Erythematosus Disease Activity and Quality of Life. Phytother. Res., 31(7): 1063–1071.
- 45. Sharif K., Amital H., Shoenfeld Y. (2018) The role of dietary sodium in autoimmune diseases: The salty truth. Autoimmun Rev., 17(11):1069–1073.
- 46. Sharma S., Chopra K., Kulkarni S.K. et al. (2007) Resveratrol and curcumin suppress immune response through CD28/CTLA-4 and CD80 co-stimulatory pathway. Clinical & Experimental Immunology, 147(1): 155–163.
- 47. Sigaux J., Semerano L., Favre G. et al. (2018) Salt, inflammatory joint disease, and autoimmunity. Joint Bone Spine, 85(4): 411–416.
- 48. Somers E.C., Marder W., Cagnoli P. et al. (2014) Population-based incidence and prevalence of systemic lupus erythematosus: the michigan lupus epidemiology and surveillance program. Arthritis Rheumatology, 66(2): 369–378.
- 49. Sumethkul K., Boonyaratavej S., Kitumnuaypong T. et al. (2013) The predictive factors of low serum 25-hydroxyvitamin D and vitamin D deficiency in patients with systemic lupus erythematosus. Rheumatology International., 33(6): 1461–1467.
- 50. Takvorian S.U., Merola J.F., Costenbader K.H. (2014) Cigarette smoking, alcohol consumption and risk of systemic lupus erythematosus. Lupus, 23(6): 537–544.
- 51. Terrier B., Derian N., Schoindre Y. et al. (2012) Restoration of regulatory and effector T cell balance and B cell homeostasis in systemic lupus erythematosus patients through vitamin D supplementation. Arthritis Research & Therapy, 14(5): R221.
- 52. Turk M., Murray K., Alammari Y. et al. (2021) The effects of alcohol consumption and its associations with disease activity among 979 patients with inflammatory arthritis. RMD Open, 7: e001510.
- 53. Vadacca M., Margiotta D., Rigon A. et al. (2009) Adipokines and systemic lupus erythematosus: Relationship with metabolic syndrome and cardiovascular disease risk factors. The Journal of Rheumatology, 36(2): 295–297.
- 54. Wang J., Pan H.F., Ye D.Q. et al. (2008) Moderate alcohol drinking might be protective for systemic lupus erythematosus: a systematic review and meta-analysis. Clinical Rheumatology, 27(12): 1557–1563.
- 55. Wang Z.-W., Luo X.-F., Li M.-T. et al. (2014) Resveratrol Possesses Protective Effects in a Pristane-Induced Lupus Mouse Model. PLos One, 9(12): e114792.
- 56. Weimann B.J., Weiser H. (1992) Effects of antioxidant vitamins C, E, and beta-carotene on immune functions in MRL/lpr mice and rats. Ann N Y Acad Sci., 669(1): 390–392.
- 57. Wislowska M., Rok M., Stepien K. et al. (2008) Serum leptin levels in systemic lupus erythematosus. Rheumatol. Int., 28(5): 467–473.
- 58. Wu T., Xie C., Han J. et al. (2012) Metabolic disturbances associated with systemic lupus erythematosus. PLoS One, 7(6): e37210.
- 59. Xuzhu G., Komai-Koma M., Leung B.P. et al. (2012) Resveratrol modulates murine collagen-induced arthritis by inhibiting Th17 and B-cell function. Annals of the Rheumatic Diseases, 71(1): 129–135.
- 60. Yang X., Yao G., Chen W. et al. (2015) Exacerbation of lupus nephritis by high sodium chloride related to activation of SGK1 pathway. Int Immunopharmacol, 29(2): 586–573.
- 61. Zhang J., Lee S.M., Shannon S. et al. (2009) The type III histone deacetylase Sirt1 is essential for maintenance of T cell tolerance in mice. J Clin Invest., 119(10): 3048–3058.
- 62. Zonana-Nacach A., Roseman J.M., McGwin Jr. G. et al. (2000) Systemic lupus erythematosus in three ethnic groups. VI: Factors associated with fatigue within 5 years of criteria diagnosis. LUMINA Study Group. LUpus in MInority populations: NAture vs Nurture. Lupus, 9(2): 101–109.
- 63. Zou T., Yang Y., Xia F. et al. (2013) Resveratrol Inhibits CD4+ T Cell Activation by Enhancing the Expression and Activity of Sirt1. PLoS One, 8(9): e75139.
Роль диетических факторов в развитии и модификации течения системной красной волчанки
Национальный медицинский университет имени А.А. Богомольца, Киев
Резюме. Системная красная волчанка (СКВ) — одно из самых тяжелых системных заболеваний соединительной ткани, которое развивается чаще у молодых женщин и девушек, хотя может возникать в любом возрасте. Больные СКВ по-прежнему имеют высокий риск смерти (в 3 раза выше, чем в общей популяции). Основой улучшения прогноза при СКВ считаются ранняя диагностика, интенсификация базисной терапии и минимизация дозы глюкокортикоидов (ГК), активное назначение гидроксихлорохина, контроль побочных эффектов ГК и иммуносупрессантов, применение иммунобиологических препаратов, оценка сердечно-сосудистого риска и лечение сердечно-сосудистых заболеваний. Однако в последние годы появляются публикации о возможном влиянии состояния питания и отдельных ингредиентов пищи на течение заболевания. Среди компонентов пищи изучается значение насыщенных и ненасыщенных жиров, витаминов, антиоксидантов, алкоголя, продуктов, богатых клетчаткой. Наиболее убедительная информация относительно возможного влияния на активность и течение СКВ получена относительно витамина D, рыбьего жира, алкоголя, зеленого чая и пищевой соли. Именно анализу литературных данных по этим вопросам посвящена наша обзорная работа.
Ключевые слова: системная красная волчанка, питание, витамин D, антиоксиданты, алкоголь, жирные кислоты, хлорид натрия.
Адреса для листування:
Яременко Олег Борисович
Національний медичний університет імені О.О. Богомольця,
кафедра внутрішньої медицини № 3
01601, м. Київ, бульвар Тараса Шевченка, 13

Leave a comment