Артеріальна гіпертензія та системний червоний вовчак: ще один погляд на проблему (огляд сучасної літератури та опис клінічних випадків)
Абрагамивич О.О1, Абрагамович У.О.1, Синенький О.В.2, Кушина А.П. 3, Циганик Л.В. 3
- 1Львівський державний медичний університет
- 2Львівська обласна клінічна лікарня
- 3Львівський національний медичний університет ім. Данила Галицького
Резюме. У статті наведено огляд сучасної літератури щодо причин та патогенетичних особливостей артеріальної гіпертензії у хворих на системний червоний вовчак, які мають складний автоімуноопосередкований характер і потребують уважного ставлення на етапі діагностики та підбору гіпотензивного лікування. Наведено два клінічні випадки симптоматичної артеріальної гіпертензії різного генезу в осіб із цим захворюванням.
Системний червоний вовчак (СЧВ) — автоімунне захворювання невідомої етіології, яке характеризується гіперпродукцією органонеспецифічних автоантитіл до різних компонентів ядра із виникненням імунозапального ураження тканин і внутрішніх органів [4].
Поширеність СЧВ серед осіб працездатного віку в Україні за 2009 р. становить 16,5, а захворюваність — 1,1 на 100 тис. населення. У Львівській області серед 100 тис. працездатного населення СЧВ діагностовано у 12,1, захворюваність — у 1,2, диспансерним наглядом охоплено — 10,7 особи. Найвищий показник поширеності СЧВ серед працездатних мешканців Житомирської області — 35,1, а найвища захворюваність (7,4) — у Закарпатській області [3].
СЧВ виникає переважно у жінок репродуктивного віку у співвідношенні 9 жінок на 1 чоловіка. Досвід свідчить, що рання смертність пацієнтів із СЧВ знизилася [48]. Однак у жінок із СЧВ відзначають значно меншу тривалість життя, а 10% пацієнтів помирають впродовж 5 років після встановлення діагнозу [24, 42]. Основною причиною смертності у осіб із СЧВ, особливо у жінок, тривалість захворювання яких >5 років, є серцево-судинні захворювання. Серед осіб, які беруть участь у дослідженні Framingham Heart Study, ризик серцево-судинних ускладнень у пацієнтів із СЧВ у 50 разів вищий порівняно з тими, хто не хворіє на нього [17, 28]. До того ж, у жінок із СЧВ зростає схильність до виникнення атеросклерозу [10] і цереброваскулярної дисфункції [38].
Відомо, що у хворих на СЧВ часто діагностується артеріальна гіпертензія (АГ), яка може бути як ознакою супутнього захворювання (гіпертонічної хвороби, феохромоцитоми [53] тощо), так і СЧВ, яка може бути її першим клінічним проявом [22] (рисунок). Найчастіше діагностується АГ ренопаренхіматозного (зумовлена вовчаковим гломерулонефритом), реноваскулярного (часто виникає внаслідок антифосфоліпідного синдрому чи автоімунного васкуліту), медикаментозного (індукована прийомом глюкокортикостероїдів (ГКС)) генезу, а також їх комбінації. Нерідко ці чинники, які стосуються патогенезу СЧВ, поодинці або в їх комбінації поєднуються з патогенетичними чинниками супутніх хвороб із підвищеним артеріальним тиском (АТ), що призводить до утворення складних, специфічних лише для хворих на СЧВ, патогенетичних механізмів виникнення АГ.
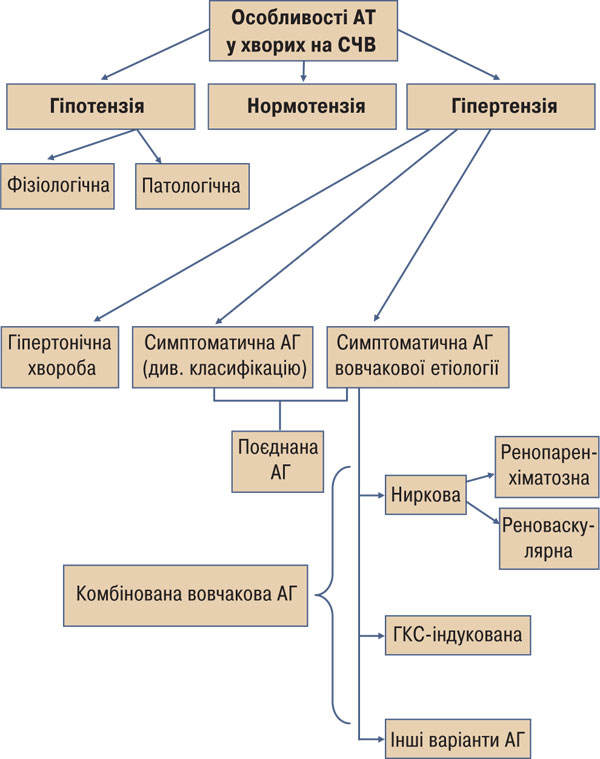
Рисунок. Особливості АТ у хворих на АГ
Все це робить проблему АГ у хворих на СЧВ такою, яка чекає свого вирішення, а ключем до нього є з’ясування особливостей патогенетичних механізмів її виникнення, які дозволять відпрацювати та рекомендувати для практичного застосування не лише ревматологам, але й лікарям загальної практики, адекватні алгоритми її діагностики та лікування.
До розв’язання цієї проблеми доклали зусилля вітчизняні та закордонні дослідники, які присвятили свою увагу ролі у патогенезі АГ у хворих на СЧВ ураження нирок, ренін-ангіотензинової системи (РАС), ендотеліальної функції судин, оксидантного стресу, порушень метаболічного гомеостазу, запальних цитокінів, ендокринної системи, генетичних чинників макроорганізму.
Сьогодні, поряд із імунними механізмами ураження нирок у хворих на СЧВ із виникненням і прогресуванням нефриту, все більше значення надається порушенням внутрішньониркової гемодинаміки (І.М. Кутиріна, В.А. Рогов, М.В. Шестакова та співавтори, 1992; J.R. Neuringer, В.М. Brenner, 1993; И.Е. Тареева, 1996). Одночасно збільшення ниркового кровотоку (гіперперфузія) призводить до підвищення внутрішньоклубочкового гідростатичного тиску (гіпертензії) і, отже, підвищення швидкості клубочкової фільтрації (ШКФ) (гіперфільтрації). Ці механізми мають адаптаційний характер, проте у довготривалих випадках пошкоджуються нефрони і виникає хронічна ниркова недостатність (В.М. Brenner, 1997; И.Е. Тареева, І.М. Кутиріна, Н.И. Неверов, 2000). Найбільш вивчені ці процеси у хворих на хронічний гломерулонефрит (ХГН) (В.М. Brenner, T.W. Meyer, Т.Н. Hostetter, 1982; И.Е. Тареева, 2000), зокрема виявлено, що за наявності нефротичного варіанта гломерулонефриту внутрішньоклубочкова гіпертензія визначає прогресування хвороби та істотно впливає на виживаність (А.Б. Будайчієва, P.P. Калієво, 2003) [5]. Виявлені знижена ШКФ та знижений нирковий плазмоток у хворих на СЧВ є важливим аргументом щодо участі порушеної ниркової гемодинаміки у патогенезі вовчакової гіпертензії [33]. Однозначно не варто знецінювати роль уражених ниркових клубочків у патогенезі вовчакової АГ. Попри значні втрати нефронів, які зумовлюють гіпертензію, прогресування ураження клубочків і втрата нефронів може достовірно погіршити ниркову гемодинаміку, асоційовану із СЧВ [39].
Проте СЧВ є також і самостійним чинником ризику стосовно гіпертензії, а тому остання може виникнути і без гломерулонефриту [36]. Це підтверджено також дослідженнями, проведеними із використанням двох моделей мишей (MRL/lpr та NZBWF1), хворих на СЧВ. Обидві мали люпус-нефрит, проте лише у моделі NZBWF1 виникла АГ [39]. Отримані результати наштовхують на думку про різні механізми, як АГ в цілому, так і ниркової АГ пацієнтів із СЧВ.
Інформація щодо реноваскулярної АГ у хворих на СЧВ маловідома. Проте є повідомлення, що свідчать про зв’язок реноваскулярної АГ із антифосфоліпідними антитілами, високою частотою артеріальних та венозних тромбозів. Такий варіант АГ дуже часто є злоякісним, а тому потребує вчасного та адекватного лікування: транслюмінальна ангіопластика, пульс-лікування преднізолоном, гепарин та дипіридамол [40].
Беззаперечним фактом є те, що РАС відіграє вагому роль у контролі АТ і гемодинаміки у людському організмі шляхом біохімічно-ферментативних механізмів з утворенням ангіотензину ІІ, який звужує судини, підвищує АТ і пришвидшує кровотік. Проте існують суперечливі факти щодо її впливу на тиск у пацієнтів із СЧВ. За результатами численних генетичних досліджень, які проводилися у різних популяціях СЧВ [23, 25, 35, 37], не виявлено чіткого зв’язку між РАС і прогресуванням вовчака. Натомість підвищений рівень реніну та ефективність лікування СЧВ інгібіторами ангіотензинперетворювального ферменту (АПФ) за результатами деяких досліджень підтверджують асоціацію між вовчаком та активацією реніну [15, 32, 41]. За повідомленнями у літературі стосовно оптимальних препаратів серед гіпотензивних ліків, які варто застосовувати у хворих на СЧВ, провідне місце належить інгібіторам АПФ та блокаторам рецепторів АПФ. Вони ефективно знижують АТ, зменшують альбумінурію, а також у разі тривалого застосування є нефропротекторами. Проте варто бути обачними під час застосування цих препаратів у пацієнтів із вовчаковим люпус-нефритом, ускладненим АГ, у зв’язку із властивістю затримувати в організмі калій, що може призвести до гіперкаліємії, порушення ритму й асистолії. У разі неефективності цих препаратів, що може бути зумовлено низькою дозою, підвищеною індивідуальною чутливістю пацієнта, до лікування варто додати сечогінні препарати та/чи антагоністи кальцію. У 2010 р. N.P. Shilkina опублікувала статтю, у якій йшлося про те, що показники добового моніторування АТ (ДМАТ) у осіб із системними захворюваннями сполучної тканини (з яких 50% хворі на СЧВ) з АГ, є прогностично несприятливими у зв’язку з недостатнім нічним зниження АТ. Також відзначила, що у хворих на СЧВ показники АТ залежать від функції нирок та активності реніну в плазмі крові [41].
У 1980 р. R.F. Furchgott i J.V. Zawadzki опублікували роботу про фактор релаксації (NO) ендотелію, вивчаючи роль ендотеліальних клітин у розслабленні ізольованих артерій у відповідь на ацетилхолін. Важливим наслідком ураження ендотелію судин та його дисфункції є зниження вазодилатації у відповідь на різні фармакологічні впливи (проба з ацетилхоліном), а також зростання вазоконстрикції, активація системи цитокінів та порушення антитромбогенних властивостей стінки судин [2]. Сучасні дослідження, проведені шляхом вимірювання кровотоку на плечовій артерії, свідчать про порушену ендотеліальну функцію судин у хворих на СЧВ [18, 27]. Судинна дисфункція часто асоційована з АГ, проте її роль у прогресуванні останньої не доведена. За умови, що судинна дисфункція буде виявлена не лише у великих, а й дрібних судинах нирок, матимемо підстави говорити про причину порушення ниркової гемодинаміки, а відтак і АГ у хворих на СЧВ. Безперечним буде і той факт, що запальні процеси, які супроводжують СЧВ, призводять до васкуліту, тим самим посилюючи судинну дисфункцію та підвищуючи ризик виникнення атеросклерозу. Додатковим фактором, який утруднить уточнення цього патологічного процесу, є ГКС, які застосовують для лікування СЧВ, сприяючи ендотеліальній дисфункції та гіпертензії [31].
Важливу патогенетичну роль в АГ відіграє ендотелін-1, який утворюється із проендотеліну під впливом низки стимулів, головними з яких є гіпоксія, ішемія та гострий стрес, а також адреналін, тромбін, ангіотензин ІІ, цитокіни, фактори росту та ГКС, має виражений вазоконстрикторний вплив і потенціює інші вазоактивні субстрати [1]. Відомі факти, що підтверджують роль ендотеліну-1 у прогресуванні як СЧВ, так і гіпертензії у хворих на СЧВ. Наприклад, у пацієнтів із вовчаком підвищений рівень ендотелінів у сироватці крові [20]. Іншим дослідженням виявлено, що сироватка крові, отримана від пацієнтів із СЧВ, стимулює вивільнення ендотеліну-1 з культури ендотеліальних клітин [54]. Нещодавні дослідження, проведені на моделі миші NZBWF1, підтверджують роль ниркового ендотеліну-1 у прогресуванні СЧВ та гіпертензії [39]. З отриманої інформації стає зрозумілим, що ендотелін-1 має вагомий вплив на судинну стінку, ниркову гемодинаміку і безпосередньо відіграє патогенетичну роль у вовчаковій гіпертонії.
Важливим механізмом, який може спровокувати ураження нирок та гіпертензію у вовчакових пацієнтів, особливо з активованими РАС та ендотелін-1-системою, є оксидантний стрес. РАС та ендотелін-1 беруть активну участь в утворенні активних форм кисню через прооксидантний фермент — НАДФН-оксидазу (нікотинамід аденін динуклеотид фосфат-оксидаза). Надмірна продукція активних форм кисню під час оксидантного стресу визнана важливою у патогенезі АГ [39]. Різні дослідження підтверджують важливість оксидантного стресу в патогенезі гіпертензії пацієнтів із СЧВ [1, 6, 7, 47]. Існує чітка кореляція між активністю СЧВ та продукцією супероксиду (супероксидний радикал — вільна форма кисню, що відіграє важливу роль у процесі пероксидного окиснення ліпідів) мононуклеарів, що циркулюють на периферії [51]. Аналогічним чином активність СЧВ чітко корелює із рівнями малондиальдегіду (маркер оксидантного стресу) у сироватці крові й має зворотні зв’язки із супероксиддисмутазою та глутатіонпероксидазою (антиоксидантні ферменти) [45]. У літературі наявні дослідження, присвячені застосуванню антиоксидантних препаратів (N-ацетилцистеїн, селеніум, темпол, апоцинін) у мишей [11, 29, 34, 44]. Після їх застосування виявлено зниження альбумінурії, зумовленої ураженням нирок, і АТ, але без впливу цих препаратів на активність вовчака, яка діагностувалася шляхом визначення рівня двоспіральної ДНК у сироватці крові мишей. Ці дослідження ще раз підтверджують важливу роль оксидантного стресу в патогенезі АГ у хворих на СЧВ, ймовірно, зумовленої ураженням нирок, а особливо ниркових судин.
Серед метаболічних чинників, які можуть брати участь у патогенезі АГ у пацієнтів із СЧВ, є ожиріння, лептин, інсулін. Відзначено, що жінки, хворі на СЧВ, більш схильні до змін тілобудови, а саме до ожиріння [24]. Одночасно зі збільшенням маси тіла у жінок, хворих на СЧВ, підвищується рівень лептину, проте він також може бути підвищеним незалежно від маси тіла [13]. Лептин (адипокін) — пептидний гормон жирової тканини, що діє на рецептори у гіпоталамусі, зменшуючи апетит і збільшуючи термогенез. Разом із інсуліном він сигналізує про вміст жирової тканини в організмі. Попри те, що нестача лептину призводить до ожиріння, в організмі людей і тварин, які страждають від цього захворювання, він значно підвищений. Ймовірно, що у цих випадках (наприклад у хворих на СЧВ) ушкоджені якісь інші елементи сигнального шляху цього гормону, і організм, намагаючись безуспішно компенсувати цей патологічний стан, посилює продукцію самого лептину. Лептин активує симпатичну нервову систему, що зумовлює підвищення ниркової реабсорбції натрію [14], і тим самим призводить до підвищення АТ. Жінки, хворі на СЧВ, мають високу ймовірність формування інсулінорезистентності, зумовленої утворенням автоантитіл до інсулінових рецепторів [46]. Прозапальні цитокіни інтерлейкін (IL)-6 та фактор некрозу пухлини (TNF)-α, які завжди підвищені у хворих на СЧВ, також беруть участь у формуванні інсулінорезистентності [9, 50]. Такі чинники, як ожиріння, порушення ліпідного обміну, АГ та інсулінорезистентність, часто виявляються у пацієнтів із СЧВ, що може свідчити про те, що СЧВ має негативний прогноз щодо метаболічного синдрому. Науковець V. Bellomio вивчав поширеність метаболічного синдрому серед пацієнтів із СЧВ та асоційовані з ним чинники, порівнюючи їх із контрольною групою осіб із незапальними захворюваннями. За його висновками частота метаболічного синдрому та АГ вища у хворих на СЧВ, а застосування преднізолону та гідроксихлорохіну захищає їх від метаболічного синдрому [8].
Давно відомо, що у хворих на СЧВ підвищені рівні запальних медіаторів IL-6, TNF-α, інтерферону (INF)-α, С-реактивного протеїну (СРП) у крові та у тканинах і вони беруть безпосередню участь у патогенезі СЧВ. Також відомою є чітка кореляція між запальними цитокінами (IL-6, TNF-α, СРП) та рівнем АТ у пацієнтів із есенціальною АГ та у здорових чоловіків [49]. Попри те, що це автоімунне захворювання супроводжується підвищеним рівнем вище зазначених прозапальних цитокінів, які, очевидно, погіршують перебіг, вони також залучені у численні патогенетичні механізми АГ. Серед основних варто відзначити такі: сприяння ендотеліальній дисфункції ниркових судин, виникнення ангіотензинової гіпертензії та продукції ендотеліну-1, генерації оксидантного стресу, прогресування інсулінорезистентності. Численні свідчення літератури підтверджують, що протизапальне чи імуносупресивне лікування є важливою стратегією щодо гіпертензії та серцево-судинних захворювань [39]. Результати дослідів на тваринах свідчать, що застосування імуносупресивних лікарських засобів дає позитивний ефект, наприклад: мікофенолат мофетил — знижує АТ та захищає нирки [30], моноклональні антитіла до IL-6 — знижують утворення автоантитіл, протеїнурію [12], блокатори TNF-α — знижують АТ і альбумінурію, але підвищують утворення антитіл до двоспіральної ДНК [39].
Роль ендокринної системи, а саме статевих гормонів, є важливою у виникненні СЧВ, оскільки чітко простежується гендерна нерівність — превалюють жінки серед хворих на СЧВ. Важливим і цікавим є той факт, що ризик виникнення кардіоваскулярних захворювань, уражень нирок і гіпертензії критично підвищений у жінок молодого віку, хворих на СЧВ, незважаючи на репродуктивний вік, коли б вони мали бути захищені статевими гормонами проти цих захворювань. Естрогени — добре відомі модулятори імунної системи — мають значний вплив на три ланки останньої: запальні цитокіни, Т- і В-клітинний (гуморальний) імунітет. Ці гормони мають сильний імуномодулювальний ефект і можуть стимулювати автореактивні В-лімфоцити для підвищеного антитілоутворення [49].
Наукові дослідження, проведені на моделі миші, хворої на СЧВ, показали, що фармакологічна блокада естрогену призводить до зниження рівня автоантитіл, протеїнурії та відтерміновує смертність [43, 52]. Роль естрогенів у патогенезі АГ у хворих на СЧВ наразі не відома. Опосередкованим механізмом АГ може бути підвищене під впливом естрогену антитілоутворення з подальшим відкладанням імунних комплексів у нирковій тканині та виникненням ниркової гіпертензії.
Вчений Y. Imai у 1989 р. вивчав вплив екзогенних ГКС на добові коливання АТ, використовуючи ДМАТ у осіб із ХГН, без лікування ГКС та хворих із люпус-нефритом і базисним лікуванням ГКС. Результати ДМАТ у хворих на ХГН без застосування ГКС були такими ж, як і у осіб із есенціальною АГ: чітке нічне падіння АТ і частоти серцевих скорочень (ЧСС). Натомість, у пацієнтів із вовчаковим гломерулонефритом, які отримували ГКС-лікування, нічне падіння АТ не спостерігалося, а, навпаки, часто і значно підвищувалися показники АТ. У цих хворих АТ піднімався з другої половини дня, досягнувши максимуму у ранковий час. Незважаючи на зміни АТ, ЧСС була чітко знижена у нічний час. Науковець зробив висновок, що преднізолон усунув нічні падіння АТ, а це свідчить, що добові зміни АТ залежать від гіпоталамо-гіпофізарно-наднирникової системи через її вплив на вегетативну нервову систему [16]. У 2000 р. L. Leon-Ruiz в американському журналі «Гіпертензія» опублікував висновок про те, що хворі на СЧВ мають високий ризик виникнення АГ, яка чітко асоційована із застосуванням ГКС та роками прогресування СЧВ [26].
H. Julkunem у 1991 р. описав клінічний випадок злоякісної гіпертензії та наявності антифосфоліпідних антитіл у жінки молодого віку, яка приймала пероральні контрацептиви. На момент її звернення до лікарні зі скаргами на високі рівні АТ, з відхилень, які наштовхували на думку про СЧВ, були: підвищені рівні антитіл до двоспіральної ДНК і антифосфоліпідні антитіла. Відміна пероральних контрацептивів та гіпотензивне лікування мали хороший ефект. З часом у неї виникли й інші симптоми, які дали можливість достовірно підтвердити діагноз СЧВ (позитивні антитіла до двоспіральної ДНК, антифосфоліпідні антитіла, тромбоцитопенія, лейкопенія та протеїнурія). З огляду на це він зробив припущення, що пероральні контрацептиви можуть сприяти маніфестації симптомів та/чи загостренню СЧВ [19].
Цікаву особливість АТ у хворих на СЧВ зауважив D. Kaplan (2005): особи з ревматоїдоподібним артритом (ерозивним артритом) не мають АГ, що зумовлено високою частотою алелі DR4 у цих пацієнтів [21].
Наведена інформація про відомі патогенетичні механізми АГ у хворих на CЧВ з поліорганними ураженнями, які не лише у них взаємно комбінуються, але й, поєднуючись з іншого генезу АГ, переплітаються, свідчить про те, що вона має складний і не celebrex generic до кінця з’ясований автоімуноопосередкований характер.
Подаємо опис двох клінічних випадків, в яких представлені пацієнтки молодого віку з верифікованим діагнозом СЧВ, проте причини вторинної АГ у них різні. У першому випадку фігурує медикаментозно індукована АГ, у другому — ренопаренхіматозна. Встановлення причини підвищення АТ дозволило визначити тактику ведення цих хворих, підібрати адекватні групи гіпотензивних лікарських засобів та час їх прийому.
Клінічний випадок № 1
Хвора П., ІХ № 13349, 1987 р.н., перебувала на стаціонарному лікуванні в ревматологічному відділенні Львівської обласної клінічної лікарні (ЛОКЛ). Під час госпіталізації скаржилася на постійну нудоту, поступову втрату маси тіла; біль і припухлість у правому колінному суглобі, який посилювався під час фізичного навантаження, зменшувався у стані спокою; підвищення температури тіла до 37,7 °С; виражену загальну слабість і зниження працездатності. З анамнезу захворювання: вважає себе хворою впродовж 6 років (з 2004 р.), з того часу, відколи вперше зауважила зміну кольору дистальних фаланг пальців рук на холоді (березень), з’явилася еритема на обличчі (червень), приєднався біль у колінних, кульшових суглобах (липень). Із зазначеними скаргами звернулася за медичною допомогою — встановлено діагноз «СЧВ». Постійно лікувалася стаціонарно, періодично — амбулаторно, почувала себе задовільно. З 2009 р. самовільно припинила прийом ГКС. Зі слів пацієнтки, стан поступово погіршувався, проте за медичною допомогою не зверталась. У зв’язку зі значним погіршенням стану та появою вищезазначених скарг, госпіталізована у ЛОКЛ. Результати об’єктивного огляду: загальний стан — тяжкий; ріст — 162,0 см; маса тіла — 49,0 кг; індекс Брока — 79,0%; індекс Кетле — 19,0 кг/м2; конституція — астенічна. Слизові оболонки — бліді вологі чисті. Шкіра — бліда суха. Дихання носом — вільне; перкуторно над легенями — ясний легеневий звук; аускультативно — везикулярне дихання, хрипи не вислуховуються; частота дихальних рухів (ЧДР) — 19/хв. Верхівковий поштовх — у п’ятому міжребер’ї на 1,5 см досередини від l. mеdioclavicularis. sin.; тони серця — чисті звучні ритмічні; патологічні серцеві шуми не вислуховуються; ЧСС — 88 уд./хв; пульс — 88 уд./хв; АТ: ліва рука — 120/80 мм рт. ст., права рука — 110/80 мм рт. ст. Язик — вологий, обкладений білим нашаруванням, уремічний запах з рота. Нирки — не пальпуються; симптом Пастернацького — від’ємний з обох боків; дизуричні прояви — ніктурія; набряки — відсутні. Пальпаторно болючий правий колінний суглоб; обсяг рухів: активні й пасивні обмежені у правому колінному суглобі; хода порушена — кульгає. Серед лабораторних та інструментальних обстежень виявлено численні патологічні відхилення (у динаміці з інтервалом у 4–7 днів): у загальному аналізі крові (ЗАК) — анемія тяжкого ступеня [еритр./RBC/ — 2,2·1012 л (N — 4,2–6,3·1012/л); гемогл./НGВ/ — 60,0 г/л (N ж — 120,0–160,0 г/л); КП — 0,8; гіпохромія — «+», анізоцитоз — «±»]; ШОЕ — 61,0 мм/год; у загальному аналізі сечі (ЗАС)– протеїнурія (білок — 1,98/1,65/3,3 г/л), прозорість — слабо-мутна; лейкоцитурія (5–7/10–15/20–25 в п.з.); еритроцитурія незм. еритр. — (8–10/30–35/30–38 в п/з.); поодинокі гіалінові та зернисті циліндри. За результатами біохімічного аналізу крові (БАК) — гіперазотемія з негативною тенденцією до наростання [креатинін — 0,190/0,238/0,330/0,383 ммоль/л (N ж — 0,044–0,115 ммоль/л); сечовина — 20,4/24,5/41,5/48,6 ммоль/л (N ж до 50 р. 2,6–6,4)]; порушення водно-електролітного обміну з тенденцією до гіперкаліємії: К — 4,86/5,54/6,7 (N — 3,4–5,8 ммоль/л). Серед імунологічних аналізів крові виявлено такі відхилення: antidsDNA — >200 МО/мл (N <25 МО/мл); антифосфоліпідні антитіла IgG viagra cialis levitra trial pack — 14,05 (N <10 МО/мл). Результат рентгенографії кистей та кульшових суглобів: остеоартроз І стадії; двобічний деформувальний коксартроз: справа — III стадії, зліва lexapro weight loss — II стадії. За результатами капіляроскопії — локальна ішемія, спастичні зміни капілярів, сповільнений кровообіг.
Взявши до уваги скарги пацієнтки, інформацію з анамнезу захворювання, результати об’єктивного та лабораторно-інструментального досліджень, встановлено такий діагноз: «СЧВ: хронічний прогресивний перебіг; активна фаза, активність IIІ ступеня; з ураженням шкіри (еритема [2004 р.]); суглобів [поліартрит із переважним ураженням дрібних суглобів кистей, колінних, кульшових суглобів (коксартроз справа ІІІ стадії, зліва ІІ стадії), ФНС ІІ]; судин (синдром Рейно); нирок (хронічна хвороба нирок (ХХН) ІV стадії: вовчаковий гломерулонефрит); імунологічними порушеннями (ANA, antidsDNA — positiv); ускладнений анемією тяжкого ступеня; функціональний клас хворого (ФКХ) ІІІ».
Після дообстеження до базисного лікування додано пульс-лікування ГКС. Через 4 дні хвора почала висловлювати скарги на періодичне підвищення АТ, що супроводжувалося нудотою та головним болем. Оскільки на момент госпіталізації пацієнтка не скаржилася на підвищення АТ, і під час вимірювання він становив 120/80 мм рт. ст., виникнення цієї АГ ми пояснювали прийомом ГКС.
Для контролю АТ та підбору гіпотензивного лікування використано метод ДМАТ.
За результатами, які ми отримали впродовж доби, середній рівень систолічного АТ був вищим від норми і становив 151 мм рт. ст., діастолічного був у межах норми — 83 мм рт. ст. Максимальні рівні систолічного і діастолічного АТ за добу перевищували дозволені границі — 185 мм рт. ст. і 99 мм рт. ст. В активний період, що тривав з 06:00 до 22:00, середні рівні систолічного і діастолічного АТ становили 150 і 85 мм рт. ст., а в пасивний період — 154 і 81 мм рт. ст. відповідно. Ступінь нічного зниження систолічного АТ був від’ємним, а ступінь нічного зниження діастолічного АТ був нижчим від норми. Пульсовий АТ підвищений — 68 мм рт. ст. Відхилень за результатами електро- та ехокардіографії не виявлено. Хвора консультована кардіологом: «Симптоматична АГ (медикаментозна): І стадія; І ступінь; кризовий перебіг; ступінь ризику І–ІІ; СН І». До лікування додано блокатори кальцієвих каналів та сечогінні препарати.
Хвора постійно лікувалася амбулаторно, періодично — стаціонарно, отримувала базисне (ГКС, цитостатики) та симптоматичне лікування: метилпреднізолон 0,04 г/добу; циклофосфамід 1,0 г — 1 раз/міс впродовж півтора року, з переходом на поквартальне введення; фелодипін 0,005 г — по 1 таблетці 2 рази на добу, зранку і ввечері; торасемід 0,01 г — по 1 таблетці вранці; пантопразол 0,04 г — по 1 таблетці зранку до їди; комплексний гепатопротекторний засіб — по 1 капсулі 3 рази на добу після їди. На момент останньої госпіталізації у ЛОКЛ, очевидним є те, що стан пацієнта зі стабільно позитивною динамікою. Скарги: на періодичний, неінтенсивний біль у колінних суглобах та загальну слабкість. Загальний стан — задовільний; під час об’єктивного огляду — патологічних відхилень не виявлено.
У ЗАК — лейк./WBC/ — 8,1·109/л; еритр./RBC/ — 4,33·1012/л; гемогл./НGВ/ — 119 г/л; КП — 0,82; ШОЕ — 40 мм/год. У БАК — креатинін — 60 мкмоль/л; сечова кислота — 0,435 ммоль/л. Результати ЗАС — солом’яно-жовта; прозора; білок — 0,66 г/л; лейкоцити –0–1–2 в п. з.; еритроцити незмінені поодинокі в п. з. Імунологічні дослідження: antidsDNA — 34,93 МО/мл (N — <25 МО/мл); антинуклеарні антитіла (ANA) — 0,73 (гран. конц.: 1,0–1,2; виявлено >1,2); антифосфоліпідні антитіла IgG — 1,35 (<10 МО/мл); антифосфоліпідні антитіла IgМ — 1,56 (<10 МО/мл). За результатами ДМАТ середні рівні систолічного та діастолічного АТ становили 127 і 79 мм рт. ст. відповідно; максимальні рівні систолічного і дастолічного АТ за добу становили 158 і 104 мм рт. ст. відповідно, в активний період, що тривав із 06:00 до 22:00, середні рівні АТ не перевищували межі норми і становили 129 і 80 мм рт. ст. відповідно, а в пасивний період — 123 і 76 мм рт. ст., варіабельність систолічного і діастолічного АТ впродовж доби була достатньою, пульсовий АТ — у межах норми.
Клінічний випадок № 2
Хвора М., ІХ № 9545, 1987 р.н., поступила у ревматологічне відділення ЛОКЛ зі скаргами на періодичний мігруючий біль у великих суглобах верхніх та нижніх кінцівок, дрібних суглобах кистей; підвищення АТ до 160/100 мм. рт. ст., періодично до 230/120 мм. рт. ст., що супроводжується нудотою, блюванням, головним болем та носовими кровотечами; неприємні відчуття у ділянці серця, відчуття посилення серцебиття; тупий біль у поперековій ділянці, часте сечовиділення, особливо у нічний час; виражену загальну слабість і втомлюваність. З анамнезу захворювання відомо, що пацієнткавважає себе хворою з грудня 2003 р., з того часу, відколи вперше зафіксувала біль, почервоніння, набряки у променезап’ясткових та дрібних суглобах кистей рук, підвищення температури тіла, виражену слабкість. За медичною допомогою звернулася в Обласну дитячу спеціалізовану клінічну лікарню м. Львова, де на основі таких змін: еритематозний висип, лейкопенія, LE-клітини, antidsDNA, ANA-positiv, було встановлено діагноз «СЧВ». Отримувала лікування ГКС, настало покращення. З серпня 2004 р. виникли ознаки antibiotic cipro пошкодження нирок (протеїнурія), діагностовано вовчаковий гломерулонефрит, до лікування додано цитостатики. Невдовзі почала відзначати періодичне підвищення АТ, у зв’язку з чим приймала гіпотензивні препарати. Лікувалася амбулаторно, періодично — стаціонарно. З серпня до березня 2012 р. самовільно припинила прийом медикаментів. З особливостей анамнезу життя відомо про обтяжену спадковість: двоюрідна сестра хворіє на СЧВ. У зв’язку з погіршенням загального стану звернулася у ревматологічне відділення ЛОКЛ.
Результати об’єктивного огляду:загальний стан — середньої тяжкості; слизові оболонки — бліді вологі чисті; шкіра — livedo reticularis; змінена на гомілках: бліді стрії розтягу, зумовлені масивними набряками в анамнезі; бліда суха; набряки — відсутні. Дихання носом — вільне; перкуторно над легенями — ясний легеневий звук; аускультативно — везикулярне дихання, хрипи не вислуховуються; ЧДР — 21/хв. Пальпаторно — верхівковий поштовх у п’ятому міжребер’ї на 1,5 см досередини від l. m.cl. sin.; перкуторно — межі відносної та абсолютної серцевої тупості у межах норми; аускультативно — тони серця ритмічні, звучні, акцент ІІ тону над аортою; АТ: ліва рука — 165/100 мм рт. ст., права рука — 160/100 мм рт. ст. Язик — вологий чистий; живіт під час пальпації — м’який, неболючий; печінка не виступає з-під краю реберної дуги; кишка — еластична. Нирки не пальпуються; симптом Пастернацького: зліва — слабопозитивний, справа — від’ємний; набряки — відсутні; дизуричні прояви — полакіурія, ніктурія. Під час об’єктивного огляду видимих деформацій та дефігурацій суглобів не виявлено; хода не порушена. Проведено низку лабораторних та інструментальних методів обстеження. Серед основних відхилень варто звернути увагу на зміни у: 1) ЗАК: гіпохромна анемія [еритр./RBC/ — 2,29·1012 л (N — 4,2–6,3·1012/л); гемогл./НGВ/ — 67,0 г/л (N ж — 120,0–160,0 г/л; гематокрит/НСТ/ — 19,7% (N ж — 37,0–46,0%); КП — 0,83; гіпохромія — «+», анізоцитоз — «±», пойкілоцитоз — «+»]; лейкопенія [лейк./WBC/ — 3,0·109/л (N — 4,3–10,0·109/л)]; ШОЕ — 40,0 мм/год.; 2) ЗАС: протеїнурія (білок — 1,32 г/л), прозорість — слабо-мутна; незм. еритр. — 5–6 в п/з.; 3) БАК: гіпопротеїнемія [заг. білок — 57,8 г/л (N — 65,0–85,0 г/л)]; дисліпідемія [холестерин загальний — 7,3 ммоль/л (N — <5,2 ммоль/л)]; гіперазотемія [креатинін — 314,0 мкмоль/л (N ж — <80,0 мкмоль/л); сечовина — 24,7 ммоль/л (N ж до 50 р. 2,6–6,4); сечова кислота — 0,414 ммоль/л (N ж — 0,14–0,34)]; залізо — 8,0 ммоль/л (N ж — 14,3–26,0 ммоль/л); 4) Аналіз крові: антитіла до двоспіральної ДНК — >200,0 МО/мл (N — <25,0 МО/мл).
За результатами ДМАТ можна вважати, що у хворої рівні АТ підвищені. Впродовж доби середні рівні систолічного та діастолічного АТ становлять 155 і 103 мм рт. ст. відповідно. Максимальні рівні систолічного і діастолічного АТ за добу 223 і 148 мм рт. ст. відповідно, мінімальні — 135 і 75 мм рт. ст. відповідно. В активний період, що тривав з 06:00 до 22:00, середні рівні систолічного і діастолічного АТ перевищували межі норми і становили 157 і 107 мм рт. ст., а в пасивний період — 150 і 96 мм рт. ст. відповідно. Ступінь нічного зниження діастолічного АТ був знижений, пацієнтка належить до групи non-dipper. Пульсовий АТ дещо перевищував норму (55 мм рт. ст.).
Встановленоклінічний діагноз: «СЧВ: хронічний прогресивний перебіг; активна фаза, активність ІІ ступеня; з ураженням шкіри (еритема [в анамнезі]); суглобів (поліартрит із переважним ураженням променезап’ясткових, ліктьових, колінних, дрібних суглобів кистей, Rtg-стадія І, ФНС І); судин (синдром Рейно, livedo retic.); нирок (ХХН ІV стадії: вовчаковий гломерулонефрит); гематологічними (лейкопенія) та імунологічними (ANA — positiv в анамнезі, antidsDNA — positiv) порушеннями. Симптоматична АГ (ренопаренхіматозна): IІ стадія (ангіопатія сітківки); ІІ ступінь, із кризовим перебігом; СН І. ФКХ ІІ».
Під час стаціонарного лікування та в амбулаторному режимі після виписки хвора отримувала: преднізолон 0,03 г/добу; азатіоприн 0,05 г — по 1 таблетці 2 рази на добу, зранку і ввечері; дилтіазем 0,09 г — по 1 таблетці 2 рази на добу, зранку і ввечері; фозиноприл 0,01 г — по 1 таблетці 2 разина добу, зранку і ввечері; омепразол 0,04 г — по 1 капсулі зранку до їди; препарати кальцію — по 500 мг 2 рази на добу (зранку і ввечері) під час їди; ентеросорбенти на основі метилкремнієвої кислоти — по 1 ст. л. 3 рази на добу, між прийомом їжі та медикаментів.
Хвора постійно перебувала на диспансерному спостереженні ревматолога. За даними аналізу результатів клінічних та лабораторних показників виявлено, що її стан має стабільно позитивну динаміку, що простежуємо і за інформацією ДМАТ, результати якого є, безперечно, не ідеальними, але прогностично хорошими.
Впродовж доби середні рівні систолічного та діастолічного АТ становили 141 і 92 мм рт. ст. відповідно. Максимальні рівні систолічного і діастолічного АТ за добу — 167 і 113 мм рт. ст. відповідно. В активний період середні рівні систолічного і діастолічного АТ не перевищували межі норми і становили 140 і 90 мм рт. ст. відповідно, а в пасивний період незначно перевищували межі та становили 143 і 95 мм рт. ст. відповідно. Варіабельність систолічного і діастолічного АТ впродовж доби була достатньою. Пульсовий АТ — у межах норми.
Отримані результати є лише віхою на шляху вирішення цієї проблеми, а її складність та важливість є мотивацією до необхідності нашої участі у її розв’язанні.
Список використаної літератури
- Волосовець О.П., Кривопустов С.П., Мороз Т.С. (2007) Патогенетична роль оксиду азоту та ендотеліальної дисфункції в розвитку захворювань серцево-судинної системи у дітей. Здоров’я дитини, 2(5): 38–39.
- Денисюк В.І., Ковальчук О.В. (2008) Судинно-рухова функція плечової артерії у хворих на ішемічну хворобу серця з часто рецидивуючою формою фібриляції передсердь. Внутр. медицина, 2(8): 24–25.
- Коваленко В.М., Корнацький В.М. (2010) Демографія і стан здоров’я народу України. Київ, с. 100–110.
- Клюквина Н.Г. (2008) viagra cialis levitra trial pack Системная красная волчанка. В кн.: Насонов Е.Л., Насонова В.А. (ред.) (2008) Ревматология национальное руководство. ГЕОТАР-Медиа, Москва, с. 419.
- Хуснутдинова Л.А. (2009) Состояние функционального почечного резерва и канальцевых функций почек у больных системной красной волчанкой и хроническими гломерулонефритами. Автореф. дис. … кан. мед. наук: спец. 14.00.05. 18 с.
- Alves J.D., Grima В.С. (2003) Oxidative stress in systemic lupus erythematosus and antiphospholipid syndrome: a gateway to atherosclerosis., Curr. Rheumatol. Rep. 5(5): 383–390.
- Bae S.C., Kim S.J., Sung M.K.(2002) Impaired antioxidant status and decreased dietary intake of antioxidants in patients with systemic lupus erythematosus. Rheumatol. Int., 22(6): 238–243.
- Bellomio V., Spindler A., Lucero E. et al. (2009) Metabolic syndrome in Argentinean patients with systemic lupus erythematosus. Lupus, 18(11): 1019–1025.
- Borst S.E. (2004) The role of TNF-alpha in insulin resistance. Endocrine, 23(2–3): 177–182.
- Bruce I.N. (2005) Atherogenesis and autoimmune disease: the model of lupus. Lupus, 14(9): 687–690.
- Costa C.A., Amaral T.A., Carvalho L.C. et al. (2009) Antioxidant treatment with tempol and apocynin prevents endothelial dysfunction and development of renovascular hypertension. Am. J. Hypertens., 22(12): 1242–1249.
- Finck B.K., Chan B., Wofsy D. (1994) Interleukin 6 promotes murine lupus in NZB/NZW F1 mice. J. Clin. Invest., 94(2): 585–591.
- Garcia-Gonzalez A., Gonzalez-Lopez L., Valera-Gonzalez I.C. et al. (2002) Serum leptin levels in women with systemic lupus erythematosus.Rheumatol. Int., 22(4): 138–141.
- Hall J.E., Brands M.W., Hildebrandt D.A. et al. (2000) Role of sympathetic nervous system and neuropeptides in obesity hypertension. Braz. J. Med. Biol. Res., 33(6): 605–618.
- Herlitz H., Edenö C., Mulec H. et al. (1984) Captopril treatment of hypertension and renal failure in systemic lupus erythematosus Nephron., 38(4): 253–256.
- Imai Y., Abe K., Sasaki S. et al. (1989) Exogenous glucocorticoid eliminates or reverses circadian blood pressure variations. J. Hypertens., 7(2): 113–120.
- Ippolito A., Petri M. (2008) An update on mortality in systemic lupus erythematosus. Clin. Exp. Rheumatol., 26(5): 72—79.
- Johnson S.R., Harvey P.J., Floras J.S. et al. (2004) Impaired brachial artery endothelium dependent flow mediated dilation in systemic lupus erythematosus: preliminary observations. Lupus, 13(8): 590–593.
- Julkunen H., Kaaja R., Jouhikainen T. et al. (1991) Malignant hypertension and antiphospholipid antibodies as presenting features of SLE in a young woman using oral contraceptives. Br. J. Rheumatol., 30(6): 471–472.
- Julkunen H., Saijonmaa O., Grönhagen-Riska C. et al. (1991) Raised plasma concentrations of endothelin-1 in systemic lupus erythematosus. Ann. Rheum. Dis., 50(7): 526–527.
- Kaplan D., Ginzler М., Feldman J. (1992) Arthritis and hypertension in patients with systemic lupus erythematosus. Arthritis Rheum., 35(4): 423–428.
- Karakizlis H., Hoyer J. (2009) Hypertensive emergency as the first manifestation of systemic lupus erythematosus. Dtsch. Med. Wochenschr., 134(45): 2274–2277.
- Kaufman K.M., Kelly J., Gray-McGuire C. et al. (2001) Linkage analysis of angiotensin-converting enzyme (ACE) insertion/deletion polymorphism and systemic lupus erythematosus. Mol. Cell. Endocrinol., 25(1–2): 81–85.
- Kipen Y., Strauss B.J., Morand Е.F. (1998) Body composition in systemic lupus erythematosus. Br. J. Rheumatol., 37(5): 514–519.
- Lee Y.H., Rho Y.H., Choi S.J. et al. (2006) Angiotensin-converting enzyme insertion/deletion polymorphism and systemic lupus erythematosus: a metaanalysis. J. Rheumatol., 33(4): 698–702.
- León-Ruiz L., Hidalgo Tenorio C., Mediavilla Garcia J.D. et al. (2000) Hypertension prediction model in systemic lupus erythematosus patients. Am. J. Hypertens., 13(4): 269.
- Lima D.S., Sato E.I., Lima V.C. et al. (2002) Brachial endothelial function is impaired in patients with systemic lupus erythematosus. J. Rheumatol., 29(2): 292–297.
- Manzi S., Meilahn E.N., Rairie J.E. et al. (1997) Age-specific incidence rates of myocardial infarction and angina in women with systemic lupus erythematosus: comparison with the Framingham Study. Am. J. Epidemiol. 145(5): 408–415.
- Mathis K.W., Venegas-Pont M., Masterson C.W. et al. (2012) Oxidative stress promotes hypertension and albuminuria during the autoimmune disease systemic lupus erythematosus. Hypertension., 59(3): 673–679.
- Mattson D.L., James L., Berdan E.A. et al. (2006) Immune suppression attenuate and renal disease in the Dahl salt-sensitive rat.Hypertension, 48(1): 149–156.
- Maxwell S.R., Moots R.J., Kendall M.J. (1994) Corticosteroids: do they damage the cardiovascular system ? Postgrad. Med. J., 70(830): 863–870.
- Metsärinne K.P., Nordström D.C., Konttinen Y.T. et al. (1992) Plasma interleukin-6 and renin substrate in reactive arthritis, rheumatoid arthritis, and systemic lupus erythematosus. Rheumatol. Int., 12(3): 93–96.
- Nakano M., Ueno M., Hasegawa H. et al. (1998) Renal haemodynamic characteristics in patients with lupus nephritis. Ann. Rheum. Dis., 57(4): 226–230.
- Nishi E.E., Oliveira-Sales E.B., Bergamaschi C.T. et al. (2010) Chronic antioxidant treatment improves arterial renovascular hypertension and oxidative stress markers in the kidney in Wistar rats. Am. J. Hypertens., 23(5): 473–480.
- Parsa A., Peden E., Lum R.F. et al. (2002) Association of angiotensin-converting enzyme polymorphisms with systemic lupus erythematosus and nephritis: analysis of 644 SLE families. Genes Immun., 3(1): 42–46.
- Petrin J., Rozman B., Dolenc P. et al. (1993) The dissociation of arterial hypertension and lupus glomerulonephritis in systemic lupus erythematosus. Blood Press., 2(2): 108–112.
- Prkacin I., Novak B., Sertić J. et al. (2001) Angiotensin-converting enzyme gene polymorphism in patients with systemic lupus.. Acta. Med. Croatica., 55(2): 73–76.
- Rahman P., Aguero S., Gladman D.D. et al. (2000) Vascular events in hypertensive patients with systemic lupus erythematosus. Lupus, 9(9): 672–675.
- Ryan M.J. (2009) The pathophysiology of hypertension in systemic lupus erythematosus. Am. J. Physiol. Regul. Integr. Comp. Physiol., 296(4): 1258–1267.
- Serino R., Osajima A., Hiroshige K. et al. (1996) Renovascular hypertension associated with antiphospholipid antibodies in a woman with systemic lupus erythematosus. Nihon Jinzo Gakkai Shi., 38(9): 417–422.
- Shilkina N.P., Iunonin I.E., Stoliarova S.A. et al. (2010) Arterial hypertension in patients with systemic connective tissue diseases and hemorrhagic vasculitis. Ter. Arkh., 82(5): 40–45.
- Smolen J.S. (2002) Therapy of systemic lupus erythematosus: a look into the future. Arthritis Res., 4(3): 25–30.
- Sthoeger Z.M., Zinger H., Mozes E. (2003) Beneficial effects of the anti-oestrogen tamoxifen on systemic lupus erythematosus of (NZBxNZW)F1 female mice are associated with specific reduction of IgG3 autoantibodies. Ann. Rheum. Dis., 62(4): 341–346.
- Suwannaroj S., Lagoo A., Keisler D. et al. (2001) Antioxidants suppress mortality in the female NZB x NZW F1 mouse model of systemic lupus erythematosus (SLE). Lupus., 10(4): 258–265.
- Taysi S., Gul M., Sari R.A. et al. (2002) Serum oxidant/antioxidant status of patients with systemic lupus erythematosus. Clin. Chem. Lab. Med., 40(7): 684–688.
- Tso T.K., Huang H.Y., Chang C.K., Liao Y.J., Huang W.N. (2004) Clinical evaluation of insulin resistance and beta-cell function by the homeostasis model assessment in patients with systemic lupus erythematosus. Clin. Rheumatol., 23(5): 416–420.
- Túri S., Németh I., Torkos A. et al. (1997) Oxidative stress and antioxidant defense mechanism in glomerular diseases. Free Radic. Biol. Med., 22(1–2): 161–168.
- Urowitz MB., Gladman D.D., Аbu-Shakra M. et al. (1997) Mortality studies in systemic lupus erythematosus. Results from a single center. III. Improved survival over 24 years. J. Rheumatol., 24(6): 1061–1065.
- Venegas-Pont М., Ryan M.J. (2010) Can estrogens promote hypertension during systemic lupus erythematosus? Steroids. 75(11): 766–771.
- Vozarova B., Weyer C., Hanson K. et al. (2001) Circulating interleukin-6 in relation to adiposity, insulin action, and insulin secretion. Obes. Res., 9(7): 414–417.
- Waszczykowska E., Robak E., Wozniacka A. et al. (1999) Estimation of SLE activity based on the serum level of chosen cytokines and superoxide radical generation. Mediators Inflam., 8(2): 93–100.
- Wu W.M., Lin B.F., Su Y.C. et al. (2000) Tamoxifen decreases renal inflammation and alleviates disease severity in autoimmune NZB/W F1 mice. Scand. J. Immunol., 52(4): 393–400.
- Wu J.J., Luo S.F., Ho H.H. (1992) Systemic lupus erythematosus and pheochromocytoma. J. Rheumatol., 19(6): 982–984.
- Yoshio T., Masuyama J., Mimori A. (1995) Endothelin-1 release from cultured endothelial cells induced by sera from patients with systemic lupus erythematosus. cialis vs viagra forum Ann. Rheum. Dis., 54(5): 361–365.
Артериальная гипертензия и системная красная волчанка: еще один взгляд на проблему (обзор современной литературы и описание клинических случаев)
Резюме. В статье представлен обзор современной литературы относительно причин и патогенетических особенностей артериальной гипертензии у больных системной красной волчанкой, которые имеют сложный аутоиммуноопосредованный характер и требуют внимательного отношения на етапе диагностики и подбора гипотензивного лечения. Представлено два клинических случая симптоматической артериальной гипертензии разного генеза у пациентов с этим заболеванием.
симптоматическая артериальная гипертензия, системная красная волчанка, суточный мониторинг артериального давления.
Адреса для листування:
Абрагамович Орест Остапович
79010, Львів, вул. Некрасова, 4
Львівський національний медичний
університет ім. Данила Галицького, кафедра внутрішньої медицини № 1

Leave a comment