Системний червоний вовчак: патогенетичні особливості клінічної симптоматики, сучасна діагностична і терапевтична тактики ведення хворих
Коваленко В.М., Шуба Н.М., Борткевич О.П. , Білявська Ю.В.
Резюме. Публікація містить аналіз даних літератури останніх років, присвячених вивченню проблеми системного червоного вовчака (СЧВ). На підставі результатів великих епідеміологічних досліджень наведено рівні захворюваності та поширення СЧВ, їх залежність від окремих характеристик популяцій. У статті описано сучасну гіпотезу етіології та з урахуванням останніх наукових досягнень пояснено основні патогенетичні ланки розвитку захворювання. Клінічна симптоматика СЧВ розглядається з позицій патогенезу і наведена у вигляді сучасних класифікацій. Мета написання цієї статті — оптимізація діагностичного процесу та удосконалення терапевтичної тактики ведення хворих на СЧВ на основі даних останніх міжнародних рекомендацій і настанов.
Системний червоний вовчак (СЧВ) — системне захворювання сполучної тканини, яке розвивається на основі генетично зумовленої недосконалості імунорегуляторних процесів, що призводить до утворення безлічі антитіл до власних клітин і їх компонентів та виникнення імунокомплексного запалення, наслідком якого є ураження багатьох органів і систем (Коваленко В.М., Шуба Н.М., 2004). В основі розвитку СЧВ — втрата імунологічної толерантності, поліклональна В-лімфоцитарна активація та продукція антитіл, що реагують із широким спектром аутоантигенів і зумовлюють полісистемний характер патологічного процесу. (Дядик А.И., Багрий А.Э., 2003; О’Сгі^ й.Р. аі., 2007).
ЕПІДЕМІОЛОГІЯ
СЧВ — найбільш тяжке й поширене хронічне захворювання, яке за умови ураження життєво важливих систем та органів, є потенційно небезпечним для життя, але у більшості випадків СЧВ характеризується розвитком хронічного виснажливого для пацієнта патологічного стану. Рівень захворюваності на СЧВ у загальній популяції залежить від її окремих характеристик (зокрема віку, статі, раси, етнічних/національних параметрів та від періоду року, коли проводиться збір даних), а також від змін у загальноприйнятих класифікаційних критеріях (Сеп/ега Я. аі., 2009).
У Європейському Союзі річна захворюваність становить від 3,3 випадки на 100 тис. осіб у Ісландії (Gudmundsson S., Steisson K., 1990) до 5,0 випадка на 100 тис. осіб у Франції (Danchenko N. et al., 2006). У США річна захворюваність становить від 1,6 до 7,6 випадків на 100 тис. осіб на рік (Uramoto K.M. et al., 1999).
Поширеність СЧВ серед жінок у 10 разів вища порівняно із чоловіками, причому для осіб жіночої статі більш типовим є розвиток патологічного процесу у репродуктивному віці (Ward М.М., 2004). Дані про рівень поширеності СЧВ у різних країнах світу відрізняє висока варіабельність, а також те, що достовірні показники поширеності СЧВ у тій чи іншій популяції отримати досить важко. Причини цього можуть полягати в нижчезазначеному: 1) різні методики збору даних; 2) суперечливість нозологічного трактування окремих випадків, однак, безумовно, не можна виключити залежність поширеності СЧВ від 3) географічного положення країни, що відображає різницю у генотипі та окремих факторах навколишнього середовища (Cerve-ra R. et al., 2009). Епідеміологічне дослідження, що проводилось у Великобританії, визначило поширеність СЧВ як 27,7 на 100 тис. осіб у загальній популяції, при цьому серед жінок Африканської етнічної групи поширеність була у 9 разів вищою (Jonson A.E. et al., 1995). Найвищу поширеність СЧВ відзначено в Італії — 71 випадок на 100 тис. осіб (Danchenko N. et al., 2006). Рівні поширеності СЧВ у США становлять від 14,6 до 50 випадків на 100 тис. населення, включаючи осіб європеоїдної та негроїдної раси (Hochberg М.С. et al., 1995).
В Україні згідно з даними 2008 р. рівень захворюваності на СЧВ становив 1,3 на 100 тис. населення, а поширеність — 17,1 на 100 тис. населення. Але водночас у різних регіонах також відзначено суттєву варіабельність даних. Так, найвищі показники поширеності та захворюваності на CЧB зареєстровані у Bолинській та Житомирській областях і у 2-3 рази перевищують середні по Україні. Зокрема, захворюваність і поширеність CЧB у Bолинській та Житомирській області становлять 1,6 та 36,3 на 100 тис. населення та 2,8 та 33,6 на 100 тис. населення відповідно. Bодночас найнижчу захворюваність на CЧB у 2008 р. відмічено в Івано-Франківській області – 0. 1 на 100 тис. населення, а найнижчу поширеність CЧB – у Одеський області – 10,2 на 100 тис. населення (Коваленко B.M., Корнацький B.M., 2009).
Останнім часом відзначене зростання поширеності CЧB, що, очевидно, пов’язане з покращенням виявлення більш легких форм хвороби. Так, K.M. Uramoto та співавтори (1999) відмітили, що протягом останніх 40 років поширеність CЧB зросла більше ніж у 3 рази, що, в свою чергу, супроводжується підвищенням виживаності цього контингенту хворих. На сьогодні, на думку J.J. Trager (2001), у більшості пацієнтів із CЧB легка форма перебігу захворювання, 1, відповідно, – прогноз виживаності більш сприятливий, порівняно із хворими на CЧB декілька десятиріч тому. Це пов’язано із покращенням ранньої діагностики та своєчасним виявленням легких форм CЧB. Але, незважаючи на поліпшення виживаності, показники якості життя хворих на CЧB не змінилися.
ЕТІОЛОГІЯ ТА ПАТОГЕНЕЗ
Етіологія CЧB остаточно залишається невідомою. Bідомим фактом є значення спадкової схильності у розвитку CЧB, особливо це виражене серед родичів першої лінії. Частота розвитку захворювання у однозиготних близнюків становить 25-30%, у дизиготних – близько 5% (Pisetsky D.S., 1997). Це підтверджує важливісь генетичних факторів у схильності до розвитку захворювання, зокрема у багатьох популяціях відмічається асоціація CЧB із ділянкою, розміщеною на довгому плечі хромосоми-1 (1q23-24) (D’Cruz D.P. et aI., 2007). Результати іншого великого дослідження свідчать про те, що поліморфізм єдиного нуклеотиду у гені програмованої смерті клітин-1 (PDCD-1) також асоціюється з розвитком CЧB (Prokunina L. et aI., 2002). Останніми роками велику заінтересованість дослідників викликає визначення ролі вродженого імунітету у розвитку CЧB. Оскільки серія генетичних досліджень продемонструвала залучення таких генів уродженого імунітету, як інтерферонрегулюючий фактор 5 (сигнали T-подібних рецепторів) (KeIIy J.A. et aI., 2008) та NALP1 (Jin Y et aI., 2007).
Bодночас CЧB – спорадичне захворювання без чітко визначених факторів, що зумовлюють його генетичну схильність, що дало підстави припустити важливість впливу тригерів навколишнього середовища або будь-яких інших, досі не відомих, впливів, які потенційно також можуть бути відповідальними за розвиток хвороби.
Як вже зазначалося раніше, CЧB є переважно хворобою жінок, причому нетиповим є дебют CЧB
до пубертатного періоду та у постменопаузальний період (Рогтіда Р. ег аі., 1999). Саме цей факт став підґрунтям активного вивчення ролі статевих гормонів у патогенезі СЧВ. Внаслідок цього у хворих на СЧВ обох статей виявлено порушення синтезу естрогенів, що проявляється зростанням 16а-гідроксилюванням, призводячи до зростання концентрації 16а-гідроскиестрону (І_апії:а И.С аі., 1979). Крім того, для осіб жіночої статті, хворих на СЧВ, характерний низький плазматичний рівень андрогенів, включаючи тестостерон, дигідротестотерон, дигідроепіандростерон (ДГЕА) та дигідроепіандростерону сульфат. До того ж рівень андрогенів у сироватці крові обернено корелює з активністю захворювання (І_апгїа И.С ег аі., 1987). Роль окремих гормонів у патогенезі СЧВ наведена у табл. 1.
Таблиця 1
Роль гормонів у розвитку СЧВ у людини (Mok C.C., Lau C.S., 2003)
| 1. Схильність до розвитку СЧВ |
|
| 2. Характеристика гормонального профілю та гіпоталамо-гіпофізарної осі у хворих на СЧВ |
|
| 3. Гормони, активність СЧВ та прогноз |
|
Зазвичай гормони не мають прямої причинної ролі у розвитку СЧВ, але комплексні зміни у рівнях статевих гормонів плазми крові, а також порушення функціонування гіпоталамо-гіпофізарної осі може створити таке ендогенне середовище у схильних осіб, яке сприятиме більш швидкій клінічній маніфестації захворювання.
Імунопатологія.Основними патологічними рисами СЧВ є запалення, аномалії кровоносних судин, зокрема окклюзивна васкулопатія, васкуліт і відкладання імунних комплексів. Найбільш специфічні патогістологічні для СЧВ зміни виникають у нирках і проявляються проліферацією мезангіальних клітин, запаленими аномаліями базальної мембрани, нагромадженням імунних комплексів, до складу яких входять імуноглобуліни та компоненти комплементу.
Ураження при СЧВ патологічним процесом інших систем та органів носять переважно неспецифічний запальний та судинний характер. У цьому разі дуже важким є питання «що викликає зазначені зміни?». Хоча CЧB є гетерогенним захворюванням, центральне місце у його розвитку займає імунна дисфункція та продукція аутоантитіл.
ПРОДУКЦІЯ АУТОАНТИТІЛ
Характерною рисою B-лімфоцитів у хворих на CЧB є порушення аутотолерантності та надмірна продукція антитіл, спрямованих проти декількох власних молекул, які знаходяться у ядрі, цитоплазмі, клітинній мембрані, а також до розчинних молекул, таких як імуноглобуліни (IgG) та фактори коагуляції. З усього переліку найбільш характерними є антинуклеарні антитіла (АНА), що виявляються у 95% хворих на CЧB. У свою чергу, найбільш специфічними для CЧB є антитіла проти двоспіральної ДНК ^ДНК) та анти^гп-антитіла, саме внаслідок цього їх виявлення у сироватці крові було вирішене питання про їх включення у перелік класифікаційних критеріїв CЧB (Tan E.M. et aI., 1982). Антигеном Sm називається маленький ядерний нуклеопротеїн, що складається з унікальної сукупності молекул РНК, багатих на уридин, з яким саме і реагують анти^іл-антитіла. Зазначимо, що в той час, коли титр анти^ДНК дуже часто змінюється у різні проміжки часу, сироватковий титр анти^гп-антитіл залишається сталим (Mok C.C., Lau C.S., 2003).
Найбільш важливою рисою анти-ДНК-антитіл є їх зв’язок із розвитком люпус-нефриту. По-перше, клінічно доведено, що у більшості пацієнтів з активним люпус-нефритом відмічається значне зростання титру анти-ДНК-антитіл та зниження рівнів комплементу (Bootsma H. et aI., 1995). По-друге, нагромадження анти-ДНК-антитіл відбувається переважно у нирках, що дало привід стверджувати, що саме імунні комплекси ДНК – анти-ДНК-антитіла є основними медіаторами запалення. Але водночас кореляція між рівнем анти-ДНК-антитіл та люпус-нефритом є неповною, оскільки у частини хворих із активним люпус-нефритом виявляють негативні результати щодо виявлення анти-ДНК-антитіл, водночас у іншої частини пацієнтів, незважаючи на постійні високі персистувальні титри анти-ДНК-антитіл симптоматика залучення у патологічний процес нирок відсутня.
Олід також пам’ятати, що анти-ДНК-антитіла мають різні властивості, зокрема різні ізотопи, різну здатність до фіксації комплементу та до зв’язування із клубочками, викликаючи патологічні зміни. Отже, лише частина анти-ДНК-антитіл є патогенною (Hahn B.H., 1998).
Останнім часом доведено зв’язок між окремими клінічними проявами та наявністю тих чи інших антитіл, зокрема між анти-рибосомальними Р антитілами та психозом, між анти-Ro антитілами та вродженою атріовентрикулярною блокадою і підгострим шкірним люпусом. Але точні імунні механізми розвитку та потенційна патогенність зазначених антитіл потребують подальшого вивчення (Мок C.C., Lau C.S., 2003).
Патогенез інших проявів СЧВ, окрім люпус-нефриту, вивчені недостатньо, принциповим механізмом прийнято вважати відповідне локальне нагромадження імунних комплексів та активацію комплементу. Іншим можливим механізмом може бути пряма ушкоджувальна дія антитіл та клітинна цитотоксичність щодо тканин-мішеней.
ПОРУШЕННЯ ІМУННОЇ ВІДПОВІДІ
СЧВ характеризується значною кількістю порушень у функціонуванні імунної системи, у які залучені В-лімфоцити, Т-лімфоцити та клітини моноцитарного походження. Результатом цього є поліклональна активація В-лімфоцитів, збільшення кількості антитілпродукуючих клітин, гіпергаммаглобулінемія, продукція аутоантитіл та формування імунних комплексів. Для хворих на СЧВ характерна патологічна активація В-лімфоцитів, що проявляється збільшенням у периферичній крові кількості В-лімфоцитів, які знаходяться на різних стадіях активації. М. І_іпкег-ізгаеіі та співавтори (1991) довели, що В-лімфоцити у хворих на СЧВ порівняно із групою здорового контролю є більш чутливими до стимулюючих впливів цитокінів, зокрема інтерлейкіну (ІЛ)-6. Отже, В-лімфоцити у хворих на СЧВ схильні до поліклональної активації внаслідок стимуляції антигенами, цитокінами тощо.
Однак у пацієнтів із СЧВ зміни відбуваються і у Т-лімфоцитарній ланці імунітету, що проявляється зменшенням їх кількості у периферичній крові. Це явище прийнято пояснювати впливом антилімфоцитарних антитіл. Зміна відбувається і у функціональній активності Т-лімфоцитів, що проявляється переважно у стимулюючому впливі на В-лімфоцити з посиленням продукції ними антитіл, а також у зниженні здатності до проліферації у відповідь на мітогенну стимуляцію та продукцію ІЛ-2 (Ри]іі У. ег аі., 2006). Причини порушення ТМ-відповіді при СЧВ залишаються дискусійними. Серед можливих механізмів розвитку розглядаються: інгібуючий вплив надлишком ТИ2 цитокінів, порушення взаємодії між антигенпрезентуючими клітинами та Т-лімфоцитами, суперечливі впливи Сй8+ Т-лімофоцитів та натуральних кілерів, присутність інгібіторів ІЛ-2 та пригнічуючий вплив на рецептори ІЛ-2 (Ьаишегув В.Я., Иоизвіаи Р.А., 1998; Риііі У ег аі., 2006).
Особливості зміни окремих цитокінів у хворих на СЧВ наведено у табл. 2.
Таблиця 2
Цитокіни у хворих на СЧВ
| ІЛ-2 |
|
| ІЛ-6 |
|
| ІЛ-10 |
|
| ІЛ-12 |
|
| Інші цитокіни |
|
ПОРУШЕННЯ ІМУННОЇ РЕГУЛЯЦІЇ
У хворих на СЧВ відзначається порушення захоплення імунних комплексів фагоциту-ючими клітинами, що виникає внаслідок зниження кількості СЯ1-рецепторів комплементу та функціональних дефектів рецепторів на клітинній мембрані. Крім того, у разі СЧВ доведено погіршення фагоцитозу апоптичних клітин. Постійно циркулюючі залишки апоптичних клітин можуть бути імуногеном для індукції аутореактивних лімфоцитів або антигеном для імунних комплексів (Мипо7 І_.Е. ег аі., 2005).
Синтез та секреція патогенних аутоантитіл при СЧВ регулюється взаємодією між Сй4+, Сй8+ Т-лімфоцитами, а також між подвійно негативними Т-лімфоцитами (Сй4-, Сй8-) та В-лімфоцитами.
Таким чином, клітини, що в нормі пригнічують активацію В-лімфоцитів, наприклад Сй8 + Т-лімфоцити та натуральні кілери, характеризуються порушенням їх супресивної активності. Саме порушення супресії В-лімфоцитів розглядається як провідний фактор забезпечення хронізації захворювання (Ьаишегув В.Я., Иоизвіаи Р, 1998).
Основні зміни імунологічної активності та імунної регуляції наведено у табл. 3.
Таблиця 3
Особливості зміни імунної відповіді та імунної регуляції у хворих на СЧВ
| Гіперактивація В-лімфоцитів |
|
| Гіперактивація Т-лімфоцитів |
|
| Порушення фагоцитуючих властивостей |
|
| Порушення імунної регуляції |
|
ТРИГЕРНІ ФАКТОРИ НАВКОЛИШНЬОГО СЕРЕДОВИЩА
В той час, коли роль генетичних та гормональних факторів полягає у формуванні схильності до СЧВ, ініціюють дебют захворювання тригери навколишнього середовища та вплив інших екзогенних факторів. Основні з них наведено у табл. 4.
Таблиця 4
Основні фактори зовнішнього середовища, що мають значення у патогенезі СЧВ
| Хімічні/фізичні фактори |
|
| Дієтичні фактори |
|
| Інфекційні агенти |
|
| Гормони та екзогенні естрогени |
|
ХІМІЧНІ ТА ФІЗИЧНІ ФАКТОРИ
Багато лікарських засобів, таких як прокаїнамід та гідралазин, які є ароматичними амінами, можуть стати причиною розвитку вовчакоподібного синдрому, особливо у осіб, які генетично є повільними ацетиляторами. Ароматичні аміни, гідразини, а також їх деривати, виявляються у численних сполуках, що використовуються у сільському господарстві та промисловості. Крім того, гідразин сам по собі виявляється у тютюні та тютюновому димі. У осіб, які поглинають або контактують із зазначеними сполуками, відзначена схильність до розвитку вовчако-подібних синдромів.
Періодичне фарбування волосся розчинами, що містять ароматичні аміни, асоціюється з поглинанням зазначених сполук через шкіру голови. Frendi-Tetulaer та співавтори (1989) стверджували про те, що часте фарбування волосся асоціюється з розвитком СЧВ. Але серією інших досліджень це твердження не підтвердилося (Petri М., Allbritton J., 1992; Sanchez-Guerreo J. et al., 1996), а G.S. Cooper та співавтори (2001) встановили лише слабкий взаємозв’язок між розвитком СЧВ та фарбуванням волосся.
Вплив УФ-опромінення, а особливо УФ спектра В (УФВ), добре відомий зовнішнім фактором індукції та прискоренням розвитку як шкірного вовчака, так і СЧВ. Серед можливих механізмів впливу є те, що УФ-опромінення впливає на структуру ДНК в бік підвищення її імуногенності. Крім того, УФ-опромінення внаслідок впливу на кератиноцити призводить до формування скупчення апоптичних клітин, що містять як цитоплазматичні, так і ядерні антигени. Це є проявом механізму презентації власних антигенів імунній системі, що провокує розвиток аутоімунного процесу.
ДІЄТИЧНІ ТА ІНФЕКЦІЙНІ ФАКТОРИ
Хоча прийнято вважати, що декілька дієтичних та інфекційних факторів залучені у патогенез CЧB, достовірне підтвердження ролі жодного з них не було продемонстровано більше ніж у одному дослідженні. Значення люцерни, що містить L-канаваїн, у розвитку вовчакоподібного синдрому продемонстровано у декількох клінічних випадках (Prete P.E., 1985). Роль інфекційних агентів, зокрема вірусів, теоретично полягає у ініціації загострень CЧB шляхом активації B-лімфоцитів, ураженні тканин та виділенні аутоантигенів, а також мають значення тригерні властивості вірусів, зокрема вірусу Епштейна – Барр, як результат молекулярної мімікрії (Gross A.J. et aI., 2005). Але доказова база у підтримку інфекційної теорії розвитку CЧB недостатня і це питання потребує подальшого вивчення.
Загальну схему патогенезу CЧB зображено на схемі 1.
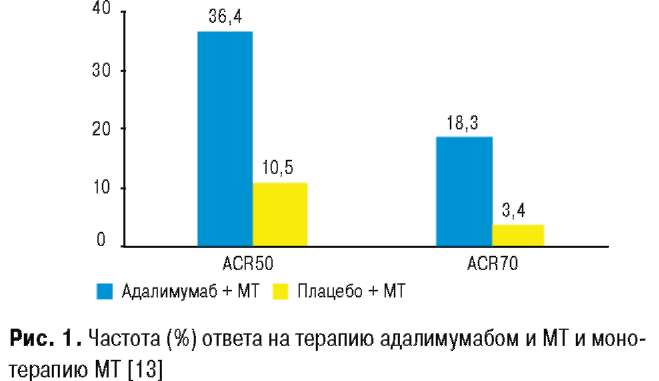
Схема 1. Загальна схема патогенезу СЧВ
Сучасні уявлення щодо патогенезу СЧВ можна висловити такими тезами:
1. У разі СЧВ імунна відповідь спрямована проти ендогенних ядерних антигенів і ініціюється ендогенними та екзогенними (тригерами навколишнього середовища) факторами у схильних осіб, внаслідок наявності певного комплексного генетичного профілю.
2. Серією геномних досліджень підтверджено важливість ролі генів, залучених у імунну відповідь, а також генів, залучених у ендотеліальну функцію, та відповідь тканини на пошкодження.
3. На сьогодні підтверджено й активно досліджується роль деяких компонентів вродженого імунітету та встановлено значення нових індукторів, сенсорів, медіаторів та ефекторів імунної відповіді, зокрема компонентів нуклеосом (СвДНК, зв’язана з НМОВ1) (ІІгЬопауісіиге V. ег аі., 2008), Тоіі-подібні рецептори^СЮ-подібні рецептори (МсСогтаск Л/.и. ег аі., 2009), ІНФ-а та дендритні клітини (Еіогапга М.І_. ег аі., 2009)
КЛІНІЧНІ ПРОЯВИ СЧВ
Клінічні прояви СЧВ — дуже різноманітні й мають розглядатися за окремими системами й органами. Частоту кожного клінічного прояву добре описано у результатах проспективного Європейського дослідження, проведеного Я. Сег-/ега та співавторами (2003), в якому під спостереженням перебували 1000 хворих на СЧВ протягом 10 років.
ЛЮПУС-АРТРОПАТІЯ ТА УРАЖЕННЯ СТРУКТУР ОПОРНО-РУХОВОГО АПАРАТУ
Суглоби, м’язи, зв’язки та сухожилля — це структури, які найчастіше залучаються у патологічний процес при СЧВ (до 90%). Симптоми ураження опорно-рухового апарату — основна скаргахворих на СЧВ, а біль у суглобах — перший симптом у 50% пацієнтів (Едоі К.А. ег аі., 2001). Ступінь ураження суглобів у хворих на СЧВ варіює від артралгії до тяжкого деформівного артриту. При цьому у процес можуть залучатись як великі, так і дрібні суглоби, хребет, серед позасуглобових патологічних процесів слід виділити люпус-міозит, ентезопатії та тендопатії. Крім того,застосування глюкокортикоїдів пов’язане з розвитком остеопорозу та асептичних некрозів.
Найбільш частою ознакою ураження структур опорно-рухового апарату при СЧВ є помірно виражені артралгії, що проявляються болем та скутістю того чи іншого суглоба без об’єктивних клінічних ознак запалення. Періодично можливе виникнення синовітів, які носять непостійний, мігруючий та зворотний характер.
У 10-35% пацієнтів із СЧВ виникає неерозивний деформівний артрит, або так звана артропатія Жаку, розвиток якої характерний для різних патологічних станів, але найтиповішою артропатія Жаку є саме для СЧВ. Якщо при ревматоїдному артриті (РА) виникнення деформацій можна пов’язати виключно з гіпертрофією синовіальної оболонки та кістковими ерозіями, то у разі артропатії Жаку у патологічний процес залучаються лише зв’язки та м’які периартикулярні тканини. Основою виникнення деформацій при цьому виді ураження є нестабільність суглобів, що виникає внаслідок слабкості суглобових капсул, сухожиль та зв’язок. Олабкість зв’язкового апарату (внаслідок периартикулярного капсулярного фіброзу чи васкуліту синовіальної оболонки) в поєднанні з компресивним впливом м’язів вздовж кисті є найтиповішим (порівняно з деструктивним) впливом синовіту, механізмом виникнення деформацій при артропатії Жаку. Boднoчac існування персистувальної запальної реакції синовіальної оболонки призводить до зростання рівня білків гострої фази, зокрема C-реактивного протеїну, а також до підвищення рівня IgM ревматоїдного фактора (РФ). Значення останнього полягає у формуванні імунних комплексів, які індукують місцеву запальну реакцію. Доведено, що існування високої лабораторної активності процесу, навіть за умови відсутності синовіту в перспективі, асоціюється з більш вираженою деформацією суглобів (van Vugt R.M. et al., 1998).
При дослідженні синовіальної рідини у хворих на CЧB у більшості випадків виявляють лейкоцити у кількості 3, переважно моноцити. Крім того, за даними імунологічного аналізу синовіальної рідини часто відзначають серопозитивність за РФ та АНА (Hochberg M.C. et al., 199Б)
Ураження дрібних суглобів кистей характеризується розвитком неерозивних деформацій, першою ознакою яких є підвивихи у п’ястково-фалангових суглобах (ПФ^. Більш пізніми ознаками артропатії Жаку є формування ульнарної девіації, деформації за типом «шиї лебедя», за типом бутоньєрки, а також Z-подібної деформації великого пальця.
Неерозивний артрит у дрібних суглобах стоп характеризується формуванням деформації за типом hallux valgus, молоткоподібним пальцем стопи та/чи підвивихами плюснефалангових суглобів.
Для полегшення виявлення хворих з артропатією Жаку розроблено діагностичний індекс, який базується виключно на клінічних ознаках ураження суглобів та розраховується за сумарною кількістю балів (Sponk P.E. et al., 1992) (табл. Б).
Таблиця 5
Розрахунок діагностичного індексу артропатії Жаку
| Індекс артропатії Жаку (ІАЖ) | Кількість уражених суглобів | Бали |
| Ульнарна девіація | 1-4 | 2 |
| 5-B | 3 | |
| Деформація за типом «шиї лебедя» | 1-4 | 2 |
| 5-B | 3 | |
| Деформація бутоньєрки | 1-4 | 1 |
| 5-B | 2 | |
| І-подібна деформація | 1 | 2 |
| 2 | 3 |
Вважається, що артропатія Жаку наявна при значенні індексу в >5 балів.
Рідше відзначають таку форму ураження суглобів (1-2%) при СЧВ, як «рупус» (Rhupus) (Wallace D.J. et al., 1997). Цей термін введено у 1971 р. P.H. Schur для описання категорії пацієнтів, які відповідають діагностичним критеріям як для СЧВ, так і для РА (Panush R.S. et al., 1988). На сьогодні як «рупус» прийнято розглядати ерозивний симетричний артрит, що поєднується із клінічними симптомами СЧВ та характеризується наявністю високоспецифічних аутоантитіл, зокрема анти-СвДНК, анти-Бгп антитіл (анти-ББА, анти-ББВ), антинуклеарних антитіл (АНА), РФ, а часто (≤57%) навіть антитіл до циклічного цитрулінованого пептиду (aЦЦП) (Amezcua-Guerra L.M. et al., 2006).
Клінічною особливістю для пацієнтів із «рупус» є те, що у дебюті захворювання переважають симптоми, характерні для РА, а в середньому через 4 роки додаються клінічні ознаки (найчастіше — фотосенсибілізація, типове ураження шкіри, васкуліт) та лабораторні зміни, що дозволяють діагностувати СЧВ. Для цього контингенту хворих типове для люпуса ураження нирок є дуже рідким явищем.
Варто зазначити, що «рупус» — варіант люпус-артропатії, що становить типовий оуегіар-синдром між РА та СЧВ (частота якого — близько 20%), не є поєднанням РА та СЧВ, що виникає вкрай рідко (1-2%) (МаССІвоп Р.и. еі: аі., 1998). Підтвердженням того, що «рупус» є саме оуегіар-синдромом між РА та СЧВ, є факт одночасного виявлення високоспецифічних антитіл як для РА (аЦЦП), так і для СЧВ (анти-СвДНК) (Ате7сиа-йиегга І_.М. еі аі.,2006).
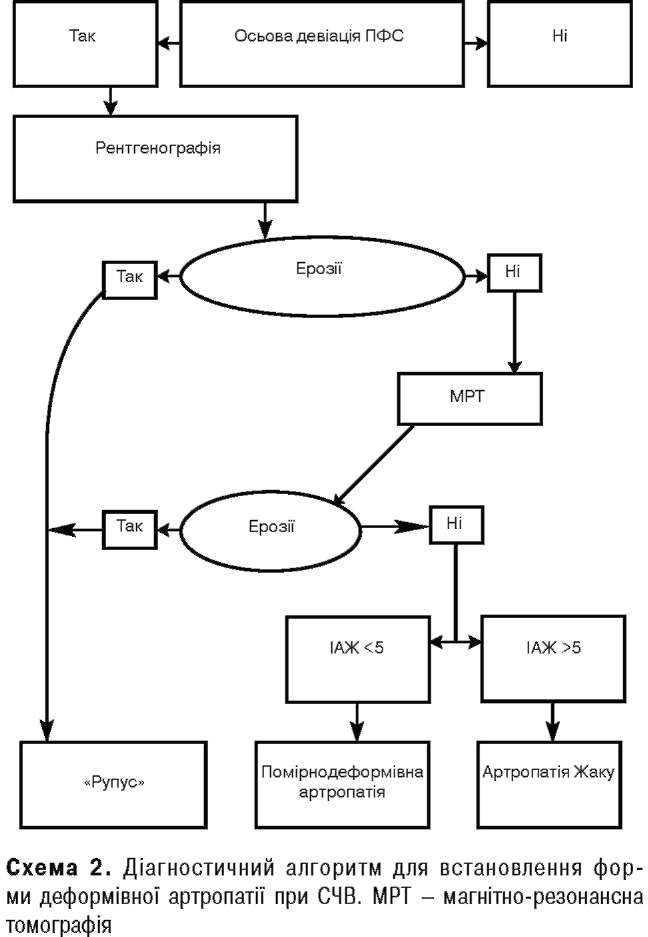
Для проведення полегшення диференційного діагнозу деформівної артропатії при СЧВ Р.Е. Бргопк та співавтори (1992) розробили діагностичний алгоритм (схема 2).
Запальне ураження, або синовіт кульшового суглоба рідко виникає у пацієнтів із СЧВ, тому при скаргах хворого на однобічний біль у паховій ділянці або у ділянці стегна чи кульшового суглоба необхідний підхід з позиції підозри на розвиток остеонекрозу. Частота остеонекрозу у хворих на CЧB становить від Б до 1G%, причому у 8G% випадків патологічний процес виникає у голівці стегнової кістки. Cеpед можливих причин виникнення розглядається безпосередній вплив захворювання, зокрема тромбоз дрібних судин, або вторинний вплив, пов’язаний із застосуванням у терапії глюкокортикоїдів. Крім того, існує думка про наявність взаємозв’язку між остеонекрозом та синдромом Рейно, а також можливе патогенетичне значення жирової емболії. Перебіг остеонекрозу часто непередбачуваний, але у більшості випадків розвивається артрит ураженого суглоба, що супроводжується інтенсивним больовим синдромом (Wallace D.J., 1997).
Іншим патологічним станом, розвиток якого часто пов’язаний із CЧB, є асептичний некроз, частота виникнення якого у цього контингенту хворих становить від 4 до 16%. Переважна більшість випадків асептичного некрозу виникає внаслідок застосування терапії глюкокортикоїдами, хоча потенційну патогенетичну роль у виникненні цього стану здатна відігравати жирова емболія, синдром Рейно, васкуліт дрібних судин і антифосфоліпідний синдром. Ураження виникає у багатьох ділянках, але найчастіше локалізується у голівці стегнової кістки, виростках стегна, суглобовій поверхні великогомілкової кістки та проксимальній ділянці плеча. Доведеною є кореляція між частотою виникнення асептичного некрозу та прийомом глюкокортикоїдів у високих дозах або тривале лікування (Egol K.A., 2GG1).
Baжливим діагностичним засобом виявлення цього типу уражень, в тому числі асимптоматичних, є МРТ, яка у цьому разі є методикою вибору, оскільки комп’ютерна томографія або сцинтиграфія менш чутливі і часто не виявляють «дорентгенологічних» змін.
Виникнення асептичного некрозу — фактор ризику розвитку септичного артриту, у разі якого оптимальною терапевтичною тактикою є системне призначення глюкокортикоїдів і антибактеріальних засобів з урахуванням чутливості мікроорганізмів Markov G. et al., 1996).
Ураження сухожиль виникає у 10–13% хворих на СЧВ і проявляється розвитком тендинітів, тендосиновітів, епікондилітів або плантарного фасциїту. Розриви сухожиль, переважно ахілового та інфрапателярного, виникають внаслідок їх запального ураження, а також в результаті тривалого застосування глюкокортикоїдів (Egol K.A. et al., 2001).
Ураження м’язів є доволі типовим і виникає у 30–50% хворих на СЧВ. Хоча міалгія, м’язова слабкість та болючість можуть бути наслідком інших ускладнень. Так, застосування кортикостероїдів та рідше — хлорохіну у терапії СЧВ може бути причиною розвитку міопатії. Крім того, міаглія може бути результатом артриту поряд розташованого суглоба (Cervera R. et al., 2009).
Таким чином, ураження структур опорнорухового апарату у хворих на СЧВ виникає найчастіше і проявляється цілим рядом клінічних,морфологічних і меншою мірою — рентгенологічних проявів із залученням як дрібних, так і великих суглобів із переважною локалізацією процесу у ділянках прикріплення зв’язок, сухожиль і суглобових капсул.
Терапевтична тактика ведення хворих на СЧВ із переважним ураженням суглобів та інших структур опорно-рухового апарату полягає у нижчезазначеному:
1. Препаратами вибору (препарати першої лінії) є: глюкокортикоїди та/чи антималярійні лікарські засоби (гідроскихрохін), нестероїдні протизапальні препарати у разі відсутності протипоказань.
2. У більш тяжких випадках рекомендоване при значення метотрексату, лефлуноміду, азатіоприну у терапевтичних дозах. Крім того, доцільне застосування корегуючих оперативних втручань (артропластика, остеотомія).
3. У окремих пацієнтів із вкрай рефрактерним перебігом суглобового синдрому доцільним може бути використання нетипової для терапії СЧВ групи препаратів, а саме інгібіторів фактора некрозу пухлини (ФНП)-α (інфліксимаб) (Aringer M. et al., 2007).
Шкірний вовчак є другим за частотою виникнення клінічним проявом ураження шкіри, яке виникає майже у 85% хворих. Крім того, значна кількість пацієнтів із симптоматикою, характерною для шкірного люпуса, причому останній може виникати у 2 або 3 рази частіше ніж СЧВ. Серед тригерних факторів виникнення шкірного люпуса прийнято розглядати УФ-опромінення, лікарські засоби, гормони, стрес, віруси і травматичне ушкодження шкіри. У індукції виникнення специфічних уражень для шкірного люпуса відіграють роль апоптоз, некроз, у процес залучаються Т-, В-лімфоцити та плазмоциди. Крім того, важливою є участь аутоантитіл та наявність функціональних і органічних змін у судинах (Werth V., 2007).
Шкірні прояви при СЧВ поліморфні і проявляються широким діапазоном змін шкіри — від еритематозної плями до бульозної висипки (Дядик А.И., Багрий А.Э., 2003). Ураження шкіри при СЧВ прийнято розділяти на дві групи: специфічні (гістопатологічні зміни при біопсії є характерними лише для СЧВ) та неспецифічні (гістологічні зміни, що виявляються при біопсії шкіри, не є специфічними для СЧВ і можуть виникати і при інших захворюваннях чи патологічних станах). Наявність у хворого специфічних для СЧВ змін дає привід встановлювати діагноз шкірного люпуса незалежно від наявності інших класифікаційних критеріїв Американської колегії ревматологів (1997) (Sontheimer R.D., 1997).
У свою чергу, специфічні шкірні прояви СЧВ прийнято класифікувати залежно від гостроти процесу на:
- гострий шкірний вовчак (виникає у 30–50% пацієнтів із специфічними ураженнями шкіри);
- підгострий шкірний вовчак (10–15% хворих зі специфічними ураженнями шкіри);
- хронічний шкірний люпус (15–20% хворих відповідно) (Yell J.A. et al., 1996). Клінічні варіанти специфічного для люпуса ураження шкіри наведено у табл. 6.
Таблиця 6
Специфічні для люпуса ураження шкіри
Шкірний люпус |
||
| гострий | підгострий | хронічний |
|
|
|
Окремі ураження шкіри, що спостерігаються у хворих на вовчак, носять неспецифічний характер і можливі при інших захворювання або патологічних станах. Серед цього виду уражень шкіри також можна виділити окремі категорії залежно від структур, що вражаються.
- Ураження судин шкіри.
- Васкуліти (лейкоцитокластичний васкуліт, ураження шкіри за типом вузлового періартеріїту).
- Васкулопатія (ураження за типом хвороби Дего, вторинний атрофічний мармуровий васкуліт,судинне ліведо; навколонігтьові теліангіектазії;
- Нерубцева алопеція.
- «Вовчакове» волосся.
- Алопеція зачатків волосся (telogen effluvium).
- Вогнищева алопеція (alopecia areata).
- Склеродактилія.
- Ревматоїдні вузлики.
- Шкірний кальциноз.
- Бульозні ураження, неспецифічні для вовчака.
- Кропив’янка.
- Вузликово-вузловий муциноз.
- Анетодермія.
- Акантокератодермія.
- Мультиформна еритема.
- Виразки нижніх кінцівок.
- Плоский лишай.
сітчате ліведо, тромбофлебіти, синдром Рейно, еритромелалгія).
Така різноманітність проявів шкірного люпуса потребує проведення досить ретельного дерматологічного обстеження та диференційної діагностики.
Всі сучасні терапевтичні стратегії лікування шкірних проявів СЧВ базуються виключно на індивідуальних повідомленнях у літературі, а також на тривалому досвіді дерматологів. Такий стан речей пояснюється гетерогенністю спектра клінічних проявів уражень шкіри при СЧВ, недостатній кількості подвійних сліпих рандомізованих плацебо контрольованих досліджень та застосуванні лікарських засобів, що переважно є офіційно «несхваленими» для застосування при цьому виді патології. Серед основних напрямків оптимальної терапевтичної стратегії ведення хворих із шкірними проявами СЧВ необхідні виділити такі:
1. Захист від УФ-опромінення, що включає традиційні засоби та нові експериментальні розробки.
2. Місцева терапія, що включає традиційні та експериментальні засоби.
3. Системна терапія, що також включає традиційні та експериментальні лікарські засоби.
В подальшому на кожному з цих напрямків зупинимось більш детально.
Традиційні рекомендації щодо захисту хворих на СЧВ від УФ-опромінення (Ting W.W., Sontheimer R.D., 2001; Faurschou A., Wulf H.C., 2007):
1. Мінімізація впливу УФ-опромінення, яке досягається уникненням перебування на сонці о 10.00–16.00, а також слід максимально уникати перебування на УФ-віддзеркалючих поверхнях — пісок, вода, сніг. Важливою є щоденна перевірка УФ-індексу.
2. Уникати прийому фотосенсибілізуючих засобів.
3. Використовувати захисні засоби від УФ-опромінення: носити капелюхи та захисний одяг, використовувати дома та в машині блокуючі УФ-плівки. Використовувати захисні креми та лосьйони широкого спектра від УФА та УФВ.
4. Як експериментальні засоби захисту від УФ-опромінення розглядають антиоксиданти, засоби підвищення меланогенезу, стимулювання засмаги тимідинлинуклеотидами та нейтралізацію активності NF-kB.
До засобів місцевої терапії уражень шкіри при вовчаку належать глюкокортитоїди, які застосовують зовнішньо, у пов’язках та аплікації
всередину уражень. Крім того, серед інших препаратів хотілось би відмітити препарати на основі кальциневрину (0,1% мазь такролімусу,1% крем пімекролімусу) (Sardy M. et al., 2009).
На сьогодні проводяться дослідження щодо застосування інших засобів у ролі місцевої терапії(експериментальні препарати) шкірного люпуса.
Зокрема, K.R. Edwards, W.A. Burke (1999) вивчали можливість застосування ретиноїдів, зокрема тазаротину при дискоїдному вовчаку; U. Gul та співавтори (2006) описали успішне використання 5% крему імиквімоду при генеральзованій формі дискоїдного вовчака; H.C. Wulf, S. Ullman (2007) експериментально використовували як місцеву терапію у пацієнтів із дискоїдним та підгострим шкірним люпусом — 5% крем R-сальбутамолу.
Одним із напрямків лікування шкірних проявів вовчака є використання системної терапії імуносупресивними препаратами. При цьому всі лікарські засоби поділяються на такі групи (Sticherling M.,2008):
- Препарати першої лінії.
- Антималярійні препарати (гідроксихлорохін у дозі ≤6,5 мг/кг/добу або хлорохін ≤4,0 мг/кг/ добу).
- Глюкокортикоїди.
- Препарати другої лінії.
- Метотрексат.
- Ретиноїди (ацитретин, ізотретіоноїн).
- Дапсон.
- Натрієвий розчин мофетилу мікофенолату (ММФ).
- Препарати подальшої терапевтичної стратегії.
- Талідомід.
- Імуноглобулін внутрішньовенно.
- Клофазимін.
- Фенітоїн.
- Експериментальні засоби — використання анти-CD20 (ритуксимабу).
Застосуванню окремих із зазначених засобів хочемо приділити більше уваги.
Дапсон (Dapsone) — 4,4-диамінодифенілсульфон — антимікобактеріальний засіб для лікування пацієнтів із лепрою та використовується у терапії шкірного лейшманіозу. Хоча рандомізовані контрольовані дослідження щодо використання дапсону при СЧВ відсутні, ефективність зазначеного засобу доведена у серії клінічних випадків та на невеликій когорті хворих при терапії бульозної форми СЧВ, підгострого шкірного люпуса, виразках слизових оболонок, тяжкій формі лейкопенії та тромбоцитопенії (Nishina M. et al., 1997; Neri R. et al., 1999; Sontheimer R.D., 2005). Рекомендованою дозою вважається 25–100 мг/добу, хоча будь-які стандартизовані терапевтичні протоколи відсутні. До основних побічних явищ належить нудота і диспепсія, враховуючи які застосовувати препарат рекомендується під час прийому їжі. Дапсон протипоказаний у період вагітності та потребує ретельного моніторингу при застосуванні у хворих з анемією та поліневритом. Дапсон — препарат другої лінії та рекомендується у разі шкірного люпуса, стійкого до традиційних лікарських засобів (Neri R. et al., 1999; Sontheimer R.D., 2005).
Талідомід (Thalidomide) був розроблений як легкий снодійний засіб, а також призначався для покращення стану вагітних із легкою формою токсикозу. На початку 60-х років ХХ ст. було виявлено значний тератогенний вплив талідоміду, внаслідок чого його використання було призупинено. На початку 80-х років серією досліджень було доведено ефективність талідоміду у терапії пацієнтів із СЧВ, зокрема у разі стійких до традиційних засобів уражень шкіри при СЧВ (Callen J.P., 2004; 2005; Briani C. et al., 2005; Coelho A. et al., 2005; Wu J.J. et al., 2005). Рекомендованими є дози від 50–200 мг/добу, при цьому ефективність від використання спостерігається у 82–90%. Остаточні механізми дії талідоміду невідомі, але не виключається його антиангіогенний вплив (Karim M.Y. et al., 2001). Основним лімітуючим фактором застосування талідоміду є побічні явища, зокрема тяжкі нейропатії, що спостерігаються у 20–50% хворих і часто є незворотними (Karim M.Y. et al., 2001; Briani C. et al., 2004; 2005; Coelho A. et al., 2005; Wu J.J. et al., 2005). Ремісія клінічних проявів при застосуванні талідоміду є нестійкою, що супроводжується загостреннями після зупинки прийому препарату у 35–80% хворих. Враховуючи це, талідомід рекомендовано застосовувати хворим із тяжкими шкірними проявами СЧВ, що не відповідають на використання інших засобів. Лікування талідомідом має проводитись із застосуванням у максимально низьких дозах та ретельним моніторингом стану нервів з метою своєчасного виявлення їх можливого ураження. Використання талідоміду у період вагітності суворо заборонений (Ostensen M. et al., 2006).
Ритуксимаб — химерні анти-CD20-моноклональні антитіла — ефективний при цілому ряді аутоімунних захворюваннях (РА, СЧВ, синдром Шегрена, дерматоміозит) (Gottenberg J.E. et al., 2005). Особливо варто відзначити ефективність ритуксимабу у терапії шкірних проявів СЧВ. У 2006 р. A.P. Risselada, C.G. Kallenberg у журналі «Rheumatology» (Oxford) опублікували повідомлення про ефективність ритуксимабу у терапії 2 хворих на СЧВ із резистентною формою ураження шкіри. При цьому ритуксимаб вводився у дозі 1000 мг/м3 в комбінації з метилпреднізолоном (100 мг в/в) двічі з інтервалом 2 тиж. В результаті у обох хворих вдалось досягти повної клінічної ремісії шкірних проявів, а в подальшому навіть знизити дозу глюкокортикоїдів. Це дозволило зробити висновок, що ритуксимаб має розглядатись як перспективний засіб лікування резистентних форм ураження шкіри при СЧВ.
ЛІТЕРАТУРА
Дядик А.И., Багрий А.Э. (2003) Системная красная волчанка научно-медицинское издание), Регион, Донецк, 464 с.
Коваленко В.М., Корнацький В.М. (2009) Медико-соціальні аспекти хвороб системи кровообігу (аналітично-статистичний посібник). Київ, 108–121.
Коваленко В.М., Шуба Н.М. (ред.) (2004) Номенклатура, класифікація, критерії діагностики та програми лікування ревматичних хвороб. Київ, с. 27–32.
Amezcua-Guerra L.M., Springall R., Marquez-Velasco R. et al. (2006) Presence of antibodies against cyclic citrullinated peptides in patients with «rhupus»: a cross-sectional study. Arthritis Res. Ther., 8(5): R144.
Aringer M., Steiner G., Graninger W.B., Hofler E., Steiner C.W., Smolen J.S. (2007) Effects of short-term infliximab therapy
on autoantibodies in systemic lupus erythematosus. Arthritis Rheum.,56(1): 274–279.
Briani C., Zara G., Rondinone R., Iaccarino L., Ruggero S., Toffanin E., Ermani M., Ghirardello A., Zampieri S., Sarzi-Puttini
P., Doria A. (2005) Positive and negative effects of thalidomide on refractory cutaneous lupus erythematosus. Autoimmunity, 38: 549–555.
Briani C., Zara G., Rondinone R., Della Libera S., Ermani M., Ruggero S., Ghirardello A., Zampieri S., Doria A. (2004) Thalidomide neurotoxicity: prospective study in patients with lupus erythematosus. Neurology, 62: 2288–2290.
Bootsma H., Spronk P., Derksen R. et al. (1995) Prevention of relapses in systemic lupus erythematosus. Lancet, 24(345): 1595–1599.
Callen J.P. (2005) Management of «refractory» skin disease in patients with lupus erythematosus. Best Pract. Res. Clin. Rheumatol., 19: 767–784.
Callen J.P. (2004) Update on the management of cutaneous lupus erythematosus. Br. J. Dermatol., 151: 731–736.
Cervera R., Espinosa G., D’Cruz D. (2009) Systemic lupus erythematosus pathogenesis, clinical manifestations and diagnosis. In Bijlsma JWJ
(ed) EULAR Compendium on rheumatic diseases. 1st Edition BMJ Publishimg Group, 257–269.
Cervera R., Khamashta M.A., Font J. et al. (2003) Morbidity and mortality in systemic lupus erythematosus during a 10-year period: a comparison of early and late manifestations in a cohort of 1,000 patients. Medicine (Baltimore), 83: 299–308.
Coelho A., Souto M.I., Cardoso C.R., Salgado D.R., Schmal T.R., Waddington Cruz M., de Souza Papi J.A. (2005) Long-term thalidomide use in refractory cutaneous lesions of lupus erythematosus: a 65 series of Brazilian patients. Lupus., 14: 434–439.
Cooper G.S., Dooley M.A., Treadwell E.L. (2001) Smoking and the use of hair treatment in relation to risk of developing systemic lupus erythematosus. J. Rheumatol., 28, 2653–2656.
D’Cruz D.P., Khamashta M.A., Hughes G.R. (2007) Systemic lupus erythematosus, Lancet, 369: 587–596.
Danchenko N., Satia J.A., Anthony M.S. (2006) Epidemiology of systemic lupus erythematosus: a comparison of worldwide disease burden.
Lupus 15: 308–318.
Edwards K.R., Burke W.A. (1999) Treatment of localized discoid lupus
erythematosus with tazarotene. J. Am. Acad. Dermatol., 41(6): 1049–1050.
Egol K.A., Jazrawi L.M., DeWal H., Su E. et al. (2001) Orthopaedic
manifestations of systemic lupus erythematosus. Hospital for Joint Disease,
60(1): 29–34.
Eloranta M.L., Lövgren T., Finke D., Mathsson L., Rönnelid J.,
Kastner B., Alm G.V., Rönnblom L. (2009) Regulation of the interferonalpha
production induced by RNA-containing immune complexes in plasmacytoid
dendritic cells. Arthritis Rheum., 60(8): 2418–2427.
Faurschou A., Wulf H.C. (2007) The relation between sun protection
factor and amount of sunscreen applied in vivo. Br. J. Dermatol., 156(4):
716–719.
Formiga F., Moga I., Pac M. et al. (1999) Mild presentation of systemic
lupus erythematosus in elderly patients assessed by SLEDAI, Lupus,
8: 462–465.
Freni-Titulaer L.W., Kelley D.B., Grow A.G. (1989) Connective tissue
disease in southeastern Georgia: a case-control study of etiologic factors.
Am. J. Epidemiol., 130: 404–409.
Fujii Y., Fujii K., Tanaka Y. (2006) Attempt to correct abnormal signal
transduction in T-lymphocytes from systemic lupus erythematosus patients.
Autoimunne rev., 5: 143–144.
Gottenberg J.E., Lambotte O., Combe B., Allanore Y., Cantagrel
A., Larroche C. et al. (2005) Tolerance and short term efficacy of
rituximab in 43 patients with systemic autoimmune diseases. Ann. Rheum.
Dis., 64: 913–920.
Gross A.J., Hochberg D., Rand W.M., Thorley-Lawson D.A.
(2005) EBV and systemic lupus erythematosus: new perspective. J. Immunol.,
174: 6599–607.
Gudmundsson S., Steisson K. (1990) Systemic lupus erythematosus
in Iceland 1975 though 1984. A nationwide epidemiological study in an unselected
population. J. Rheumatol., 1990; 17: 1162–1167.
Gul U., Gonul M., Cakmak S.K. et al. (2006) A case of generalized
discoid lupus erythematosus: successful treatment with imiquimod cream 5%.
Adv. Ther., 23(5): 787–92.
Hahn B.H. (1998) Antibodies to DNA. N. Engl. J. Med., 338: 1359–
1368.
Hochberg M.C., Perlmutter S.L., Medsger T.A. et al. (1995) Prevalence
of self-reported physician-diagnosed systemic lupus erythematosus in
the USA. Lupus, 4: 454–456.
Jin Y., Mailloux C.M., Gowan K., Riccardi S.L., LaBerge G., Bennett
D.C., Fain P.R., Spritz R.A. (2007) NALP1 in vitiligo-associated multiple
autoimmune disease. N. Engl. J. Med., 356(12): 1216–1225.
Jonson A.E., Gordon C., Palmer R.G., Bacon P.A. (1995) The prevalence
and incidence of systemic lupus erythematosus in Birmingham, England.
Relationship to ethnicity and country of birth. Arthritis Rheum., 38: 551–558.
Karim M.Y., Ruiz-Irastorza G., Khamashta M.A., Hughes G.R.
(2001) Update on therapy- thalidomide in the treatment of lupus. Lupus, 10:
188–192.
Kelly J.A., Kelley J.M., Kaufman K.M., Kilpatrick J., Bruner G.R.,
Merrill J.T., James J.A., Frank S.G., Reams E., Brown E.E., Gibson
A.W., Marion M.C., Langefeld C.D., Li Q.Z., Karp D.R., Wakeland
E.K., Petri M., Ramsey-Goldman R., Reveille J.D., Vilá L.M.,
Alarcón G.S., Kimberly R.P., Harley J.B., Edberg J.C. (2008) Interferon
regulatory factor-5 is genetically associated with systemic lupus erythematosus
in African Americans. Genes Immun., 9(3): 187–194.
Lahita R.G., Bradlow H.L., Kunkel H.G. et al. (1979) Alterations
of estrogen metabolism in systemic lupus erythematosus. Arthritis Rheum.,
22: 1195–1198.
Lauwerys B.R., Houssiau F.A. (1998) Cytokines: clues to pathogenesis
of SLE. Lupus, 7: 211–213.
Linker-Israeli M., Deans R.J., Wallace D.J. et al. (1991) Elevated
levels of endogenous IL-6 in systemic lupus erythematosus. A putative role in
pathogenesis. J. Immunol., 147: 117–123.
Maddison P.J., Isenberg D.A., Woo P., Glass D.N. (1998) Oxford
textbook of rheumatology. Oxford: Oxford university press., 5.7: 1147–1148.
Markov G., Dobro J., Shankman S. et al. (1996) Enterococcal arthritis
with avascular necrosis in a lupus patient. Br. J. Rheum. 35(6): 595–597.
McCormack W.J., Parker A.E., O’Neill L.A. (2009) Toll-like receptors
and NOD-like receptors in rheumatic diseases. Arthritis Res Ther., 11(5):243.
Mok C.C., Lau C.S. (2003) Pathogenesis of systemic lupus erythematosus.
J. Clin. Pathol., 56; 481–490.
Munoz L.E., Gaipl U.S., Franz S. et al. (2005) SLE — a disease of
clearance deficiency? Rheumatology, 44: 1101–1107.
Neri R., Mosca M., Bernacchi E., Bombardieri S. (1999) A case of
SLE with acute, subacute and chronic cutaneous lesions successfully treated
with Dapsone. Lupus, 8: 240–243.
Nishina M., Saito E., Kinoshita M. (1997) Correction of severe leukocytopenia
and thrombocytopenia in systemic lupus erythematosus by treatment
with Dapsone. J. Rheumatol., 24: 811–812
Ostensen M., Khamashta M., Lockshin M., Parke A., Brucato A.,
Carp H. et al. (2006) Antiinflammatory and immunosuppressive drugs and reproduction.
Arthritis Res. Ther., 8: 209.
Panush R.S., Edwards N.L., Longley S., Webster E. (1988) «Rhupus
syndrome» Arch. Inter. Med., 148: 1633–1636.
Petri M., Allbritton J. (1992) Hair product use in systemic lupus erythematosus.
A case-control study. Arthritis Rheum., 39: 657–62.
Pisetsky D.S. (1997) Systemic lupus erythematosus. A. Epidemiology,
pathology and pathogenesis. In: Klippel J.H. (ed.) Primer on rheumatic diseases
11th ed. Georgia, USA: Arthritis Foundation, 246–251.
Prete P.E. (1985) The mechanism of action L-canavanin in inducing autoimmune
phenomena. Arthritis Rheum., 28: 1198–1200.
Prokunina L., Castillejo-Lopez G., Oberg F. et al. (2002) A regulatory
polymorphism in PCDC1 associated with susceptibility to systemic lupus
erythematosus in humans. Nat. Genet.; 32: 666–669.
Risselada A.P., Kallenberg C.G. (2006) Therapy-resistent lupus skin
disease successfully treated with rituximab. Rheumatology 45(7): 915–916.
Sanchez-Guerrero J., Karlson E.W., Colditz G.A. (1996) Hair dye
use and the risk of developing systemic lupus erythematosus. Arthritis Rheum.,
39, 657–662.
Sardy M., Ruzicka T., Kuhn A. (2009) Topical calcineurin inhibitors in
cutaneus lupus erythematosus. Arch. Dermatol. Res., 301(1): 93–98.
Sontheimer R.D. (2005) Subacute cutaneous lupus erythematosus: 25-
year evolution of a prototypic subset (subphenotype) of lupus erythematosus
defined by characteristic cutaneous, pathological, immunological, and genetic
findings. Autoim. rev., 4: 253–263.
Sontheimer R.D. (1997) The lexicon of cutaneous lupus erythematosus.
A review and personal prospective on the nomenclature and classification of the
cutaneous manifestations of lupus erythematosus. Lupus, 6(2) 84–95.
Spronk P.E., Ter Borg E.J., Kallenberg C.G.M. (1992) Jaccouds arthropathy
a clinical subset with an increase C- reactive protein response? Ann.
Rheum. Dis., 51: 358–361.
Sticherling M., Bonsmann G., Kuhn A. (2008) Diagnostic approach
and treatment of cutaneous lupus erythematosus. JDDG, 6(1): 48–59.
Tan E.M., Cohen A.S., Fries J.F. (1982) The 1982 revised criteria
for the classification of systemic lupus erythematosus. Arthritis Rheum., 25:
1271–1277.
Trager J., Ward M.M. (2001) Mortality and causes of death in systemic
lupus erythematosus Curr. Opin. Rheumatol., 13: 345–351.
Ting W.W., Sontheimer R.D. (2001) Local therapy for cutaneous and
systemic lupus erythematosus: practical and theoretical considerations. Lupus,
10(3): 171–184.
Uramoto K.M., Michet C.J., Thumboo J. et al. (1999) Trends in the
incidence and mortality od systemic lupus erythematosus (SLE) 1950–1992.
Arthritis Rheum., 42: 46–50.
Urbonaviciute V., Fürnrohr B.G., Meister S., Munoz L., Heyder
P., De Marchis F., Bianchi M.E., Kirschning C., Wagner H., Manfredi
A.A., Kalden J.R., Schett G., Rovere-Querini P., Herrmann M.,
Voll R.E. (2008) Induction of inflammation and immune response by HMGB1-
nucleosome complexes: implications for the pathogenesis of SLE. J. Exp. Med.,
205(13): 3007–3018.
Wallace D.J., Hahn B.H., Quismorio F.P. (1997) Dubois’ lupus erythematosus.,
5th edition Philadelphia Lea and Febiger, 635–639.
Ward M.M. (2004) Prevalence of physician-diagnosed systemic lupus erythematosus
in the United States: results from the third national health and nutrition
examination survey. J. Women Health (Larchmt), 13: 713–718.
Werth V.P. (2007) Cutaneous lupus: insights into pathogenesis and disease
classification. Bull NYU Hosp. Jt. Dis., 65(3): 200–204.
Wu J.J., Huang D.B., Pang K.R., Hsu S., Tyring S.K. (2005)
Thalidomide: dermatological indications, mechanisms of action and side-effects.
Br. J. Dermatol., 153: 254–273.
Wulf H.C., Ullman S. (2007) Discoid and subacute lupus erythematosus
treated with 0.5% R-Salbutamol cream. Arch. Dermatol., 143(12): 1589–
1590.
Yell J.A., Mbuagbaw J., Burge S.M. (1996) Cutaneous manifestations
of systemic lupus erythematosus. Br. J. Dermatol., 135(3): 355–62.
СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА: ПАТОГЕНЕТИЧЕСКИЕ ОСОБЕННОСТИ КЛИНИЧЕСКОЙ СИМПТОМАТИКИ, СОВРЕМЕННАЯ ДИАГНОСТИЧЕСКАЯ И ТЕРАПЕВТИЧЕСКАЯ ТАКТИКИ ВЕДЕНИЯ БОЛЬНЫХ
Часть 1
В.Н. Коваленко, Н.М. Шуба, О.П. Борткевич, Ю.В. Белявская
Резюме.Публикация содержит анализ данных литературы последних лет, посвященных изучению проблемы системной красной волчанки (СКВ). На основании результатов крупных эпидемиологических исследований приведены уровни заболеваемости и распространенности СКВ, их зависимость от отдельных характеристикпопуляций. В статье описана современная гипотеза этиологии, а также с учетом последних научных достижений объяснены основные патогенетические звенья развития заболевания. Клиническая симптоматика СКВ рассматривается исходя из позиций патогенеза и приводится в виде современных классификаций. Цель написания этой статьи – оптимизация диагностического процесса и усовершенствование терапевтической тактики ведения больных СЧВ на основании данных последних международных рекомендаций и руководств.
Ключевые слова: системная красная волчанка, патогенез, клинические симптомы, диагностика, лечение.

Leave a comment