Сучасний погляд на патогенетичні аспекти подагри (огляд літератури)
Кондратюк В.Є., Тарасенко О.М.
Резюме. Подагра є важливою соціально-економічною проблемою у світі, що зумовлює зниження і втрату працездатності, обмеження професійної діяльності, погіршення якості життя хворих. Підвищення рівня уратів у крові є провідним лабораторним маркером подагри. Разом з тим гомеостаз обміну уратів детермінується балансом між комплексом процесів секреції, екскреції сечової кислоти (CК) нирковими канальцями і її виведенням екстраренальними шляхами. Домінуюча кількість CК (65–75%) екскретується нирками, менша частина (25–35%) — через шлунково-кишковий тракт. У представленій статті висвітлено основні патогенетичні аспекти подагри, що включають каскад імунологічних змін, варіанти порушення уратної рівноваги; наведена остання інформація щодо ролі ниркових, кишкових і бактеріальних транспортерів СК у підтримці уратного гомеостазу. Сучасною тенденцією вивчення подагри є акцентування уваги дослідників саме на екстраренальних шляхах виведення СК у взаємозв’язку зі змінами імунологічного статусу, що дозволить розширити наші знання щодо особливостей патогенезу захворювання.
Подагра — системне захворювання, що характеризується появою запальної реакції в місцях відкладання кристалів моноурату натрію (МУН) в осіб з гіперурикемією (ГУ), яка зумовлена зовнішніми чинниками і (або) генетичними факторами [7]. Під подагрою, з одного боку, патофізіологічно, розуміють аутозапальний синдром внаслідок активації інфламасом, з іншого — метаболічне порушення, що характеризується накопиченням уратів, як наслідок ГУ, з їх артикулярною та екстраартикулярною кристалізацією та хронічним запаленням [22].
Сучасні епідеміологічні дані свідчать про істинне зростання захворюваності на подагричний артрит, що не зумовлене підвищенням якості діагностики чи збільшенням кількості хворих, що приймають діуретичні препарати. З іншого боку, збільшення вживання білків в їжу в багатьох популяціях за минуле десятиліття призвело до значного зростання кількості випадків даного захворювання в усьому світі [5]. Серед української популяції поширеність подагри становить 0,4% дорослого населення, в той же час поширеність ГУ сягає 15–20% [3]. Інші автори наголошують, що ГУ частіше відмічають у представників негроїдної раси та чоловіків [47]. Співвідношення хворих чоловіків до хворих жінок становить 20:1 [8], а згідно з даними A. Reginato та співавторів [39] поширеність подагри у жінок репродуктивного віку та чоловіків становить 2 і 5,9% відповідно. За даними інших авторів, поширеність подагри у віці старше 75 років становить 2,8% у жінок та 5,3% — у чоловіків [3]. Пік захворюваності припадає на вік 40–50 років у чоловіків та старше 60 років — у жінок, що пояснюється наявністю в репродуктивному періоді останніх естрогенів, які стимулюють канальцеву екскрецію сечової кислоти (СК) і, тим самим, виявляють уратзнижувальний ефект [51]. Хоча Л.М. Михайлів (2016) [3] стверджує, що навіть після настання менопаузи у здорових жінок рівень СК в крові в середньому на 1 мг/дл нижчий, ніж у чоловіків. Тільки у 3–6% пацієнтів симптоми подагри з’являються у віці молодше 25 років, у таких випадках подагричний артрит має зазвичай тяжкий перебіг та несприятливий прогноз [3].
Подагра становить велику соціальну та економічну проблему для суспільства, призводить до зниження та втрати працездатності, обмеження професійної діяльності, тим самим погіршуючи якість життя [1, 14].
Підвищення рівня уратів у крові є першопричиною розвитку подагри, а запальний артрит індукується накопиченням кристалів МУН у суглобах. До 80% уратів в організмі людини утворюється шляхом ендогенного метаболізму пуринових основ, близько 20% — шляхом надходження пуринів ззовні з їжею (рисунок). СК є кінцевим продуктом деградації пуринів [3]. Загалом в організмі здорової людини міститься близько 1100 мг СК. За добу відбувається обмін СК 50–70% від загальної кількості (400–600 мг).
В організмі тварин синтезується фермент уриказа, який розщеплює надлишок СК до алантоїну, тому спровокувати подагру у тварин в експерименті неможливо. Власне тому і рівень СК в крові людини є вищим (240–360 мкмоль/л), ніж у ссавців (5–50 мкмоль/л). Такий рівень СК в сироватці крові людини відібраний еволюцією, оскільки СК має важливі антиоксидантні властивості [38, 48]. Концентрація СК в сироватці крові залежить від віку та статі. У нормі верхній рівень СК в крові чоловіків дещо вищий — 7 мг/дл, ніж в жінок репродуктивного віку — 6 мг/дл; у період постменопаузи даний показник у жінок сягає 7 мг/дл [3, 4]. Рівень СК менше 120 мкмоль/л вважається гіпоурикемією. Цікаво, що існує циркадний біоритм синтезу СК — максимальний рівень її відмічається з 6:00 до 10:00, при цьому рівень урикемії в крові в середньому підвищується на 25–30 мкмоль/л, а мінімальний — вночі [6].
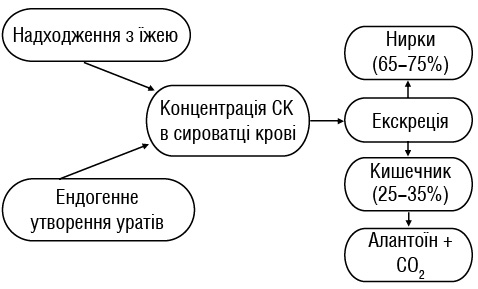
Гомеостаз обміну уратів залежить від балансу між комплексом процесів секреції та екскреції нирковими канальцями та виведенням через шлунково-кишковий тракт (ШКТ). СК синтезується в печінці. Близько 65–75% СК виділяється нирками, а 25–35% — через ШКТ [20, 27, 53]. У кишечнику відбувається бактеріальний уриколіз СК до алантоїну та вуглекислого газу.
Згідно із сучасною класифікацією ГУ поділяється на ту, що виникає внаслідок гіперпродукції уратів при порушенні метаболізму та, як наслідок, зниження ниркової екскреції, або комбінації цих двох механізмів (змішана форма). Головною причиною ГУ є порушення ниркового шляху виведення уратів, меншою мірою — гіперпродукція СК. ГУ є давно відомим супутником таких шкідливих звичок, як вживання надмірної кількості алкоголю та висококалорійної їжі. Однак причини її гіперпродукції досі залишаються нез’ясованими. Немає жодних досліджень, які б пояснили точні механізми гіперпродукції СК. К. Ichida та співавторами (2014) у дослідженнях на мишах показано, що частою причиною ГУ є зниження саме екстраренального шляху виведення уратів внаслідок дисфункції гена АBCG2 [21]. Сучасні дослідження дозволили розширити розуміння патогенезу виникнення ГУ і запропонувати нову класифікацію. Згідно з останньою класифікацією термін «гіперпродукція сечової кислоти» має бути замінений на «перенавантаження ниркового шляху» (renal overload type), який включає істинну гіперпродукцію СК, зниження екстраренальної екскреції уратів (переважно за рахунок дисфункції гена АBCG2) та зниження ниркової екскреції уратів [21].
Загальна кількість уратів, які виділяються за хвилину, — це продукт загального кліренсу та концентрації СК [20]. Загальний кліренс уратів — це сума ренального та екстраренального кліренсу. Для підтримки стабільного рівня СК в крові потрібна відповідність її кількості, що продукується та елімінується [20]. Нирковий шлях елімінації СК умовно поділяють на 4 послідовні фази: 1) повна фільтрація; 2) повна реабсорбція у проксимальних ниркових канальцях; 3) секреція (близько 50% від реабсорбованих; 4) повторна реабсорбція у дистальних ниркових канальцях (40% від секретованих). Нирки відповідають за 70–80% денної елімінації СК [19]. Її кліренс в нормі — 10% від швидкості клубочкової фільтрації (ШКФ), що становить в середньому 8,7±2,5 мл/хв [2]. Урати крові добре фільтруються гломерулярним апаратом. Урати, що фільтруються, значною мірою реабсорбуються в проксимальних відділах клубочків. Також відбувається і секреція уратів. Обидва процеси здійснюються за рахунок мембранних уратних транспортерів. Тільки 3–10% відфільтрованих уратів екскретуються з сечею, інша частина реабсорбується в проксимальних відділах ниркових канальців. Фракційна екскреція уратів (ФЕУ) дозволяє визначати ефективність реабсорбції уратів нирками. ФЕУ визначається як відсоток фільтрованих уратів, які в результаті екскретуються. ФЕУ = екскретовані урати/фільтровані урати. ФЕУ може бути обчислена шляхом визначення концентрації уратів в крові та сечі й концентрації креатиніну в крові та сечі, використовуючи наступну формулу:
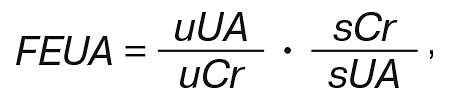
де FEUA (ФЕУ) — фракційна екскреція уратів, uUA — концентрація уратів в сечі, uCr — концентрація креатиніну в сечі, sCr — концентрація креатиніну в крові, sUA — концентрація уратів у крові. В той час як ГУ може бути наслідком гіперпродукції уратів та зниження виведення СК через ШКТ, зниження ренальної екскреції або низького рівня ФЕУ є предиктором ГУ. Рівень ФЕУ здорової людини в середньому становить 6–8%, тоді як у пацієнтів з подагрою рівень ФЕУ нижче 3–5% [19, 26]. Розподіл уратів складається з продукції СК, що дорівнює 1100 мг/добу, інтестинального кліренсу — 6 мл/хв, рівня ШКФ — 100 мл/хв, рівня СК. В підсумку — це кількість продукованої СК, що поділена на загальний кліренс СК, який складається з ренального та екстраренального [19]. Після фільтрації гломерулярним апаратом урати потрапляють в проксимальний відділ ниркових канальців, де більшість (98–100%) відфільтрованих уратів реабсорбується, значно менша частина уратів екскретується (близько 50% реабсорбованих). Проте ступінь і локалізація тубулярної секреції є предметом дискусій. На даний час зрозуміло, що після гломерулярної фільтрації 90–97% уратів реабсорбуються в проксимальних відділах ниркових канальців. Тубулярна секреція уратів відбувається, однак досі незрозуміло, чи відбувається секреція одночасно з реабсорбцією і (або) існує постреабсорбційна секреція в межах канальців. Таким чином, молекула СК може проходити через нирки багато разів, перед тим як екскретуватися [20, 27].
Не існує жодного методу, який би дозволяв виміряти ступінь реабсорбції уратів нирками. Враховуючи, що екскретованих уратів менше 10% від відфільтрованих, немає жодних заперечень того, що реабсорбція уратів нирками відіграє важливу роль у перерозподілі уратів. Існує багато уратних транспортерів, основними серед яких є три наступні: URAT1/SLC22A12, GLUT9/SLC2A9 та ABCG2/BCRP2. Саме вони відіграють головну роль в регуляції концентрації СК в крові [20, 27]. Відомо, що у частини пацієнтів з подагрою екскретується лише 40% СК через нирки [19]. Це може стосуватися хворих на подагру з нирковою недостатністю. У таких пацієнтів зростає роль позаниркового шляху виведення СК.
Урати надходять з крові у кишечник шляхом секреції, а також як компонент жовчі, слини, шлункового соку. У нормі СК не виводиться в чистому вигляді з калом, оскільки кишкова мікробіота виявляє уриказну активність, внаслідок чого СК в кишечнику розпадається до СО2 та алантоїну [6, 20]. Вперше роль кишечнику в екскреції подагри була описана досить давно (Buzard et al., 1952; Sorensen, 1965). У своїх дослідженнях вони показали, що при введенні оксалатів щурам значна частина їх виділяється через кишечник і в той же час через жовч оксалати виділялися в мінімальній кількості. А. Hosomi та співавтори (2012) [19] відмічають, що пряма інтестинальна секреція є одним із компонентів системи екскреції уратів і важливим шляхом їх виведення у пацієнтів з хронічною нирковою недостатністю (ХНН), а в деяких з них є основним альтернативним шляхом виведення оксалатів з організму. Однак й досі мало досліджень, які пояснюють механізми інтестинального уриколізу, що потребує подальшого вивчення.
Аналогічно до уратних транспортерів, що існують в нирках, в кишечнику теж є транспортери, які відповідають за виведення уратів (таблиця).
| Назва | Кодуючий ген | Вивчена стадія | Посилання |
|---|---|---|---|
| ABCG2/BCRP | ABCG2 | In vitro, in vivo, in cliniс | [18, 20, 28, 31, 41, 48 ] |
| MRP2 | ABCC2 | In vivo | [14, 16, 17] |
| MRP4 | ABCC4 | In vivo | [14, 16, 17] |
| GLUT9 | SLC2A9 | In vivo | [13, 36] |
| MCT9 | SLC13A9 | In clinic | [30] |
| NPT4 | SLC16A3 | No study | [40] |
| OAT10 | SLC22A13 | In vitro, in vivo | [10] |
| YgfU | ygfU | In vitro | [35] |
У кишечнику людини відкрито більше 5000 транспортерів, що переносять більше 3700 молекул [45]. Відомості про кишкові транспортери з’явилися ще раніше за ниркові [53], однак вивчені менше останніх.
Переносник ксенобіотиків АBCG2 вперше був виявлений у тканині плаценти. На даний час відомо, що він експресується на апікальній мембрані тканин нирок, печінки та кишечнику [21] і є важливим інтестинальним переносником СК; відіграє вирішальну роль в підтримці гомеостазу уратів в організмі як за рахунок виведення СК нирковим, так і позанирковим шляхом. АBCG2 опосередковано впливає на ренальну екскрецію уратів [21, 43]. Дисфункція цієї молекули зумовлює зниження ренальної екскреції уратів. Однак дослідження K. Ichida та співавторів [21] показали, що дисфункція АBCG2, навпаки, посилює ренальну екскрецію уратів, ці парадоксальні результати пояснюються двома фактами: даний ген експресується не лише в нирках, а третина уратів екскретується у людини екстраренальним шляхом, головним чином через ШКТ. У клітинах Caco-2, які є експериментальною моделлю клітин людського кишкового епітелію, помічено поляризований рух СК від базолатерального до апікального боку, і цей рух майже повністю припиняється за наявності інгібітора ABCG2 [19]. У дослідженнях на мишах пригнічення гена ABCG2 викликало зменшення кишкової екскреції СК та підвищення її концентрації в плазмі крові [21]. K. Ichida та співавтори (2012) [21] експериментально показали, що частою причиною ГУ є зниження саме екстраренального шляху виведення уратів внаслідок дисфункції АBCG2. Даний ген, можливо, стане мішенню для розробки в майбутньому нових уратзнижувальних препаратів, що дозволить уникати уролітіазу — побічного ефекту, що притаманний традиційній терапії подагри. В іншому дослідженні [55] у 5 з 6 щурів з ХНН після нефректомії рівень СК в сироватці не підвищився, в той же час рівень ABCG2 в кишечнику значно зріс. Підвищення рівня СК в сироватці у пацієнтів з дисфункцією ABCG2 можна пояснити зменшенням виділення СК через кишечник [49]. До 88,2% пацієнтів з дисфункцією ABCG2 середнього та тяжкого ступеня мають ризик раннього розвитку подагри [29]. Результати цих досліджень дозволили припустити, що зниження кишкової екскреції СК, спричиненої дисфункцією ABCG2, є поширеним механізмом ГУ [53].
У родині MRPs (мультирезистентних до лікарських засобів протеїнів) налічується 6 транспортерів, які розташовані на апікальній мембрані епітеліальних клітин кишечнику [16]. MRP-2 та -4 є органічними аніонними транспортерами, що також беруть участь у транспортуванні СК через стінку кишечнику, що було показано в дослідах на птахах С. Hilgendorf та співавторами (2007) [18].
Спочатку GLUT9 було ідентифіковано як транспортер глюкози. На даний час відомо, що, на відміну від інших GLUT, GLUT9, ймовірно, не бере участі у транспортуванні глюкози та/або фруктози [28, 30]. Не так давно було вивчено зв’язок між GLUT9 та СК. Незважаючи на постійно зростаючий перелік генів, що кодують ГУ, варіація в SLC2A9, що кодує переносник GLUT9, залишається основною генетичною детермінантою рівня СК у сироватці крові [28]. У дослідах на мишах із системним пригніченням GLUT9 було виявлено помірну ГУ, масивну гіперурикозурію та ниркову недостатність легкого ступеня [39].
Котранспортери Na/фосфат (NPTs), родина білків, що кодуються геном SLC17, які раніше характеризували як носії фосфатів, пов’язують із транспортуванням органічних аніонів [32]. Три члени родини SLC17, які пов’язані з концентрацією СК у сироватці крові, були ідентифіковані за допомогою геномного аналізу та позначені як NPT1 (SLC17A1), NPT4 (SLC17A3) та NPT (SLC17A4) [53].
Переносник фосфату натрію у людини (hNPT4) локалізується на апікальній мембрані ниркових канальців. Ймовірно, він відіграє важливу роль при ГУ, яка викликана прийомом діуретиків [24]. NPT4 присутній також і в тонкому кишечнику [41].
Білок SLC17A4 був виділений зі слизової оболонки кишечнику людини. Послідовність амінокислот має схожість на 48% з білком ниркового NPT1. Білок LC17A4 кодує переносник СК в кишечнику — NPT5 [50].
Родина OAT (кодованих геном SLC22A) становить приблизно половину родини транспортерів SLC22. Переважно переносники OAT знаходяться в нирках. Загалом ідентифіковано 9 ОАТ (OAT1–7, Oatv1 та URAT1). Деякі з них мають високу селективність до СК [34]. Органічний аніонний транспортер людини (hOAT10) виражений у нирках і слабше в кишечнику. У дослідженні з циклоспорин А-індукованою ГУ hOAT10 був ідентифікований як новий транспонтер СК [11].
Кишечник є ще одним місцем уриколізу. У субстраті культур Escherichia coli, Aerobacter aerogenes та Paracolobacterum, виділених з людського калу та вмісту кишечнику щурів, спостерігали зниження СК. У товстій кишці СК піддається дії великої кількості бактерій, які можуть використовувати її як метаболічний субстрат. Дані результати були виявлені під час досліджень на птахах [12]. У 1953 р. під час проведення дослідів, коли людині інтравенозно вводили СК, 80% її виділилося через нирки, в той час як при пероральному введенні СК остання розщеплюється більшою мірою та виводиться через кишечник [52]. Налічується близько 2000 бактеріальних переносників родини NAT/NCS2, однак експериментальну характеристику отримали лише 15. Останні дослідження in vitro показали наявність у E. coli бактеріального транспортера СК YgfU [36, 37]. Відомо, що група бактерій E. coli шляхом вироблення ензиму ксантиноксидази бере участь у деградації пуринів до алантоїну, алантоїнази та сечовини. З’явилися відомості, що такі ензими синтезують група лактобактерій та Pseudomonas [17]. Бактеріальні транспортери в кишечнику людини потребують подальшого досконалого вивчення.
Баланс між продукцією та елімінацією СК визначає рівень її концентрації в крові людини. Подагра дебютує у пацієнтів з рівнем СК понад 6,8 мг/дл [25]. ГУ називають стан підвищення рівня СК в крові >6,8 мг/дл, при якому розчинність МУН знижується. Тому згідно з міжнародними рекомендаціями при лікуванні подагри необхідно досягати таргетного рівня СК в крові <6 мг/дл (або 360 мкмоль/л), а у пацієнтів з тяжким перебігом подагри та наявністю тофусів — <5 мг/дл (300 мкмоль/л) [25].
Виражене підвищення концентрації уратів у плазмі крові, що виникає під час хронічної ГУ, призводить до їх перенасичення, а при концентрації >6,8 мг/дл може виникати осадження кристалів МУН [11]. Важливою патогенетичною складовою подагричного артриту є запальний каскад, спричинений відкладанням кристалів МУН у суглобах та інших тканинах, що зумовлює підвищення рівня прозапальних цитокінів та транслокацію в уражений суглоб нейтрофілів [15]. Кристали МУН, що відклалися, потрапляють в порожнину суглоба та запускають процес запалення. Однак не у всіх пацієнтів, які мають високий вміст СК в крові, розвивається подагричний артрит. Останні дослідження показали, що IL-1β є ключовим медіатором запалення при подагрі [7, 15]. Кристали МУН індукують відповідь неспецифічної ланки вродженого імунітету подібно до мікробного процесу [15].
Ініціюють процес запалення макрофаги, що надходять в порожнину суглоба і фагоцитують кристали МУН. Далі макрофаги створюють каркас для формування специфічних білків, так званих інфламасом у цитоплазмі макрофага. Інфламасоми є високомолекулярним білковим комплексом, який запускає механізми трансформації неактивного про-IL-1β в біологічно активний IL-1β, який згодом і вивільняється з клітини [7, 15, 46]. Важливим є те, що наявності лише кристалів МУН недостатньо для вивільнення та активації IL-1β з макрофагів. Даний процес потребує стимуляції вільними жирними кислотами або ліпополісахаридами [23, 35]. Саме тому споживання алкоголю або великої кількості жирної їжі може призвести до підвищення концентрації вільних жирних кислот, які є тригерами вивільнення IL-1β, що є важливим фактором ініціації гострого подагричного артриту [23]. IL-1β є основним медіатором запалення, який регулює проліферацію клітин, диференціювання та апоптоз при подагричному артриті [15]. Саме цей прозапальний цитокін може викликати вивільнення широкого спектра медіаторів запалення, які безпосередньо відповідають за приплив нейтрофілів до синовії, зокрема фактора некрозу пухлини (ФНП)-α [9, 12, 26].
Активація IL-1 рецепторів на ендотеліальних клітинах IL-1β є ключовим етапом розвитку запалення, що індукується кристалами МУН. Активація рецепторів IL-1 полегшує транскрипцію інших прозапальних цитокінів і хемокінів, які беруть участь у наступних стадіях розвитку запального процесу. Приплив нейтрофілів призводить до подальшого фагоцитозу кристалів МУН та продовження вивільнення як IL-1β, так і пов’язаних з ним прозапальних медіfторів (IL-6, IL-8, ФНП-α), а також простагландинів, кінінів, токсичних оксигенних радикалів, активізації фактора Хагемана та системи комплементу, що, в свою чергу, сприяє підвищенню проникності судинної стінки, міграції нейтрофілів [7, 16, 26]. Існує прямий кореляційний зв’язок між рівнем СК в крові та вмістом інтерлейкінів (ФНП-α, TGF-β, PAF) та інших біологічно активних речовин [3].
Гострий запальний процес, що супроводжує напади подагричного артриту, призводить до ушкодження суглоба. Тривале накопичення кристалів МУН сприяє утворенню тофусів, що складаються з кристалів МУН у матриксі ліпідів, білків та мукополісахаридів [44]. Ферменти, такі як матричні металопротеїнази та кістково-резорбтивні остеокласти, що виробляються локально в межах цих тофусів, призводять до прогресуючої ерозії кісток [44]. Підвищений рівень прозапальних цитокінів, що виникає під час спалахів подагричного артриту, також може зумовлювати пошкодження кістки. IL-6 є ключовою молекулою в процесі пошкодження кістки та хрящової тканини і відіграє вирішальну роль у формуванні остеобластів [7, 15].
Отже, сучасною тенденцією щодо вивчення механізмів розвитку та прогресування подагри є акцентування уваги дослідників на екстраренальних шляхах виведення СК та імунологічних аспектах патогенезу захворювання. Прогресивним і пріоритетним напрямком наукового пошуку в даному контексті є розробка шляхів впливу на каскад імунологічних змін у хворих на подагру та пошук засобів, що дадуть можливість нормалізувати рівень СК шляхом збільшення частки екстраренальної екскреції СК та її уриколізу в просвіті кишечнику. Це дозволить розширити спектр урикозуричної терапії, покращити клінічний перебіг захворювання та якість життя хворих на подагру.
Список використаної літератури
- 1. Капустянська А.А.(2013) Рання діагностика подагричного артриту на етапі первинної медико-санітарної допомоги. Світ медицини та біології, 4: 104.
- 2. Максудова А., Салихов И., Хабиров Р., Халфина Т. (2017) Подагра. Медпресс. Москва. с. 112.
- 3. Михайлів Л.М. (2016) Сучасний стан проблеми ранньої діагностики та адекватного лікування подагри. Проблеми остеології, 2(19): 8–14.
- 4. Палієнко І.А., Кармазіна О.М. (2014) Лікування подагри. «Видавництво АСТ-ПРЕС-Україна». Київ. с. 159.
- 5. Силантьева Т.С., Казимирко В.К., Козак И.А. и др. (2015) Подагра в практике врача-интерниста. Укр. ревматол. журн., 3(61): 48–52.
- 6. Синяченко О.В., Ігнатенко Г.А., Мухін І.В. (2004) Клініко-лабораторні аспекти пуринового обміну: норма та патологія. Медицина залізничного транспорту України, 1: 96–100.
- 7. Шуба Н.М. (2015) Гиперурикемия — мультиморбидная патология. Укр. ревматол. журн., 1(59): 72–83.
- 8. Яременко О.Б. (2015) Практическая ревматология: современные аспекты. «Библиотека «Здоровье Украины». Киев. с. 337.
- 9. Amaral F.A., Bastos L.F., Oleveira T.H. et al. (2016) Transmembrane TNF-αis sufficient for articular inflammation and hypernociception in a mouse model of gout. Eur. J. Immunol., 46(1): 204–11.
- 10. Bahn A., Hagos Y., Reuter S. et al. (2013) Identification of a new urate and high affinity nicotinate transporter, hOAT10 (SLC22A13). J. Biol. Chem., 283(24): 16332–16341.
- 11. Braun I.G., Campbell C.E. (1989) Uric acid decomposition in the lower gastrointestinal tract. J. Exp. Zool. (Suppl. 3): 70–4.
- 12. Cleophas M.C., Crişan T.O., Joosten L.A. (2017) Factors modulating the inflammatory response in acute gouty arthritis. Curr. Opin.Rheumatol., 29(2): 163–70.
- 13. De Bosch B.J., Kluth O., Fujiwara H. et al. (2014) Early-onsetmetabolic syndrome in mice lacking the intestinal uric acid transporterSLC2A9. Nat. Commun., 5: 4642.
- 14. Dudas P.L., Pelis R.M., Braun E.J. et al. (2005) Transepithelial urate transport by avian renal proximal tubule epithelium in primary culture. J. Exp. Biol., 208: 4305–4315.
- 15. Gonzalez Emilio B. (2012) An update on the pathology and clinical management of gouty arthritis. Clin. Rheumatol., 31: 13–21.
- 16. Grandvuinet A.S., Vestergaard H.T., Rapin N. et al. (2012) Intestinal transporters for endogenic and pharmaceuticalorganic anions: the challenges of deriving in-vitro kineticparameters for the prediction of clinically relevant drug–drug interactions. Royal Pharmaceutical Society. J. Pharm. Pharmacol., 64: 1523–1548.
- 17. Guo Z., Zhang J., Zhanli Wang Z. et al. (2016) Intestinal microbiota distinguish gout patients from healthy humans. Sci Rep., 6: 20602.
- 18. Hilgendorf C., Ahlin G., Seithel A. (2007) Expression of thirty-six drug transporter genes in human intestine, liver, kidney, and organotypic cell lines. DMD, 35(8): 1333–1340.
- 19. Hosomi A., Nakanishi T., Fujita T. et al. (2012) Extra-renal elimination of uric acid via intestinal efflux transporter BCRP/ABCG2. PLoS One., 7(2): e30456.
- 20. Hyndman D., Liu S., Miner J. (2016) Urate handling in the human body. Curr. Rheum. Rep., 18: 34.
- 21. Ichida K., Matsuo H., Takada T. et al. (2012) Decreased extra-renal urate excretion is a common cause of hyperuricemia. Nat. Commun., 3: doi: 10.1038/ncomms1756.
- 22. Jansen T., Janssen M. (2017) The American College of Physicians and the 2017 guideline for them anagement of acute and recurrent gout:treat to avoiding symptoms versus treat to target. Clin. Rheumatol., 36: 2399–2402.
- 23. Joosten L.A., Netea M.G., Mylona E. et al. (2010) Engagement of fatty acids with Toll-like receptor 2 drives interleukin-1 beta production via the ASC/caspase 1 pathway in monosodium urate monohydrate crystal-induced gouty arthritis. Arth. Rheum., 62(11): 3237–3248.
- 24. Jutabha P., Anzai N., Kitamura K. et al. (2010) Human Sodium Phosphate Transporter 4 (hNPT4/SLC17A3) as a Common Renal Secretory Pathway for Drugs and Urate. J. Biol. Chem., 285(45): 35123–35132.
- 25. Khanna D., Fitzgerald J.D., Khanna P.P. et al. (2012) American College of Rheumatology Guidelines for management of gout. Part 1: systematic nonpharmacologic and pharmacologic therapeutic approaches to hyperuricemia. Arth. Care Res., 64(10): 1431–1446.
- 26. Liu-Bryan R., Terkeltaub R. (2011) Tophus biology and pathogenesis of monosodium urate crystal-induced inflammation. In: Terkeltaub R, editor. Gout and other crystal deposition arthropathies. Philadelphia, PA: Elsevier: 59—71.
- 27. Maiuolo J., Oppedisano F., Gratteri S. et al. (2016) Regulation of uric acid metabolism and excretion. Int. J. Cardiol., 213: 8–14.
- 28. Mandal A., Mount D. (2015) The molecular physiology of uric acid homeostasis. Ann. Rev. Physiol., 77: 323–345.
- 29. Matsuo H., Ichida K., Takada T. et al. (2014) Common dysfunctional variants in ABCG2 are a major cause of early-onset gout. Sci Rep., 3: doi: 10.1038.
- 30. Mueckler M., Thorens B. (2013) The SLC2 (GLUT) Family of membrane transporters. Mol. Aspects Med., 34(0): 121–138.
- 31. Nakayama A., Matsuo H., Shimizu T. et al. (2013) A commonmissense variant of monocarboxylate transporter 9 (MCT9/SLC16A9) gene is associated with renal overload gout, but not with all gout susceptibility. Hum. Cell., 26: 133–136.
- 32. Nakayama A., Matsuo H., Takada T. et al. (2011) ABCG2 is a high-capacity urate transporter and its genetic impairment increases serum uric acid levels in humans. Nucleos. Nucleot. Nucl., 30: 1091–1097.
- 33. Neogi T. (2011) Clinical practice. Gout. N. Engl. J. Med., 364(5): 443—452.
- 34. Nigam S.K., Bush K.T., Martovetsky G.et al. (2015) The organic anion transporter (OAT) family: A systems biology perspective. Physiol. Rev., 95(1): 83–123.
- 35. Ohira H., Tsutsui W., Fujioka Y. (2017) Are short chain fatty acids in gut microbiota defensive players for inflammation and atherosclerosis? J. Atheroscler. Thromb., 24: 660–672.
- 36. Papakostas K., Frillingos S. (2012) Substrate Selectivity of YgfU, a Uric Acid Transporter from Escherichia coli. J. Biol. Chem., 287(19): 15684–15695.
- 37. Phay J.E., Hussain H.B., Moley J.F. (2000) Cloning and expression analysis of a novel member of the facilitative glucose transporter family, SLC2A9 (GLUT9). Genomics, 66: 217–220.
- 38. Prasad C., Umar I., Westfall S. et al. (2017) Managament of hyperuricemia and gout by prebiotics and probiotics: potentials and limitations. Int. J. Prob. Preb., 12(1): 5–16.
- 39. Preitner F., Bonny O., Laverrière A. (2009) GLUT9 is a major regulator of urate homeostasis and its genetic inactivation induces hyperuricosuria and urate nephropathy. Proc Natl Acad Sci U S A. Sep 8; 106(36): 15501–15506.
- 40. Reginato A.M., Mount D.B., Yang I. et al. (2012) The genetics of hyperuricaemia and gout. Nat. Rev. Rheumatol., 8(10): 610–621.
- 41. Reimer R., Edwards R. (2004) Organic anion transport is the primary function of the SLC17/type I phosphate transporter family. Pflugers Arch., 447(5): 629–635.
- 42. Sarkadi B., Ozvegy-Laczka C., Nemet K. (2004) ABCG2-a transporter for all seasons. FEBS Lett., 567: 116–120.
- 43. Schett G., Schauer C., Hoffmann M., Herrmann M. (2015) Why does the gout attack stop? A roadmap for the immune pathogenesis of gout. RMD Open, 1(Suppl. 1): e000046. doi: 10.1136/rmdopen-2015-000046.
- 44. Schlesinger N., Thiele R.G. (2010) The pathogenesis of bone erosions in gouty arthritis. Ann. Rheum. Dis., 69(11): 1907–1912.
- 45. Sedykh A., Fourches D., Jianmin D. et al. (2013) Human intestinal transporter database: QSAR modeling and virtual profiling of drug uptake, efflux and interactions. Pharm. Res., 30(4): 996–1007.
- 46. Shi Y., Evans J.E., Rock K.L. (2003) Molecular identification of a danger signal that alerts the immune system to dying cells. Nature, 425(6957): 516–521.
- 47. Singh J.A. (2013) Racial and gender disparities among patients with gout. Curr. Rheumatol. Rep., 15(2): 307.
- 48. So A., Thorens B. (2010) Uric acid transport and disease. J. Clin. Invest., 120(6): 1791–1799. doi: 10.1172/JCI42344.
- 49. Takada T., Ichida K., Matsuo H. et al. (2014) ABCG2 dysfunction increases serum uric acid by decreased intestinal urate excretion. Nucleos. Nucleot. Nucl., 33: 275–281.
- 50. Tagawa N., Miyaji T., Izawa S. et al. (2012) A Na-phosphate cotransporter homologue (SLC17A4 protein) is an intestinal organic anion exporter. Am. J. Physiol. Cell., 302: C1652–C1660.
- 51. Wallace K.L., Riedel A.A., Joseph-Ridge N. et al. (2014) Increasing prevalence of gout and hyperuricemia over 10 years among older adults in a managed care population. J. Rheumatol., 31(8): 1582–1587.
- 52. Wyngaarden J.B., Stetten D. Jr (1953) Uricolysis in normal man. J. Biol. Chem., 203(1): 9–21.
- 53. Xu X., Li C., Zhou P. et al. (2016) Uric acid transporters hiding in the intestine. Pharm. Biol., 54(12): 3151–315.
- 54. Shi Y., Evans J.E., Rock K.L. (2003) Molecular identification of a danger signal that alerts the immune system to dying cells. Nature, 425(6957): 516–521.
- 55. Yano H., Tamura Y., Kobayashi K. (2014) Uric acid transporter ABCG2 is increased in the intestine of the 5/6 nephrectomy rat model of chronic kidney disease. Clin. Exp. Nephr., 18(1): 50–55.
Современный взгляд на патогенетические аспекты подагры (обзор литературы)
Резюме. Подагра является важной социально-экономической проблемой в мире, что обусловливает снижение и потерю трудоспособности, ограничение профессиональной деятельности, ухудшение качества жизни больных. Повышение уровня уратов в крови является ведущим лабораторным маркером подагры. Вместе с тем гомеостаз обмена уратов детерминируется балансом между комплексом процессов секреции, экскреции мочевой кислоты (МК) почечными канальцами и ее выведением экстраренальным путем. Доминирующее количество МК (65–75%) выделяется почками, меньшая часть (25–35%) — через желудочно-кишечный тракт. В представленной статье освещены основные патогенетические аспекты подагры, включающие каскад иммунологических изменений, варианты нарушения уратного равновесия; приведена последняя информация о роли почечных, кишечных и бактериальных транспортеров МК в поддержании уратного гомеостаза. Современной тенденцией изучения подагры является акцентирование внимания исследователей именно на экстраренальных путях выведения МК во взаимосвязи с изменениями иммунологического статуса, что позволит расширить наши знания относительно особенностей патогенеза заболевания.
подагра, гиперурикемия, мочевая кислота, уратные транспортеры.
Адреса для листування:
Кондратюк Віталій Євгенович
01601, Київ, бульв. Т. Шевченка, 13
Національний медичний університет
імені О.О. Богомольця,
кафедра пропедевтики внутрішньої медицини № 2

Leave a comment