МЕТАБОЛІЧНИЙ ФЕНОТИП ОСТЕОАРТРИТУ. СУЧАСНІ ПОГЛЯДИ НА ПАТОГЕНЕЗ, МЕХАНІЗМИ ПРОГРЕСУВАННЯ ТА ПІДХОДИ ДО ЛІКУВАННЯ
Резюме. В останні роки спостерігається зростання інтересу до метаболічних змін при остеоартриті (ОА). В оглядовій статті підсумовані дані щодо метаболічного фенотипу ОА, про роль ожиріння, дисліпідемії, діабету в розвитку метаболічного фенотипу. Поточні проспективні епідеміологічні дослідження демонструють наявність чітких асоціацій між ОА і компонентами метаболічного синдрому. Деякі дослідники схильні розглядати метаболічний ОА лише як наслідок надмірного навантаження на опорні суглоби в результаті ожиріння. Однак численні недавні дослідження продемонстрували, що адипокіни і цитокіни, які продукуються жировою тканиною, гіперглікемія, інсулінорезистентність та дисліпідемія здатні порушувати метаболізм суглобових тканин. Вісцеральне ожиріння, дисліпідемія та інсулінорезистентність формують особливий вид запалення — низькорівневе, хронічне, пов’язане з метаболічними розладами, що отримало назву «метазапалення». Саме цей вид запалення відіграє вирішальну роль у патогенезі ожиріння, діабету II типу та його ускладнень, а множинні сигнальні шляхи пов’язують інсулінорезистентність та імунну відповідь. Ожиріння здійснює двояку дію на перебіг ОА: механічний вплив на опорні суглоби, а також генерацію метазапалення, що порушує метаболізм суглобових тканин неопірних суглобів. Таким чином, ожиріння може впливати на патогенез і прогресування ОА за допомогою біомеханічних ефектів, а також при збільшенні метастимулювального запалення.
Еще десятилетие назад остеоартрит (ОА) однозначно воспринимался как болезнь «tear and wear», что является единственным следствием деградации хряща без какого-либо участия других суставных клеток и тканей. Эта гипотеза базировалась на известных на то время факторах риска ОА, все из которых содержали механический аспект: травма, деформация суставов, нестабильность, длительно повторяющиеся механические воздействия на суставы, ожирение (для опорных суставов), старение. Эта гипотеза, без сомнения, является действующей, поскольку чрезмерное механическое напряжение любого сустава приводит к потере хряща, росту остеофитов, призванных стабилизировать и защитить измененный сустав [16]. Эта первоначальная парадигма медленно меняется, благодаря важнейшим открытиям за последние 20 лет [8].
Роль воспаления в развитии и прогрессировании ОА долгое время отрицалась, поскольку суставной хрящ является неваскуляризованной тканью. Создание клеточной культуры хондроцитов в 70-х годах ХХ столетия явилось революционным открытием, поскольку позволило рассматривать ОА как следствие клеточных событий [13]. Благодаря фантастическим достижениям молекулярной биологии установлена роль хондроцитов в поддержании гомеостаза хрящевой ткани, которые при определенных обстоятельствах способны выделять многочисленные растворимые медиаторы — простагландины, цитокины, хемокины [24]. Одновременно эти медиаторы способны увеличивать продукцию матриксных металлопротеиназ (ММП) хондроцитами. Эти открытия обусловили первые шаги в создании «воспалительной» парадигмы ОА [17]. Примечательно, что источник и тип медиаторов воспаления могут отличаться при различных фенотипах ОА. Синовит долгое время считался патогномоничным симптомом ревматоидного артрита, однако многие исследовательские группы продемонстрировали, что синовит различной степени выраженности (от легкой до тяжелой) присутствует при ОА, кроме того, его интенсивность коррелирует с прогнозом заболевания [5]. Помимо этого, представление об ОА как патологии только хрящевой ткани претерпело существенные изменения. Стало очевидным, что в патологический процесс при ОА вовлекаются все структуры сустава, в том числе субхондральная кость [22].
Спор о возможном только механическом повреждении суставного хряща был фактически прекращен после открытия внутриклеточного механосигналинга [18]. Оказалось, что любое ненормальное механическое напряжение — растяжение, сжатие, компрессия, напряжение сдвига, гидростатическое давление — может быть преобразовано во внутриклеточные сигналы посредством возбуждения механорецепторов, расположенных на поверхности клеток сустава. Эти сигналы могут привести к избыточной экспрессии провоспалительных медиаторов, таких как простагландины, цитокины, хемокины, в хондроцитах и клетках субхондральной кости [28]. Преобразование механического сигналинга в синтез медиаторов воспаления опосредуется активацией внутриклеточных сигнальных путей, прежде всего, через NF-kВ и МАРК.
На современном этапе ОА рассматривается как анормальное ремоделирование суставных тканей, управляемое множеством провоспалительных факторов, продуцируемых, прежде всего, субхондральной костью и синовией [7]. Анормальное/патологическое ремоделирование впоследствии формирует метаболическую, а позже и функциональную дисфункцию всех суставных структур [22] с развитием типичной клинической картины и однотипных патобиохимических изменений.
В то же время ОА не является уникальным заболеванием, но представляет собой гетерогенную группу с различными клинико-патогенетическими фенотипами, которые постоянно изменяются, гетерогенно и независимо прогрессируют, что в конечном итоге приводит к общим клиническим проявлениям [9]. Сегодня четко определяется ведущая роль системного воспаления в прогрессировании ОА и дифференциации клинических фенотипов на основании факторов риска: старение (возраст-зависимый фенотип), травма (посттравматический ОА), наследственность (генетически детерминированный ОА), ожирение и метаболический синдром (МС) (метаболический фенотип) [1, 14].
ОА, ассоциированный с МС, возникает в результате сочетания метаболических нарушений — ожирения, сахарного диабета, инсулинорезистентности, дислипидемии, гиперурикемии, артериальной гипертензии. В его основе лежит концепция нарушения системной регуляции суставных тканей. Некоторые исследователи склонны рассматривать ОА, ассоциированный с МС, только как следствие избыточной нагрузки на опорные суставы вследствие ожирения [19]. Однако многие недавние исследования продемонстрировали, что адипокины, продуцируемые жировой тканью, гипергликемия, инсулинорезистентность и дислипидемия могут нарушать метаболизм суставных тканей, впрочем как и других органов [1, 4, 8, 10, 21]. В последние годы также установлены новые механизмы, связывающие ОА с метаболическими заболеваниями: прямая взаимосвязь инсулинорезистентности и синовиального воспаления; роль окисленных липопротеидов низкой плотности в формировании очагов жирового повреждения кости и поддержания воспаления синовиальной оболочки; потенциальное вовлечение кишечной микрофлоры и наличие циркадных ритмов [14]. Кроме того, более высокая смертность пациентов с ОА и МС от сердечно-сосудистых событий может быть объяснена не только низкой физической активностью, но и низкоуровневым хроническим воспалением, связанным с ОА [8].
Понимание роли ожирения в патогенезе ОА сместилось от восприятия, что оно оказывает исключительно механическое воздействие на хрящ опорных суставов, до признания роли ожирения в прогрессировании ОА кистей (неопорных суставов). Действительно, эпидемиологические исследования показали, что у пациентов с ожирением в 2 раза повышена частота ОА кистей по сравнению с общей популяцией [31]. Сегодня жировая ткань рассматривается не только как пассивный аккумулятор жирных кислот, но и как мощный эндокринный орган, а также продуцент провоспалительных сигнальных молекул, наличие которых знаменует хроническое низкоуровневое иммунное воспаление [1, 26]. Жировая ткань является эндокринным органом, способным производить субстанции с локальным (автокринним) и системным (эндокринным) эффектами [10].
Все эти доказательства роли воспаления в развитии и прогрессировании ОА открыли дверь в новую и захватывающую область исследований молекулярных взаимодействий между суставными тканями/клетками и отдаленными органами/тканями и влиянием нарушений метаболических процессов на ОА.
Эпидемиологические исследования подтвердили более высокую частоту МС при ОА (59% против 23% без ОА) [25]. Одновременно по результатам нескольких исследований отмечали повышенный риск развития ОА (независимо от локализации) у пациентов с МС [29]. Исследование A.W. Visser и соавторов (The NEO study, 2015) [29] продемонстрировало также ведущую и двоякую роль ожирения в развитии ОА. При ОА коленных суставов, безусловно, ожирение оказывают механическое воздействие на суставы в первую очередь, тогда как при ОА внимание акцентируется на хроническом вялотекущем воспалении, связанном с ожирением. Недавно опубликованные результаты нескольких проспективных когортных исследований четко указали, что у пациентов с наличием ожирения с МС повышенный риск ОА коленных суставов и кистей рук [23, 27, 30]. На основании выборки, включавшей 482 женщины с ОА коленных суставов и ожирением, установлено, что при наличии <2 дополнительных кардиометаболических факторов (низкий уровень холестерина липопротеидов высокой плотности, повышенный уровень холестерина липопротеидов низкой плотности, триглицеридов, артериального давления, С-реактивного белка, соотношения окружностей талии/бедра или глюкозы, или наличие сахарного диабета) частота выявления ОА составила 12,8% по сравнению с женщинами, имевшими ≥2 кардиометаболических параметров — 23,3% [27]. В крупном австралийском когортном исследовании (The Melbourne Collaborative Cohort Study), продолжавшемся в течение 2003–2007 гг., проанализированы кардиометаболические факторы у пациентов, перенесших тотальное эндопротезирование (ТЭП) коленных суставов. Установлено, что компоненты МС были напрямую связаны с ТЭП коленных суставов, независимо от индекса массы тела. Так, для двух компонентов МС риск проведения ТЭП составил 2,92 (95% доверительный интервал (ДИ) 1,60–5,33) и 3,09 (95% ДИ 1,68–5,69) при наличии трех составляющих МС [23]. Ряд исследований также продемонстрировал повышенный риск ОА коленного сустава и/или суставов кистей у пациентов с артериальной гипертензией и/или атеросклерозом, тем самым поддерживая гипотезу о нарушении перфузии субхондральной кости вследствие распространенного атеросклероза [12, 23]. Данная гипотеза подтверждается результатами исследований, установившими ассоциацию между повышенными уровнями холестерина и триглицеридов с распространенностью поражений костного мозга (участки жировой дегенерации) при магнитно-резонансной томографии коленных суставов [15].
Таким образом, все проведенные эпидемиологические исследования свидетельствуют о наличии взаимосвязи между ОА и различными компонентами МС, причем некоторые из них явно исключают эффект механической перегрузки суставов. Схематически ассоциация между ОА и МС представлена на рис. 1. Висцеральное ожирение, дислипидемия и инсулинорезистентность формируют особое воспаление — низкоуровневое, хроническое, связанное с метаболическими расстройствами и получившее название «метавоспаление» (metaflammation) [11]. Вялотекущий воспалительный процесс и МС образуют некий замкнутый круг, взаимно потенцируя друг друга. Для обозначения таких состояний микробиолог из Гарварда G.S. Hotamisligil в середине 90-х годов прошлого столетия предложил термин «metaflammation» — «метавоспаление». G.S. Hotamisligil и соавторы [20] выявили факт высвобождения фактора некроза опухоли (ФНО)-α адипоцитами мышей и людей с ожирением, в отличие от тех, кто не имел ожирения. Именно этот вид воспаления — метавоспаление — играет решающую роль в патогенезе ожирения, диабета II типа и его осложнений, а множественные сигнальные пути связывают инсулинорезистентность и иммунный ответ [2].
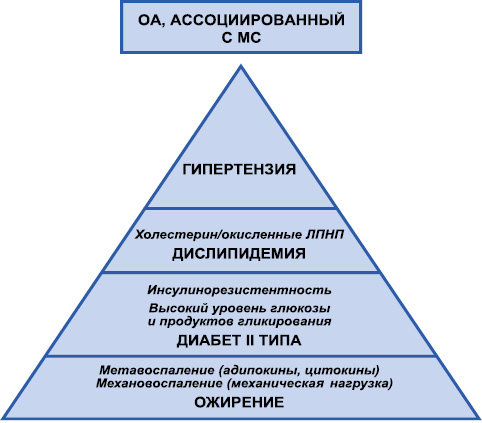
Механическая нагрузка на опорные суставы вследствие ожирения в совокупности с системным низкоуровневым воспалением (метавоспаление) с участием адипокинов и цитокинов нарушает гомеостаз суставных тканей. Накопление конечных продуктов гликирования (AGE) и стойко высокие уровни глюкозы инициируют окислительный стресс, а также высвобождение цитокинов и протеолитических ферментов, поддерживая таким образом синовиальное воспаление. Гипергликемия и глюкозотоксичность являются основными триггерами повреждений при ОА [6]. Изменения функции переносчиков глюкозы на поверхности хондроцитов участвуют в поддержании воспалительного и дегенеративного процесса. Кроме того, гипергликемия индуцирует низкоинтенсивное системное воспаление. Наконец, нейротоксичность вследствие гипергликемии приводит к нервно-мышечным повреждениям, что ухудшает течение ОА и дестабилизирует сустав. Дислипидемия связана с накоплением окисленных липопротеидов, которые увеличивают эктопическое образование кости за счет активации трансформирующего фактора роста (TGF)-β и способствуют воспалению синовиальной оболочки из-за активации макрофагов. Наконец, артериальная гипертензия может вызывать сосудистую ишемию субхондральной кости, однако эти сведения являются на сегодня дискутабельными.
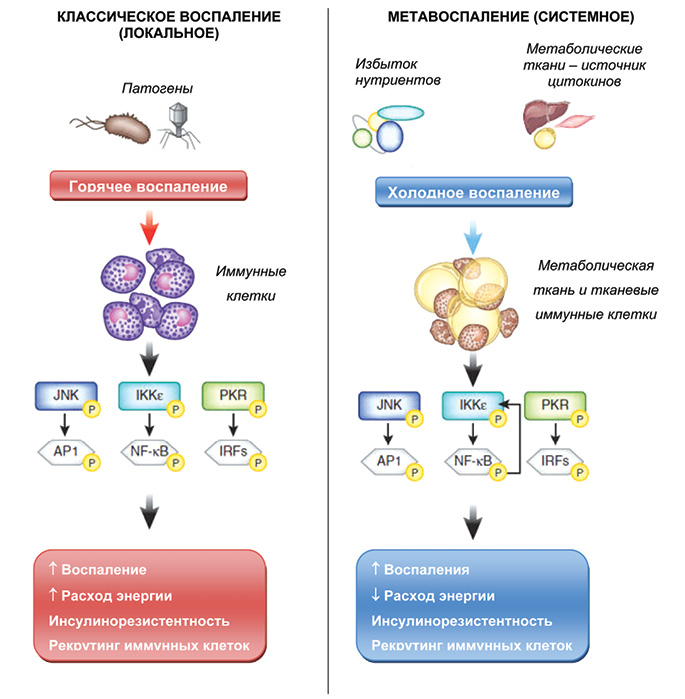
Концепция метавоспаления глубоко изучена. Чрезмерное поступление нутриентов приводит к ожирению, повышенной метаболической активности жировых клеток, продуцирующих адипокины и цитокины, и к низкоуровневому («холодному») системному воспалению. В свою очередь, вялотекущий системный воспалительный процесс запускает каскад метаболических нарушений, состав которых в каждом отдельном случае определяется индивидуальными особенностями конкретного индивида (коморбидностью, наследственностью, образом жизни и др.), — формируется МС. На рис. 2 представлены отличия метавоспаления, которое является системным низкоуровневым воспалительным процессом, от классического локального воспаления, вызванного патогенной микрофлорой.
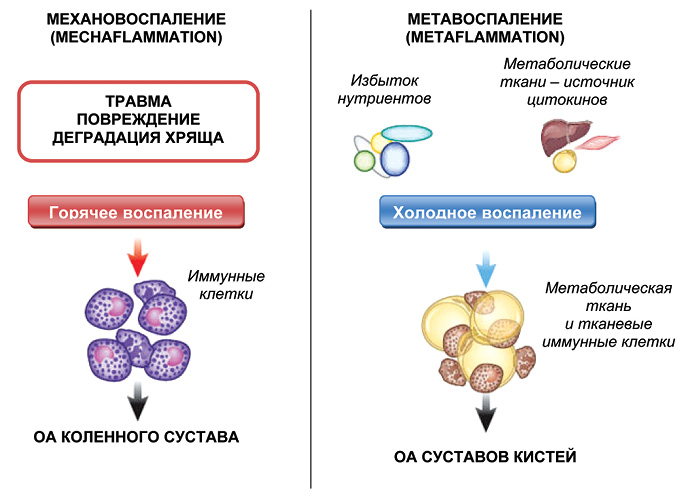
При ОА, протекающего на фоне ожирения и МС, именно метавоспаление лежит в основе поражения неопорных суставов, субклинического синовита и прогрессирующей потери хряща. Одновременно травма сустава и длительное механическое воздействие на сустав (при ожирении) вызывают локальную воспалительную реакцию — механовоспаление (mechaflammation). Классическое воспаление — естественная реакция организма — из-за большой площади воспаления неизбежно переходит в патологическую реакцию — вялотекущий системный воспалительный процесс. Последний, в свою очередь, становится причиной МС. Оба процесса, взаимно потенцируя друг друга, в зависимости от исходного набора факторов риска, вызывают то или иное хроническое неинфекционное заболевание, а чаще — их сочетание [3]. Именно поэтому ОА считается заболеванием с высоким индексом коморбидности.
Ожирение играет двоякую роль при ОА в зависимости от того, какие суставы поражены — опорные или неопорные (рис. 3). При поражении суставов кистей в патогенезе болезни ведущую роль играют системные процессы и метавоспаление, в случае с коленным суставов — механическая нагрузка является наиболее важным компонентом, однако системные метавоспалительные процессы также участвуют в прогрессировании ОА коленных суставов [29]. Таким образом, ожирение может влиять на патогенез и прогрессирование ОА посредством биомеханических эффектов, а также при увеличении выраженности метастимулирующего воспаления. Ожирение связано с более высокими уровнями нагрузки на сустав и снижением уровня физической активности, что, в свою очередь, уменьшает мышечную силу. В сочетании эти эффекты могут привести к структурным изменениям ОА. Именно они становятся источником боли, которая ограничивает физическую активность, что еще больше снижает затраты энергии и приводит к уменьшению мышечной и увеличению жировой массы. Таким образом, эти факторы могут обусловливать порочный цикл ожирения и ОА. Демонстрация метаболических воздействий ожирения на синовиальный сустав, помимо прямого механического эффекта, является одним из наиболее важных достижений в этой области. Таким образом, полученные и накопленные на сегодняшний день данные литературы позволяют рассматривать ОА как проблему собственно системной метаболической болезни по сути, но в то же время как проблему полиморбидности, приобретающей уже и прогностический характер [4].
Несмотря на то что уровень доказательств связи МС и ОА постоянно растет, точные механизмы, связывающие эти два заболевания, полностью не расшифрованы. Долгое время считалось, что МС и ОА связаны одним общим патофизиологическим процессом, однако он так и не был установлен. Однако клинические и экспериментальные данные укрепили гипотезу о самостоятельной роли системного низкоуровневого воспаления вследствие ожирения и развития МС независимо от уровня избыточной массы тела. Несмотря на то что рекомендации по ведению пациентов с ОА, ассоциированным с МС, не разработаны, менеджмент ОА должен включать коррекцию всех составляющих МС: уменьшение массы тела, контроль гликемии, липидов и артериального давления, адекватную физическую активность.
Список использованной литературы
- 1. Головач І.Ю. (2015) Остеоартрит, індукований ожирінням: мультифакторіальні асоціації та провідна роль адипокінів, дисліпідемії й механічного навантаження. Травма, 16(4): 70–78.
- 2. Казыгашева Е.В., Ширинский В.С., Ширинский И.В. (2016) Диабетассоциированный остеоартрит — синтропия? Мед. иммунология, 18(4): 317–330.
- 3. Ковальчук Е.Ю., Костенко В.А., Сорока В.В., Алексеенко О.В. (2015) Модификация концепции сердечно-сосудистого континуума на основе представлений о коморбидности и метавоспалении. Биомед. журн. Medline.ru. Кардиология. 16: 596–608.
- 4. Курята А.В., Черкасова А.В. (2016) Инсулинорезистентность и системное воспаление у пациентов с остеоартрозом в сочетании с ожирением: эффективность симптоматических препаратов замедленного действия. Травма, 17(1): 47–54.
- 5. Ayral X., Pickering E.H., Woodworth T.G. et al. (2005) Synovitis: a potential predictive factor of structural progression of medial tibiofemoral knee osteoarthritis: results of a 1 year longitudinal arthroscopic study in 422 patients. Osteoarthritis Cartilage, 13: 361–367.
- 6. Berenbaum F. (2011) Diabetes-induced osteoarthritis: from a new paradigm to a new phenotype. Ann. Rheum. Dis., 70(8):1354–1356.
- 7. Berenbaum F. (2013) Osteoarthritis as an inflammatory disease (osteoarthritis is not osteoarthrosis!). Osteoarthritis Cartilage, 21: 16–21.
- 8. Berenbaum F., Griffin T.M., Liu-Bryan R. (2017) Metabolic Regulation of Inflammation in Osteoarthritis. Arthritis Rheum. 69(1): 9–21.
- 9. Bijlsma J.W., Berenbaum F., Lafeber F.P. (2011) Osteoarthritis: an update with relevance for clinical practice. Lancet, 377: 2115–2126.
- 10. Bliddal H., Leeds A.R., Christensen R. (2014) Osteoarthritis, obesity and weight loss: evidence, hypotheses and horizons — a scoping review. Obes Rev., 15(7): 578–586.
- 11. Calay E.S., Hotamisligil G.S. (2013) Turning off the inflammatory, but not the metabolic, flames. Nat Med., 19: 265–267.
- 12. Conaghan P.G., Vanharanta H., Dieppe P.A. (2005) Is progressive osteoarthritis an atheromatous vascular disease? Ann. Rheum. Dis., 64: 1539–1541.
- 13. Corvol M.T., Malemud C.J., Sokoloff L. (1972) A pituitary growth promoting factor for articular chondrocytes in monolayer culture. Endocrinology, 90(1): 262–271.
- 14. Courties A., Sellam J., Berenbaum F. (2017) Metabolic syndrome-associated osteoarthritis. Curr. Opin Rheumatol., 29: 214–222.
- 15. Davies-Tuck M.L., Hanna F., Davis S.R. et al. (2009) Total cholesterol and triglycerides are associated with the development of new bone marrow lesions in asymptomatic middle-aged women: a prospective cohort study. Arthritis Res. Ther., 11: R181.
- 16. Felson D.T. (2013) Osteoarthritis as a disease of mechanics. Osteoarthritis Cartilage, 21: 10–15.
- 17. Goldring M.B., Otero M. (2011) Inflammation in osteoarthritis. Curr. Opin. Rheumatol., 23(5): 471–478.
- 18. Guilak F. (2011) Biomechanical factors in osteoarthritis. Best Pract. Res. Clin. Rheumatol., 25(6): 815–823.
- 19. Han C.D., Yang I.H., Lee W.S. et al. (2013) Correlation between metabolic syndrome and knee osteoarthritis: data from the Korean National Health and Nutrition Examination Survey (KNHANES). BMC Public Health., 13: 603.
- 20. Hotamisligil G.S., Shargill N.S., Spiegelman B.M. (1993) Adipose expression of tumor necrosis factor-alpha: direct role in obesity-linked insulin resistance. Science, 259: 87–91.
- 21. Laiguillon M-C., Courties A., Houard X. et al. (2015) Characterization of diabetic osteoarthritic cartilage and role of high glucose environment on chondrocyte activation: toward pathophysiological delineation of diabetes mellitus-related osteoarthritis. Osteoarthr Cartil., 23: 1513–1522.
- 22. Loeser R.F., Goldrina S.R., Scanzello C.R. et al. (2012) Osteoarthritis: A Disease of the Joint as an Organ. Arthritis Rheum., 64(6): 1697–1707.
- 23. Monira Hussain S., Wang Y., Cicuttini F.M. et al. (2014) Incidence of total knee and hip replacement for osteoarthritis in relation to the metabolic syndrome and its components: a prospective cohort study. Semin Arthritis Rheum., 43: 429–436.
- 24. Pelletier J.P., Roughley P.J., DiBattista J.A. et al. (1991) Are cytokines involved in osteoarthritic pathophysiology? Semin. Arthritis Rheum., 20(6 Suppl. 2): 12–25.
- 25. Puenpatom R.A., Victor T.W. (2009) Increased prevalence of metabolic syndrome in individuals with osteoarthritis: an analysis of NHANES III data. Postgrad Med., 121: 9–20.
- 26. Rosen E.D., Spiegelman B.M. (2006) Adipocytes as regulators of energy balance and glucose homeostasis. Nature, 444: 847–853.
- 27. Sowers M., Karvonen-Gutierrez C.A., Palmieri-Smith R. et al. (2009) Knee osteoarthritis in obese women with cardiometabolic clustering. Arthritis Rheum., 61: 1328–1336.
- 28. Stevens A.L., Wishnok J.S., White F.M. et al. (2009) Mechanical injury and cytokines cause loss of cartilage integrity and upregulate proteins associated with catabolism, immunity, inflammation, and repair. Mol. Cell Proteomics, 8(7): 1475–1489.
- 29. Visser A.W., de Mutsert R., le Cessie S. et al. (2015) The relative contribution of mechanical stress and systemic processes in different types of osteoarthritis: the NEO study. Ann. Rheum. Dis., 74(10): 1842–1847.
- 30. Yoshimura N., Muraki S., Oka H. et al. (2012) Accumulation of metabolic risk factors such as overweight, hypertension, dyslipidaemia, and impaired glucose tolerance raises the risk of occurrence and progression of knee osteoarthritis: a 3-year follow-up of the ROAD study. Osteoarthritis Cartilage, 20: 1217–1226.
- 31. Yusuf E., Nelissen R.G., Ioan-Facsinay A. et al. (2010) Association between weight or body mass index and hand osteoarthritis: a systematic review. Ann. Rheum. Dis., 69: 761–765.
Адрес для переписки:
03420, Киев, ул. Академика Заболотного, 21
Клиническая больница «Феофания» ГУС,
центр ревматологии
E-mail: golovachirina@gmail.com

Leave a comment