ПАТОГЕНЕТИЧНЕ ЗНАЧЕННЯ МАРКЕРІВ КАРДІОПАТІЇ ПРИ УРАЖЕННІ СЕРЦЯ У ТВАРИН З ЕКСПЕРИМЕНТАЛЬНИМ СИСТЕМНИМ ЧЕРВОНИМ ВОВЧАКОМ
Синяченко О.В.1, Бреславец А.В.2, Егудина Е.Д.3, Головач И.Ю.2, Ермолаева М.В.1
- 1Донецкий национальный медицинский университет, Лиман
- 2Научно-практический центр профилактической и клинической медицины ГУД, Киев
- 3Днепропетровская государственная медицинская академия, Днепр
Резюме. Актуальність. Патологія серця при системному червоному вовчаку (СЧВ) належить до найчастіших проявів захворювання і багато в чому визначає його прогноз, а патогенетична будова уражень міокарда, ендокарда й коронарних судин залишається недостатньо вивченою. Оцінка окремих аспектів патогенезу вовчакової кардіопатії проводиться на природних моделях у деяких лінійних мишей. Мета роботи: вивчити у крові експериментальних тварин (щурів) з моделлю СЧВ маркери кардіопатії та оцінити їх патогенетичну значущість в ураженні кардіоміоцитів, міокарда, ендокарда, клапанів та судин серця. Матеріал і методи. Моделювання СЧВ виконано у 53 білих безпородних щурів (34 самки і 19 самців) з використанням уведень повного ад’юванта Фрейнда, селезінкової дезоксирибонуклеїнової кислоти великої рогатої худоби, циклофосфаміду, азиду й дезоксирибонуклеїнату натрію, вигодовуванням тварин із додаванням в їжу сульфату кадмію, оксибутирату літію та молібдату амонію. Імуноферментним методом у крові інтактних (контроль) і експериментальних щурів досліджували рівні ендотеліну-1, тромбоксану А2, простацикліну, інтерлейкіну-6, фактора некрозу пухлини-альфа, гомоцистеїну, апеліну, передсердного й мозкового натрійуретичного пептиду (BNP), термінального попередника останнього (NT-BNP). Результати. У тварин з моделлю СЧВ спостерігаються зміни у крові маркерів експериментальної вовчакової кардіопатії, що відображають стан ендотеліальної функції судин, прозапальної цитокінової мережі та натрійуретичних пептидів, які проявляються достовірним підвищенням на 10% концентрації ендотеліну-1, відповідно на 54% вмісту інтерлейкіну-6 і співвідношення цього цитокіну з фактором некрозу пухлини-альфа, на 73% рівня BNP, що встановлено у 36; 66; 62 і 13% обстежених щурів. Висновки. Вивчені маркери кардіопатії визначають ураження коронарних судин, а показники адипоцитокіну апеліну та натрійуретичних гормонів типу А і В беруть участь у розвитку змін кардіоміоцитів (гіпертрофія, дистрофія, некроз) і строми міокарда (набряк, клітинна інфільтрація, склероз), причому тяжкість ураження структур серця залежить від значень BNP і NT-BNP.
ВВЕДЕНИЕ
Патология сердца при системной красной волчанке (СКВ) относится к наиболее частым проявлениям заболевания и во многом определяет его прогноз (Falasinnu T. et al., 2017; Hasham M.G. et al., 2017; Jafri K. et al., 2017). В большинстве случаев СКВ выявляют изменения систоло-диастолической функции левого желудочка (Wislowska M. et al., 2009; Lee S.W. et al., 2012), а у некоторых пациентов также дисфункцию правого желудочка и предсердия (Ge X.Y. et al., 2016; Goswami R.P. et al., 2017). Хорошо известны наблюдения внезапной смерти больных СКВ вследствие острой сердечной недостаточности (Yiu K.H., Tse H.F., 2017). Отметим, что СКВ относится к факторам риска раннего развития коморбидного коронарокардиосклероза (Dhakal B.P. et al., 2017; Watad A. et al., 2017a; b).
По данным электрокардиографии, электрофизиологического исследования, эхокардиографии и магнитно-резонансной томографии признаки поражения сердца при СКВ в виде миокардита, коронарита, инфаркта миокарда, нарушений кардиального ритма (процессов возбудимости и электрической проводимости) весьма неспецифичны, зачастую труднодиагностируемые, а различные звенья их патогенеза требуют уточнения (Mavrogeni S. et al., 2017; Myung G. et al., 2017; Thomas G. et al., 2017). Особую значимость приобретает волчаночный эндокардит Либмана — Сакса (чаще на фоне антифосфолипидного синдрома) (Samura T. et al., 2017; Unic D. et al., 2017) с формированием клапанных пороков сердца (Watad A. et al., 2017a; b).
В настоящее время поражение сердца при СКВ изучают на мышах линий NZM (NZB/W, NZB/BXSB), JunB-Δep, MRL (MRL/lpr, MRL/MpJ), BALB/c, C3H/HeJ и других, которые являются естественными моделями заболевания. Цель данной работы — изучение в крови экспериментальных животных (крыс) с разработанной нами моделью СКВ маркеров кардиопатии и оценка их патогенетической значимости в поражении кардиомиоцитов, миокарда, эндокарда, клапанов и сосудов сердца.
Материал и методы исследования
Моделирование СКВ выполнено на 60 белых беспородных крысах со средней массой 220 г. К окончанию эксперимента остались живыми 53 особи (34 самки и 19 самцов), которые и вошли в объект исследования. 20 интактных крыс (12 самок и 8 самцов) составили контрольную группу. Методика создания модели СКВ состояла в следующем. Под эфирным ингаляционным наркозом в корень хвоста вводили полный адъювант Фрейнда (ПАФ) и раствор селезеночной дезоксирибонуклеиновой кислоты (ДНК) крупного рогатого скота (по 5 мг/кг массы животного) а также в течение 3 дней внутрибрюшинно вводили азид натрия (по 2 мг/кг). Через 2 нед от начала эксперимента внутримышечно дополнительно вводили циклофосфамид (100 мг/кг), а в корень хвоста — ПАФ и ДНК (по 2,5 мг/кг). Со следующих суток на протяжении 1 нед животные ежедневно получали внутримышечные введения дезоксирибонуклеината натрия (20 мг/кг), после чего им повторяли введение циклофосфамида (100 мг/кг), ПАФ (1,5 мг/кг) и ДНК (1,5 мг/кг). Потом еще в течение 7 дней ежедневно вводили дезоксирибонуклеинат натрия (20 мг/кг). Через 2 мес от начала исследования на фоне внутрибрюшного нембуталового наркоза (50 мг/кг) животных выводили из эксперимента. Исследование одобрено комиссией по биоэтике Донецкого национального медицинского университета в соответствии с решением І Национального комитета по биоэтике (Киев, 2000) и с положениями Европейской конвенции по защите позвоночных животных при их использовании для экспериментальных биомедицинских научных целей.
Гистологические препараты тканей сердца окрашивали гематоксилином и эозином, по ван Гизону, альциановым синим (рН 2,6) и ставилась PAS-реакция. Иммуноферментным анализом (ридер «PR2100-Sanofi diagnostic pasteur», Франция) с использованием наборов «Biomedica-Diagnostics» (Канада), «R&D-Systems» (США) и «Roche-Diagnostics» (Швейцария) определяли в сыворотке крови показатели эндотелина (ЕТ)-1, тромбоксана А2 (ТхА2), простациклина (PgI2), соотношения TxA2/PgI2, интерлейкина (IL)-6, фактора некроза опухоли (TNF)-альфа, соотношения IL-6/TNF-альфа, гомоцистеина (HCys), апелина (Ар), предсердного и мозгового натрийуретического гормонов (соответственно ANP и BNP), предшественника (N-terminal fragment) BNP (NT-BNP).
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного непараметрического корреляционного одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы «Microsoft Excel» и «Statistica-Stat-Soft», США). Оценивали средние значения (M), их стандартные отклонения (SD) и ошибки (SE), коэффициенты параметрической корреляции Пирсона и непараметрической Кендалла, критерии дисперсии Брауна — Форсайта и Уилкоксона — Рао (WR), Стьюдента и достоверность статистических показателей.
Результаты исследования
У 92,5% животных с моделью СКВ выявлен периваскулярный склероз, у 86,8% — склероз стромы миокарда, у 79,3% — некроз кардиомиоцитов, у 75,5% — отек стромы, у 69,8% — ее лимфоцитарно-макрофагальная инфильтрация, у 67,9% — спазм коронарных сосудов, у 62,3% — склероз клапанов, у 58,5% — пролиферация сосудистого эндотелия, по 54,7% — соответственно гипертрофия и дистрофия кардиомиоцитов, соответственно у 43,4% — склероз/гиалиноз сосудов и склероз эндокарда, у 39,6% — венозное полнокровие, у 35,9% — соответственно периваскулярная инфильтрация и клеточная инфильтрация клапанов, у 32,1% — инфильтрация стромы тучными клетками, у 26,4% — коллагенолиз клапанов, у 18,9% — клеточная инфильтрация эндокарда, у 13,2% — пролиферация эндотелия клапанов, у 9,4% — некроз эндокарда. Примеры вариантов морфологических изменений отдельных структур сердца при волчаночной экспериментальной кардиопатии по данным гистологических препаратов представлены на рис. 1–4.
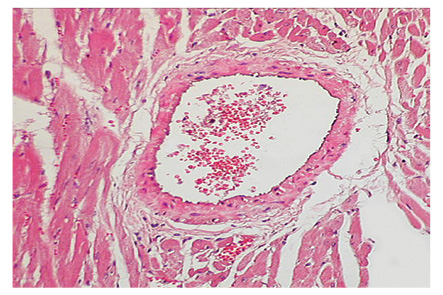
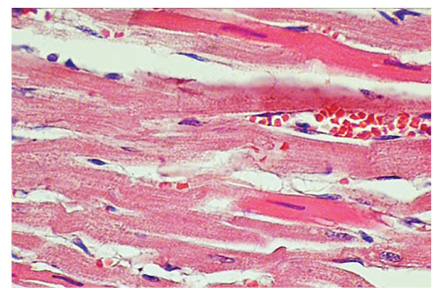
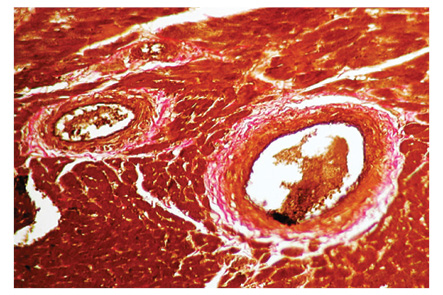
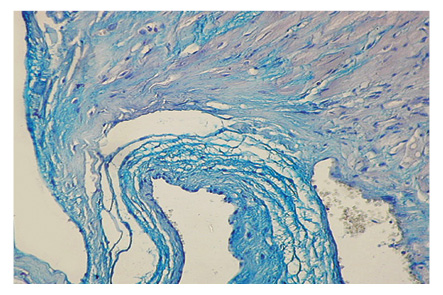
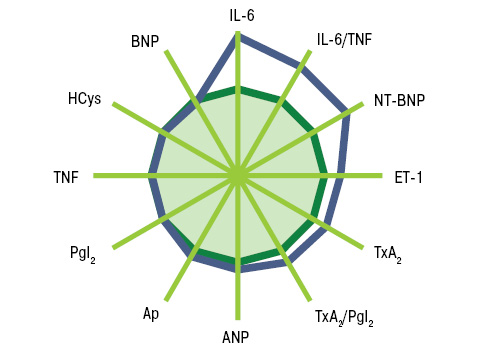
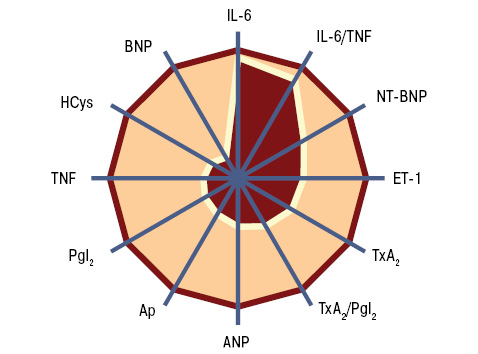
Показатели маркеров кардиопатии в сыворотке крови крыс с моделью СКВ были следующими (M±SD±SE): ET-1 — 6,9±0,93±0,13 пг/мл, TxA2 — 20,9±6,74±0,93 нг/мл, PgI2 — 36,4±7,62±1,05 нг/мл, TxA2/PgI2 — 60,7±23,91±3,28%, IL-6 — 2,0±0,69±0,10 пг/мл, TNF-альфа — 5,6±1,04±0,14 пг/мл, IL-6/TNF-альфа — 38,1±13,93±1,91%, HCys — 15,5±3,75±0,52 мкмоль/л, Ap — 225,5±26,63±3,66 пг/мл, ANP — 6,1±1,99±0,27 пг/мл, BNP — 13,7±11,87±1,63 пг/мл, NT-BNP — 4,6±2,83±0,39 пмоль/л. По сравнению с интактными животными контрольной группы при экспериментальной СКВ констатировано достоверное повышение на 10% уровня ЕТ-1, соответственно на 54% — IL-6 и IL-6/TNF-альфа, на 73% — BNP (рис. 5). Изменения этих показателей (>M+SD интактных крыс) соответственно выявлены у 35,9; 66,0; 62,3 и 13,2% обследованных животных с моделью заболевания (рис. 6).
Обсуждение
Существуют обратные корреляционные связи Пирсона показателя ET-1 c PgI2, a NT-BNP — c Ap, тогда как прямые достоверные соотношения имеют значения TxA2 c IL-6/TNF-альфа, а NT-BNP — c ANP и IL-6. При этом именно IL-6 характеризуется наибольшими отклонениями от нормы среди всех изученных показателей и набольшей частотой таких изменений по сравнению с интактными крысами. IL-6, обладающий и провоспалительными, и иммунорегуляторными свойствами, имеет особую значимость в патогенезе люпус-эндомиокардита (Birner P. et al., 2016). К семейству IL-6 принадлежит кардитропный фактор роста кардиотрофин (СТ)-1 с ярко выраженными промитотическим и пролиферативными качествами, способный индуцировать гипертрофию кардиомиоцитов. В этой связи IL-6 через СТ-1 становится маркером риска возникновения и выраженности повышенного кардиоваскулярного ремоделирования. IL-6 опосредуется сигнальной системой, характер экспрессии которой определяет направление «переключения» метаболических процессов, что при экспериментальной волчаночной кардиопатии может приводить к тому, что одни и те же внеклеточные стимулы в различных условиях способствуют реализации потенциально разнонаправленных биологических эффектов в тканях сердца (кардиотоксичных и кардиопротекторных).
Гистрограммы интегральных показателей эндотелиальной функции сосудов (ЭФС) и уровня пептидов в крови (соответственно ET-1 + TxA2 + PgI2 и ANP + BNP + NT-BNP) нашли свое отражение на рис. 7 и 8. Как свидетельствует многофакторный анализ Уилкоксона — Рао (рис. 9), на интегральные лабораторные показатели маркеров кардиопатии оказывают влияние степень изменений кардиомиоцитов (гипертрофия, дистрофия, некроз), повреждение стромы миокарда (отек, лимфомакрофагальная инфильтрация, инфильтрация тучными клетками, склероз), сосудов (пролиферация эндотелия, периваскулярная инфильтрация, склероз/гиалиноз), повреждение эндокарда (некроз, склероз, клеточная инфильтрация).
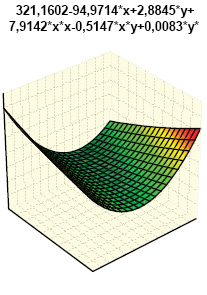
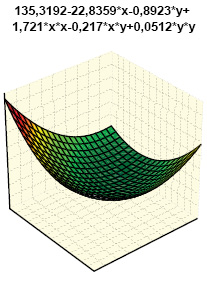
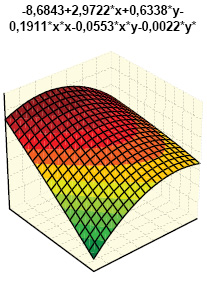
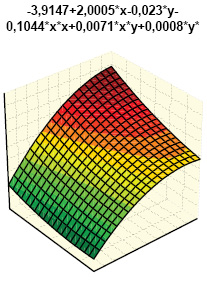
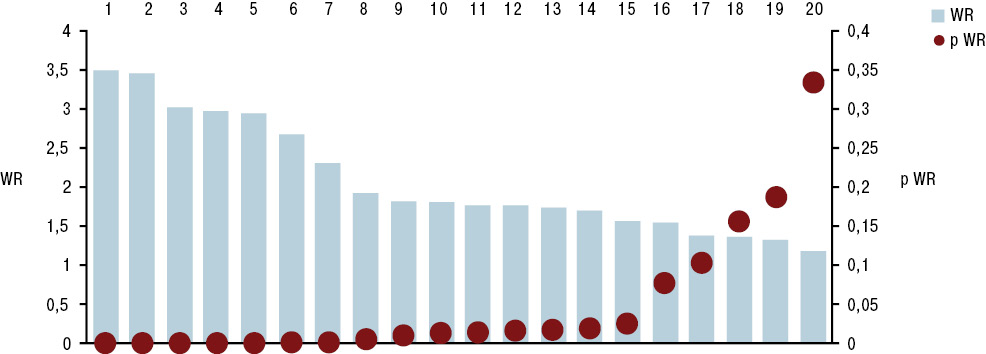
Одновременное состояние ЭФС и состав натрийуретических пептидов в крови экспериментальных крыс зависят от выраженности гипертрофии и некроза кардиомиоцитов, отека стромы миокарда, ее лимфомакрофагальной инфильтрации, периваскулярной инфильтрации, склероза эндокарда. В этой связи необходимо представить некоторые комментарии. ЭФС относится к наиболее важным факторам в развитии волчаночной кардиопатии (Thacker S.G. et al., 2012; Mak A. et al., 2017), что в первую очередь касается гиперпродукции ЕТ-1 (Guo L. et al., 2015). ANP синтезируется в виде прогормона кардиомиоцитов предсердий (отчасти и желудочков), секретируется в ответ на их растяжение, является маркером ранней дисфункции левого желудочка. Биологически активный BNP синтезируется в кардиомиоцитах и фибробластах сердца как прогормон и отделен от предшественника BNP, неактивного N-терминального участка пептида (NT-BNP), ведущим стимулом синтеза которого желудочками является повышение растяжимости миокарда и давления в камерах сердца, а кумулятивный уровень NT-BNP в крови прямо коррелирует со степенью сердечной недостаточности. Неблагоприятное действие натрийуретических пептидов А- и В-типа (предсердного и мозгового) продемонстрировано на линейных мышах NZB/W, являющихся естественной моделью СКВ (Tzang B.S. et al., 2011).
По данным дисперсионного анализа Брауна — Форсайта, на уровни простациклинемии, соотношений TxA2/PgI2 и IL-6/TNF-альфа, концентраций ANP, BNP и NT-BNP оказывает влияние степень тяжести поражения сосудов сердца. Кроме того, показатели натрийуретических гормонов связаны с выраженностью морфологических изменений кардиомиоцитов и стромы. Патогенетические построения волчаночной кардиопатии тесно связаны с показателями ET-1, HCys и BNP. При этом установлено влияние NT-BNP на уровень повреждений стромы и сосудов, а HCys — только на сосудистую патологию.
Выраженные изменения сосудов сердца (средний показатель повреждений более 2 у.е.) по сравнению с остальными животными сопровождаются достоверным повышением ЕТ-1 на 14%, ANP — на 43%, NT-BNP — на 68% при снижении PgI2 на 14% и Ар — на 11% . Как видно из рис. 10, 11, выраженность повреждений кардиомиоцитов, стромы и сосудов имеет обратные корреляционные связи Пирсона с уровнем в крови Ар, а прямые соотношения — с параметрами ANP и NT-BNP. Кроме того, тяжесть интегральных изменений структур сердца позитивно коррелирует с содержанием тромбоксанемии и сывороточного натрийуретического гормона типа В, кардиомиоцитов — с показателями ЕТ-1, ТхА2 и BNP, стромы — со значениями простациклинемии, а сосудов — с концентрацией ЕТ-1.
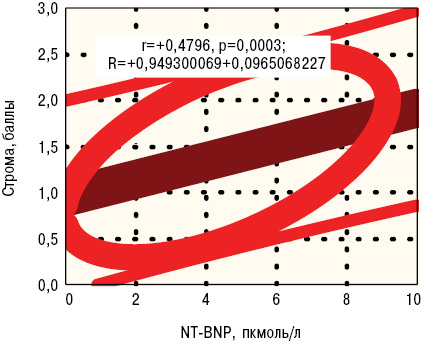
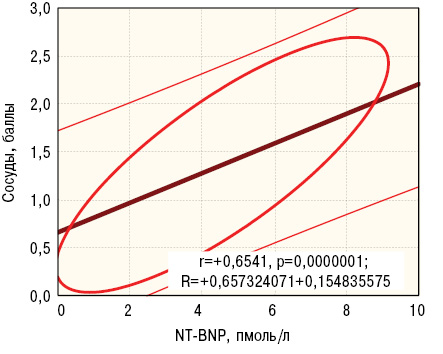
С учетом параллельно выполненного дисперсионного и корреляционного анализа можно говорить о наиболее важной роли NT-BNP в патогенезе повреждений стромы миокарда и сосудов сердца при экспериментальной волчаночной кардиопатии. Следует подчеркнуть, что высокое содержание в крови больных СКВ NT-BNP является предиктором легочной гипертензии вследствие поражения правых отделов сердца (Pérez-Peñate G.M. et al., 2016; Ghofraniha L. et al., 2017), а также диастолической дисфункции левого желудочка (Sugiura A. et al., 2016). У больных СКВ с поражением сердца существуют прямые корреляционные связи показателя NT-BNP с концентрацией С-реактивного протеина, активацией кардиотоксичных матриксных металлопротеиназ и профибринолизина (Saxena A. et al., 2015).
Нами отобраны те показатели, с которыми морфологические признаки экспериментальной волчаночной кардиопатии имели одновременно связи Брауна — Форсайта и Кендалла. Оказалось, что степень гипертрофии кардиомиоцитов прямо зависит от концентраций в сыворотке крови ЕТ-1 и ANP, дистрофии кардиомиоцитов и периваскулярной инфильтрации — от содержания BNP, периваскулярного склероза — от уровней HCys и Ap, склероза/гиалиноза сосудов — от NT-BNP.
Необходимо отметить, что нами выявлены обратные корреляционные связи тяжести поражения структур сердца с уровнем в крови адипоцитокина Ар. По данным литературы, в зависимости от характера клинического течения СКВ может разнонаправленно изменяться содержание Ар в сыворотке крови (Scotece M. et al., 2011). Жировая ткань является своеобразным эндокринным органом, синтезирующим в кровоток биологически активные соединения пептидной природы, а система адипоцитокинов рассматривается как инициальный механизм, вносящий основной вклад в манифестацию кардиальных событий. Эндогенный лиганд Ар секретируется адипоцитами, свойства которого подобны рецептору ангиотензина. В экспериментальных условиях на крысах продемонстрирован позитивный инотропный и вазодилатирующий эффекты Ар, который реализуется через зависимые от оксида азота механизмы (Tatemoto K. et al., 2011; Berry M.F. et al., 2014). Адипоцитарная дисфункция считается при волчаночной кардиопатии компонентом нарушений ЭФС (Thacker S.G. et al., 2012).
Изученные маркеры кардиопатии по-разному связаны с процессами склерозирования структур сердца. Так, Ap, ANP и NT-BNP объединяет общность корреляционных связей Кендалла со степенью склероза сосудов и эндокарда, а PgI2 — сосудов и стромы миокарда. При этом особенностью IL-6 и BNP являются обратные корреляции с выраженностью интерстициальных изменений миокарда, TNF-альфа, HCys и NT-BNP — прямые с васкулосклерозом, а ET-1 и TxA2 — с выраженностью вальвулосклероза.
Выводы
Экспериментальная СКВ сопровождается развитием кардиопатии у всех животных с гипертрофией, дистрофией и некрозом кардиомиоцитов, морфологическими признаками склероза коронарных сосудов, стромы миокарда, эндокарда и клапанов сердца, пролиферацией сосудистого эндотелия, которая имеет дисперсионные и прямые корреляционные связи со степенью лимфомакрофагальной инфильтрации интерстиция, периваскулярной и клапанной гистиоцитарной клеточной инфильтрацией. У крыс с моделью СКВ отмечают изменения в крови маркеров волчаночной кардиопатии, отражающих состояние ЭФС, провоспалительной цитокиновой сети и натрийуретических пептидов, которые проявляются достоверным повышением на 10% концентрации ЕТ-1, соответственно на 54% содержания IL-6 и соотношения этого цитокина с TNF-альфа, на 73% уровня BNP, что установлено у 36; 66; 62 и 13% обследованных крыс, определяет поражение коронарных сосудов, а показатели адипоцитокина апелина и натрийуретических гормонов типа А и В участвуют в развитии повреждений кардиомиоцитов (гипертрофия, дистрофия, некроз) и стромы миокарда, причем тяжесть поражения структур сердца зависит от значений BNP и NT-BNP. Представленная модель может быть полезной для разработки новых подходов к патогенетической терапии волчаночной кардиопатии и СКВ в целом.
Список использованной литературы
- Berry M.F., Pirolli T.J., Jayasankar V. (2014) Apelin has in vivo inotropic effects on normal and failing hearts. Circulation, 110: 187–193.
- Birner P., Heider S., Petzelbauer P. et al. (2016) Interleukin-6 receptor alpha blockade improves skin lesions in a murine model of systemic lupus erythematosus. Exp. Dermatol., 25(4): 305–310.
- Dhakal B.P., Kim C.H., Al-Kindi S.G., Oliveira G.H. (2017) Heart failure in systemic lupus erythematosus. Trends. Cardiovasc. Med., 6(9): 1050.
- Falasinnu T., Chaichian Y., Simard J.F. (2017) Impact of sex on systemic lupus erythematosus-related causes of premature mortality in the United States. J. Womens Health, 26(11): 1214–1221.
- Ge X.Y., Shao L., Zheng Z.L. (2016) Assessment right atrial function in patients with systemic lupus erythematosus by speckle tracking and three-dimensional echocardiography. Zhonghua Yi Xue Za Zhi, 96(47): 3815–3818.
- Ghofraniha L., Mirfeizi Z., Khabbaz F.S. et al. (2017) Correlation of echocardiographic findings of pulmonary hypertension with six-minute walk test and plasma pro b-type natriuretic peptide level in systemic lupus erythematous. Electron Physician., 9(8): 5122–5128.
- Goswami R.P., Sircar G., Ghosh A., Ghosh P. (2017) Cardiac tamponade in systemic lupus erythematosus. QJM, 17(10): 172–178.
- Guo L., Li M., Chen Y. et al. (2015) Anti-endothelin receptor type a autoantibodies in systemic lupus erythematosus-associated pulmonary arterial hypertension. Arthritis Rheumatol., 67(9): 2394–2402.
- Hasham M.G., Baxan N., Stuckey D.J. et al. (2017) Systemic autoimmunity induced by the TLR7/8 agonist Resiquimod causes myocarditis and dilated cardiomyopathy in a new mouse model of autoimmune heart disease. Dis. Model Mech., 10(3): 259–270.
- Jafri K., Ogdie A., Qasim A. et al. (2017) Discordance of the Framingham cardiovascular risk score and the 2013 American College of Cardiology/American Heart Association risk score in systemic lupus erythematosus and rheumatoid arthritis. Clin. Rheumatol., 9(10): 203–209.
- Lee S.W., Park M.C., Park Y.B., Lee S.K. (2012) E/E ratio is more sensitive than E/A ratio for detection of left ventricular diastolic dysfunction in systemic lupus erythematosus. Lupus, 17(3): 195–201.
- Mak A., Kow N.Y., Schwarz H. et al. (2017) Endothelial dysfunction in systemic lupus erythematosus — a case-control study and an updated meta-analysis and meta-regression. Sci. Rep., 7(1): 7320.
- Mavrogeni S., Koutsogeorgopoulou L., Markousis-Mavrogenis G. et al. (2017) Cardiovascular magnetic resonance detects silent heart disease missed by echocardiography in systemic lupus erythematosus. Lupus, 1(1): 961203317731533.
- Myung G., Forbess L.J., Ishimori M.L. et al. (2017) Prevalence of resting-ECG abnormalities in systemic lupus erythematosus: a single-center experience. Clin. Rheumatol., 36(6): 1311–1316.
- Pérez-Peñate G.M., Rúa-Figueroa I., Juliá-Serdá G. et al. (2016) Pulmonary arterial hypertension in systemic lupus erythematosus: prevalence and predictors. J. Rheumatol., 43 (2): 323–9.
- Samura T., Toda K., Yoshioka D. et al. (2017) Libman-Sacks endocarditis due to systemic lupus erythematosus activation after mitral valve plasty. Ann. Thorac. Surg., 104(2): 109–111.
- Saxena A., Izmirly P.M., Han S.W. et al. (2015) Serum biomarkers of inflammation, fibrosis, and cardiac function in facilitating diagnosis, prognosis, and treatment of anti-ssa/ro-associated cardiac neonatal lupus. J. Am. Coll. Cardiol., 66(8): 930–939.
- Scotece M., Conde J., Gómez R. et al. (2011) Beyond fat mass: exploring the role of adipokines in rheumatic diseases. Sci. World J., 11: 1932–1947.
- Sugiura A., Funabashi N., Ozawa K., Kobayashi Y. (2016) Left ventricular diastolic dysfunction and increased left ventricular mass index related to pulmonary hypertension in patients with systemic autoimmune disease without pericardial effusion. Int. J. Cardiol., 220(1): 268–272.
- Tatemoto K., Takayama K., Zou M.X. (2011) The novel peptide apelin lowers blood pressure via a nitric oxide-dependent mechanism. Regul. Pept., 99(2–3): 87–92.
- Thacker S.G., Zhao W., Smith C.K. et al. (2012) Type I interferons modulate vascular function, repair, thrombosis, and plaque progression in murine models of lupus and atherosclerosis. Arthritis Rheumatol., 64(9): 2975–2985.
- Thomas G., Cohen Aubart F., Chiche L. et al. (2017) Lupus myocarditis: initial presentation and longterm outcomes in a multicentric series of 29 patients. J. Rheumatol., 44(1): 24–32.
- Tzang B.S., Lin T.M., Tsai C.C. et al. (2011) Increased cardiac injury in NZB/W F1 mice received antibody against human parvovirus B19 VP1 unique region protein. Mol. Immunol., 48(12–13): 1518–1524.
- Unic D., Planinc M., Baric D. et al. (2017) Isolated tricuspid valve Libman-Sacks endocarditis in systemic lupus erythematosus with secondary antiphospholipid syndrome. Tex. Heart Inst. J., 44(2): 147–149.
- Watad A., Abu Much A., Bracco D. et al. (2017a) Association between ischemic heart disease and systemic lupus erythematosus-a large case-control study. Immunol. Res., 65(2): 459–463.
- Watad A., Tiosano S., Grysman N. et al. (2017b) The association between systemic lupus erythematosus and valvular heart disease: an extensive data analysis. Eur. J. Clin. Invest., 47(5): 366–371.
- Wislowska M., Derez D., Kochmazski M., Sypuza S. (2009) Systolic and diastolic heart function in SLE patients. Rheumatol. Int., 29(12): 1469–1476.
- Yiu K.H., Tse H.F. (2017) Editorial commentary for Dhakal: Heart failure in systemic lupus erythematosus: A problem to address. Trends. Cardiovasc. Med., 8(11): 30165.
Адрес для переписки:
Синяченко Олег Владимирович Украина, 84404, Донецкая обл., Лиман, ул. Привокзальная, 27
Донецкий национальный
медицинский университет
Е-mail: synyachenko@ukr.net

Leave a comment