Анализ факторов риска ПЕРЕЛОМОВ У ПАЦИЕНТОВ С перенесеннЫМ инфарктОМ миокарда
Кордубайло І.А.1, Лисак З.В.2, Лєвенко Є.І.2, Нішкумай О.І.1
- 1Національний медичний університет ім. О.О. Богомольця, Київ
- 2Олександрівська клінічна лікарня м. Києва
Резюме. Результаты исследований последних лет свидетельствуют о наличии общих патогенетических механизмов, обусловливающих снижение минеральной плотности костной ткани и кальцификацию сосудов. Цель исследования. Проанализировать наличие факторов риска переломов костей у пациентов с перенесенным инфарктом миокарда на фоне стенозирующего атеросклероза коронарных сосудов. Объект и методы исследования. В обследование отобраны 46 пациентов (16 женщин, средний возраст — 58±14,1 года с длительностью менопаузы 10,6±7,7 года и 30 мужчин, средний возраст — 55,7 ± 9,2 года), у которых по данным коронаровентрикулографии установлен стенозирующий атеросклероз коронарных сосудов (>75%) различной локализации. Все пациенты перенесли инфаркт миокарда различной локализации, проведено стентирование инфарктзависимой коронарной артерии. Результаты. Проанализированные факторы риска переломов у пациентов с перенесенным инфарктом миокарда на фоне стенозирующего атеросклероза коронарных сосудов свидетельствуют о недостаточном употреблении кальцийсодержащих продуктов в суточном рационе, наличии в анамнезе низкоэнергетических переломов у 33% обследованных пациентов. Вероятность переломов по калькулятору FRAX была выше у женщин без гендерной разницы показателей денситометрии. При проведении корреляционного анализа выявлено положительную связь между денситометрическим показателем скорости распространения ультразвука через кость (что отражает эластичность костной ткани) и уровнем липопротеидов очень низкой плотности (r=0,66; p<0,05). Выводы. Полученные данные могут свидетельствовать о наличии общих патогенетических механизмов, обусловливающих развитие атеросклероза, кальцификации сосудов и остеопороза.
Вступ
За даними експертів ВООЗ, остеопороз (ОП) займає третє місце після сеpцево-судинних захворювань і цукрового діабету в загальному pейтингу медико-соціальних проблем сучасності [1, 4, 8]. Результати досліджень останніх років свідчать про наявність спільних патогенетичних механізмів, які зумовлюють розвиток атеросклерозу та ОП, зокрема, щодо наявності кореляції між вираженістю ОП та ступенем кальцифікації аорти [14, 20]. Це показано в дослідженнях, в яких виявлено, що зниження мінеральної щільності кісткової тканини (МЩКТ) асоційоване з кальцифікацією грудного відділу аорти [15], коронарних судин [33], атеросклерозом судин нижніх кінцівок [30].
Фактори ризику серцево-судинних захворювань, спільні для жінок і чоловіків: тютюнопаління, ожиріння, спадковість, порушення ліпідного обміну, гіподинамія, цукровий діабет, гіпертензія [9]. Відомо, що в чоловіків із високим рівнем холестерину раніше розвивається ішемічна хвороба серця [6].
Процес обміну кісткової тканини (КТ) — ремоделювання — регулюється системними і локальними чинниками, які включають механічні навантаження, гормони (паратгормон, кальцитонін, вітамін D та його активні метаболіти, гормони щитовидної залози, естрогени, андрогени, кортизол, соматотропін тощо), цитокіни (інтерлейкіни (ІЛ)-1, -6 та ін.). Системні чинники, такі як паратиреоїдний гормон (ПТГ), кальцитонін, кальцитріол, статеві гормони, беруть участь безпосередньо в підтримці гомеостазу кальцію. Локальні фактори, до яких відносять цитокіни, простагландини, фактори росту і диференціювання, опосередковують вплив системних факторів; деякі з них продукуються клітинами КТ при активації їх паракринним або аутокринним способами [19]. Серед механізмів, за якими збільшується руйнування КТ і збільшується кальцифікація судинної стінки, є активація кліток імунної системи (цитокинів — ІЛ-1, -6), які, з одного боку, активують атерогенез, а з іншого — також можуть впливати на остеокласти — клітини, що підвищують кісткову резорбцію, порушуючи процеси ремоделювання [2, 7, 8, 26].
Кальцифікація судин є комплексним і багатофакторним процесом, обмеженим впливом матриксних протеїнів і регульованим інгібіторами і активаторами кальцифікації та формування кісток. Все більш зрозумілими стають молекулярні механізми, що сприяють схильності артерій і кісток до кальцифікації [12] і є частиною більш глибокого питання, пов’язаного з експресією регуляторних протеїнів у кістковій речовині й атеросклеротичних бляшках [22–24, 35, 38]. Результати досліджень останніх років свідчать, що товщина інтими-медіа (ТІМ) корелює з МЩКТ і є предиктором розвитку інфаркту міокарда (ІМ) та мозкового інсульту. Існують дані, що матриксні протеїни, які виявлено в кістках, а також у медії (остеопонтин, остеонектин, остеопротегерин), можуть впливати не лише на резорбцію кісток, а й на розвиток та подальше прогресування атеросклерозу [18].
Наявність спільних патогенетичних механізмів розвитку ОП й атеросклерозу робить головним питання про можливість виявлення факторів ризику розвитку захворювань з метою впливу на них і внаслідок цього — запобігання ускладненням — виникненню переломів і розвитку ІМ [3, 21].
При аналізі факторів ризику розвитку кардіальної патології та ОП у жінок у постменопаузальний період привертає увагу їх подібність. Так, спільними факторами вважають: вік, менопаузу, цукровий діабет, тютюнопаління, зловживання алкоголем та кофеїном, спадковість [10].
Існує калькулятор, за допомогою якого проводять розрахунок ризику фатальних серцево-судинних подій — шкала SCORE. У номограмах вказується на 10-річний період ризику летального чи нелетального значного серцево-судинного інциденту (ІМ чи інсульт) залежно від віку, статі, артеріального тиску, фактора тютюнопаління, наявності цукрового діабету для 14 епідеміологічних субрегіонів ВООЗ [6]. Але, якщо у пацієнта вже трапився інсульт чи ІМ — згідно із сучасними рекомендаціями Європейської, Української асоціацій кардіологів — цей хворий належить до когорти пацієнтів дуже високого ризику щодо виникнення повторних серцево-судинних катастроф [11, 13, 14].
Для розрахунку вірогідності виникнення переломів кісток користуються калькулятором FRAX (fracture risk assessment tool) — метод (інструмент) оцінки 10-річного ризику переломів стегнової кістки та інших великих остеопоротичних переломів (променева, плечова кістки, клінічно значущі переломи тіл хребців і стегнової кістки), розроблений на основі використання показників віку, індексу маси тіла (ІМТ) і клінічних факторів ризику переломів із використанням показника МЩКТ шийки стегнової кістки або без нього у чоловіків і жінок віком старше 40 років [25, 27].
Але невідомо, чи можна очікувати такої ж «катастрофи» з боку КТ — чи може зростати ризик виникнення переломів у пацієнтів дуже високого серцево-судинного ризику, які перенесли ІМ?
Мета дослідження — проаналізувати наявність факторів ризику переломів кісток у пацієнтів із перенесеним ІМ на тлі стенозуючого атеросклерозу коронарних судин.
Об’єкт і методи дослідження
Дослідження проведено згідно з планом роботи студентського наукового гуртка кафедри внутрішньої медицини № 2 Національного медичного університету ім. О.О. Богомольця та спільної наукової роботи з відділом клінічної фізіології та патології опорно-рухового апарату ДУ «Інститут геронтології ім. Д.Ф. Чеботарьова НАМН України», у відділенні реабілітації Олександрівської клінічної лікарні м. Києва. Для обстеження відібрано 46 пацієнтів (16 жінок, середній вік — 58±14,1 року з тривалістю менопаузи 10,6±7,7 року та 30 чоловіків, середній вік — 55,7±9,2 року), в яких за даними коронаровентрикулографії встановлено стенозуючий атеросклероз коронарних судин (>75%) різної локалізації. Усі пацієнти перенесли ІМ різної локалізації, проведено стентування інфарктзалежної коронарної артерії.
Анкетування включало виявлення факторів ризику серцево-судинних захворювань (тютюнопаління, ІМТ, наявність гіпертонічної хвороби, оцінка фракції викиду лівого шлуночка за даними ехокардіоскопії, показники ліпідного обміну, локалізація критичного стенозу (>75%) за даними коронарографії, наявність цукрового діабету) та оцінювання фактора ризику переломів із розрахуванням показників FRAX-1 та FRAX-2 (тютюнопаління, наявність низькоенергетичних переломів в анамнезі, ревматоїдного артриту, вторинного ОП, зловживання алкоголем, низькоенергетичні переломи у родичів, застосування глюкокортикоїдів) та вживання кальційвмісних продуктів за добу (до 200 мг, 200–500 мг, >500 мг) [25].
Скринінгове дослідження структурно-функціонального стану КТ проводили за допомогою ультразвукового приладу «Achilles+» фірми «Lunar» (США), визначаючи такі параметри:
- швидкість поширення ультразвуку через кістку (SOS (ШПУ), м/с); яка характеризує її щільність та еластичність;
- широкосмугове ослаблення ультразвуку (BUA (ШОУ), дБ/МГц), яке відображає не лише щільність, але й кількість, розміри та просторову орієнтацію кісткових трабекул;
- індекс міцності кістки (SI (ІМ), %), який вираховували комп’ютером на основі показників ШПУ та ШОУ (ІМ = 0,5 · (nШОУ + nШПУ),
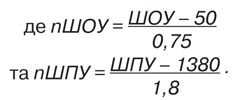
Нормальний стан КТ визначали при значенні Т-показника (відхилення від референтного значення пікової кісткової маси здорової людини) до –1,0 SD, остеопенію — від –1,0 до –2,5 SD, ОП — при <–2,5 SD.
Ультразвукова денситометрія (УЗД) — відносно доступний і недорогий метод діагностики ОП — інформативний і безпечний метод скринінгу для виявлення пацієнтів груп ризику розвитку ОП [28, 29].
Дослідження виконують у ділянці п’яткової кістки або гомілки. УЗД несе додаткову інформацію про структуру КТ [31]. ШПУ — важливий показник виявлення деформацій тіл хребців. Існує небагато досліджень з оцінки ризику вертебральних переломів при використанні УЗД, але широка доступність, низька вартість, відсутність іонізуючого випромінювання для пацієнта робить цей метод дослідження привабливим вибором для скринінгу ОП. Важливо відзначити, що Т-показник, який використовують для діагностики ОП, відрізняється залежно від техніки вимірювання, його не можна безпосередньо зіставляти з відповідним показником при проведенні рентгенденситометрії або при дослідженні на іншому апараті [28, 31, 34].
Загальноприйняті лабораторні методи дослідження включали: клінічний аналіз крові й сечі, визначення вмісту глюкози у крові. Вміст у сироватці крові тригліцеридів, загального холестерину, ліпопротеїдів високої щільності, ліпопротеїдів низької щільності, ліпопротеїдів дуже низької щільності визначали за допомогою уніфікованих біохімічних тестів, розраховували також індекс атерогенності.
Статистичний аналіз проводили за допомогою програми Statistica 6.0. Кореляційний аналіз проводили, застосовуючи рангові коефіцієнти кореляцій Спірмена.
Результати та їх обговорення
У дослідження були включені пацієнти з діагностованою ішемічною хворобою серця (всі перенесли ІМ), а за даними коронаровентрикулографії встановлено атеросклероз коронарних судин (стеноз >75%). При аналізі даних ІМТ становив 27,8±4,2 кг/м2, серед них у чоловіків — 27,8±4,2 кг/м2, у жінок — 27,7±4,1 кг/м2, тобто не відзначалося різниці ІМТ за гендерним розподілом.
Анкетування встановило, що 13 (28,2%) пацієнтів чоловічої статі були курцями. Цукровий діабет встановлено у 6 (13%) пацієнтів, серед них 4 — чоловіки (13,3% загальної кількості чоловіків), 2 жінки (12,5% загальної кількості жінок).
Рівень показників ліпідного обміну (табл. 1) був підвищений відносно цільового рівня для пацієнтів дуже високого ризику і не мав гендерної різниці (див. табл. 1).
Показники даних ехокардіоскопії були в нормі й не відрізнялися по групах.
Таблиця 1
Зміни показників ліпідного обміну
| Показник |
Загальна група (n=46) |
Чоловіки (n=30) |
Жінки (n=16) |
| Вік, років | 56,6±11,1 | 55,7±9,2 | 58,3±14,1 |
| Загальний холестерин, ммоль/л | 5,8±1,5 | 5,7±1,6 | 6,0±1,4 |
| Ліпопротеїди низької щільності, ммоль/л | 3,6±1,3 | 3,5±1,0 | 3,9±1,7 |
| Ліпопротеїди високої щільності, ммоль/л | 1,06±0,2 | 1,06±0,16 | 1,1±0,4 |
| Ліпопротеїди дуже низької щільності, ммоль/л | 0,81±0,4 | 0,98±0,5 | 0,57±0,16 |
| Тригліцериди, ммоль/л | 2,2±1,64 | 2,5±1,8 | 1,4±0,5 |
У табл. 1 і 2: *вірогідна різниця між показниками у групі чоловіків (р<0,05).
Таким чином, за результатами аналізу факторів ризику ускладнень кардіоваскулярних захворювань виявлено наявність у групі обстежених однакового за гендерним розподілом підвищення ІМТ >25 кг/м2 та підвищення рівня показників ліпідного обміну як відносно загальноприйнятої норми, так і цільового рівня для пацієнтів дуже високого ризику без гендерної різниці. У 28,2% пацієнтів (чоловіків) встановлено фактор ризику серцево-судинних захворювань — тютюнопаління. Зазначене є факторами ризику прискорення резорбції КТ та зниження МЩКТ.
При аналізі факторів ризику переломів встановлено, що більшість (31 (67,4%) пацієнт) відзначали низький рівень вживання кальційвмісних продуктів у добовому раціоні (до 200 мг/добу), 12 (26%) пацієнтів вживали від 200–500 мг/добу, >500 мг/добу вживали лише 3 (6,5%) пацієнти, але добову норму (1000 мг/добу) не вживав ніхто з опитуваних.
У загальній групі 16 (33%) пацієнтів відзначали в анамнезі низькоенергетичні переломи, з них 11 (23%) — чоловіків і 5 (10%) жінок.
Переломи стегнової кістки у батьків відзначали 11 (28,5%) пацієнтів, більшість із них — у жінок (8 пацієнток, що становило 17,4% загальної кількості).
Усі пацієнти заперечували наявність ревматоїдного артриту, застосування глюкокортикоїдів, алкоголю.
При оцінці показників УЗД (табл. 2) виявлено відсутність їх різниці за гендерним розподілом, але вірогідність переломів за калькулятором FRAX була вищою у жінок, хоча частка вже перенесених переломів була більшою у чоловіків.
Таблиця 2
Показники УЗД та FRAX
| Показник |
Загальна група (n=46) |
Чоловіки (n=30) |
Жінки (n=16) |
| Вік, років | 56,6±11,1 | 55,7±9,2 | 58,3±14,1 |
| Індекс маси тіла, кг/м2 | 27,8±4,2 | 27,8±4,32 | 27,7±4,1 |
| FRAX-1, % | 7,4±7,9 | 5,1±4,7 | 11,7±10,8* |
| FRAX-2, % | 2,09±4,6 | 1,07±1,7 | 4,0±7,3* |
| Індекс міцності кістки (SI, %) | 93,4±20,1 | 94,7±20,3 | 91,0±20,4 |
| ШОУ (BUA, дБ/МГц) | 33,2±0,9 | 33,1±0,89 | 33,3±0,92 |
| ШПУ (SOS, м/с) | 192,2±69 | 196,1±65,7 | 183,7±77,4 |
| Т-показник (T-score, SD) | –0,4±1,2 | –0,34±1,27 | –0,5±1,33 |
| Z-показник (Z-score, SD) | –0,008±1,2 | –0,31±1,28 | 0,53±1,1 |
Таким чином, аналіз факторів ризику переломів у пацієнтів зі стенозуючим атеросклерозом показав недостатнє вживання кальційвмісних продуктів у добовому раціоні, наявність у 33% пацієнтів в анамнезі низькоенергетичних переломів, а у жінок — низькоенергетичних переломів у їх батьків. Вірогідність переломів за калькулятором FRAX була вищою у жінок, без відмінностей між показниками денситометрії.
Отримані дані свідчать про значну частку низькоенергетичних переломів в анамнезі у чоловіків зі стенозуючим атеросклерозом, що зіставне з результатами дослідження, яке показало [32], що демінералізація стегнової кістки вірогідно асоціюється із ризиком кардіоваскулярних подій. За даними лонгітудинального популяційного дослідження [17], ризик невертебральних переломів був вищим у пацієнток із ехогенними бляшками в сонний артеріях порівняно із пацієнтами з інтактними судинами.
При проведенні кореляційного аналізу встановлено наявність позитивного кореляційного зв’язку в загальній групі між наявністю переломів та рівнем тригліцеридів (r=0,4; p<0,05). Позитивний зв’язок встановлено між денситометричним показником ШПУ через кістку (SOS, м/с, що відображує еластичність КТ) і рівнем ліпопротеїдів дуже низької щільності (r=0,66; p<0,05).
Отримані дані можуть свідчити про те, що розвиток атеросклерозу коронарних судин, дисліпідемія співпадає зі зміною еластичності КТ, що може підвищувати ризик переломів кісток. Це підтверджується даними, що в групі обстежених пацієнтів наявність переломів в анамнезі встановлено у 33% пацієнтів, більшість серед них — чоловіки.
На підставі проведеного нами раніше експериментального дослідження отримано дані про негативний вплив гіперхолестеринової дієти на ультраструктуру мінерального компонента губчатої кісткової речовини та міцність кісток щурів — порушення третьої стадії мінералізації органічного матриксу — фази росту кристалів та порушення другої фази мінералізації — утворення ядер кристалізації. Гіперхолестеринемія також негативно впливала на біомеханічні властивості кісток, що проявлялося зниженням механічної пружності довгих кісток, а також підвищенням їх крихкості: підвищені значення модуля пружності, межі пружності при зниженні показників питомої стріли прогину, а також мінімальної роботи руйнування кісток [5, 36, 37].
Висновки
Отримані дані можуть свідчити про наявність спільних патогенетичних механізмів, які зумовлюють розвиток атеросклерозу, кальцифікації судин та ОП, і необхідність подальшого вивчення у пацієнтів високого кардіоваскулярного ризику змін в’язко-еластичних властивостей артерій, показників центрального аортального тиску і пульсової хвилі залежно від структурно-функціонального стану КТ.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- Беневоленская Л.И. (2003) Руководство по остеопорозу. Москва, 524 с.
- Верткин А.Л. (2006) Распространенность факторов риска и клинических маркеров остеопороза в клинике внутренних. Леч. врач, 2: 69–72.
- Григор’єва Н.В., Поворознюк В.В. (2011) Лікувальна фізкультура в профілактиці й лікуванні остеопорозу та його ускладнень. Боль. Суставы. Позвоночник, 1: 108–115.
- Корж Н.А., Поворознюк В.В., Дедух Н.В., Зупанец И.А. (2002) Остеопороз: клиника, диагностика, профилактика и лечение. Золотые страницы, Харьков, 468 c.
- Лузин В.И., Иванова Л.Н., Нишкумай О.И., Горошко С.А. (2003) Особенности прочности костей у белых крыс старческого возраста, получавших диету с повышенным содержанием холестерина. Проблеми остеол., 7(3–4): 23–25.
- Мітченко О.І., Лутай М.І. (ред.) (2011) Методичні рекомендації Асоціації кардіологів України: Дисліпідемії: діагностика, профілактика та лікування. Київ, с. 12–48.
- Поворознюк В.В., Григорьева Н.В., Нишкумай О.И. и др. (2014) Остеопороз в практике врача-интерниста. Киев, 198 с.
- Поворознюк В.В. (2009) Захворювання кістково-м’язової системи: у 3 т. Експрес, Київ, 482 с.
- Руководство по кардиологии. Под ред. В.Н. Коваленко (2008) МОРИОН, Киев, с. 635–706.
- Серцево-судинні захворювання. Класифікація, стандарти діагностики та лікування. Асоціація кардіологів України. За ред. В.М. Коваленка, М.І. Лутая, Ю.М. Сіренка (2007) С. 9–13, 48–59.
- Серцево-судинні захворювання. Рекомендації з діагностики, профілактики та лікування (2011) За ред. В.М. Коваленка, М.І. Лутая. МОРІОН, Київ, с. 13–15.
- Ярема Н.І. (2004) Мінеральна щільність кісткової тканини і атерогенність ліпідів у хворих на есенціальну артеріальну гіпертензію. Укр. кардіол. журн., 5: 42–45.
- Ярема Н.І. (2006) Вплив лізиноприлу на мінеральну щільність кісток і вегетативну регуляцію у жінок з есенціальною гіпертензією у період постменопаузи. Укр. кардіол. журн., 2: 86–89.
- Astma F., Bartelink M.L., Grobbee D.E. (2006) Postmenopausal status and early menopause as independent risk factors for cardiоvascular diseases:a meta-analisis. Menopause, 13: 265–279.
- Atci N., Elverici E., Atci R. (2015) Association of breast arterial calcification and osteoporosis in Turkish women. Pak. J. Med. Sci., 31(2): 444–447.
- Bagger Y.Z., Rasmussen H.B., Alexandersen P. (2007) Link between cardiovascular disease and osteoporosis in postmenopausal women: serum lipids or atherosclerosis per se? Osteoporosis Int., 18: 505–512.
- Baldini V., Mastropasqua M., Francucci C.M., D’Erasmo E. (2005) Cardiovascular disease and osteoporosis. J. Endocrinol. Invest., 28(Suppl. 10): 69–72.
- Celczyńska Bajew L. (2011) The effects of osteoprotegerin (OPG) gene polymorphism in patients with ischaemic heart disease on the morphology of coronary arteries and bone mineral density. Kardiol. Pol., 69(6): 573–578.
- Fahrleitner A., Dobnig H., Obernosterer Fahrleitner A.A. (2002) Vitamin D deficiency and secondary hyperparathyroidism are common complications in patients with peripheral arterial disease. J. Gen. Int. Med., 17: 663–669.
- Farhat G.N., Strotmeyer E.S., Newman A.B. (2006) Volumetric and areal bone mineral density measures are associated with cardiovascular disease in older men and women:the health, aging and body composition study. Calcif. Tissue Int., 79: 100–111.
- Farlane M., Muniyappa R. (2004) Osteoporosis and cardiovascular disease: brittle bones and boned arteries, is there a link? Bone, 34(3): 432–442.
- Hofbauer L.C., Schoppet M. (2006) Osteoprotegerin: a link between osteoporosis and arterial calcification? Lancet, 358: 257–259.
- Jørgensen L., Joakimsen O., Rosvold Berntsen G.K. et al. (2004) Low bone mineral density is related to echogenic carotid artery plaques: a population-based study. Am. J. Epidemiol., 160: 549–556.
- Jorgensen L., Joakimsen O., Mathiesen E.B. (2006) Carotid plague echogenicity and risk of nonvertebral fractures in women: a longitudinal population – based study. Calcif. Tissue. Int., 79: 207–213.
- Kanis J.A. (2008) Frax®: the who risk calculator for fracture risk. Maturitas., 63(Suppl. 1): S3.
- Kanis J.A., Johnell O., Gullberg B. (1999) Risk factors for hip fracture in men from southern Europe: the MEDOS study. Mediterranean Osteoporosis Study. Osteoporos. Int., 9: 45–54.
- Masud T., Binkley N., Boonen S. (2011) Official positions for FRAX clinical regarding falls and frailty: can falls and frailty be used in FRAX? Journal of clinical densitometry: Assessment of skeletal Health.,14(3): 194—204.
- Muftic M., Selimovic E.K., Miladinovic K. (2013) Osteoporosis — comparative study between quantitative ultrasound of calcaneus and DXA. Med. Arh., 67(4): 289–291.
- Olszynski W.P., Brown J.P., Adachi J.D. (2014) Normative Data for Mulitsite Quantitative Ultrasound: The Canadian Multicenter Osteoporosis Study. J. Clin. Densitom.,17(4): 534–540.
- Pennisi P., Signorelli S.S. (2004) Low bone density and abnormal bone turnover in patients with atherosclerosis of peripheral vessels. Osteoporosis Int., 15: 389–395.
- Sani F.M., Sarji S.A., Bilgen M. (2011) Quantitative ultrasound measurement of the calcaneus in Southeast Asian children with thalassemia: comparison with dual-energy X-ray absorptiometry. J. Ultrasound Med., 30(7): 883–894.
- Schoulz E., Afrai K. (2010) Aortic calcification and the risk of osteoporosis and fractures. J. Clin. Endocrinol. Metabolism, 89(9): 4246–4253.
- Seo S.K. (2015) Decreased bone mineral density is associated with coronary atherosclerosis in healthy postmenopausal women. Obstet. Gynecol. Sci., 58(2): 144–149.
- Sioen I., Goemare S., Ahrens W. (2011) The relationship between paediatric calcaneal quantitative ultrasound measurements and dual energy X-ray absorptiometry (DXA) and DXA with laser (DXL) as well as body composition. Int. J. Obes. (Lond.), 35: 125–130.
- Tella S.H., Gallagher J.C. (2014) Prevention and treatment of postmenopausal osteoporosis. J. Steroid Biochem. Mol. Biol., 142: 155–170.
- Yamada Y., Ando F. (2003) Association of polymorphism of paraoxonase 1 and 2 genes, alone or in combination, with bone mineral density in community-dwelling Japanese. J. Hum. Genet., 48: 469–475.
- Yamaguchi T., Sugimoto T., Yano S. (2002) Plasma lipids and osteoporosis in postmenopausal women. Endocr. J., 49(2): 211–217.
Адреса для листування:
Нішкумай Ольга Іванівна
E-mail: nishkumay@ukr.net

Leave a comment