МОЖЛИВОСТІ РЕЗОРБЦІЇ ПОДАГРИЧНИХ ТОФУСІВ ПРИ ПРОВЕДЕННІ УРАТЗНИЖУвальнОЇ ТЕРАПІЇ: КЛІНІЧНЕ СПОСТЕРЕЖЕННЯ
Триполка С.А. 1, Головач И.Ю.2
- 1Коммунальное учреждение здравоохранения «Областная клиническая больница — центр экстренной медицинской помощи и медицины катастроф», Харьков
- 2Клінічна лікарня «Феофанія» Державного управління справами, Київ
Резюме. Відомо, що тофуси утворюються при «природному» перебігу подагри та відсутності адекватної уратзнижувальної терапії в середньому через 7–10 років від дебюту захворювання, частота їх виявлення досягає 34% і наростає із тривалістю хвороби. Уратзнижувальну терапію використовують для первинного зниження і контролю рівня сечової кислоти, а також для усунення відкладень депозитів кристалів у тканинах хворих на хронічну подагру. В останні роки з’явилися дані про можливість резорбції тофусів аж до їх повного розчинення при ретельному моніторуванні рівня сечової кислоти в сироватці крові й адекватному призначенні уратзнижувальних препаратів. Час, необхідний для розчинення депозитів кристалів, пов’язаний із тривалістю захворювання, загальним кристалічним навантаженням і досягнутим рівнем сечової кислоти. Представлено клінічне спостереження зменшення розмірів тофусів у пацієнта з тяжкою тофусною подагрою після заміни алопуринолу на фебуксостат і досягнення цільового рівня сечової кислоти.
Подагра — системное тофусное заболевание, характеризующееся отложением кристаллов моноурата натрия в различных органах и тканях и развивающимся в связи с этим воспалением у лиц с гиперурикемией, обусловленной внешнесредовыми и/или генетическими факторами [3]. Общеизвестно, что клинические проявления подагры, такие как острый подагрический артрит, хроническая подагрическая артропатия и формирование тофусов, развиваются в связи с отложением кристаллов моноурата натрия в суставных, околосуставных тканях и в подкожной клетчатке. Учитывая, что, помимо длительности заболевания, основным фактором формирования хронической тофусной подагры является выраженность и стойкость гиперурикемии, большое значение имеют своевременная диагностика и применение препаратов, снижающих уровень мочевой кислоты в сыворотке крови [7, 12]. Развития тофусной подагры, приводящей к инвалидизации пациентов, можно избежать. Уратснижающую терапию используют для первоначального снижения и контроля уровня мочевой кислоты, а также для устранения отложения депозитов кристаллов в тканях у больных хронической подагрой. Это особенно важно при тофусной подагре для предупреждения дальнейшего осаждения кристаллов и вызванного ими повреждения тканей.
Тофусы образуются при «естественном» течении подагры и отсутствии адекватной уратснижающей терапии в среднем через 7–10 лет от дебюта заболевания, частота их выявления достигает 34% и нарастает параллельно длительности болезни, хотя иногда они могут быть первым клиническим проявлением подагры, предшествуя типичным приступам артрита [10, 15]. Отложение моноурата натрия в тканях предполагает медленное эпитаксиальное наращение кристаллов с формированием кристаллических структур [9]. Отложения кристаллов моноурата натрия наиболее часто наблюдаются в тканях сустава, околосуставных сумках, связках [5], однако в литературе описаны казуистические случаи отложения уратных депозитов в стенке желудка [4], тканях почки, в миокарде и клапанах сердца, а также в позвоночнике, приводя к полной деструкции позвонков и развитию жизнеугрожающей неврологической симптоматики [2]. Гистологически тофус представляет собой мелоподобный (белого цвета в центральной его части) узел, состоящий из кристаллов моноурата натрия, белков и мукополисахаридов; отложения окружены гистиоцитами, лимфоцитарным валом, фибробластами. При обработке формалином кристаллы моноурата натрия могут растворяться, что может быть причиной отсутствия в препарате кристаллов при проведении поляризационной микроскопии.
Уратные депозиты обусловливают постоянное низкоуровневое воспаление в тканях, повышение воспалительных маркеров в синовиальной жидкости, тканях сустава и в крови, приводя в конечном итоге к эрозивно-деструктивному поражению суставов и формированию коморбидности [5]. Недостаточный контроль уровня мочевой кислоты в сыворотке крови приводит к вовлечению в воспалительный процесс все новых и новых суставов, что, как правило, сочетается с формированием внутрикожных и внутрикостных тофусов, которые могут вскрываться, формируя характерные трудно заживающие кожные дефекты. Помимо физического и эстетического беспокойства, тофусы могут вызывать функциональную недостаточность, снижая качество жизни больных, их трудоспособность, нередко инвалидизируя пациентов [13].
При значении уровня мочевой кислоты в сыворотке крови >360 мкмоль/л происходит насыщение ею биологических жидкостей, что приводит к ее кристаллизации в виде мононатриевой соли в случае достижения точки супернасыщения. Клинически это проявляется приступами подагрического артрита, формированием конкрементов в почках, ростом тофусов. Напротив, стойкая нормоурикемия коррелирует с отсутствием приступов острого артрита и растворением уже имеющихся кристаллов [8]. Таким образом, исследования последних лет указывают на возможность резорбции тофусов, уменьшение их количества и размеров при адекватной уратснижающей терапии. К сожалению, пациентам с подагрой, особенно в первые годы болезни, свойственно пренебрегать рекомендациями о необходимости соблюдения диеты и применении антигиперурикемических препаратов. Так, P. Primatesta и соавторы [11] в ретроспективном исследовании с участием 177 637 больных подагрой выявили, что на протяжении последующего года от момента установления диагноза для лечения, направленного на подагрический артрит, в 41,7% случаев применяли нестероидные противовоспалительные препараты, и только 31,8% больных получали аллопуринол, в то время как у 39% пациентов медикаментозного лечения подагры не проводили вовсе.
Однако тщательное мониторирование уровня мочевой кислоты в сыворотке крови, адекватное применение уратснижающих препаратов (прежде всего аллопуринола или фебуксостата), модификация способа жизни способны привести к реверсии тофусов, вплоть до их полного исчезновения. E. Pascual и соавторы [8] отметили, что при адекватной антигиперурикемической терапии кристаллы моноурата натрия перестают определяться в синовиальной жидкости через 3–33 мес от начала лечения. В исследовании ЕXCEL (Febuxostat vs Allopurinol Comparative Extension Longterm Study), в котором проведено сравнение двух ингибиторов ксантиноксидазы, помимо достижения нормоурикемии и полного исчезновения у всех больных приступов острого артрита через 40 мес лечения, отмечено и рассасывание тофусов при терапии как фебуксостатом (у 36–46% пациентов), так и аллопуринолом (у 29%) [6]. В другом исследовании оценена эволюция тофусов у 63 пациентов с тяжелой тофусной подагрой при лечении аллопуринолом, бензбромароном и их сочетанием до достижения уровня мочевой кислоты в сыворотке крови ниже, чем порог насыщения уратов в тканях [10]. Исследователями продемонстрированы темпы редукции тофусов в зависимости от средней концентрации мочевой кислоты: при уровне мочевой кислоты 6,1–7,0 мг/дл скорость редукции тофусов составляла 0,53±0,59 мм/мес; при уровне 5,1–6,0 мг/дл — 0,77±0,41 мм/мес; 4,1–5,0 мг/дл — 0,99±0,50 мм/мес. Наилучшие результаты получены при жестком контроле уровня мочевой кислоты: при концентрации в сыворотке крови ≤4,0 мг/дл рассасывание тофусов происходило со скоростью 1,52±0,67 мм/мес. Отметим, что у всех пациентов наблюдалось полное разрешение тофусов через 64 мес терапии.
Время, необходимое для растворения депозитов кристаллов, связано с длительностью заболевания, общей кристаллической нагрузкой (количеством и размерами тофусов) и достигнутым уровнем мочевой кислоты [5]. Например, у большинства (90%) пациентов с длительностью подагры <10 лет наблюдалось полное рассасывание тофусов через 112 мес терапии (уровень мочевой кислоты в сыворотке крови в среднем составлял 291 мкмоль/л (4,9 мг/дл)). Аналогичных результатов удалось достичь только у 25% пациентов с длительностью подагры >10 лет [8]. Вероятно, такая разница в достижении результатов связана с общей кристаллической нагрузкой. При этом скорость уменьшения подагрических тофусов приблизительно удваивается при достижении концентрации мочевой кислоты в крови 238 мкмоль/л (4 мг/дл) по сравнению с 360 мкмоль/л (6 мг/дл) [10]. Согласно большинству современных рекомендаций ACR, EULAR, 3E Initiative [7, 12], при хронической тофусной подагре целевым является уровень мочевой кислоты <5 мг/дл (<300 мкмоль/л), однако при значительной длительности болезни и большом объеме тофусов эти показатели могут быть индивидуально снижены.
Основными уратснижающими препаратами, широко применяемыми в реальной клинической практике, являются аллопуринол и фебуксостат (в Украине фебуксостат зарегистрирован в 2014 г. под торговым названием Аденурик). Аллопуринол наиболее часто применяют в фиксированной дозе 300 мг/сут, но его максимальная доза составляет 800 мг/сут [14]. К сожалению, у большинства пациентов она не может быть достигнута из-за реакций гиперчувствительности, поражения печени и развития почечной недостаточности, что часто сопровождает тофусную стадию подагры. Фебуксостат является селективным ингибитором ксантиноксидазы, может активно применяться при почечной недостаточности, не требует коррекции дозы у пациентов пожилого возраста, а также обеспечивает более быстрое достижение целевого уровня мочевой кислоты и более жесткий ее контроль по сравнению с аллопуринолом [1].
В этой связи представляет интерес клиническое наблюдение, иллюстрирующее положительную динамику в виде значительного уменьшения тофусов и отсутствия обострений на протяжении 3 мес при замене длительного применения аллопуринола на фебуксостат.
Клиническое наблюдение. Пациент К., 44 года, врач, обратился на консультативный прием в Коммунальное учреждение здравоохранения «Областная клиническая больница — центр экстренной медицинской помощи и медицины катастроф» города Харькова, поликлиническое отделение, с жалобами на боль в суставах кистей, стоп, коленных, голеностопных, локтевых суставах, утреннюю скованность до 1 ч, множественные образования (тофусы), деформирующие суставы кистей и стоп.
Из анамнеза: Общая длительность заболевания составляет около 12 лет. В 2004 г. появились приступообразная боль и отечность в суставах нижних конечностей. После проведения обследования установлен диагноз подагры. В течение 12 лет постоянно принимал аллопуринол в дозе от 50 до 300 м/сут, однако приступы артрита сохранялись и целевой уровень мочевой кислоты не был достигнут. Попытка повышения дозы аллопуринола приводила к токсическим реакциям со стороны кожи. Частота и интенсивность приступов со временем нарастали, появились округлые образования с белесоватым содержимым в области ушных раковин, а в последующем — и в области кистей рук. С 2008 г. отмечается подагрическое поражение почек (интерстициальный нефрит и мочекаменная болезнь) в виде протеинурии, повышения показателей мочевины и креатинина. В 2010 г. оперирован по поводу мочекаменной болезни. С 2011 г. отмечается стойкое повышение артериального давления, по поводу которого принимает лозартан в дозе 50 мг/сут. Применение диуретиков, ацетилсалициловой кислоты, злоупотребление алкоголем отрицает. Подагры у родственников не отмечает.
Обратился на прием к ревматологу в связи с выраженным болевым синдромом в области мелких суставов кистей рук, локтевых, лучезапястных, голеностопных суставов, а также в связи со значительной деформацией суставов, значительными функциональными ограничениями.
Объективно: состояние относительно удовлетворительное. Передвигается, прихрамывая из-за боли в коленных и голеностопных суставах. Кожные покровы обычной окраски. Множественные тофусы в области ушных раковин. Периферических отеков нет. Припухлость, дефигурация и деформация суставов кистей, стоп, пальпация их болезненна, объем движений ограничен. Множественные тофусы размерами от 1,0 х 0,5 до 4,0 х 5,0 см в области суставов кистей, некоторые из них — с элементами местного воспаления. Припухлость локтевых суставов, тофусы в области локтевых суставов. Припухлость, дефигурация коленных, голеностопных суставов, пальпация их болезненна, объем движений значительно ограничен. В легких — аускультативно везикулярное дыхание на всем протяжении. ЧД — 18/мин. Тоны сердца — звучность тонов снижена, деятельность ритмичная, акцент II тона на аорте, ЧСС 74 уд./мин, АД 150/100 мм рт. ст. Живот мягкий, увеличен в объеме за счет подкожной жировой клетчатки. Печень не пальпируется. Симптом Пастернацкого отрицателен с обеих сторон. Мочеиспускание свободное.
На момент обращения пациент принимал 200 мг/сут аллопуринола.
Общий анализ крови: гемоглобин 122 г/л, эритроциты 4,9·10/л, лейкоциты 8,7·10/л, СОЭ 32 мм/ч, формула не изменена.
Биохимический анализ крови: С-реактивный белок 24 мг/дл, мочевая кислота 6,9 мг/дл (411 мкмоль/л), ревматоидный фактор отрицательный, мочевина 7,8 ммоль/л, креатинин 108 ммоль/л, функциональные пробы печени без изменений, глюкоза в крови 8,6 ммоль/л.
Скорость клубочковой фильтрации (по формуле CKD-EPI): 72 мл/мин/1,73 м, что соответствует хронической болезни почек (ХБП) II стадии.
Рентгенограмма кистей в прямой проекции с захватом лучезапястных суставов выявила грубые нарушения структуры суставов со множественными суставно-перисуставными тофусами (рис. 1).
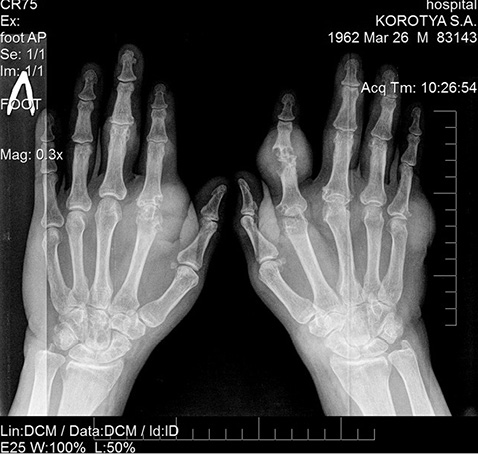
На рентгенограмме кистей в прямой проекции определяются проявления локального остеопороза; в костях запястья, более четко левой кисти, визуализируются множественные участки просветления — симптом «пробойника» (тофусы) различного диаметра, наиболее крупные диаметр 8–9 мм; резко сужены рентгеновские суставные щели II пястно-фалангового сустава левой кисти, II, III, V пястно-фаланговых суставов правой кисти с наличием на уровне II пястно-фалангового сустава левой кисти и V пястно-фалангового сустава правой кисти кист и массивных шаровидных уплотнений периартикулярных мягких тканей (периартикулярные тофусы) с наличием в них мелких отложений кальциевых депозитов. На уровне суставных концов вышеописанных пястно-фаланговых суставов определяются участки просветления — симптом «пробойника» (тофусы), занимающих >⅓ суставной поверхности, а также массивные краевые костные разрастания. Выраженная деформация с подвывихом на уровне проксимального межфалангового сустава II пальца правой кисти с разрушением эпифизов смежных костей, множественными участками просветления (тофусами) и выраженным повышением рентгеновской плотности в увеличенных в объеме периартикулярных мягких тканях (подагрические суставно-перисуставные тофусы). Подобные изменения также отмечаются в меньшей степени на уровне проксимальных и дистальных межфаланговых суставов II, III пальцев левой кисти и II–IV пальцев правой кисти.
Заключение: рентгенологические признаки соответствуют подагрическому полиартриту кистей, стадия III, со множественными эрозиями суставных поверхностей костей запястья, кисти и фаланг пальцев, суставно-перисуставными тофусами, отложением кальциевых депозитов в периартикулярных мягких тканях и на уровне суставных хрящей, остеолизом эпифиза проксимальной фаланги II пальца правой кисти с развитием подвывиха в проксимальном межфаланговом суставе II пальца правой кисти.
Ультразвуковое исследование почек: правая почка 9 х 4,5 см, левая 9,6 х 4,8 см. Контуры волнистые, паренхима 1,6 см, эхогенность повышена. Просветы чашечек справа до 0,7 см, щелевидная лоханка — до 1,7 см. Во всех сегментах обеих почек — множественные гиперэхогенные структуры 0,5–0,8–1,3 см с акустической тенью.
Течение подагры расценено как тяжелое, учитывая раннее начало подагры (в 32 года), частые обострения (>4 раз в год), полиартикулярное поражение суставов как нижних, так и верхних конечностей, наличие множественных массивных тофусов.
Пациенту установлен следующий диагноз:
Подагра, смешанный тип, тяжелое течение. Хроническая тофусная подагра с поражением суставов верхних и нижних конечностей, III стадия, функциональная недостаточность суставов І–ІІ степени. Тофусы ушной раковины, массивные тофусы области локтевых суставов, области суставов кистей и стоп. ХБП ІІ стадии. Подагрическая нефропатия (интерстициальный нефрит, мочекаменная болезнь).
В связи с отсутствием достижения целевого уровня мочевой кислоты, продолжающимися обострениями подагрического артрита, наличием множественных тофусов больших размеров, поражением почек пациенту было рекомендовано отменить аллопуринол и начать прием фебуксостата 80 мг/сут под контролем мочевой кислоты 1 раз в 2 нед с титрованием дозы до 120 мг/сут до достижения целевого уровня мочевой кислоты 5 мг/дл (300 мкмоль/л) и, возможно, ниже. Противовоспалительная терапия включала применение диклофенака натрия в дозе 100 мг/сут сочетанно с ингибиторами протонной помпы. Рекомендована коррекция образа жизни и гастрономических предпочтений. Доза лозартана была повышена до 100 мг/сут под контролем артериального давления.
Через 3 мес пациент обратился в клинику для повторной консультации и коррекции лечения. При осмотре отмечено значительное уменьшение в размерах тофусов всех локализаций. Со слов пациента, приступы обострения артрита не беспокоили, значительно уменьшилась интенсивность болевого синдрома, улучшилась физическая активность. Это позволило снизить дозу диклофенака до 50 мг/сут, а также осуществлять непостоянный его прием. На момент осмотра пациент продолжал принимать фебуксостат в дозе 120 мг/сут. При лабораторном обследовании установлено снижение СОЭ до 18 мм/ч, С-реактивный белок — 6 мг/дл, креатинин — 98 мкмоль/л, мочевина — 6,7 ммоль/л. Достигнут целевой уровень мочевой кислоты — 292 мкмоль/л (4,9 мг/дл).
Отмечено уменьшение тофусов на ушных раковинах, однако наибольшую динамику (рис. 2–4) выявлено на кистях рук.
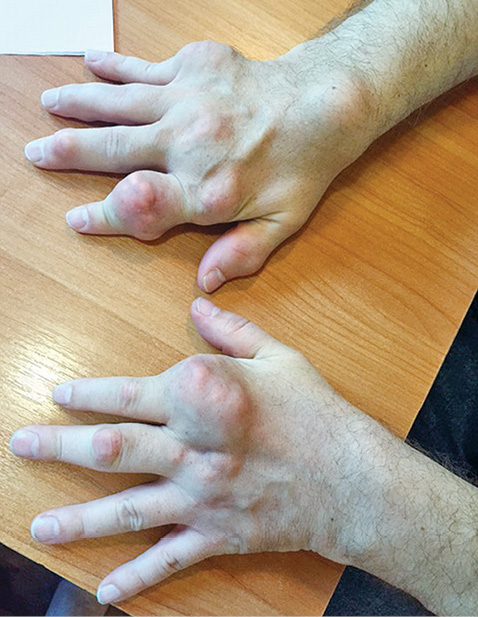
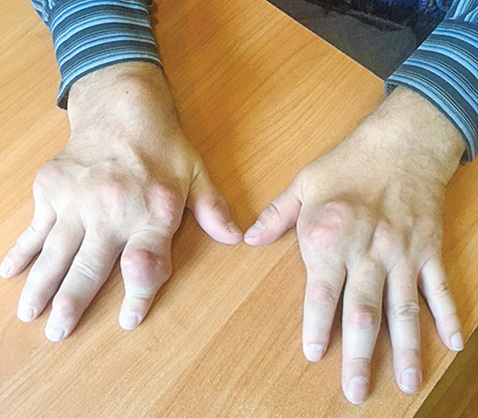
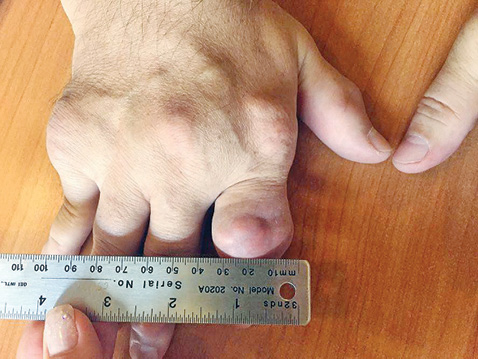
При первичном осмотре тофус в области проксимального межфалангового сустава II пальца правой руки составлял 3,9 х 2,4 см (ширина и высота), был воспален, напряжен и болезненный при пальпации; через 3 мес адекватной уратснижающей терапии его размеры уменьшились и составили — 3,4 х 2,0 см, явления воспаления и болезненность отсутствуют. Размер тофуса дистального межфалангового сустава правой руки до лечения составил 1,7 х 1,4 см; через 3 мес терапии — 1,4 х 1,2 см. Объем правой кисти на уровне пястно-фаланговых суставов до лечения составил 24,8 см, через 3 мес терапии — 24,1 см; левой кисти до лечения — 24,2 см, через 3 мес — 23,7 см. Значительная позитивная динамика уменьшения размеров коснулась всех тофусов кистей.
Данное наблюдение, по нашему мнению, наглядно демонстрирует результаты правильно подобранной терапии и высокой приверженности пациента назначениям врача, что позволило достичь целевого уровня мочевой кислоты, а также значительного клинического улучшения. И хотя размеры тофусов остаются все еще впечатляющими, ответ на лечение, позитивная динамика в первые 3 мес терапии и приверженность пациента дальнейшей адекватной уратснижающей терапии позволяют сделать оптимистические выводы.
Несмотря на то что диагностика и лечение подагры в настоящее время достаточно хорошо отработаны, медицинской общественности представлены рекомендации по ранней диагностике и менеджменту пациентов с подагрой [7], до сих пор отмечают крупные недостатки в их организации и внедрении. Существующий арсенал медицинских препаратов позволяет не только эффективно и быстро купировать острый приступ подагры, но и проводить эффективное лечение в межприступный период, предупреждая развитие осложнений. Однако, несмотря на всю очевидность, ряд причин мешают этому процессу. Описанный клинический случай позволил выделить несколько факторов, которые привели к формированию тяжелой тофусной подагры у пациента К.:
1. Недостаточная информированность широкого круга врачей относительно особенностей течения заболевания и новых, наиболее эффективных методов лечения и лекарственных препаратов, с необходимостью динамического наблюдения пациентов, быстрым реагированием и гибким назначением препаратов в зависимости от клинической ситуации.
2. Неправильное применение уратснижающих лекарственных препаратов (неадекватная доза, длительность применения, несвоевременное назначение уратснижающих препаратов, применение их в высоких дозах в момент острого приступа, отсутствие ориентации на достижение целевых значений мочевой кислоты). Так, пациент К. долгое время применял аллопуринол в неадекватных дозах без ориентации на уровень мочевой кислоты и достижение клинического эффекта.
3. Широкая доступность безрецептурного отпуска нестероидных противовоспалительных препаратов, быстрое купирование первого приступа, в результате чего больной остается вне поля зрения врача-ревматолога; отсутствие профилактики обострений приводит к тому, что пациенты обращаются за медицинской помощью уже на стадии тофусной подагры.
4. Низкая приверженность больных систематическому применению уратснижающих препаратов в межприступный период. И хотя данный пункт не относится к представленному пациенту (пациент упорно продолжал принимать аллопуринол без клинического и лабораторного эффекта), многие пациенты в межприступный период интермиттирующей подагры прерывают назначенное лечение.
5. Отсутствие учета сопутствующей терапии, длительное применение препаратов, вызывающих гиперурикемию (тиазидные и петлевые диуретики, ацетилсалициловая кислота, рибоксин и т.д.).
Таким образом, исследования последних лет, а также разработанные рекомендации по менеджменту подагры позволяют достигать самых дерзких целей в лечении, а именно: рассасывания подагрических тофусов при длительной, упорной, адекватной уратснижающей терапии. Интенсивная медикаментозная уратснижающая терапия может быть полезна пациентам с серьезными последствиями тофусного поражения суставов.
Список использованной литературы
- 1. Барскова В.Г., Ильиных Е.В., Насонов Е.Л. (2011) Фебуксостат — новый препарат в лечении подагры. Науч.-практ. ревматол., 2: 52–58.
- 2. Елисеев М.С. (2016) Поражение позвоночника при подагре. Рус. мед. журн., 24(2): 85–89.
- 3. Насонова В.А., Барскова В.Г. (2004) Ранние диагностика и лечение подагры — научно обоснованное требование улучшения трудового и жизненного прогноза больных. Науч.-практ. ревматол., 1: 5–7.
- 4. Насонова В.А., Захарова М.М., Барскова В.Г. и др. (2004) Выявление кристаллов моноурата натрия в биоптатах слизистой оболочки желудка у больных подагрой. Терапевт. арх., 76(6): 47–51.
- 5. Andrés M., Sivera F., Pascual E. (2014) Rapid Crystal Dissolution in Gout. Is It Feasible and Advisable? Int. J. Clin. Rheumatol., 9(4): 395–401.
- 6. Becker M.A., Schumacher H.R., MacDonald P.A. et al. (2009) Clinical efficacy and safety of successful longterm urate lowering with febuxostat or allopurinol in subjects with gout. J. Rheumatol., 36(6): 1273–1282.
- 7. Khanna D., Fitzgerald J.D., Khanna P.P. et al. (2012) 2012 American College of Rheumatology guidelines for management of gout. Part 1: systematic nonpharmacologic and pharmacologic therapeutic approaches to hyperuricemia. Arthritis Care Res., 64(10): 1431–1446.
- 8. Pascual E., Sivera F. (2007) Time required for disappearance of urate crystals from synovial fluid after successful hypouricaemic treatment relates to the duration of gout. Ann. Rheum. Dis., 66(8): 1056–1058.
- 9. Pascual E., Ordoñez S. (1998) Orderly arrayed deposit of urate crystals in gout suggest epitaxial formation (letter). Ann. Rheum. Dis., 57: 255.
- 10. Perez Ruiz F., Calabozo M., Pijoan J.I. et al. (2002) Effect of urate-lowering therapy on the velocity of size reduction of tophi in chronic gout. Arthritis Rheum., 47(4): 356–360.
- 11. Primatesta P., Plana E., Rothenbacher D. (2011) Gout treatment and comorbidities: a retrospective cohort study in a large US managed care population. BMC Musculoskelet Disord., 12: 103–107.
- 12. Richette P., Doherty M., Pascual E. (2016) 2016 Updated EULAR evidence-based recommendations for the management of gout. Ann. Rheum. Dis (doi:10.1136/annrheumdis –209707).
- 13. Roddy E., Zhang W., Doherty M. (2007) Is gout associated with reduced quality of life? A case-control study. Rheumatology (Oxford), 46: 1441–1444.
- 14. Stamp L., Taylor W., Jones P. et al. (2011) Starting dose, but not maximum dose, is a risk factor for allopurinol hypersensitivity syndrome: a proposed normogram fro safe starting dosing of allopurinol. Arthritis Rheum., 63(10): S1012–1018.
- 15. Wernick R., Winkler C., Campbell S. (1992) Tophi as the initial manifestation of gout. Report of six cases and review of the literature. Arch. Intern. Med., 152: 873–876.
Адрес для переписки:
Триполка Светлана Анатольевна
61058, Харьков, просп. Правды, 13
Коммунальное учреждение здравоохранения
«Областная клиническая больница —
центр экстренной медицинской помощи
и медицины катастроф»
E-mail: svtripolka@gmail.com

Leave a comment