ВПЛИВ ЛІПОПОЛІСАХАРИДУ І ДЕКСАМЕТАЗОНУ НА ВЛАСТИВОСТІ МУЛЬТИПОТЕНТНИХ СТРОМАЛЬНИХ КЛІТИН ЖИРОВОЇ ТКАНИНИ ХВОРИХ НА СИСТЕМНИЙ ЧЕРВОНИЙ ВОВЧАК
Нікольський І.С.1, Нікольська В.В.1, Проценко Г.О.1, Подпрятов С.Є.2, Подпрятов С.С.2, Семенова Я.-М.О.1, Тарануха Л.І.1
- 1ДУ «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска НАМН України», Київ
- 2Київська міська клінічна лікарня № 1, Київ
Резюме. Системний червоний вовчак (СЧВ) — це аутоімунне захворювання і тому, мабуть, найбільш адекватним підходом до розробки більш ефективних лікувальних методів є удосконалення способів регуляції активності імунної системи. У цьому аспекті перспективним напрямком вважається клітинна терапія, зокрема мультипотентні стромальні клітини (МСК). Велика кількість робіт в експерименті і клініці присвячена МСК жирової тканини (ЖТ), що можна пояснити відносно нескладною методикою їх отримання і їх відомими імуноактивними можливостями. З метою поліпшення культуральних і трансплантаційних властивостей проводяться дослідження з модифікації МСК. Часто для цього in vitro використовують біологічно активні речовини. У роботі представлені результати впливу на культуральні властивості МСК ЖТ ліпополісахариду (ЛПС) і дексаметазону — одних із найбільш ефективних імуноактивних речовин. Мета. Дослідити деякі культуральні властивості МСК ЖТ хворих на СЧВ і вивчити можливості позитивного впливу на них імуноактивних факторів: прозапального ЛПС і антизапального дексаметазону та в цілому оцінити перспективність розробки методів клітинної терапії із використанням цих факторів. Матеріали і методи. Вивчали МСК ЖТ хворих на СЧВ та косметологічних пацієнтів, у яких клітини отримували із надлишків жирової тканини (група порівняння). Проводили культивування МСК ЖТ, визначення параметрів кінетики росту клітинних популяцій, вивчення колонієутворюючих одиниць фібробластів (КУО-Ф), дослідження контактної взаємодії МСК ЖТ з лімфоцитами та результати кріконсервування МСК. Результати. Розроблені культуральні способи отримання МСК ЖТ хворих на СЧВ, що піддані дії прозапального фактора — ЛПС, й антизапального — дексаметазону. Виявлено, що кінетика росту МСК ЖТ пацієнтів з СЧВ порівняно з такою МСК ЖТ косметологічних пацієнтів суттєво уповільнена, а здатність до утворення фібробласто-лімфоцитарних розеток з тимоцитами і клоногенна активність МСК ЖТ пацієнтів з СЧВ суттєво знижені. Під впливом ЛПС кінетика росту МСК ЖТ у пацієнтів із СЧВ суттєво стимулюється, дексаметазон на кінетику росту не впливає, але має властивість відміняти стимулювальну дію ЛПС. Таким же чином реалізується дія ЛПС і дексаметазону на здатність до контактної взаємодії МСК з тимоцитами і ефективність клонування МСК ЖТ. Кріоконсервування практично не впливає на життєздатність МСК ЖТ. Висновки. Адаптовані методичні підходи до отримання стимульованих ЛПС культур МСК ЖТ хворих на СЧВ. Встановлено, що кінетика росту МСК ЖТ пацієнтів з СЧВ суттєво уповільнена. Здатність до контактної взаємодії МСК ЖТ з тимоцитами і ефективність клонування МСК ЖТ пацієнтів з СЧВ також суттєво знижені. Під впливом ЛПС кінетика росту МСК ЖТ у пацієнтів з СЧВ значно стимулюється, дексаметазон має властивість відміняти дію ЛПС. Так само реалізується дія ЛПС і дексаметазону на здатність до контактної взаємодії МСК з тимоцитами й ефективність клонування МСК ЖТ.
DOI: 10.32471/rheumatology.2707-6970.96.18879
УДК 602/616.5-002.525.2(477+100)
Вступ
Для підвищення ефективності лікування ревматичних захворювань необхідна перманентна розробка нових підходів. Відоме велике значення запалення та імунних процесів, які індукуються цитокінами, у розвитку зазначеної патології. Але антицитокінові імуносупресивні методи хоча і підвищили ефективність лікування, але все ж недостатньо. Між тим, імунологічний прогрес триває і відкриває нові можливості. Так, стало відомо, що активність імунної системи значною мірою регулюється також клітинами, які формально не включають до цієї системи, — мультипотентними стромальними клітинами (МСК).
Є достатньо даних, які свідчать про порушення функцій МСК при розвитку аутоімунних процесів. Припускається, що шляхом впливу на МСК біологічно активних речовин можна керувати їх активністю. Але недостатній базовий рівень розробки проблеми зобов’язує до створення більш фундаментальних уявлень про зміни функціонування МСК при конкретній імунопатології з визначенням адекватних способів контролювання клітинних властивостей.
При системному червоному вовчаку (СЧВ) стан МСК деякі автори визначають як «stem cell disorder» [9], тому що кістково-мозкові МСК у хворих на СЧВ демонструють виражену функціональну недостатність, що зумовлює вагомий внесок клітинних порушень у патогенез захворювання. Так, одна із головних функцій МСК — проліферація, при розвитку СЧВ сильно пригнічується внаслідок порушень молекулярної регуляції [20]. У пацієнтів виявляється велика кількість МСК зі значно підвищеною активацією сигнальних шляхів: JAK-STAT (сигнальний шлях, ключовий регулятор клітинної проліферації, диференціювання, міграції, апоптозу та виживання), p53/p21 (внутрішньоклітинний сигнальний шлях), PI3К/Akt (внутрішньоклітинний сигнальний шлях, центральними компонентами якого є ферменти фосфоінозитид-3-кіназа (PI3K), кінази AKT та mTOR), Wnt (внутрішньоклітинний сигнальний шлях, що регулює ембріогенез і диференціювання клітин), а також бета-катенін. Разом названі фактори індукують і супроводжують сенесценцію клітин [12, 14]. Мабуть, тому у пацієнтів з СЧВ порівняно зі здоровими людьми у кістковому мозку визначається значне збільшення кількості апоптотичних і сенесцентних МСК. У МСК хворих на СЧВ ознаки старіння in vitro виявляють через 5 пасажів, між тим як у здорових людей тільки через 10. У МСК хворих на СЧВ суттєво збільшується вміст мітохондріального противірусного сигнального білка (MAVS), який впливає на продукцію інтерферонів (IFN), особливо IFN-β, і теж зумовлює старіння клітин [25].
У МСК хворих на СЧВ значно знижена експресія важливого для пригнічення апоптотичних процесів фактора субсімейства протиапоптотичних білків (Bcl)-2, а при індукції апоптозу фактором некрозу пухлин (TNF)-α значно підвищується експресія субсімейства проапоптотичних білків (Bax) і каспази 8, члена суперсімейства рецепторів TNF (FAS), а також значно зростає сироватковий рівень FAS і TNF-α, що і призводить до розвитку апоптозу, а у клітинах суттєво підвищується і вміст активних форм кисню [15].
У кістково-мозкових МСК хворих на СЧВ виражено пригнічена здатність до міграції, диференціювання та імуномодуляції. Гальмується лінійне диференціювання МСК за остео-, хондро- і адипогенним напрямками [10], а пригнічення остеобластного диференціювання може бути причиною остеопорозу при СЧВ. Воно індукується активацією внутрішньоклітинного сигнального шляху, центральним компонентом якого є транскрипційний фактор NF-κB [23].
МСК здорових людей і пацієнтів з СЧВ експресують цитокіни, такі як інтерлейкіни (IL): IL-6, IL-7, IL-11, трансформуючий фактор росту β (TGF-β), колонієстимулюючий фактор макрофагів (M-CSF) і фактор стовбурових клітин (SCF). Секретуючи цитокіни, МСК забезпечують в нормі сприятливе середовище для дозрівання, диференціювання і проліферації гемопоетичних стовбурових клітин. Однак експресія мРНК IL-6 і IL-7 явно пригнічується в МСК пацієнтів із СЧВ. Важливо, що експресія IL-7 МСК негативно корелює з індексом активності захворювання, а зниження рівня IL‑6 стримує поляризацію макрофагів, яку індукують МСК [7]. Також важливим є те, що продукція індоламін-2,3-діоксигенази (IDO), яка має вирішальне значення для імунорегуляторної функції МСК, є дефектною в МСК кісткового мозку і призводить до недостатності пригнічення проліферації Т- і В-клітин і термінального диференціювання плазматичних клітин [30].
Виражене пошкодження МСК при СЧВ аргументувало розробку лікувальних методів, які враховують важливість у формуванні захворювання розладів у функціонуванні МСК [2]. Найбільш перспективним підходом до цього вважається трансплантація функціонально нормальних МСК, особливо аутологічних. Але, як наголошувалося вище, МСК хворих на СЧВ притаманна виражена функціональна недостатність, що ставить під сумнів можливість їх повноцінного функціонування після трансплантації. Тому виникла необхідність у розробці підходів ефективної стимуляції функціональної активності клітин майбутніх трансплантатів.
У цьому аспекті привертають увагу деякі відомі імуноактивні препарати. Першочергово це стосується ліпополісахариду (ЛПС). Дія ЛПС, як і його здатність до індукції в організмі запалення та стимуляції імунної системи, реалізуються через взаємодію ЛПС з двома молекулярними системами розпізнавання — MD-2/TLR4 (фактор диференціювання мієлоїду 2/толлподібний рецептор) і ЛПС-чутливими цитозольними каспазами [28]. В результаті утворюється комплекс (TLR4/MD-2/ЛПС)2, що включає внутрішньоклітинну передачу сигналів, яка призводить до активації нуклеотидних факторів і продукції запальних цитокінів і молекул адгезії (ICAM-1, VCAM-1 і E-селектину) [8, 21]. При цьому стимуляція ЛПС TLR4 МСК підвищує експресію генів IL-1β і IL-6, що обмежує здатність МСК до пригнічення проліферації Т-лімфоцитів і позитивно впливає на активність імунної системи [22].
Тому метою роботи було дослідити деякі культуральні властивості МСК ЖТ хворих на СЧВ і вивчити можливості позитивного впливу на них імуноактивних факторів: прозапального ЛПС і антизапального дексаметазону та в цілому оцінити перспективність розробки методів клітинної терапії із використанням цих факторів.
Матеріал та методи дослідження
Дослідження проводили в лабораторії імунології відділу клітинних та тканинних технологій Інституту генетичної та регенеративної медицини та у відділі некоронарних захворювань серця, ревматології та терапії ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини ім. акад. М.Д. Стражеска НАМН України».
Культивування МСК ЖТ. Ізолювання МСК ЖТ проводили за загальноприйнятими методиками [18, 19, 31]. Вивчали МСК ЖТ хворих на СВЧ та косметологічних пацієнтів, у яких клітини отримували із надлишків жирової тканини (група порівняння). Фрагмент тканини (2–5 см3) тричі промивали в 10 мл фосфатно-сольового буфера (PBS) (Sigma, США) та подрібнили ножицями. Додавали 5 мл середовища aМЕМ (BioWest, Франція) та 5 мл розчину колагенази (Worthington, США) (1,5 г/мл). Кінцева концентрація колагенази — 0,75 мг/мл (0,075%). Інкубували при 37 °С протягом 60 хв при постійному перемішуванні. Додавали 10 мл середовища aMEM з 10% ембріональної телячої сироватки (ЕТС) (BioWest, Франція), фільтрували через 4 шари марлі. Потім центрифугували при 1500 об./хв (400 g) протягом 20 хв для отримання осаду, що містить стромально-васкулярну фракцію.
Осад ресуспендували в 2 мл середовища aMEM з 10% ЕТС, 10 мМ L-глутаміну (Sigma, США) та по 100 мкг/мл пеніциліну і стрептоміцину (Дарниця, Україна), засівали ними культуральні флакони (25 см2), які вміщували до СО2-інкубатору при 37 °С та 5% СО2. Зміну поживного середовища проводили кожні 3–4 доби.
Пасування клітин здійснювали при досягненні культурами конфлуентного моношару з використанням суміші розчинів трипсину / ЕДТА (BioWest, Франція) у співвідношенні 0,05:0,02% у фосфатно-сольовому буфері (рН 7,4).
Кріконсервування МСК. Кріоконсервування використовується для довготривалого збереження МСК, що важливо для розробки і впровадження методів клітинної терапії. Сучасні експериментальні дані свідчать, що в результаті кріоконсервування не порушуються ні виживаність МСК, ні їх функціональна активність відносно взаємодії з імунною системою [5]. Кріоконсервування клітин проводили за методикою, розробленою в Інституті проблем кріобіології та кріомедицини НАН України [1], із застосуванням програмного заморожувача KRYO-516 (Planer, Англія) в кріопробірках (Nunc, США) по 1,8 мл з використанням диметилсульфоксиду (ДМСО) (5%).
Процес заморожування клітин проводили згідно з 4-етапною програмою. Після завершення програми кріопробірки переносили в низькотемпературний банк для довгострокового зберігання в рідкому азоті до використання в експерименті.
Визначення параметрів кінетики росту клітинних популяцій. Кількість подвоєнь популяції (population doubling — PD) обчислювали за такою формулою:
PD = 3,32 · lg(N/N0),
де N0 і N — початкова і кінцева кількість клітин. Тривалість подвоєння популяції (population doubling time — PDT) розраховували за формулою:
PDT = (t2 — t1) / 3,32 · lg(N/N0),
де N0 і N — початкова і кінцева кількість клітин, (t2–t1) — час між пасажами (год) [29] .
Вивчення колонієутворюючих одиниць фібробластів (КУО-Ф). Активність колонієутворення вивчали шляхом посіву 2·102 МСК на чашку Петрі (Ø 100 мм, Costar, США) в поживному середовищі, що містило середовище aMEM з 10% ЕТС, 10 мМ L-глутаміну та по 100 мкг/мл пеніциліну і стрептоміцину. Клітини культивували в CO2-інкубаторі при 37 °С і 5% CO2 протягом 14 діб. Надалі колонії фарбували кристалічним фіолетовим та підраховували за допомогою інвертованого мікроскопа [6]. Ефективність клонування КУО-Ф (ЕК) розраховували за формулою:
ЕК = (кількість колоній : кількість посіяних клітин) · 100% [4].
Реакція утворення фібробласто-лімфоцитарних розеток. Для визначення мембранної спорідненості суспензію з сумішшю МСК (105/мл, 50 мкл) і тимоцитів (107/мл, 50 мкл) у співвідношенні 1:100 центрифугували при 250g, осад ресуспендували піпетуванням і далі здійснювали мікроскопування в камері Горяєва. Проводили підрахунок поодиноких фібробластоподібних клітин і таких, що приєднали кілька лімфоцитів. Фібробласто-лімфоцитарною розеткою вважали асоціацію, що складалася з центрально розташованої фібробластоподібної клітини з приєднаними до неї трьома і більше лімфоцитами [3].
Інкубація МСК ЖТ з ЛПС та дексаметазоном. Субпопуляція МСК1 індукується прозапальними цитокінами, синтез яких стимулюється у тому числі ЛПС, а МСК2 формуються під впливом антизапальних факторів, одним із яких є дексаметазон [11, 13, 16, 17, 24, 26].
У роботі досліджували вплив на активність МСК ЖТ пацієнтів таких препаратів: бактеріальний ЛПС пірогенал і дексаметазон. МСК ЖТ вносили по 2·105 клітин в 4 культуральні флакони (25 см2) (8·103 клітин/см2): у першому були МСК нативні, у другому — МСК, інкубовані з ЛПС (0,1 мкг/мл), у третьому — МСК, інкубовані з дексаметазоном (0,1 мкг/мл), і у четвертому — МСК, інкубовані з ЛПС і дексаметазоном. ЛПС і дексаметазон додавали в культуральне середовище через 24 год культивування. Ще через 4 доби МСК відокремлювали від поверхні з використанням суміші розчинів трипсину / ЕДТА і проводили відповідні дослідження.
Статистичний аналіз. Отримані результати оброблені методами варіаційної статистики за допомогою програм Excel (MS Office XP) та Statistica 8.0 (StatSoft, Inc.). Для визначення відмінностей між досліджуваними групами використовували непараметричний критерій Манна — Уїтні. Усі дані на діаграмах представлені як медіана (Median), 25 та 75% процентилі, мінімальне та максимальне значення. При інтерпретації результатів критичною величиною рівня значущості вважали р<0,05.
Результати та їх обговорення
Дослідження кінетики клітинного росту культур МСК ЖТ пацієнтів
МСК ЖТ ізолювали методом механічно-ферментативного дезагрегування тканини і культивували в культуральних флаконах (25 см2) при 37 °С та 5% СО2. Через 10–14 днів культивування при досягненні конфлуєнтності проводили 1-й пасаж, пересіваючи 2·105 клітин в культуральний флакон (25 см2) (8·103 клітин/см2). Наступні пасажі здійснювали через 7 днів, використовуючи для пересіву таку ж кількість клітин (2·105) і такі самі культуральні флакони (25 см2). Фотографія нативної культури МСК ЖТ першого пасажу представлена на рис. 1.

Для кожного пасажу проводили обчислення параметрів кінетики клітинного росту. Кінетика росту МСК ЖТ пацієнтів із групи порівняння була суттєво активнішою, ніж та, що спостерігається у МСК ЖТ при СЧВ (рис. 2).
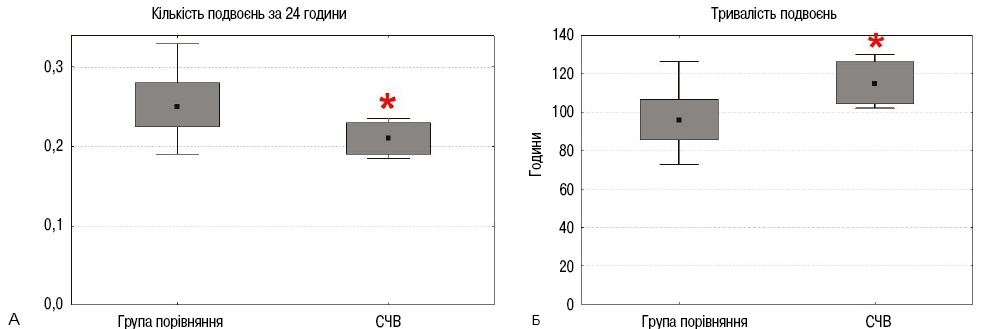
Вивчення впливу ЛПС і дексаметазону на кінетику росту МСК ЖТ пацієнтів
МСК ЖТ пацієнтів із груп порівняння та СЧВ вносили по 2·105 клітин в 4 культуральні флакони (25 см2) (8·103 клітин/см2) і культивували їх з ЛПС, дексаметазоном та ЛПС і дексаметазоном. Через 7 діб культивування клітини відокремлювали від поверхні з використанням суміші розчинів трипсину / ЕДТА і проводили обчислення параметрів кінетики росту культур.
Під впливом ЛПС кількість подвоєнь популяції за 24 год суттєво зростала (рис. 3). Дексаметазон не впливав на цей показник, а при додаванні в культуру і ЛПС, і дексаметазону показник кількості подвоєнь популяції нормалізувався. Тобто дексаметазон нівелював дію ЛПС. У результаті стимуляції ЛПС клітин пацієнтів обох груп тривалість подвоєнь популяції достовірно скорочувалася (рис. 4). Дексаметазон не впливав на цей показник, а поєднане культивування з ЛПС і дексаметазоном нормалізувало його значення, що свідчить про протилежну ЛПС дію дексаметазону.
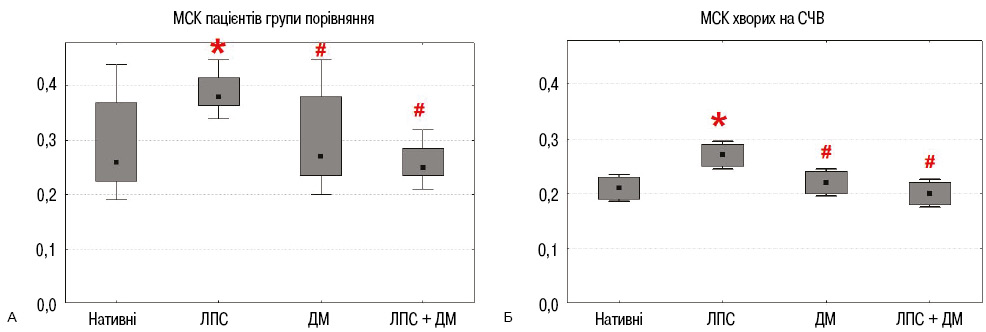
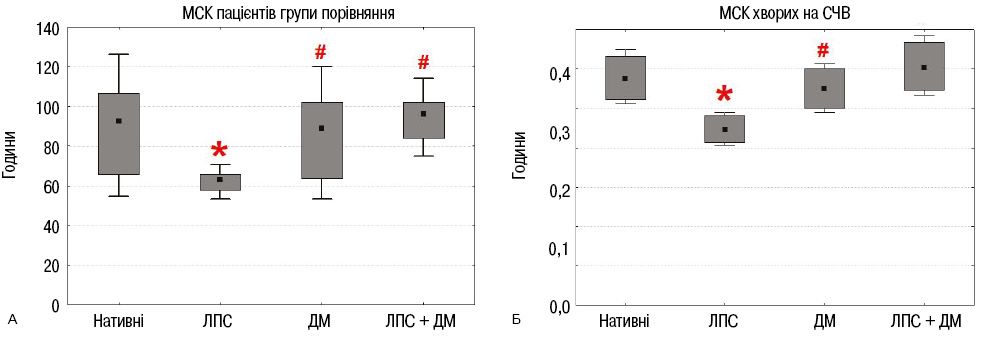
Вивчення впливу ЛПС і дексаметазону на здатність МСК ЖТ пацієнтів до контактної взаємодії з лімфоцитами
МСК ЖТ пацієнтів із груп порівняння та СЧВ вносили по 2·105 клітин в 4 культуральні флакони (25 см2) (8·103 клітин/см2) і культивували їх з ЛПС, дексаметазоном або з обома препаратами. Через 7 діб культивування клітини відокремлювали від поверхні з використанням суміші розчинів трипсину / ЕДТА. Визначали здатність нативних та інкубованих з ЛПС і дексаметазоном МСК ЖТ до утворення фібробласто-лімфоцитарних розеток з тимоцитами нелінійних мишей. Кількість фібробласто-лімфоцитарних розеток, що утворювали МСК ЖТ і тимоцити, значно підвищувалася в результаті стимуляції ЛПС (рис. 5). Сам дексаметазон не впливав, а поєднане культивування МСК пацієнтів обох груп з дексаметазоном і ЛПС нівелювало ефект останнього.
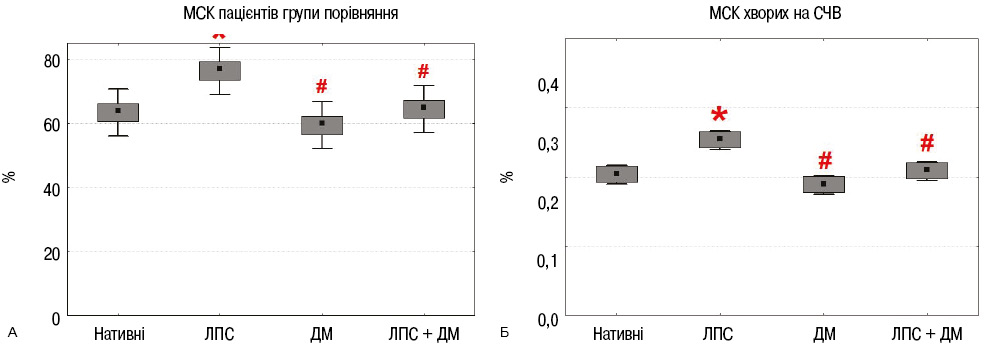
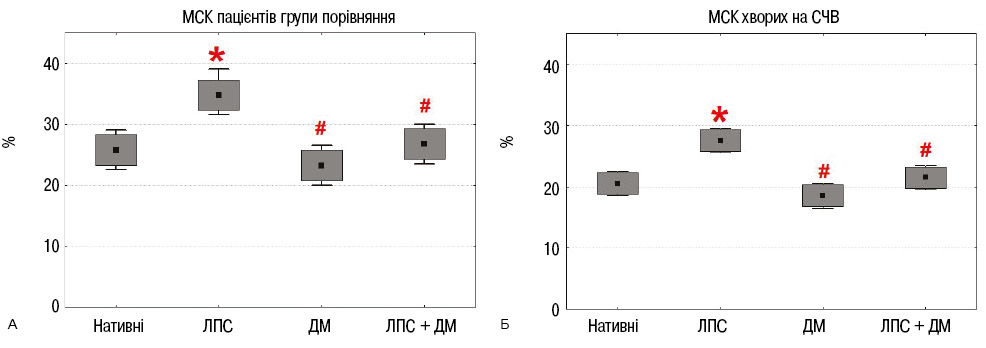
Вивчення впливу ЛПС і дексаметазону на здатність до утворення фібробластних колоній МСК ЖТ пацієнтів
МСК ЖТ пацієнтів із груп порівняння та СЧВ вносили по 2·105 клітин в 4 культуральні флакони (25 см2) (8·103 клітин/см2) і культивували їх з ЛПС та дексаметазоном, або з обома препаратами. Через 7 діб культивування клітини відокремлювали від поверхні з використанням суміші розчинів трипсину / ЕДТА.
Процес колонієутворення вивчали шляхом посіву 2·102 нативних та інкубованих з ЛПС і дексаметазоном клітин на чашку Петрі (Ø100 мм) в 10 мл поживного середовища. Культивували в CO2-інкубаторі при 37°С і 5% CO2. Через 14 діб культури фарбували кристалічним фіолетовим, підраховували кількість колоній та визначали ефективність клонування. Клоногенна активність МСК ЖТ із обох груп в результаті інкубації з ЛПС значно підвищувалася, дексаметазон практично не впливав на цю активність, а поєднана інкубація МСК з ЛПС і дексаметазоном нівелювала дію ЛПС (рис. 6).
Дослідження впливу кріоконсервування на життєздатність МСК ЖТ пацієнтів
МСК ЖТ пацієнтів із груп порівняння та СЧВ заморожували на програмному заморожувачі «KRYO 516» («Planer», Англія). Через 1 год клітини розморожували і визначали життєздатність клітин до і після кріоконсервування методом виключення барвника трипанового синього.
Кріоконсервування практично не впливало на життєздатність клітин із обох груп (таблиця).
| Джерело МСК | Статистичні показники | Життєздатність культивованих МСК,% | |
|---|---|---|---|
| До кріоконсервування | Після кріоконсервування | ||
|
Група порівняння (n=8) |
Me | 84,5 | 81,7 |
| 25–75% | 79,9–87,4 | 77,1–84,6 | |
| p | – | >0,05 | |
|
СЧВ (n=4) |
Me | 86,3 | 84,7 |
| 25–75% | 83,8–88,4 | 82,2–86,8 | |
| p | – | >0,05 | |
Таким чином, проведені дослідження показали, що ЛПС in vitro чинить, на відміну від дексаметазону, суттєву стимулюючу дію, що проявляється підвищенням темпу проліферації МСК ЖТ, їх клоногенної активності та здатності до контактної взаємодії з лімфоцитами.
Висновки
1. Адаптовані методичні підходи до отримання стимульованих ЛПС культур МСК ЖТ хворих на СЧВ.
2. Встановлено, що кінетика росту МСК ЖТ пацієнтів з СЧВ суттєво уповільнена. Здатність до контактної взаємодії МСК ЖТ з тимоцитами й ефективність клонування МСК ЖТ пацієнтів з СЧВ також суттєво знижені.
3. Під впливом ЛПС кінетика росту МСК ЖТ у пацієнтів з СЧВ суттєво стимулюється, дексаметазон на кінетику росту не впливає, але має властивість нівелювати дію ЛПС. Таким же чином реалізується дія ЛПС і дексаметазону на здатність до контактної взаємодії МСК з тимоцитами і ефективність клонування МСК ЖТ.
4. Кріоконсервування практично не впливає на життєздатність МСК ЖТ.
Список використаної літератури
- 1. Грищенко В.И., Лобынцева Г.С., Вотякова И.А. и др. (1988) Гемопоэтические клетки эмбриональной печени. Наук. думка, Київ, 192 с.
- 2. Нікольський І.С., Бутенко Г.М. (2021) Клітинна терапія в ревматології: можливі напрямки. Укр. ревматол. журн., 86 (4): 8–17.
- 3. Нікольський І.С., Нікольська В.В., Зубов Д.О. та ін. (2013) Спосіб одержання фібробласто-лімфоцитарних розеток (ФЛР), як модельного аналогу тимічної ніши ex vivo. Пат. 80076 Україна, МПК C12N5/00. Заявлено 04.12.2012. Дата публ. 13.05.2013. Бюл. № 9.
- 4. Панченко Л.М., Сыч Е.Е., Яценко А.П. (2014) Эффективность клонирования стволовых стромальных клеток костного мозга человека в присутствии высокопористой стеклокерамики и её растворимость ex vivo. Вісник ортопедії, травматології та протезування, 4: 50–54.
- 5. Семенова В.М., Цимбалюк В.І., Любич Л.Д. та ін. (2021) Структурні зміни у головному мозку щурів з експериментальним алергічним енцефаломієлітом за впливу кріоконсервованих мезенхімальних стовбурових клітин. Світ медицини і біології, 74 (4): 199–204.
- 6. Фрешни Р.Я. (2010) Культура животных клеток: практическое руководство (Пер. с англ.) Бином. Лаборатория знаний, Москва, 691 с.
- 7. Cheng R.J., Xiong A.J., Li Y.H. et al. (2019) Mesenchymal Stem Cells: Allogeneic MSC May Be Immunosuppressive but Autologous MSC Are Dysfunctional in Lupus Patients. Frontiers in cell and developmental biology, 7: 285.
- 8. Cochet F., Peri F. (2017). The Role of Carbohydrates in the Lipopolysaccharide (LPS)/Toll-Like Receptor 4 (TLR4) Signalling. International journal of molecular sciences, 18(11): 2318.
- 9. Fathollahi A., Gabalou N.B., Aslani S. (2018) Mesenchymal stem cell transplantation in systemic lupus erythematous, a mesenchymal stem cell disorder. Lupus, 27(7): 1053–1064.
- 10. Gao L., Bird A.K., Meednu N. et al. (2017) Bone Marrow-Derived Mesenchymal Stem Cells From Patients With Systemic Lupus Erythematosus Have a Senescence-Associated Secretory Phenotype Mediated by a Mitochondrial Antiviral Signaling Protein-Interferon-β Feedback Loop. Arthritis & rheumatology (Hoboken N.J.), 69(8): 1623–1635.
- 11. Holan V., Hermankova B., Bohacova P. et al. (2016) Distinct Immunoregulatory Mechanisms in Mesenchymal Stem Cells: Role of the Cytokine Environment. Stem cell reviews and reports, 12(6): 654–663.
- 12. Ji J., Wu Y., Meng Y. et al. (2017) JAK-STAT signaling mediates the senescence of bone marrow-mesenchymal stem cells from systemic lupus erythematosus patients. Acta biochimica et biophysica Sinica, 49(3): 208–215.
- 13. Kapranov N.M., Davydova Y.O., Galtseva I.V. et al. (2017) Effect of Priming of Multipotent Mesenchymal Stromal Cells with Interferon γ on Their Immunomodulating Properties. Biochemistry. Biokhimiia, 82(10): 1158–1168.
- 14. Li W., Chen W., Sun L. (2021) An Update for Mesenchymal Stem Cell Therapy in Lupus Nephritis. Kidney diseases (Basel, Switzerland), 7(2): 79–89.
- 15. Li X., Liu L., Meng D. et al. (2012) Enhanced apoptosis and senescence of bone-marrow-derived mesenchymal stem cells in patients with systemic lupus erythematosus. Stem cells and development, 21(13): 2387–2394.
- 16. Liu G. Y., Liu Y., Lu Y. et al. (2016) Short-term memory of danger signals or environmental stimuli in mesenchymal stem cells: implications for therapeutic potential. Cellular & molecular immunology, 13(3): 369–378.
- 17. Liu Y., Wang L., Kikuiri T. et al. (2011) Mesenchymal stem cell-based tissue regeneration is governed by recipient T lymphocytes via IFN-γ and TNF-α. Nature medicine, 17(12): 1594–1601.
- 18. Mitchell J.B., McIntosh K., Zvonic S. et al. (2006) Immunophenotype of human adipose-derived cells: temporal changes in stromal-associated and stem cell-associated markers. Stem cells (Dayton, Ohio), 24(2): 376–385.
- 19. Najar M., Raicevic G., Boufker H. I. et al. (2010) Mesenchymal stromal cells use PGE2 to modulate activation and proliferation of lymphocyte subsets: Combined comparison of adipose tissue, Wharton’s Jelly and bone marrow sources. Cellular immunology, 264(2): 171–179.
- 20. Nikolska V.V., Semenova Y.-M.O., Taranukha L.I. et al. (2021) Cultural Properties of Cryopreserved Thymic Multipotent Stromal Cells and Fetal Skin- and Muscle-Derived Cells. Probl. Cryobiol. Cryomed., 31 (3): 249–257.
- 21. Petruk G., Puthia M., Petrlova J. et al. (2020) SARS-CoV-2 spike protein binds to bacterial lipopolysaccharide and boosts proinflammatory activity. Journal of molecular cell biology, 12(12): 916–932.
- 22. Sangiorgi B., De Freitas H.T., Schiavinato J.L. et al. (2016) DSP30 enhances the immunosuppressive properties of mesenchymal stromal cells and protects their suppressive potential from lipopolysaccharide effects: A potential role of adenosine. Cytotherapy, 18(7): 846–859.
- 23. Tang Y., Xie H., Chen J. et al. (2013) Activated NF-κB in bone marrow mesenchymal stem cells from systemic lupus erythematosus patients inhibits osteogenic differentiation through downregulating Smad signaling. Stem cells and development, 22(4): 668–678.
- 24. Tate M.D., Deng Y.M., Jones J.E. et al. (2009) Neutrophils ameliorate lung injury and the development of severe disease during influenza infection. Journal of immunology (Baltimore, Md. : 1950), 183(11): 7441–7450.
- 25. Vazquez C., Horner S.M. (2015) MAVS Coordination of Antiviral Innate Immunity. Journal of virology, 89(14): 6974–6977.
- 26. Vigo T., Procaccini C., Ferrara G. et al. (2017) IFN-γ orchestrates mesenchymal stem cell plasticity through the signal transducer and activator of transcription 1 and 3 and mammalian target of rapamycin pathways. The Journal of allergy and clinical immunology, 139(5): 1667–1676.
- 27. Wang C., Bischof E., Xu J. et al. (2022) Effects of Methylprednisolone on Myocardial Function and Microcirculation in Post-resuscitation: A Rat Model. Frontiers in cardiovascular medicine, 9: 894004.
- 28. Weiss J., Barker J. (2018). Diverse pro-inflammatory endotoxin recognition systems of mammalian innate immunity. F1000Research, 7, F1000, Faculty Rev-516.
- 29. Wolfrom C., Raynaud N., Maigne J. et al. (1994) Periodic fluctuations in proliferation of SV-40 transformed human skin fibroblast lines with prolonged lifespan. Cell biology and toxicology, 10(4): 247–254.
- 30. Zhu Y., Feng X. (2018) Genetic contribution to mesenchymal stem cell dysfunction in systemic lupus erythematosus. Stem. cell research & therapy, 9(1): 149.
- 31. Zuk P.A., Zhu M., Ashjian P. et al. (2002) Human adipose tissue is a source of multipotent stem cells. Molecular biology of the cell, 13(12): 4279–4295.
Відомості про авторів:
Нікольський Ігор Сергійович, доктор медичних наук, професор, завідувач лабораторії імунології відділу клітинних та тканинних технологій Інституту генетичної та регенеративної медицини Державної установи «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска Національної академії медичних наук України».
ORCID ID 0009-0007-4165-5088
Нікольська Валентина Василівна, кандидат біологічних наук, старший науковий співробітник, провідний науковий співробітник лабораторії імунології відділу клітинних та тканинних технологій Інституту генетичної та регенеративної медицини Державної установи «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска Національної академії медичних наук України».
E-mail: nikolskaya.kiev@gmail.com
ORCID ID 0000-0002-0412-1366
Проценко Галина Олександрівна, доктор медичних наук, професор, провідний науковий співробітник відділу некоронарних хвороб серця, ревматології та терапії Державної установи «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска Національної академії медичних наук України».
ORCID ID 0000-0001-9328-4839
Подпрятов Сергій Євгенійович, доктор медичних наук, хірург Київської міської клінічної лікарні № 1.
ORCID ID 0000-0003-1350-7532
Подпрятов Сергій Сергійович, доктор медичних наук, хірург, проктолог Київської міської клінічної лікарні № 1.
ORCID ID 0000-0001-5942-6311
Семенова Яніна-Марія Олексіївна, кандидат біологічних наук, старший науковий співробітник лабораторії імунології відділу клітинних та тканинних технологій Інституту генетичної та регенеративної медицини Державної установи «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска Національної академії медичних наук України».
ORCID ID 0009-0000-9093-5085
Тарануха Люба Іванівна, кандидат медичних наук, провідний науковий співробітник лабораторії імунології відділу клітинних та тканинних технологій Інституту генетичної та регенеративної медицини Державної установи «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска Національної академії медичних наук України».
ORCID ID 0009-0003-0524-2789

Leave a comment