ПОРІВНЯЛЬНИЙ АНАЛІЗ ЗМІН ІМУННОГО СТАТУСУ ТА СТРУКТУРНО-ФУНКЦІОНАЛЬНОГО СТАНУ СЕРЦЯ У ПАЦІЄНТІВ З МІОКАРДИТОМ ЗА РЕЗУЛЬТАТАМИ 12-МІСЯЧНОГО ПЕРІОДУ СПОСТЕРЕЖЕННЯ
Резюме. Міокардит являє собою запальне ураження серцевого м’яза, що характеризується гетерогенністю клінічної симптоматики і непередбачуваним перебігом. Дослідження, присвячені аналізу динамічних змін імунного статусу та їх впливу на структурно-функціональний стан серця, є перспективними для прогнозування тяжкості перебігу захворювання, своєчасної корекції тактики ведення пацієнтів з міокардитом і профілактики ускладнень. Мета. Встановити особливості клінічного перебігу міокардиту на основі вивчення імунного статусу та структурно-функціонального стану серця. Матеріали і методи. У дослідження було включено 80 пацієнтів з гострим міокардитом (ГМ) зі зниженою фракцією викиду (ФВ) лівого шлуночка (ЛШ). Обстеження проводилися в 1-й місяць від появи симптомів ГМ до призначення лікування, через 6 та через 12 міс спостереження. Усім пацієнтам проводили дослідження показників імунного статусу, ехокардіографію та магнітно-резонансну томографію (МРТ) серця. Результати. У 1-й місяць від появи клінічних симптомів міокардит характеризувався вираженою активацією імунопатологічних реакцій, дилатацією і низькою ФВ ЛШ, середня величина якої становила 33,1±2,2%. Через 12 міс спостереження на фоні зниження активності імунозапальної відповіді і зменшення кількості сегментів ЛШ, залучених в патологічний процес, відбувалося поступове відновлення структурно-функціонального стану серця, що виявлялося зниженням дилатації та збільшенням ФВ ЛШ в середньому до 43,8±2,6%. Встановлено прямий кореляційний зв’язок між персистенцією запальних змін ЛШ на МРТ серця через 12 міс і величиною титру антитіл до міокарда (r=0,60; р<0,02), вмістом прозапального інтерлейкіну-17А (r=0,51; р<0,05), а також сильний зворотний кореляційний зв’язок із високою концентрацією протизапального інтерлейкіну-10 (r =–0,73; р<0,01), визначеними в 1-й місяць від початку захворювання. Висновки. Встановлено, що висока активність імунопатологічних реакцій в 1-й місяць від початку міокардиту асоціюється із довготривалою персистенцією запального процесу в міокарді, дилатацією та зниженням скоротливої здатності ЛШ.
DOI: 10.32471/rheumatology.2707-6970.95.18593
УДК: 616.127-002-036.12:355.11
ВСТУП
Міокардит являє собою запальне ураження серцевого м’яза, що характеризується гетерогенністю клінічної симптоматики і непередбачуваним перебігом [1, 2]. Серед кардіологічних нозологій міокардит залишається однією з небагатьох, для яких донині не розроблено відповідних рекомендацій з діагностики та лікування Європейським товариством кардіологів та Американською асоціацією серця, що вказує на складність і невизначеність цієї проблеми. Крім цього, необхідно зазначити, що досі в світовій літературі практично відсутні дані щодо проведення широкомасштабних багатоцентрових проспективних досліджень, присвячених пошуку нових підходів до удосконалення діагностики, прогнозування перебігу й оптимізації тактики лікування міокардиту. Наявні дані нерідко є контраверсійними і стосуються переважно одноцентрових досліджень, які включають зазвичай не більше сотні пацієнтів, що, очевидно, і є однією з головних причин відсутності достатньої доказової бази для створення загальноприйнятих рекомендацій з діагностики і лікування цієї нозології [3, 4, 5]. Актуалізація проблеми міокардиту останніми роками пов’язана як з пандемією COVID-19, який може бути тригером активації запального процесу в міокарді, так і зі стрімким розвитком сучасних методів візуалізації серця, зокрема магнітно-резонансної томографії (МРТ), що, безумовно, зумовлює більш часте виявлення запального ураження серця [6, 7, 8].
На сьогодні у пацієнтів з міокардитом доведено ключову роль імунопатологічних реакцій як системного, так і локального характеру, в розвитку запального ураження міокарда, порушенні структурно-функціонального стану серця і прогресуванні серцевої недостатності [2, 5, 9, 10]. Саме тому дослідження, присвячені аналізу динамічних змін імунного статусу та їх впливу на структурно-функціональний стан серця, є перспективними для прогнозування тяжкості перебігу захворювання, своєчасної корекції тактики ведення хворих на міокардит і профілактики ускладнень.
МЕТА ДОСЛІДЖЕННЯ
Встановити особливості клінічного перебігу міокардиту на основі вивчення імунного статусу та структурно-функціонального стану серця.
МАТЕРІАЛИ І МЕТОДИ ДОСЛІДЖЕННЯ
Результати дослідження ґрунтуються на даних динамічного обстеження 80 пацієнтів з гострим міокардитом (ГМ) зі зниженою фракцією викиду (ФВ) лівого шлуночка (ЛШ), що становила на момент включення ≤40 %, які мали ІІ–ІV функціональний клас (ФК) серцевої недостатності (СН) згідно з класифікацією Нью-Йоркської асоціації серця [11]. Діагноз міокардиту встановлювали на основі Рекомендацій з діагностики та лікування міокардиту та Стандартів з діагностики та лікування серцево-судинних захворювань Всеукраїнської асоціації кардіологів України за 2021 р. [12, 13]. Обстеження проводилися в 1-й місяць від появи симптомів ГМ до призначення оптимальної медикаментозної терапії (ОМТ), через 6 та через 12 міс спостереження.
Дослідження виконано відповідно до принципів біоетики, викладених у Гельсінській декларації «Етичні принципи медичних досліджень за участю людей» та Загальній декларації про біоетику та права людини (ЮНЕСКО), на базі відділу некоронарних хвороб серця, ревматології та терапії з червня 2022 до березня 2023 р. Дослідження схвалені комісією з питань етики ДУ «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені акад. М.Д. Стражеска НАМН України» (протокол засідання № 1-27 від 13.06.2022 р.). Усі пацієнти до початку проведення досліджень підписали інформовану згоду на обробку персональних даних згідно з наказом Міністерства охорони здоров’я України від 14.02.2012 р. № 110 «Про затвердження форм первинної облікової документації та Інструкцій щодо їх заповнення, що використовуються в закладах охорони здоров’я незалежно від форми власності та підпорядкування».
Медикаментозна терапія з приводу СН проводилася відповідно до останніх рекомендацій Європейського товариства кардіологів за 2021 р. і включала інгібітори ангіотензинперетворювального фермента, блокатори бета-адренорецепторів, антагоністи мінералокортикоїдних рецепторів, інгібітори натрійзалежного ко-транспортера глюкози 2-го типу [11]. Імуносупресивна терапія глюкокортикоїдами призначалася відповідно до алгоритму Всеукраїнської асоціації кардіологів України [13]. За наявності показань призначали діуретики, антиаритмічні препарати та антикоагулянти.
Дослідження показників імунного статусу виконували у відділі імунології та біохімії ДУ «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска НАМН України», в периферичній крові, взятій натще, визначали:
1) кількість лімфоцитів із антигенними детермінантами СD4+, CD3+8+, СD3+16+, CD3–19+ на проточному цитофлуориметрі Facscalibur (Becton Dickinson, США);
2) інтенсивність проліферативної відповіді лімфоцитів на специфічний антиген міокарда за допомогою реакції бласттрансформації лімфоцитів (РБТЛм);
3) рівні цитокінів — прозапального інтерлейкіну-17А (ІЛ-17А) з використанням тест-систем ТОВ «Вектор-Бест Україна» і протизапального інтерлейкіну-10 (ІЛ-10) за допомогою тест-системи ООО «Цитокін» в сироватці крові методом імуноферментного аналізу;
4) частоту виявлення і середній титр антитіл до міокарда (АТм), а також концентрацію циркулюючих імунних комплексів (ЦІК) за допомогою реакції зв’язування комплементу, вміст імуноглобулінів (Ig) класів M та G методом Manchini.
Для дослідження структурно-функціонального стану серця всім пацієнтам проводили трансторакальну двовимірну ехокардіографію (ехоКГ) на ультразвуковому діагностичному апараті Aplio Artida SSH-880 CV, Toshiba Medical System Corporation (Японія). Перед дослідженням визначали зріст і масу тіла пацієнтів, за таблицями обчислювали площу поверхні тіла. У 2D-режимі в період систоли та діастоли обчислювали кінцево-діастолічний об’єм (КДО) і кінцево-систолічний об’єм (КСО) ЛШ, ФВ ЛШ оцінювали біплановим методом дисків за Сімпсоном [14]. Виміряний КДО ЛШ співвідносили до площі поверхні тіла й отримували індексований показник — ІКДО ЛШ.
МРТ серця з використанням гадовісту в якості контрастного препарату виконували у відділенні променевої діагностики ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска НАМН України». Дослідження виконували на апараті Toshiba Vantage titan HSR 1,5 Тесла (Японія). Оцінювали зображення у трьох режимах по короткій і довгій осі серця: до введення контрастного препарату (режим Т2 Black blood FSat) для виявлення ділянки набряку в міокарді, протягом 3–5 хв після введення (Т1 раннє контрастування) для виявлення гіперемії в зоні запального ураження та режимі Т1 відстроченого контрастування (ВК) через 10–15 хв після введення контрастного розчину для виявлення фібротичних/некротичних змін [15, 16]. Для оцінки кількості сегментів ЛШ, уражених запальними або фібротичними/некротичними змінами, використовували сучасну концепцію 17-сегментарної будови ЛШ [16].
З метою статистичної обробки даних була створена комп’ютерна база даних за допомогою програмного забезпечення Exсel XP (Місrosoft Office, USA) і статистичної програми Statistica for Windows 10 v. 13.3 (Statsoft, USA). Розраховували середню величину (М), похибку середньої величини (m), критерій достовірності (t) і значення достовірності (p). Для оцінки достовірності відмінностей використовували тест Ст’юдента, при р<0,05 відмінності вважали достовірними. Взаємозв’язок між перемінними визначали за допомогою параметричного кореляційного аналізу Пірсона.
РЕЗУЛЬТАТИ дослідження
У табл. 1 наведено результати дослідження вмісту імунологічних біомаркерів у пацієнтів з міокардитом при динамічному спостереженні протягом 12 міс. Слід наголосити, що середній титр АТм був максимальним не в дебюті захворювання, а через 6 міс від початку міокардиту, і тільки через 12 міс відмічалося його зниження на 36,0% (р<0,01), що є свідченням зниження активності аутоімунних реакцій гуморального типу. У дебюті захворювання вміст імуноглобулінів G класу та ЦІК був вищим на 24,3 та 33,5% відповідно порівняно із таким через 12 міс (р<0,01–0,05), концентрація гострофазового імуноглобуліну М була найвищою в дебюті захворювання, а через 6 і 12 міс відмічалося її достовірне зниження. Ці дані можна пояснити більш високим вмістом CD3+19+ протягом перших 6 міс від початку захворювання, адже, як відомо, CD3+19+ належать до В-лімфоцитів, які при трансформації в плазматичну клітину відповідають за синтез антитіл, у тому числі антиміокардіальних.
Таблиця 1. Порівняльна характеристика імунологічних показників у різні терміни від дебюту міокардиту
| Показники | Величина показника (М±m) в групі з ГМ | Референтні значення | ||
|---|---|---|---|---|
| 1-й місяць | 6 міс | 12 міс | ||
| Титр АТм, ум. од. | 16,8±1,6 | 17,8±1,5 | 11,4±1,4* | 0—10 |
|
Вміст IgG, г/л |
16,3±0,8 | 18,8±0,8 | 12,5±0,7* | 7,0—14,0 |
| Вміст IgM, г/л | 2,03±0,16 | 1,60±0,14** | 1,19±0,11* | 0,7—1,5 |
|
Вміст ЦІК, од. опт. пл. |
70,7±5,9 | 86,7±6,6* | 39,7±3,5** | 20—40 |
|
Активність РБТЛм, % |
8,07±0,61 | 5,32±0,40** | 3,71±0,30** | 1,0—4,0 |
|
Вміст CD4+, ·109/л |
0,92±0,06 | 0,98±0,06 | 0,81±0,06* | 0,6—0,8 |
|
Вміст CD3+8+, ·109/л |
0,68±0,05 | 0,44±0,03* | 0,40±0,03** | 0,4—0,6 |
|
Вміст CD3+16+, ·109/л |
0,46±0,04 | 0,35±0,03* | 0,31±0,03** | 0,2—0,4 |
|
Вміст CD3+19+, ·109/л |
0,37±0,04 | 0,42±0,03 | 0,28±0,02* | 0,2—0,4 |
| ІЛ-17А, пг/мл | 13,20±0,92 | 7,12±0,52** | 7,05±0,63** | 0—5 |
| ІЛ-10, пг/мл | 12,1±1,1 | 24,1±2,2** | 34,2±3,0** | 0—31 |
Примітки. Різниця показників достовірна порівняно із такими в 1-й місяць від початку захворювання: *р<0,05, **р<0,01.
Стосовно показників клітинної ланки імунітету порівняльний аналіз встановив достовірні відмінності вмісту CD3+8+, CD3+16+ та активності РБТЛм (див. табл. 1), що були більшими на 35,3; 23,9 і 34,1% відповідно в 1-й місяць порівняно з такими через 6 міс (р<0,01–0,05). Привертає також увагу високий вміст CD4+ лімфоцитів в перші 6 міс від дебюту захворювання, як відомо, вони є потужним стимулятором гуморальної ланки імунітету. Висока активність клітинної ланки імунітету в 1-й місяць від початку захворювання супроводжувалась високим вмістом прозапального ІЛ-17А, достовірне зниження концентрації цього цитокіну відмічали вже через 6 міс. При цьому вміст протизапального ІЛ-10 в дебюті міокардиту був найнижчим, а через 6 та 12 міс зафіксоване прогресивне зростання його концентрації. Встановлені відмінності свідчать про більш активну аутосенсибілізацію Т-лімфоцитів до тканин міокарда та їх вищу цитотоксичність в 1-й місяць від початку захворювання і є доказом високої активності клітинної ланки імунітету. Слід відмітити, що через 12 міс від початку захворювання відмічали значне зниження активності імунопатологічних реакцій як клітинного, так і гуморального типу, про що свідчило достовірне зниження рівня досліджуваних імунологічних біомаркерів.
Наступним етапом дослідження стало проведення порівняльного аналізу результатів вивчення структурно-функціонального стану серця в різні терміни від дебюту міокардиту на основі даних ехоКГ та МРТ серця. Згідно з результатами ехоКГ, встановлено, що найбільш виражене порушення скоротливої здатності ЛШ відмічено в 1-й місяць від дебюту міокардиту — величина ФВ ЛШ становила в середньому 33,1±2,2%. Вже через 6 міс спостереження визначалося поступове поліпшення скоротливої здатності ЛШ, про що свідчило достовірне збільшення ФВ ЛШ до 39,6±2,3% (р<0,05)%, позитивна динаміка утримувалася до 12-го місяця від дебюту захворювання зі зростанням цього показника до 43,8±2,6%, тобто на 24,4% порівняно з вихідним (р<0,001). На останньому контрольному етапі динамічного спостереження виявлено також і зворотне ремоделювання ЛШ, свідченням чому стало достовірне зниження ІКДО ЛШ зі 105,7±7,2 мл/м2 в 1-й місяць до 85,9±5,9 мл/м2 (р<0,01) через 12 міс. Аналіз результатів МРТ серця в динаміці 12-місячного спостереження дав змогу встановити, що в дебюті захворювання відзначалася найбільша кількість сегментів ЛШ, уражених запальними змінами, — в середньому 6,64±0,63, на рисунку продемонстровано приклад МРТ-дослідження при первинному обстеженні в 1-й місяць від появи симптомів. Однак через 6 міс кількість сегментів ЛШ із наявністю запальних змін достовірно зменшилася і становила 4,24±0,51 (р<0,05), а через 12 міс їх кількість була вже в 2,3 раза меншою (р<0,001), аніж у 1-й місяць від початку захворювання. Через 12 міс достовірно зменшилася з 4,75±0,43 до 3,54±0,51 (р<0,05) і кількість сегментів ЛШ з наявністю відстроченого накопичення контрасту, яке є ознакою наявності фібротичних/некротичних змін міокарда.
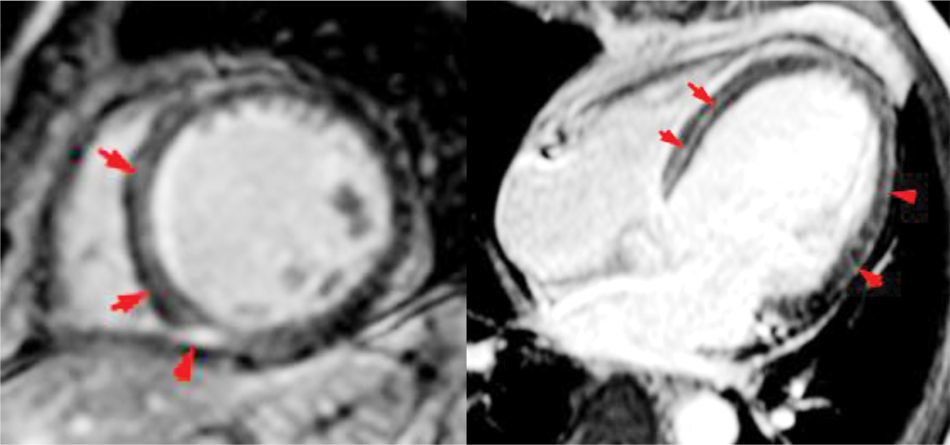
Для встановлення можливого впливу гіперактивації імунопатологічних реакцій в дебюті міокардиту на довготривалу персистенцію порушення структурно-функціонального стану серця було проведено кореляційний аналіз з метою пошуку взаємозв’язків між концентрацією імунологічних біомаркерів в 1-й місяць від початку міокардиту і результатами ехоКГ та МРТ серця через 12 міс спостереження (табл. 2). Результати кореляційного аналізу засвідчили наявність прямого взаємозв’язку між активністю РБТЛм в 1-й місяць, що характеризує аутосенсибілізацію лімфоцитів до тканини міокарда, та величиною ІКДО ЛШ через 12 міс спостереження; крім цього, встановлено зворотний кореляційний зв’язок цього імунологічного показника із величиною ФВ ЛШ. Також встановлено прямий кореляційний зв’язок між вмістом прозапального ІЛ-17А в 1-й місяць від дебюту захворювання та величиною ФВ ЛШ через 12 міс. На цьому фоні закономірною виглядає наявність зворотного кореляційного зв’язку величини ФВ ЛШ із вмістом протизапального ІЛ-10. Стосовно результатів МРТ серця, то з персистенцією запальних змін ЛШ через 12 міс прямий кореляційний зв’язок виявлено між величиною титру АТм і вмістом прозапального ІЛ 17А в 1-й місяць від початку захворювання, натомість висока концентрація ІЛ-10 в дебюті міокардиту мала сильний зворотний кореляційний зв’язок із наявністю запальних змін в міокарді ЛШ через 12 міс (див. табл. 2). Довготривала персистенція відстроченого накопичення контрасту в міокарді ЛШ мала достовірний асоціативний зв’язок тільки з високим титром АТм в 1-й місяць від початку захворювання.
Таблиця 2. Результати кореляційного аналізу між показниками імунного статусу, визначеними в 1-й місяць від дебюту міокардиту і параметрами, що характеризують структурно-функціональний стан серця через 12 міс спостереження
| Показник | Імунологічні маркери | |||
|---|---|---|---|---|
| Титр АТм | РБТЛм | ІЛ-17А | ІЛ-10 | |
| ІКДО ЛШ | r=0,22; p<0,05 | r=0,51; р<0,05 | r=0,21; р>0,05 | r=–0,14; р>0,05 |
| ФВ ЛШ | r=–0,13; p>0,05 | r=–0,80; р<0,01 | r=–0,37; р<0,05 | r=0,39; р<0,05 |
| Присутність запальних змін на МРТ серця | r=0,60; р<0,02 | r=0,20; р>0,05 | r=0,51; р<0,05 | r=–0,73; р<0,01 |
| Присутність ВК на МРТ серця | r=0,54; р<0,05 | r=0,24; р>0,05 | r=0,15; р>0,05 | r=0,08; р>0,05 |
ОБГОВОРЕННЯ
Дані, отримані за результатами вивчення імунного статусу, свідчать про найбільш виражену активацію клітинної ланки імунітету в 1-й місяць від початку міокардиту, що супроводжувалось аутосенсибілізацією лімфоцитів до тканини міокарда і стимуляцією синтезу прозапального ІЛ-17А. Висока активність імунопатологічних реакцій в гостру фазу міокардиту, очевидно, є закономірним результатом залучення досить великої кількості сегментів ЛШ в патологічний процес, що було діагностовано при проведенні МРТ серця. На цьому фоні логічними виглядають суттєві порушення структурно-функціонального стану серця у вигляді підвищення ІКДО та значного зниження ФВ ЛШ. На сьогодні в декількох вітчизняних і зарубіжних дослідженнях отримано дані, що гіперактивація імунопатологічних реакцій клітинного типу є домінуючим патогенетичним фактором гострої стадії міокардиту, особливо в 1-й місяць від дебюту захворювання [1, 5, 9]. Через 6 міс спостереження відмічалося поступове зниження активності імунопатологічних реакцій клітинного типу, однак активність аутологічних реакцій гуморального типу підтримувалася на досить високому рівні, про що свідчили високий титр АТм та високий вміст IgG. Тим не менше, вже через пів року спостереження встановлено часткове відновлення скоротливої здатності ЛШ за показником ФВ ЛШ, яке, найбільш вірогідно, можна пов’язати як зі зменшенням кількості сегментів ЛШ, уражених запальним процесом, так і з позитивним впливом оптимальної медикаментозної терапії з приводу СН [3, 11, 17]. Через 12 міс спостереження порівняно з дебютом захворювання відмічалося суттєве поліпшення структурно-функціонального стану серця та достовірне зниження дилатації ЛШ, що виглядало цілком закономірним на фоні значного зниження активності імунопатологічних реакцій як клітинного, так і гуморального типу, а також більш ніж дворазового зменшення об’єму запального ураження ЛШ згідно з даними МРТ серця. Результати, отримані при проведенні кореляційного аналізу, свідчать про високу прогностичну цінність значного підвищення активності імунологічних біомаркерів, таких як титр АТм, активність РБТЛм, концентрації ІЛ-17А та ІЛ-10, визначених в дебюті міокардиту, щодо довготривалої персистенції запального процесу в міокарді та наявності порушень структурно-функціонального стану серця навіть через 12 міс від початку захворювання. Однак проблема пошуку нових діагностичних алгоритмів та удосконалення підходів до прогнозування перебігу міокардиту залишається однією з найбільш складних в сучасній кардіології [2, 4, 5]. Єдиним шляхом розв’язання цієї проблеми, з урахуванням її актуалізації в останні декілька років, очевидно, є проведення багатоцентрових проспективних досліджень із обміном досвідом між командами експертів з різних центрів.
ВИСНОВКИ
1. В 1-й місяць від появи клінічних симптомів міокардит характеризується вираженою активацією імунопатологічних реакцій, дилатацією і суттєвим зниженням скоротливої здатності ЛШ. Через 6 та 12 міс спостереження на фоні зниження активності імунозапальної відповіді і зменшення кількості сегментів ЛШ, залучених в патологічний процес, відбувається поступове відновлення структурно-функціонального стану серця, що виявляється зниженням дилатації та поліпшенням скоротливої здатності ЛШ.
2. За результатами кореляційного аналізу встановлено, що висока активність імунопатологічних реакцій в 1-й місяць від початку міокардиту, яка проявляється значним підвищенням активності РБТЛм, високим вмістом ІЛ-17А, високим титром АТм та низьким вмістом протизапального ІЛ-10, асоціюється із довготривалою персистенцією запального процесу в міокарді, дилатацією та зниженням скоротливої здатності ЛШ.
Джерела фінансування. Дослідження проведено за рахунок коштів іменної стипендії Верховної Ради України для молодих вчених — докторів наук за 2023 р. Постанова Верховної Ради України від 9 серпня 2023 р. № 3297-IX.
Список використаної літератури
- 1. Ammirati E., Frigerio M., Adler D.E. et al. (2020) Management of Acute Myocarditis and Chronic Inflammatory Cardiomyopathy. Circ. Heart Fail., 13: e007405. doi: 10.1161/CIRCHEARTFAILURE.120.007405.
- 2. Tschöpe C., Ammirati E., Bozkurt B. et al. (2021) Myocarditis and inflammatory cardiomyopathy: current evidence and future directions. Nat. Rev. Cardiol., 18(3): 169–193. doi: 10.1038/s41569-020-00435-x.
- 3. Mahrholdt H., Greuilich S. (2017) Prognosis in myocarditis. J. Am. Col. Cardiol; 70: 1988–1990. DOI: 10.1016/j.jacc.2017.08.062.
- 4. Younis A., Matetzky S., Mulla W. et al. (2020). Epidemiology characteristics and outcome of patients with clinically diagnosed acute myocarditis. American Journal of Medicine, 133: 492–499. doi: 10.1016/j.amjmed.2019.10.015.
- 5. Lasica R., Djukanovich L., Savic L. et al. (2023). Update on Myocarditis: From Etiology and Clinical Picture to Modern Diagnostics and Methods of Treatment. Diagnostics, 13(19): 3073. doi: 10.3390/diagnostics13193073.
- 6. Davis M.G., Bobba A., Chourasia P. et al. (2022) COVID-19 Associated Myocarditis Clinical Outcomes among Hospitalized Patients in the United States: A Propensity Matched Analysis of National Inpatient Sample. Viruses, 14(12): 2791. doi: 10.3390/v14122791.
- 7. Sozzi F.B., Gherbesi E., Faggiano A. et al. (2022). Viral myocarditis: classification, diagnosis, and clinical implications. Frontiers in Cardiovascular Medicine. 9: 908663. doi: 10.3389/fcvm.2022.908663.
- 8. Ho H.T., Peischard S., Strutz-Seebohm N. et al. (2021) Myocardial Damage by SARS-CoV-2: Emerging Mechanisms and Therapies. Viruses, 13: 1880. https://doi.org/10.3390/v13091880.
- 9. Гавриленко Т.І., Чернюк С.В., Підгайна О.А. та ін. (2019) Визначення діагностичної і прогностичної ролі імунологічних біомаркерів у пацієнтів з міокардитом. Світ медицини та біології. 2(68): 34—39. DOI 10.26724/2079-8334-2019-2-68-34-39.
- 10. Чернюк С.В. (2019) Динамічні зміни структурно-функціонального стану серця у хворих на гострий міокардит. Запорізький медичний журнал. 21 (5): 576—581. DOI: 10.14739/2310-1210.2019.5.179404.
- 11. McDonagh T.A., Metra M., Adamo M. et al. (2021) 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC. European Heart Journal, 42(36): 3599–3726. doi: 10.1093/eurheartj/ehab368.
- 12. Коваленко В.М., Несукай О.Г., Чернюк С.В. та ін. (2021) Діагностика та лікування міокардиту. Рекомендації Всеукраїнської асоціації кардіологів України. Український кардіологічний журнал, 28(3): 67-88. doi:10.31928/1608-635X-2021.3.6788.
- 13. Коваленко В.М., Лутай М.І., Сіренко Ю.М., Сичов О.С., редактори. Серцево-судинні захворювання: класифікація, стандарти діагностики та лікування. Київ: МОРІОН, 2023. 384 с.
- 14. Lang R., Badano L.P., Mor-Avi V. et al. (2015) Recommendations for cardiac chamber quantification in adults: an update from the American Society of echocardiography and European Asssociation of cardiovascular imaging. J. Am. Soc. Echocardiogr., 28(1): 1—38. dx.doi.org/10.1016/j.echo.2014.10.003.
- 15. Hundley W.G., Bluemke D.A., Finn J.P. et al. (2010) ACCF/ACR/AHA/ NASCI/SCMR 2010 Expert consensus document on cardiovascular magnetic resonance: a report of the American college of cardiology foundation task force on the expert consensus documents. J. Am. Coll. Cardiol., 55(23): 2614–62. doi.org/10.1161/CIR.0b013e3181d44a8f.
- 16. Ferreira V.M., Schulz-Menger J., Holmvang G. et al. (2018) Cardiovascular magnetic resonance in nonischemic myocardial inflammation: Expert recommendations. J. Am. Coll. Cardiol.; 72(24): 3158–3176. doi: 10.1016/j.jacc.2018.09.072.
- 17. Gräni C., Eichhorn C., Bière L. et al. (2017) Prognostic value of cardiac magnetic resonance tissue characterization in risk stratifying patients with suspected myocarditis. JACC; 70(16):1964–1976. doi:10.1016/j.jacc.2017.08.050.
Відомості про авторів:
Чернюк С.В., провідний науковий співробітник відділу некоронарних хвороб серця, ревматології та терапії, доктор медичних наук
Державна установа «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска Національної академії медичних наук України»
03151, м. Київ, вул. Святослава Хороброго, 5
E-mail: cerniuk.sergey@gmail.com
ORCID ID: 0000-0002-7151-5437

Leave a comment