ПОРІВНЯЛЬНИЙ АНАЛІЗ ЕФЕКТИВНОСТІ ІМУНОСУПРЕСИВНОЇ ТЕРАПІЇ У ПАЦІЄНТІВ ІЗ ТЯЖКИМ ПЕРЕБІГОМ МІОКАРДИТУ ПІСЛЯ ІНФЕКЦІЇ COVID-19
Резюме. Міокардит — запальне захворювання міокарда, асоційоване з серцевою дисфункцією. Симптоми є малоспецифічними та залежать від ступеня міокардіального запалення та систолічної дисфункції, перебіг може бути малосимптомним, через що захворювання може бути вчасно не розпізнане. Внаслідок пандемії COVID-19 описані численні випадки міокардиту, пов’язаного з SARS-CoV-2. Глюкокортикоїди мають спільні точки прикладання щодо впливу на основні патогенетичні механізми як при міокардиті, так і при COVID-19. Мета: дослідити структурно-функціональний стан серця та розповсюдженість запального ураження міокарда у пацієнтів із тяжким перебігом міокардиту після інфекції COVID-19, які знаходяться на терапії глюкокортикоїдами. Матеріали та методи. У дослідження було включено 66 пацієнтів з тяжким перебігом міокардиту, яких розподілили на 4 групи: 1-ша група — 23 пацієнти з COVID-19 в анамнезі; 2-га група — 23 пацієнти без COVID-19 в анамнезі; 3-тя група — 10 пацієнтів, які не отримували терапію глюкокортикоїдами і мали в анамнезі COVID-19; 4-та група — 10 пацієнтів, які не отримували терапію глюкокортикоїдами і не мали в анамнезі COVID-19. Обстеження проводилися в 1-й місяць від початку симптомів до початку лікування глюкокортикоїдами та через 6 міс спостереження. Усім пацієнтам визначали кількісний вміст С-реактивного білка та попередника мозкового натрійуретичного пептиду в плазмі крові, також проводили трансторакальну ехокардіографію та магнітно-резонансну томографію (МРТ) серця із контрастуванням. Результати. При аналізі результатів дослідження в усіх групах відмічали зворотне ремоделювання лівого шлуночка (ЛШ), але в групах прийому глюкокортикоїдів кінцево-діастолічні розміри ЛШ поверталися до норми швидше. При оцінці уражень серця за даними МРТ після 6-місячного курсу лікування відмічено меншу кількість сегментів ЛШ, уражених запальними змінами, у групах пацієнтів, які отримували глюкокортикоїди. Висновки. Застосування глюкокортикоїдів виявилося найбільш ефективним щодо покращання скоротливої здатності та нормалізації розмірів ЛШ саме в групі пацієнтів, які перенесли COVID-19, що свідчить про патогенетичну обґрунтованість призначення імуносупресивної терапії такій категорії пацієнтів.
DOI: 10.32471/rheumatology.2707-6970.93.18094
УДК: 616.127-002-073
ВСТУП
Міокардит, що являє собою запальне захворювання серцевого м’яза, часто асоційоване із серцевою дисфункцією, має гетерогенний спектр клінічних проявів [1]. Симптоми є малоспецифічними та залежать від ступеня міокардіального запалення та систолічної дисфункції, перебіг може бути малосимптомним, через що захворювання може бути вчасно не розпізнаним [2]. Міокардит є діагнозом виключення, виникає переважно у молодих пацієнтів без ризиків захворювання коронарних артерій, іноді може виявлятися у пацієнтів старшого віку, а також розвиватися спонтанно чи бути розтягнутим у часі [1, 3]. Виникнення міокардиту зазвичай викликається ентеровірусами, але з роками список вірусів, що можуть спричинити міокардит, розширюється [4]. Внаслідок пандемії COVID-19 описані численні випадки міокардиту, пов’язаного з SARS-CoV-2, патогенетичні механізми якого включають виникнення аутоімунної відповіді та «цитокінового шторму» [4, 5]. Точні патофізіологічні аспекти, що лежать в основі виникнення міокардиту після COVID-19 чітко не охарактеризовані, висунуто декілька гіпотез, включаючи пряме пошкодження міокарда після взаємодії SARS-CoV-2 та ангіотензинперетворювального ферменту (АПФ)-2 та подальшу надмірну стимуляцію ренін-ангіотензин-альдостеронової системи [6]. Гіперзапальний статус через надмірну активність Toll-подібних рецепторів (TLR), опосередковану Т-клітинами цитотоксичність міокарда, надмірне вироблення цитокінів також можуть відігравати роль у розвитку міокардиту [5, 6]. Одним із механізмів пошкодження міокарда при зараженні COVID-19 є активація імунної відповіді. Фактор некрозу пухлин альфа (ФНП-α) та інтерлейкін (ІЛ)-6 виявляють негативний інотропний ефект на кардіоміоцити, знижуючи експресію Са2+ — регуляторного гена, зумовлюючи гіпертрофію кардіоміоцитів. ІЛ-6 активує процес піроптозу, внаслідок чого відбувається агресивна активація запальних цитокінів з розривом плазматичної мембрани та вивільненням прозапального вмісту та швидкої загибелі клітин [6, 7]. ФНП-α та ІЛ-6 посилюють фібротичну активність кардіальних фібробластів, внаслідок чого активується механічне розтягнення клітин, що супроводжується збільшенням вмісту прозапальних цитокінів і стимуляцією вироблення хемокінів [6].
Фармакологічні протизапальні та імуносупресивні ефекти глюкокортикоїдів є доволі активними та реалізуються через процес транспресії факторів транскрипції, таких як нуклеарний фактор (НФ) каппа-В, білок-активатор-1 і регуляторний фактор інтерферону-3, що призводить до пригнічення синтезу прозапальних цитокінів, таких як ІЛ-1, ІЛ-2, ІЛ-6, ІЛ-8, ФНП-α, інтерферон-γ, а також до зниження активності циклооксигенази-2 і зменшення продукції простагландинів [6, 8]. З іншого боку, відбувається стимуляція синтезу протизапальних цитокінів, таких як ІЛ-10 та ІЛ-4, а також збільшення продукції ліпокортину-1. Глюкокортикоїди мають спільні точки прикладання щодо впливу на основні патогенетичні механізми як при міокардиті, так і при COVID-19 [8, 9]. Таким чином, застосування глюкокортикоїдів для лікування міокардиту, асоційованого з інфекцією COVID-19, є патогенетично обґрунтованим і може бути перспективним для зниження активності запального процесу в міокарді, відновлення скоротливої здатності серця та поліпшення клінічного стану пацієнта.
МЕТА ДОСЛІДЖЕННЯ
Дослідити структурно-функціональний стан серця та поширеність запального ураження міокарда у пацієнтів із тяжким перебігом міокардиту після інфекції COVID-19, які отримують терапію глюкокортикоїдами.
МАТЕРІАЛИ І МЕТОДИ ДОСЛІДЖЕННЯ
Обстежено 66 пацієнтів, які були розподілені на 4 групи: 1-ша група — 23 пацієнти з тяжким перебігом міокардиту, що мали в анамнезі COVID-19, 2-га група — 23 пацієнти з тяжким перебігом міокардиту, що не мали в анамнезі інфекції COVID-19, 3-тя група — 10 пацієнтів з тяжким перебігом міокардиту, які не отримували терапію глюкокортикоїдами і мали в анамнезі інфекцію COVID-19, 4-та група — 10 пацієнтів з тяжким перебігом міокардиту, які не отримували терапію глюкокортикоїдами і не мали в анамнезі COVID-19. Усі групи до початку лікування були зіставними за вираженістю кардіомегалії та зниженням систолічної функції лівого шлуночка (ЛШ) за показниками фракції викиду (ФВ) та кінцевим діастолічним об’ємом (КДО) ЛШ, що достовірно не відрізнялися. Діагностику міокардиту і визначення критеріїв тяжкого перебігу захворювання проводили згідно з рекомендаціями Всеукраїнської асоціації кардіологів України за 2021 р. [10].
Обстеження проводилися в 1-й місяць від появи симптомів до початку лікування глюкокортикоїдами та через 6 міс спостереження. Усі пацієнти отримували стандартну терапію серцевої недостатності (СН), що включала інгібітори АПФ, блокатори бета-адренорецепторів, сечогінні препарати, антагоністи мінералокортикоїдних рецепторів, інгібітори натрій залежного котранспортера глюкози 2-го типу (НЗКТГ-2) у зіставних дозах [11].
Патогенетичне лікування глюкокортикоїдами проводилося згідно з алгоритмом Всеукраїнської асоціації кардіологів України за такою схемою: дексаметазон 8 мг внутрішньовенно протягом 5 днів з подальшим переходом на пероральний прийом метилпреднізолону 0,25 мг/кг маси тіла на добу протягом 3 міс з подальшим зниженням добової дози на 1–2 мг щотижня до повної відміни [10, 11]. Загальна тривалість курсу патогенетичної терапії становила близько 6 міс.
Пацієнти 3-ї та 4-ї груп не отримували терапії глюкокортикоїдами через наявність протипоказів, а саме:
- декомпенсовані захворювання печінки та нирок (рівень аланінамінотрансферази (АлАТ), аспартатамінотрансферази (АсАТ), креатиніну вище норми в 3 і більше разів, швидкість клубочкової фільрації (ШКФ) ↓ 30 мл/хв/1,73 м2 за Chronic Kidney Disease Epidemiology Collaboration — CKD-EPI);
- наявність активного інфекційного процесу в анамнезі (вірусні гепатити, ВІЛ-інфекція, туберкульоз);
- системні грибкові інфекції;
- виразкова хвороба шлунка чи дванадцятипалої кишки, ентороколіт у стадії загострення;
- наявність атеросклеротичного ураження коронарних артерій (стеноз ≥50%);
- декомпенсований цукровий діабет;
- наявна супутня патологія з підвищеним ризиком тромбоутворення (антифосфоліпідний синдром, онкологічні захворювання);
- остеопороз;
- особиста відмова пацієнта від прийому глюкокортикостероїдів.
Усім пацієнтам визначали кількісний вміст С-реактивного білка (СРБ) та попередника мозкового натрійуретичного пептиду (NТ-proBNP) в плазмі крові.
Для дослідження структурно-функціонального стану серця всім пацієнтам була виконана трансторакальна ехокардіографія (ЕхоКГ) на ультразвуковому діагностичному апараті Aplio Artida SSH — 880 CV, Toshiba Medical System Corporation (Японія). У 2D-режимі в період систоли та діастоли обчислювали КДО і кінцево-систолічний об’єм (КСО) ЛШ, ФВ ЛШ оцінювали біплановим методом дисків за Сімпсоном. Виміряний показник КДО ЛШ співвідносили до площі поверхні тіла й отримували індексований показник — ІКДО ЛШ. За допомогою спекл-трекінг ЕхоКГ пацієнтам без фібриляції передсердь (ФП) та блокади лівої ніжки пучка Гіса виміряно величину поздовжньої глобальної систолічної деформації (ПГСД) ЛШ. Для визначення ПГСД проводили запис відеопетель з трьох стандартних апікальних доступів: чотирикамерної, трикамерної, та двокамерної позиції з використанням моделі будови ЛШ за R. Lang та співавторами [12].
МРТ серця з внутрішньовенним контрастуванням виконували на апараті Toshiba Vantage Titan HSR 1,5 Тесла (Японія) із визначенням кількості сегментів, уражених запальними та фібротичними змінами та підрахунком загального об’єму ураження. Оцінювали вираженість набряку міокарда та проводили кількісний аналіз ділянок накопичення контрасту у ранню та відстрочену фази згідно із стандартизованою для методик візуалізації 17-сегментарною будовою міокарда ЛШ з оцінкою кількості сегментів із запальними та фібротичними змінами [13]. Оцінювали зображення серця по короткій і довгій осі в 3 режимах: до введення контрастного препарату для виявлення ділянки набряку в міокарді, протягом 3–5 хв після введення (раннє контрастування для виявлення гіперемії міокарда) та в режимі відстроченого контрастування через 10–15 хв після введення контрастного розчину для виявлення фібротичних змін. В якості контрастної речовини використовували гадобутрол.
З метою визначення функціонального класу (ФК) серцевої недостатності (СН) за критеріями Нью-Йоркської асоціації серця (NYHA) виконували тест з 6-хвилинною ходьбою.
Для статистичної обробки даних була створена комп’ютерна база даних за допомогою програмного забезпечення Exсel XP (Місrosoft Office, USA) і статистичної програми Statistica for Windows 10 v. 13.3 (Statsoft, USA). Обчислювали середню величину (М), похибку середньої величини (m), критерій достовірності (t) і значення достовірності (p). Для оцінки достовірності відмінностей в різних клінічних групах використовували тест Стьюдента. При р<0,05 відмінності вважали достовірними.
РЕЗУЛЬТАТИ
За результатами аналізу даних лабораторних досліджень через 6 міс лікування встановлено достовірне зниження показників NT-proBNP у всіх групах (рис. 1): в 1-й групі з (671,1±110,3) до (280,7±60,8) пг/мл (р<0,01), в 2-й групі з (650,5±98,0) до (300,5±55,7) пг/мл (р<0,05), в 3-й групі з (642,9±104,8) до (350,1±74,0) пг/мл (р<0,05), в 4-й групі (654,2±102,8) до (370,1±81,6) пг/мл (р<0,05).
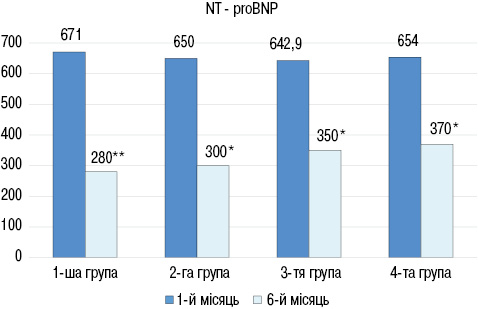
При порівнянні рівнів NT-proBNP між групами достовірних відмінностей не виявлено як у 1-й місяць, так і через 6 місяців спостереження. Порівняльна оцінка показників СРБ дозволила встановити достовірне його зниження тільки у групах, які отримували глюкокортикоїди (рис. 2): в 1-й групі до лікування показник становив (5,12±0,70), після лікування — (3,33±0,51) мг/л (р<0,05), в 2-й групі до лікування — (5,22± 0,52), після — (3,80±0,31) мг/л (р<0,01), в 3-й групі до лікування — (5,62±0,45) після — (4,87±0,36) мг/л (р>0,05), в 4-й групі до лікування (5,49±0,36), після — (4,77±0,38) мг/л (р>0,05).
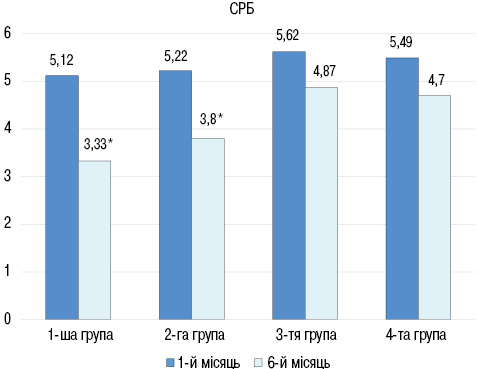
Через 6 міс спостереження за результатами тесту з 6-хвилинною ходьбою у всіх групах відмічали підвищення толерантності до фізичного навантаження та покращання функціонального класу СН (рис. 3): в 1-й групі величина пройденої дистанції збільшилася з (250±13) до (370±20) м (р<0,01), в 2-й групі з (280±10) до (390±23) м (р<0,05), в 3-й групі з (240±12) до (345±16) м (р<0,01), в 4-й групі з (270±11) до (380±20) м (р<0,05).
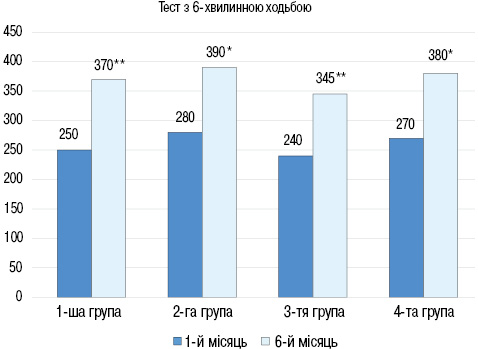
В усіх групах через 6 міс спостереження відмічено достовірне збільшення ФВ ЛШ: в 1-й групі з (36±2,5) до (44,5±3,0)% (р<0,05), у 2-й групі з (35,3±2,6) до (45,7±2,9)% (р<0,05), у 3-й групі з (35,3±2,6) до (45,1±2,9)% (р<0,05), в 4-й групі з (37±2,4) до (44,3±2,8)% (р<0,05). При порівнянні груп між собою через 6 міс достовірної різниці в показниках ФВ ЛШ не виявлено. При цьому ІКДО ЛШ достовірно знизився у всіх групах (рис. 4): у 1-й групі з (110,4±8,2) до (75,2±4,2) мл/м2 (р<0,05), у 2-й групі з (106±8,2) до (81,1±3,2) мл/м2 (р<0,05), у 3-й групі з (108,1±8,1) до (93,3±4,2) мл/м2 (р<0,05), в 4-й групі з (104±8,2) до (90,2±4,1) мл/м2 (р<0,05).
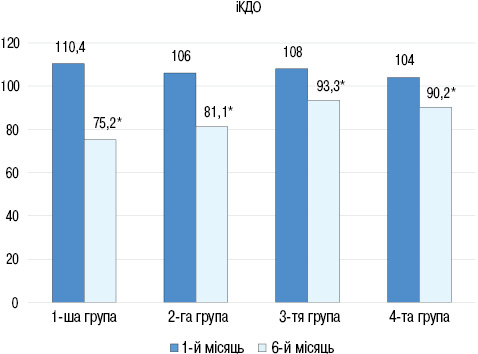
При порівнянні груп між собою виявлено достовірне поліпшення показника іКДО у групах, які отримували глюкокортикоїди. Оцінка ПГСД ЛШ свідчить, що через 6 міс її показник достовірно підвищився у перших 2 групах: у 1-й групі з (7,5±1,1) до (15,2±2,2)% (р<0,01), у 2-й групі з (8,2±2,5) до (11,5±1,3)% (р<0,05), тоді як у 3-й та 4-й групі достовірного зростання цього параметра не виявлено. Також встановлено, що через 6 міс спостереження величина ПГСД була більшою на 13% в 1-й групі порівняно з 2-ю групою (р<0.05). При аналізі результатів дослідження в усіх групах відмічали зворотне ремоделювання ЛШ, але в групах, в яких приймали глюкокортикоїди, кінцево-діастолічні розміри ЛШ поверталися до норми швидше.
За результатами оцінки ураження серця за даними МРТ після 6-місячного курсу лікування, відмічено меншу кількість уражених сегментів ЛШ у 1-й та 2-й групах: в 1-й групі їх кількість зменшилася з (10,2±2,1) до (4,6±0,8), а у 2-й групі з (9,8±2,0) до (4,7±0,9) (р<0,05), натомість у 3-й та 4-й групах кількість уражених сегментів достовірно не зменшилася.
Згідно з даними, наведеними в таблиці, у пацієнтів, які отримували глюкокортикоїди, відмічали кращий ефект від лікування, про що свідчило достовірне зменшення кількості сегментів, уражених запальними змінами (набряком та гіперемією) у 1-й та 2-й групах, за рахунок чого зменшилася і загальна кількість уражених сегментів. В 3-й та 4-й групах запалення в міокарді, за даними МРТ, зберігалося більш тривалий період (див. таблицю).
Таблиця. Порівняння даних МРТ на фоні застосування глюкокортикоїдів
| 1-ша група | ||||
|---|---|---|---|---|
| Набряк міокарда | Гіперемія міокарда | Фібротичні зміни | Загальна кількість уражених сегментів | |
| 1-й місяць | 2,7±0,7 | 5,7±0,7 | 2,7±0,5 | 10,2±1,7 |
| 6-й місяць | 0,8±0,4* | 2,5±0,4** | 5,9±0,8** | 4,6±0,8** |
| 2-га група | ||||
| 1-й місяць | 2,4±0,5 | 4,8±0,8 | 2,1±0,4 | 9,8±1,6 |
| 6-й місяць | 0,8±0,5* | 1,8±0,6** | 4,6±0,7** | 4,7±0,9** |
| 3-тя група | ||||
| 1-й місяць | 2,6±1,1 | 4,9±1,2 | 2,1±1,1 | 9,4±1,9 |
| 6-й місяць | 1,9±0,2 | 4,0±0,7 | 3,1±1,0 | 7,4±1,1 |
| 4-та група | ||||
| 1-й місяць | 2,0±1,0 | 3,8±1,3 | 1,9±1,2 | 8,9±2,0 |
| 6-й місяць | 1,8±0,3 | 3,0±1,0 | 2,3±1,1 | 6,9±1,0 |
Примітка. Різниця показників достовірна порівняно із такими в 1-й місяць від дебюту міокардиту: *р<0,05; **р<0,01.
При оцінці залучення перикарда у запальний процес виявлено, що у пацієнтів, які перенесли інфекцію СOVID-19, запальні зміни перикарда (включаючи раннє та відстрочене контрастування) виявляли частіше, у 1-й групі залучення перикарда відмічено у 34,7% пацієнтів, у 2-й групі — у 8,7% пацієнтів, у 3-й — у 40% пацієнтів, у 4-й — у 10%.
ОБГОВОРЕННЯ
В обговоренні результатів слід зазначити, що отримані в дослідженні дані щодо ефективності додавання глюкокортикоїдів до стандартної терапії СН у хворих з міокардитом в цілому відповідають таким зарубіжних досліджень. Так, колективом італійських авторів на чолі з A. Frustaci в дослідженні TIMIC ще наприкінці 2000-х років отримано дані щодо ефективності глюкокортикоїдів у комбінації з азатіоприном у пацієнтів з міокардитом для покращання ФВ ЛШ та зменшення його КДО [14]. Іншим суттєвим аргументом на користь доцільності призначення імуносупресивної терапії, зокрема із застосуванням глюкокортикоїдів, у пацієнтів з міокардитом слугують результати аналізу даних Інсбрукського і Маастрихтського регістрів, оприлюднених в 2018 р. і присвячених динамічному спостереженню 209 хворих із запальною кардіоміопатією, середній термін якого становив 31 міс [15]. Згідно з отриманими із цих регістрів даними величина ФВ ЛШ у 110 хворих, яким додатково до стандартної терапії СН призначали імуносупресивну терапію, була достовірно вищою порівняно з тими 99 пацієнтами, які отримували тільки стандартну терапію СН. Крім цього, за результатами метааналізу найбільш авторитетних медичних баз Medline, Embase, Cochrane та Chinese Biomedical Literature Database, що включили 9 досліджень із застосуванням імуносупресивної терапії у пацієнтів із міокардитом, зроблено висновок, що ця терапія може застосовуватися для відновлення ФВ і зменшення дилатації ЛШ та поліпшення функціонального класу СН, однак при цьому не впливає на частоту розвитку серцево-судинних подій і показник смертності [16]. Отримані нами дані також свідчили про ефективність глюкокортикоїдів щодо зниження частоти виявлення і поширеності запального ураження серця при проведенні МРТ, чим, очевидно, і можна пояснити покращання скоротливої здатності і зниження дилатації ЛШ. Причому найвищу ефективність застосування глюкокортикоїдів зафіксовано саме у хворих, в яких міокардит асоціювався із перенесеною інфекцією COVID-19, що можна пояснити потужним впливом глюкокортикоїдів на аутоімунні процеси і наслідки «цитокінового шторму», які, вірогідно, лежали в основі розвитку запального ураження серця у хворих із постковідним міокардитом.
Таким чином, на сьогодні з’являється все більше даних, що свідчать на користь ефективності застосування імуносупресивної терапії глюкокортикоїдами у пацієнтів із тяжким перебігом міокардиту, принаймні для покращання структурно-функціонального стану серця, зокрема у хворих з перенесеним COVID-19. Однак з огляду на частий розвиток побічних реакцій від прийому глюкокортикоїдів та непередбачуваність клінічного перебігу міокардиту, очевидною є необхідність проведення широкомасштабних багатоцентрових досліджень із тривалим періодом спостереження для виявлення прогностичних маркерів ефективності та розробки нових і удосконалення існуючих алгоритмів лікування.
ВИСНОВКИ
1. У перший місяць від початку захворювання в усіх досліджуваних групах міокардит характеризувався наявністю порушень скоротливої функції та дилатацією ЛШ на фоні наявності запальних змін в міокарді, виявлених при МРТ серця, що асоціювалося зі зниженням толерантності до фізичного навантаження і високим рівнем NT-proBNP.
2. Через 6 міс на фоні лікування виявлено зменшення об’єму запального ураження, зворотне ремоделювання та покращання скоротливої здатності ЛШ, причому в групах, які приймали глюкокортикоїди, показники КДО поверталися до норми швидше та відмічалось достовірне підвищення показника поздовжньої систолічної деформації.
3. Застосування глюкокортикоїдів виявилося найбільш ефективним щодо поліпшення скоротливої здатності та нормалізації розмірів ЛШ саме в групі пацієнтів, які перенесли COVID-19, що свідчить про патогенетичну обґрунтованість призначення імуносупресивної терапії такій категорії пацієнтів.
Список використаної літератури
- 1. Caforio A.L., Pankuweit S., Arbustini E. et al. (2013) Current state of knowledge on aetiology, diagnosis, management, and therapy of
myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur. Heart J., 34: 2636–2648. doi: 10.1093/eurheartj/eht210. - 2. Davis M.G., Bobba A., Chourasia P. et al. (2022) COVID-19 Associated Myocarditis Clinical Outcomes among Hospitalized Patients in the United States: A Propensity Matched Analysis of National Inpatient Sample. Viruses, 14(12): 2791. doi: 10.3390/v14122791.
- 3. Ammirati E., Frigerio M., Adler D.E. et al. (2020) Management of Acute Myocarditis and Chronic Inflammatory Cardiomyopathy. Circ. Heart Fail., 13: e007405. doi: 10.1161/CIRCHEARTFAILURE.120.007405.
- 4. Tschöpe C., Ammirati E., Bozkurt B. et al. (2021) Myocarditis and inflammatory cardiomyopathy: current evidence and future directions. Nat Rev Cardiol., 18(3): 169–193. doi: 10.1038/s41569-020-00435-x.
- 5. Pannucci P., Jefferson S.R., Hampshire J. et al. (2023) COVID-19-Induced Myocarditis: Pathophysiological Roles of ACE2 and Toll-like Receptors. Int. J. Mol. Sci., 24: 5374. doi.org/10.3390/ijms24065374.
- 6. Ho H.T., Peischard S., Strutz-Seebohm N. et al. (2021) Myocardial Damage by SARS-CoV-2: Emerging Mechanisms and Therapies. Viruses, 13: 1880. doi.org/10.3390/v13091880.
- 7. Kersten J., Schellenberg J., Jerg A. et al. (2023) Strain Echocardiography in Acute COVID-19 and Post-COVID Syndrome: More than Just a Snapshot. Biomedicines, 11: 1236. doi.org/10.3390/biomedicines11041236.
- 8. Yasir M., Goyal A., Sonthalia S. (2023) Corticosteroid Adverse Effects. (2023). In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. Available from: http://www.ncbi.nlm.nih.gov/books/NBK531462/.
- 9. Hu H., Ma F., Wei X., Fang Y. (2021) Coronavirus fulminant myocarditis treated with glucocorticoid and human immunoglobulin. European Heart Journal, 42 (2): 206. doi.org/10.1093/eurheartj/ehaa190.
- 10. Коваленко В.М., Несукай О.Г., Чернюк С.В. та ін. (2021) Діагностика та лікування міокардиту. Рекомендації Всеукраїнської асоціації кардіологів України. Український кардіологічний журнал, 28(3): 67–88. doi:10.31928/1608-635X-2021.3.6788.
- 11. Коваленко В.М., Лутай М.І., Сіренко Ю.М., Сичов О.С. ред. (2020) Серцево-судинні захворювання: класифікація, стандарти діагностики та лікування. Київ: МОРІОН. 239 с.
- 12. Lang R., Badano L.P., Mor-Avi V. et al. (2015) Recommendations for cardiac chamber quantification in adults: an update from the American Society of echocardiography and European Asssociation of cardiovascular imaging. J. Am. Soc. Echocardiogr., 28(1): 1–38. dx.doi.org/10.1016/j.echo.2014.10.003.
- 13. Hundley W.G., Bluemke D.A., Finn J.P. et al. (2010) ACCF/ACR/AHA/ NASCI/SCMR 2010 Expert consensus document on cardiovascular magnetic resonance: a report of the American college of cardiology foundation task force on the expert consensus documents. J. Am. Coll. Cardiol., 55(23): 2614–62. doi.org/10.1161/CIR.0b013e3181d44a8f.
- 14. Frustaci A., Russo M.A., Chimenti C. (2009) Randomized study on the efficacy of immunosuppressive therapy in patients with virus-negative inflammatory cardiomyopathy: the TIMIC study. Eur. Heart J., 30: 1995–2002. doi: 10.1093/eurheartj/ehp249.
- 15. Merken J., Hazebroek M., Van Paassen P. et al. (2018) Immunosuppressive Therapy Improves Both Short- and Long-Term Prognosis in Patients With Virus Negative Nonfulminant Inflammatory Cardiomyopathy. Circulation: Heart Failure, 11: e004228. DOI: 10.1161/ CIRCHEARTFAILURE.117.004228.
- 16. Lu C., Qin F., Yan Y. et al. (2016). Immunosupressive treatment for myocarditis: a meta-analysisof randomized controlled trials. J. Cardiovasc. Med., 17(8): 631–637. doi: 10.2459/JCM.0000000000000134.
Адреса для листування:
Марченко Катерина Сергіївна
Державна установа «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска НАМН України»
03151, м. Київ, вул. Святослава хороброго, 5
Е-mail: mrchkktrn@gmail.com

Leave a comment