МУЛЬТИСИСТЕМНИЙ ЗАПАЛЬНИЙ СИНДРОМ, АСОЦІЙОВАНИЙ З ІНФЕКЦІЄЮ SARS-COV-2, У ДІТЕЙ: НОВА ХВОРОБА ЧИ СИНДРОМ? НА ПРИКЛАДІ КЛІНІЧНОГО ВИПАДКУ
Ошлянська О.А.1, Охотнікова О.М.1, Захарчук О.В.2, Русак С.О.2
- 1Національний університет здоров’я України імені П.Л. Шупика, м. Київ
- 2Комунальне некомерційне підприємство «Житомирська обласна клінічна лікарня Житомирської обласної ради», с. Станишівка, Житомирська область
Резюме. У статті наведені узагальнені дані літератури щодо відмінності патогенезу та клінічних проявів інфекції SARS-CoV-2 та мультисистемного запального синдрому у дітей, асоційованого з інфекцією SARS-CoV-2, обговорені спільні риси і відмінності його від інших ревматичних хвороб та сучасні дані щодо тактики лікування. На клінічному прикладі представлений алгоритм дій лікаря у разі підозри на мультисистемне запальне захворювання, асоційованого з інфекцією SARS-CoV-2.
УДК-616.151.5–053.2:616.9–036.22
DOI: 10.32471/rheumatology.2707-6970.84.16258
Пандемія інфекції, викликаної коронавірусом SARS-CoV-2, яка триває на планеті, продовжує ставити перед клініцистами нові питання. Як вже було досліджено, вірус SARS-CoV-2 належить до сімейства β-коронавірусів, має розміри 50–200 нм, його одноланцюгова РНК масою 30 К обгорнута оболонкою та кодує структурний глікопротеїн спайка (S), який складається з трьох S1-S2 гетеродимерів, здатних зв’язуватися з рецептором до ангіотензинперетворювального ферменту 2-го типу в організмі людини та безпосередньо з альвеолоцитами. Поверхневий білок вірусу представлений димером гемаглютинінестерази. Після поглинання вірус розмножується в цитоплазмі пневмоцитів, викликаючи їх апоптоз, крім того, внаслідок розпізнавання РНК вірусу імунокомпетентними клітинами людини відбуваються активація хемокінів, міграція й активація нейтрофілів до вогнища ураження, що у сукупності швидко призводить до порушення альвеолярно-капілярної стінки [1]. Проте різноманіття клінічної картини інфекції зумовлене залученням до патологічного процесу не лише прямої ушкоджувальної дії віруса, але й інших універсальних механізмів реагування організму людини: реакцій запалення, системи коагуляції, інших протеолітичних систем тощо.
Доведено, що провідними ланками патогенезу інфекції, викликаної SARS-CoV-2, особливо у випадках тяжкого перебігу, є лізис уражених клітин, розвиток тромбоваскуліту та наслідки «цитокінового шторму».
Крім безпосереднього лізису клітин-мішеней, які експресують рецептор 2-го типу до ангіотензинперетворювального ферменту, цитоліз клітин, хворих на інфекцію, викликану SARS-CoV-2, може відбуватися опосередковано внаслідок активації перфоринового шляху, гіперактивації ретикуло-ендотеліальної системи, циркуляторної гіпоксії [2].
Другим патогенетичним механізмом ураження тканин при SARS- CoV-2 є тромбоваскуліт. Тромбоутворення зумовлене не лише прямим травмуванням судин вірусом, але й інфільтрацією судин імунними клітинами (васкуліт), воно супроводжується активацією патологічного фібринолізу (маркером якого постає підвищення Д-димеру) з численними крововиливами різних локалізацій [3]. Патофізіологічними механізмами тромбоваскуліту також є гіперактивація тромбоцитів та ендотеліоцитів і залучення системи комплементу.
Наявність «цитокінового шторму» як третього механізму генералізації інфекції, що викликана SARS-CoV-2, була припущена спочатку за клінічними ознаками (гіпертермія, артралгії, міалгії, артеріальна гіпотензія, синдром дисемінованого згортання крові, поліорганна недостатність з ураженням органів дихання, нирок, центральної нервової системи) та в подальшому підтверджена високими рівнями прозапальних цитокінів у сироватці крові хворих та морфологічними особливостями їх лімфоїдних органів [4]. Науковці висловили думку, що при коронавірусній інфекції альвеолоцити 2-го типу, які мають рецептори до ангіотензинперетворювального ферменту, активуються вірусом та активують інші клітини імунної системи — антигенпрезентуючі, В- та Т-лімфоцити [5]. Гіперактивація Т-лімфоцитів індукує викид інтерферону-γ та фактору некрозу пухлин-α, що, в свою чергу, викликає повторну активацію макрофагів, дендритних клітин, ендотеліоцитів з наступним викидом прозапальних цитокінів (інтерлейкінів-1, -6), та в подальшому реактивацію Т-лімфоцитів, відкриття химерних антигенних рецепторів, синтез вільних радикалів, гіпоксію та руйнування тканин. Хуан та співавтори у пацієнтів із COVID-19 виявили зростання вмісту в сироватці крові водночас численної кількості цитокінів (інтерлейкіну-1, його рецептора, інтерлейкінів-7, -8, -9, -10, факторів росту фібробластів та гранулоцитів, інтерферону-γ та індукованого ним білка, фактора росту тромбоцитів, фактора некрозу пухлин та фактора росту судин) [5]. Проведене в подальшому мультицентрове когортне дослідження показало й суттєві зміни співвідношення субпопуляцій лімфоцитів: у всіх хворих виявлена лімфопенія, у 34,31% відмічено зменшення природних кілерів, у 28,43 % зменшено вміст цитолітичних Т-лімфоцитів зі зростанням активованих Т-лімфоцитів та Т-лімфоцитів-хелперів-17. Дані аутопсій при цьому свідчать про ознаки атрофії лімфоїдної тканини з наявністю інфільтрацій уражених тканин активованими клітинами макрофагального походження та Т-лімфоцитами-хелперами [6]. Лабораторні ознаки «цитокінового шторму» (цитопенія, підвищення вмісту креатиніну та активності трансаміназ, погіршені параметри згортання та підвищення рівня С-реактивного білка (СРБ), феритину, тригліцеридів та цитокінів) нагадували синдром гіперактивації макрофагів, проте, на відміну від останнього, при SARS-CoV-2 підвищення рівня інтерлейкіну-6 в сироватці крові було більш значним, ніж феритину [4].
Подальші дослідження показали, що гіперактивація імунної системи при SARS-CoV-2 інфекції зазвичай не супроводжується синтезом аутоантитіл [7] та найчастіше розвивається у пацієнтів, які мають певні фактори генетичного ризику (дефект природних кілерів та цитолітичних Т-лімфоцитів, який унеможливлює швидке знищення організмом інфікованих клітин, гомозиготні генетичні вади білків перфоринового шляху, рецепторів до інтерлейкіну-1 тощо) [8, 9]. Після інкубаційного періоду при SARS-CoV-2 залежно від генетичних особливостей вірус може елімінуватися з організму, проте якщо цього не відбулося, пацієнти переходять у другу стадію хвороби, коли відбуваються інгібіція синтезу гіалуронової кислоти, активація макрофагів та мезенхімальних клітин і послаблюються процеси репарації [10]. Вже під час першого аналізу клінічного перебігу захворювання відмічена висока коморбідність у пацієнтів з тяжким перебігом хвороби [11] та виявлена залежність факторів ризику тяжкого перебігу та смерті від відсутності елімінації вірусу з організму людини [12, 13]. Продовження досліджень у цьому напрямку показало, що фенотип SARS-CoV-2 -інфекції неоднорідний, причому генетично-зумовлені особливості функціонування імунної системи людини можуть зумовлювати розвиток різної імунної відповіді і обґрунтовувати різні підходи до лікування, тому для визначення його оптимальної тактики запропоноване використання багатопараметричних алгоритмів (включаючи визначення співвідношення нейтрофілів до лімфоцитів, гострофазових білків тощо) [14].
Під час накопичення числа спостережень клініцистами відмічено, що у частини пацієнтів, особливо дитячого віку, після світлого проміжку розвивалася друга хвиля симптомів, які мали клінічні прояви, схожі з ревматичними хворобами. Зазвичай першими скаргами у таких хворих були лихоманка, біль у животі, блювання, діарея, почервоніння очей, висип на тулубі, зміни слизової оболонки рота та плями на язиці, збільшення шийних лімфовузлів. Таке системне вторинне аутоімунне запалення комбінувалося із симптомами COVID-19 та найбільше нагадувало за клінічними ознаками хворобу Кавасакі [15], тому такі випадки спочатку розглядалися як васкуліт Кавасакі, що зумовило зростання реєстрації захворюваності на хворобу Кавасакі на тлі пандемії інфекції, викликаної вірусом SARS-CoV-2, влітку 2020 р. У квітні 2021 р. кількість таких зареєстрованих випадків у США перевищила 3 тис., 36 з яких були летальними, причому різке збільшення їх кількості відмічене із запізненням після початку епідемії (з літа 2020 р.), а швидке зниження частоти реєстрації зафіксоване з січня 2021 р. після початку вакцинації [16].
Зазначене зумовило високу зацікавленість дитячих ревматологів світу та призвело до запропонування ВООЗ діагностичних критеріїв цього захворювання, яке отримало назву мультисистемний запальний синдром у дітей, асоційований з COVID-19 (Multisystem Inflammatory Syndrome in Children associated with COVID-19 — MIS-C). За ВООЗ, до діагностичних критеріїв MIS-C віднесені випадки, які відмічають у дітей віком 0–19 років із лихоманкою тривалістю більше 3 діб з наявністю 2 ознак з наступних:
- висип або двобічний негнійний кон’юнктивіт або слизово-шкірні ознаки запалення (ротової порожнини, рук або ніг);
- гіпотензія або шок;
- ознаки дисфункції міокарда, перикардиту, вальвуліту або коронарних аномалій (включаючи дані ехокардіографії (ехоКГ) або підвищений тропонін/натрійуретичний пептид В);
- коагулопатія (за протромбіновим індексом, парціальним тромбопластиновим часом та з підвищеним рівнем Д-димеру);
- гострі шлунково-кишкові симптоми (діарея, блювання або біль у животі).
Додатково при встановленні діагнозу MIS-C мають бути враховані підвищені маркери запалення (швидкість осідання еритроцитів (ШОЕ), СРБ, прокальцитонін), у пацієнта не має бути виявлена жодна інша очевидна мікробна причина запалення, в тому числі бактеріальний сепсис, інфекційно-токсичний шок, проте є докази попередньої або наявної SARS-CoV-2 інфекції (полімеразна ланцюгова реакція (ПЛР) або дані серологічних досліджень, або ймовірний контакт з хворим).
Американським коледжем з ревматології (American College of Rheumatology — ACR) запропоновано конкретизацію цих критеріїв зі збільшенням віку (до 21 року), уточненням характеристики лихоманки (≥38,0 °C тривалістю більше доби або відомості про неї), необхідністю виявлення наявності ураження двох та більше систем органів (серцево-судинної, центральної нервової, сечостатевої, дихальних шляхів, шлунково-кишкового тракту та гематологічних проявів) без іншого альтернативного діагнозу, конкретизовані були і лабораторні докази запалення (СРБ, ШОЕ, фібриноген, прокальцитонін, Д-димер, феритин, лактатдегідрогеназа, інтерлейкін-6, нейтропенія, лімфопенія, альбумінопенія). Також підкреслено, що деякі випадки можуть не відповідати всім критеріям, і необхідно розглядати можливість розвитку MIS-C при будь-якій дитячій смерті з ознаками попередньої інфекції SARS-CoV-2 [17].
Протягом наступного півріччя науковці ретельно вивчали відмінності патогенезу MIS-C та самої інфекції SARS-CoV-2. Встановлено, що її провідними ланками є залучення процесів нетозу з позаклітинною активацією протеолітичних процесів, ініціація антитілозалежної цитотоксичності, інтерлейкін-16-залежних механізмів активації хемотаксису, моноцитів та природних кілерів, що робило патогенез MIS-C дуже схожим на аутозапальні хвороби. З іншого боку, відмічено перехресне реагування аутоантитіл до ендотелію, ентероцитів та імунних клітин (Gruber), також підтверджені імунокомплексні механізми, які зумовлюють ураження серцево-судинної системи, які притаманні і васкуліту Кавасакі [18].
Основні риси MIS-C, асоційованої з SARS-CoV-2, відображають генералізоване ураження зі специфічною клінічною характеристикою (табл. 1).
Таблиця 1. Клінічні прояви MIS-C
| Клінічна ознака | Її особливості |
|---|---|
| Висип | Поліморфний, плямисто-папульозний, петехіальний, але ніколи не везикулярний |
| Шлунково-кишковий тракт | Діарея, біль у животі, блювання |
| Зміни кінцівок | Еритема і набряк кистей і стоп у гострій фазі |
| Зміни слизової оболонки порожнини рота | Еритема і розтріскування губ, полуничний язик та/або еритема слизової оболонки порожнини рота і глотки |
| Кон’юнктивіт | Може бути бульбарним або лімбічним, без ексудату |
| Лімфаденопатія | Шийна, розміри лімфовузлів більше 1,5 см, двобічна, зрідка однобічна |
| Неврологічні симптоми | Головний біль, дратівливість, млявість, змінений психічний стан, ригідність шиї, параліч черепних нервів |
| Епідеміологічний зв’язок з COVID-19 | Пацієнт з історією хвороби COVID-19 або близький контакт з відомим позитивним випадком COVID-19 протягом останніх 4–6 тиж, або людина, поміщена в карантин |
ACR рекомендовано наступний обсяг диференційно-діагностичного пошуку у випадках, підозрілих щодо MIS-C (табл. 2) [17].
Таблиця 2. Диференційний діагноз MIS-C
| Нозологічна одиниця | Спільні ознаки | Що слід зробити |
|---|---|---|
| Бактеріальні інфекції/сепсис | Тяжкість стану, порушення життєво важливих функцій, погіршення перфузії, зміни психічного статусу | Шукати потенційне вогнище інфекції: шкіра/м’які тканини, менінгіт, пневмонія.
Бактеріальні культури |
| Інфекційно-токсичний шок | Лихоманка/озноб.
Гіпотензія — симптоми розвиваються швидко, джерело інфекції може бути неочевидне — стафілококове |
Звернути увагу на дифузну еритродермію,
може бути поліорганне ураження (діарея, гепатит і гостре пошкодження нирок), уточнити термін останньої менструації |
| Синдром стафілококового опікоподібного ураження шкіри | Шкірні прояви | Відмічається у дітей віком до 6 років, звернути увагу на сильний шкірний біль і еритему складок або генералізовану еритему, наявність млявих бул з ерозіями в ділянці тертя |
| Рикетсіози (лихоманка плямистих гір) | Лихоманка, головний біль, за якою слідує висип, тромбоцитопенія | Розвивається переважно у весняні та літні місяці (кліщі), проте висип відрізняється наявністю не лише плям, але і петехій, починається на зап’ястках/щиколотках, прогресує до тулуба, долоней і підошв; у 10–20% висипу немає; характерна гіпонатріємія |
| Вірусні інфекції (аденовірус, ентеровірус, EBV, HHV6) | Міокардит, ознаки кардіогенного шоку (холодні кінцівки, зниження пульсу/наповнення капілярів, гіпотензія).
Підвищений вміст тропоніну, зміни сегмента SТ на ЕКГ, порушення ритму |
Відмічаються у літні місяці, у дітей молодшого віку, не характерні інші прояви MIS-C, доцільно уточнити епідемічний анамнез, зробити відповідні серологічні дослідження |
| Сироваткова хвороба | Гіпертермія, висип, артралгії | Розвивається внаслідок впливу лікарського засобу |
Проте найбільша схожість виявлена між MIS-C та хворобою Кавасакі, що спонукало до початкової назви синдрому «Кавасакі-подібний». Подальші порівняльні дослідження дозволили виявити більш детально їх спільні риси і відмінності (табл. 3) [16].
Таблиця 3. Диференційний діагноз MIS-C та хвороби Кавасакі
| MIS-C | Хвороба Кавасакі |
|---|---|
| Середній вік хворих — 7,6 року | Середній вік 2,7 року |
| Розвивається частіше через 1 міс від появи симптомів або контакту з хворим на SARS-CoV-2 | Передує респіраторна симптоматика. Може бути підтверджений тригер: лактобацили, стафілококи, герпесвіруси тощо |
| Патогенез — аномальна імунна реакція на інфекцію | Механізми патогенезу спільні з системними васкулітами |
| Мають значення етнічні особливості (40% латиноамериканського походження, 13,5% решта — європеоїдної раси); генетичну та біологічну основу продовжують вивчати | Японія — 263 на 100 тис. дітей
США — 20,8 на 100 тис. дітей (переважно азіатсько-тихоокеанського та латиноамериканського походження) Європа — 5 на 100 тис. дітей |
| Позитивні антитіла до SARS-CoV-2 (G), негативна ПЛР | – |
| 3–6 днів високої лихоманки | 5 днів лихоманки |
| Залучаються у 60% 4–5 систем органів. Описані три фенотипи: шкірно-слизовий, кардіальний, респіраторний | Вісцеральні ураження переважно з боку серцево-судинної системи |
| Частота залучення серцево-судинної системи становить 86,5%.
Кардіальний фенотип (міокардит, перикардит, серцево-судинна недостатність, шок). |
Переважають коронарити, міокардит, перикардит |
| Респіраторний (найтяжчий, 75% у хворих молодшого віку) | Пневмоніт, плеврит виникають рідко |
| Гастроінтестинальні прояви — біль, діарея — 90,9% випадків | Діарея, панкреатит відмічаються рідко |
| Найбільш часто спостерігається гостре ураження нирок | Більш характерний уретрит |
| ЦНС включається часто (менінгізм, судоми, галюцинації тощо) | ЦНС залучається іноді |
| Лімфаденопатія відмічається рідко — 13,3% | Лімфаденопатія шийна є характерним і діагностично-значущим критерієм хвороби (однобічна, більше 1,5 см) |
| Періорбітальний набряк та набряки кінцівок виникають рідко — 4,7% | Майже завжди відмічається набряк кистей та/або стоп, часто — навколонігтьова десквамація |
| Ураження слизових оболонок — 35,3% | Еритема та тріщини язика і слизових оболонок — майже завжди |
| Двобічна ін’єкція кон’юнктиви — 48,5% | Двобічна ін’єкція кон’юнктив без відділяємого — патогномонічна |
| Висип — 55,3% | Мультиформна еритема |
| Гематологічні прояви типові | Цитопенічний синдром не характерний |
| Летальність 1,8%, переважно — підлітки | Летальність 1–2%, переважно дошкільний вік |
Важливим питанням для педіатрів та дитячих ревматологів є необхідність своєчасно відрізнити MIS-C від системного ювенільного артриту (табл. 4), оскільки тактика лікування суттєво відрізняється.
Таблиця 4. Диференційний діагноз MIS-C та системного ювенільного артриту
| MIS-C | Системний ювенільний артрит |
|---|---|
| Лихоманка щонайменше протягом доби | Лихоманка тривалістю 2 та більше тижні |
| Висип стійкий, може бути плямисто-папульозний | Висип переважно локалізується над розгинальними поверхнями суглобів, на тулубі, плямистий, притаманні добові коливання (спостерігається на висоті лихоманки, зникає при нормалізації температури тіла) |
| Набряки периферичні | Набряки можуть бути над суглобами |
| Шийна лімфаденопатія | Характерна генералізована лімфаденопатія |
| Ураження 2 та більше систем органів | Ураження органів дихання, шлунково-кишкового тракту, нирок, нервової системи нехарактерне; характерна гепатоспленомегалія |
| Гематологічні прояви характерні | Цитопенія відмічається лише при синдромі гіперактивації макрофагів |
| Може бути серозит | Серозит характерний |
| Ураження слизових оболонок (порожнина рота, кон’юнктиви) | Не характерне |
Для швидкої діагностики MIS-C Центри з контролю та профілактики захворювань США (Centers for Disease Control and Prevention — CDC) рекомендують батькам негайно звернутися за невідкладною допомогою, якщо у дитини з’являються будь-які з тривожних ознак (утруднене дихання, біль або тиск у грудях, погіршення після покращання стану, порушення сну, блідість, сіруватість або синій відтінок шкіри, губ або нігтів, сильний біль у животі) [19].
ACR запропонований алгоритм дій лікарів при підозрі у дитини на MIS-C [17], згідно з яким за наявності в дитини лихоманки вище 38 °С, епідеміологічного зв’язку з інфекцією SARS-CoV-2 (COVID-19) та 2 з клінічних ознак (висип, гастроінтестинальні симптоми, набряки стоп та кистей, зміни слизової оболонки рота, кон’юнктивіт, лімфаденопатія, неврологічні симптоми) та виключення інших причин, що можуть пояснювати дані симптоми, такий випадок має бути розглянутий та обстежений як MIS-C. У першу чергу, необхідно виявити, чи є симптоми шоку, та провести обстеження згідно з протоколом [загальноклінічний аналіз крові з формулою та ШОЕ, біохімічне дослідження крові (вміст натрію, калію, CO2, хлору, креатиніну, глюкози, кальцію, альбуміну, загального білка, СРБ, сечовини, білірубіну, визначення активності аланінамінотрансферази, аспартатамінотрасферази, лужної фосфатази), ПЛР та серологічні дослідження COVID-19 — за можливості необхідно визначити специфічні до COVID-19 імуноглобуліни класів G, М та A].
У випадку, якщо СРБ перевищує 25 мг/дл та/або ШОЕ перевищує 40 мм/год та наявна ще хоча б одна з наступних лабораторних ознак (лімфопенія <1000 в мкл, тромбоцитопенія <150·109/л, натрій <135 ммоль/л, нейтрофільоз, гіпоальбумінемія), у дитини додатково необхідно дослідити натрійуретичний пептид В, тропонін Т, прокальцитонін, феритин, протромбін, протромбіновий час, Д-димер, фібриноген, лактатдегідрогеназу, цитокінову панель, тригліцериди, мазок крові та зробити ультразвукове дослідження (УЗД) серця та електрокардіографію (ЕКГ). Якщо у пацієнта СРБ та ШОЕ не підвищені та/або немає лімфопенії, тромбоцитопенії, гіпонатріємії, нейтрофільозу, гіпоальбумінемії, то необхідно продовжити діагностичний пошук інших причин захворювання.
Підкреслено, що за умови ретельного спостереження випадки з нетяжким перебігом MIS-C можуть спостерігатися амбулаторно. Під час амбулаторного спостереження виключення інфекційних хвороб та злоякісних новоутворень має проводитися у всіх пацієнтів дитячого віку за відсутності тяжких уражень, за показаннями проводять рентгенографічне дослідження або комп’ютерну томографію (КТ) органів грудної клітки. Показаннями до госпіталізації дітей з MIS-C є аномальні життєві показники (тахікардія, тахіпное); респіраторний дистрес-синдром; неврологічні порушення або зміна психічного стану; будь-яке ураження нирок або печінки; значно підвищені маркери запалення (СРБ ≥100 мг/л), аномальна ЕКГ, підвищений вміст натрійуретичного пептиду типу B або тропоніну T.
Лікування MIS-C складається з трьох провідних напрямків: використання протоколу лікування хвороби Кавасакі, вирішення питання про доцільність проведення противірусної терапії (ремдесивір призначається лише у ПЛР-позитивних пацієнтів), симптоматичне лікування шоку та коагулопатії.
Першою лінією лікування MIS-C вважається введення внутрішньовенних імуноглобулінів. Вони призначаються всім пацієнтам з наявністю критеріїв MIS-C у високих дозах (2 г/кг ідеальної маси тіла), можуть розподілятися на кілька введень (особливо це необхідне у хворих з кардіальними ураженнями для попередження перевантаження об’ємом), у випадках зі зниженням серцевої функції додаються діуретичні засоби.
Глюкокортикостероїди (1–2 мг/кг/добу) додаються у пацієнтів із шоком та/або ураженням внутрішніх органів (респіраторний дистрес-синдром, істотно підвищені активність лактатдегідрогенази, рівень Д-димеру, інтерлейкіну-6, СРБ та/або феритину, зниження вмісту лімфоцитів, альбумінів та/або тромбоцитів), при зберіганні лихоманки у хворих на тлі введення високих доз внутрішньовенних імуноглобулінів.
У випадках резистентності до комбінованої терапії внутрішньовенними імуноглобулінами та системними кортикостероїдами, дози останніх підвищуються до пульс-терапії (10–30 мг/кг/добу). Особливо її проведення доцільне, якщо пацієнту потрібні високі дози або багаторазові введення інотропних та вазопресорних засобів.
Попередніми дослідженнями [20] доведено, що комбінована терапія з використанням системних кортикостероїдів та внутрішньовенних імуноглобулінів сприяє зменшенню обсягів симптоматичної терапії, необхідності у гемодинамічній підтримці та частоти розвитку гострої дисфункції міокарда порівняно з монотерапією MIS-C лише препаратами внутрішньовенних імуноглобулінів.
За наявності синдрому активації макрофагів або неефективності попереднього лікування рекомендується інгібітор інтерлейкіну-1 — анакінра (в добовій дозі >4 мг/кг маси тіла). На даний час ще недостатньо доказів, що підтверджують ефективність використання інших імуномодулюючих засобів, якщо дана терапія не дала результатів [21]. Проте можливість призначення подальшої імуносупресивної терапії продовжує широко обговорюватися європейськими дослідниками.
Поступове звуження імунотропної терапії можливо розглядати за умови нормалізації стану дитини та при відсутності відхилень лабораторних показників вже через 2–3 тиж від початку лікування.
Антиагрегантна та антикоагуляційна терапія при MIS-C є обов’язковою частиною лікування, оскільки дозволяє попередити найтяжчі ускладнення [22]. Хворим призначається ацетилсаліцилова кислота (3–5 мг/кг/добу) до нормалізації кількості тромбоцитів та підтвердження нормального стану коронарних артерій (оптимально не раніше, ніж через 4 тиж після встановлення діагнозу MIS-C). Призначення ацетилсаліцилової кислоти протипоказане при кровотечах та тромбоцитопенії ≤80 000 в мкл.
Доцільно враховувати рівень активності запального процесу та ризику тромбозів при MIS-C. Якщо він не перевищує 10 балів — призначається лише ацетилсаліцилова кислота, якщо перевищує — додаються антикоагулянти (еноксапарин) або варфарин. У випадках із задокументованим тромбозом або вираженою серцево-судинною недостатністю (фракція викиду <35%) тривалість застосування еноксапарину пролонгується до повного розсмоктування тромбу.
Доцільно звернути увагу читачів на певні відмінності у лікуванні інфекції SARS-CoV-2 [23] та MIS-C, асоційованого з інфекцією SARS-CoV-2 (табл. 5).
Таблиця 5. Особливості лікування інфекції SARS-CoV-2 та MIS-C, що асоційований з COVID-19
| COVID [22] | MIS-C [16] |
|---|---|
| Пацієнтам, які потребують кисневої терапії, призначають системні глюкокортикоїди (дексаметазон) | Системні глюкокортикоїди (метилпреднізолон) в рефрактерних випадках |
| Комбінація ремдесивіру та барицитинібу | Лише за умови персистенції віремії (позитивні тести ПЛР) |
| У пацієнтів, які не потребують кисневої терапії, рекомендовано уникати застосування внутрішньовенних імуноглобулінів та препаратів плазми крові | Внутрішньовенні імуноглобуліни є стартовою терапією |
| У негоспіталізованих хворих (які не потребують кисневої терапії) немає доказів доцільності застосування гідроксихлорохіну, рутинного призначення інгібіторів інтерлейкіну-6 або -1 | У рефрактерних випадках рекомендується призначення інгібіторів інтерлейкіну-1 |
| Розглядається терапія препаратами інтерферонів -γ, -β, -α, лефлуномідом, колхіцином, сарилумабом, лензилумабом, екулізумабом, циклоспорином, канакінумабом (крім випадків з наявністю імунодефіциту) | |
| Антибактеріальна терапія за умови підтвердження бактеріальної інфекції | Антибіотики призначаються лише до отримання негативних результатів бактеріологічних досліджень, потім відміняються |
Оскільки, за даними попередніх спостережень, частота розвитку аневризм коронарних судин при MIS-C сягає 15,5%, рекомендується подальший моніторинг B-натрійуретичного пептиду та/або тропоніну T до їх нормалізації, проведення ЕКГ у випадках з її змінами спочатку щонайменше кожні 48 год або постійно (при порушенні провідності). УЗД серця виконується кожні 7–14 днів, потім через 4 та 6 тиж протягом 1 року (або частіше за наявності дисфункції лівого шлуночка). Оцінюється функція шлуночків та структура клапанів, наявність випоту в перикард та розміри коронарних артерій із вимірюваннями, індексованими до площі поверхні тіла за допомогою z-балів.
Магнітно-резонансну томографію (МРТ) серця рекомендується проводити через 2–6 міс від дебюту хвороби у випадках значної транзиторної дисфункції лівого шлуночку у гострій фазі (фракція викиду <50%) або стійкої дисфункції (включаючи функціональну оцінку, зважене зображення Т1/Т2, картографування Т1 та кількісне визначення позаклітинного об’єму, а також пізнє посилення гадолінію). КТ серця слід проводити пацієнтам з підозрою на дистальні ураження судин, які погано видно на ехоКГ.
Незважаючи на те що кількість вакцинацій, проведених у світі, перевищила кількість зареєстрованих випадків інфікування, що призвело до різкого зменшення кількості реєстрації випадків MIS-C в США та країнах Європи, в Україні їх кількість тільки зростає та, за неофіційними повідомленнями лікарів з різних регіонів, вже перевищила два десятки.
Саме тому доцільно розглянути один з таких випадків, який спостерігався в Житомирській обласній клінічній лікарні.
Дитина Ш., 7 років, хлопчик, ранній анамнез не обтяжений, щеплений за Національним календарем вакцинації в повному обсязі. До даного захворювання дитина хворіла рідко, переважно на гострі респіраторні вірусні інфекції (ГРВІ), відвідувала дитячий дошкільний заклад. Дідусь хлопчика в грудні 2020 р. переніс COVID-19, у самого хлопчика за 2 тиж до госпіталізації відмічалися ознаки риніту.
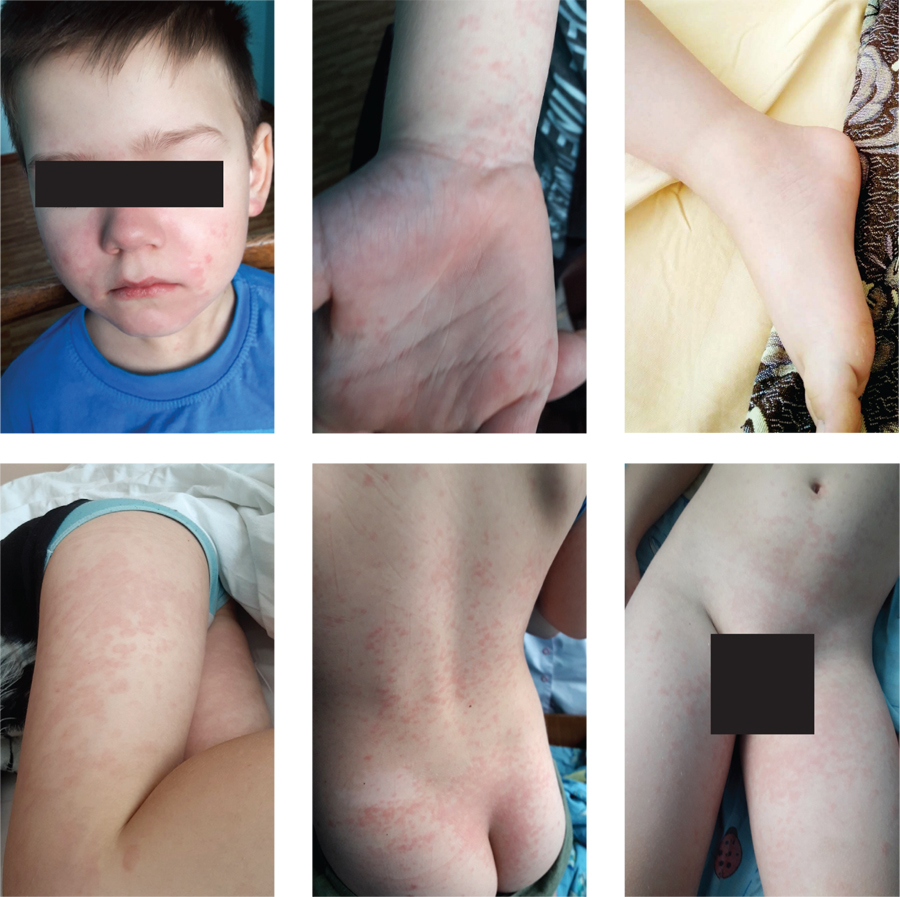
Захворів гостро 08.02.2021 р., протягом трьох діб відмічалася висока лихоманка 39–40 °С, спостерігався вдома, отримував ібупрофен, ефект частковий. Через добу з’явилися розповсюджений висип на шкірі, набряки ніг та рук (рис. 1), біль у кінцівках. На третю добу захворювання у дитини почервоніли очі, долоні, стопи, соматичний біль посилився до повної знерухомленості.
У зв’язку зі зберіганням гіпертермії 10.02.2021 р. ургентно госпіталізований каретою швидкої допомоги, при поступленні в стаціонар згідно з вимогами проведена ПЛР на SARS-CoV-2 — результат отриманий негативний.
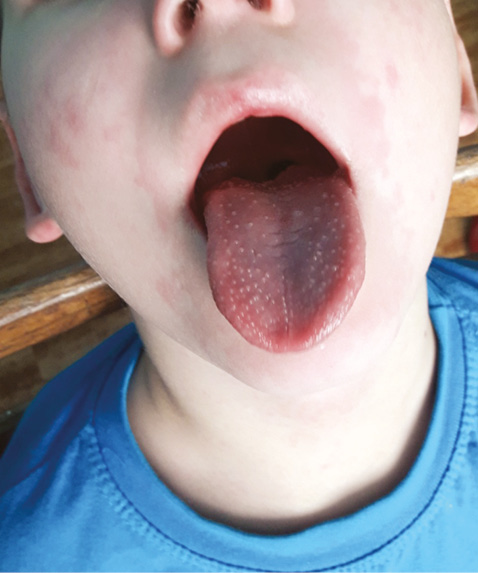
При госпіталізації стан дитини був тяжким, відмічені головний біль, блювання, біль у животі, діарея, виражений соматичний больовий синдром, гіпертермія, ригідність м’язів потилиці, задишка. Об’єктивно спостерігався набряковий синдром, розповсюджений макулопапульозний висип на шкірі обличчя, тулуба, кінцівок. Слизові оболонки порожнини рота були гіперемовані, губи набряклі, з тріщинами, язик також був червоний та нагадував полуницю (рис. 2). Лімфовузли в дитини дещо збільшені в усіх групах, не спаяні з навколишніми тканинами, неболючі. Над легенями дихання було послаблене, вислуховувалися множинні звучні дрібнопухерцеві хрипи на всій протяжності. Частота дихання становила 24 за хвилину, сатурація дорівнювала 89%. При перкусії серця відмічене розширення відносних меж серцевої тупості, аускультативно на тлі тахікардії (частота серцевих скорочень 140 уд./хв) вислуховувався систолічний шум на верхівці, артеріальний тиск був дещо знижений — 85/55 мм рт. ст. Живіт чутливий при пальпації. Печінка виступала з-під правої реберної дуги на 3 см, селезінка — на 2 см.
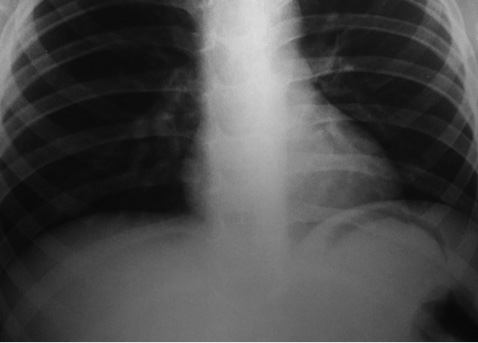
Проведене рентгенологічне дослідження органів грудної клітки виявило посилення легеневого малюнку та численні дрібно-вогнищеві затінення (рис. 3), що були спочатку розцінені як пневмонія, тому дитині призначені антибактеріальні та жарознижувальні засоби, розпочата інфузійна дезінтоксикаційна терапія.
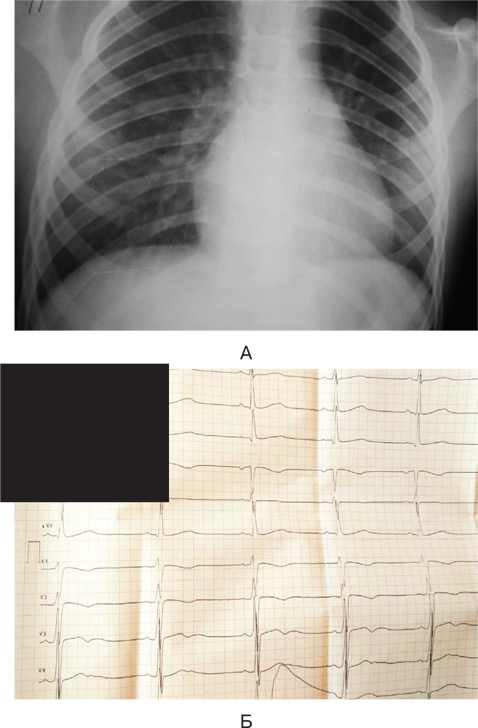
За даними ЕКГ (рис. 3Б), відмічений синусовий ритм серця, електрична вісь серця не відхилена, виявлені порушення реполяризації міокарда шлуночків; РQ=0,12 мс, QRS=0,08 мс, Q–T=0,30 мс, частота серцевих скорочень 95–100 уд. за хвилину.
У загальному аналізі крові гемоглобін дорівнював 103 г/л (ретикулоцити 0,2 °%), відмічався лейкоцитоз 16,8·109/л (П 34%, С 60%, Л 2%, М 3%), тромбоцити 218·109/л, ШОЕ 40 мм/год.
У загальному аналізі сечі відмічені лейкоцитурія (20–25 в полі зору), еритроцитурія (5–20 в полі зору, змінені та незмінені), циліндрурія (2–6 в полі зору).
За даними біохімічного дослідження крові: сечовина 4,9 мкмоль/л, креатинін 30 мкмоль/л, амілаза 11 Од./л, лужна фосфатаза 379 Од./л, загальний білок 58 г/л (альбумін 31 г/л), креатинфосфокіназа 441 Од./л, сироваткове залізо 3,4 мкмоль/л, холестерин 3,2 ммоль/л, тригліцериди 2,38 ммоль/л, лактатдегідрогеназа 620 Од/л, глюкоза 5,1 ммоль/л, СРБ 30 мг/л.
У коагулограмі дитини також виявлені певні відхилення: протромбіновий час 14,2 с, протромбіновий індекс 89%, міжнародне нормалізоване відношення 1,1, активований частковий тромбопластиновий час (АЧТЧ) 33,6 с; фібриноген 15 г/л, етаноловий тест був негативним, β-нафтоловий тест — позитивний, Д-димер 511 нгФЕО/мл.
Під час проведення копрологічного дослідження виявлені рослинна клітковина, м’язові волокна, мила, нейтральний жир, жирні кислоти та йодофільна флора.
Оскільки в дитини наступної доби після госпіталізації з’явилися ознаки ригідності потиличних м’язів, дитина була оглянута неврологом, стан розцінений як енцефалічна реакція та менінгізм, від проведення люмбальної пункції вирішено утриматися до отримання всіх результатів обстеження.
12.02.2021 р. під час огляду окуліста відмічені незначна кон’юнктивальна реакція, очні середовища прозорі, диски зорових нервів рожеві, межі чіткі, вени сітківки повнокровні.
Враховуючи зміни загального аналізу крові, дитину проконсультував гематолог для виключення гемобластозу, від проведення діагностичної стернальної пункції вирішено утриматися. Для виключення новоутворень проведене дослідження α-фетопротеїну (1,35 нг/мл), визначена нейрональна енолаза (9,67 нг/мл), що не виходили за межі нормальних значень.
Враховуючи появу одиничних екстрасистол та збільшення сегменту ST за даними ЕКГ, для виключення неревматичного кардиту проведено УЗД серця та грудної клітки, за даними якого виявлені гідроторакс, гідроперикард, збільшення порожнини лівого шлуночка, незначна недостатність мітрального клапану з регургітацією, проте фракція викиду не була знижена (70%), тому визначений тропонін Т (0,227 нг/мл). Враховуючи, що висип не був патогномонічним, РQ був нормальним, антистрептолізини дорівнювали 200 Од, в мазках зіву патогенна флора не виявлена, діагноз гострої ревматичної лихоманки не розглядався.
У зв’язку з наявністю периферичних набряків та мінімальних проявів сечового синдрому проведене дослідження цистатину С в крові (0,94 мг/л, що відповідало нормальним значенням); дослідження сечі за Зимницьким (відносна щільність сечі 1010–1027, тобто порушення концентраційної функції не виявлене), розрахована ШКФ — 104 мл/хв (не знижена), проведене УЗД органів черевної порожнини та позачеревного простору (дифузні зміни паренхіми нирок, двобічний нефроптоз, лівобічна пієлоектазія).
Враховуючи те, що у дитини виявлені гепатоспленомегалія, збільшення лімфовузлів, гіпертермія, висип на шкірі, а під час проведення УЗД суглобів — синовіти колінних суглобів, виключали наявність системного ювенільного артриту, проте ураження шкіри було нехарактерне (див. табл. 3), ревматоїдний фактор був негативним, феритин не підвищений.
Незважаючи на підвищення активності лактатдегідрогенази, також було недостатньо критеріїв (нормальні значення тригліцеридів, відсутність цитопенічного синдрому та гіпертрансаміназемії) для встановлення діагнозу синдрому гіперактивації макрофагів.
Наявність поліорганних уражень та змін з боку шкіри та опорно-рухового апарату спонукала розглянути системні захворювання сполучної тканини в якості одного з можливих діагнозів, проте проведення серологічних досліджень із визначенням антинуклеарних антитіл (включаючи антитіла до ДНК2, РНП, sm, scl-70, jo1, pm-scl тощо), які всі були негативними, та недостатня кількість діагностичних критеріїв призвели до виключення цих нозологій.
Враховуючи наявність ознак синдрому системної запальної відповіді та змін коагулогічних показників, для виключення сепсису проведені бактеріологічні дослідження сечі, крові, випророжнень, зішкрібків із зіву (у всіх патогенна флора не виявлена) та визначений в крові прокальцитонін (0,82 нг/мл).
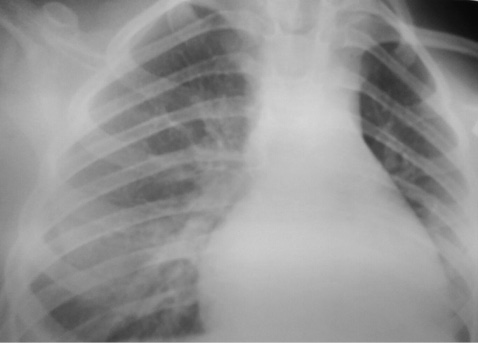
За 2 дні протягом проведення зазначеної диференційної діагностики стан дитини погіршився, на УЗД відмічене збільшення випоту в плевральній порожнині з обох боків, збільшилася вираженість змін в легенях за даними рентгенологічного дослідження (рис. 4).
З огляду на анамнез (контакт з дідусем, перенесене ГРВІ), дитині додатково, крім ПЛР, проведені дослідження вмісту імуноглобулінів М до нуклеокапсидного антигену SARS-CoV-2 (негативні) та імуноглобулінів G (0,837, позитивні), що дозволило 13.03.2021 р. встановити діагноз: дитячий мультисистемний запальний синдром внаслідок інфекції, що викликана вірусом SARS-CoV-2 (Кавасакі-подібний) (лихоманка, ураження шлунково-кишкового тракту, легень, серцево-судинної системи, шкіри (висип, набряки), слизових оболонок, гостре ураження нирок, гематологічні прояви, підтвердження перенесеної інфекції).
Дитині були призначені внутрішньовенні імуноглобуліни та глюкокортикостероїдні препарати в дозі 1 мг/кг/добу, оскільки протягом наступних 4 діб результат не був отриманий, їх доза була підвищена до 3 мг/кг/добу та продовжене введення внутрішньовенних імуноглобулінів до загальної дози 2 г/кг маси тіла, призначені ацетилсаліцилова кислота та гепаринотерапія, відмінені антибактеріальні препарати.
Через 1 тиж від початку лікування відмічене зниження температури тіла, покращання лабораторних показників (в загальному аналізі крові ШОЕ 7 мм/год, лейкоцитоз 27·109/л, тромбоцити 490·109/л, за даними біохімічних досліджень крові білок дорівнював 75 г/л, лактатдегідрогеназа 272 Од./л, СРБ став негативним.
Проте, за даними КТ органів грудної клітки від 19.02.2021 р., зберігалися полісегментарні затемнення з умовним ураженням легень 15%, виявлені слабко інтенсивні ділянки за типом «матового скла» в легенях, зберігався двобічний гідроторакс до 20 мм, та гідроперикард. При цьому сатурація була достатньою (96%). У той час дитині було проведено визначення вмісту інтерлейкіну-1 в сироватці крові (12,1 пг/мл, незначно підвищений) та інтерлейкіну-6 (6 пг/мл, в межах референтних значень).
01.03.2021 р. одноразово відмічені нове підвищення температури тіла, діарея, підвищення ШОЕ до 24 мм/год, тимчасове зростання вмісту калію в крові до 5,81 ммоль/л за відсутності брадикардії. Загальний аналіз сечі, вміст креатиніну та сечовини в сироватці крові та УЗД нирок не змінені. У цей же термін показники коагулограми (ПТЧ 14 с, ПТІ 90%, МНВ 1,1, АЧТЧ 28,6 с, фібриноген 2,1 г/л, етаноловий та β-нафтоловий тест негативні) були в межах норми. При цьому, за даними рентгенологічного дослідження органів грудної клітки, також мала місце безумовна позитивна динаміка (рис. 5).
Через 23 дні від дебюту хвороби стан дитини був задовільним. Дитина почала рухатися самостійно, задишки та тахікардії при рухах не відмічалося, шкіра була чиста, слизові оболонки не змінені. У загальному аналізі крові зберігався лейкоцитоз 13,8·109/л, вміст гемоглобіну дорівнював 129 г/л, тромбоцити 227·109/л, ШОЕ 4 мм/год. Усі показники загального аналізу сечі, біохімічного дослідження крові та коагулограми були в межах референтних значень. Вміст Д-димеру становив 187 нгФЕО/мл. Повністю зникли зміни на УЗД серця, ЕКГ. Розпочато зниження дози глюкокортикоїдів, відмінена гепаринотерапія. Під час подальшого спостереження змін коронарних артерій за даними УЗД серця у дитини не відмічено. Після незначної травми у дитини виявлено сильний біль у спині та за даними рентгенологічних досліджень відмічений компресійний перелом тіл хребців поперекового відділу. Показники активності запального процесу не підвищувалися. Дитина продовжує спостереження у ревматолога.
Узагальнюючи вищезазначене, хотілося б відмітити, що у дитини виявлено типовий випадок запального захворювання, асоційованого з інфекцією SARS-CoV-2. Незважаючи на пересторогу лікарів, дане захворювання не завжди швидко і правильно трактується, оскільки під час госпіталізації не виконуються водночас серологічні та вірусологічні дослідження, що іноді призводить до запізнення призначення лікування. Клінічні прояви запального захворювання, асоційованого з інфекцією, викликаною SARS-CoV-2, є схожими на васкуліт Кавасакі, проте воно є окремим захворюванням. Реєстрація його сьогодні в нашій країні є недосконалою, оскільки за МКХ лікарі враховують його за різними кодами. Лише подальший нагляд за хворими дозволить відрізнити, чи CОVІD-19 є тригером нової хронічної аутоімунної патології, чи є одним із запізнілих синдромів самої інфекційної хвороби з моноциклічним перебігом.
Пандемія COVID-19 є новим неочікуваним викликом для всієї медичної спільноти, проте постійна спільна робота науковців та клініцистів дозволить нам отримати перемогу і в неочікуваних випадках.
Список використаної літератури
- 1. Миттал А., Манджунат К., Ранджан Р. et al. (2020) Пандемия COVID-19: понимание структуры, функции и распознавания рецептора hACE2 SARS-CoV-2. PLoS Pathog . 16 (8): e1008762. Опубликовано 21 августа 2020 г. doi: 10.1371/journal.ppat.1008762.
- 2. Mason R.J. (2020) Pathogenesis of COVID-19 from a cell biology perspective European Respiratory Journal, 55: 2000607; DOI: 10.1183/13993003.00607–2020.
- 3. Becker R.C. (2020) COVID-19-associated vasculitis and vasculopathy. J Thromb Thrombolysis. Oct; 50(3): 499–511. doi: 10.1007/s11239–020–02230–4. PMID: 32700024; PMCID: PMC7373848.
- 4. Hojyo S., Uchida M., Tanaka K. et al. (2020) How COVID-19 induces cytokine storm with high mortality Inflammation and Regeneration, 40: 37. doi.org/10.1186/s41232–020–00146–3.
- 5. McGonaglea D., Sharifa K., O’Regand A., Bridgewooda Ch. (2020) The Role of Cytokines including Interleukin-6 in COVID-19 induced Pneumonia and Macrophage Activation Syndrome-Like Disease Autoimmun.; 19 (6): 102537. DOI: 10.1016 / j.autrev.2020.102537.
- 6. Shimabukuro-Vornhagen et al. (2018) Cytokine release syndrome Journal for ImmunoTherapy of Cancer, 6: 56. doi.org/10.1186/s40425–018–0343–9.
- 7. Chi Zhang, Zhao Wua, Jia-Wen Li et al. (2020) Cytokine release syndrome in severe COVID-19: interleukin-6 receptor antagonist tocilizumab may be the key to reduce mortality CiteInternational Journal of Antimicrobial Agents Volume 55, Issue 5, May, 105954. doi.org/10.1016/j.ijantimicag.2020.105954.
- 8. Wen Zhanga, Yan Zhaoa, Fengchun Zhanga et al. (2020) The use of anti-inflammatory drugs in the treatment of people with severe coronavirus disease 2019 (COVID-19): The Perspectives of clinical immunologists from China Clinical Immunology Volume 214, May: 108393. doi.org/10.1016/j.clim.2020.108393.
- 9. The Severe Covid-19 GWAS Group (2020) Genomewide Association Study of Severe Covid-19 with Respiratory Failure List of authors. N. Engl. J. Med.; 383: 1522–1534. DOI: 10.1056/NEJMoa2020283. http://www.nejm.org/doi/full/10.1056/NEJMoa2020283.
- 10. Randy Q. Cron and W. Winn Chatham (2020) The Rheumatologist’s Role in Covid-19. The Journal of Rheumatology, March, jrheum. 200334. doi.org/10.3899/jrheum.200334.
- 11. Chaolin Huang, Yeming Wang et al. (2020) Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China, Lancet 2020; 395: 497–506 Published Online January 24. doi.org/10.1016/S0140–6736(20)30183–5.
- 12. Fei Zhou, Ting Yu, Ronghui Du et al. (2020) Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study Online March 9. doi.org/10.1016/ S0140–6736(20)3.
- 13. Yufang Shi, Ying Wang, Changshun Shao et al. (2020) COVID-19 infection: the perspectives on immune responses Cell Death & Differentiation. doi.org/10.1038/s41418–020–0530–3.
- 14. Alunno A., Najm A., Machado P.M et al. (2021) EULAR points to consider on pathophysiology and use of immunomodulatory therapies in COVID-19. Ann. Rheum. Dis.; 0: 1–9. doi:10.1136/annrheumdis-2020–219724.
- 15. Li Jiang, Kun Tang, Levin M. et al. (2020) COVID-19 and multisystem inflammatory syndrome in children and adolescents http://www.thelancet.com/infection 1002 / Vol 20 November: 10.1002/ jmv.26340.http://www.acrconvergencetoday.org/covid-19-session-reviews-new-pediatric-condition-mis-c/?utm_source=acr-enews&utm_medium=email&utm_campaign=ACR-2020-extended-int&utm_content=button.
- 16. Godfred-Cato S., Bry’ant B., Leung J. et al. (2020)Мультисистемный воспалительный синдром, ассоциированный с COVID-19, у детей — США, март — июль 2020 г. MMWR Morb Mortal Wkly Rep; 69: 1074–1080. DOI:http://dx.doi.org/10.15585/mmwr.mm6932e2 https://pedsinreview.aappublications.org/content/39/2/78.
- 17. Henderson L.A., Canna S.W., Friedman K.G. et al. (2020) American College of Rheumatology Clinical Guidance for Pediatric Patients with Multisystem Inflammatory Syndrome in Children (MIS‐C) Associated with SARS‐CoV‐2 and Hyperinflammation in COVID‐19. Version 2. Arthritis Rheumatol. doi: https://onlinelibrary.wiley.com/doi/10.1002/art.41616. Developed by the ACR MIS-C and COVID-19 Related Hyperinflammation Task Force published in the November, issue of Arthritis & Rheumatology.
- 18. McCrindle B.W., Rowley C.A.H., Newburger J.W. et al. (2017) Diagnosis, Treatment, and Long-Term Management of Kawasaki Disease Scientific Statement for Health Professionals From the American Heart Association Circulation; 135: e927–e999. DOI: 10.1161/CIR.0000000000000484.
- 19. Center for Disease Control and Prevention, Center for Preparedness and Response (2020) Multisystem Inflammatory Syndrome in Children (MIS-C) Associated with Coronavirus Disease 2019 (COVID-19), Clinician Outreach and Communication (COCA) Webinar. Available at: emergency.cdc.gov/coca/calls/2020/callinfo_051920.asp?deliveryName=USCDC_1052-DM28623. (Accessed on May 19, 2020).
- 20. Association of Intravenous Immunoglobulins Plus Methylprednisolone vs Immunoglobulins Alone With Course of Fever in Multisystem Inflammatory Syndrome in Children Naïm Ouldali et al. (2021) JAMA March 2, Volume 325, Number 9.
- 21. Son M.B.F, Friedman K. (2021) COVID-19: Multisystem inflammatory syndrome in children (MIS-C) clinical features, evaluation, and diagnosis, Apr 2021. |This topic last updated: Apr 02.
- 22. Veiga A.B.G.D., Martins L.G., Riediger I. et al. (2021) More than just a common cold: Endemic coronaviruses OC43, HKU1, NL63, and 229E associated with severe acute respiratory infection and fatality cases among healthy adults. J. Med. Virol. Feb; 93(2): 1002–1007. doi: 10.1002/jmv.26362. Epub 2020 Aug 2. PMID: 32720706.
- 23. The guidelines for the diagnosis, treatment, and control of the coronavirus disease 2019 (COVID-19). An official website of the National Institutes of Health. http://www.covid19treatmentguidelines.nih.gov/
МУЛЬТИСИСТЕМНЫЙ ВОСПАЛИТЕЛЬНЫЙ СИНДРОМ, АССОЦИИРОВАННЫЙ С ИНФЕКЦИЕЙ SARS-COV-2, У ДЕТЕЙ: НОВАЯ БОЛЕЗНЬ ИЛИ СИНДРОМ? НА ПРИМЕРЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Резюме. В статье приведены обобщенные данные литературы по различиям патогенеза и клинических проявлений инфекции SARS-CoV-2 и мультисистемного воспалительного синдрома у детей, ассоциированного с инфекцией SARS-CoV-2, обсуждены общие черты и отличия его от других ревматических болезней и современные данные относительно тактики лечения. На клиническом примере представлен алгоритм действий врача при подозрении на мультисистемное воспалительное заболевание, ассоциированное с инфекцией, вызванной SARS-CoV-2.
Ключевые слова: дети, мультисистемное воспалительное заболевание, ассоциированное с инфекцией SARS-CoV-2, лечение, ведение.
Адреса для листування:
Ошлянська О.А.
E-mail: eoshljanskaja17@gmail.com

Leave a comment