Аналіз структурно-функціонального стану серця при застосуванні різних програм фармакотерапевтичного лікування у пацієнтів з тяжким перебігом міокардиту
Резюме. Мета. Провести аналіз різних програм лікування пацієнтів з тяжким перебігом міокардиту на основі комплексного дослідження динаміки структурно-функціонального стану серця протягом 6 міс спостереження. Матеріали і методи. Обстежено 90 пацієнтів з гострим міокардитом та зниженою фракцією викиду (ФВ) лівого шлуночка (ЛШ), всім пацієнтам у перший місяць хвороби та через 6 міс спостереження проводили аналіз ехокардіографічних (ехоКГ) показників та спекл-трекінг ехоКГ, магнітно-резонансну томографію, добове моніторування електрокардіограми (ЕКГ). Результати. Встановлено, що пацієнти з COVID-19 інфекцією в анамнезі, які приймали комбінацію сакубітрил-валсартан протягом 6 міс, характеризувалися вищою толерантністю до фізичного навантаження в середньому на 9,6% (p<0,05) за даними 6-хвилинного тесту, достовірно більшими величинами ФВ ЛШ (в середньому на 9,8%), поздовжньої глобальної систолічної деформації і циркулярної глобальної систолічної деформації ЛШ (в середньому на 11,8% та 10,2% відповідно), достовірно меншою кількістю сегментів ЛШ, уражених фібротичними змінами (в середньому на 22,5%), що асоціювалося із в 1,5 та 2 рази меншою кількістю шлуночкових екстрасистол та епізодів нестійкої шлуночкової тахікардії відповідно порівняно з хворими, які отримували терапію інгібіторами ангіотензинперетворювального ферменту. Висновки. Застосування комбінації сакубітрил-валсартан у хворих з міокардитом та зниженою ФВ ЛШ, які мали COVID-19 інфекцію в анамнезі, рекомендовано з метою підвищення толерантності до фізичного навантаження, зниження дилатації та поліпшення скоротливої здатності ЛШ, зменшення фібротичних змін міокарда та зниження частоти виникнення порушень серцевого ритму.
DOI:10.32471/rheumatology.2707-6970.95.18528
Вступ. Актуальність проблеми міокардиту зумовлена насамперед тим, що захворювання частіше відмічають в осіб молодого працездатного віку і при тяжкому перебігу воно може призводити до стійкої втрати працездатності, інвалідизації і смерті. Незважаючи на швидкий розвиток та удосконалення технологій діагностики і лікування, міокардит залишається однією з найбільш складних і актуальних проблем кардіології як з наукової, так і з практичної точки зору. Лікування міокардиту — вагома проблема сучасної кардіології, актуальна в усіх країнах світу, оскільки це захворювання нерідко призводить до інвалідизації та смерті осіб працездатного віку. Відсутність загальноприйнятих рекомендацій та визнаних світовою кардіологічною спільнотою алгоритмів терапії міокардиту, створених на основі сучасних принципів доказової медицини, зумовлюють актуальність проведення подальших досліджень, присвячених удосконаленню діагностики і розробці алгоритмів ведення хворих на міокардит [1, 5]. Одним з найбільш актуальних і складних викликів для сучасних дослідників і практикуючих лікарів на сучасному етапі є розробка адекватних схем патогенетично обґрунтованої імуносупресивної терапії. У цьому напрямку проведені дослідження із застосуванням імуносупресантів, глюкокортикоїдів, препаратів інтерферону, стовбурових клітин, імуноадсорбції та ін., однак результати цих досліджень суперечливі і, на думку більшості експертів, поки що не можуть бути імплементовані в повсякденну клінічну практику [2, 3]. Розвиток міокардиту є потенційним наслідком інфекції COVID-19 і може проявлятися дисфункцією правого і лівого шлуночків, фіброзом міокарда, шлуночковими і надшлуночковими аритміями, кардіогенним шоком та раптовою серцевою смертю [6, 7]. Різними авторами описані випадки розвитку міокардиту/перикардиту, дисфункції провідної системи серця, тромбоемболії легеневих артерій, розвитку гострого коронарного синдрому внаслідок тромбозу коронарних артерій або розривів бляшок, ускладнених гострою або хронічною серцевою недостатністю (СН), пов’язаних із SARS-CoV-2 [8, 9]. Таким чином, хоча гострий міокардит рідко є причиною пошкодження міокарда, пов’язаного з COVID-19, він може залишатися недостатньо діагностованим через різноманітність клінічних проявів у хворих, що перенесли COVID-19.
Отже, наукове обґрунтування нових підходів до діагностики, прогнозування перебігу і лікування пацієнтів з гострим міокардитом на основі динамічного спостереження із вивченням особливостей розвитку і прогресування запального процесу в міокарді, ремоделювання серця та перебігу СН є однією із основних проблем сучасної кардіології, і актуальність цього дослідження не викликає сумнівів.
Матеріали і методи дослідження. Обстежено 90 пацієнтів з гострим міокардитом (ГМ), ускладненим СН ІІ або вище функціонального класу (ФК) за класифікацією Нью-Йоркської асоціації серця (New York Heart Association — NYHA) та зниженою фракцією викиду (ФВ) лівого шлуночка (ЛШ), яка становила ≤40% згідно із стандартами з діагностики і лікування серцево-судинних захворювань. Пацієнтів розділили на 2 групи. До першої включили 48 пацієнтів з гострим міокардитом, що розвинувся в середньому через 1,5±0,5 міс після перенесеної COVID-19 інфекції — 28 (58,3% чоловіків та 20 (41,7%) жінок), середній вік 36,8±2,4 року, в подальшому цю групу було розділено на 2 підгрупи, в підгрупу 1А включили 20 пацієнтів, яким було призначено комбінацію сакубітрил-валсартан, в підгрупу 1Б — 28 хворих, що приймали стандартну терапію інгібіторами ангіотензинперетворювального ферменту (іАПФ). До 2-ї групи увійшли 42 пацієнти з гострим міокардитом без коронавірусної хвороби в анамнезі — 27 (64,3%) чоловіків і 15 (36,7%) жінок, середній вік 37,6±2,8 року. Цю когорту також розділили на 2 підгрупи: в підгрупу 2А включили 18 пацієнтів, яким було призначено комбінацію сакубітрил-валсартан, в підгрупу 2Б — 24 хворих, що приймали іАПФ. Пацієнти досліджуваних підгруп були зіставні за основними показниками структурно-функціонального стану серця. Усі хворі отримували стандартну терапію СН згідно з сучасними рекомендаціями, включаючи іАПФ (еналаприл), комбінації сакубітрил-валсартан та блокатори бета-адренорецепторів у зіставних дозах, сечогінні засоби, антагоністи мінералокортикоїдних рецепторів [1, 13, 16]. За наявності відповідних показань призначалися антикоагулянти й антиаритмічні засоби. Метилпреднізолон за відсутності протипоказань призначали згідно з алгоритмом, наведеним у Стандартах з діагностики і лікування серцево-судинних захворювань Всеукраїнської асоціації кардіологів за 2020 р. у дозі 0,25 мг/кг маси тіла на добу протягом 3 міс із подальшим поступовим зниженням дози до повної відміни препарату через 6 міс від початку лікування [2]. Аналіз результатів обстежень проводили в 1-й місяць від дебюту міокардиту до призначення глюкокортикоїдів та через 6 міс спостереження.
Для оцінки функціонального класу СН за критеріями NYHA проводили тест із 6-хвилинною ходьбою. Під час дослідження структурно-функціонального стану серця всім пацієнтам проводили трансторакальну ехокардіографію (ехоКГ) на ультразвуковому діагностичному апараті Aplio Artida SSH — 880 CV, Toshiba Medical System Corporation. За допомогою спекл-трекінг ехоКГ всім пацієнтам без наявності фібриляції передсердь (ФП) та частої екстрасистолічної аритмії вимірювали величини поздовжньої глобальної систолічної деформації (ПГСД), циркулярної глобальної систолічної деформації (ЦГСД), радіальної глобальної систолічної деформації (РГСД) [12]. Магнітно-резонансну томографію (МРТ) серця проводили у відділі променевої діагностики ДУ «ННЦ «Інститут кардіології ім. акад. М.Д. Стражеска» НАМН України, в дослідженні використовувався апарат Toshiba Vantage Titan HSR 1,5 Тесла. Оцінювали зображення серця по короткій і довгій осі в 3 режимах: до введення контрастного препарату (режим Т2 Black blood FSat) для виявлення ділянки набряку в міокарді, протягом 3–5 хв після введення (раннє контрастування), та в режимі відстроченого контрастування через 10–15 хв після введення контрастного розчину [14]. Добове моніторування ЕКГ проводили на апараті Philips Digitrack TM-plus 3100A. Оцінювали загальну кількість надшлуночкових екстрасистол (НШЕ) і шлуночкових екстрасистол (ШЕ) за добу, наявність пароксизмів суправентрикулярної тахікардії (СВТ) та нестійкої шлуночкової тахікардії (НШТ), порушення провідності серця. Для оцінки параметрів варіабельності серцевого ритму (ВСР) використовували частотні та спектральні показники. Частотні характеристики ВСР: SDNN (мс) — стандартне відхилення всіх R–R-інтервалів та його індекс — іSDNN; SDANN5 (мс) — стандартні відхилення середніх значень R–R-інтервалів, обчислених за 5-хвилинними проміжками протягом всього запису; RMSSD (мс) — квадратний корінь з середньої суми квадратів різниць між сусідніми R–R-інтервалами. Спектральні характеристики ВСР: LF (мс²) — низькочастотна частина спектру коливань в частотному діапазоні 0,04–0,15 Гц; HF (мс2) — високочастотна складова спектру коливань в частотному діапазоні 0,15–0,5 Гц та відношення LF/HF.
РЕЗУЛЬТАТИ ДОСЛІДЖЕНЬ ТА ЇХ ОБГОВОРЕННЯ
При порівняльному аналізі результатів тесту із 6-хвилинною ходьбою через 6 міс спостереження у групі хворих з інфекцією СОVID-19 в анамнезі виявлено, що величина дистанції, пройденої за 6 хв, на 14,2% більша в осіб підгрупи 1А (рис. 1), що свідчить про більш інтенсивне відновлення толерантності до фізичного навантаження в цій когорті хворих.
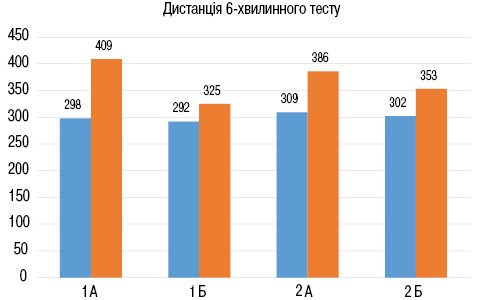
У пацієнтів без COVID-19 в анамнезі через 6 міс спостереження дистанція 6-хвилинного тесту була на 12,7% більшою в осіб підгрупи 2А (р<0,05), що свідчить про більш інтенсивне відновлення толерантності до фізичного навантаження у хворих, які приймали комбінацію сакубітрил-валсартан, ніж у пацієнтів, що отримували іАПФ. При порівнянні пацієнтів підгруп 1А і 2А виявлено, що величина пройденої дистанції через 6 міс спостереження у хворих підгрупи 1А була на 9,6% (p <0,05) більшою порівняно з такою у пацієнтів підгрупи 2А, що свідчить про більш інтенсивне відновлення толерантності до фізичного навантаження у пацієнтів з перенесеним COVID-19 в анамнезі, які отримували комбінацію сакубітрил-валсартан.
При проведенні порівняльного аналізу показників ехоКГ встановлено, що через 6 міс під впливом лікування відмічено суттєве зменшення вираженості кардіомегалії в обох групах хворих. Проте зменшення величин індексів кінцеводіастолічного об’єму (іКДО) та кінцевосистолічного об’єму (іКСО) у пацієнтів з міокардитом було нерівномірним. У підгрупах пацієнтів з COVID-19 в анамнезі порівняльний аналіз даних ехоКГ демонструє достовірне зниження іКДО та іКСО та, відповідно, зростання ФВ вже через 6 міс від початку захворювання у пацієнтів підгрупи 1А, при цьому у хворих підгрупи 1Б не виявлено достовірної тенденції до зниження показників іКДО та іКСО протягом 6 міс спостереження, а приріст ФВ ЛШ в цій когорті хворих був достовірно нижчим (рис. 2).
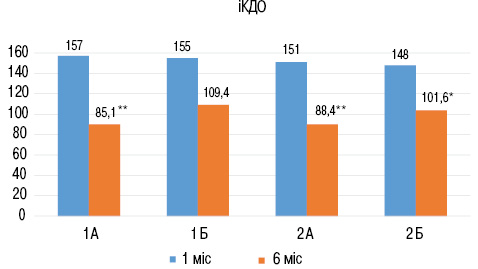
Подібну картину виявлено і у пацієнтів без інфекції COVID-19 в анамнезі. У підгрупі 2А іКДО за 6 міс знизився в середньому на 15,2% (р<0,01), а середня величина ФВ зросла на 12,5% (р<0,05), у хворих підгрупи 2Б зниження іКДО відбувалося повільніше і становило 12,1% (р<0,05), а приріст ФВ ЛШ становив усього 7,8% (р>0,05) через 6 міс спостереження.
При порівнянні між собою пацієнтів підгруп 1А та 2А виявлено, що за величинами іКДО ЛШ ці підгрупи не відрізнялися, але хворі підгрупи 1А мали на 10,5% нижчий іКСО та, відповідно, на 9,8% (р<0,05) більшу величину ФВ ЛШ, ніж пацієнти підгрупи 2А, що підтверджує результати тесту із 6-хвилинною ходьбою та свідчить про більш інтенсивне відновлення систолічної функції ЛШ та зменшення вираженості СН у підгрупі хворих з перенесеним СОVID-19, які отримували терапію комбінацією сакубітрил-валсартан протягом 6 міс (табл. 1).
Таблиця 1. Показники глобальної та сегментарної скоротливої функції ЛШ у підгрупах пацієнтів з міокардитом за даними ехоКГ через 6 міс спостереження
| Підгрупи | 1А (n=20) | 1Б (n=28) | 2А (n=18) | 2Б (n=25) |
|---|---|---|---|---|
| іКДО ЛШ, мл/м² | 85,1±5,5 | 109,4±5,5** | 88,4±7,1 | 101,6±7,1° |
| іКСО ЛШ, мл/м² | 52,8±4,5 | 62,7±4,5* | 59,0±5,2* | 63,2±4,3° |
| ФВ ЛШ, % | 48,2 ±2,9 | 38,6±2,4* | 43,1±2,8* | 37,4±2,3° |
| ПГСД, % | 11,2±1,6 | 7,1±1,3* | 9,7±1,2 | 8,1±1,2 |
| ЦГСД, % | 8,6±1,4 | 5,7±1,1* | 9,4±1,4 | 7,8±1,1° |
| РГСД, % | 17,5±2,6 | 14,3±2,1 | 19,2±2,6 | 16,9±2,3 |
Примітки. Різниця показників достовірна порівняно із такими в підгрупі 1А: *р<0,05, **р<0,01. Різниця показників достовірна порівняно із такими в підгрупі 2А: °р<0,05.
Через 6 міс спостереження у пацієнтів з перенесеним COVID-19 в анамнезі, за результатами спекл-трекінг ехоКГ, величини ПГСД та ЦГСДЛШ були більшими на 11,3 та 12,8% відповідно (р<0,05) у підгрупі1А, що свідчить про більш інтенсивне відновлення показників локальної скоротливості у пацієнтів, які отримували терапію комбінацією сакубітрил-валсартан. У той же час слід звернути увагу, що у хворих підгрупи 1Б величина ПГСД ЛШ не продемонструвала достовірного приросту протягом 6 міс спостереження. Величини РГСД ЛШ були зіставними в обох підгрупах хворих через 6 міс спостереження. При вивченні показників ротації виявлено, що у пацієнтів групи 1Б відмічено більш значні порушення показників закручування ЛШ, що проявлялося нижчим в середньому на 22,4% значенням показника ротаційної деформації ЛШ: 8,3±0,6 та 11,1±0,8 0/с відповідно (р <0,01) порівняно з такими в підгрупі 1А.
Схожа картина виявлена через 6 міс спостереження і у підгрупах хворих без перенесеного СOVID-19. Зокрема, в підгрупі 2А величина ПГСД була більшою на 9,4% (р<0,05), а ЦГСД — на 10,6% (р<0,05), ніж у хворих підгрупи 1Б, при цьому величина РГСД також була зіставною і у цих когортах хворих. Величина показника ротаційної деформації ЛШ у пацієнтів підгрупи 2А була в середньому на 15,3% вищою (р<0,05) порівняно з підгрупою 2Б, що може свідчити про більш інтенсивне відновлення ротаційної функції ЛШ у хворих, які отримували 6-місячний курс терапії комбінацією сакубітрил-валсартан у порівнянні зі стандартною терапією іАПФ.
При оцінці скоротливої функції передсердь виявлено, що у пацієнтів 1-ї групи показник систолічної деформації лівого передсердя (СДЛП) був у середньому нижчим на 12,2% порівняно з таким у хворих 2-ї групи (р<0,01), що свідчило про зниження резервуарної функції лівого передсердя у пацієнтів з перенесеним COVID-19 в анамнезі. Значення СДЛП в підгрупах хворих як 1-ї, так і 2-ї груп не показало статистично значимих розбіжностей.
При порівняльному аналізі спекл-трекінг ехо-КГ в підгрупах 1А та 2А виявлено вищі показники ПГСД ЛШ на 11,8% та ЦГСД ЛШ — на 10,2% відповідно у пацієнтів підгрупи 1А порівняно з такими підгрупи 2А (р<0,05), решта параметрів спекл-трекінг ехоКГ в обох підгрупах були зіставними.
Виявлене зниження ПГСД в обох групах пацієнтів відображає істотне порушення роботи субепікардіальних волокон міокарда, що, згідно з останніми літературними даними, корелює з локалізацією та зонами ураження за даними МРТ серця [10, 12]. Порушення глобальної деформації міокарда при міокардиті, спричинене ураженням субендокардіальних та субепікардіальних волокон ЛШ, може бути вирішальним підходом до діагностики міокардиту, особливо у хворих, що перенесли інфекцію COVID-19. Переважне ураження зовнішніх та середніх шарів міокарда при міокардиті призводить до порушення циркулярної та ротаційної деформації, що потенційно може були новим діагностичним спекл-трекінг ехоКГ критерієм при цій патології, а також методом відбору пацієнтів для проведення додаткових діагностичних процедур, зокрема МРТ серця [15].
Аналіз результатів МРТ серця показав, що через 6 міс лікування частота виявлення запальних змін міокарда — набряку і гіперемії (про наявність яких свідчила наявність раннього контрастування та посилення інтенсивності Т2-сигналу) зменшилася більше ніж удвічі, а частота виявлення відстроченого контрастування, що свідчить про наявність фібротичних змін міокарда, підвищилася в середньому на 40% (рис. 3).
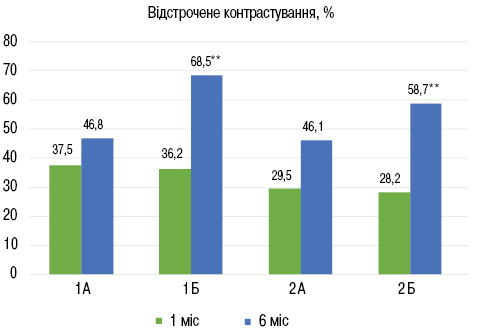
Після завершення 6-місячного курсу спостереження та лікування у хворих підгрупи 1А кількість сегментів ЛШ, уражених запальними змінами, зменшилася з 7,2±0,8 до 2,6±0,28 сегмента (р<0,001), у пацієнтів підгрупи 1Б — з 7,4±0,82 до 2,9±0,3 сегмента (р<0,001) порівняно з 1-м місяцем від початку захворювання. У той же час кількість сегментів із наявністю фібротичних змін у підгрупі 1А становила в середньому 4,6±0,45 сегмента, що значимо не відрізнялося від результату 1-го місяця спостереження 4,2±0,41 сегмента відповідно (табл. 2). У хворих підгрупи 1Б кількість виявлених фібротичних змін збільшилася на 34,3% з 4,4±0,27 до 6,7±0,38 сегмента відповідно. У підгрупах хворих без COVID-19 в анамнезі картина МРТ-дослідження через 6 міс спостереження та лікування була подібною, зокрема в підгрупі 2А кількість сегментів ЛШ з виявленими запальними змінами зменшилася до 2,2±0,24 порівняно з 6,9±0,75 сегмента в 1-й місяць спостереження, а фібротичні зміни через 6 міс були виявлені в 3,8±0,28 порівняно з 4,4±0,22 сегмента у 1-й місяць захворювання. У пацієнтів підгрупи 2Б зменшення вираженості запальних змін за 6 міс лікування становило з 7,3±0,85 до 3,2±0,33 сегмента (р<0,01). У той же час кількість вогнищ відстроченого накопичення контрасту у хворих цієї підгрупи збільшилася на 22% — з 4,3±0,38 до 5,6±0,56 відповідно, що може свідчити про більшу вираженість фібротичних змін міокарда ЛШ у цій підгрупі пацієнтів. Підсумовуючи аналіз патологічних змін, що виявлялися при МРТ серця через 6 міс спостереження, слід зазначити, що частота виявлення запальних змін і обсяги запального ураження міокарда ЛШ в усіх досліджуваних групах були зіставними, при цьому пацієнти з перенесеним СOVID-19, які отримували терапію як іАПФ, так і комбінацією сакубітрил-валсартан, через 6 міс характеризувалися більшою кількістю фібротичних змін, ніж пацієнти без СOVID-19 в анамнезі. Однак не можна залишити поза увагою факт, що у хворих підгрупи 1А та 2А, які отримували лікування комбінацією сакубітрил-валсартан, частота виявлення фібротичних змін і обсяги фібротичного ураження міокарда ЛШ через 6 міс були суттєво меншими.
На завершення було проаналізовано результати холтерівського моніторування ЕКГ у досліджуваних групах хворих через 6 міс спостереження. У динаміці відмічався приріст величин основних показників ВСР у всіх досліджуваних пацієнтів, проте зростання показників у підгрупах хворих було неоднорідним. Так, показник SDNN в підгрупі 1А підвищився на 18,3% (р<0,05) протягом 6 міс, тоді як у підгрупі 1Б його приріст становив 9,6% відповідно. У пацієнтів підгрупи 2А зростання величини SDNN становило 22,6% (р<0,01), в підгрупі 2Б — 11,8% (р<0,05) відповідно (рис. 4).
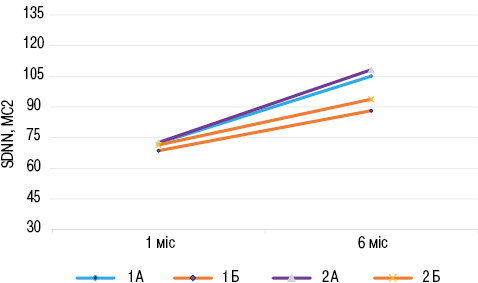
Виявлено також підвищення величини RMSSD на 17,3 та 10,9% в підгрупах 1А та 1Б відповідно, та на 25 і 12,9% в підгрупах 2А та 2Б відповідно порівняно з такими в 1-й місяць захворювання (табл. 2).
Таблиця 2. Частотні та спектральні параметри ВСР у підгрупах пацієнтів з міокардитом через 6 міс спостереження
| Показник | 1-ша група | 2-га група | ||
|---|---|---|---|---|
| Підгрупи | 1А (n=20) | 1Б (n=28) | 2А (n=18) | 2Б (n=24) |
| SDNN, mc | 84,6±8,6 | 69,3±4,2* | 81,2±8,1 | 76,3±7,8° |
| RMSSD, mс | 27,4±3,1 | 19,6±2,4** | 29,7±3,1 | 21,2±2,6° |
| LF | 1250±112 | 1130±98 | 1290±138 | 1150±121° |
| HF | 920± 90 | 890±114 | 900±104 | 910±110 |
| LF/HF | 1,25±0,06 | 1,39±0,08* | 1,19±0,08 | 1,60±0,08° |
Примітки. Різниця показників достовірна порівняно з такими в підгрупі 1А: *р<0,05, **р<0,01. Різниця показників достовірна порівняно з такими в підгрупі 2А: °р<0,05.
При аналізі спектральних параметрів ВСР виявлено, що величина HF через 12 міс збільшилася на 24,6% (p<0,05) в осіб з підгрупи 1А порівняно з аналогічним в 1-й місяць, в осіб підгрупи 1Б приріст цього показника становив лише 9,2% (p>0,05), в той же час величина LF протягом 12 міс у 1-й підгрупі збільшилася на 20% (p<0,05), тоді як у 2-й на 28,9% (p<0,01). Відношення LF/HF у підгрупі 1Б збільшилося на 14,8% (р<0,05), а у підгрупі 1А — достовірно не змінилося. При порівняльному аналізі груп 1А та 2А суттєвих розбіжностей в основних параметрах ВСР не виявлено.
За результатами аналізу розподілу порушень ритму та провідності серця у пацієнтів з міокардитом через 6 міс спостереження проведено оцінку кількості надшлуночкових та шлуночкових екстрасистол, пароксизмів нестійкої ШТ, АВ-блокади та блокад ніжок пучка Гіса в обох досліджуваних підгрупах. Встановлено, що у хворих підгруп 1Б та 2Б кількість надшлуночкових і шлуночкових порушень ритму через 6 міс майже в 1,5 та 2 рази відповідно перевищували аналогічні показники підгруп 1А та 2А (табл. 3).
Таблиця 3. Розподіл порушень ритму і провідності серця в підгрупах пацієнтів з міокардитом за даними добового моніторингу ЕКГ через 6 міс спостереження
| Підгрупи | 1A (n=20) | 1Б (n=24) | 2А (n=18) | 2Б (n=24) |
|---|---|---|---|---|
| ЧСС, уд./хв | 82,1±5,9 | 83,8±6,1 | 70,3±4,7 | 74,1±5,2 |
| НШЕ, % | 0,89±0,11 | 1,04±0,35 | 0,76±0,08 | 1,27±0,32° |
| ШЕ, % | 0,98±0,21 | 2,08±0,22** | 0,87±0,09 | 2,0±0,23°° |
| НШТ, % | 9,1 | 14* | 8,2 | 12° |
| АВ-блокада, % | 13,6 | 10 | 11,1 | 10 |
| БНПГ, % | 18,2 | 22* | 14,6 | 20 |
Примітки. БНПГ — блокада ніжки пучка Гіса. АВ — атріовентрикулярна. Різниця показників достовірна порівняно із такими в підгрупі 1А: *р<0,05, **р<0,01. Різниця показників достовірна порівняно з такими в підгрупі 2А: °р<0,05, °°р<0,01.
Таким чином, результати порівняльного аналізу в зіставних групах пацієнтів з гострим міокардитом зі зниженою фракцією викиду дозволили оцінити ефективність призначення 6-місячного курсу терапії комбінацією сакубітрил-валсартан порівняно з терапією іАПФ. Підсумовуючи викладені вище результати, зупинимось на декількох ключових, на нашу думку, позиціях: по-перше, додавання комбінації сакубітрил-валсартан до планової терапії СН через 6 міс призводить до поліпшення скоротливої здатності ЛШ і зменшення його об’єму, при цьому найвища ефективність цієї комбінації виявляється саме у хворих з інфекцією COVID-19 в анамнезі; по-друге, на фоні призначення цього препарату знижується частота виявлення вогнищ відстроченого контрастування на МРТ серця, що є маркером фібротичного ураження міокарда ЛШ; по-третє, відбувається більш швидке відновлення параметрів ВСР, зокрема її парасимпатичної ланки регуляції, і зниження частоти виявлення порушень ритму та провідності серця, зокрема розвитку життєво небезпечних епізодів НШТ, що може розглядатися як позитивне зрушення на шляху до одужання хворого.
Висновки
1. Пацієнти з гострим міокардитом та зниженою ФВ ЛШ, які мали інфекцію COVID-19 в анамнезі та отримували терапію комбінацією сакубітрил-валсартан протягом 6 міс, характеризувалися достовірно вищою толерантністю до фізичного навантаження (в середньому на 9,6% (p<0,05)), за даними 6-хвилинного тесту, достовірно більшою величиною ФВ ЛШ (в середньому на 9,8%), ПГСД і ЦГСД ЛШ (в середньому на 11,8 та 10,2% відповідно) порівняно з хворими, які отримували терапію іАПФ.
2. У групі пацієнтів із гострим міокардитом після перенесеного COVID-19 зі зниженою ФВ ЛШ, які приймали комбінацію сакубітрил-валсартан, через 6 міс спостереження на тлі зіставної кількості запального ураження міокарда виявлено достовірно меншу кількість сегментів ЛШ, уражених фібротичними змінами (в середньому на 22,5%), що асоціювалося із в 1,5 та 2 рази меншою кількістю шлуночкових екстрасистол та епізодів НШТ порівняно з хворими, які отримували терапію іАПФ.
3. Застосування комбінації сакубітрил-валсартан у пацієнтів з міокардитом та зниженою ФВ ЛШ, які мали інфекцію COVID-19 в анамнезі, рекомендовано з метою підвищення толерантності до фізичного навантаження, зниження дилатації та поліпшення скоротливої здатності ЛШ, зменшення вираженості фібротичних змін міокарда та зниження частоти виникнення порушень серцевого ритму.
Список використаної літератури
- 1. Коваленко В.М., Лутай М.І., Сіренко Ю.М., Сичов О.С., ред. (2020) Серцево-судинні захворювання: класифікація, стандарти діагностики та лікування. Київ: МОРІОН. 239 с.
- 2. Коваленко В.М., Несукай О.Г., Чернюк С.В. та ін. (2020) Діагностика та лікування міокардиту. Рекомендації Всеукраїнської асоціації кардіологів України. Український кардіологічний журнал, Т32(3): 67–88.
- 3. Caforio A.L., Pankuweit S., Arbustini E. et al. (2013) Current state of knowledge on aetiology, diagnosis, management and therapy of myocarditis: a position statement of the ESC Working group on myocardial and pericardial diseases. Eur. Heart J., Vol. 34(33): 2636–2648. doi: 10.1093/eurheartj/eht210.
- 4. Ammirati E., Veronese G., Bottiroli M. et al. (2020) Update on acute myocarditis. Trends in Cardiovascular Medicine, Vol. 31(6): 370–379. doi: 10.1016/j.tcm.2020.05.008.
- 5. Tschöpe C., Ammirati E., Bozkurt B. et al. (2021) Myocarditis and inflammatory cardiomyopathy: current evidence and future directions. Nat. Rev. Cardiol., Vol. 18(3): 169–193. doi: 10.1038/s41569-020-00435-x.
- 6. Guo T., Fan Y., Chen M. et al. (2020) Cardiovascular implications of fatal outcomes of patients with coronavirus disease 2019 (COVID-19). JAMA Cardiol., Vol. 5: 811. doi: 10.1001/jamacardio.2020.1017.
- 7. Boylan M., Roddy J., Lim N. et al. (2021) Recovery of a critically ill patient with COVID-19 myocarditis. Irish Journal of Medical Science, Vol. 16: 5. doi:10.1007/s11845-021-02681-5.
- 8. Azevedo R.B., Botelho B.G., de Hollanda J.V.G. et al. (2020) Covid-19 and the cardiovascular system: a comprehensive review. J. Hum. Hypertens, Vol. 35(1): 4–11. doi: 10.12998/wjcc.v10.i27.9602. doi: 10.1038/s41371-020-0387-4.
- 9. Babapoor-Farrokhran S., Gill D., Walker J. et al. (2020) Myocardial injury and COVID-19: possible mechanisms. LifeSci., Vol. 253: 1177–1223. doi: 10.1016/j.lfs.2020.117723.
- 10. Szekely Y., Lichter Y., Taieb P. et al. (2020) Spectrum of Cardiac Manifestations in Coronavirus Disease 2019 (COVID-19)-a Systematic Echocardiographic Study. Circulation, Vol. 142: 342–353. doi.org/10.1161/CIRCULATIONAHA.120.047971.
- 11. Коваленко В.М., Несукай О.Г., Тітова Н.С. та ін. (2020) COVID-19-асоційований міокардит: власний досвід патогенетичного лікування. Український кардіологічний журнал, Т. 32(3): 9–19.
- 12. González-Ruiz F.J., Lazcano-Díaz E.A., Vásquez-Ortiz Z.Y. et al. (2021) Comprehensive Left Ventricular Mechanics Analysis by Speckle Tracking Echocardiography in COVID-19. World Journal of Cardiovascular Diseases, Vol. 11: 113–125. doi: 10.4236/wjcd.2021.112013.
- 13. Caforio A.L., Pankuweit S., Arbustini E. et al. (2013) Current state of knowledge on aetiology, diagnosis, management and therapy of myocarditis: a position statement of the ESC Working group on myocardial and pericardial diseases. Eur. Heart J., Vol. 34(33): 2636–2648. doi: 10.1093/eurheartj/eht210.
- 14. Arnold J.R., McCann G.P. (2020) Cardiovascular Magnetic Resonance: Applications and Practical Considerations for the General Cardiologist. Heart, Vol. 106(3): 174–181. doi: 10.1136/heartjnl-2019-314856.
- 15. Goody P., Zimmer S., Zimmer A. et al. (2021) 3D-speckle-tracking echocardiography correlates with CMR diagnosis of acute myocarditis; Feb 17: 549–563. doi: 10.22541/au.161359840.05297135/v1.
- 16. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure (2022) A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J. Am. Coll. Cardiol., May 79 (17): e263–e421. http://www.jacc.org/doi/10.1016/j.jacc.2021.12.012.
- 17. Peretto G., Sala S., Rizzo S. et al. (2020) Ventricular arrhythmias in myocarditis: characterization and relationships with myocardial inflammation. J. Am. Coll.Cardiol., Vol. 75(9): 1046–1057. doi: 10.1016/j.jacc.2020.01.036.
Відомості про авторів:
Кириченко Р.М., науковий співробітник відділу некоронарних хвороб серця, державна установа «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска Національної академії медичних наук України».
03151, Київ, вул. Святослава Хороброго, 5.
Е-mail: kirichenko87se@gmail.com
ORCID ID: 0000-0003-0564-8052
Тітова Н.С. — старший науковий співробітник відділу некоронарних хвороб серця, державна установа «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска Національної академії медичних наук України».
03151, Київ, вул. Святослава Хороброго, 5.
Е-mail: natalkapolenova@gmail.com
ORCID ID: 0009-0005-7562-4058

Leave a comment