ДОСЛІДЖЕННЯ ПОТЕНЦІЙНИХ ЛАБОРАТОРНИХ МАРКЕРІВ СИСТЕМНОГО ЧЕРВОНОГО ВОВЧАКА ТА ЇХ ЗВ’ЯЗКУ З КЛІНІКО-ЛАБОРАТОРНИМИ ХАРАКТЕРИСТИКАМИ ПАЦІЄНТІВ
Резюме. Пошук біомаркерів системного червоного вовчака (СЧВ), які б дозволили підвищити ефективність діагностики, моніторингу, стратифікації ризиків та прогнозування індивідуальної відповіді на лікування залишається актуальним питанням, яке зараз активно вивчається. Мета роботи — доповнити існуючі дані про інтерлейкін-2 (ІЛ-2), сироватковий амілоїд А (СAA), феритин, васкулярний ендотеліальний фактор росту А (vasclar endothelial growth factor А — VEGF-А), розчинний рецептор васкулярного ендотеліального фактора росту 1-го типу (sVEGF-R1) та ендотелін-1 (ЕТ-1) при СЧВ, вивчити їх зв’язки з рутинними лабораторними показниками та клінічними проявами захворювання. Методи дослідження. У дослідження включено 38 пацієнтів з діагнозом СЧВ, що проходили стаціонарне лікування у ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска НАМН України» в 2021–2023 рр. та 14 здорових осіб, зіставних за віком та статтю. Результати дослідження. Сироваткові рівні САА, феритину, VEGF-А, sVEGF-R1 та ЕТ-1 є достовірно вищими у пацієнтів з СЧВ порівняно з контрольною групою. ЕТ-1 та САА є маркерами високої активності СЧВ. За концентрацією ІЛ-2 в сироватці крові можна виділити групи з низьким та високим рівнем; у останніх виявлено нижчий рівень VEGF-A та вищий рівень С-реактивного білка. Висновки. Отримані результати мають теоретичне значення та потребують подальших досліджень на більших групах пацієнтів.
DOI: 10.32471/rheumatology.2707-6970.92.17937
УДК: 616.5-002.525.2-071
ВСТУП
Пошук біомаркерів системного червоного вовчака (СЧВ), які б дозволили підвищити ефективність діагностики, моніторингу, стратифікації ризиків та прогнозування індивідуальної відповіді на лікування залишається актуальним питанням, яке зараз досить активно вивчається. Ці зусилля є важливими з кількох причин:
- гіпер- та недодіагностика СЧВ є поширеним явищем, навіть серед досвідчених ревматологів;
- ідентифікація провісників та рання діагностика загострень СЧВ залишається більшою мірою мистецтвом, ніж наукою;
- здатність стратифікувати ризики пацієнтів, щоб передбачити, у кого будуть розвиватися специфічні моделі ураження органів, наразі неможлива, хоча потенційно могла б допомогти розробляти профілактичні терапевтичні стратегії;
- повільна, порівняно з іншими ревматологічними захворюваннями, розробка препаратів для лікування СЧВ [1, 2].
За даними аналізу літератури, обрано кілька потенційних маркерів активності аутоімунного процесу та ураження органів-мішеней: інтерлейкін-2 (ІЛ-2), сироватковий амілоїд А (СAA), феритин, васкулярний ендотеліальний фактор росту А (vascular endothelial growth factor А — VEGF-А), розчинний рецептор васкулярного ендотеліального фактора росту 1-го типу (sVEGF-R1) та ендотелін-1 (ЕТ-1).
IЛ-2 — цитокін з подвійними про- і протизапальними властивостями, роль якого при СЧВ вивчена недостатньо.
Феритин та СAA — білки гострої фази, що поряд з С-реактивним білком відображають активність запального процесу.
VEGF-А та ЕТ-1 виробляються переважно ендотеліоцитами, мають прозапальні властивості та відіграють ключову роль в патогенезі судинних уражень.
Нижче коротко розглянемо кожен з досліджуваних маркерів.
ІЛ-2 відіграє важливу роль у підтриманні балансу між недостатністю та гіперактивністю імунітету. У високих дозах стимулює протипухлинний імунітет, а в низьких підтримує субпопуляцію регуляторних T-лімфоцитів (T-reg) та зменшує вираженість аутоімунних захворювань [3]. Його рівень знижується в дебюті СЧВ, проте зворотно підвищується на фоні лікування [4]. На цей момент проводиться кілька клінічних досліджень, що демонструють обнадійливі результати щодо ефективності призначення низьких доз ІЛ-2 при СЧВ [5].
Сироватковий амілоїд А є разом з С-реактивним білком, одним із основних білків гострої фази, який продукується гепатоцитами під дією прозапальних цитокінів, в основному — ІЛ-6. Відома його здатність формувати відкладення амілоїду при хронічних запальних процесах, проте його основна роль вивчена мало. Серед деяких відомих функцій такі:
- індукція синтезу ІЛ-1, ІЛ-8, фактора некрозу пухлин альфа (TNF-aльфа) нейтрофілами;
- подовження часу життя нейтрофілів шляхом супресії апоптозу;
- активація Toll-like-рецепторів 2-го і 4-го типів;
- участь у механізмах зворотного зв’язку, що забезпечують припинення гострофазової реакції [6].
Раніше показано підвищення САА при СЧВ та кореляцію з активністю захворювання [7].
Феритин — відомий маркер запального процесу, що підвищується, зокрема, при СЧВ. В одному з досліджень виявлено прямий кореляційний зв’язок з рівнем тромбоцитів і гемоглобіну та зворотний з рівнем лейкоцитів, що робить його потенційним маркером активності захворювання у пацієнтів з гематологічними проявами [8].
VEGF-А є одним із ключових цитокінів у процесі неоангіогенезу в ході запального процесу і пухлинного росту та вважається основним медіатором ендотеліальної дисфункції при СЧВ. Також чинить прозапальну дію шляхом активізації хемотаксису та інфільтрації тканин моноцитами/макрофагами та лімфоцитами [9, 10]. Існує 7 підтипів VEGF, серед яких основний — VEGF-A, рівень якого і визначався в нашому дослідженні. Він реалізує свої функції через 2 типи рецепторів VEGF-R1 (висока афінність) та VEGF-R2 (низька афінність) [9]. Доведено підвищення VEGF при СЧВ порівняно зі здоровими особами, а також у пацієнтів з люпус-нефритом порівняно з пацієнтами без ураження нирок [11, 12].
ЕТ-1 — потужний вазоконстриктор з прозапальними, профібротичними та мітогенними властивостями [13]. Показано, що при СЧВ імунні комплекси та антитіла до ендотеліоцитів стимулюють продукцію останніми ЕТ-1 [14]. При захворюваннях нирок та ниркових проявах ревматологічних захворювань відмічають підвищену внтрішньоренальну експресію ЕТ-1, концентрацію в сироватці крові та екскрецію із сечею. Разом з тим його роль в позаниркових проявах СЧВ та зв’язок з активністю захворювання вивчені недостатньо [13].
Мета роботи — доповнити існуючі дані щодо досліджуваних маркерів при СЧВ, вивчити їх зв’язки між собою, з рутинними лабораторними показниками та клінічними проявами захворювання.
МАТЕРІАЛИ І МЕТОДИ ДОСЛІДЖЕННЯ
У дослідження включено 38 пацієнтів з СЧВ, що проходили стаціонарне лікування у ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска Національної академії медичних наук України» в 2021–2023 рр. Діагноз встановлювався за критеріями Міжнародної співпраці клінік СЧВ (Systemic Lupus International Collaborating Clinics — SLICC), 2012 р., або Американського коледжу ревматології (American College of Rheumatology — ACR)/Європейського альянсу асоціацій ревматологів (European Alliance of Associations for Rheumatology — EULAR), 2019 р. Контрольну групу становили 14 здорових осіб, зіставних за віком та статтю. Дані щодо клінічних проявів захворювання, рутинних лабораторних показників отримували з медичної документації пацієнтів. У всіх досліджуваних здійснювали забір крові натще та сепарацію сироватки крові. Після цього отриману сироватку розливали в пробірки типу «Епіндорф» та залишали для зберігання при температурі –80 °С до моменту визначення концентрації досліджуваних маркерів.
Вміст VEGF-А, його рецептора sVEGFR-1 та ЕТ-1 у сироватці крові пацієнтів досліджували методом імуноферментного аналізу (ІФА) за допомогою наборів реагентів «Invitrоgen» (США). Вміст ІЛ-2 визначали також за допомогою ІФА (тест-системи «FineTest», Китай). Постановки проводили згідно з інструкціями відповідних виробників. Облік здійснювали на імуноферментному аналізаторі «iEMSLabSystems» (Фінляндія). Результати наведено в пг/мл. Концентрацію сироваткового амілоїду А (мг/л) та феритину (нг/мл) визначали за допомогою імунофлуоресцентного методу (тест-системи «Finecare», Китай).
Порівнювали отримані показники у дослідній та контрольній групі, у групах пацієнтів з високою (індекс SELENA-SLEDAI >10) та низькою чи помірною активністю захворювання SELENA-SLEDAI=1–10); а також у пацієнтів з наявністю чи відсутністю кожного з основних клінічних проявів на момент забору крові. Характер розподілу отриманих значень оцінювали на нормальність за допомогою методу Колмогорова — Смірнова. При нормальному розподілі для порівняння груп використовували Т-критерій Стьюдента, при ненормальному — U-критерій Манна — Уїтні. Різницю вважали достовірною при p<0,05. Вивчали кореляційні зв’язки досліджуваних показників між собою та з рутинними лабораторними параметрами. Використовували коефіцієнт рангової кореляції Спірмена. Зв’язок вважали достовірним при p<0,05.
Для оцінки діагностичної цінності досліджуваних лабораторних показників як маркерів високої активності СЧВ використовували ROC-аналіз (Receiver Operator Characteristic). Для кожного визначали площу під кривою (Area Under Curve): чим її значення ближче до одиниці, тим вища ефективність діагностичного тесту. Також визначали порогові значення та відповідні їм специфічність і чутливість. Для аналізу статистичних даних використано програмне забезпечення Statistical Package for the Social Sciences (SPSS) версії 26.0
РЕЗУЛЬТАТИ ТА ОБГОВОРЕННЯ
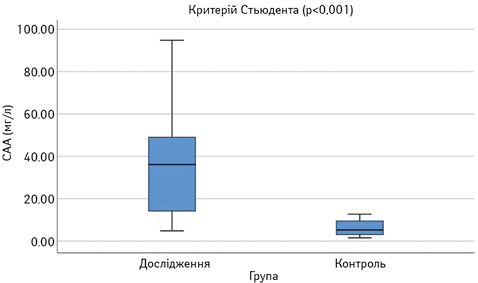
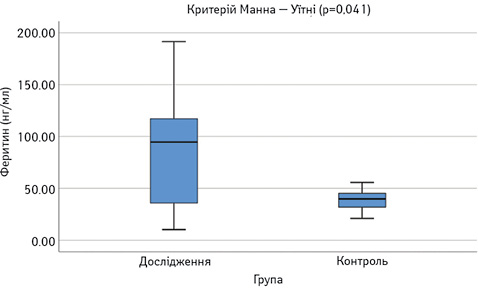
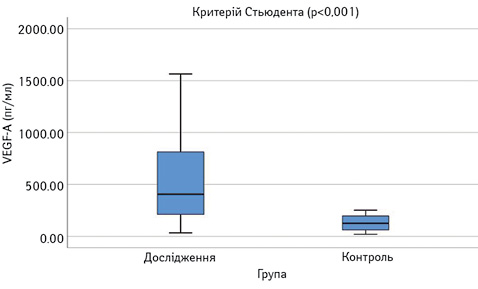
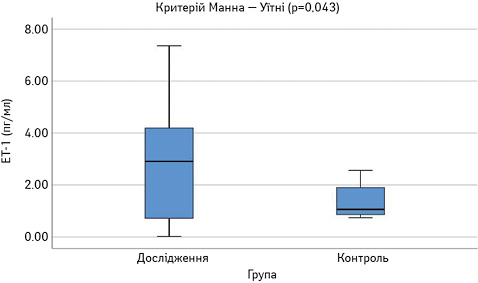
Виявлено достовірне підвищення сироваткових концентрацій САА, феритину, VEGF-А, sVEGF-R1 та ЕТ-1 у пацієнтів з СЧВ порівняно з контрольною групою (рис.1–6). Варто зауважити, що рівень sVEGF-R1 у всіх осіб з контрольної групи був нижчим межі чутливості методу визначення, тоді як серед контрольної групи лише у 16 (42%) (див. рис. 2).
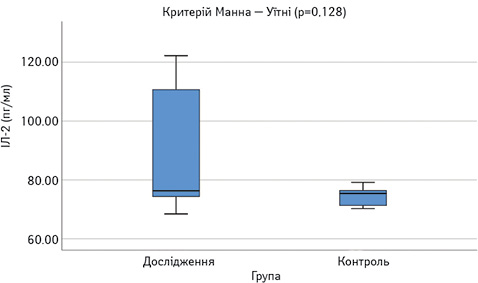
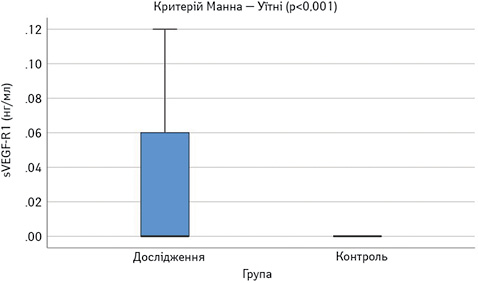
Рівень IЛ-2 в обох групах достовірно не відрізнявся (див. рис. 1), проте при аналізі таблиці розсіювання значень IЛ-2 (рис. 7) виявлено специфічну закономірність, нехарактерну для інших показників: у більшості пацієнтів його концентрація в сироватці крові є низькою — 76,3 пг/мл (74,4–110,7), проте у 8 пацієнтів — значно вище середнього показника — 1027,5 пг/мл (282,4–1685,9). В осіб контрольної групи високий рівень ІЛ-2 виявлено у 3 обстежених.
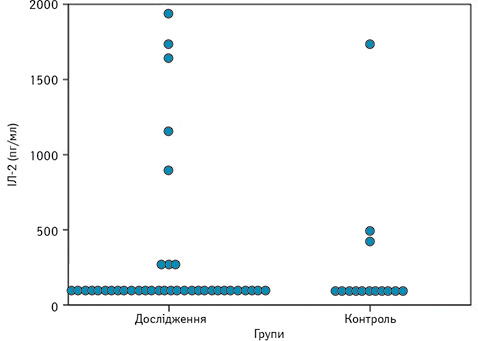
Проаналізувавши особливості пацієнтів з високим рівнем IЛ-2, у них встановлено достовірно нижчий рівень VEGF-A (р=0,006) та вищий рівень С-реактивного білка з достовірністю на рівні тенденції (p=0,088). Інших зв’язків з лабораторними показниками чи клінічними проявами захворювання не виявлено. Подальше дослідження на більшій кількості пацієнтів, ймовірно, дозволить виявити інші специфічні характеристики пацієнтів з високим рівнем ІЛ-2.
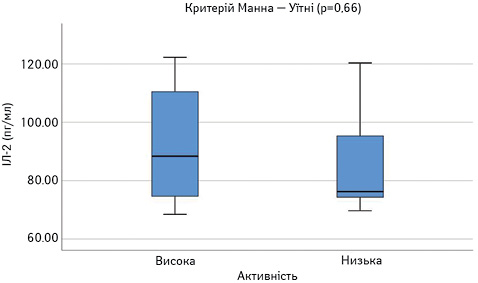
Далі порівняли досліджувані параметри у групах пацієнтів з низькою чи помірною (SLEDAI=1–10) та високою активністю (SLEDAI >10). Результати наведено на рис. 8–13. Достовірно вищими у пацієнтів з високою активністю виявилися показники САА, VEGF-A та ET-1.
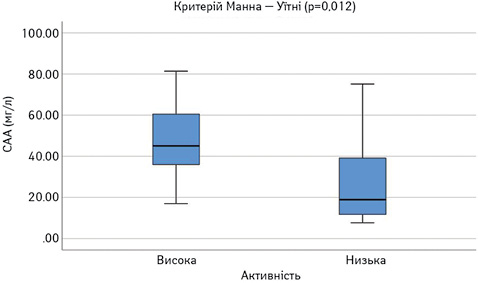
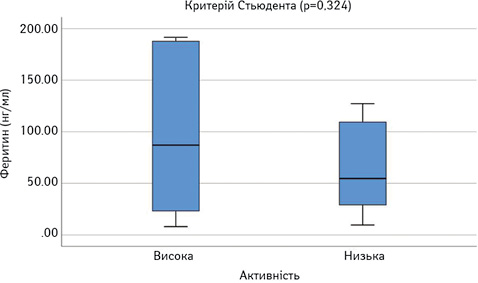
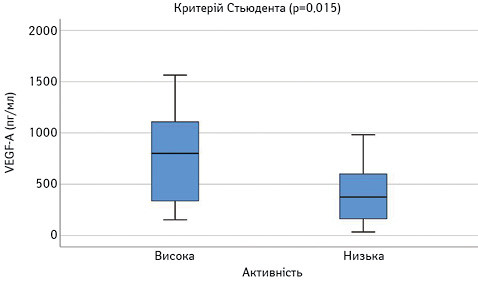
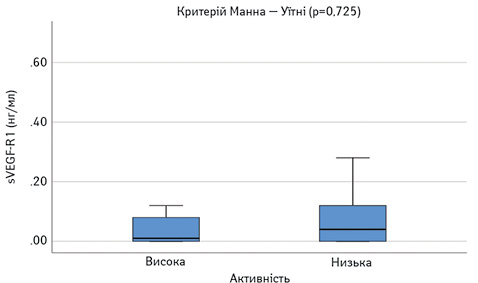
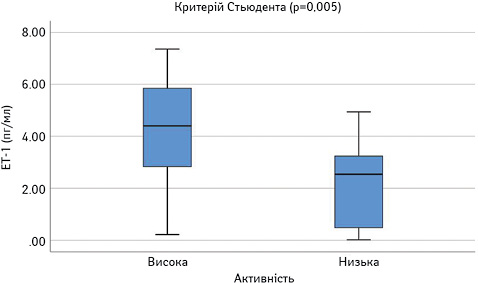
При проведенні ROC-аналізу для оцінки досліджуваних параметрів як маркерів високої активності СЧВ виявлено, що показник «площа під кривою» для ЕТ-1 та CAA є достовірно вищим за 0,5 (табл. 1). Це свідчить про їх хорошу здатність диференціювати хворих на СЧВ з високою та низькою/помірною активністю захворювання.
Таблиця 1. Показники ROC-аналізу досліджуваних показників як маркерів високої активності СЧВ
| Площа під кривою | Стандартна похибка | Рівень значимості, р | 95% Довірчий інтервал | ||
|---|---|---|---|---|---|
| Нижня межа | Верхня межа | ||||
| ІЛ-2, пг/мл | 0,450 | 0,150 | 0,745 | 0,155 | 0,745 |
| СAA, мг/л | 0,817 | 0,109 | 0,039 | 0,604 | 1,000 |
| Феритин, нг/мл | 0,667 | 0,147 | 0,278 | 0,378 | 0,955 |
| VEGF-А, пг/мл | 0,733 | 0,139 | 0,129 | 0,460 | 1,000 |
| sVEGF-R1, нг/мл | 0,608 | 0,154 | 0,481 | 0,306 | 0,911 |
| EТ-1, пг/мл | 0,783 | 0,118 | 0,065 | 0,552 | 1,000 |
Нижче наведено їх Cut-off значення та відповідні чутливість і специфічність:
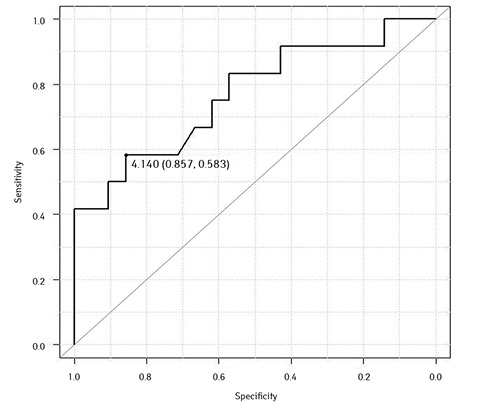
ЕТ-1 = 4,14 (чутливість 0,583; специфічність 0,857) (рис. 14);
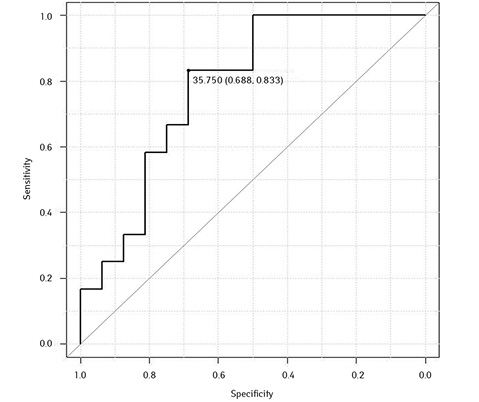
САА = 35,75 (чутливість 0,833; специфічність 0,688) (рис. 15).
Результати проведення бінарної логістичної регресії (табл. 2) дозволили створити математичну модель взаємозв’язку між підвищенням концентрації САА та ЕТ-1 в сироватці крові та високою активністю захворювання. Рівняння, що описує цей зв’язок, має наступний вигляд (Y — ймовірність того, що у пацієнта із заданими значеннями ЕТ-1 та САА відзначається висока активність СЧВ):
Таблиця 2. Показники бінарної логістичної регресії для САА та ЕТ-1 як маркерів високої активності СЧВ
| Назва | Коефіцієнт | Стандартна похибка | Значимість (p) |
|---|---|---|---|
| Базове значення | –8,32 | 3,666 | 0,0232 |
| САА | 0,09 | 0,042 | 0,0409 |
| ЕТ-1 | 1,39 | 0,707 | 0,0487 |
Y = e–8,32+1,39·(ЕТ-1)+0,09·(САА)/(1+ e–8,32+1,39·(ЕТ-1)+0,09·(САА))
або
lnY/(1–Y)=–8,32+1,39·(ЕТ-1)+0,09·(САА).
Наступним кроком було визначення кореляційних зв’язків досліджуваних лабораторних показників між собою (табл. 3) та з рутинними загальноклінічними показниками у хворих на СЧВ (табл. 4).
Бачимо, що рівні ІЛ-2 та sVEGF-R1 не корелюють з жодним з інших показників. В той же час для решти (окрім пари феритин — ЕТ-1) існують достовірні прямі кореляційні зв’язки, що вказує на синергічність їх прозапальних властивостей (див. табл. 3).
Таблиця 3. Взаємні кореляційні зв’язки досліджуваних лабораторних показників сумарно в обох групах
(метод рангової кореляції Спірмена, *зв’язок достовірний при р<0,05)
| ІЛ-2, пг/мл | СAA, мг/л | Феритин, нг/мл | VEGF-А, пг/мл | sVEGF-R1, нг/мл | EТ-1, пг/мл | |
|---|---|---|---|---|---|---|
| ІЛ-2, пг/мл | – | –0,045 | –0,069 | –0,096 | –0,052 | 0,013 |
| СAA, мг/л | –0,045 | – | 0,301* | 0,535* | 0,212 | 0,447* |
| Феритин, нг/мл | –0,069 | 0,301* | – | 0,368* | 0,181 | 0,027 |
| VEGF-A, пг/мл | –0,096 | 0,535* | 0,368* | – | 0,204 | 0,442* |
| sVEGF-R1, нг/мл | –0,052 | 0,212 | 0,181 | 0,204 | – | 0,222 |
| EТ-1, пг/мл | 0,013 | 0,447* | 0,027 | 0,442* | 0,222 | – |
Нижче наведено коментарі з приводу виявлених кореляційних зв’язків (див. табл. 4).
Таблиця 4. Кореляційні зв’язки досліджуваних лабораторних показників з рутинними загальноклінічними показниками у дослідній групі (метод рангової кореляції Спірмена, *зв’язок достовірний при р<0,05)
| ІЛ-2, пг/мл | СAA, мг/л | Феритин, нг/мл | VEGF-А, пг/мл | sVEGF-R1, нг/мл | EТ-1, пг/мл | |
|---|---|---|---|---|---|---|
| Лейкоцити, 109/л | 0,140 | 0,275 | 0,364 | 0,276 | 0,127 | 0,150 |
| Лімфоцити, 109/л | 0,162 | –0,165 | 0,046 | –0,195 | 0,144 | –0,207 |
| Гранулоцити, 109/л | 0,103 | 0,360* | 0,411* | 0,345* | 0,114 | 0,291 |
| Гранулоцити/лімфоцити | –0,059 | 0,538* | 0,310 | 0,525* | –0,056 | 0,385* |
| Гемоглобін, г/л | –0,007 | –0,333 | 0,093 | –0,193 | 0,104 | –0,317 |
| Тромбоцити, 109/л | –0,118 | 0,490* | –0,263 | 0,171 | –0,238 | 0,077 |
| ШОЕ, мм/год | –0,113 | 0,318 | 0,037 | 0,164 | 0,003 | 0,534* |
| АлАТ, Од/л | 0,091 | 0,057 | 0,415* | 0,075 | 0,017 | –0,063 |
| Креатинін, ммоль/л | –0,084 | 0,332 | 0,475* | 0,236 | 0,422* | 0,109 |
| Глюкоза, ммоль/л | –0,472* | –0,005 | 0,236 | –0,010 | 0,156 | –0,255 |
| С-реактивний білок, мг/л | 0,099 | 0,104 | –0,141 | –0,205 | 0,015 | –0,102 |
| Сечова кислота, ммоль/л | 0,074 | –0,096 | 0,462* | –0,053 | 0,021 | 0,079 |
| Холестерин загальний, ммоль/л | –0,128 | 0,211 | 0,092 | 0,137 | –0,092 | 0,226 |
Гранулоцитарно-лімфоцитарне співвідношення (ГЛС) або його аналог нейтрофільно-лімфоцитарне співвідношення (НЛС) є відомим маркером активності запального процесу при ряді захворювань: сепсис, COVID-19, онкопатологія, серцево-судинні захворювання. Також існують докази його кореляції з активністю захворювання при СЧВ. Отримані дані показують зв’язок ГЛС з іншими маркерами запального процесу при цьому захворюванні, зокрема VEGF-A, ET-1, CAA [15, 16].
Зв’язок САА з рівнем тромбоцитів (прямий) є типовим проявом запального процесу за медіації ІЛ-6, рівень якого підвищується в більшості пацієнтів з СЧВ та корелює з активністю захворювання [17].
Прямий кореляційний зв’язок сироваткової концентрації креатиніну з sVEGF-R1 та феритином, ймовірно, пов’язаний з підвищенням концентрації цих речовин при люпус-нефриті та, відповідно, їх участі в ураженні нирок [18, 19].
У попередніх дослідженнях встановлено кореляцію між рівнями сечової кислоти та феритину в сироватці крові як у здорових осіб [20], так і в хворих на подагру [21]. Отримані результати підтверджують цей зв’язок і для пацієнтів з СЧВ.
Стосовно зв’язку між рівнем феритину і АлАТ, а також ІЛ-2 та глюкози літературні дані обмежені.
Не виявлено кореляційних зв’язків між досліджуваними маркерами та рівнем С-реактивного білка, що підтверджує його недостатню інформативність як показника активності СЧВ [22, 23]. Щодо ШОЕ, то виявлено достовірний прямий кореляційний зв’язок лише з рівнем ЕТ-1.
При порівнянні сироваткової концентрації досліджуваних маркерів у групах пацієнтів з наявністю чи відсутністю кожного конкретного клінічного прояву (на момент забору крові) виявлено наступні значимі закономірності (критерій Манна — Уїтні):
1. Рівень ЕТ-1 є достовірно вищим у пацієнтів з нефритом (р=0,045) та серозитом (р=0,007).
2. У пацієнтів з висипом за типом «метелика» виявлено вищі рівні VEGF-A (p=0,009) та САА (р=0,023).
3. Рівень ІЛ-2 є достовірно нижчим у пацієнтів з феноменом Рейно (р=0,041).
Серед отриманих результатів відомим фактом є підвищення ЕТ-1 при люпус-нефриті [24], інші потребують подальшого дослідження. Зокрема, про роль ІЛ-2 в патогенезі феномену Рейно відомо мало, проте існують дані про те, що ілопрост підвищує рівень IЛ-2 в сироватці крові у пацієнтів з феноменом Рейно при системному склерозі [25].
Варто зауважити, що в нашому дослідженні не підтверджено деякі раніше отримані дані, зокрема зв’язок рівня феритину з гематологічними показниками [8], підвищення VEGF-A в сироватці крові при люпус-нефриті та у пацієнтів з вторинним феноменом Рейно [12], що, ймовірно, пов’язано з відносно невеликим розміром вибірки.
ВИСНОВКИ
1. Концентрація САА, феритину, VEGF-А, sVEGF-R1 та ЕТ-1 у сироватці крові є достовірно вищими у пацієнтів з СЧВ порівняно з контрольною групою.
2. За концентрацією ІЛ-2 в сироватці крові можна виділити групи з низьким та високим рівнем цього показника. У хворих на СЧВ з високим рівнем ІЛ-2 виявлено достовірно нижчий рівень VEGF-A (р=0,006) та вищий рівень С-реактивного білка з достовірністю на рівні тенденції (p=0,088).
3. ЕТ-1 та САА є маркерами високої активності СЧВ згідно з даними ROC-аналізу.
4. Виявлені зв’язки досліджуваних маркерів з клініко-лабораторними характеристиками пацієнтів потребують подальшого дослідження на більшій за чисельністю групі хворих на СЧВ для оцінки їх діагностичної значимості.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- 1. Liu C.C., Kao A.H., Manzi S. et al. (2013) Biomarkers in systemic lupus erythematosus: challenges and prospects for the future. Ther. Adv. Musculoskelet. Dis., 5(4): 210–33. doi.org/10.1177/1759720X13485503.
- 2. Yu H., Nagafuchi Y., Fujio K. (2021) Clinical and Immunological Biomarkers for Systemic Lupus Erythematosus. Biomolecules, 11(7): 928. doi.org/10.3390/biom11070928.
- 3. Arenas-Ramirez N., Woytschak J., Boyman O. (2015) Interleukin-2: Biology, Design and Application. Trends Immunol., 36(12): 763–777, doi.org/10.1016/j.it.2015.10.003.
- 4. Sedighi S., Aghaei M., Musavi S. et al. (2014). Relationship between Serum Level of Interleukin-2 in Patients with Systemic Lupus Erythematosus and Disease Activity in Comparison with Control Group. J. Clin. Diagnostic, 8(7): 16–18. doi.org/10.7860/JCDR/2014/7903.4602.
- 5. Bader L., Boyman O., Miro E. (2022). Raeber Low-dose interleukin-2 for the treatment of systemic lupus erythematosus: A systematic review and meta-analysis (preprint). medRxiv 12.02.22283038. doi.org/10.1101/2022.12.02.22283038.
- 6. Sack G.H. (2018) Serum amyloid A — a review. Mol. Med., 24(1): 46. doi.org/0.1186/s10020-018-0047-0.
- 7. Wang C.M., Deng J.H., Mao G.F. et al. (2020) Serum Amyloid A: A Potential Biomarker Assessing Disease Activity in Systemic Lupus Erythematosus. Med. Sci. Monit., Jun 25; 26: e923290. doi: 10.12659/MSM.923290. PMID: 32584794; PMCID: PMC7333508.
- 8. Gamal N.M., Khedr T.M., Ismail N.M. et al. (2020) Is it useful to measure serum ferritin level in systemic lupus erythematosus patients? Egyp. Rheumatol., 42(1): 17–21.
- 9. Shibuya M. (2011) Vascular Endothelial Growth Factor (VEGF) and Its Receptor (VEGFR) Signaling in Angiogenesis: A Crucial Target for Anti- and Pro-Angiogenic Therapies. Genes. Cancer, 2(12): 1097–105. doi.org/10.1177/1947601911423031.
- 10. Liu J., Wang X., Yang X. et al. (2015) Investigating the role of angiogenesis in systemic lupus erythematosus. Lupus, 24(6): 621–627.
- 11. Willis R., Smikle M., DeCeulaer K. et al. (2017). Clinical associations of proinflammatory cytokines, oxidative biomarkers and vitamin D levels in systemic lupus erythematosus. Lupus, 26(14): 1517–1527. doi.org/10.1177/0961203317706557.
- 12. Ghazali W.S.W., Iberahim R., Ashari N.S.M. (2017) Serum Vascular Endothelial Growth Factor (VEGF) as a Biomarker for Disease Activity in Lupus Nephritis. Malays. J. Med. Sci., 24: 62–72. doi.org/10.21315/mjms2017.24.5.7.
- 13. Neuhofer W., Pittrow D. (2006) Endothelin in human autoimmune diseases with renal involvement. Rheumatol. (Oxford), 45(3): 39–41. doi.org/10.1093/rheumatology/kel277.
- 14. Yoshio T., Masuyama J., Mimori A. et al. (1995) Endothelin-1 release from cultured endothelial cells induced by sera from patients with systemic lupus erythematosus. Ann. Rheum. Dis., 54(5): 361–365. doi.org/10.1136/ard.54.5.361.
- 15. Buonacera A., Stancanelli B., Colaci M. et al. (2022) Neutrophil to Lymphocyte Ratio: An Emerging Marker of the Relationships between the Immune System and Diseases. Int. J. Mol. Sci., 23(7): 3636. doi.org/10.3390/ijms23073636.
- 16. Wang L., Wang C., Jia X. et al. (2020) Relationship between Neutrophil-to-Lymphocyte Ratio and Systemic Lupus Erythematosus: A Meta-analysis. Clinics (Sao Paulo), 75: e1450. doi.org/10.6061/clinics/2020/e1450.
- 17. Tanaka T., Narazaki M., Kishimoto T. (2014) IL-6 in inflammation, immunity, and disease. Cold. Spring. Harb. Perspect. Biol., 6(10): a016295. doi.org/10.1101/cshperspect.a016295.
- 18. Edelbauer M., Kshirsagar S., Riedl M. et al. (2012) Soluble VEGF receptor 1 promotes endothelial injury in children and adolescents with lupus nephritis. Pediatr. Nephrol., 27(5): 793–800. doi.org/10.1007/s00467-011-2062-z.
- 19. Tripathy R., Panda A.K., Das B.K. (2015) Serum ferritin level correlates with SLEDAI scores and renal involvement in SLE. Lupus, 24(1): 82–9. doi.org/10.1177/0961203314552290.
- 20. Ghio A.J., Ford E.S., Kennedy T.P. et al. (2005) The association between serum ferritin and uric acid in humans. Free Radical Res., 39(3): 337–42. doi.org/10.1080/10715760400026088.
- 21. Fatima T., McKinney C., Major T.J. et al. (2018) The relationship between ferritin and urate levels and risk of gout. Arthritis Res. Ther., 20: 179. doi.org/10.1186/s13075-018-1668-y.
- 22. Rezaieyazdi Z., Sahebari M., Hatef M. et al. (2011) Is there any correlation between high sensitive CRP and disease activity in systemic lupus erythematosus? Lupus, 20(14): 1494–1500. doi:10.1177/0961203311418706.
- 23. Luo K.-L., Yang Y.-H., Lin et al. (2020) Differential parameters between activity flare and acute infection in pediatric patients with systemic lupus erythematosus. Sci. Rep., Nov 16; 10(1): 19913. doi:10.1038/s41598-020-76789-6. PMID: 33199770; PMCID: PMC7670442.
- 24. Neuhofer W., Pittrow D. (2006) Endothelin in human autoimmune diseases with renal involvement, Rheumatology, Vol. 45, Issue suppl. 3, Oct: iii39–iii41. doi.org/10.1093/rheumatology/kel277.
- 25. D’Amelio P., Cristofaro M.A., D’Amico L. et al. (2010) Iloprost modulates the immune response in systemic sclerosis. BMC Immunol., 11: 62. doi.org/10.1186/1471-2172-11-62.
Адреса для листування:
Дубас Віталій Васильович
03151, Київ, вул. Святослава Хороброго, 5
ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска Національної академії медичних наук України»
E-mail: vdubas1994@gmail.com

Leave a comment