ПЕРСПЕКТИВИ ЗАСТОСУВАННЯ ПРОБІОТИКІВ НА ОСНОВІ СПОР БАКТЕРІЙ РОДУ BACILLUS У КОМПЛЕКСНІЙ ТЕРАПІЇ ЗАХВОРЮВАНЬ ОПОРНО-РУХОВОГО АПАРАТУ
Головач І.Ю.1, Рекалов Д.Г. 2, Костенко В.О.3
- 1Клінічна лікарня «Феофанія» Державного управління справами
- 2Запорізький державний медичний університет
- 3Полтавський державний медичний університет
Резюме. У статті обговорюється роль порушення кількісного та якісного складу мікробіоти товстої кишки як чинника патогенезу запальних і аутоімунних захворювань опорно-рухового апарату. На підставі аналізу літературних джерел підтверджується доцільність застосування пробіотиків у ревматологічній практиці, акцентується увага на їх здатності полегшувати біль і запалення, покращувати метаболізм у хрящовій і кістковій тканинах, зменшувати вираженість клінічних проявів диспептичного синдрому при застосуванні антибіотиків. Відмічається потенційний ризик прозапальної гіперцитокінемії та розвитку аутоімунних реакцій при застосуванні пробіотиків, що містять молочнокислі бактерії. Зроблено висновок щодо доцільності застосування пробіотичних штамів спороутворювальних бактерій роду Bacillus, особливо їх багатокомпонентних композицій, як засобів профілактики та комплексної терапії захворювань опорно-рухового апарату, чому сприяє їх здатність відновлювати порушений внаслідок дисбіозу кишковий бар’єр, забезпечувати суттєву протизапальну й антиоксидантну дію, пов’язану із залученням провідних елементів систем внутрішньоклітинної сигналізації (транскрипційних факторів NF-κB і STAT, янус-кінази), обмежувати деградацію сполучної тканини позаклітинного матриксу.
DOI: 10.32471/rheumatology.2707-6970.89.17262
УДК 616.7:615.246-085
КИШКОВА МІКРОБІОТА ТА ДИСБІОЗ: РЕВМАТОЛОГІЧНІ АСПЕКТИ
 Резидентна (індигенна та факультативна) мікробіота кишечнику наявна в ньому тривалий час — до місяця і більше. Вона становить близько 400–500 видів, причому облігатних анаеробів (біфідобактерій, бактероїдів) у 10 разів більше, ніж аеробів (лактобактерій, ентерококів, кишкової палички). Максимальна щільність мікробного обсіменіння досягається в товстій кишці, де загальна біомаса мікробних клітин становить близько 2,5–3 кг, що відповідає 1011–1012 колонієутворювальних одиниць/мл (КУО/мл) кишкового вмісту.
Резидентна (індигенна та факультативна) мікробіота кишечнику наявна в ньому тривалий час — до місяця і більше. Вона становить близько 400–500 видів, причому облігатних анаеробів (біфідобактерій, бактероїдів) у 10 разів більше, ніж аеробів (лактобактерій, ентерококів, кишкової палички). Максимальна щільність мікробного обсіменіння досягається в товстій кишці, де загальна біомаса мікробних клітин становить близько 2,5–3 кг, що відповідає 1011–1012 колонієутворювальних одиниць/мл (КУО/мл) кишкового вмісту.
Саме резидентна коменсальна мікробіота створює на слизовій оболонці товстої кишки біоплівку, що складається з шару слизу, мікроколоній індигенних бактерій та їх метаболітів, молекул секреторного імуноглобуліну А. Таким чином, мікробне співтовариство набуває можливостей «суперорганізму», а саме здатності до «соціальної поведінки мікроорганізмів» через механізм «quorum sensing» (у перекладі з англ. — «відчуття достатності») [1].
До головних властивостей кишкової мікробіоти відносять такі: захисні (мікробний антагонізм), ферментативні (розщеплення клітковини, крохмалю, залишків харчових білків і жирів, органічних кислот), синтетичні (синтез вітамінів групи В, К, нікотинової кислоти, амінокислот тощо), імуногенні (вплив на вроджений та адаптивний імунітет) [2, 3]. Кишкова мікробіота також відіграє значну роль у когнітивних і поведінкових реакціях хазяїна.
Нині відомо, що до виконання цих функцій залучаються не тільки представники індигенної (головної, облігатної) мікробіоти — Bifidobacterium, Lactobacіllus, Bacteroides, Propionibacterium, але й факультативної (супутньої), представленої умовно-патогенними видами — Escherichia coli, Fusobacterium, Enterococcus, Clostridium та ін. Перевищення популяції останніх може викликати кишкові захворювання [4, 5].
Ще однією групою мікробіоценозу кишечнику є транзиторна (залишкова, алохтонна) мікробіота, представлена родами Staphylococcus, Enterobacter, Proteus, Klebsiella, Pseudomonas, Bacillus та ін.). Ці мікроорганізми потрапляють у кишечник із зовнішнього середовища і, як правило, через нетривалий час (2–3 доби) виводяться. За сучасними уявленнями, різні представники цієї групи можуть бути як умовно-патогенними, так і мати позитивне значення для функціонування мікробного співтовариства (запобігають колонізації кишечнику патогенами) та макроорганізму (покращують антиоксидантні та антирадикальні процеси) [6, 7].
Так, аеробні спороутворювальні бактерії роду Bacillus постійно потрапляють у систему травлення з навколишнього середовища або внаслідок споживання ферментованих продуктів харчування. При контакті зі слизовими оболонками спори цих мікроорганізмів переходять до вегетативного росту та залишаються в організмі хазяїна протягом деякого часу [8, 9]. Тривалість їх перебування в органах травлення, на думку дослідників, визначається генетичними особливостями штамів бацил або наявністю патологічних процесів у організмі хазяїна.
Видові та територіальні порушення кишкової мікробіоти зумовлюють розвиток дисбіозу кишечнику [2, 10]. У наш час цей стан вважається головною ланкою патогенезу низки захворювань: псевдомембранозного коліту (у зарубіжній літературі відомого як антибіотикоасоційований коліт), розвиток якого пов’язаний з дією Clostridium difficile, Enterococcus faecalis, Enterococcus faecium, E. coli та Bacteroides fragilis [11]. Окрім того, виявлено зв’язок порушень кишкової мікробіоти з розвитком виразкового коліту, колоректального раку, неалкогольного та алкогольного стеатогепатиту, ожиріння, цукрового діабету 2-го типу, атеросклерозу, аутоімунних захворювань, патології нервової системи (розсіяний склероз, полінейропатія, епілепсія, шизофренія, аутизм, депресія).
Нині все більше уваги звертають на взаємозв’язок між дисбіозом товстої кишки та розвитком патології опорно-рухового апарату. В останні десятиліття одержано докази щодо впливу дисбіозу кишечнику на баланс між про- та протизапальною відповіддю [12] та механізми деструкції хряща [13]. Все це може зумовлювати виникнення або розвиток низки ревматичних захворювань, таких як ревматоїдний артрит [14, 15], анкілозуючий спондилоартрит [16, 17], системний червоний вовчак [18, 19] та остеоартрит [20, 21]. Оскільки дисбіоз кишкової мікробіоти потенційно може бути усунений, він вважається перспективною мішенню для дії профілактичних або терапевтичних засобів, що можуть бути включені у комплексну терапію ревматичних захворювань [22]. Лікарські засоби, що застосовуються в ревматології (глюкокортикоїди, антибіотики, метотрексат, сульфасалазин, гідроксихлорохін, нестероїдні протизапальні препарати, біологічні хворобомодифікуючі протиревматичні засоби та ін.), у свою чергу, також можуть викликати розвиток дисбіозу в органах травлення [5, 23, 24].
Опублікований у березні 2022 р. метааналіз 92 досліджень підтвердив зв’язок дисбіозу кишечнику з ревматичними захворюваннями [22]. Хоча виявлено мало доказів щодо специфічних порушень кількісного та якісного складу мікробіоти товстої кишки, дослідники відмічають патогенетичну роль зменшення числа «протизапальних» мікроорганізмів (Faecalibacterium), які продукують бутират, і збільшення «прозапальних» бактерій (Streptococcus) при ревматоїдному артриті, синдромі Шегрена та системному червоному вовчаку.
Примітно, що експериментальне моделювання остеоартриту (інфрапателярна ін’єкція мононатрію йодоацетату) також може викликати розвиток дисбіозу: в кишковому вмісті щурів значно знижується кількість Bifidobacterium і Lactobacillus при вірогідному підвищенні числа Clostridium spp., умовно-патогенних ентеробатерій, лактонегативної E. coli, Staphylococcus aureus, Staphylococcus spp. та дріжджоподібних грибів роду Candida [25].
МЕХАНІЗМИ ПРОТИЗАПАЛЬНОЇ ДІЇ КИШКОВОЇ МІКРОБІОТИ
У нормі в кишечнику підтримується баланс між мікробіотою та місцевим (мукозальним) імунітетом. Так, слизова оболонка товстої кишки виробляє протизапальні цитокіни, такі як інтерлейкін (IL)-10, що сприяють толерантності до коменсальних бактерій і збереженню цілісності епітелію [26].
Кишкова мікробіота, в свою чергу, виявляє досить незначну експресію молекулярних структур, пов’язаних з патогенами (англ. Pathogen-Associated Molecular Patterns — PAMPs), недостатню для запуску через рецептори розпізнавання образів (англ. Pattern-Recognition Receptors — PRRs) прозапальних внутрішньоклітинних сигнальних шляхів (наприклад, асоційованих з транскрипційними факторами NF-κB, AP-1, STAT та ін.) [27, 28]. До того ж ентероцити в здоровому стані виявляють досить слабку експресію таких PRRs, як Тол-подібні рецептори (англ. Toll-like receptors — TLRs) 2-го та 4-го типів, що робить кишкові клітини нечутливими до дії бактеріальних ліпополісахаридів (LPS). Цьому також сприяє продукування ентероцитами TLR-інгібувального пептиду, що пригнічує сигнальні шляхи, опосередковані TLR2 і TLR4. Це також захищає хазяїна від запальної реакції на коменсальні мікроорганізми. Водночас стабільна експресія TLR3 і TLR5 робить епітеліоцити чутливими до інфікування ентеропатогенними бактеріями [29].
Іншим механізмом збереження толерантності кишки до симбіотичних бактерій є їх здатність знижувати убіквітинування інгібіторного білка IκB, що унеможливлює транслокацію NF-κB до ядра та подальшу експресію контрольованих ним генів багатьох прозапальних і прооксидантних білків [30]. Зниження рівня прозапальних цитокінів, включаючи IL-8, IL-12 та IL-23, забезпечує захисні ефекти та посилює дію протизапальних цитокінів, таких як IL-10 [31].
На здатність кишкової мікробіоти регулювати місцевий імунітет можуть впливати продукти ферментації харчових волокон — коротколанцюгові жирні кислоти (англ. Short-Chain Fatty Acids — SCFAs), які є монокарбоновими кислотами з довжиною ланцюга до 6 атомів карбону [31, 32]. Зазвичай ці сполуки (ацетат, пропіонат та бутират) діють локально — на імунні клітини, розташовані щільно в лімфоїдних відділах кишечнику, але можуть циркулювати та потрапляти у периферичні тканини.
Виявлено, що масляна кислота (бутират) здатна регулювати продукцію цитокінів Т-хелперами та сприяє цілісності кишкового бар’єру, що може обмежувати вплив на імунну систему слизової оболонки люмінальних мікроорганізмів і запобігати аномальним запальним реакціям [33]. Показано, що зменшення за умов дисбіозу утворення SCFAs, особливо ацетату, зумовлює порушення бар’єрної функції слизової оболонки кишечнику [34].
Один з головних механізмів протизапальної дії SCFAs реалізується через метаботропний G-білокзв’язувальний рецептор [35]. Серед SCFAs найважливішим посередником між коменсалами та хазяїном вважається бутират. Його рецептором у товстій кишці є GPR109A (від англ. G Protein-coupled Receptor 109A), відомий також як ніациновий рецептор. Передавання сигналу Gpr109a активує макрофаги товстої кишки та дендритні клітини, спонукаючи їх до індукції диференціювання Treg-лімфоцитів, що продукують IL-10 [36].
Слід звернути увагу на той факт, що GPR109A функціонує як блокатор LPS-індукованої активації NF-κB [37]. Сигнальний шлях NF-κB відіграє вирішальну роль не тільки у запаленні товстої кишки, а й у розвитку системної запальної відповіді, що є важливим чинником патогенезу остеоартриту [38]. Тобто активація GPR109A здатна ініціювати NF-κB-залежне гальмування синтезу прозапальних медіаторів, таких як IL-1β та IL-6, фактор некрозу пухлин альфа (TNF-α), індуцибельна NO-синтаза (iNOS), циклооксигеназа-2. Це дає підстави вважати, що GPR109A може бути потенційною терапевтичною мішенню для лікування запальних захворювань [27].
Інший механізм протизапального впливу SCFAs пов’язаний з впливом на ферменти, що регулюють ацетилювання залишків лізину в гістонах. Так, SCFAs пригнічують гістон-деацетилазу та підвищують активність гістон-ацетилтрансферази [39, 40]. Наслідком цього є епігенетичні посттрансляційні модифікації, реконфігурація хроматину, експресія генів і активація деяких факторів транскрипції [41]. Цей механізм згідно з сучасними уявленнями відіграє ключову роль у контролі різних імунних клітин, зниженні експресії прозапальних цитокінів, обмеженні системної запальної відповіді [31, 42].
Примітно, що дієта «західного типу», яка характеризується високою калорійністю, надмірною кількістю ліпідів і вуглеводів, а також низькою кількістю клітковини, викликає розвиток кишкового дисбіозу з підвищенням ризику запальних та аутоімунних захворювань [43]. Численні дослідження на тваринах показали, що надмірне споживання жиру та цукру викликає збільшення співвідношення представників Firmicutes/Bacteroidetes і підвищення проникності кишкового бар’єру [44]. Ці зміни пов’язані зі зростанням LPS у сироватці крові, що, як наслідок, призводить до розвитку синовіту та підвищує тяжкість остеоартриту [44, 45]. При цьому споживання харчових волокон позитивно впливає на мікробіоту кишечнику [46], а продукти їх бродіння чинять імунорегуляторну та протизапальну дію [47].
Розвиток кишкового дисбіозу при застосуванні антибіотиків широкого спектру дії супроводжується зниженням утворення SCFAs, що спричиняє гіперактивацію кишкових макрофагів і збільшення прозапальних Т-хелперів [48].
Таким чином, порушення кількісного та якісного складу мікробіоти товстої кишки може сприяти розвитку складних імуноопосередкованих розладів, патогенетично пов’язаних з розвитком системної запальної відповіді та аутоімунітету.
ПАТОГЕНЕТИЧНЕ ЗНАЧЕННЯ ОСІ КИШЕЧНИК — СУГЛОБИ
Розвиток кишкового дисбіозу значно обмежує протизапальні властивості кишкової мікробіоти та за умов порушеної бар’єрної функції слизової оболонки кишечнику створює умови для надходження вироблених мікроорганізмами PAMPs (LPS, пептидоглікан, флагелін, бактеріальна ДНК) у системний кровотік, що ініціює системну запальну відповідь [49, 50]. ДНК представників кишкової мікробіоти виявляється навіть у хрящі людини та миші [51]. Наслідком потрапляння PAMPs у тканини є розвиток низькоступеневого хронічного запалення, активація макрофагів та пошкодження суглобів. Такий патерн причинно-наслідкових відносин одержав назву «вісь кишечник — суглоби» [52].
Дійсно, нещодавно було показано, що підвищення рівня LPS і LPS-зв’язувального білка (LBP) корелює з тяжкістю остеоартриту колінного суглоба та великою кількістю активованих макрофагів у синовіальній оболонці [49]. Визначення концентрації циркулюючих LPS навіть рекомендується як перспективний засіб діагностики деяких фенотипів остеоартриту [53].
Z. Huang та співавтори [53, 54] запропонували 2-етапну модель LPS-індукованого остеоартриту. На 1-му етапі макрофаги суглобової тканини праймуються LPS через TLR4, на 2-му — активацію макрофагальних інфламасом забезпечують продукти деградації тканин суглоба, що розглядаються як молекулярні патерни, асоційовані з ушкодженням (англ. Damage-Associated Molecular Patterns — DAMPs). Згідно з цією моделлю в першу чергу активується вроджений імунітет, а потім розгортається системна та локальна запальна відповідь, наслідком чого є пошкодження суглобів через співіснуючі комплементарні механізми, такі як активація інфламасоми та деградація молекул хрящового матриксу [53].
Нині відомо 3 шляхи активації LPS-залежної системної запальної відповіді з наступним локальним запаленням суглобів [50] (рисунок):
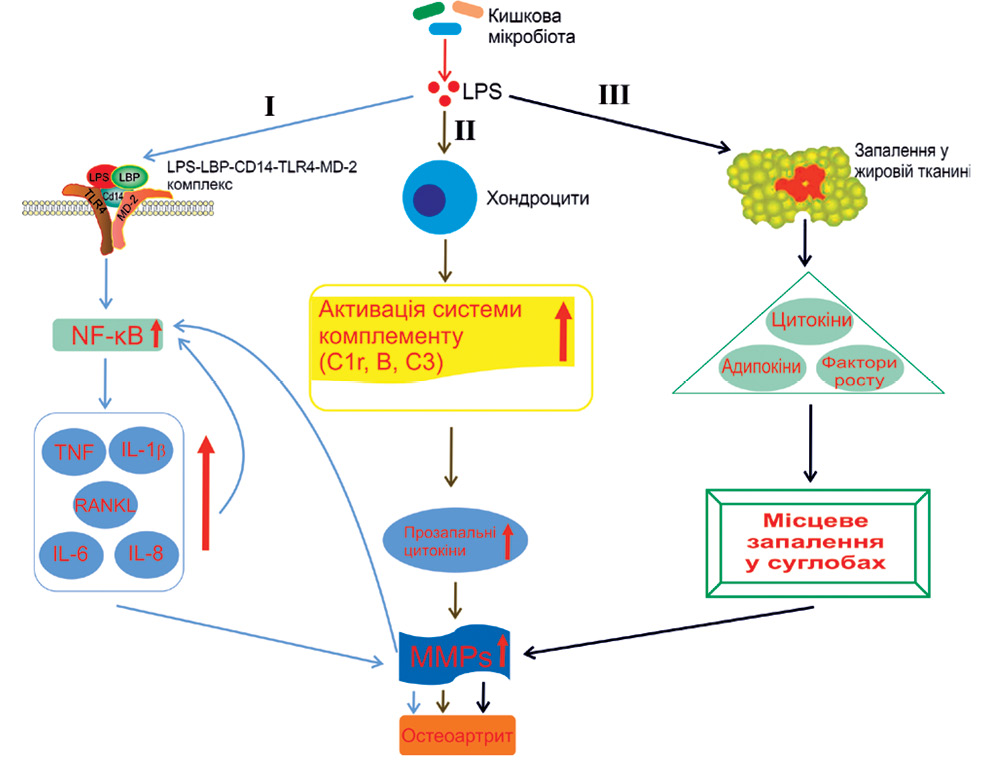
Примітки: LPS – ліпополісахарид; LBP – LPS-зв’язувальний білок; MD-2 – корецепторний білок мієлоїдної диференціації-2; NF-κB — ядерний фактор капа B; TNF – фактор некрозу пухлини; IL – інтерлейкін; RANKL – активатор рецептора ліганду NF-κB; MMPs — матриксні металопротеїнази.
1) через зв’язування комплексу CD14 — LPS — LPS-зв’язувальний білок (LBP) і TLR4, який експресується на плазматичній мембрані різних типів клітин, особливо моноцитів/макрофагів, разом з його корецепторним білком MD-2 (англ. Myeloid Differentiation protein-2) [55, 56]. Наслідком цього є активація NF-κB [57] з подальшим продукуванням у суглобах прозапальних цитокінів, таких як TNF-α, IL-1β, IL-6, IL-8 та активатор остеокластів RANKL (від англ. Receptor Activator of NF-κB Ligand);
2) шляхом активації системи комплементу в хондроцитах;
3) через LPS-індуковане запалення в жировій тканині, яке викликає системні зміни продукції цитокінів, адипокінів і факторів росту.
Прозапальна гіперцитокінемія супроводжується підвищенням вироблення матриксних металопротеїназ і зниженням синтезу колагену та протеогліканів. Це ще більше посилює активацію NF-κB і, нарешті, призводить до вторинного запалення тканин суглобів [50, 58];
Інший продукт кишкової мікрофлори — пептидоглікан — розпізнається ефекторами вродженого імунітету завдяки PRRs, відомим як NOD-подібні рецептори (англ. Nucleotide Oligomerization Domain-like receptors — NLRs) [59], що є основними компонентами (або попередниками) інфламасоми [60]. Крім того, бактеріальний пептидоглікан здатний стимулювати внутрішньосуглобові синовіальні фібробласти та індукувати експресію прозапальних цитокінів і матриксних металопротеїназ шляхом взаємодії з TLR2 на синовіальних фібробластах [61].
Все це свідчить, що зміни мікробіоти кишечнику за умов дисбіозу супроводжуються реалізацією декількох механізмів системної запальної відповіді (вісь кишечник — суглоби), наслідком чого може бути розвиток запальних захворювань суглобів.
ЗАСТОСУВАННЯ ПРОБІОТИКІВ ПРИ ЗАПАЛЬНИХ ЗАХВОРЮВАННЯХ ОПОРНО-РУХОВОГО АПАРАТУ
За визначенням Всесвітньої гастроентерологічної організації, пробіотики — це живі мікроорганізми, які при вживанні в адекватній кількості позитивно впливають на здоров’я організму хазяїна [62]. Найчастіше як пробіотики використовуються деякі види молочнокислих бактерій (Lactobacillus), біфідобактерій (Bifidobacterium), сахароміцетів (Saccharomyces cerevisiae), кишкова паличка (E. coli), а також окремі представники роду бацил (Bacillus).
У ревматологічній практиці лікування пробіотиками, за даними дослідників, зумовлює антиноцицептивну та протизапальну дію, покращує метаболізм у хрящовій і кістковій тканинах [63, 70], зменшує вираженість клінічних проявів диспептичного синдрому при застосуванні антибіотиків [5].
За наявності численних експериментальних наукових праць, що обґрунтовують доцільність використання пробіотиків у терапії захворювань суглобів [25, 64–69], позитивна дія молочнокислих і біфідобактерій при лікуванні остеоартиту підтверджується лише двома рандомізованими плацебо-контрольованими клінічними дослідженнями [70, 71]. Повідомляється про зниження у пацієнтів, які отримували Lactobacillus casei Shirota, концентрації С-реактивного білка у сироватці крові, що є маркером системної запальної відповіді [70]. У піддослідних щурів з експериментальним остеоартритом застосування пробіотичної композиції, яка відновлює кількісний та якісний склад мікробіоти товстої кишки (збільшує число Bifidobacterium, Lactobacillus та E. coli), позитивно впливає на вміст прозапальних цитокінів (IL-1β, TNF-α, інтерферону γ) та матриксних металопротеїназ у сироватці крові [65, 66]. Дослідниками виявлено позитивний ефект комбінованого застосування пробіотика та хондроїтинсульфату за умов експериментального остеоартриту, який може бути пов’язаний як з корекцією дисбіозу кишечнику, так і з можливим впливом хондроїтинсульфату та бактеріальних метаболітів на TLR2/4-залежний NF-κB-запальний шлях і метаболізм хрящової тканини [25, 67].
Незважаючи на те що пробіотичні бактерії загалом визнані безпечними, є повідомлення про побічну дію, викликану наявністю цих мікроорганізмів. Деякі з них, як виявилося, можуть викликати системні інфекції (аж до септичних станів за умов порушеного кишкового бар’єру та імунодефіцитів), стимулювати імунну систему, порушувати метаболізм і брати участь у горизонтальному перенесенні генів [72, 73]. У літературі повідомляється про деякі випадки бактеріємії, пов’язаної з Lactobacillus, у тому числі L. rhamnosus GG, L. casei та L. acidophilus [74–76]. Окрім того, описано 9 випадків сепсису, пов’язаного з S. boulardii, L. rhamnosus GG, Bifidobacterium breve, Bacillus subtilis або комбінацією пробіотичних бактерій [72].
Певний ризик для використання пробіотиків, що містять молочнокислі бактерії, може бути пов’язаний із їх імуногенними ефектами, зокрема представники роду Lactobacillus спроможні стимулювати продукцію прозапальних цитокінів Т-хелперами 1-го типу (штами біфідобактерій забезпечували більш протизапальний профіль) [77]. На мишачій моделі червоного вовчака виявлено здатність L. reuteri стимулювати аутоімунітет [78].
До того ж лактобацили та біфідобактерії вирізняються дуже повільним ростом та вираженою чутливістю до шлункового соку, що може негативним чином позначитися на них у ході транзитного переміщення травним каналом [79].
Останніми роками одержала підтримку точка зору, що вплив пробіотиків, а також бактерій, які колонізують їжу, навряд чи полягає в їх здатності прищеплюватися до резидентної мікробіоти, яка утворює досить стабільну біоплівку. Така дія пробіотичних мікроорганізмів швидше пов’язана з обміном генами та метаболітами, підтримкою проблемної мікробіоти та безпосереднім впливом на епітеліальні та імунні клітини [80].
Ці результати обґрунтовують необхідність розширення пошуку безпечних пробіотиків для потреб ревматології, здатних позитивно впливати на патогенез захворювань опорно-рухового апарату. Такі засоби, на нашу думку, можуть містити представників транзиторної мікробіоти, яка хоч і має обмежений час перебування в кишечнику, але здатна посилювати кишковий бар’єр, коригувати імунологічні, прозапальні та метаболічні порушення, пов’язані з дисбіозом кишечнику та основним захворюванням.
БАКТЕРІЇ РОДУ BACILLUS ЯК ПРОБІОТИКИ ТА ПЕРСПЕКТИВИ ЇХ ВИКОРИСТАННЯ В КОМПЛЕКСНІЙ ТЕРАПІЇ ЗАХВОРЮВАНЬ ОПОРНО-РУХОВОГО АПАРАТУ
Аеробні бактерії роду Bacillus родини Bacillaceae, що утворюють термостійкі ендоспори, є значно поширеними в навколишньому середовищі (воді, повітрі, ґрунті та харчових продуктах) [9]. Як наслідок, вони постійно потрапляють у шлунково-кишковий тракт та дихальні шляхи, засіваючи ці відділи. Кількість бацил у кишечнику може досягати 107 КУО/г, що взагалі відповідає чисельності Lactobacillus. У зв’язку з цим бактерії роду Bacillus розглядаються як одна з домінуючих складових мікробіоценозу товстої кишки разом із молочнокислими бактеріями [8, 81]. Наприклад, додавання широко відомого штаму B. subtilis natto, що використовується в Японії для ферментації бобів, до культури Lactobacillus посилює ріст та життєздатність останньої (припускають, що за рахунок продукування каталази та субтилізину) [82]. Взагалі бактерії роду Bacillus, за винятком B. anthracis і B. cereus, мають довгу історію безпечного використання у ферментованих харчових продуктах у країнах Східної та Південно-Східної Азії [8].
Комерційними пробіотичними штамами бацил є B. subtilis, B. clausii, B. coagulans, B. licheniformis, B. polyfermenticus, B. pumilus, B. megaterium, B. amyloliquefaciens і B. cereus. Спори цих бактерій виявляють більшу стійкість до дії температури, підвищеної кислотності шлункового соку, жовчі, є технологічними у виробництві та стабільними при зберіганні [8, 9]. При потраплянні в кишечник спори бацил піддаються процесам гермінації та проліферації, що забезпечує функціональну активність цих мікроорганізмів [83]. Вегетативні клітини деяких бацил (наприклад B. subtilis) також виявилися здатними виживати при проходженні шлунково-кишкового тракту [8].
На основі пробіотичних штамів бацил створено препарати для профілактики та лікування дисбіозу кишечнику, антибіотикасоційованої діареї, кишкових інфекцій, синдрому подразненого кишечнику, корекції імунного статусу.
Нині досить добре відомими є антимікробні, протипухлинні, антиоксидантні та вітамінні властивості цих мікроорганізмів, про що свідчить низка оглядових і оригінальних публікацій [7–9, 81, 84–89]. Однією з головних біологічних властивостей бацил, що визначають їх пробіотичний потенціал, на думку науковців, є антагонізм щодо широкого спектра патогенних та умовно-патогенних мікроорганізмів. Повідомляється про існування близько 800 антибактеріальних сполук, що можуть синтезуватися бактеріями роду Bacillus, більшість з яких є поліпептидами [9, 88–92]. Крім того, деякі пептиди та гексадеканова кислота є перспективними сполуками проти SARS-CoV-2, що може мати велике значення для боротьби з пандемією COVID-19 [93, 94].
Проте в плані перспективи використання бактерій роду Bacillus як пробіотиків у комплексній терапії захворювань опорно-рухового апарату найбільший інтерес викликає протизапальний потенціал цих мікроорганізмів.
Виявлено, що екзополісахариди (EPS) бацил виявляють істотну протизапальну ефективність, антиоксидантну та протипухлинну активність [95–97]. У літературі обговорюється можливість використання EPS бактерій роду Bacillus як протимікробного лікарського засобу [9]. Показано, що олігосахарид, який виробляється B. subtilis, модулює продукцію цитокінів, пов’язаних з T-хелперами 1-го і 2-го типів [98]. Протизапальний механізм EPS B. subtilis може бути пов’язаний з поляризацією макрофагів у бік формування фенотипу М2 [99], а також зі зниженням експресії янус-кіназ (англ. Janus kinase 1 — JAK1) та транскрипційних факторів STAT6 і NF-κB [100].
Оброблення культури клітин кишкового епітелію штамами B. subtilis значно обмежує вивільнення прозапального IL-8 на різні стимули (IL-1β, дезоксиніваленол і флагелін) [101]. Ці мікроорганізми обмежують ядерну транслокацію NF-κB, індуковану IL-1β, шляхом порушення деградації IκB, а також значно знижують регуляцію рівня білка iNOS, що ще більше підкреслює протизапальний потенціал бактерій. Експериментальні результати показали, що один із трьох протестованих штамів B. subtilis істотно зміцнює цілісність кишкового бар’єру шляхом посилення експресії білків щільного з’єднання.
Цінною властивістю пробіотичних штамів B. subtilis є їх здатність обмежувати деградацію сполучної тканини позаклітинного матриксу [102].
Незважаючи на наявність фармакологічної дії, деякі з представників роду Bacillus можуть викликати небажані ефекти [87]. Так, застосування пробіотиків B. cereus створює ризик утворення ентеротоксину та розвитку діареї та блювання. Подібні випадки описано при застосуванні B. cereus, B. licheniformis і B. subtilis, водночас штами B. coagulans, B. subtilis PY79 і BS3, B. licheniformis BL31 і B. indicus не чинять токсичної дії.
Одним з найбільш перспективних шляхів оптимізації позитивної дії мікроорганізмів та уникнення побічних ефектів є створення та використання багатокомпонентних пробіотиків. Прикладом таких продуктів є препарат Ремедіум (Sirion), який містить 5 видів полірезистентних до антибіотиків штамів бактерій роду Bacillus (B. subtilis, B. licheniformis, B. amyloliquefaciens, B. pumilus і B. megaterium). Безпека композиції підтверджена висновками Управління з контролю за харчовими продуктами та лікарськими засобами США (англ. Food and Drug Administration — FDA). Одна доза препарату містить 1,7·109 КУО/флакон живих мікробних клітин. Зазначені пробіотичні штами виявляють антагоністичну активність до широкого спектра умовно-патогенних культур різних видів мікроорганізмів, особливо до бактерій роду Staphylococcus, Proteus і грибів роду Candida [88].
ВИСНОВКИ
1. Порушення кількісного та якісного складу мікробіоти товстої кишки, здатної за фізіологічних умов регулювати вроджений та адаптивний імунітет та попереджувати розвиток системної запальної відповіді, що зумовлює реалізацію патогенного потенціалу осі кишечник — суглоби, є важливим чинником патогенезу запальних і аутоімунних захворювань опорно-рухового апарату.
2. Сучасні літературні джерела підтверджують доцільність використання пробіотиків у ревматологічній практиці, вказуючи на їх роль у зменшенні вираженості болю і запалення, покращенні метаболізму в хрящовій і кістковій тканинах, зменшенні вираженості клінічних проявів диспептичного синдрому при застосуванні антибіотиків. Проте використання пробіотиків, що містять молочнокислі бактерії, може підвищувати ризик прозапальної гіперцитокінемії та розвитку аутоімунних реакцій.
3. Обґрунтовується доцільність використання пробіотичних штамів спороутворювальних бактерій роду Bacillus як засобів профілактики та комплексної терапії захворювань опорно-рухового апарату на підставі їх властивостей відновлювати порушений внаслідок дисбіозу кишковий бар’єр, забезпечувати суттєву протизапальну і антиоксидантну дію, пов’язану із залученням провідних елементів систем внутрішньоклітинної сигналізації (транскрипційних факторів NF-κB і STAT, янус-кіназ), обмежувати деградацію сполучної тканини позаклітинного матриксу.
4. Одним з найбільш перспективних шляхів оптимізації позитивної дії мікроорганізмів роду Bacillus та уникнення їх побічних ефектів є створення та використання багатокомпонентних пробіотиків на основі композицій найбільш перспективних штамів бацил.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- 1. Abisado R.G., Benomar S., Klau J.R. et al. (2018) Bacterial Quorum Sensing and Microbial Community Interactions. mBio, 9(3): e02331-17.
- 2. Pushpanathan P., Mathew G.S., Selvarajan S. et al. (2019) Gut microbiota and its mysteries. Indian J. Med. Microbiol., 37(2): 268–277.
- 3. Cristofori F., Dargenio V.N., Dargenio C. et al. (2021) Anti-Inflammatory and Immunomodulatory Effects of Probiotics in Gut Inflammation: A Door to the Body. Front. Immunol., 12: 578386.
- 4. Широбоков В.П., Янковський Д.С., Димент Г.С. (2009) Мікробна екологія людини з кольоровим атласом: навч. посіб. Київ: Червона Рута Турс. 312 с.
- 5. Бережний В.В., Бондарець Ю.І. (2019) Порушення мікробіому товстого кишечника та його корекція у хворих на ювенільний ревматоїдний артрит. Современная педиатрия, (2): 76–84.
- 6. Safronova L.A., Zelena L.B., Klochko V.V. et al. (2012) Does the applicability of Bacillus strains in probiotics rely upon their taxonomy?, Can. J. Microbiol., 58(2): 212–219.
- 7. Safronova L.S., Skorochod I.A., Ilyash V.M. (2021) Antioxidant and Antiradical Properties of Probiotic Strains Bacillus amyloliquefaciens ssp. plantarum. Probiotics Antimicrob. Proteins, 13(6): 1585–1597.
- 8. Sorokulova I. (2013) Modern Status and Perspectives of Bacillus Bacteria as Probiotics. J. Prob. Health., 1(4): 1000e106.
- 9. Сафронова Л.А., Иляш В.М. (2017) Биосинтетическая активность бацилл, обусловливающая их пробиотический эффект. Мікробіол. журн., 79(6): 120–136.
- 10. Belizário J.E., Faintuch J. (2018) Microbiome and Gut Dysbiosis. Exp. Suppl., 109: 459–476.
- 11. Strati F., Pujolassos M., Burrello C. et al. (2021) Antibiotic-associated dysbiosis affects the ability of the gut microbiota to control intestinal inflammation upon fecal microbiota transplantation in experimental colitis models. Microbiome, 9(1): 39.
- 12. Van de Wiele T., Van Praet J. T., Marzorati M. et al. (2016) How the microbiota shapes rheumatic diseases. Nature reviews. Rheumatology, 12(7): 398–411.
- 13. Hernandez C.J. (2017) The Microbiome and bone and joint disease. Curr. Rheumatol. Rep., 19(12): 77.
- 14. Alpizar-Rodriguez D., Lesker T.R., Gronow A. et al. (2019) Prevotella copri in individuals at risk for rheumatoid arthritis. Ann. Rheum. Dis., 78(5): 590–593.
- 15. Kishikawa T., Maeda Y., Nii T. et al. (2020) Metagenome-wide association study of gut microbiome revealed novel aetiology of rheumatoid arthritis in the Japanese population. Ann. Rheum. Dis,.;79(1): 103–111.
- 16. Breban M., Tap J., Leboime A. et al. (2017) Faecal microbiota study reveals specific dysbiosis in spondyloarthritis. Ann. Rheum. Dis., 76(9): 1614–1622.
- 17. Yin J., Sternes P.R., Wang M. et al. (2020) Shotgun metagenomics reveals an enrichment of potentially cross-reactive bacterial epitopes in ankylosing spondylitis patients, as well as the effects of TNFi therapy upon microbiome composition. Ann. Rheum. Dis., 79(1): 132–140.
- 18. Tomofuji Y., Maeda Y., Oguro-Igashira E. et al. (2021) Metagenome-wide association study revealed disease-specific landscape of the gut microbiome of systemic lupus erythematosus in Japanese. Ann. Rheum. Dis., 80(12): 1575–1583.
- 19. Chen B.D., Jia X.M., Xu J.Y. et al. (2021) An autoimmunogenic and proinflammatory profile defined by the gut microbiota of patients with untreated systemic lupus erythematosus. Arthritis Rheumatol., 73(2): 232–243.
- 20. Huang Z., Chen J., Li B. et al. (2020) Faecal microbiota transplantation from metabolically compromised human donors accelerates osteoarthritis in mice. Ann. Rheum. Dis., 79(5): 646–656.
- 21. Wei J., Zhang C., Zhang Y. et al. (2021) Association between gut microbiota and symptomatic hand osteoarthritis: data from the Xiangya osteoarthritis study. Arthritis Rheumatol., 73(9): 1656–1662.
- 22. Wang Y., Wei J., Zhang W. et al. (2022) Gut dysbiosis in rheumatic diseases: A systematic review and meta-analysis of 92 observational studies. EBioMedicine, 80: 104055.
- 23. Сміян С.І., Юськевич В.В., Маховська О.С. (2020) Стан мікробіоти порожнини товстої кишки у пацієнтів з ревматоїдним артритом, асоційованим із Borrelia burgdorferi. Український ревматологічний журнал, (2): 9–13.
- 24. Zhang L., Chu C.Q. (2021) Gut Microbiota–Medication Interaction in Rheumatic Diseases. Front. Immunol., 12: 796865.
- 25. Короткий О.Г., Луговська Т.В., Сергійчук Т.М. та ін. (2020) Мікробіота кишечника щурів з експериментальним остеоартритом при застосуванні хондроітин сульфату та пробіотика. Мікробіол. журн., 82(6): 64–73.
- 26. Hyun J., Romero L., Riveron R. et al. (2015) Human intestinal epithelial cells express interleukin-10 through Toll-like receptor 4-mediated epithelial-macrophage crosstalk. J. Innate Immun., 7(1): 87–101.
- 27. Korotkyi O., Kyriachenko Y., Kobyliak N. et al. (2020) Crosstalk between gut microbiota and osteoarthritis: A critical view. J. Funct. Foods, 68: 103904.
- 28. Zheng D., Liwinski T., Elinav E. (2020) Interaction between microbiota and immunity in health and disease. Cell Res., 30(6): 492–506.
- 29. Cario E., Podolsky D.K. (2000) Differential alteration in intestinal epithelial cell expression of Toll-like receptor 3 (TLR3) and TLR4 in inflammatory bowel disease. Infection Immunity, 68(12): 7010–7017.
- 30. Neish A.S. (2002) The gut microflora and intestinal epithelial cells: A continuing dialogue. Microbes Infection, 4(3): 309–317.
- 31. Yoo J.Y., Groer M., Dutra S. et al. (2020). Gut Microbiota and Immune System Interactions. Microorganisms, 8(10): 1587.
- 32. Yap Y.A., Mariño E. (2018) An Insight Into the Intestinal Web of Mucosal Immunity, Microbiota, and Diet in Inflammation. Front. Immunol., 9: 2617.
- 33. Al Nabhani Z., Dulauro S., Marques R. et al. (2019) A Weaning Reaction to Microbiota Is Required for Resistance to Immunopathologies in the Adult. Immunity, 50(5): 1276–1288.e5.
- 34. De Palma G., Nadal I., Medina M. et al. (2010). Intestinal dysbiosis and reduced immunoglobulin-coated bacteria associated with coeliac disease in children. BMC Microbiol., 10: 63.
- 35. Tan J., McKenzie C., Potamitis M. et al. (2014) The role of short-chain fatty acids in health and disease. Adv. Immun., 121: 91–119.
- 36. Singh N., Gurav A., Sivaprakasam S. et al. (2014) Activation of Gpr109a, receptor for niacin and the commensal metabolite butyrate, suppresses colonic inflammation and carcinogenesis. Immunity, 40(1): 128–139.
- 37. Thangaraju M., Cresci G. A., Liu K. et al. (2009) GPR109A is a G-protein-coupled receptor for the bacterial fermentation product butyrate and functions as a tumor suppressor in colon. Cancer Res., 69(7): 2826-2832.
- 38. Рекалов Д.Г., Головач І.Ю., Костенко В.О. та ін. (2022) Фармакотерапія захворювань опорно-рухового апарату у пацієнтів з ризиком COVID-19-асоційованого тромбозапалення. Український ревматологічний журнал, (1): 1–9.
- 39. Vinolo M.A., Rodrigues H.G., Hatanaka E. et al. (2011). Suppressive effect of short-chain fatty acids on production of proinflammatory mediators by neutrophils. J. Nutr. Biochem., 22(9): 849–855.
- 40. Fellows R., Denizot J., Stellato C. et al. (2018) Microbiota derived short chain fatty acids promote histone crotonylation in the colon through histone deacetylases. Nat. Commun., 9(1): 105.
- 41. Mathias R.A., Guise A.J., Cristea I.M. (2015) Post-translational modifications regulate class IIa Histone Deacetylase (HDAC) function in health and disease. Mol. Cell. Proteomics, 14(3): 456–470.
- 42. Villagra A., Sotomayor E.M., Seto E. (2010) Histone deacetylases and the immunological network: Implications in cancer and inflammation. Oncogene, 29(2): 157–173.
- 43. Richards J.L., Yap Y.A., McLeod K.H. et al. (2016) Dietary metabolites and the gut microbiota: An alternative approach to control inflammatory and autoimmune diseases. Clin. Transl. Immunol., 5(5): e82.
- 44. Chisari E., Wouthuyzen-Bakker M., Friedrich A.W. et al. (2021) The relation between the gut microbiome and osteoarthritis: A systematic review of literature. PloS One, 16(12): e0261353.
- 45. Guido G., Ausenda G., Iascone V. et al. (2021) Gut permeability and osteoarthritis, towards a mechanistic understanding of the pathogenesis: a systematic review. Annals of medicine, 53(1): 2380–2390.
- 46. De Filippo C., Cavalieri D., Di Paola M. et al. (2010) Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. Proc. Natl. Acad. Sci U S A, 107(33): 14691–14696.
- 47. Macia L., Thorburn A.N., Binge L.C. et al. (2012) Microbial influences on epithelial integrity and immune function as a basis for inflammatory diseases. Immun. Rev., 245(1): 164–176.
- 48. Scott N.A., Andrusaite A., Andersen P. et al. (2018) Antibiotics induce sustained dysregulation of intestinal T cell immunity by perturbing macrophage homeostasis. Sci Transl Med., 10(464): eaao4755.
- 49. Huang Z.Y., Stabler T., Pei F. X. et al. (2016) Both systemic and local lipopolysaccharide (LPS) burden are associated with knee OA severity and inflammation. Osteoarthritis Cartilage, 24(10): 1769–1775.
- 50. Wei Z., Li F., Pi G. (2022) Association Between Gut Microbiota and Osteoarthritis: A Review of Evidence for Potential Mechanisms and Therapeutics. Front. Cell. Infect. Microbiol., 12: 812596.
- 51. Dunn C.M., Velasco C., Rivas A. et al. (2020) Identification of Cartilage Microbial DNA Signatures and Associations With Knee and Hip Osteoarthritis. Arthritis Rheumatol., 72(7): 1111–1122.
- 52. Hao X., Shang X., Liu J. et al. (2021) The gut microbiota in osteoarthritis: where do we stand and what can we do? Arthritis Res. Ther., 23(1): 42.
- 53. Huang Z., Kraus V.B. (2016) Does lipopolysaccharide-mediated inflammation have a role in OA?. Nature reviews. Rheumatology, 12(2): 123–129.
- 54. Huang Z.Y., Stabler T., Pei F.X. et al. (2016) Both Systemic and Local Lipopolysaccharide (LPS) Burden Are Associated With Knee OA Severity and Inflammation. Osteoarthr. Cartil., 24 (10): 1769–1775.
- 55. Akashi S., Ogata H., Kirikae F. et al. (2000) Regulatory Roles for CD14 and Phosphatidylinositol in the Signaling via Toll-Like Receptor 4-MD-2. Biochem. Biophys. Res. Commun., 268 (1): 172–177.
- 56. Cani P.D., Amar J., Iglesias M.A. et al. (2007) Metabolic Endotoxemia Initiates Obesity and Insulin Resistance. Diabetes, 56 (7): 1761–1772.
- 57. Nair A., Kanda V., Bush-Joseph C. et al. (2012) Synovial Fluid From Patients With Early Osteoarthritis Modulates Fibroblast-Like Synoviocyte Responses to Toll-Like Receptor 4 and Toll-Like Receptor 2 Ligands via Soluble CD14. Arthritis Rheum., 64 (7): 2268–2277.
- 58. Kapoor M., Martel-Pelletier J., Lajeunesse D. et al. (2011) Role of Proinflammatory Cytokines in the Pathophysiology of Osteoarthritis. Nat. Rev. Rheumatol., 7 (1): 33–42.
- 59. Clarke T.B., Davis K.M., Lysenko E.S. et al. (2010) Recognition of Peptidoglycan From the Microbiota by Nod1 Enhances Systemic Innate Immunity. Nat. Med., 16 (2): 228–231.
- 60. Zhao L.R., Xing R.L., Wang P.M. et al. (2018) NLRP1 and NLRP3 Inflammasomes Mediate LPS/ATP−induced Pyroptosis in Knee Osteoarthritis. Mol. Med. Rep., 17 (4): 5463–5469.
- 61. Kyburz D., Rethage J., Seibl R. et al. (2003) Bacterial Peptidoglycans But Not CpG Oligodeoxynucleotides Activate Synovial Fibroblasts by Toll-Like Receptor Signaling. Arthritis Rheum., 48 (3): 642–650.
- 62. Guarner F., Sanders M.E., Eliakim R. et al. (2017) Probiotics and prebiotics: World Gastroenterology Organisation Global Guidelines. 35 p.
- 63. Abdollahi-Roodsaz S., Abramson S.B., Scher J.U. (2016) The metabolic role of the gut microbiota in health and rheumatic disease: Mechanisms and interventions. Nature Reviews Rheumatology, 12(8): 446–455.
- 64. Amdekar S., Singh V., Singh R. et al. (2011) Lactobacillus casei reduces the inflammatory joint damage associated with collageninduced arthritis (CIA) by reducing the pro-inflammatory cytokines — Lactobacillus casei: COX-2 inhibitor. J. Clin. Immunol., 31(2): 147–154.
- 65. Korotkyi O.H., Vovk A.A., Dranitsina A.S. et al. (2019) The influence of probiotic diet and chondroitin sulfate administration on Ptgs2, Tgfb1 and Col2a1 expression in rat knee cartilage during monoiodoacetate-induced osteoarthritis. Minerva Medica, 110(5): 419–424.
- 66. Korotkyi O.H., Vovk A.A., Galenova T. et al. (2019) Effect of probiotic on serum cytokines and matrix metalloproteinases profiles during monoiodoacetate-induced osteoarthritis in rats. Minerva Biotecnologica., 31(2): 68–73.
- 67. Korotkyi O., Dvorshchenko K., Falalyeyeva T. et al. (2020) Combined effects of probiotic and chondroprotector during osteoarthritis in rats. Panminerva Med., 62(2): 93–101.
- 68. Tan T.C., Chong T., Low A. et al. (2021) Microbiome and osteoarthritis: New insights from animal and human studies. Int. J. Rheum. Dis., 24(8): 984–1003.
- 69. O-Sullivan I., Natarajan Anbazhagan A., Singh G. et al. (2022) Lactobacillus acidophilus Mitigates Osteoarthritis-Associated Pain, Cartilage Disintegration and Gut Microbiota Dysbiosis in an Experimental Murine OA Model. Biomedicines, 10(6): 1298.
- 70. Lei M., Guo C., Wang D. et al. (2017) The effect of probiotic Lactobacillus casei Shirota on knee osteoarthritis: a randomised double-blind, placebo-controlled clinical trial. Benef. Microbes., 8(5): 697–703.
- 71. Taye I., Bradbury J., Grace S. et al. (2020) Probiotics for pain of osteoarthritis; An N-of-1 trial of individual effects. Complement. Ther. Med., 54: 102548.
- 72. Doron S., Snydman D.R. (2015) Risk and safety of probiotics. Clin. Infect. Dis., 60 (Suppl 2): 129–134.
- 73. Zawistowska-Rojek A., Tyski S. (2018) Are Probiotic Really Safe for Humans? Pol. J. Microbiol., 67(3): 251–258.
- 74. De Groote M.A., Frank D.N., Dowell E. et al. (2005) Lactobacillus rhamnosus GG bacteremia associated with probiotic use in a child with short gut syndrome. Ped. Infect. Dis. J., 24: 278–280.
- 75. Ledoux D., Labombardi V.J., Karter D. (2006) Lactobacillus acidophilus bacteremia after use of a probiotic in a patient with AIDS and Hodgkin’s disease. Int. J. STD AIDS., 17: 280–282.
- 76. Vahabnezhad E., Mochon A.B., Wozniak L.J. et al. (2013) Lactobacillus bacteremia associated with pobiotic use in a pediatric patient with ulcerative colitis. J. Clin. Gastroenterol., 47: 437–439.
- 77. Dong H., Rowland I., Yaqoob P. (2012) Comparative effects of six probiotic strains on immune function in vitro. Br. J. Nutr., 108(3): 459–470.
- 78. Zegarra-Ruiz D.F., El Beidaq A., Iñiguez A.J. et al. (2019) A Diet-Sensitive Commensal Lactobacillus Strain Mediates TLR7-Dependent Systemic Autoimmunity. Cell Host Microbe, 25(1): 113–127.
- 79. Penaloza-Vazquez A. (2016). Bacillus species are Superior Probiotic Feed-Additives for Poultry. J. Bacteriol. Mycol., 3: 00023.
- 80. Wieërs G., Belkhir L., Enaud R. et al. (2020) How Probiotics Affect the Microbiota. Front. Cell. Infect. Microbiol., 9: 454.
- 81. Савустьяненко А. В. (2016) Механизмы действия пробиотиков на основе Bacillus subtilis. Актуальная инфектология, (2): 35–44.
- 82. Hosoi T., Ametani A., Kiuchi K. et al. (2000) Improved growth and viability of lactobacilli in the presence of Bacillus subtilis (natto), catalase, or subtilisin. Can. J. Microbiol., 46(10): 892–897.
- 83. Tam N.K., Uyen N.Q., Hong H.A. et al. (2006) The intestinal life cycle of Bacillus subtilis and close relatives. J. Bacteriol., 188(7): 2692–2700.
- 84. Потебня Г.П., Воєйкова І.М., Черемшенко Н.Л. та ін. (2008) Підвищення ефективності протипухлинної вакцини пробіотичним препаратом субалін. Онкологія, 10(2): 246–251.
- 85. Сорокулова И.Б., Рыбалко С.Л., Руденко А.А. и др. (2007) Пробиотик субалин — принципиально новый подход к лечению бактериальных и вирусных инфекций. К.: ДИА. 36.
- 86. Колоскова О.К., Білоус Т.М., Гарас М.Н. (2014) Патогенетичне обґрунтування оптимізації лікування вірусних діарей у дітей за допомогою спороутворювальних бацил, здатних до самоелімінації. Актуальна інфектологія, 3: 49–52.
- 87. Lee N.K., Kim W.S., Paik H.D. (2019) Bacillus strains as human probiotics: characterization, safety, microbiome, and probiotic carrier. Food Sci Biotechnol., 28(5): 1297–1305.
- 88. Сафронова Л.А., Скороход І.О. (2021) Потенціал бактерій роду Bacillus як пробіотиків. Здоров’я України, 13–14: 14–15.
- 89. Tenea G.N., Gonzalez G.L., Moreno J.L. (2022) Probiotic Characteristics and Antimicrobial Potential of a Native Bacillus subtilis Strain Fa17.2 Rescued from Wild Bromelia sp. Flowers. Microorganisms, 10(5): 860.
- 90. Stein T. (2005) Bacillus subtilis antibiotics: structures, syntheses and specific functions. Mol. Microbiol., 56(4): 845–857.
- 91. Awais M., Pervez A., Qayyum S. et al. (2008) Effects of glucose, incubation period andpH on the production of peptide antibiotics by Bacillus pumilus. Afr. J. Microbiol. Res., 2: 114–119.
- 92. Sang Y., Blecha F. (2008) Antimicrobial peptides and bacteriocins: alternatives to traditional antibiotics. Anim. Health Res. Rev., 9(2): 227–235.
- 93. Padhi S., Sanjukta S., Chourasia R. et al. (2021) A Multifunctional Peptide From Bacillus Fermented Soybean for Effective Inhibition of SARS-CoV-2 S1 Receptor Binding Domain and Modulation of Toll Like Receptor 4: A Molecular Docking Study. Front. Mol. Biosci., 8: 636647.
- 94. Alam S., Sadiqi S., Sabi M. et al. (2022) Bacillus species; a potential source of anti-SARS-CoV-2 main protease inhibitors. J. Biomol. Struct. Dyn., 40(13): 5748–5758.
- 95. Bouallegue A., Casillo A., Chaari F. et al. (2020) Levan from a new isolated Bacillus subtilis AF17: purification, structural analysis and antioxidant activities. Int. J. Biol. Macromol., 144: 316–324.
- 96. Yousef R.H., Baothman O., Abdulaal W.H. et al. (2020) Potential antitumor activity of exopolysaccharide produced from date seed powder as a carbon source for Bacillus subtilis. J. Microbiol. Methods., 170: 105853.
- 97. Sathishkumar R., Kannan R., Jinendiran S. et al. (2021) Production and characterization of exopolysaccharide from the sponge-associated Bacillus subtilis MKU SERB2 and its in-vitro biological properties. Int. J. Biol. Macromol., 166: 1471–1479.
- 98. Bang M.A., Seo J.H., Seo J.W. et al. (2015) Bacillus subtilis KCTC 11782BP-produced alginate oligosaccharide effectively suppresses asthma via T-helper cell type 2-related cytokines. PLoS ONE, 10(7): e0130510.
- 99. Li R., Kou X., Tian J. et al. (2014) Effect of sulfur dioxide on inflammatory and immune regulation in asthmatic rats. Chemosphere, 112: 296–304.
- 100. Zhang L., Yi H. (2022) An exopolysaccharide from Bacillus subtilis alleviates airway inflammatory responses via the NF-κB and STAT6 pathways in asthmatic mice. Biosci Rep., 42(1): BSR20212461.
- 101. Rhayat L., Maresca M., Nicoletti C. et al. (2019) Effect of Bacillus subtilis Strains on Intestinal Barrier Function and Inflammatory Response. Front. Immunol., 10: 564.
- 102. Sojan J.M., Raman R., Muller M. et al. (2022) Probiotics Enhance Bone Growth and Rescue BMP Inhibition: New Transgenic Zebrafish Lines to Study Bone Health. Int. J. Mol. Sci., 23(9): 4748.
Адреса для листування:
Головач Ірина Юріївна — доктор медичних наук,
професор, заслужений лікар України,
керівник центру ревматології, остеопорозу та
імунобіологічної терапії Клінічної лікарні
«Феофанія» ДУС, Київ
03423, Київ, вул. Заболотного, 21
E-mail: golovachirina@gmail.com

Leave a comment