Рекомендації щодо алгоритму ведення пацієнтів із остеоартрозом колінного суглоба в Європі та по всьому світу: звіт спеціальної комісії Європейського товариства з вивчення клінічних та економічних аспектів остеопорозу та остеоартрозу (ESCEO)
Bruyère Olivier, PhD1, Cooper Cyrus, MD, PhD(c)2, Pelletier Jean-Pierre, MD, PhD3, Branco Jaime, MD4, Brandi Maria Luisa, MD5, Guillemin Francis, MD, PhD6, Hochberg Marc C., MD, PhD(h,i)7, Kanis John A., MD8, Kvien Tore K., MD, PhD9, Martel-Pelletier Johanne, PhD3, Rizzoli René, MD, PhD10, Silverman Stuart, MD(n)11, Reginster Jean-Yves, MD, PhD1
- 1Відділення епідеміології та біостатистики, Департамент громадського здоров’я, епідеміології та економіки охорони здоров’я, Льєжський університет, Госпіталь Сарт Тільман, 4000 Льєж, Бельгія
- 2Відділення способу життя та епідеміології MRC, Університет Саутгемптону, Саутгемптон, Великобританія
- 3Відділення досліджень остеоартрозу, Дослідний центр на базі Госпіталю Монреальського університету (CRCHUM), Монреаль, Квебек, Канада
- 4Департамент ревматології, факультет de Ciências Médicas, Університет Nova de Lisboa/CHLO, EPE-Hospital Egas Moniz, Лісабон, Португалія
- 5Департамент внутрішньої медицини, Університет Флоренції, Флоренція, Італія
- 6Université de Lorraine, Université Paris Descartes, Нансі, Франція
- 7Система охорони здоров’я, Балтимор, Меріленд
- 8Центр співпраці з ВООЗ з питань метаболічних захворювань кісток, Шеффілдський університет, Шеффілд, Великобританія
- 9Департамент ревматології, Госпіталь Д’яконхьєммет, Осло, Норвегія
- 10Підрозділ захворювань кісток, Медичний факультет та Госпіталь Женевського університету, Женева, Швейцарія
- 11Клінічний дослідний центр ОМС, Беверлі-Гіллз, Каліфорнія
Резюме. У чинних практичних настановах з остеоартрозу (ОА) аналізують дані, які обґрунтовують кожен із запропонованих типів лікування, але не розподіляють усі види терапії за пріоритетом у певній послідовності. Мета — розроблення алгоритму терапевтичних рекомендацій, які лікарю легше інтерпретувати на підставі наявних підтверджувальних даних та які можна застосовувати як у Європі, так і по всьому світу. Колінний суглоб використовували як модель суглоба, враженого ОА. Методи. ESCEO скликало спеціальну комісію з 13 міжнародних експертів (ревматологів, клінічних епідеміологів, вчених-клініцистів). Розглянуто чинні настанови, перелічено всі типи лікування та знайдено всі підтверджувальні результати з використанням наявних баз даних. Результати. Базові принципи включають необхідність застосування комбінації фармакологічного і нефармакологічного лікування із ключовим набором початкових заходів, що включає доступ до інформації/освіти, зменшення маси тіла за наявності надмірної маси і прийнятну програму фізичних вправ. Визначено чотири етапи. Етап 1 — фонова терапія, яка може бути як нефармакологічною, так і фармакологічною. Етап 2 — розширене фармакологічне ведення пацієнтів із персистувальними симптомами, яке фокусується на застосуванні пероральних циклооксигеназа-2-селективних або неселективних нестероїдних протизапальних препаратів, вибраних на підставі супутніх факторів ризику, в поєднанні зі внутрішньосуглобовими кортикостероїдами або гіалуронатом для подальшого послаблення симптомів. Етап 3 — останні спроби фармакологічного лікування перед проведенням хірургічного втручання представлені слабкими опіоїдами та іншими анальгетиками центральної дії. Етап 4 — фармакологічне та хірургічне лікування захворювання в термінальній стадії із застосуванням класичних опіоїдів як єдиної альтернативи у разі, якщо хірургічна операція протипоказана. Висновки. Запропонований терапевтичний алгоритм може стати новою загальною схемою для розроблення майбутніх настанов для ведення ОА, які будуть краще сприйматися лікарями.
|
Відділення біомедичних досліджень скелетних м’язів NIHR, Оксфордський університет, Оксфорд, Великобританія.
Відділення ревматології та клінічної імунології, департамент медицини Школи медицини Мерілендського університету, Балтимор, Меріленд.
Відділення геріатричних досліджень освітнього та клінічного центру, Балтимор, Меріленд.
Медичний центр Седарс-Сінай, Лос-Анджелес, Каліфорнія.
©2014 Автори. Опубліковано у видавництві Elsevier HS Journals, Inc. Ця стаття знаходиться у відкритому доступі згідно з умовами ліцензії CC BY-NC-ND (http://creativecommons.org/licenses/by-nc-nd/3.0/). Автор, який відповідає за листування. E-mail: olivier.bruyere@ulg.ac.be (О. Брюйєр (O. Bruyère)). http://dx.doi.org/10.1016/j.semarthrit.2014.05.014
Надано компанією «Меда» за публікацією: Bruyère О. et al. (2014) An algorithm recommendation for the management of knee osteoarthritis in Europe and internationally: A report from a task force of the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO). Seminars in Arthritis and Rheumatism, 44: 253–263. Головна сторінка наукового журналу: http://www.elsevier.com/locate/semarthrit
|
Вступ
Остеоартроз (OA) — найпоширеніша форма артриту — основна причина інвалідності [1]. Найчастіше ОА локалізується в колінному суглобі, а симптоматичний ОА колінного суглоба вражає 24% загальної популяції [2], таким чином, його можна використовувати як модель для розроблення настанов з лікування. Рекомендації з лікування ОА колінного суглоба випущено національними, континентальними та міжнародними науковими організаціями, включаючи серед інших Європейську антиревматичну лігу (EULAR) [3]; Американський коледж ревматології (ACR) [4] та Міжнародне товариство з дослідження остеоартрозу (OARSI) [5–8]. Національний інститут здоров’я та клінічної кваліфікації (NICE) також випустив настанову для ведення OA у дорослих [9, 10].
Європейське товариство з вивчення клінічних та економічних аспектів остеопорозу та остеоартрозу (ESCEO) сприяло створенню різноманітних робочих груп експертів у сфері вивчення OA з метою аналізу та розроблення консенсусних документів щодо ведення захворювання [11, 12]. Що стосується настанов із лікування, ESCEO відчуло необхідність пошуку спільного знаменника для опублікованих у різних джерелах настанов та рекомендацій і створення алгоритму лікування, який можна використовувати як в Європі, так і в будь-яких інших країнах. У більшості чинних практичних настанов аналізують дані, що обґрунтовують кожен із запропонованих типів лікування, але не встановлюють (часто навмисно) пріоритетність видів терапії, оскільки небагато клінічних досліджень проведено з метою вивчення впливу певного типу лікування у пацієнтів, для яких початкова терапія не була успішною, та/чи вивчення того, коли і як слід починати нове лікування. Таким чином, лікування, як і раніше, ґрунтується на індивідуальній оцінці пацієнта з урахуванням потреб і уподобань хворого чи суб’єктивної інтерпретації даних лікарем. З іншого боку, ретельний аналіз підтверджувальних даних фактично дозволяє розподілити типи лікування за пріоритетом і створити схему прийняття рішення з використанням послідовних і логічних етапів. Крім того, необхідно було створити рекомендації для ситуації в Європі, адаптуючи міжнародні настанови [6–8], запозичуючи все, що можливо, з інших континентальних настанов [4] та беручи відповідну інформацію з деяких національних настанов [9, 10], забезпечуючи початкове оновлення поточних Європейських настанов [3], які теоретично можуть стати універсальними. Нарешті, ця спроба може побудувати нову основу для розроблення рекомендацій з лікування ОА, які будуть більш практичними й інтуїтивно зрозумілими для практикуючих лікарів порівняно з простим поясненням наявних і часто суперечливих даних.
Методи
 ESCEO зібрало міжнародну спеціальну комісію з 13 членів, що складалася з 11 ревматологів (8 із Європи, 2 із США і 1 із Канади), 1 клінічного епідеміолога та 1 вченого-клініциста, які мають великий досвід у проведенні, аналізі та інтерпретації даних клінічних досліджень, пов’язаних з ОА.
ESCEO зібрало міжнародну спеціальну комісію з 13 членів, що складалася з 11 ревматологів (8 із Європи, 2 із США і 1 із Канади), 1 клінічного епідеміолога та 1 вченого-клініциста, які мають великий досвід у проведенні, аналізі та інтерпретації даних клінічних досліджень, пов’язаних з ОА.
Одному члену спеціальної комісії (O.B.) було доручено завдання зі збору основних настанов, включаючи останні чорнові версії, випущені для обговорення [3, 4, 6–10], та розповсюдження серед членів спеціальної комісії. Після цього було створено вихідний список усіх типів лікування, виявлених у різних документах і підготовлено першу та дуже схематичну карту можливого розподілу різних типів лікування за пріоритетом тією мірою, якою це було можливо на підставі інформації, отриманої з документів. Для кожного типу лікування виконано повний пошук літератури з метою виявлення нових або додаткових рандомізованих контрольованих досліджень і систематичних оглядів/метааналізів, за наявності таких, не використаних у чинних настановах. Пошук у базі даних Medline (PubMed) виконано із використанням кожного типу лікування як пошукового терміну в поєднанні з терміном «остеоартроз» і з подальшим обмеженням результатів за допомогою термінів «людина», «рандомізоване контрольоване дослідження», «метааналіз», «огляд» і «систематичний огляд» та «настанова». Подібний пошук виконано в базі даних Embase, а пошук за кожним типом лікування — проведено в Кокранівському центральному реєстрі контрольованих досліджень, базі даних систематичних оглядів Кокрану та Центрі щодо складання оглядів і розповсюдження інформації Йоркського університету. Список прийнятних виявлених статей вручну перевірено на наявність додаткових джерел, а членів спеціальної комісії опитано стосовно статей чи матеріалів з’їздів, що перебувають у друку. Вільний пошук в мережі інтернет також виконано і враховано. Обидва пошуки виконано у період із 2000 р. і до лютого 2014 р., при цьому членам спеціальної комісії постійно передавалися додаткові дані для вибору найкращого підтвердження.
Початковий матеріал було представлено спеціальній комісії разом із першою чорновою блок-схемою на одноденній зустрічі, проведеній у кінці вересня 2013 р. У ході детального обговорення початкову схему перетворено на алгоритм лікування. Кожен етап і тип лікування у межах етапів обговорювалися і виправлялися до досягнення консенсусу між членами спеціальної комісії. Після цього було підготовлено перший чорновий варіант остаточного алгоритму із включенням підтверджувальних даних (O.B.). У період із грудня 2013 р. по лютий 2014 р. проведено три цикли нарад шляхом електронного обміну інформацією, які стосувалися чорнового варіанта рукопису: всі виправлення і пропозиції кожного члена обговорювалися з іншими учасниками спеціальної комісії і включалися в алгоритм після досягнення остаточного консенсусу на третьому циклі нарад.
ESCEO — некомерційна організація, створена для забезпечення практикуючих лікарів останньою клінічною інформацією в галузі захворювань кісток, суглобів та м’язів. Розроблення практичних рекомендацій входить у сферу діяльності організації та виконується з метою надання практикуючим фахівцям і неспеціалістам можливості організувати щоденну клінічну роботу з позицій доказової медицини та з урахуванням економічного чинника. ESCEO отримує необмежені освітні гранти від декількох фармацевтичних компаній, що не впливають на діяльність організації. Зокрема, чинні рекомендації розроблено незалежно від будь-яких джерел фінансування, які не відіграли ніякої ролі в ухваленні рішення про підготовку цього документа, його впровадженні, внесенні виправлень і затвердженні рукопису для публікації. Крім того, кожен член спеціальної комісії погодився заявити про потенційний конфлікт інтересів, при виникненні такого у процесі подання рукопису.
Результати
Базові принципи та ключовий набір методів алгоритму лікування ОА колінного суглоба
Належна діагностика ОА колінного суглоба є обов’язковою передумовою лікування. EULAR опублікувала оновлені рекомендації з цього питання [13].
Практично всі чинні практичні настанови наполегливо рекомендують поєднання методів лікування, включаючи нефармакологічні й фармакологічні втручання. Спеціальна комісія чітко заявила про те, що зазначений базовий принцип залишається в силі і йому буде надано абсолютний пріоритет при розробленні терапевтичного алгоритму з метою запобігання плутанині серед лікарів, пов’язаної з проблемою щодо того, як розподілити типи лікування за пріоритетом, а також як їх комбінувати.
Спеціальною комісією прийнято і розширено ключовий набір, запропонований NICE [9], з метою представити початкові заходи і втручання, які слід застосовувати до кожного пацієнта з ОА колінного суглоба. Зокрема:
Доступ до інформації та освіти включає надання пацієнтові необхідних знань про природу захворювання та цілі лікування. За необхідності лікар має ініціювати зміни у способі життя пацієнта, які можуть позитивно вплинути на захист суглоба чи щонайменше зупинити прогресування захворювання або його симптомів. З’ясовано, що ці заходи зумовлюють мінімальний вплив на симптоми ОА, але вони мають велике значення для комплаєнтності до лікування. EULAR опублікувала детальні рекомендації щодо нефармакологічного ведення пацієнтів із ОА стегнового і колінного суглоба, що відіграють роль розширеної настанови з надання доступу до інформації та освіти, а також зміни способу життя [14].
Зменшення маси тіла при надмірній масі
Результат аналізу наявних даних свідчить, що зменшення маси тіла щонайменше на 5% за 6 міс індукує невелике, але добре підтверджене полегшення симптомів, яке здебільшого стосується фізичного функціонування, ніж болю, де ефект менш прогнозований [15]. Спеціальна група вважала, що слід обов’язково позначити граничне значення та на підставі попередніх даних [15] і результатів недавнього високоякісного випробування [16] рекомендувала зменшення маси тіла як мінімум на 10% для досягнення вираженого полегшення симптомів. Схожий рівень зменшення маси тіла також запропоновано для поліпшення якості й товщини хряща медіальної стегнової камери [17].
Програма фізичних вправ
Освіта має включати інформацію про фізичні вправи та фізичну активність [14], оскільки вони забезпечують позитивний вплив як на біль, так і на функціонування у пацієнтів з ОА колінного суглоба за допомогою різних варіантів виконання (індивідуальні чи групові заняття, чи домашні програми) [18]. Хоча оптимальне фізичне навантаження і швидкість збільшення кількості вправ залишаються нез’ясованими, експерти вважають, що інтенсивність та/чи тривалість фізичних вправ слід поступово збільшувати [14]. Існує безліч доказів того, що водні вправи є досить ефективними щодо купірування болю та поліпшення функціонування [19]. Однак специфічні вправи для зміцнення квадрицепса чи силові тренування нижніх кінцівок разом з аеробними вправами, такими як ходьба, залишаються найкращими підходами, що підтвердили свою ефективність [18]: експерти вважають, що слід рекомендувати змішані програми (які включають зміцнення м’язів, аеробне навантаження і гнучкість/обсяг рухів) [14] за умови дотримання мінімальних вимог до інтенсивності [18]. Недавні дослідження свідчать, що тайцзи також є ефективним методом полегшення симптомів [20].
Алгоритм лікування OA: за межами ключового набору
Часто у клінічній практиці відбувається так, що базової терапії недостатньо для повного контролю симптомів після встановлення діагнозу і з прогресуванням захворювання. Відповідно до базового принципу лікування, що потребує поєднання терапевтичних режимів, слід врахувати сумісне включення додаткових нефармакологічних і фармакологічних методів терапії. Алгоритм лікування, розроблений у результаті реалізації представленої ініціативи, відображено на рисунку, і його можна описати таким чином:
Етап 1: Фонове лікування
Протягом етапу 1, наступного за застосуванням ключового набору базових методів, за необхідності слід використовувати додаткові фізичні терапевтичні засоби. Водночас, якщо у пацієнта зберігається симптоматика, слід почати фонове фармакологічне лікування і поступово рухатися у напрямку комбінованої терапії до досягнення задовільної клінічної відповіді.
Етап 1-a. Нефармакологічне фонове лікування
Протягом етапу 1 пацієнта слід направити до фізіотерапевта для того, щоб з’ясувати, чи потрібно застосовувати фізичні методи. Зокрема, фізіотерапевт має спочатку оцінити, чи необхідна корекція деформації. Більше того, протягом етапу 1 і далі на наступних етапах у будь-який час, він/вона повинен/повинна також оцінити, чи можуть інші методи бути корисними для додаткового полегшення симптомів паралельно з фармакологічним лікуванням, призначеним лікарем.
Деформація за типом варус або вальгус є фактором ризику для ОА колінного суглоба і його прогресування. Таким чином, є теоретичне обґрунтування використання біомеханічних втручань, таких як ортопедичні шини або устілки, у пацієнтів з однополюсним тибіофеморальним ОА для зменшення деформації та подальшого навантаження на суглоб і, отже, купірування болю і поліпшення функціонування, або навіть затримки прогресування захворювання. Незважаючи на значну гетерогенність і низьку якість дослідження, існує достатньо доказів для припущення, що колінні шини дійсно зменшують біомеханічний дисбаланс [21] і можуть полегшити симптоми ОА колінного суглоба [22]. Те ж саме може стосуватися комбінованого лікування з виправлення деформації, яке включає шини, ортези для ступень і ортопедичне взуття [23]. Відносно ортезів для ступень проведено безліч досліджень використання устілок із латеральним клином при ОА медіальної камери колінного суглоба, призначених для збільшення пронації ступні, тим самим зменшуючи навантаження на медіальну камеру. Їхні біомеханічні ефекти є менш узгодженими [21], а клінічна ефективність суперечливою, зокрема, недавній високоякісний метааналіз при об’єднанні всіх рандомізованих контрольованих досліджень виявив виражений вплив на больовий синдром, але відсутність ефекту при врахуванні лише більш надійних досліджень високої якості [24]. Проведено лише кілька досліджень устілок із латеральним клином і субтаранним кріпленням та устілок із медіальним кріпленням при однополюсному латеральному ОА, хоча в них відзначено тенденцію до прояву ефективності [22, 24]. Існує недостатньо даних для визначення, чи впливають шини або устілки на прогресування ОА колінного суглоба. EULAR не рекомендувала використання устілок у рамках застосування нефармакологічних типів лікування ОА колінного суглоба й у світлі підвищеного ризику розвитку побічних ефектів [14]. З іншого боку, слід рекомендувати відповідне ортопедичне взуття (включаючи амортизуючі устілки, устілки-супінатори і за необхідності — засоби контролю пронації стопи з униканням високих підборів) [14].
Ідеальними кандидатами для застосування шин є пацієнти молодого віку, більш фізично активні, без тяжкого ожиріння, з однополюсним симптоматичним тибіофеморальним ОА і деформацією за типом варус або вальгус, яка коригується шляхом зміни навантаження при об’єктивному обстеженні. Устілки з латеральним клином застосовують у пацієнтів із ранньою та легкою формою захворювання.
Серед додаткових фізичних терапевтичних засобів важливою допомогою у забезпеченні безпеки пацієнтів є використання допоміжних пристосувань для ходьби: хоча існує недостатня кількість відповідних клінічних досліджень, недавнє рандомізоване випробування підтвердило, що використання ціпка полегшує симптоми ОА колінного суглоба [25]. Консультація фізіотерапевта може також включати оцінку можливості використання теплолікування, наприклад ультразвуку, щодо якого є деякі докази ефективності, хоча і в дослідженнях низької якості [26]. В останніх рандомізованих випробуваннях не було показано додаткового поліпшення при використанні ультразвуку порівняно з фіктивною процедурою [27] або при використанні мануальної терапії в поєднанні з фізичними вправами або за потреби — обв’язування надколінка. У мережевому метааналізі всіх фізичних методів лікування ОА колінного суглоба високо оцінені бальнеотерапія і особливо акупунктура [28]. З іншого боку, деякі дослідники припускають, що користь акупунктури незначна, особливо при порівнянні з фіктивною акупунктурою [29], і, можливо, зумовлена очікуванням і ефектом плацебо [30]. Врешті-решт, черезшкірна електронейростимуляція (ЧЕНС) також є можливим фізіотерапевтичним методом: доказів недостатньо, особливо у зв’язку з наявністю (як це часто буває стосовно фізіотерапевтичних методів) в основному дрібних досліджень низької якості [31]. Однак у великому рандомізованому випробуванні зроблено припущення, що ЧЕНС може зменшувати потребу в знеболювальних препаратах [32]. Відзначимо, що настанови ACR [4] запропонували підхід, який рекомендує застосування акупунктури і ЧЕНС як нефармакологічної альтернативи хірургічному втручанню, якщо останнє протипоказане чи пацієнт не погоджується на операцію. Немає спеціальних досліджень з цього питання і, отже, правильно зазначати акупунктуру і ЧЕНС в цих рекомендаціях і враховувати в алгоритмі, включаючи їх використання (яке не є обов’язковим) як альтернативу хірургічному втручанню.
Етап 1-b. Фармакологічне фонове лікування
Метою фармакологічного лікування етапу 1 є визначення початкової тривалої терапії, яка може полегшити чи усунути симптоми або щонайменше забезпечити знеболювальний ефект.
У більшості клінічних настанов як початкову фармакологічну терапію рекомендують застосування парацетамолу в дозах не вище 3 г/добу на регулярній основі, незважаючи на мінімальний вплив на симптоми, у світлі прийнятної безпеки і помірної ціни. Однак результати метааналізу [33] свідчать, що переважну більшість клінічних випробувань (препаратів негайного чи подовженого звільнення) проводили протягом періоду до 6 міс, що дозволяє сумніватися в ефективності тривалого лікування парацетамолом: насправді, лише у плацебо-контрольованому дослідженні тривалістю 6 міс продемонстровано виражений вплив на функціонування, але не на біль [34]. Цей метааналіз також підтвердив незначну вираженість ефекту (<0,20), виявлену в попередній версії настанови OARSI [7] і підтверджену у великих дослідженнях або таких, що були піддані аналізу відповідно до призначеного лікування [33]. Крім того, існує велика кількість даних, що підтверджують підвищений ризик розвитку небажаних явищ з боку шлунково-кишкового тракту з вираженим підвищенням рівнів печінкових ферментів при застосуванні парацетамолу [7]. Насправді, парацетамол є найчастішою причиною ураження печінки, індукованого лікарським засобом, у США; більше половини таких випадків пов’язані з ненавмисним пероральним прийомом.
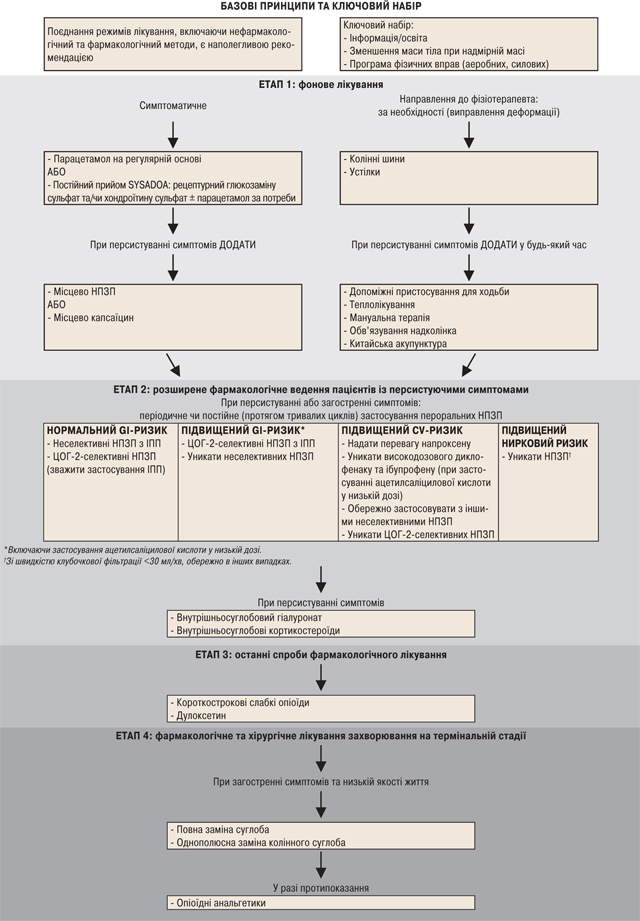
Більш безпечним і розумним підходом може стати використання фонової терапії тривалими SYSADOA у поєднанні із прийомом парацетамолу на вимогу для короткочасного знеболення. Серед SYSADOA слід диференціювати рецептурний глюкозаміну сульфат від інших препаратів глюкозаміну. Версія спеціального Кокранівського огляду 2009 р. [35] чітко показує, що в той час як загальне купірування болю при застосуванні будь-яких форм глюкозаміну знаходиться під сумнівом у зв’язку з високою гетерогенністю, аналіз підгруп у високоякісних дослідженнях безрецептурного глюкозаміну продемонстрував відсутність позитивного ефекту порівняно з плацебо [35]. І навпаки, високоякісні дослідження патентованої рецептурної форми, затвердженої в Європі та в інших країнах (кристалічний глюкозаміну сульфат), свідчать, що він перевершує плацебо при болю та порушенні функціонування [35]: всі три базових випробування [34, 36, 37] є довгостроковими дослідженнями тривалістю від 6 міс до 3 років за участю пацієнтів із легким та помірним болем, а розрахункова загальна вираженість ефекту (без гетерогенності) становить 0,27 (95% ДІ: 0,12–0,43) для болю та 0,33 (95% ДІ: 0,17–0,48) — для функціонування [38], тобто знаходиться приблизно в тому ж діапазоні, що й НПЗП в короткострокових випробуваннях [39]. Мережевий метааналіз, в якому, знову ж таки, змішувалися всі форми [40], був розкритикований за серйозні методологічні помилки [41], а редактор журналу виключив негативні висновки статті [42]. Настанови ACR не рекомендували глюкозамін, оскільки вони відзначають, що глюкозамін не є рецептурним препаратом у США, а існує лише у вигляді спеціальних харчових продуктів, якість яких не оцінювалася Управлінням з контролю за харчовими продуктами і лікарськими засобами США (FDA) [4]. Крім того, такі спеціальні харчові продукти часто містять глюкозаміну гідрохлорид, а велике дослідження, спонсороване NIH, продемонструвало відсутність позитивного ефекту цього препарату [43] так само, як і в інших дослідженнях глюкозаміну гідрохлориду [7, 9]. Насправді ці форми мають різний фармакокінетичний профіль порівняно з рецептурним глюкозаміну сульфатом в дозі 1500 мг 1 раз на добу, затвердженим в Європі [44], отже, перед тим як рекомендувати генеричні чи безрецептурні препарати глюкозаміну, слід провести відповідні дослідження біоеквівалентності [35]. Тривалий прийом рецептурного глюкозаміну сульфату може уповільнити зміни структури суглоба [36, 37], що свідчить про потенційний позитивний ефект, який виходить за рамки полегшення симптомів при застосуванні на початкових стадіях ОА колінного суглоба, як і рекомендується в цій настанові.
Хондроїтину сульфат може зумовити схожий позитивний вплив на зміни структури суглобів у пацієнтів із легкою чи помірною формою захворювання [45–47] при застосуванні рецептурного хондроїтину-4,6-сульфату. Однак слід розуміти, що модифікація структури суглобів не є чітким показанням до призначення рецептурного хондроїтину чи глюкозаміну сульфату, а всього лише потенційним позитивним ефектом при їх використанні для довгострокового контролю симптомів. Повідомлено, що дані стосовно хондроїтину сульфату є суперечливими [48], але вираженість впливу на біль в метааналізі варіює від 0,13 (0,00–0,27) до 0,75 (0,50–0,99) [8]. З іншого боку, повні дані одного базового дослідження хондроїтину-4,6-сульфату, опубліковані пізніше, свідчать, що хондроїтину сульфат зменшує структурні зміни в суглобі із симптоматичним ефектом, який може бути клінічно значущим [46], що підтверджено в іншому дослідженні [49]. Необхідно відрізняти рецептурний препарат, який застосовували в цьому дослідженні [46], від низькоякісних безрецептурних препаратів, доступних за межами Європи. Негативні висновки недавнього мережевого метааналізу щодо глюкозаміну сульфату [40] вилучено редактором [42].
Крім ефективності, глюкозаміну сульфат і хондроїтин є безпечними препаратами, побічні ефекти яких не відрізняються від плацебо [35, 46], що також зміцнює їхню позицію як препаратів для тривалого фонового лікування. Глюкозамін і хондроїтину сульфат часто застосовують у комбінації як спеціальні харчові продукти. На жаль, відсутні опубліковані дослідження комбінації двох фармацевтичних рецептурних складів. У вищенаведеному дослідженні, спонсорованому NIH [43], хоча і не виявлено загального позитивного впливу, був описаний значущий симптоматичний ефект у пошуковому аналізі пацієнтів із помірним або сильним болем, які отримували комбінацію глюкозаміну гідрохлориду та хондроїтину сульфату [43]. І справді, схожа комбінація продемонструвала порівнянну із целекоксибом ефективність після 6 міс лікування пацієнтів з ОА колінного суглоба з помірним або сильним болем (M.C. Hochberg та ін., тези доповіді, представлені OARSI у 2014 р. [8]). На увагу заслуговує і той факт, що слідом за попередніми даними з бази даних Ініціативи з ОА [50] недавно опубліковані результати австралійського випробування продемонстрували клінічно значущу модифікацію структури суглоба після 2 років лікування із застосуванням комбінації безрецептурних чи фармацевтичних хондроїтину/глюкозаміну сульфату. При цьому не спостерігалося вираженого впливу на симптоми, враховуючи те, що досліджувана популяція мала легку форму захворювання і була сприйнятливою до плацебо [51].
Доказів ефективності інших SYSADOA, таких як неомилювані сполуки олій авокадо та сої та діацереїн, представлено набагато менше [52, 53]. Що стосується діацереїну, Європейське агентство з оцінювання лікарських засобів (ЕМА) нещодавно повідомило, що, незважаючи на те що більшість останніх метааналізів показують наявність деякої ефективності за відсутності гетерогенності, з точки зору безпеки може мати місце несприятливе співвідношення користь/ризик, у зв’язку з чим рекомендовано провести повторне оцінювання [54]. Крім того, з’являється все більше свідчень про те, що нові ліки можуть виступати в ролі агентів, що модифікують перебіг захворювання при ОА, наприклад стронцію ранелат — хімічна речовина, на сьогодні наявна на ринку як засіб для лікування постменопаузального остеопорозу та остеопорозу у чоловіків.
Стронцію ранелат впливає на субхондральну кістку і хрящ, що може свідчити про потенційний позитивний вплив на прогресування ОА. Недавнє високоякісне 3-річне плацебо-контрольоване випробування показало, що стронцію ранелат знижує рентгенологічне прогресування ОА колінного суглоба разом зі зменшенням вираженості симптомів [55]. У цьому дослідженні препарат добре переносився, але недавно EMA обмежило застосування стронцію ранелату в лікуванні пацієнтів із тяжким остеопорозом у зв’язку з можливим підвищенням серцево-судинного ризику [56], таким чином, роль цього препарату у веденні пацієнтів із ОА потребує додаткового оцінювання.
Якщо у пацієнта зберігається симптоматика після застосування відповідної фонової фармакологічної терапії із застосуванням SYSADOA, а купірування болю за допомогою парацетамолу є недостатнім, до фонових препаратів можна додати місцеві НПЗП паралельно з нефармакологічним лікуванням. Ефективність місцевих НПЗП встановлено в декількох рандомізованих дослідженнях, систематичний огляд яких виконаний у 2004 р. [57], результати якого свідчать про помірну вираженість ефекту щодо купірування болю при ОА [9] на фоні високої гетерогенності, пов’язаної з відмінностями між місцевими препаратами. Недавні рандомізовані випробування підтвердили відсутність значущої відмінності між місцевими НПЗП та їхніми пероральними аналогами, при цьому місцеві засоби показували кращу шлунково-кишкову безпеку, але призводили до розвитку більшої кількості місцевих шкірних реакцій, що спостерігалося і у великих дослідженнях [58, 59], а також у повному систематичному огляді [60]. Однак тривалість більшості досліджень становила ≤12 тиж, що може підтвердити роль місцевих НПЗП як циклічних додаткових анальгетиків, якщо фонове лікування не приводить до зникнення симптомів. Лише в одному дослідженні, проведеному в умовах загальної практики [61], отримано схожі результати за період >1 року, але це дослідження не відповідало всім стандартам якості надійного рандомізованого контрольованого випробування, а також не було сліпим [61].
У той час як місцеві саліцилати, що містять подразнювальні речовини, не продемонстрували ефективності при ОА порівняно з плацебо, на фоні підвищення ризику розвитку місцевих побічних реакцій [62] після оцінки всіх наявних даних, немає ніяких причин для того, щоб рекомендувати застосування місцевого капсаїцину замість місцевих НПЗП [60]. Фактично, незважаючи на деякі докази ефективності порівняно з плацебо, існує підвищений ризик розвитку місцевих побічних реакцій, а також відсутні порівняльні дослідження місцевих або пероральних НПЗП.
Етап 2. Розширене фармакологічне ведення пацієнтів із персистуючими симптомами
Спеціальна комісія погодилася, що пацієнтів із легким або помірним болем, пов’язаним з ОА колінного суглоба, можна відповідним чином лікувати, застосовуючи базові методи і терапевтичні схеми етапу 1. Однак, якщо перший етап є недостатньо ефективним, а також у пацієнтів із помірним або сильним болем, які перебувають під спостереженням, корисним може бути розширене фармакологічне лікування. Зазначимо, що таке лікування складніше контролювати і/чи воно може призвести до розвитку більш тяжких небажаних реакцій.
Центральна роль у фармакологічному лікуванні при ОА традиційно відводиться пероральним НПЗП. Лікування із застосуванням пероральних НПЗП можна проводити на ранній стадії для купірування болю протягом дуже коротких циклів. Фактично пероральні неселективні або ЦОГ-2-селективні НПЗП забезпечують краще полегшення симптомів, ніж парацетамол [63], при цьому вираженість ефекту щодо болю становить 0,29 (0,22–0,35) [39], що у 2 рази більше впливу парацетамолу [63]. Пацієнти віддають більшу перевагу застосуванню НПЗП порівняно з парацетамолом [64]. Хоча в систематичних оглядах клінічних досліджень не виявлено чітких відмінностей між глюкозаміну сульфатом та пероральними НПЗП щодо вираженості болю чи функціонування [60], на фоні кращого профілю безпеки останніх [35], спеціальна комісія вважає, що на підставі наявних доказів, отриманих у клінічних дослідженнях, НПЗП можуть бути корисними у пацієнтів із більш сильним болем, особливо, якщо SYSADOA не забезпечили достатнього контролю симптомів. З іншого боку, SYSADOA можуть зменшити потребу в НПЗП при застосуванні як фонової терапії [65].
Пероральні НПЗП можна застосовувати періодично чи постійно, хоча навіть в останньому варіанті їх не приймають безперервно, а протягом тривалих циклів, з метою безпеки і у зв’язку з недостатньою кількістю довгострокових досліджень. Недавні систематичні огляди великої кількості короткострокових клінічних досліджень не виявили чітких відмінностей в ефективності між ЦОГ-2-селективними, частково селективними і неселективними НПЗП [60]. Таким чином, вибір лікарського засобу серед доступних НПЗП диктується профілем безпеки з урахуванням різних факторів ризику, супутніх захворювань пацієнта і медичних умов.
ЦОГ-2 селективні агенти асоціюються з розвитком меншої кількості таких ускладнень, як шлунково-кишкові виразки, порівняно з неселективними НПЗП при короткостроковому застосуванні, більш тривале лікування не доводить такого результату [60], зокрема для целекоксибу [66] чи еторикоксибу [67], які є єдиними ЦОГ-2-селективними агентами, присутніми на ринку в Європі. Нещодавно отримані дані дозволяють припустити, що коксиби істотно підвищують ризик розвитку ускладнень у верхньому відділі шлунково-кишкового тракту порівняно з плацебо, хоча і з нижчою частотою, ніж селективні НПЗП [68]. Таким чином, з одного боку, неселективні НПЗП слід завжди призначати в комбінації з ІПП. Однак з вищеописаних причин, а також з урахуванням економічних аспектів [69], спеціальна комісія вважає, що лікарям слід зважити доцільність супутнього застосування ІПП та ЦОГ-2-селективних НПЗП у пацієнтів у групі нормального ризику розвитку шлунково-кишкових захворювань. У пацієнтів у групі підвищеного ризику розвитку шлунково-кишкових захворювань не слід застосовувати неселективні НПЗП, а ЦОГ-2-селективні НПЗП потрібно призначати в комбінації з ІПП [70]. Супутнє застосування ацетилсаліцилової кислоти підвищує ризик розвитку шлунково-кишкових захворювань і щонайменше частково знижує поліпшену шлунково-кишкову переносимість НПЗП [71]: додавання ІПП є корисним і знижує ризик у зазначеному випадку [60].
Майже немає сумнівів щодо того, що всі НПЗП, селективні й неселективні, підвищують ризик розвитку серйозних серцево-судинних захворювань; однак напроксен зазвичай асоціюється з низьким ризиком розвитку тромботичних серцево-судинних явищ [60]. Це підтверджено результатами метааналізу індивідуальних даних пацієнтів у 639 рандомізованих контрольованих випробуваннях [68], які демонструють, що коксиби і диклофенак підвищують частоту серйозних судинних явищ на третину, головним чином через збільшення серйозних коронарних явищ (включаючи летальний і нелетальний інфаркт міокарда), що спостерігалися і при застосуванні ібупрофену, але не напроксену, який не підвищував загального судинного ризику, можливо, у зв’язку з тривалим пригніченням агрегації тромбоцитів [68]. У 2012 р. ЕМА припустило, що напроксен може асоціюватися з більш низьким ризиком розвитку артеріальних тромботичних явищ порівняно з інгібіторами ЦОГ-2 та іншими НПЗП, хоча невисокий ризик не може бути виключений [72]. Останню думку поділяє і FDA, яке нещодавно прийняло рішення не рекомендувати внесення змін до тексту щодо запобігання серцево-судинному ризику для напроксену на підставі сукупності доказів, отриманих у систематичних оглядах спостережних досліджень і рандомізованих контрольованих досліджень (Hochberg M.C., особиста розмова).
Хоча більш ранні дані дозволяють припустити, що відносний ризик розвитку серцево-судинних явищ зростає при підвищенні вихідного серцево-судинного ризику на початку лікування із застосуванням ЦОГ-2-селективних НПЗП [73], останній і найбільший метааналіз виявив, що пропорційне підвищення ризику було подібним незалежно від вихідного ризику [68]; однак надмірний абсолютний ризик у будь-якому разі є вищим у пацієнтів із високим ризиком розвитку серйозних серцево-судинних явищ, які отримують коксиби або диклофенак і, можливо, ібупрофен [68]. З цієї причини спеціальна комісія запропонувала відмовитися від застосування коксибів і диклофенаку у високій дозі чи ібупрофену у пацієнтів із високим серцево-судинним ризиком. Однак це може поширюватися також на інші неселективні НПЗП (напроксен є можливим винятком), на підставі спостережних досліджень [74], де ризик стійко підвищувався [75], викликаючи серйозну настороженість. З іншого боку, напроксен, через можливий нижчий серцево-судинний ризик [68, 75], може бути кращим засобом у тих випадках, коли застосування НПЗП необхідне у пацієнтів групи високого серцево-судинного ризику. Супутнє застосування ацетилсаліцилової кислоти у низькій дозі не знижує підвищеного серцево-судинного ризику, що асоціюється із застосуванням ЦОГ-2-селективних НПЗП у плацебо-контрольованих дослідженнях [76, 77], тоді як спостережні дослідження не виявили підвищення серцево-судинного ризику при додаванні до низькодозованої ацетилсаліцилової кислоти неселективних НПЗП, крім ібупрофену [60]. Фактично це не стосується ібупрофену, який демонструє клінічно значущу фармакодинамічну взаємодію з ацетилсаліциловою кислотою, отже, його застосування слід уникати [78].
Зв’язок НПЗП із підвищеним серцево-судинним ризиком — складне питання — крім прямого опосередкування дисбалансом простаноїдів [79], може мати непрямий характер, пов’язаний із підвищенням артеріального тиску, застійною серцевою недостатністю і нирковою дисфункцією, характерними для всіх НПЗП [80], про що лікарям завжди необхідно пам’ятати. Зокрема, це може призвести до відмови від застосування пероральних НПЗП у пацієнтів із підвищеним нирковим ризиком, наприклад, при хронічному захворюванні нирок із розрахунковою швидкістю клубочкової фільтрації <30 мл/хв [4].
За наявності протипоказань до прийому НПЗП або у разі персистування симптомів, незважаючи на застосування НПЗП, чи у разі загострення симптомів, можна використовувати внутрішньосуглобове лікування.
Роль внутрішньосуглобових ін’єкцій гіалуронової кислоти остаточно не з’ясована, але у більшості метааналізів продемонстровано виражений позитивний ефект при ОА колінного суглоба, який знижується при розгляді лише високоякісних досліджень [7]. Проте метааналіз продемонстрував величину ефекту, що становила 0,34 (0,22–0,46), що нівелюється високою гетерогенністю, але залишається в декількох аналізах чутливості, заснованих на якості дослідження, і, що важливо, невеликі ефекти зберігаються до 6 міс після лікування [81]. Ці сприятливі дані підтверджуються результатами іншого виконаного метааналізу, в якому, крім усього іншого, автори роблять негативні висновки на підставі селективних і сумнівних даних [82], з якими спеціальна комісія не погоджується. Насправді внутрішньосуглобові ін’єкції гіалуронової кислоти є відносно безпечними, хоча отримано повідомлення про розвиток псевдосептичних реакцій, особливо при застосуванні вмісту препарату із поперечними зв’язками та вищою молекулярною масою. Крім того, гіалуронова кислота забезпечує триваліший контроль болю порівняно із внутрішньосуглобовими ін’єкціями кортикостероїдів [83] і може відстрочити повну заміну суглоба [84]. Також нещодавно отримані дані підтверджують відсутність значущих відмінностей щодо ефективності полегшення симптомів порівняно з пероральними НПЗП [85]; насправді, внутрішньосуглобова гіалуронова кислота може стати хорошою альтернативою НПЗП при ОА колінного суглоба у пацієнтів похилого віку або в осіб із високим ризиком розвитку побічних ефектів, індукованих НПЗП.
Внутрішньосуглобові кортикостероїди можна запропонувати пацієнтам, особливо за наявності випоту, хоча ця рекомендація є більше теоретичною, ніж заснованою на реальних доказах. На практиці за аспірацією синовіальної рідини із суглоба безпосередньо випливає внутрішньосуглобове введення кортикостероїдів, наприклад метилпреднізолону ацетату чи тріамцинолону гексацетоніду. У контрольованих дослідженнях протягом перших тижнів після застосування [83] вони загалом мають вищу ефективність, ніж внутрішньосуглобове введення гіалуронової кислоти, але їхній вплив на біль може фактично тривати лише декілька (від 1 до 3) тижнів [86]. Безпека цих препаратів є достатньою, але їх слід застосовувати протягом повторюваних циклів [87] у зв’язку з короткостроковим знеболювальним ефектом.
Етап 3. Останні спроби фармакологічного лікування перед хірургічним втручанням
Пацієнта, якому не допомогли всі вищенаведені послідовні підходи, можна розглянути як кандидата для проведення хірургічної операції. Останньою спробою фармакологічного лікування у пацієнтів із вираженою симптоматикою може стати застосування слабких опіоїдів короткої дії. Ефективність трамадолу в полегшенні болю і поліпшенні функціонування при ОА колінного суглоба невисока, але значуща [88], при цьому частота небажаних явищ достовірно зростає порівняно з плацебо і (хоча вони можуть бути головним чином незначними) може призвести до припинення лікування істотної частки пацієнтів [88]. Загалом опіоїди, застосовувані у пацієнтів з артритом, пов’язані з високою захворюваністю, отже, їх слід використовувати з великою обережністю [89]. Комбінована терапія із застосуванням трамадолу і парацетамолу виявилася ефективною при поєднанні з НПЗП у пацієнтів, які недостатнім чином відповідають на прийом останніх [90]. Однак профіль безпеки залишається таким же, як і у разі прийому лише трамадолу, і неясно, чи приведе поєднання тільки парацетамолу з НПЗП у цих пацієнтів до поліпшення ефективності та зниження частоти появи побічних ефектів [91].
Антидепресанти часто застосовують при хронічних больових синдромах у зв’язку з їх впливом на нейротрансмітери (тобто серотонін і норадреналін) на центральному рівні, що може деякою мірою стосуватися і трамадолу. Насправді, центральна сенсибілізація може впливати на ступінь тяжкості больового синдрому при ОА [92]. У цьому відношенні підтвердження застосування дулоксетину при ОА колінного суглоба отримано у двох рандомізованих плацебо-контрольованих дослідженнях тривалістю 13 тиж, які продемонстрували позитивний вплив на клінічно значущі результати лікування, але також отримано схожу ймовірність розвитку таких небажаних реакцій, як нудота, слабкість, запор, сухість у роті тощо [93]. У схожому короткостроковому дослідженні дулоксетин зменшив вираженість болю у колінному суглобі у пацієнтів із неналежною відповіддю на НПЗП [94], що могло б підтвердити можливу роль лікарського засобу в розширеному веденні пацієнта. Перед початком застосування дулоксетину на більш ранніх етапах лікування захворювання необхідно провести додаткові довгострокові дослідження. Фактично раннє об’єктивне обстеження може дозволити виявляти пацієнтів із центральною сенсибілізацією [95], що дасть можливість ефективно застосовувати центральні анальгетики на більш ранніх етапах лікування захворювання.
Етап 4. Фармакологічне та хірургічне лікування захворювання на термінальній стадії
Повний огляд та рекомендації щодо проведення хірургічних процедур для лікування пацієнтів із ОА колінного суглоба на термінальній стадії виходить за рамки сфери діяльності спеціальної комісії. Однак немає сумнівів щодо того, що повна заміна суглоба є економічно вигідним рішенням, коли всі попередні методи лікування не дали результату і спостерігається виражене погіршення якості життя, хоча це твердження із зрозумілих причин базується в основному не на рандомізованих контрольованих дослідженнях [96]. Повна заміна суглоба є досить ефективним методом у полегшенні тяжких симптомів ОА колінного суглоба і має сприятливе співвідношення користь/ризик у тих випадках, коли пацієнтів ретельно відбирають, добре інформують, належним чином виконують анестезію і хірургічне втручання, а також призначають відповідну програму реабілітації [10]. Остання відіграє особливо важливу роль, якщо вона починається безпосередньо після хірургічної операції, в цьому разі нормальну активність можна відновити за 6–12 тиж після втручання, при цьому 95% усіх протезів витримують понад 10 років після операції; тільки у близько 20% пацієнтів не відзначають позитивного ефекту після повної заміни суглоба [10].
Однополюсна заміна колінного суглоба ефективна у тому разі, якщо захворювання обмежується однією камерою колінного суглоба і у пацієнтів може розвиватися менша кількість ускладнень, таких як тромбоз глибоких вен [97]. Щодо інших хірургічних процедур існують підтвердження певної ефективності остеотомії великогомілкової кістки при захворюванні медіальної камери колінного суглоба [98], а дані про позитивний ефект промивання/санації порожнини суглоба відсутні [99].
Для пацієнтів із вираженою симптоматикою, в яких хірургічне втручання протипоказане, або у разі, якщо пацієнти не погоджуються на операцію, останнім фармакологічним методом лікування можуть стати класичні пероральні чи трансдермальні опіоїди, хоча їх незначна чи помірна ефективність переважується вираженим зростанням ризику розвитку небажаних явищ [100]. Слід дотримуватися настанов щодо застосування опіоїдних анальгетиків при хронічному болю неракової етіології [101].
Обговорення
Серед багатьох чинних рекомендацій та настанов, випущених авторитетними науковими товариствами по всьому світу, що стосуються лікування пацієнтів із ОА [3–10], це перша спроба створити детальний алгоритм для лікарів, який складається з поетапної схеми лікування для окремого пацієнта.
Єдину попередню спробу розробити алгоритм зроблено в настановах NICE [9, 10]. Проте їхнє застосування обмежується дозволами регуляторних органів у Великобританії (не всі лікарські засоби, що розглядаються в цих настановах, мають ту ж історію затвердження, що і в інших європейських країнах) і особливо міркуваннями щодо автономності в національній системі охорони здоров’я (NHS) Великобританії. Насправді існує обмежена кількість фармакологічних варіантів лікування, що розглядаються в остаточних документах NICE. Найважливіше те, що існують лише два кільця (враховуючи конкретну форму алгоритму NICE) після базових методів (освіта, фізичні вправи і зменшення маси тіла) з низьким ступенем (або навіть повною відсутністю) встановлення пріоритетності на третьому і найбільшому етапі, який простягається від НПЗП до артропластики. Ці обмеження не усуваються і в нових версіях настанови NICE [10].
Інші недавно опубліковані рекомендації, такі як настанова ACR [4], що використовуються в деяких країнах, також пов’язані з неповною локальною доступністю всіх лікарських засобів, що розглядаються в цьому документі. Крім того, комісія ACR навмисно прийняла рішення не розробляти алгоритм, але використовувати формальний процес для оцінки наявних доказів. Такий процес призвів до відсутності того, що було позначено у процесі як «наполеглива рекомендація» для будь-якого фармакологічного втручання при ОА колінного суглоба, за винятком пероральних НПЗП у пацієнтів із неналежною відповіддю на парацетамол та у тих, хто не має протипоказань до застосування цих засобів. Практично всі фармакологічні методи лікування отримали оцінку «умовна (слабка) рекомендація», а деякі — «не рекомендується». Автори настанови ACR усвідомлювали, що хоча більша частина рекомендацій не буде суперечливою, щодо деяких питань можуть бути розбіжності [4].
Схожі обмеження є і в нових настановах OARSI. В OARSI існує потужна традиція детального доказового аналізу з розробленням чітких рекомендацій щодо використання цього методу лікування [5–7]. В останніх настановах [8] OARSI вибрало «мінімалістський» підхід, в якому підтверджувальні дані описуються лише коротко і часто мають недостатню доказову базу, а методи лікування просто перелічені в алфавітному порядку, при цьому більшість із них класифікується як «невизначена» рекомендація. Лише невелика їхня частина отримала позначення «належна» рекомендація, а «належним» методом лікування пацієнтів з ОА колінного суглоба із супутніми патологіями (переважна більшість входить у популяцію пацієнтів літнього віку) залишилися тільки місцеві НПЗП та внутрішньосуглобові кортикостероїди, крім можливого використання біомеханічних методів і ціпка [8]. Таким чином, спеціальна група ESCEO не виявила чіткого розмежування між «належною» і «невизначеною» рекомендацією, тому лікарям досить складно інтерпретувати останній термін.
Запропонований тут алгоритм об’єднує докази по всіх запропонованих методах лікування і розміщує їх у послідовності, яка залежить від самого доказу. Хоча одне серйозне обмеження полягає у відсутності в переважній більшості випадків відповідних клінічних досліджень щодо розподілу типів лікувань за пріоритетом, спеціальна комісія переконана, що докази, отримані в наявних стандартних випробуваннях, є достатніми для включення зазначеного типу втручання в конкретний етап алгоритму.
Згідно з базовими методами, які, відповідно до більшості чинних рекомендацій та настанов, включають доступ до інформації/освіти, зменшення маси тіла за наявності надмірної маси і складання відповідної програми фізичних вправ, алгоритм пропонує чотири етапи з декількома методами. На етапі 1 зроблено спробу краще охарактеризувати застосування парацетамолу в ролі початкового фармакологічного втручання. Враховуючи обмежену ефективність і деякі недавно виниклі питання щодо безпеки, спеціальна комісія пропонує залишити парацетамол для купірування болю в ході фонового лікування із застосуванням SYSADOA, такими як глюкозаміну сульфат або хондроїтину сульфат: обидва ці препарати повинні мати фармацевтичний ступінь чистоти та бути рецептурними, дозволеними в Європі та в інших країнах, вони визнані єдиними препаратами, які спеціальна комісія рекомендує на підставі потужних клінічних підтверджень, включаючи безпеку та можливість додаткового позитивного ефекту при використанні на початкових етапах ведення захворювання [36, 37, 46].
Місцеві НПЗП можна приєднувати для додаткового знеболення, враховуючи їх короткочасний симптоматичний ефект, схожий із тим пероральних аналогів, і хорошу системну безпеку. Більше того, під час першого етапу, крім базових методів, слід призначити належне фонове нефармакологічне лікування і додавати його послідовно в будь-який час по ходу виконання алгоритму на підставі відповіді пацієнта.
Етап 2 складається з розширеного фармакологічного лікування у пацієнтів із персистуючими симптомами. Центральну роль цього етапу відіграє застосування пероральних НПЗП. Незважаючи на нечітку диференціацію доступних прямих порівнянь між пероральними НПЗП та SYSADOA або місцевими НПЗП, спеціальна комісія вважає, що останні можуть бути більш ефективними у більш тяжких пацієнтів. По-перше, найважливіші питання, пов’язані з безпекою, розглянуто в цьому документі, що в результаті зумовило появу рекомендації про те, що пероральні НПЗП не слід використовувати постійно, але періодично чи протягом тривалих терапевтичних циклів. По-друге, такі питання, пов’язані з безпекою, привели до розроблення різних принципів вибору між неселективними чи ЦОГ-2-селективними НПЗП, залежно від супутнього шлунково-кишкового, серцево-судинного чи ниркового ризику.
Внутрішньосуглобове лікування — серйозний фармакологічний метод. Насправді, як гіалуронова кислота, так і кортикостероїди досліджували в основному у пацієнтів, у яких попереднє знеболювальне чи протизапальне лікування виявилося неефективним. З точки зору клініциста, два типи лікування можна диференціювати за тривалістю індукованого позитивного впливу, який є більш вираженим при застосуванні внутрішньосуглобових кортикостероїдів, але короткочасним (кілька тижнів після однієї ін’єкції) порівняно з гіалуронатом, величина ефекту якого є меншою (і більше суперечливою), але тривалість становить до 6 міс після 1–3-тижневого курсу лікування.
Етап 3 складається з останньої спроби фармакологічного лікування перед проведенням хірургічного втручання і включає пероральні слабкі опіоїди або дулоксетин, часткові підтвердження для якого отримано у пацієнтів, які не дали відповіді на попереднє лікування: невисока ефективність супроводжувалася небажаними реакціями, які можуть призвести до припинення лікування і високої захворюваності [89].
Таким чином, лікування на термінальній стадії захворювання є останнім, або четвертим етапом алгоритму і включає хірургічні процедури, представлені в основному повною заміною суглоба. Класичні опіоїди в цих випадках застосовують як альтернативу для пацієнтів, яким хірургічна операція протипоказана.
Важливо, що розроблений алгоритм є, за наявною у нас інформацією, першою спробою підготувати настанову з комбінованої терапії. Перш за все спеціальна комісія вважає, що запропоновані базові методи слід використовувати в усіх пацієнтів, так само як фонове лікування, передбачене на етапі 1, який вже надає рекомендації щодо терапії із застосуванням декількох методів, пропонуючи, з одного боку, додавання в будь-який час нефармакологічних методів лікування за необхідності і, з іншого боку, додавання місцевих НПЗП до постійного застосування SYSADOA (у поєднанні з парацетамолом для купірування болю) для подальшого контролю болю, якщо це потрібно. Коли пацієнти переходять до етапу 2, і, отже, до лікування із застосуванням пероральних НПЗП, фонову терапію етапу 1 не слід скасовувати, оскільки вона забезпечує інший підхід до захворювання та обмежує застосування НПЗП. Подібним чином, рішення про початок внутрішньосуглобового введення гіалуронату чи кортикостероїдів при збереженні у пацієнта симптомів не має автоматично призводити до скасування попереднього лікування. Ситуація ускладнюється, коли внаслідок недостатнього контролю симптомів пацієнт переходить до етапу 3. Хоча методи етапу 1 можна продовжувати застосовувати у зв’язку з тим, що вони можуть забезпечити довгостроковий сприятливий ефект, ступінь, за яким лікування, розпочате на етапі 2, слід замінити, залежить від загального співвідношення користь/ризик. Очевидно, що етап 4 змінює всю тактику, особливо, коли він включає хірургічне втручання.
Чинна спроба є консенсусом експертів, заснованим виключно на наявних даних. Серед наукових товариств у галузі ревматології ESCEO є єдиним, присвяченим двом специфічним розладам, таким як остеопороз і ОА, враховуючи безліч біологічних взаємозв’язків між кісткою і суглобом. У той час як більшість експертів спеціальної комісії мають клінічний і дослідний досвід стосовно обох захворювань або більшою мірою ОА і опублікували велику кількість статей у цій галузі, меншість мають в основному інтерес щодо дослідження остеопорозу. Проте всі вони є лікарями, які спеціалізуються в галузі ревматології, мають величезний досвід ведення пацієнтів з ОА і є членами різних вчених рад, присвячених ОА і фармакоекономіці ревматичних розладів.
Поглянувши на всі зважені методи лікування, спеціальна комісія вважає, що був наданий повний огляд нефармакологічної фонової терапії, тоді як ширший огляд хірургічних процедур на етапі 4, як уже зазначалося, не входив у завдання спеціальної комісії. Навпаки, практично всі доступні фармакологічні методи лікування було розглянуто і включено в алгоритм із відповідними коментарями. Класи препаратів, які не були розглянуті в цих рекомендаціях, включають бісфосфонати у зв’язку з тим, що ризедронова кислота у клінічних дослідженнях фази III виявився неефективною у контролі симптомів і уповільненні прогресування захворювання, незважаючи на позитивні зміни деяких біомаркерів [102]. М’язові релаксанти також не були включені у зв’язку з відсутністю належних досліджень за участю пацієнтів з ОА, тоді як дослідження фокусувалися на інших ревматологічних захворюваннях (наприклад циклобензаприну при фіброміалгії).
Як і будь-яка настанова, цей документ має обмеження, пов’язані з появою нових даних, які можуть накопичитися за час його підготовки, і потребує періодичного оновлення. На сьогодні настанова містить прості й засновані на доказах рекомендації щодо того, як і коли призначати лікування пацієнтам з ОА колінного суглоба. Крім того, цей документ є спробою створення нового каркаса для розроблення нових міжнародних настанов із лікування ОА, які будуть більш доступними і зрозумілими для фахівців та практикуючих лікарів.
Список використаної літератури
- 1. Bijlsma J.W., Berenbaum F., Lafeber F.P. (2011) Osteoarthritis: an update with relevance for clinical practice. Lancet, 377: 2115–2126.
- 2. Pereira D., Peleteiro B., Araújo J. et al. (2011) The effect of osteoarthritis definition on prevalence and incidence estimates: a systematic review. Osteoarthritis Cartilage, 19: 1270–1285.
- 3. Jordan K.M., Arden N.K., Doherty M. et al. (2003) EULAR recommendations 2003: an evidence based approach to the management of knee osteoarthritis: report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Ann. Rheum. Dis., 62: 1145–1155.
- 4. Hochberg M.C., Altman R.D., April K.T. et al. (2012) American College of Rheumatology 2012 recommendations for the use of nonpharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip, and knee. Arthritis Care Res., 64: 465–474 (review).
- 5. Zhang W., Moskowitz R.W., Nuki G. et al. (2007) OARSI recommendations for the management of hip and knee osteoarthritis, part I: critical appraisal of existing treatment guidelines and systematic review of current research evidence. Osteoarthritis Cartilage, 15: 981–1000.
- 6. Zhang W., Moskowitz R.W., Nuki G. et al. (2008) OARSI recommendations for the management of hip and knee osteoarthritis, part II: OARSI evidence-based, expert consensus guidelines. Osteoarthritis Cartilage, 16: 137–162.
- 7. Zhang W., Nuki G., Moskowitz R.W. et al. (2010) OARSI recommendations for the management of hip and knee osteoarthritis, part III: changes in evidence following systematic cumulative update of research published through January 2009. Osteoarthritis Cartilage, 18: 476–499.
- 8. McAlindon T.E., Bannuru R.R., Sullivan M.C. et al. (2014) OARSI guidelines for the non-surgical management of knee osteoarthritis. Osteoarthritis Cartilage, 22: 363–388.
- 9. National Collaborating Centre for Chronic Conditions (2008) Osteoarthritis: National clinical guidelines for care and management in adults. London: Royal College of Physicians.
- 10. National Clinical Guideline Centre (2014) Osteoarthritis: The care and management of osteoarthritis in adults. Clin. guideline, CG177.
- 11. Bruyère O., Burlet N., Delmas P.D. et al. (2008) Evaluation of Symptomatic Slow-Acting Drugs in Osteoarthritis using the GRADE system. BMC Musculoskelet Disord, 9: 165.
- 12. Hiligsmann M., Cooper C., Arden N. et al. (2013) Health economics in the field of osteoarthritis: an expert’s consensus paper from the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO). Semin. Arthritis Rheum., 43: 303–313.
- 13. Zhang W., Doherty M., Peat G. et al. (2010) EULAR evidence-based recommendations for the diagnosis of knee osteoarthritis. Ann. Rheum. Dis., 69: 483–489.
- 14. Fernandes L., Hagen K.B., Bijlsma J.W. et al. (2013) EULAR recommendations for the non-pharmacological core management of hip and knee osteoarthritis. Ann. Rheum. Dis., 72: 1125–1135.
- 15. Christensen R., Bartels E.M., Astrup A. et al. (2007) Effect of weight reduction in obese patients with knee osteoarthritis: a systematic review and metaanalysis. Ann. Rheum. Dis., 66: 433–439.
- 16. Messier S.P., Mihalko S.L., Legault C. et al. (2013) Effects of intensive diet and exercise on knee joint loads, inflammation, and clinical outcomes among overweight and obese adults with knee osteoarthritis: the IDEA randomized clinical trial. J. Am. Med. Assoc., 310: 1263–1273.
- 17. Anandacoomarasamy A., Leibman S., Smith G. et al. (2012) Weight loss in obese people has structure-modifying effects on medial but not on lateral knee articular cartilage. Ann. Rheum. Dis., 71: 26–32.
- 18. Fransen M., McConnell S. (2008) Exercise for osteoarthritis of the knee. Cochrane Database Syst. Rev., 4: CD004376.
- 19. Bartels E.M., Lund H., Hagen K.B. et al. (2007) Aquatic exercise for the treatment of knee and hip osteoarthritis. Cochrane Database Syst. Rev., 4: CD005523.
- 20. Kang J.W., Lee M.S., Posadzki P., Ernst E. (2011) T’ai chi for the treatment of osteoarthritis: a systematic review and meta-analysis. BMJ Open., 1: e000035 [PubMed PMID: 22021734. Pubmed Central PMCID: PMC3191392. Epub. 2011/10/25].
- 21. Segal N.A. (2012) Bracing and orthoses: a review of efficacy and mechanical effects for tibiofemoral osteoarthritis. PM R., 4(Suppl. 5): S89–S96.
- 22. Raja K., Dewan N. (2011) Efficacy of knee braces and foot orthoses in conservative management of knee osteoarthritis: a systematic review. Am. J. Phys. Med. Rehabil., 90: 247–262.
- 23. Hunter D., Gross K.D., McCree P. et al. (2012) Realignment treatment for medial tibiofemoral osteoarthritis: randomised trial. Ann. Rheum. Dis., 71: 1658–1665.
- 24. Parkes M.J., Maricar N., Lunt M. et al. (2013) Lateral wedge insoles as a conservative treatment for pain in patients with medial knee osteoarthritis: a meta-analysis. J. Am. Med. Assoc., 310: 722–730.
- 25. Jones A., Silva P.G., Silva A.C. et al. (2012) Impact of cane use on pain, function, general health and energy expenditure during gait in patients with knee osteoarthritis: a randomised controlled trial. Ann. Rheum. Dis., 71: 172–179.
- 26. Loyola-Sanchez A., Richardson J., MacIntyre N.J. (2010)Efficacy of ultrasound therapy for the management of knee osteoarthritis: a systematic review with metaanalysis. Osteoarthritis Cartilage, 18: 1117–1126.
- 27. Cakir S., Hepguler S., Ozturk C.et al. (2013) Efficacy of therapeutic ultrasound for the management of knee osteoarthritis: a randomized, controlled, and double-blind study. Am. J. Phys. Med. Rehabil., 93: 405–412.
- 28. Corbett M.S., Rice S.J., Madurasinghe V. et al. (2013) Acupuncture and other physical treatments for the relief of pain due to osteoarthritis of the knee: network meta-analysis. Osteoarthritis Cartilage, 21: 1290–1298.
- 29. Vickers A.J., Cronin A.M., Maschino A.C. et al. (2012) Acupuncture for chronic pain: individual patient data meta-analysis. Arch. Intern. Med., 172: 1444–1453.
- 30. Manheimer E., Cheng K., Linde K. et al. (2010) Acupuncture for peripheral joint osteoarthritis. Cochrane Database Syst. Rev., D001977.
- 31. Rutjes A.W., Nuesch E., Sterchi R. et al. (2009) Transcutaneous electrostimulation for osteoarthritis of the knee. Cochrane Database Syst. Rev., CD002823.
- 32. Atamaz F.C., Durmaz B., Baydar M. et al. (2012) Comparison of the efficacy of transcutaneous electrical nerve stimulation, interferential currents, and shortwave diathermy in knee osteoarthritis: a double-blind, randomized, controlled, multicenter study. Arch. Phys. Med. Rehabil., 93: 748–756.
- 33. Bannuru R.R., Dasi U.R., McAlindon T.E. (2010) Reassessing the role of acetaminophen in osteoarthritis: systematic review and meta-analysis. Osteoarthritis Cartilage, 18(Suppl. 2): S250.
- 34. Herrero-Beaumont G., Ivorra J.A., Del Carmen Trabado M. et al. (2007) Glucosamine sulfate in the treatment of knee osteoarthritis symptoms: a randomized, double-blind, placebo-controlled study using acetaminophen as a side comparator. Arthritis Rheum., 56: 555–567.
- 35. Towheed T.E., Maxwell L., Anastassiades T.P. et al. (2009) Glucosamine therapy for treating osteoarthritis. Cochrane Database Syst. Rev., CD002946.
- 36. Reginster J.Y., Deroisy R., Rovati L.C. et al. (2001) Longterm effects of glucosamine sulphate on osteoarthritis progression: a randomised, placebo-controlled clinical trial. Lancet, 357: 251–256.
- 37. Pavelká K., Gatterová J., Olejarová M. et al. (2002) Glucosamine sulfate use and delay of progression of knee osteoarthritis: a 3-year, randomized, placebo-controlled, double-blind study. Arch. Intern. Med., 162: 2113–2123.
- 38. Reginster J.Y. (2007) The efficacy of glucosamine sulfate in osteoarthritis: financial and nonfinancial conflict of interest. Arthritis Rheum., 56: 2105–2110.
- 39. Bjordal J.M., Klovning A., Ljunggren A.E. et al. (2007) Short-term efficacy of pharmacotherapeutic interventions in osteoarthritic knee pain: a metaanalysis of randomised placebo-controlled trials. Eur. J. Pain., 11: 125–138.
- 40. Wandel S., Jüni P., Tendal B. et al. (2010) Effects of glucosamine, chondroitin, or placebo in patients with osteoarthritis of hip or knee: network meta-analysis. Br. Med. J., 341: c4675.
- 41. Reginster J.Y., Altman R.D., Hochberg M.C. (2010) Glucosamine and osteoarthritis. Prescribed regimen is effective. Br. Med. J., 341: c6335.
- 42. Groves T. (2011) Effects of glucosamine, chondroitin, or placebo in patients with osteoarthritis of hip or knee: network meta-analysis. Report from post publication review meeting. Br. Med. J. Avilable from: (Published online: http://www.bmj.com/rapid-response/2011/11/03/report-bmj-post-publicationreview-meeting).
- 43. Clegg D.O., Reda D.J., Harris C.L. et al. (2006) Glucosamine, chondroitin sulfate, and the two in combination for painful knee osteoarthritis. N. Engl. J. Med., 354: 795–808.
- 44. Altman R.D. (2009) Glucosamine therapy for knee osteoarthritis: pharmacokinetic considerations. Expert Rev. Clin. Pharmacol., 2: 359–371.
- 45. Hochberg M.C., Zhan M., Langenberg P. (2008) The rate of decline of joint space width in patients with osteoarthritis of the knee: a systematic review and metaanalysis of randomized placebo-controlled trials of chondroitin sulfate. Curr. Med. Res. Opin., 24: 3029–3035.
- 46. Kahan A., Uebelhart D., De Vathaire F.et al. (2009) Long-term effects of chondroitins 4 and 6 sulfate on knee osteoarthritis: the study on osteoarthritis progression prevention, a two-year, randomized, double-blind, placebo-controlled trial. Arthritis Rheum., 60: 524–533.
- 47. Wildi L.M., Raynauld J.P., Martel-Pelletier J. et al. (2011) Chondroitin sulphate reduces both cartilage volume loss and bone marrow lesions in knee osteoarthritis patients starting as early as 6 months after initiation of therapy: a randomised, double-blind, placebo-controlled pilot study using MRI. Ann. Rheum. Dis., 70: 982–989.
- 48. Reichenbach S., Sterchi R., Scherer M. et al. (2007) Metaanalysis: chondroitin for osteoarthritis of the knee or hip. Ann. Intern. Med., 146: 580–590.
- 49. Zegels B., Crozes P., Uebelhart D. et al. (2013) Equivalence of a single dose (1200 mg) compared to a three-time a day dose (400 mg) of chondroitin 4&6 sulfate in patients with knee osteoarthritis. Results of a randomized double blind placebo controlled study. Osteoarthritis Cartilage, 21: 22–27.
- 50. Martel-Pelletier J., Roubille C., Abram F. et al. (2013) First-line analysis of the effects of treatment on progression of structural changes in knee osteoarthritis over 24 months: data from the osteoarthritis initiative progression cohort. Ann. Rheum. Dis. [Epub ahead of print].
- 51. Fransen M., Agaliotis M., Nairn L. et al. (2014) Glucosamine and chondroitin for knee osteoarthritis: a double-blind randomised placebo-controlled clinical trial evaluating single and combination regimens. Ann. Rheum. Dis. [Epub ahead of print].
- 52. Christensen R., Bartels E.M., Astrup A. et al. (2008) Symptomatic efficacy of avocado-soybean unsaponifiables (ASU) in osteoarthritis (OA) patients: a meta-analysis of randomized controlled trials. Osteoarthritis Cartilage,16: 399–408.
- 53. Bartels E.M., Bliddal H., Schondorff P.K. et al. (2010) Symptomatic efficacy and safety of diacerein in the treatment of osteoarthritis: a meta-analysis of randomized placebo-controlled trials. Osteoarthritis Cartilage, 18: 289–296.
- 54. The European Medicines Agency (2013) Meeting highlights from the Pharmacovigilance Risk Assessment Committee (PRAC). Avilable from: http://www. ema.europa.eu/ema/index.jsp?curl=pages/news_and_events/news/2013/12/ news_detail_001985.jsp&mid=WC0b01ac058004d5c1.
- 55. Reginster J.Y., Badurski J., Bellamy N. et al. (2013) Efficacy and safety of strontium ranelate in the treatment of knee osteoarthritis: results of a double-blind, randomised placebo-controlled trial. Ann. Rheum. Dis., 72: 179–186.
- 56. The European Medicines Agency (2014) European Medicines Agency recommends that Protelos/Osseor remain available, but with further restrictions. Avilable from: http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_ and_events/news/2014/02/news_detail_002031.jsp&mid=WC0b01ac058001d 126.
- 57. Lin J., Zhang W., Jones A., Doherty M. (2004) Efficacy of topical nonsteroidal antiinflammatory drugs in the treatment of osteoarthritis: meta-analysis of randomised controlled trials. Br. Med. J., 329: 324–326.
- 58. Tugwell P.S., Wells G.A., Shainhouse J.Z. (2004) Equivalence study of a topical diclofenac solution (pennsaid) compared with oral diclofenac in symptomatic treatment of osteoarthritis of the knee: a randomized controlled trial. J. Rheumatol., 31: 2002–2012.
- 59. Simon L.S., Grierson L.M., Naseer Z. et al. (2009) Efficacy and safety of topical diclofenac containing dimethyl sulfoxide (DMSO) compared with those of topical placebo, DMSO vehicle and oral diclofenac for knee osteoarthritis. Pain, 143: 238–245.
- 60. Chou R., McDonagh M.S., Nakamoto E., Griffin J. (2006) Analgesics for osteoarthritis: An update of the 2006 comparative effectiveness review [internet].
- 61. Underwood M., Ashby D., Cross P. et al. (2008) TOIB study team. Advice to use topical or oral ibuprofen for chronic knee pain in older people: randomised controlled trial and patient preference study. Br. Med. J., 336: 138–142.
- 62. Matthews P., Derry S., Moore R.A., McQuay H.J. (2009) Topical rubefacients for acute and chronic pain in adults. Cochrane Database Syst. Rev., 8: CD007403.
- 63. Zhang W., Jones A., Doherty M. (2004) Does paracetamol (acetaminophen) reduce the pain of osteoarthritis? A meta-analysis of randomised controlled trials. Ann. Rheum. Dis., 63: 901–907.
- 64. Pincus T., Koch G., Lei H. et al. (2004) Patient preference for Placebo, Acetaminophen (paracetamol) or Celecoxib Efficacy Studies (PACES): two randomised, double blind, placebo controlled, crossover clinical trials in patients with knee or hip osteoarthritis. Ann. Rheum. Dis., 63: 931–939.
- 65. Lagnaoui R., Baumevielle M., Bégaud B. et al. (2006) Less use of NSAIDs in long-term than in recent chondroitin sulphate users in osteoarthritis: a pharmacy-based observational study in France. Therapie, 61: 341–346.
- 66. Witter J. (2000) Celebrex Capsules (Celecoxib) NDA 20-998/S-009 Medical Officer Review. Available from: http://www.fda.gov/ohrms/dockets/ac/01/briefing/ 3677b1_03_med.pdf [cited 31.03.2011].
- 67. Laine L., Curtis S.P., Cryer B. et al. MEDAL Steering Committee (2007) Assessment of upper gastrointestinal safety of etoricoxib and diclofenac in patients with osteoarthritis and rheumatoid arthritis in the Multinational Etoricoxib and Diclofenac Arthritis Long-term (MEDAL) programme: a randomized comparison. Lancet, 369: 465–473.
- 68. Bhala N., Emberson J., Merhi A. et al. (2013) Coxib and traditional NSAID Trialists’ (CNT) Collaboration: Vascular and upper gastrointestinal effects of non-steroidal anti-inflammatory drugs: meta-analyses of individual participant data from randomised trials. Lancet, 382: 769–779.
- 69. Latimer N., Lord J., Grant R.L. et al. (2009) Cost effectiveness of COX 2 selective inhibitors and traditional NSAIDs alone or in combination with a proton pump inhibitor for people with osteoarthritis. Br. Med. J., 339: b2538.
- 70. Chan F.K., Wong V.W., Suen B.Y. et al. (2007) Combination of a cyclo-oxygenase-2 inhibitor and a proton-pump inhibitor for prevention of recurrent ulcer bleeding in patients at very high risk: a double-blind, randomised trial. Lancet, 369: 1621–1626.
- 71. Moore R.A., Derry S., Makinson G.T., McQuay H.J. (2005) Tolerability and adverse events in clinical trials of celecoxib in osteoarthritis and rheumatoid arthritis: systematic review and meta-analysis of information from company clinical trial reports. Arthritis Res. Ther., 7: R644–R655.
- 72. The European Medicines Agency. Assessment report for non-steroidal antiinflammatory drugs (NSAIDs) and cardiovascular risk (2012) EMA/696137/2012.
- 73. Solomon S.D., Wittes J., Finn P.V. et al. (2008) Cardiovascular risk of celecoxib in 6 randomized placebo-controlled trials. Circulation, 117: 2104–2113.
- 74. Gislason G.H., Jacobsen S., Rasmussen J.N. et al. (2006) Risk of death or reinfarction associated with the use of selective cyclooxygenase-2 inhibitors and nonselective nonsteroidal antiinflammatory drugs after acute myocardial infarction. Circulation, 113: 2906–2913.
- 75. Olsen A.M., Fosbøl E.L., Lindhardsen J. et al. (2012) Longterm cardiovascular risk of nonsteroidal anti-inflammatory drug use according to time passed after first-time myocardial infarction: a nationwide cohort study. Circulation, 126: 1955–1963.
- 76. Bresalier R.S., Sandler R.S., Quan H. et al. (2005) Cardiovascular events associated with rofecoxib in a colorectal adenoma chemoprevention trial. N. Engl. J. Med., 352: 1092–1102 [Erratum in: N. Engl. J. Med., 2006, 355: 221].
- 77. Solomon S.D., McMurray J.J., Pfeffer M.A. et al. (2005) Cardiovascular risk associated with celecoxib in a clinical trial for colorectal adenoma prevention. N. Engl. J. Med., 352: 1071–1080.
- 78. US Food and Drug Administration (2006) Information for healthcare professionals: Concomitant use of ibuprofen and aspirin. Available from: http://www.fda. gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandPro viders/ucm125222.htm
- 79. Fitzgerald G.A. (2004) Coxibs and cardiovascular disease. N. Engl. J. Med., 351: 1709–1711.
- 80. American College of Rheumatology Ad Hoc Group on Use of Selective and Nonselective Nonsteroidal Antiinflammatory Drugs (2008) Recommendations for use of selective and nonselective nonsteroidal antiinflammatory drugs: an American College of Rheumatology white paper. Arthritis Rheum., 59: 1058–73 [Erratum in: Arthritis Rheum 2008;58:1686. Dosage error in article text].
- 81. Bannuru R.R., Natov N.S., Dasi U.R. et al. (2011) Therapeutic trajectory following intra-articular hyaluronic acid injection in knee osteoarthritis—meta-analysis. Osteoarthritis Cartilage, 19: 611–619.
- 82. Rutjes A.W., Jüni P., da Costa B.R. et al. (2012) Viscosupplementation for osteoarthritis of the knee: a systematic review and meta-analysis. Ann. Intern. Med., 157: 180–191.
- 83. Bannuru R.R., Natov N.S., Obadan I.E. et al. (2009) Therapeutic trajectory of hyaluronic acid versus corticosteroids in the treatment of knee osteoarthritis: a systematic review and meta-analysis. Arthritis Rheum., 61: 1704–1711.
- 84. Abbott T., Altman R.D., Dimef R. et al. (2013) Do hyaluronic acid injections delay total knee replacement surgery? Arthritis Rheum., 65: S910–S911.
- 85. Bannuru R.R., Vaysbrot E.E., Sullivan M.C., McAlindon T.E. (2013) Relative efficacy of hyaluronic acid in comparison with NSAIDs for knee osteoarthritis: a systematic review and meta-analysis. Semin. Arthritis Rheum., 43: 593–599 [pii:S0049–0172(13)00206–0].
- 86. Bellamy N., Campbell J., Robinson V. et al. (2006) Intraarticular corticosteroid for treatment of osteoarthritis of the knee. Cochrane Database Syst .Rev., CD005328 [review].
- 87. Raynauld J.P., Buckland-Wright C., Ward R. et al. (2003) Safety and efficacy of long-term intraarticular steroid injections in osteoarthritis of the knee: a randomized, double-blind, placebo-controlled trial. Arthritis Rheum., 48: 370–377 [Erratum in: Arthritis Rheum., 2003, 48: 3300].
- 88. Cepeda M.S., Camargo F., Zea C., Valencia L. (2007) Tramadol for osteoarthritis: a systematic review and metaanalysis. J. Rheumatol., 34: 543–555.
- 89. Emkey R., Rosenthal N., Wu S.C. et al., CAPSS-114 Study Group (2004) Efficacy and safety of tramadol/acetaminophen tablets (Ultracet) as add-on therapy for osteoarthritis pain in subjects receiving a COX-2 nonsteroidal antiinflammatory drug: a multicenter, randomized, double-blind, placebocontrolled trial. J. Rheumatol., 31: 150–156.
- 90. Altman R.D. (2004) Pain relief in osteoarthritis: the rationale for combination therapy. J. Rheumatol., 31: 5–7.
- 91. Solomon D.H., Rassen J.A., Glynn R.J. et al. (2010) The comparative safety of analgesics in older adults with arthritis. Arch. Intern. Med., 170: 1968–1976.
- 92. Arendt-Nielsen L., Nie H., Laursen M.B. et al. (2010) Sensitization in patients with painful knee osteoarthritis. Pain, 149: 573–581.
- 93. Hochberg M.C., Wohlreich M., Gaynor P. et al. (2012) Clinically relevant outcomes based on analysis of pooled data from 2 trials of duloxetine in patients with knee osteoarthritis. J. Rheumatol., 39: 352–358.
- 94. Risser R.C., Hochberg M.C., Gaynor P.J. et al. (2013) Responsiveness of the Intermittent and Constant Osteoarthritis Pain (ICOAP) scale in a trial of duloxetine for treatment of osteoarthritis knee pain. Osteoarthritis Cartilage, 21: 691–694.
- 95. Neogi T., Frey-Law L., Scholz J. et al. (2013) Sensitivity and sensitisation in relation to pain severity in knee osteoarthritis: trait or state? Ann. Rheum. Dis. [Epub ahead of print].
- 96. Ethgen O., Bruyere O., Richy F. et al. (2004) Health-related quality of life in total hip and total knee arthroplasty: a qualitative and systematic review of the literature. J. Bone Joint Surg. Am., 86-A: 963–974.
- 97. Griffin T., Rowden N., Morgan D. et al. (2007) Unicompartmental knee arthroplasty for the treatment of unicompartmental osteoarthritis: a systematic study. ANZ J. Surg., 77: 214–221.
- 98. Brouwer R.W., Raaij van T.M., Bierma-Zeinstra S.M. et al. (2007) Osteotomy for treating knee osteoarthritis. Cochrane Database Syst. Rev., CD004019.
- 99. Laupattarakasem W., Laopaiboon M., Laupattarakasem P., Sumananont C. (2008) Arthroscopic debridement for knee osteoarthritis. Cochrane Database Syst. Rev., CD005118.
- 100. Nüesch E., Rutjes A.W., Husni E. et al. (2009) Oral or transdermal opioids for osteoarthritis of the knee or hip. Cochrane Database Syst. Rev., 7: CD003115.
- 101. Chou R., Fanciullo G.J., Fine P.G. et al. (2009) Clinical guidelines for the use of chronic opioid therapy in chronic noncancer pain. J. Pain,10:113–130.
- 102. Bingham C.O.3, Buckland-Wright J.C., Garnero P. et al. (2006) Risedronate decreases biochemical markers of cartilage degradation but does not decrease symptoms or slow radiographic progression in patients with medial compartment osteoarthritis of the knee: results of the two-year multinational knee osteoarthritis structural arthritis study. Arthritis Rheum., 54: 3494–3507.
Рекомендации относительно алгоритма ведения ПАЦИЕНТОВ С стеоартрозОМ коленного сустава в Европе и по всему миру: отчет специальной комиссии Европейского общества по изучению клинических и экономических аспектов остеопороза и остеоартроза (ESCEO)
Резюме. В существующих практических руководствах по остеоартрозу (ОА) анализируют данные, обосновывающие каждый из предложенных типов лечения, но не распределяют все виды терапии по приоритету в определенной последовательности. Цель — разработка алгоритма терапевтических рекомендаций, которые врачу легче интерпретировать на основании имеющихся подтверждающих данных и которые можно применять как в Европе, так и по всему миру. Коленный сустав использовали в качестве модели сустава, пораженного ОА. Методы. ESCEO созвало специальную комиссию из 13 международных экспертов (ревматологов, клинических эпидемиологов, ученых-клиницистов). Рассмотрены существующие руководства, перечислены все типы лечения и найдены все подтверждающие результаты с использованием имеющихся баз данных. Результаты. Базовые принципы включают необходимость применения комбинации фармакологического и нефармакологического лечения с ключевым набором начальных мероприятий, включая доступ к информации/образованию, уменьшение массы тела при наличии избыточной массы и подходящую программу физических упражнений. Определено четыре этапа. Этап 1 — фоновая терапия, которая может быть как нефармакологической, так и фармакологической. Этап 2 — расширенное фармакологическое ведение пациентов с персистирующими симптомами, которое фокусируется на применении пероральных циклооксигеназа-2-селективных или неселективных нестероидных противовоспалительных препаратов, выбранных на основании сопутствующих факторов риска, в сочетании с внутрисуставными кортикостероидами или гиалуронатом для дальнейшего ослабления симптомов. Этап 3 — последние попытки фармакологического лечения перед проведением хирургического вмешательства представлены слабыми опиоидами и другими анальгетиками центрального действия. Этап 4 — фармакологическое и хирургическое лечение заболевания в терминальной стадии с применением классических опиоидов в качестве единственной альтернативы в случаях, когда хирургическая операция противопоказана. Выводы. Предложенный терапевтический алгоритм может стать новой общей схемой для разработки будущих руководств для ведения ОА, которые будут лучше восприниматься врачами.
алгоритм, остеоартроз коленного сустава.

Leave a comment