КАЛЬЦИНАТИ М’ЯКИХ ТКАНИН ПРИ СИСТЕМНОМУ ЧЕРВОНОМУ ВОВЧАКУ. КЛІНІЧНИЙ ВИПАДОК ТА ОГЛЯД ЛІТЕРАТУРИ
Джус М.Б.1, Івашківський О.І.2, Карасевська Т.А.1, Потьомка Р.А.2, Новицька А.Л.2, Мікукстс В.Я.2, Мазур В.І. 1
- 1Національний медичний університет імені О.О. Богомольця
- 2КНП «Олександрівська клінічна лікарня м. Києва»
Резюме. Актуальність. Кальцифікація м’яких тканин при системному червоному вовчаку (СЧВ) є рідкісним клінічним проявом. Однак існують різні літературні дані щодо локалізації кальцинатів при СЧВ та зв’язку їх появи з активністю захворювання та супутніми станами. Також немає єдиної думки щодо методів лікування кальцифікації м’яких тканин. Мета дослідження. Описати клінічний випадок розвитку кальцинатів у м’язах гомілок пацієнтки з СЧВ та оцінити в динаміці ефективність призначеного лікування. Об’єктом дослідження стала жінка віком 55 років, яка хворіє на СЧВ впродовж 7 років. У статті детально описані динаміка захворювання, його ускладнення, супутні захворювання та стани, етапи діагностичного пошуку причини появи кальцинатів м’яких тканин. Проведено літературний огляд за період з 1969 по 2020 р. з використанням MEDLINE/PubMed, ScienceDirect, Wiley Online Library та Scopus, відібрано 45 статей із задокументованими випадками кальцифікації м’яких тканин у хворих на СЧВ, з яких до аналізу включено 29 опублікованих англійською мовою. Провівши диференційну діагностику та проаналізувавши літературу, виключивши інші потенційні причини розвитку патології, дійшли висновку, що даний клінічний випадок є ще одним задокументованим описом кальцифікації м’яких тканин у хворої на СЧВ. Як й інші системні захворювання сполучної тканини, СЧВ має безліч нез’ясованих чи недостатньо вивчених особливостей патогенезу та може мати різноманітні, в тому числі рідкісні, клінічні прояви. Опис клінічного випадку, проведений аналіз літератури є доповненням до сучасних відомостей та мають на меті привернення уваги до рідкісних проявів системних хвороб і можливостей сучасної терапії.
УДК: 616–018.2–036.12:612.017.1]:616–003.84
DOI: 10.32471/rheumatology.2707-6970.83.16006
Вступ
Системний червоний вовчак (СЧВ) — системне аутоімунне поліетіологічне захворювання, що характеризується гіперпродукцією аутоантитіл до різних компонентів клітинного ядра з розвитком імунозапального ушкодження тканин і внутрішніх органів. В усіх вікових групах захворюваність є вищою серед жінок, особливо репродуктивного віку, коли співвідношення захворюваності жінок до чоловіків становить 8:1–15:1, у той час як найменш виражена така закономірність у препубертатному віці — 4:3 (Almaani S. et al., 2017). За останні 60 років 5-річне виживання хворих на СЧВ зросло з 50 до 91–97% (Заремба Є.Х. та співавт., 2017). Таке покращення пов’язано в першу чергу з вчасною діагностикою, а отже, і раннім початком терапії, та веденням хворих за принципом «лікування до досягнення мети» — стійкої клініко-лабораторної ремісії.
СЧВ супроводжується поліорганними ураженнями та розвитком різноманітних ускладнень, серед яких відмічаються як типові, так і рідкісні. Зокрема, однією з основних причин несприятливого прогнозу захворювання є ураження нирок. Незважаючи на прогрес у діагностиці та лікуванні даної патології, ураження нирок залишається провідною причиною смертності хворих на СЧВ. У багатьох таких пацієнтів розвиваються хронічна хвороба нирок (ХХН), а також ускладнення, супутні захворювання і стани, що є наслідком імуносупресивної терапії: інфекції, остеопороз, ураження серцево-судинної та репродуктивної систем тощо (Anders H.J. et al., 2020). Щодо методів лікування люпус-нефриту при СЧВ проводяться багато досліджень, з’являються нові перспективні препарати (Imran T.F. et al., 2016; Zhong Z. et al., 2019; Furie R. et al., 2020). ХХН також асоціюється з розвитком недостатності вітаміну D, системним остеопорозом, вторинним гіперпаратиреозом.
Так, у дослідженні C. Muñoz та D.A. Isenberg (2019) вивчали частоту розвитку ендокринної патології у хворих на СЧВ шляхом аналізу історій хвороб впродовж 1978–2017 рр. Серед 708 проаналізованих пацієнтів у 55 з них зафіксовано патологію ендокринної системи чи ендокринні розлади. Найбільш часто реєстрували вторинний гіперпаратиреоз, частка якого становила 5,2%. Така патологія без належного лікування закономірно веде до метаболічних розладів та кардіоваскулярних ускладнень. До лабораторних показників, що підлягають ретельному контролю, належать загальний та іонізований кальцій у сироватці крові, фосфор, 25-гідроксикальциферол та паратгормон (Chandran M., Wong J., 2019).
Згідно з літературними даними розрізняють 5 основних типів кальцифікації м’яких тканин: дистрофічний, метастатичний, ідіопатичний, ятрогенний та кальцифілаксію (Jimenez-Gallo D. et al., 2015). Найчастіше при системних захворюваннях сполучної тканини відмічається дистрофічний процес, що полягає у вторинному до ушкодження тканин формуванні кальцинатів. Загальноприйнятим є той факт, що кальцинати м’яких тканин виявляють при дерматоміозиті, системній склеродермії, CREST-синдромі, overlap-синдромі, проте вони є рідкістю для СЧВ (Lopez A.T., Grossman M.E., 2017).
Ще у 70-х роках минулого століття було зовсім небагато задокументованих випадків кальцифікації м’яких тканин у хворих на СЧВ. За різними даними на той момент описано близько 10 таких хворих (Quismorio F.P. et al., 1975). При аналізі клінічних випадків кальцифікації м’яких тканин різної локалізації у хворих на СЧВ у першу чергу виключалися інші можливі причини порушення мінерального обміну: первинний та вторинний гіперпаратиреоз (Budin J.R., Feldman F., 1975). Автори припустили, що такий патологічний процес є схожим у пацієнтів із різними системними захворюваннями сполучної тканини та має подібні патогенетичні механізми, що, залежно від індивідуальних факторів, виникають у відповідь на ішемію, інфекцію, васкуліт, аутоімунну реакцію чи фібриноїдне набухання.
Ще декілька схожих кейсів задокументовано у роботі A. Minami та співавторів (1994), проте, як вказується у статті, де описується поширена кальцифікація м’яких тканин у пацієнтів із тривалим перебігом захворювання, автори зафіксували лише 26 подібних випадків. На момент написання статті у світовій літературі можна знайти не більше 45 описів кальцифікації м’яких тканин при СЧВ (Achebe I. et al., 2020).
Пропонуємо вашій увазі клінічний випадок розвитку кальцифікації м’яких тканин у хворої на СЧВ. Наявність у пацієнтки на тлі СЧВ ХХН та вторинного гіперпаратиреозу, хронічної хвороби вен нижніх кінцівок, тривалого прийому варфарину як можливих факторів розвитку кальцифікації тканин, потребували диференційної діагностики у конкретній ситуації.
Мета: описати клінічний випадок розвитку кальцинатів у м’язах гомілок пацієнтки з СЧВ та оцінити в динаміці ефективність призначеного лікування.
Матеріали і методи
У даній статті описано клінічний випадок та проаналізовано літературу, що описує дану патологію. Об’єкт дослідження — хвора на СЧВ із люпус-нефритом, вторинним гіперпаратиреозом, хронічною хворобою вен нижніх кінцівок, а також іншими проявами основного системного захворювання і супутніми хворобами, у якої під час дослідження виявлено кальцинати м’яких тканин гомілок.
Аналіз літературних даних охоплює статті за період з 1969 по 2020 р. з таких джерел, як MEDLINE/PubMed, ScienceDirect, Wiley Online Library та Scopus. Пошукові запити включали різноманітні терміни та їх комбінації: «системний червоний вовчак», «кальцинати м’яких тканин», «лікування кальцифікації», «дистрофічний тип кальцифікації», «кальцифікація при хронічній хворобі нирок», «calcinosis cutis», «кальцинати та вторинний гіперпаратиреоз», «тромбоз та варикозне розширення вен» тощо. В аналіз включали огляди літератури, «case-based reviews» та описи клінічних випадків. Відібрано 45 джерел із задокументованими випадками кальцифікації м’яких тканин у хворих на СЧВ, з яких у статті проаналізовано 29, що опубліковані англійською мовою.
Результати (опис клінічного випадку). Хвора віком 55 років була госпіталізована до І ревматологічного відділення КНП «Олександрівська клінічна лікарня м. Києва» у лютому 2020 р. із діагнозом системний червоний вовчак, хронічний перебіг, за направленням ревматолога за місцем проживання у зв’язку з погіршенням самопочуття та підвищенням рівня креатиніну в сироватці крові.
Провідними скаргами при госпіталізації були загальна слабкість, втомлюваність, задишка, набряки гомілок, біль та набряк у суглобах кистей, синці на шкірі тулуба та кінцівок, зміна кольору шкіри на гомілках.
Із анамнезу захворювання відомо, що у 2010 р. перенесла тромбоемболію легеневої артерії (ТЕЛА), у 2011 р. відмічено епізод порушення мови. У 2013 р. виявлено підвищення креатиніну в сироватці крові до 250 мкмоль/л, швидкість клубочкової фільтрації (ШКФ) — 87 мл/хв/м2, на основі чого встановлено діагноз ХХН. Пацієнтку також періодично турбував біль у плечових та ліктьових суглобах. При амбулаторному обстеженні діагностовано аутоімунний тиреоїдит, еутиреоз.
У 2014 р. хвора вперше направлена до ревматологічного відділення, де на підставі скарг, анамнезу та результатів об’єктивного огляду припущено діагноз СЧВ. При обстеженні виявлено лейкопенію, анемію та тромбоцитопенію, протеїнурію, а також позитивні ANA, SS-A антитіла та антитіла до хроматину. За критеріями SLICC 2012 (Petri M. et al., 2012) нараховано 5 балів: артрит — 1, ураження нирок (протеїнурія >0,5 г/добу) — 1, лейкопенія — 1, тромбоцитопенія — 1, позитивний вовчаковий антикоагулянт — 1, встановлено діагноз СЧВ. Окрім того, враховуючи тромбоз вен нижніх кінцівок та ТЕЛА в анамнезі у поєднанні з підтвердженою наявністю вовчакового антикоагулянта встановлено антифосфоліпідний синдром на основі Сіднейських критеріїв, 2012 р. (Garg N., Deodhar A., 2012). Наявні гіперпігментація та трофічні зміни шкіри гомілок розцінені як прояв посттромбофлебітичного синдрому. Хворій призначена така терапія: метилпреднізолон, гідроксихлорохін, інгібітори ангіотензинперетворювального ферменту (іАПФ), нестероїдні протизапальні препарати (НПЗП) та варфарин.
У березні 2015 р. стан хворої погіршився: відмічалися еритроцитурія та протеїнурія в межах сечового синдрому, у зв’язку з чим вона була госпіталізована. При огляді гомілок зберігалися двобічна гіперпігментація шкіри та варикозно розширені вени нижніх кінцівок. Пальпаторно виявлено значне ущільнення м’яких тканин гомілок. При проведенні рентгенографії гомілок на той момент підтверджено наявність кальцинатів у м’яких тканинах (рис. 1). При рентгенографії кистей, стоп та органів грудної клітки кальцинатів не виявлено.
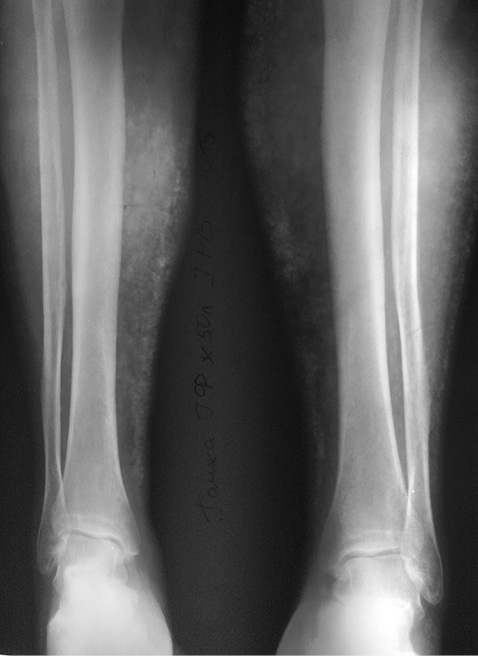
Враховуючи виявлені кальцинати, пацієнтці призначено дилтіазем 80 мг двічі на добу, а варфарин, у зв’язку з його можливим впливом на їх формування, замінено на дабігатран. Тоді ж, враховуючи прогресування ХХН, еналаприл замінено на раміприл.
При госпіталізації у 2016 р. клінічні прояви та лабораторні дані відповідали мінімальній активності СЧВ. При огляді виявляли незначні набряки на нижніх кінцівках, варикозне розширення вен нижніх кінцівок, зберігалися гіперпігментація та трофічні зміни шкіри гомілок, пальпаторно м’які тканини гомілок залишалися ущільненими. Зафіксовано підвищення артеріального тиску. Продовжено терапію глюкокортикоїдами у підтримувальній дозі, гідроксихлорохіном, відкориговано терапію артеріальної гіпертензії. Дозу дилтіазему підвищено до 120 мг двічі на добу. Протягом наступних 4 років клініко-лабораторні показники пацієнтки були стабільними, спостерігалася у ревматолога за місцем проживання.
На момент останньої госпіталізації (лютий 2020 р.) загальний стан хворої середнього ступеня тяжкості. При огляді: гіперпігментація та трофічні зміни шкіри гомілок (рис. 2). Болю, набряку чи обмеження рухів у суглобах немає. Пальпаторно гомілки виявилися м’якшими, ущільнення м’яких тканин гомілок зменшилося. При лабораторному дослідженні виявлено анемію легкого ступеня, помірну тромбоцитопенію, незначно підвищену швидкість осідання еритроцитів (ШОЕ) — 24 мм/год, рівень креатиніну в сироватці крові — 176 мкмоль/л (ШКФ — 51 мл/хв/м2), С-реактивний білок (СРБ) <6 мг/л; загальний кальцій в сироватці крові — 2,49 ммоль/л, іонізований кальцій — 1,3 ммоль/л; фосфор — 1,40 ммоль/л; підвищений рівень паратгормону крові — 788 пг/мл, рівень 25-OH вітаміну D — 6,76 нг/мл; C3, C4 компоненти комплементу в межах норми, антитіла до двоспіральної ДНК — негативні.
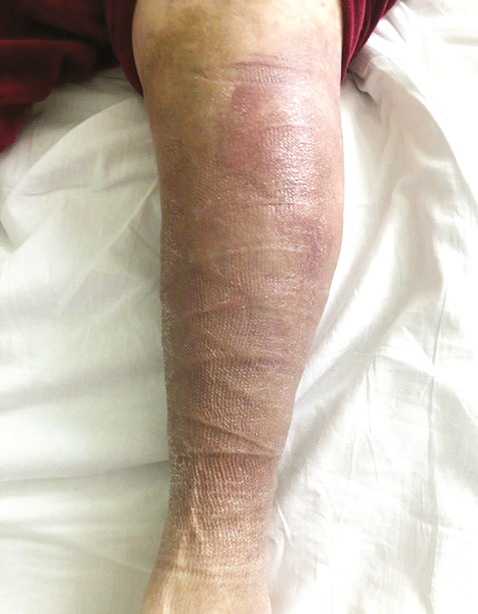
А
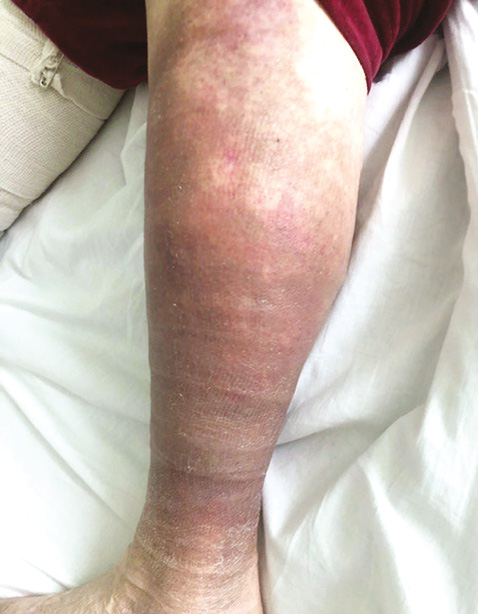
Б
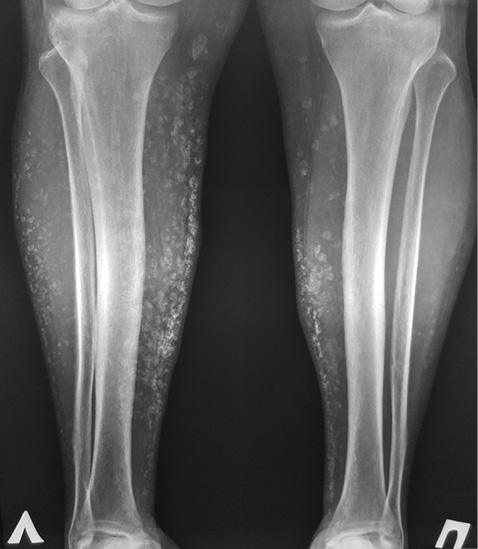
При рентгенографії нижніх кінцівок хворої (рис. 3) відмічені множинні звапнення м’яких тканин, які можна порівняти із попередніми знімками.
А
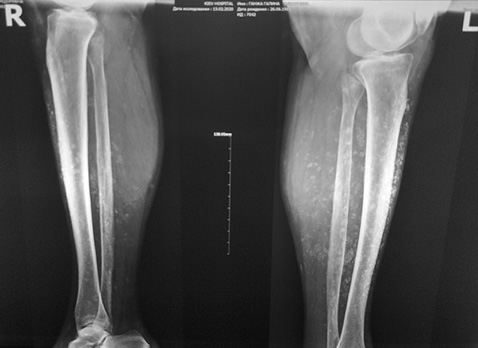
Б
На останніх рентгенограмах виявлена краща візуалізація кальцинатів у гомілках хворої. Така рентгенологічна картина не до кінця відповідає описаній позитивній клінічній динаміці. На нашу думку, дана ситуація могла виникнути через різницю якості проведення рентгенографії та безпосередньо не пов’язана зі зміною кальцифікації. Також необхідно відмітити відсутність негативної динаміки: прогресування кальцифікації чи утворення нових кальцинатів.
Пацієнтці проведена денситометрія, за результатами якої показники мінеральної щільності кісткової тканини (МЩКТ) відповідали остеопорозу на рівні стегнових кісток (МЩКТ шийки стегнової кістки ліворуч — 0,570 г/см2, Т-критерій –3,1SD) й остеопенії на рівні поперекового відділу хребта (МЩКТ — 0,803 г/см2, Т-критерій –2,2SD) та кісток передпліччя (МЩКТ середньої третини кісток передпліччя — 0,450 г/см2, Т-критерій –2,2SD). Зроблено висновок про наявність системного остеопорозу, змішаного ґенезу (постменопаузального, глюкокортикоїд-індукованого). За ультразвуковим дослідженням судин нижніх кінцівок встановлено варикозне розширення підшкірних вен, тромбоз поверхневих та глибоких вен нижніх кінцівок (переважно ліворуч), посттромбофлебітичний синдром.
Враховуючи атиповий перебіг основного захворювання та з метою проведення диференційної діагностики, діагноз СЧВ у хворої переглядався. За новими критеріями EULAR/ACR 2019 у хворої наявні прояви з клінічного домену: ураження суглобів — 6; з гематологічного домену: тромбоцитопенія — 4; ураження нирок: протеїнурія >0,5 г/добу — 4, з імунологічного домену: вовчаковий антикоагулянт — 2; загальна кількість балів — 16, що підтверджує встановлений діагноз (Aringer M. et al., 2019).
Клінічний діагноз
Основний: СЧВ, хронічний перебіг, І ст. активності, з ураженням нирок (люпус-нефрит, хронічна хвороба нирок ІІІ ст. ШКФ — 51 мл/хв/м2), РЕС (гепатоспленомегалія в анамнезі), суглобів (поліартрит в анамнезі, артралгії, ФНС 0 ст.), м’язів (осифікуючий міозит), з гематологічним синдромом (анемія, лейкопенія, тромбоцитопенія), з ураженням щитоподібної залози (аутоімунний тиреоїдит, еутиреоз), з антифосфоліпідним синдромом з ураженням судин нижніх кінцівок (венозні тромбози, ТЕЛА у 2010 р.), ANA+, Aт до хроматину+, Ro-SSA+.
Супутній: вторинна артеріальна гіпертензія ІІ ст., 3 ст., ризик 4 (дуже високий), СН І ст. Системний остеопороз без патологічних переломів. Недостатність вітаміну D. Вторинний гіперпаратиреоз.
Зважаючи на прогресування люпус-нефриту, з метою індукції ремісії до лікування додано внутрішньовенне введення циклофосфаміду 0,5 г з інтервалом в 2 тиж.
Враховуючи результати денситометрії, наявний дефіцит вітаміну D на тлі ХХН рекомендовано продовжити прийом препаратів кальцію та призначено активні метаболіти вітаміну D.
Протягом подальшого спостереження клінічний стан хворої залишався стабільним. Кальцинати м’яких тканин гомілок виявилися чутливими до терапії дилтіаземом та інтенсифікації терапії СЧВ. Позитивна динаміка полягала у зниженні інтенсивності гіперпігментації та трофічних змін шкіри гомілок, а також у зменшенні їх ущільнення — при об’єктивному огляді пальпаторно гомілки стали м’якшими. Також необхідно відмітити відсутність прогресування змін чи утворення кальцинатів de novo.
У таблиці наводимо порівняльну клініко-лабораторну характеристику деяких описаних в літературі випадків кальцифікації м’яких тканин у хворих на СЧВ та власне спостереження.
| Автори, рік, країна | Вік пацієнта, років (стать) | Клінічні прояви, тривалість захворювання | Локалізація кальцинатів | Лабораторні дані |
|---|---|---|---|---|
| Kabir D.I., Malkinson F.D., 1969, США | 20 (ж) | Виразки шкіри, еритематозні атрофічні бляшки на верхніх кінцівках, спині, сідницях, стегнах; тривалість — 4 роки | Розгинальні поверхні ліктьових суглобів та великих пальців рук | — |
| Powell R.J., 1974, Канада |
21 (ж) | Лихоманка, лімфаденопатія, спленомегалія, васкуліт, висип «метелик»; тривалість — 9 років | Обидва передпліччя, сідниці, стегна | Значно підвищена ШОЕ (90 мм/год), LE-клітини (+), ANA (+), знижений рівень комплементу сироватки |
| Budin J.R., Feldman F., 1975, США | 19 (ж) | Лихоманка, артралгії, нефрит, висип, виразки нижніх кінцівок; тривалість — 7 років | Дифузні (стегна, гомілки, плечі та передпліччя, артерії) | LE-клітини (+), ANA (+), зниження рівня комплементу сироватки крові, лейкопенія |
| 60 (ж) | Лихоманка, артрит, плевральний випіт, інфекції, виразки нижніх кінцівок; тривалість — 14 років | Дифузні (підшкірно та у глибоких тканинах стегон та гомілок) | LE-клітини (+), гіпергамаглобулінемія | |
| 23 (ж) | Висип «метелик», артралгії, нефрит, асептичний некроз головок стегнових кісток; тривалість — 6 років | Периартикулярні тканини кистей | LE-клітини (підозра), підвищена ШОЕ | |
| 52 (ж) | Висип, алопеція, синдром Рейно, венозна недостатність нижніх кінцівок | Дифузні (глибокі тканини обох нижніх кінцівок) | LE-клітини (+), знижений комплемент сироватки крові | |
| 22 (ж) | Оніміння кистей та пальців, артралгії, нефрит, піодермія, рецидивуючий тромбофлебіт | Локалізовані (поверхневі тканини правої нижньої кінцівки) | LE-клітини (+) | |
| 40 (ж) | Слабкість, артралгії, лихоманка, лімфаденопатія, нефрит | Локалізовані (глибокі тканини лівого стегна) | LE-клітини (+), ANA (+), зниження рівня комплементу сироватки крові | |
| 20 (ж) | Артралгії, висип | Локалізовані (глибокі тканини правого стегна) | Anti-DNA (+), знижений рівень комплементу сироватки крові | |
| 34 (ч) | Висип, пурпура, нефрит, асептичний некроз голівок стегнових кісток | Стегнові артерії білатерально | ANA (+), тромбоцитопенія | |
| 23 (ж) | Артралгії, висип, нефрит, асептичний некроз стегнових кісток | Ліва підколінна ямка | LE-клітини (+), ANA (+) | |
| Quismorio F.P. et al., 1975, США | 37 (ж) | Поліартрит, алопеція, висип «метелик», плевральний випіт | Обличчя та передпліччя | LE-клітини (+), ANA (+), лейкопенія |
| Weinberger A. et al., 1979, США | 29 (ж) | Еритематозний висип, артрит, лімфаденопатія, синдром Рейно, виразки слизової оболонки ротової порожнини, нефрит, перикардіальний випіт, перфорація носової перегородки; тривалість — 17 років | Дифузні (верхні та нижні кінцівки, грудна клітка, аксилярні ділянки, спина, сідниці) | LE-клітини (+), значно підвищена ШОЕ, гіперглобулінемія, анемія |
| Nomura M. et al., 1990, Японія | 42 (ж) | Лихоманка, синдром Рейно, артралгії, набряки суглобів, алопеція, висип «метелик», еритема, підшкірні вузлики із виразкуванням та виділеннями молочного кольору; тривалість — 7 років | Шия, тулуб, верхні та нижні кінцівки | Значно підвищена ШОЕ (90 мм/год), лейкопенія, ANA (+), протеїнурія та еритроцитурія |
| Rothe M.J. et al., 1990, США | 35 (ж) | Артрит, алопеція, синдром Рейно, фотосенситивний висип, виразки слизової оболонки рота, рецидивуючі плевроперикардити, остеопороз; тривалість — 20 років | Нижні кінцівки (дифузно) | ANA (+), anti-DNA (-), низький рівень комплементу сироватки крові |
| 28 (ж) | Міалгії, лихоманка, синдром Рейно, еритема обличчя, алопеція, назальні виразкування; тривалість — 13 років | Нижні кінцівки | ANA (+), anti-DNA (+), anti-Sm (+), anti-RNP (+), низький рівень комплементу сироватки крові, високі рівні креатинфосфокінази (КФК) | |
| Minami A. et al., 1994, Японія | 30 (ж) | Артрит обох кистей, макулопапульозний еритематозний висип; тривалість — 18 років | Медіальна поверхня лівого ліктьового суглоба, задня поверхня лівого передпліччя; пізніше — симетрично на правій руці, передніх поверхнях колінних суглобів | LE-клітини (+), гіперглобулінемія, підвищена ШОЕ |
| 34 (ж) | Тривалість — 20 років | Розгинальні поверхні передпліч, ліктьових та колінних суглобів | — | |
| Cousins M.A. et al., 1997, США | 43 (ж) | Артралгії, міалгії, синдром Рейно, висип «метелик», виразкування та формування абсцесів у ділянках кальцинатів; тривалість — 12 років | Дифузні та масивні (аксилярні ділянки, передпліччя, нижня частина живота, клубові ділянки, стегна, періанально) | Anti-DNA (+), низький рівень комплементу сироватки крові |
| Park Y.M. et al., 1999, Південна Корея | 33 (ж) | Набряки, артралгії, міалгії, виразки слизової оболонки порожнини рота, слабкість проксимальних груп м’язів кінцівок; тривалість — 11 років | Дифузні (аксилярні та клубові ділянки, верхні та нижні кінцівки) | Anti-DNA (+), ANA (+), SS-A (+), висока ШОЕ |
| Bhatia S. et al., 2001, США | 49 (ж) | Фотосенсибілізація, синдром Рейно, міалгії, артралгії, асептичний некроз головок обох стегон; тривалість — 17 років | Таз, стегна, шкіра голови, грудні залози | ANA (+),
Anti-DNA (-) |
| Tristano A.G. et al., 2006, США, Венесуела | 40 (ж) | Поліартралгії, висип «метелик», набряки ніг; тривалість — 8 років | Тулуб, верхні та нижні кінцівки | ANA (+), Anti-DNA (+), anti-Ro (+), anti-La (+), низькі рівні С3 та С4 компонентів комплементу сироватки крові |
| Carocha A.P. et al, 2010, Бразилія | 30 (ж) | Еритематозні бляшки з виразкуванням на верхніх кінцівках, сідницях, згинальних поверхнях стегон, висип; тривалість — 13 років | Кисті, ліктьові та колінні суглоби | Лейкопенія, підвищена ШОЕ, ANA (+), нормальні рівні сироваткового кальцію та фосфору |
| Huang H.L. et al., 2014, Тайвань | 37 (ж) | Еритематозні болючі бляшки з виразками та виділеннями молочного кольору у ділянках кальцинатів; тривалість — 4 роки | Таз, стегна, гомілки | — |
| Dima A. et al., 2015, Румунія | 65 (ж) | Поліартралгія, функціональні порушення суглобів верхніх та нижніх кінцівок, виразки на сідницях; тривалість — 5 років | Пальці кистей, ліктьові суглоби, стегна, сідничні м’язи | Anti-DNA (+), anti-Ro (+) |
| Soudet S. et al., 2016, Франція | 70 (ж) | Асимптомний перебіг (на фоні терапії); тривалість — 15 років | Нижні кінцівки (стегна та гомілки) | Anti-Sm (+), відсутні ознаки активності СЧВ |
| Lederhandler M. et al., 2016, США | 34 (ж) | Хронічний остеомієліт, виразки правої стопи та лівої гомілки; тривалість — 11 років | Обидві гомілки | Панцитопенія, підвищена ШОЕ |
| Lopez A.T., Grossman M.E., 2017, США | 24 (ж) | Поліартрит, сверблячий висип, нефрит, міокардит, гемолітична анемія, рецидивуючий люпус-церебрит, виразки піднебіння, некротичний васкуліт пальців рук; тривалість — 4 роки | Обличчя (білатерально преаурикулярно) | Anti-DNA (+), anti-Sm (+), ANA (+), anti-SMA (+), анемія, знижений рівень комплементу сироватки крові |
| Achebe I. et al., 2020, США | 36 (ж) | Cиндром Рейно, нефрит, виразки сідничних ділянок, повторні гангрени ІІІ пальця лівої руки, виразка правої гомілки | Дифузні (обличчя, грудна клітка, верхні кінцівки, особливо пальці, права гомілка, ліва стопа, нижня частина живота) | Anti-DNA (+), ANA (+), підвищений рівень СРБ, рівень комплементу в межах норми, низький рівень кальцію та високий — фосфору у сироватці крові |
| Наведений клінічний випадок, 2021, Україна | 55 (ж) | Нефрит, артралгії, втомлюваність, тромбоз та варикозне розширення вен нижніх кінцівок, гіперпігментація та трофічні зміни шкіри гомілок; тривалість — 7 років | Обидві гомілки | ANA (+), SS-A (+), АТ до хроматину (+), anti-DNA (-), C3 та С4 компоненти комплементу в межах норми, анемія, нормальний рівень загального та іонізованого кальцію у крові, фосфору, високий рівень креатиніну в сироватці крові, протеїнурія |
Серед вказаних випадків переважали жінки (28 із 29) молодого віку, середній вік — 36,2 року. Описані хворі з довго- та короткотривалим перебігом захворювання. Середня тривалість серед 22 хворих становила 11 років. У представлених випадках відмічалися пацієнти із безсимптомним перебігом, а також хворі з вираженою симптоматикою. Це стосується як проявів основного системного аутоімунного захворювання, так і симптомів, що безпосередньо спричинені кальцинатами.
Локалізація кальцифікації також була різною. Описано локалізовану та дифузну кальцифікацію м’яких тканин. Найчастіше виявляли кальцинати на нижніх кінцівках (стегна, гомілки, ділянки колінних суглобів, пахвинні ямки) — 25 випадків. При цьому у більшості з них спостерігалися ураження й інших тканин. До них належать м’які тканини обличчя, верхніх кінцівок (особливо кистей, ліктьових суглобів), живота, таза, грудної клітки, аксилярних ділянок. Описані ретроареолярні кальцинати, а також кальцинати, що уражують артерії. Відмічено різноманітні місцеві прояви кальцифікації: описані поверхневі кальцинати із виразкуванням та в деяких випадках виділеннями, схожими на крейду, а також кальцинати, що розташовані глибоко у м’яких тканинах та не викликають симптомів. Серед інших супутніх станів згадується хронічна венозна недостатність нижніх кінцівок, що спостерігалося і в нашої пацієнтки. Лабораторні показники активності та тяжкості системного захворювання також відрізняються. Нерідко виявляють низький рівень С3 та С4 компонентів комплементу в сироватці крові.
Обговорення
Дистрофічний тип кальцифікації м’яких тканин є провідним серед механізмів утворення кальцинатів у пацієнтів із системними захворюваннями сполучної тканини. Він розвивається вторинно в пошкодженій тканині чи зоні некрозу. Така кальцифікація відбувається за нормальних рівнів кальцію сироватки та потенційно може переходити в осифікацію. Близько 95% кальцинатів, що спостерігаються в радіології, належать до згаданого патогенетичного типу (Freire V. et al., 2018). Кальцифікація може супроводжувати перебіг інших захворювань та станів. До них, зокрема, належать ХХН та гіперпаратиреоз. На відміну від СЧВ, у такому випадку характерним є метастатичний тип кальцифікації. Кальцинати при ХХН можуть локалізуватися у внутрішніх органах, стінках судин (особливо артерій), параартикулярно, а також у м’яких тканинах (Yıldız F. et al., 2014). Зазначимо, що кальцинати у хворої виявлені до розвитку ХХН та вторинного гіперпаратиреозу. Відомо, що кальцинати м’яких тканин є частою знахідкою у хворих із ХХН, що перебувають на лікуванні діалізом. У нашому випадку хвора на момент опису не була переведена на нирковозамісну терапію.
Інші можливі причини кальцифікації м’яких тканин включають саркоїдоз, онкологічну патологію, overlap-синдром, кальцифілаксію (змінені рівні кальцію та фосфору), гіпервітаміноз D та ін. (Dima A. et al., 2015). У наведеному клінічному випадку переконливих даних щодо overlap-синдрому не було.
Гетеротопічна осифікація може бути вродженою, виникати унаслідок тривалої ішемії чи після травм, а також при неврологічних порушеннях. Вроджена осифікація із формуванням «нового» скелету характерна для прогресуючої осифікуючої фібродисплазії — дуже рідкісної спадкової хвороби, що характеризується вродженими деформаціями скелету (особливо великих пальців стопи), та прогресуючим формуванням осифікатів, що у подальшому призводять до знерухомлення та тяжкої інвалідизації (Pignolo R.J. et al., 2011). Як правило, вона проявляється ще з дитинства та досягає максимуму у зрілому віці, має характерний сімейний анамнез, значно деформує зовнішній вигляд пацієнтів.
На нашу думку, походження кальцинатів у даному випадку є поліетіологічним, а патогенез — комплексним, із переважанням дистрофічного типу кальцифікації. До потенційних етіологічних факторів, що зіграли роль у формуванні кальцифікації у пацієнтки належать вторинний гіперпаратиреоз, ХХН, хронічна венозна недостатність, посттромбофлебітичний синдром. Вважаємо, що саме дистрофічний тип кальцифікації, який часто спостерігається при системних аутоімунних захворюваннях, у даної хворої відіграв ключову роль у формуванні кальцинатів.
Патогенез кальцинозу м’яких тканин при системних захворюваннях, у тому числі СЧВ, залишається не до кінця зрозумілим та вивченим. У розвитку цього процесу деяку роль відіграють такі агенти, як фетуїн-А, остеопонтин, інтерлейкін-6, фактор некрозу пухлин (ФНП)-альфа, хоча немає переконливих даних, які б стосувалися залучення даних агентів патогенезу безпосередньо при СЧВ (Chander S., Gordon P., 2012).
Серед можливих препаратів та методів лікування кальцифікації в літературі описують внутрішньовенне введення імуноглобуліну, лікування анти-ФНП-агентами, трансплантацію стовбурових клітин крові, застосування бісфосфонатів, антагоністів кальцію (дилтіазем). Проте жоден з них не увійшов до стандартів терапії.
У дослідженні A. Dima та співавторів (2015) з метою розгляду можливих схем лікування дистрофічного типу кальцинозу, асоційованого із системними захворюваннями сполучної тканини, проведено аналіз статей за 1970–2014 рр. Окрім ключових слів «кальциноз» та «лікування», в них відмічені наступні методи/препарати: дилтіазем, блокатори кальцієвих каналів, верапаміл, варфарин, антикоагулянти, бісфосфонати, етидронат, памідронат, алюмінію гідроксид, пробенецид, тетрациклін, цефтріаксон, колхіцин, внутрішньовенний імуноглобулін, натрію тіосульфат, інгібітори ФНП-альфа, інфліксимаб, ритуксимаб, кортикостероїди та трансплантація стовбурових клітин (Dima A. et al., 2014).
Згідно з даними літератури дилтіазем є рекомендованим засобом першої лінії терапії, враховуючи позитивний ефект його застосування у більш ніж половині описаних клінічних випадків. Дія препарату полягає у пригніченні внутрішньоклітинної абсорбції кальцію. Проте у зв’язку із незначною кількістю досліджень, необхідним є індивідуальний підхід до кожного пацієнта. В інших дослідженнях серед препаратів першої лінії, окрім дилтіазему, згадуються колхіцин та міноциклін (Achebe I. et al., 2020).
Міноциклін у дозі 50–100 мг/добу та колхіцин пригнічують виразкування та деструкцію тканини у вогнищі запалення (Dima A. et al., 2014; Le C., Bedocs P.M., 2020). Роль бісфосфонатів у лікуванні кальцинатів м’яких тканин полягає у їх механізмі дії — зниженні кісткової резорбції та пригніченні формування ектопічних кальцинатів. Існують рекомендації щодо використання у тяжких випадках трансплантації стовбурових клітин. У дослідженні 2008 р. описано три клінічні випадки ефективного застосування трансплантації гемопоетичних стовбурових клітин у лікуванні хворих на СЧВ із кальцинатами та/чи кальцифілаксією (Mandelbrot D.A. et al., 2008). Однак автори не рекомендують рутинне застосування даного методу терапії у зв’язку з його потенційною токсичністю.
Щодо призначення низьких доз варфарину для лікування дистрофічного типу кальцифікації існують різні думки. Ще у минулому столітті застосування даного препарату описувалося у літературі (Yoshida S., Torikai K., 1993). Було відзначено деякий позитивний ефект після його застосування, але даних було недостатньо. Пізніше досліджено ефективність низьких доз варфарину (1 мг/добу) для лікування кальцинозу у хворих на системну склеродермію (Cukierman T. et al., 2004). Дані рекомендації стосувалися лише невеликої групи хворих із мінімальними проявами кальцинозу та недавньою його появою. Застосування непрямого антикоагулянта в низьких дозах для лікування кальцинатів м’яких тканин проаналізовано і в 2014 р.
Серед багатьох обговорених у публікаціях препаратів, що мали позитивний ефект у лікуванні кальцинозу, автори згадують і варфарин (Dima A. et al., 2014). Механізм його дії пов’язують із тим, що високі концентрації вітаміну К сприяють посиленню процесів зв’язування кальцію та його солей. Сучасний аналіз літератури демонструє зовсім інші результати. Минулого року проведено огляд статей за 1980–2018 рр., у яких згадувалися схеми лікування даної патології (calcinosis cutis). Автори проаналізували 30 публікацій та 288 пацієнтів із системними захворюваннями сполучної тканини із кальцинозом. У результаті рекомендованими для лікування таких хворих є дилтіазем та бісфосфонати, а варфарин застосовувати взагалі не радять (Traineau H. et al., 2020). Навпаки, наявні літературні дані, що варфарин потенціює розвиток кальцинатів, зокрема в медії коронарних артерій (Andrews J. et al., 2018), аортальному клапані (Rattazzi M., 2018). Тому його роль у патогенезі кальцинозу м’яких тканин залишається недостатньо вивченою.
Нами описано позитивну клінічну динаміку у хворої з кальцинатами м’яких тканин гомілок при лікуванні дилтіаземом із паралельною інтенсифікацією терапії СЧВ. Проте, за результатами власного спостереження та за даними літератури, чіткого зв’язку між клінічними проявами кальцинатів, тривалістю та активністю СЧВ не виявлено. Атиповість описаної нами патології та обмежена кількість досліджень щодо ефективності застосування тих чи інших методів терапії потребують подальшого аналізу та документування таких випадків, що допоможе краще зрозуміти висвітлену тему. Відкритими залишаються питання патогенезу кальцифікації, факторів ризику їх утворення та прогресування, вибір терапії з доведеною клінічною ефективністю.
Висновки
Кальцифікація м’яких тканин у хворих на СЧВ є рідкісним проявом системного захворювання. Мінімальна кількість описаних у світовій літературі клінічних випадків даної патології поки що не дає змоги детальніше розібратися у патогенезі та виборі тактики лікування таких хворих. Враховуючи проведену диференційну діагностику із виключенням інших причин кальцифікації, у статті описано новий випадок рідкісного явища при СЧВ. Застосування блокаторів кальцієвих каналів у даному випадку продемонструвало свою ефективність й потребує подальшого спостереження. Чітких закономірностей між клінічними проявами, лабораторними даними і розвитком кальцинатів у проаналізованих клінічних випадках не виявлено. Проведений у дослідженні аналіз літератури демонструє, що дана патологія потребує більшої уваги, оскільки досі немає чітких рекомендацій щодо її лікування.
Конфлікт інтересів. Автори заперечують будь-який конфлікт інтересів.
Список використаної літератури
- 1. Заремба Є.Х., Вірна М.М., Ших Л.Б. та співавт. (2017) Системний червоний вовчак (клінічний випадок). Практикуючий лікар, (6, № 4): 39–41.
- 2. Achebe I., Mbachi C., Asotibe J.C. et al. (2020) Dystrophic Calcinosis Cutis in Systemic Lupus Erythematosus. Cureus, 12(6), e8727. doi.org/10.7759/cureus.8727.
- 3. Almaani S., Meara A., Rovin B.H. (2017) Update on Lupus Nephritis. Clinical journal of the American Society of Nephrology : CJASN, 12(5): 825–835. doi.org/10.2215/CJN.05780616.
- 4. Anders H.J., Saxena R., Zhao M.H. et al. (2020) Lupus nephritis. Nature reviews. Disease primers, 6(1): 7. doi.org/10.1038/s41572–019–0141–9.
- 5. Andrews J., Psaltis P.J., Bayturan O. et al. (2018) Warfarin use is associated with progressive coronary arterial calcification: insights from serial intravascular ultrasound. JACC: Cardiovascular Imaging, 11(9), 1315–1323.
- 6. Aringer M., Costenbader K., Daikh D. et al. (2019) European League Against Rheumatism/American College of Rheumatology classification criteria for systemic lupus erythematosusAnnals of the Rheumatic Diseases; 78: 1151–1159.
- 7. Bhatia S., Silverberg N.B., Don P.C. et al. (2001) Extensive calcinosis cutis in association with systemic lupus erythematosus. Acta dermato-venereologica, 81(6): 446–447.
- 8. Budin J.R., Feldman F. (1975) Soft tissue calcification in systemic lupus erythematosus. American Journal of Roentgenology, Radium Therapy and Nuclear Medicine, 124: 350–364.
- 9. Carocha A.P., Torturella D.M., Barreto G.R. et al. (2010). Calcinosis cutis universalis associated with systemic lupus erythematosus: an exuberant case. Anais brasileiros de dermatologia, 85 (6): 883–7.
- 10. Chandran M., Wong J. (2019) Secondary and Tertiary Hyperparathyroidism in Chronic Kidney Disease: An Endocrine and Renal Perspective. Indian journal of endocrinology and metabolism, 23(4): 391–399. doi.org/10.4103/ijem.IJEM_292_19.
- 11. Chander S., Gordon P. (2012) Soft tissue and subcutaneous calcification in connective tissue diseases. Current opinion in rheumatology, 24(2): 158–164. doi.org/10.1097/BOR.0b013e32834ff5cd.
- 12. Cousins M.A., Jones D.B., Whyte M.P. et al. (1997) Surgical management of calcinosis cutis universalis in systemic lupus erythematosus. Arthritis and rheumatism, 40(3): 570–572. doi.org/10.1002/art.1780400325.
- 13. Cukierman T., Elinav E., Korem M. et al. (2004) Low dose warfarin treatment for calcinosis in patients with systemic sclerosis. Annals of the rheumatic diseases, 63(10): 1341–1343. doi: 10.1136/ard.2003.014431.
- 14. Dima A., Balanescu P., Baicus C. (2014) Pharmacological treatment in calcinosis cutis associated with connective-tissue diseases. Romanian journal of internal medicine = Revue roumaine de medecine interne, 52(2): 55–67.
- 15. Dima A., Berzea I., Baicus C. (2015) Impressive Subcutaneous Calcifications in Systemic Lupus Erythematosus. Maedica, 10(1): 55–57.
- 16. Freire V., Moser T.P., Lepage-Saucier M. (2018) Radiological identification and analysis of soft tissue musculoskeletal calcifications. Insights into imaging, 9(4): 477–492. doi.org/10.1007/s13244-018-0619-0.
- 17. Furie R., Rovin B.H., Houssiau F. et al. (2020) Two-year, randomized, controlled trial of belimumab in lupus nephritis. New England Journal of Medicine, 383(12): 1117–1128.
- 18. Garg N., Deodhar A. (2012) The Sydney Classification Criteria for Definite Antiphospholipid Syndrome.
- 19. Huang H.L., Wu W.T., Ou T.T. (2014) Extensive calcinosis cutis universalis in a patient with systemic lupus erythematosus: 10-year treatment experience. The Kaohsiung journal of medical sciences, 30(12): 639–640.
- 20. Imran T.F., Yick F., Verma S. et al. (2016) Lupus nephritis: an update. Clinical and experimental nephrology, 20(1): 1–13. doi.org/10.1007/s10157-015-1179-y.
- 21. Jimenez-Gallo D., Ossorio-Garcia L., Linares-Barrios M. (2015) Calcinosis cutis and calciphylaxis. Actas Dermosifiliogr. 106(10): 785–794.
- 22. Kabir D.I., Malkinson F.D. (1969) Lupus erythematosus and calcinosis cutis. Archives of dermatology, 100(1): 17–22.
- 23. Le C., Bedocs P.M. (2020) Updated. Treasure Island, FL: StatPearls Publishing. Calcinosis Cutis.
- 24. Lederhandler M., Valins W., Zoghbi Z., Grossman M.E. (2016) Leg ulcers in systemic lupus erythematosus associated with underlying dystrophic calcinosis and bone infarcts in the absence of antiphospholipid antibodies. JAAD case reports, 2(2): 164–167. doi.org/10.1016/j.jdcr.2016.02.009.
- 25. Lopez A.T., Grossman M.E. (2017) Facial calcinosis cutis in a patient with systemic lupus erythematosus: A case report of tissue injury owing to photosensitivity as the cause of dystrophic calcification. JAAD case reports, 3(5): 460–463.doi.org/10.1016/j.jdcr.2017.06.018.
- 26. Mandelbrot D.A., Santos P.W., Burt R.K. et al. (2008) Resolution of SLE-related soft-tissue calcification following haematopoietic stem cell transplantation. Nephrology Dialysis Transplantation, 23(8): 2679–2684.
- 27. Minami A., Suda K., Kaneda K., Kumakiri M. (1994) Extensive Subcutaneous Calcification of the Forearm in Systemic Lupus Erythematosus. Journal of Hand Surgery, 19(5): 638–641. doi.org/10.1016/0266–7681(94)90134–1.
- 28. Muñoz C., Isenberg D.A. (2019) Review of major endocrine abnormalities in patients with systemic lupus erythematosus. Clinical and experimental rheumatology, 37(5), 791–796.
- 29. Nomura M., Okada N., Okada M. et al. (1990). Large subcutaneous calcification in systemic lupus erythematosus. Archives of dermatology, 126(8): 1057–1059.
- 30. Park Y.M., Lee S.J., Kang H. et al. (1999). Large subcutaneous calcification in systemic lupus erythematosus: treatment with oral aluminum hydroxide administration followed by surgical excision. Journal of Korean medical science, 14(5): 589–592. doi.org/10.3346/jkms.1999.14.5.589.
- 31. Petri M., Orbai A.M., Alarcón G.S. et al. (2012) Derivation and validation of the Systemic Lupus International Collaborating Clinics classification criteria for systemic lupus erythematosus. Arthritis and rheumatism, 64(8), 2677–2686. doi.org/10.1002/art.34473.
- 32. Pignolo R.J., Shore E.M., Kaplan F.S. (2011) Fibrodysplasia ossificans progressiva: clinical and genetic aspects. Orphanet journal of rare diseases, 6(1): 1–6.
- 33. Powell R.J. (1974) Systemic lupus erythematosus with widespread subcutaneous fat calcification. Proceedings of the Royal Society of Medicine, 67(3): 215–217.
- 34. Quismorio F.P., Dubois E.L., Chandor S.B. (1975) Soft-Tissue Calcification in Systemic Lupus Erythematosus. Arch. Dermatol., 111(3): 352–356.
- 35. Rattazzi M., Faggin E., Bertacco E. et al. (2018) Warfarin, but not rivaroxaban, promotes the calcification of the aortic valve in ApoE-/- mice. Cardiovascular therapeutics, 36(4): e12438. doi.org/10.1111/1755–5922.12438.
- 36. Rothe M.J., Grant-Kels J.M., Rothfield N.F. (1990) Extensive calcinosis cutis with systemic lupus erythematosus. Archives of dermatology, 126(8): 1060–1063.
- 37. Soudet S., Delaporte E., Hatron P.Y. (2016) Diffuse calcinosis cutis in systemic lupus erythematosus: an exceptional complication. Lupus, 25(9): 1064–1065. doi.org/10.1177/0961203316630819.
- 38. Traineau H., Aggarwal R., Monfort J.B. et al. (2020) Treatment of calcinosis cutis in systemic sclerosis and dermatomyositis: A review of the literature. Journal of the American Academy of Dermatology, 82(2): 317–325. doi.org/10.1016/j.jaad.2019.07.006.
- 39. Tristano A.G., Villarroel J.L., Rodríguez M.A. et al. (2006) Calcinosis cutis universalis in a patient with systemic lupus erythematosus. Clinical rheumatology, 25(1): 70–74. doi.org/10.1007/s10067–005–1134–5.
- 40. Weinberger A., Kaplan J.G., Myers A.R. (1979) Extensive soft tissue calcification (calcinosis universalis) in systemic lupus erythematosus. Annals of the rheumatic diseases, 38(4): 384–386. doi.org/10.1136/ard.38.4.384.
- 41. Yıldız F., Kelle B.A.Y.R.A.M., Taş D.A. et al. (2014) Diffuse soft tissue and vascular calcification in systemic lupus erythematosus with chronic kidney disease. Zeitschrift für Rheumatologie, 73(8): 754–757.
- 42. Yoshida S., Torikai K. (1993) The effects of warfarin on calcinosis in a patient with systemic sclerosis. The Journal of Rheumatology, 20(7): 1233–1235.
- 43. Zhong Z., Li H., Zhong H. et al. (2019) Clinical efficacy and safety of rituximab in lupus nephritis. Drug design, development and therapy, 13: 845–856. doi.org/10.2147/DDDT.S195113.
КАЛЬЦИНАТЫ МЯГКИХ ТКАНЕЙ ПРИ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКЕ. КЛИНИЧЕСКИЙ СЛУЧАЙ И ОБЗОР ЛИТЕРАТУРЫ
1Национальный медицинский университет имени А.А. Богомольца
2КНП «Александровская клиническая больница г. Киева»
Резюме. Актуальность. Кальцификация мягких тканей при системной красной волчанке является редким клиническим проявлением. Однако существуют разные литературные данные относительно локализации кальцинатов при СКВ и связи их появления с активностью заболевания и сопутствующими состояниями. Также нет единого мнения относительно методов лечения кальцификации мягких тканей. Цель исследования. Описать клинический случай развития кальцинатов в мышцах голеней пациентки с СКВ и оценить в динамике эффективность назначенного лечения. Объектом исследования стала женщина в возрасте 55 лет, которая болеет СКВ на протяжении 7 лет. В статье детально описаны динамика заболевания, его осложнения, сопутствующие заболевания и состояния, этапы диагностического поиска причины появления кальцинатов мягких тканей. Проведен литературный обзор за период с 1969 по 2020 г. с использованием MEDLINE/PubMed, ScienceDirect, Wiley Online Library и Scopus, отобрано 45 статей с задокументированными случаями кальцификации мягких тканей у больных СКВ, из которых для анализа включено 29 опубликованных на английском языке. Проведя дифференциальную диагностику и проанализировав литературу, исключив другие потенциальные причины развития патологии, пришли к выводу, что данный клинический случай является еще одним задокументированным описанием кальцификации мягких тканей у больной СКВ. Как и другие системные заболевания соединительной ткани, СКВ имеет множество невыясненных или недостаточно изученных особенностей патогенеза и может иметь разнообразные, в том числе редкие, клинические проявления. Описание клинического случая, проведенный анализ литературы являются дополнением к современным сведениям и имеют цель привлечь внимание к редким проявлениям системных болезней и возможностям современной терапии.
Ключевые слова: кальцинаты мягких тканей, кальцификация, кальциноз, системная красная волчанка, хроническое заболевание почек, дилтиазем.
Адреса для листування:
Мазур В.І.
03067, Київ, вул. Шутова, 14
Національний медичний університет імені О.О. Богомольця
E-mail: stipe.cf@gmail.com

Leave a comment