НПЗП-ризики та вибір безпечної терапії
Шуба Н.М., Воронова Т.Д., Кокунов Ю.О.
Резюме. Наведений матеріал присвячений аналізу пошуків оптимальних протизапальних і анальгетичних препаратів (від неселективних нестероїдних протизапальних препаратів (НПЗП) до циклооксигеназа (ЦОГ)-2-специфічних). Також показано, що далеко не лише ступінь ЦОГ-2-селективності НПЗП визначає їх безпеку. Існують НПЗП, що володіють цілим рядом додаткових, не ЦОГ-залежних ефектів, значимість яких у терапії багатьох захворювань може перевершувати лише інгібування ЦОГ.
Нестероидные противовоспалительные препараты (НПВП) — лекарственные средства одной из самых успешных групп, которые наиболее широко применяются, что отражает их эффективность и клиническую значимость. В связи с универсальностью и распространенностью воспалительного процесса НПВП сегодня являются самым назначаемым классом препаратов, в том числе и в Украине (по третьему уровню АТС-классификации по итогам 9 мес 2017 г., согласно данным проекта «Rx test — Мониторинг назначений лекарственных средств»). Эта группа имеет одновременно противовоспалительные, анальгезирующие и жаропонижающие свойства.
Применение НПВП играет фундаментальную роль в контролировании воспаления и купировании болевого синдрома. Эти препараты тормозят синтез простагландинов (PG) через ингибирование циклооксигеназы (ЦОГ)-1 и ЦОГ-2 — ферментов, ответственных за синтез PG.
Воспалительный процесс активируется различными антигенными стимулами: вирусами, бактериями, паразитами, эндотоксинами, аутоантигенами и др. (рис. 1).
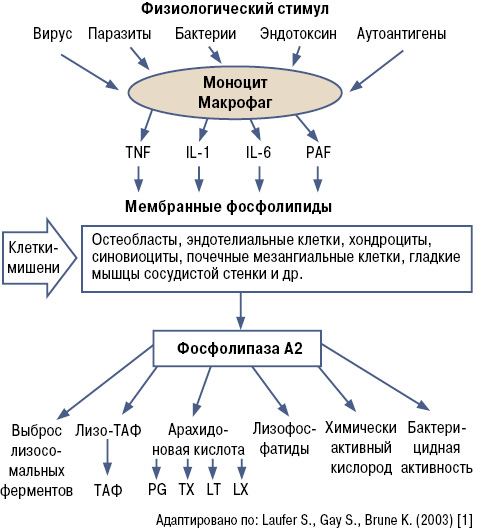
В результате взаимодействия вышеописанных агентов с макрофагами происходит повышение синтеза провоспалительных цитокинов (фактор некроза опухоли (TNF), интерлейкин (IL)-1, IL-6 и др.) и тромбоцитактивирующего фактора (ТАФ), которые в мембранных фосфолипидах (остеобластов эндотелиальных клеток, хондроцитов, синовиоцитов, почечных мезангиальных клеток и др.) приводят к активации фосфолипазы А2, что сопровождается выбросом лизосомальных ферментов, ТАФ, метаболитов арахидоновой кислоты (тромбоксанов, лейкотриенов, лизофосфатидов, супероксидных радикалов кислорода), что и определяет выраженность воспалительного процесса [1].
Картина физиологического и воспалительного процессов представлена на рис. 2.
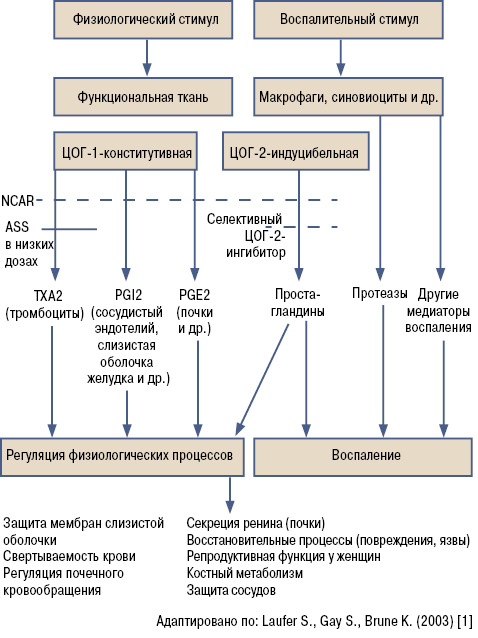
Гипотезы Вейна относительно различной роли ЦОГ-1 и ЦОГ-2 в физиологических и патологических процессах привели к созданию новых противовоспалительных средств и способствовали проведению полной переоценки уже существующих НПВП. По фармакодинамике НПВП отличаются своей способностью в различной степени ингибировать ЦОГ-1 и ЦОГ-2. ЦОГ-1 является конститутивной и активно участвует в физиологических механизмах регуляции гомеостаза (выработка защитных факторов слизистой оболочки желудочно-кишечного тракта (ЖКТ)-простациклинов, процессы свертывания крови, регуляция почечного кровообращения). ЦОГ-2 является индуцибельной (неактивной в нормальных условиях), проявляющей свои эффекты преимущественно при возникновении воспалительного процесса. Поэтому логично, что поиск новых — более безопасных НПВП — шел в направлении селективности к ЦОГ-2. Они проявляли как умеренную (4 — мелоксикам, 7 — целекоксиб), так и высокую (36 — рофекоксиб) селективность к ЦОГ-2 [2] и по данным ряда клинических исследований имели более высокую гастроинтестинальную безопасность.
Это актуально, поскольку осложнения со стороны ЖКТ — одни из наиболее частых, ассоциированных с применением НПВП. Так, по данным Канадского реестра мониторинга побочных эффектов (2015), средняя частота развития побочных реакций со стороны ЖКТ на фоне применения НПВП составляет 8,5% [3].
В недавнее время применение коксибов вызвало беспокойство у врачей в связи с тем, что оно ассоциировалось с фатальными сердечно-сосудистыми событиями. Так, в 2004 г. рофекоксиб был отозван в связи с возрастанием рисков развития фатальных кардиоваскулярных событий, причем даже при применении в стандартных дозах. По данным исследования APPROVe риск развития таковых при применении рофекоксиба оказался на 92% выше по сравнению с приемом плацебо [4] (рис. 3).
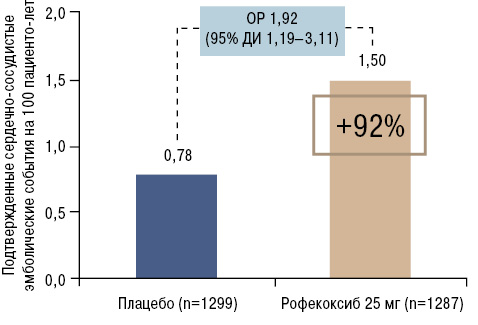
Согласно данным уже упоминавшегося Канадского реестра мониторинга побочных эффектов, частота эмболий при применении НПВП недооценена. На их долю приходится 30% всех побочных реакций [3]. Таким образом, сердечно-сосудистые побочные эффекты отмечают более чем в 3 раза чаще, чем гастроинтестинальные.
Хотя абсолютный риск развития побочных реакций со стороны сердечно-сосудистой системы при применении НПВП относительно невысок, их широкое применение позволяет НПВП оказывать значительное влияние на частоту развития сердечно-сосудистой патологии во всем мире [5].
Сердечно-сосудистые заболевания являются ведущей причиной смертности, и Украина в этом не исключение. По данным Всемирной организации здравоохранения по итогам 2015 г., в нашей стране 70% летальных исходов обусловлено сердечно-сосудистыми заболеваниями, причем 95% этой смертности вызваны инфарктом и инсультом.
В своем обзоре от 2005 г. Европейский комитет по лекарственным средствам для человека (Committee for Medicinal Products for Human Use — CHMP) Европейского агентства по лекарственным средствам (European Medicines Agency — EMEA) пришел к выводу, что применение селективных ингибиторов ЦОГ-2 как целого класса препаратов сопряжено с повышенным риском развития тромботических сердечно-сосудистых событий (таких как инфаркт и инсульт). Поэтому эксперты EMEA не рекомендуют назначать ингибиторы ЦОГ-2 пациентам с ишемической болезнью сердца, перенесшим инсульт, или тем, у которых диагностировано заболевание периферических артерий.
Селективные ингибиторы ЦОГ-2 совсем не так безопасны в отношении ЖКТ, как ожидалось. Согласно данным крупного метаанализа 2013 г., в котором оценивали риск развития побочных реакций со стороны сердечно-сосудистой системы и ЖКТ при применении диклофенака, ибупрофена и напроксена, коксибов, последние показали неудовлетворительные результаты в плане риска развития побочных реакций со стороны ЖКТ, — там, где, по идее, должны были бы демонстрировать очевидное преимущество в сравнении с неселективными НПВП [6]. Согласно результатам указанного метаанализа, коксибы не отличались от диклофенака по частоте поражения ЖКТ. А по сравнению с плацебо оба препарата чаще вызывали гастроинтестинальные осложнения — относительный риск (ОР) 1,81 (95% доверительный интервал (ДИ) 1,17–2,81).
В США ситуация с эторикоксибом закончилась отказом в регистрации препарата FDA (Food and Drug Administration) с формулировкой, что он не является более эффективным и более безопасным в сравнении с диклофенаком [7].
Касательно сердечно-сосудистых осложнений применения селективных НПВП существует несколько теорий, их объясняющих. Первая — теория Фиджеральда. В норме синтез тромбоксана (протромботическего агента) и простациклина (антитромботического агента) находится в физиологическом равновесии. Синтез тромбоксана осуществляется тромбоцитами, которые содержат только ЦОГ-1. Синтез же простациклина происходит в эндотелии. При применении ЦОГ-2-селективных НПВП синтез простациклина снижается, а тромбоксана — нет (поскольку ЦОГ-1 тромбоцитов остается интактной пропорционально степени селективности препарата). В результате этого динамическое равновесие нарушается в сторону преобладания свертывающей системы крови [8, 9]. Следующая теория, объясняющая риски развития эмболических осложнений при применении НПВП, посвящена нестабильности атеросклеротической бляшки. Некоторые НПВП, в частности эторикоксиб и рофекоксиб, способны вызывать окисление липидов [10], что может приводить к дестабилизации атеросклеротической бляшки. Это проявляется омылением холестерина, ее наполняющего, увеличением размеров, вплоть до разрыва крышки, с последующим тромбозом самой бляшки и вторичной эмболией. Также показано, что данный эффект (снижение синтеза простациклина) может носить дозозависимый характер. Так, в исследовании APC при применении целекоксиба 200 мг 2 раза в сутки частота сердечно-сосудистых событий была ниже после 12 мес терапии в сравнении с целекоксибом 400 мг 2 раза в сутки. Причем на фоне применения ацетилсалициловой кислоты риски не только не были ниже, а даже повышались с 2,4 до 3,8 раза [11].
Имеющиеся данные свидетельствуют о том, что ранее общепринятое разграничение ЦОГ-2 как патологической и ЦОГ-1 как физиологической — весьма условно.
Так, ЦОГ-2, которую много лет традиционно считали ответственной исключительно за развитие патологического процесса, выполняет и ряд физиологических функций. В частности, ЦОГ-2 задействована в регуляции тонуса сосудов (вазодилатации), заживлении дефектов слизистой оболочки желудка и кишечника, регуляции процесса овуляции, функции поджелудочной железы, ремоделировании и регенерации костной ткани [12–14]. При этом не только ЦОГ-2, но и ЦОГ-1 является источником медиаторов воспаления при ревматоидном артрите, остеоартрите, бурсите [13, 14].
Примечательно, что ЦОГ-1 может самостоятельно способствовать развитию воспалительного процесса не меньшей интенсивности, чем обе ЦОГ одновременно. Так, в экспериментах на животных показано, что даже при удалении гена, кодирующего ЦОГ-2, выраженность воспалительного процесса не уменьшалась [15].
Можно с уверенностью утверждать, что функционирование всех типов ЦОГ взаимосвязано и находится в динамическом равновесии. Равно как и действие НПВП следует рассматривать комплексно, учитывая ЦОГ-1, ЦОГ-2, а также не ЦОГ-зависимые эффекты. В этом контексте внимание привлекают такие НПВП, как диклофенак и нимесулид, которые сбалансированно блокируют и ЦОГ-1, и ЦОГ-2. А нимесулид обладает целым рядом дополнительных эффектов, имеющих важное значение в лечении.
Диклофенак
Диклофенак является золотым стандартом в оценке эффективности НПВП. Механизм действия, эффективность и профиль безопасности диклофенака хорошо изучены. Высокая эффективность данного препарата не вызывает сомнений, однако сегодня внимание исследователей и интерес практикующих врачей сфокусирован на вопросе: «Эффективнее и безопаснее ли диклофенак, чем селективные НПВП?».
Диклофенак максимально эффективно подавляет синтез провоспалительного PGE2 [16]. Так, согласно результатам рандомизированного плацебо-контролируемого клинического исследования, применение диклофенака позволяет снизить уровень PGE2 на 93%, что значительно (почти на 20%) эффективнее аналогичных показателей как ЦОГ-2-селективных рофекоксиба, мелоксикама, так и неселективных — ибупрофена и напроксена [17].
Кроме того, диклофенак эффективнее мелоксикама клинически. Согласно результатам исследования MELISSA, в котором приняли участие более 9 тыс. человек с остеоартритом, пациенты, применявшие мелоксикам, на 38% чаще отказывались от лечения из-за его неэффективности (80 из 4635; р<0,01) по сравнению с когортой, получавшей диклофенак (48 из 4688) [18].
В другом крупном исследовании показано, что диклофенак характеризуется одним из самых низких рисков развития кровотечений из верхнего отдела пищеварительной системы.
Так, метаанализ данных 280 рандомизированных клинических исследований, где различные НПВП сравнивали с плацебо (n=124 513), и 474 рандомизированных клинических исследований, где НПВП сравнивали с другими препаратами этой группы (n=229 296) [6], показал, что при применении коксибов в сравнении с плацебо относительный риск (ОР) побочных реакций со стороны ЖКТ составил для этих препаратов 1,81 (95% ДИ 1,17–2,81; p=0,0070), что сопоставимо с таковым диклофенака — 1,89 (95% ДИ 1,16–3,09; p=0,0106). Для сравнения: ОР развития осложнений со стороны ЖКТ при применении ибупрофена составил 3,97 (95% ДИ 2,22–7,10; p<0,0001), а для напроксена — 4,22 (95% ДИ 2,71–6,56; p<0,0001).
Пути профилактики осложнений
К сожалению, даже выбрав наиболее безопасный НПВП из существующих, мы не застрахованы от развития класс-специфических побочных реакций, поэтому важным является внедрение эффективных методов профилактики.
Применение ацетилсалициловой кислоты сегодня рассматривается как один из методов снижения риска развития кардиоваскулярных тромботических событий при назначении НПВП.
Однако, согласно результатам исследований, применение ацетилсалициловой кислоты с ЦОГ-2-селективными НПВП не дает ожидаемого защитного эффекта, статистически достоверно даже повышая риск развития кардиоваскулярных событий с 2,4 до 3,8 [11].
Одновременное применение диклофенака и ацетилсалициловой кислоты в кардиопрофилактической дозе сопровождалось самым низким ОР кровотечений из верхнего отдела пищеварительной системы среди пациентов, принимающих ацетилсалициловую кислоту в сравнении с пятью другими используемыми НПВП, — 5,7 [19]. Также стоит отметить, что сочетание НПВП и ингибиторов протонной помпы благоприятно влияет на профиль гастроинтестинальной безопасности. В частности, сочетание диклофенака и ингибиторов протонной помпы сопровождается наименьшим ОР со стороны ЖКТ — 0,3 [19].
Нимесулид — НЕКИСЛОТНЫЙ НПВП С НЕ ЦОГ-ЗАВИСИМЫМИ ЭФФЕКТАМИ
Рассматривая НПВП с учетом их столь различной эффективности и безопасности, очень важно помнить о не ЦОГ-зависимых механизмах действия.
Так, нимесулид, помимо сбалансированного блокирования ЦОГ-1 и ЦОГ-2, также оказывает следующие дополнительные эффекты:
- блокирует супероксидные радикалы кислорода;
- блокирует активность iNO-синтетазы и образование оксида азота (NO), пероксинитрита (ONOO), которые являются ключевыми медиаторами воспалительного процесса и деструкции хряща;
- отменяет апоптоз хондроцитов;
- блокирует коллагеназу и стромелизин, что приводит к уменьшению деградации коллагена II типа и протеогликана;
- активирует глюкокортикоидные рецепторы, повышая их чувствительность, в том числе к эндогенному кортизолу;
- ингибирует фосфодиэстеразу, тем самым снижая выработку гистамина и выраженность его медиаторных эффектов;
- активирует синтез тканевого активатора плазминогена;
- блокирует синтез тромбоцитактивирующего фактора;
- играет важную роль в предупреждении тромбоэмболических осложнений.
Нимесулид был синтезирован компанией «Хелсин» как ловушка для супероксидных радикалов кислорода. Свободные радикалы являются важными патогенетическими факторами при хронических воспалительных процессах, поэтому их элиминация может значительно усилить противовоспалительный эффект.
В отношении нимесулида доказано ингибирование гидроксил-радикалов, а также супероксид-радикалов (супероксидных анионов О2 и образования хлорноватистой кислоты, которая активирует полиморфноядерные нейтрофилы). Уменьшение уровней супероксида и фагоцитоза было показано в исследованиях с участием здоровых добровольцев после приема ими стандартной дозы нимесулида.
Нимесулид блокирует индуцибельную NO-синтетазу и соответственно образование оксида азота (NO) и пероксинитрита (ONOO), которые ответственны за деструкцию хряща и развитие воспалительного процесса при остеоартрите. Также нимесулид отменяет апоптоз хондроцитов.
При лечении больных с заболеваниями опорно-двигательного аппарата важно помнить, что нимесулид обладает антиколлагеназным эффектом. Снижение активности коллагеназы, а также стромелизина отмечено в плазме крови у пациентов с дегенеративными болезнями суставов при применении нимесулида. Это важный клинический эффект, замедляющий деструкцию суставного хряща [20].
Кроме того, нимесулид ингибирует фосфодиэстеразу с соответствующим повышением внутриклеточного уровня циклической аденозинмонофосфорной кислоты, которая, в свою очередь, угнетает синтез и высвобождение гистамина.
Нимесулид активирует глюкокортикоидные рецепторы, тем самым усиливая противовоспалительные эффекты как эндогенного кортизола, так и глюкокортикоидных лекарственных препаратов.
Важно, что нимесулид является двойным ингибитором не только ЦОГ, но и 5-липооксигеназы (5-ЛОГ). Известно, что при блокаде ЦОГ происходит активация 5-ЛОГ. Причем в результате действия 5-ЛОГ образуются только провоспалительные факторы, а именно — лейкотриены, которые вызывают воспаление, язвообразование, бронхоспазм и аллергические реакции.
Метаболизм арахидоновой кислоты показан на рис. 4.
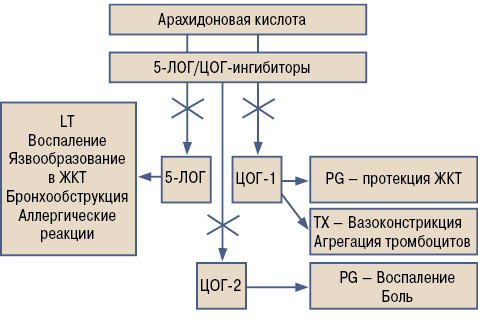
Именно с активацией метаболизма арахидоновой кислоты по пути 5-ЛОГ связывают в настоящее время побочное действие и органотоксичность НПВП. Лейкотриены LTC4, LTD4, LTE4 и хемотаксический LTB4 накапливаются в различных органах и обусловливают разнообразные побочные эффекты НПВП [21].Чем сильнее блокируется ЦОГ, тем активнее 5-ЛОГ и, соответственно, выработка лейкотриенов [22].
Применение двойных ингибиторов ЦОГ и 5-ЛОГ в настоящее время рассматривается как новая стратегия повышения безопасности НПВП-терапии. Единственным известным НПВП, который блокирует и ЦОГ, и 5-ЛОГ, является нимесулид [23]. С учетом этого нимесулид применяют как базовый препарат для поиска новых перспективных молекул. Биариловый эфир нимесулида, который ответственен за блокирование 5-ЛОГ, взят в этом поиске за основу.
Благоприятный профиль гастроинтестинальной безопасности нимесулида отмечен в рамках обзора, проведенного ЕМЕА в 2012 г. Особый интерес в этом контексте представляют результаты ретроспективного эпидемиологического исследования, в ходе которого оценивали риск развития осложнений, затрагивающих верхний отдел пищеварительной системы у пациентов, применявших различные НПВП. В исследование были включены данные о 588 827 пациентах. Из них более 250 тыс. человек применяли нимесулид, около 225 тыс. — диклофенак, более 150 тыс. — кетопрофен, а также по убывающей — пироксикам, ибупрофен, кеторолак, мелоксикам, напроксен и другие НПВП. Это во многом отражает также уровень назначаемости различных НПВП в странах Европы.
Согласно полученным результатам, ОР ЖКТ-осложнений, скорригированный с учетом возраста, пола и факторов риска, для целекоксиба составил 1,38, для нимесулида — 1,5, что в 2 раза ниже по сравнению с ибупрофеном и в 3 раза ниже — мелоксикамом. Таким образом, нимесулид является обоснованным выбором для пациентов со средним и высоким гастроинтестинальным риском осложнений.
Подводя итог, следует отметить, что нимесулид является препаратом выбора для быстрого устранения боли и воспалительного процесса [24]. Препарат показан пациентам со средним и высоким гастроинтестинальным и сердечно-сосудистым рисками.
Также отметим, что, помимо благоприятного профиля гастроинтестинальной безопасности, для нимесулида характерна низкая частота развития побочных эффектов со стороны сердечно-сосудистой системы. Согласно данным фармаконадзора, риск кардиоваскулярных осложнений при применении нимесулида ниже такового для селективных НПВП — мелоксикама, целекоксиба, а также неселективных кетопрофена, индометацина и пироксикама. Частота развития инфаркта и инсульта при применении нимесулида была очень низкой (0,01) — значительно ниже таковой целекоксиба (0,35), индометацина (0,04), мелоксикама, кетопрофена и пироксикама. Базируясь на этих данных, эксперты ЕМЕА положительно оценили показатели сердечно-сосудистой безопасности нимесулида.
Указанный обзор EMEA от 2012 г. также примечателен тем, что он содержит развернутый анализ гепатобезопасности различных НПВП. Необходимо отметить, что гепатотоксичность является класс-специфической побочной реакцией для всех НПВП. В этом контексте выгодно отличаются нимесулид и диклофенак, о чем свидетельствуют результаты крупного ретроспективного исследования SALT (Study of Acute Liver Transplant), в котором приняли участие почти 9 тыс. пациентов из 7 европейских стран (таблица). Согласно полученным результатам, относительный риск развития острой печеночной недостаточности из расчета на 1 млн лет лечения при применении нимесулида составил 5,64, диклофенака — 4,46. Для сравнения аналогичный показатель для парацетамола — 9,80 (95% ДИ 7,66–12,37), для индометацина — 13,10, для этодолака — 22,46 и для кеторолака — 58,31.
| НПВП | Количество суточных доз | Относительный риск на млн человеко-лет (ДИ 95%) |
|---|---|---|
| Целекоксиб | 357 873 149 | 3,48 [0,10; 19,37] |
| Диклофенак | 1 514 709 881 | 4,46 [1,45; 10,41] |
| Кетопрофен | 899 161 612 | 4,67 [0,96; 13,64] |
| Напроксен | 647 295 878 | 5,35 [0,64; 19,35] |
| Нимесулид | 1 356 255 833 | 5,64 [2,43; 11,11] |
| Ибупрофен | 1 219 162 429 | 5,77 [2,77; 10,61] |
| Индометацин | 80 584 130 | 13,10 [0,39; 72,98] |
| Нифлуминовая кислота | 62 794 037 | 14,44 [0,43; 80,41] |
| Этодолак | 70 791 098 | 22,46 [0,67; 125,1] |
| Кеторолак | 38 652 374 | 58,31 [7,00; 210,8] |
| Итого | 8 461 912 281 | 4,37 [3,02; 6,10] |
Пути дальнейшего повышения эффективности и безопасности НПВП-терапии
Несмотря на высокую эффективность выбранных системных НПВП, их противовоспалительный и анальгезирующий эффект может оказаться недостаточным, а повышение дозы в ряде случаев чревато увеличением риска развития побочных реакций. Как обеспечить необходимый уровень анальгезирующего и противовоспалительного действия, не ухудшив профиль безопасности терапии? Ответом на этот вопрос может стать применение местных НПВП, что позволяет повысить эффективность терапии без ущерба для показателей безопасности. Однако в этом свете становится актуальным другой вопрос: «Действительно ли терапия местными НПВП достаточно эффективна?», или в этом случае большее значение имеет эффект плацебо?
Весь масштаб влияния эффекта плацебо на самочувствие пациентов отлично иллюстрируют результаты исследования эффективности парацетамола при острой боли в спине [25]. В исследовании приняли участие 1652 пациента, которые были рандомизированы на три группы: пациенты 1-й группы регулярно применяли парацетамол по 4000 мг/сут, 2-й — применяли парацетамол по требованию, в зависимости от интенсивности боли — до 4000 мг/сут, 3-й — получали плацебо. Результаты оказались достаточно неожиданными — как регулярное применение парацетамола, так и по требованию не влияло на период восстановления при боли в спине сравнительно с плацебо. Таким образом, парацетамол оказался таким же эффективным, как и плацебо.
Поэтому для анализа эффективности того или иного препарата важно принимать во внимание результаты исследований с достаточно крупными выборками пациентов. Привлекает внимание обзор, проведенный учеными Оксфордского университета (University of Oxford) [26], в ходе которого проанализированы результаты 86 клинических исследований (более 10 тыс. пациентов) применения местных НПВП. Согласно данным этого обзора, местные НПВП эффективно купируют острый и хронический болевой синдром. Также интересными в свете изучения эффективности и профиля безопасности местных НПВП при болевом синдроме представляются результаты Кокрановского метаанализа, который объединил данные, полученные у 7688 пациентов в ходе 32 исследований [27]. Так, прямое сравнение не показало различий в эффективности между системными и местными НПВП, при этом частота развития гастроинтестинальных побочных реакций при применении местных НПВП была сопоставимой с таковой у пациентов, получавших плацебо. Таким образом, при отсутствии системных побочных реакций, противоболевая эффективность местных НПВП сопоставима с эффективностью системных НПВП. Одним из наиболее эффективных местных НПВП при общем благоприятном профиле безопасности является кетопрофен, о чем свидетельствуют результаты ряда исследований. Так, в ходе крупного клинического исследования показано, что кетопрофен является наиболее эффективным местным НПВП при купировании болевого синдрома [28]. Согласно полученным данным, кетопрофен значительно эффективнее других местных НПВП по интегральному показателю эффективности терапии NNT (numbers needed to treat), а именно: на 58% лучше, чем ибупрофен; на 80% лучше, чем пироксикам, и на 92% лучше, чем диклофенак. Таким образом, при топикальном применении кетопрофен почти в 2 раза эффективнее местного диклофенака.
Такие преимущества в противоболевой и противовоспалительной эффективности именно кетопрофена для местного применения обусловлены не только активностью молекулы, но и его способностью к проникновению в ткани суставов и околосуставных структур.
Преимущество кетопрофена по сравнению с другими топическими НПВП подтверждают и результаты исследования японских авторов [29], в котором рассматривали местные НПВП в современных лекарственных формах гелей и пластырей. Так, препараты кетопрофена для местного применения определены как наиболее перспективные. По мнению авторов исследования, кетопрофен имеет более высокую противовоспалительную и противоболевую активность, связанную как с фармакологическими особенностями молекулы, так и с лучшим ее проникновением через кожу.
Возникает закономерный вопрос, почему кетопрофен характеризуется благоприятным профилем безопасности, ведь если препарат хорошо проникает через кожу, то и концентрация в плазме крови должна быть высокой. Однако это не так, поскольку кетопрофен селективно накапливается в области приложения лечебных свойств — в тканях суставов. Так, показано, что концентрация кетопрофена в плазме крови примерно в 100 раз ниже, чем в тканях сустава [30]. Примечательно, что при этом кетопрофен не влияет на синтез матрикса суставного хряща — протеогликанов даже в остеоартритически измененном суставном хряще [31]. А в молодом хряще в концентрации 10 М кетопрофен даже повышает синтез хрящевого матрикса.
Таким образом, кетопрофен является обоснованным выбором в комплексе с системными диклофенаком или нимесулидом. Согласно данным доказательной медицины, препарат демонстрирует высокую эффективность и благоприятный профиль безопасности, при этом не оказывая негативного влияния на суставной хрящ, что имеет ключевое значение при длительном применении. Кетопрофен достигает очага боли и воспаления в необходимой концентрации, обеспечивая анальгезирующий и противовоспалительный эффекты. При этом концентрация препарата в плазме крови остается очень низкой и не вызывает развития системных побочных реакций даже в случае длительной терапии.
Выводы
Выбирая НПВП для купирования болевого синдрома и воспалительного процесса необходимо учитывать эффективность и безопасность препарата, а также риск развития тех или иных побочных реакций у конкретного пациента:
- При низких кардиоваскулярных и гастроинтестинальных рисках препаратом выбора может быть любой НПВП, но в первую очередь диклофенак, который по-прежнему является золотым стандартом противовоспалительной терапии.
- Препаратом выбора в лечении патологии опорно-двигательного аппарата, в частности ОА, является нимесулид.
- При наличии сердечно-сосудистой патологи препаратом выбора является нимесулид или же диклофенак в сочетании с ацетилсалициловой кислотой.
- Для усиления клинических эффектов системных НПВП целесообразно добавление локальных НПВП, в первую очередь кетопрофена, который демонстрирует высокую эффективность и низкий риск системных побочных реакций, который сопоставим с плацебо.
Список использованной литературы
- 1. Laufer S., Gay S., Brune K. (2003) Inflammation and Rheumatic Diseases: The molecular basis of novel therapies. Georg Thieme Verlag, New York.
- 2. Visha M.G. (2013) Selective Cox-2 inhibitor. Int. J. Pharm. Sci Interv., 3(2): 28–33.
- 3. Olsen A.M.S., Gislason G.H., McGettigan P. et al. (2015) Association of NSAID use with risk of bleeding and cardiovascular events in patients receiving antithrombotic therapy after myocardial infarction. Jama, 313(8): 805–814.
- 4. Bresalier R.S., Sandler R.S., Quan H. et al. (2005) Cardiovascular events associated with rofecoxib in a colorectal adenoma chemoprevention trial. N. Engl. J. Med., 352(11): 1092–1102.
- 5. Fanelli A., Ghisi D., Aprile P.L., Lapi F. (2017) Cardiovascular and cerebrovascular risk with nonsteroidal anti-inflammatory drugs and cyclooxygenase 2 inhibitors: latest evidence and clinical implications. Therapeutic Advances in Drug Safety, р. 173–182.
- 6. Bhala N., Emberson J., Merhi A. et al. (2013) Vascular and upper gastrointestinal effects of non-steroidal anti-inflammatory drugs: metaanalyses of individual participant data from randomised trials. Coxib and traditional NSAID Trialists (CNT) Collaboration. Lancet, 382(9894): 769–779.
- 7. www.drugs.com/history/arcoxia.html
- 8. Fitzgerald G.A., Patrono C. (2001) The coxibs, selective inhibitors of cyclooxygenase-2. N. Engl. J. Med., 345(6): 433–442.
- 9. Brune K., Patrignani P. (2015) New insights into the use of currently available non-steroidal anti-inflammatory drugs. J. Pain Res., 8: 105.
- 10. Walter M.F., Jacob R.F., Day C.A. et al. (2004) Sulfone COX-2 inhibitors increase susceptibility of human LDL and plasma to oxidative modification: comparison to sulfonamide COX-2 inhibitors and NSAIDs. Atherosclerosis, 177(2): 235–243.
- 11. Solomon S.D., McMurray J.J., Pfeffer M.A. et al. (2005) Cardiovascular risk associated with celecoxib in a clinical trial for colorectal adenoma prevention. N. Engl. J. Med., 352(11): 1071–1080.
- 12. Simon L.S. (2000) Are the biologic and clinical erfects of the COX-2-specific inhibitors an advance compared with the effects of traditional NSAIDs? Curr. Opin. Rheumatol., 12: 163–170.
- 13. Smith W.L., Langen B.R. (2001) Why there are two cyclooxygenase isoenzymes. J. Clin. Invest., 107: 1491–95.
- 14. Wallace J.L. (1999) Distribution and expression of cyclooxygenase (COX) isoenzymes, their physiological roles, and the categorization of nonsteroidal anti-inflammatory drugs (NSAIDs). Am. J. Med., 107(6A): 11–16.
- 15. Wallace J.L., Bak A., McKnight W. et al. (1998) Cyclooxygenase-1 contributes to inflammatory responses in rats and mice: implications for gastrointestinal toxicity. Gastroenterology, 15: 101–109.
- 16. Dey I., Lejeune M., Chadee K. (2006) Prostaglandin E2 receptor distribution and function in the gastrointestinal tract. British J. Pharmacol., 149(6): 611–623.
- 17. Hecken A., Schwartz J.I., Depré M. et al. (2000) Comparative inhibitory activity of rofecoxib, meloxicam, diclofenac, ibuprofen, and naproxen on COX-2 versus COX-1 in healthy volunteers. J. Clin. Pharmacol., 40(10): 1109–1120.
- 18. Hawkey C., Kahan A., Steinbrück K. et al. (1998) Gastrointestinal tolerability of meloxicam compared to diclofenac in osteoarthritis patients. International MELISSA Study Group. Meloxicam Large-scale International Study Safety Assessment. British J. Rheumatol., 37(9): 937–945.
- 19. Lanas A., García-Rodríguez L.A., Arroyo M.T. et al. (2006) Risk of upper gastrointestinal ulcer bleeding associated with selective COX-2 inhibitors, traditional non-aspirin NSAIDs, aspirin, and combinations. Gut. Dec., 55(12): 1731–1738.
- 20. Barracchini A., Franceschini N., Amicosante G. et al. (1998) Biochemistry: Can Non-steroidal Anti-inflammatory Drugs Act as Metalloproteinase Modulators? An In-vitro Study of Inhibition of Collagenase Activity. J. Pharm. Pharmacol., 50(12): 1417–1423.
- 21. Holgate S.T., Peters-Golden M., Panettieri R.A. et al. (2003) Roles of cysteinyl leukotrienes in airway inflammation, smooth muscle function, and remodeling. J. Aller. Clin. Immunol., 111(1): 18–36.
- 22. Burnett B.P., Levy R.M. (2012) 5-Lipoxygenase Metabolic Contributions to NSAID-Induced Organ Toxicity. Advances in Therapy, 29(2): 79–98.
- 23. Шуба Н.М., Воронова Т.Д., Пилипенко А.В. (2015) Изучение эффективности нимесулида и его влияние на отдельные патогенетические звенья в практике семейного врача. Семейная медицина, 2: 41–45.
- 24. Шуба Н.М., Воронова Т.Д., Крилова А.С. (2017) Диференційований підхід до лікування остеоартрозу з коморбідною патологією. Укр. ревматол. журн., 2(68): 6–16.
- 25. Williams C.M., Maher C.G., Latimer J. et al. (2014) Efficacy of paracetamol for acute low-back pain: a double-blind, randomized controlled trial. Lancet, 384(9954): 1586–1596.
- 26. Moore R.A., Tramer M.R., Carroll D. et al. (1998) Quantitive systematic review of topically applied non-steroidal anti-inflammatory drugs. BMJ, 316(7128): 333–338.
- 27. Derry S., Moore R.A., Rabbie R. (2012) Topical NSAIDs for chronic musculoskeletal pain in adults. Cochrane Database Syst. Rev., 9:CD007400.
- 28. Mason L., Moore R.A., Edwards J.E. et al. (2004) Topical NSAIDs for acute pain: a meta-analysis. BMC family practice, 5(1): 10.
- 29. Komatsu T., Sakurada T. (2012) Comparison of the efficacy and skin permeability of topical NSAID preparations used in Europe. Eur. J. Pharmac. Sci., 47(5): 890–895.
- 30. Ballerini R., Casini A., Chinol M. et al. (1986) Study on the absorption of ketoprofen topically administered in man: comparison between tissue and plasma levels. Int. J. Clin. Pharmacol. Res., 6(1): 69–72.
- 31. Wilbrink B., van der Veen M.J., Huber J. et al. (1991) In vitro influence of ketoprofen on the proteoglycan metabolism of human normal and osteoarthritis cartilage. Inflam. Res, 32(3): 154–159.
Адрес для переписки:
Шуба Неонила Михайловна
04112, Киев, ул. Дорогожицкая, 9
Национальная медицинская академия
последипломного образования
им. П.Л. Шупика

Leave a comment