АНГІОПАТІЯ ПРИ СИСТЕМНІЙ СКЛЕРОДЕРМІЇ
Синяченко О.В.1, Егудина Е.Д.2, Микукстс В.Я.1, Ермолаева М.В.1, Кетинг Е.В. 1, Дядык Е.А.3
- 1Донецкий национальный медицинский университет, Лиман
- 2ДУ «Дніпровська медична академія» МОЗ України, Дніпро
- 3Национальная медицинская академия последипломного образования им. П.Л. Шупика, Киев
Резюме. Актуальність проблеми. Серед хвороб ревматологічного профілю частка системної склеродермії (ССД) становить близько 2%, причому чисельність таких хворих всюди зростає. Одним із основних клінічних проявів ССД є ураження судин, а при морфологічному дослідженні шкіри та внутрішніх органів ознаки ангіопатії відзначають в усіх випадках. Варіанти перебігу судинної патології у цих хворих вивчено недостатньо. Мета і завдання дослідження. Оцінити перебіг ураження судин у хворих на ССД за даними інструментальних методів діагностики, характер взаємовідносин із морфологічними проявами вазопатії шкіри й нирок, роль порушень системи імунітету й ендотеліальної судинної функції в патогенетичних побудовах склеродермічної ангіопатії. Об’єкт і методи. Під наглядом перебували 57 хворих на ССД (6 чоловіків і 51 жінка, середній вік — 42 роки). Тривалість від клінічної маніфестації захворювання становила 11 років. В усіх обстежених виявлено хронічний перебіг ССД, активність патологічного процесу І ступеня констатовано у 40% випадків, ІІ — у 37%, ІІІ — у 23%. Проводили клінічне та ультразвукове дослідження (ехокардіографію, допплерографію судин), біомікроскопію судин кон’юнктиви, у 37 пацієнтів — біопсію шкіри, а у 8 з них — нефробіопсію. Результати. Маніфестне ураження судин спостерігається у 88% хворих на ССД, клінічні, інструментальні й морфологічні ознаки якого щільно пов’язані зі ступенем активності патологічного процесу і тривалістю хвороби, з характером «вегетативного паспорта» (ваготонічний та симпатотонічний тип вегетативної нервової системи), із серопозитивністю захворювання за антитопоізомеразними антитілами, антинуклеарним фактором, антитілами до нативної дезоксирибонуклеїнової кислоти й кардіоліпіну. Ангіопатія при ССД супроводжується підвищенням легеневого судинного опору, розвитком легеневої гіпертензії та змінами процесів вазодилатації, при цьому інтегральні судинні клінічні, інструментальні й морфологічні параметри впливають на тяжкість склеродермічної пневмопатії та нефропатії, вираженість проліферації ендотелію, лімфогістіоцитарної інфільтрації та мікротромбозування судин. Імунологічні параметри, разом з інтегральним рівнем ендотеліальної судинної дисфункції, беруть участь у патогенетичних побудовах васкулопатії при ССД і мають у цих пацієнтів прогностичну значущість.
УДК 616.5:616.72+616.13/.14-137-007-094]-07-085-092
Введение
Среди болезней ревматологического профиля на долю системной склеродермии (ССД) приходится около 2% (Yang Z. et al., 2016), причем численность этих больных повсеместно растет (Ramos-Casals M. et al., 2015). Одним из основных проявлений ССД является поражение сосудов (Visconti L. et al., 2014; Sharma A. et al., 2016), а при морфологическом исследовании кожи и внутренних органов признаки ангиопатии (вазопатии, васкулопатии) у этих больных отмечают во всех случаях (Srivastava R. et al., 2016). К сосудистой патологии при ССД относятся первичная и вторичная (связанная с пульмональной патологией) легочная гипертензия (Karabay C.Y. et al., 2011; Denton C.P., 2015), дигитальный артериит с некрозом фаланг пальцев (Sharp C.A. et al., 2016), хроническая болезнь почек с изменениями капилляров клубочков и артериол (Visconti L. et al., 2014; Kubota K. et al., 2015), поражение сонных и коронарных артерий (Ciccone M.M. et al., 2015; Dadoniene J. et al., 2015).
Хорошо известно, что ангиопатия при ССД вызывает нарушения микроциркуляции с ишемией органов (Hegner B. et al., 2016), активацией фибробластов и последующим развитием обширного фиброза (Visconti L. et al., 2014; Wang Y.J. et al., 2015). Вместе с тем все варианты клинического течения сосудистой патологии у таких больных изучены недостаточно, остается малоизвестным характер взаимоотношений с морфологическими проявлениями вазопатии кожи и почек, роль нарушений системы иммунитета и эндотелиальной функции сосудов в патогенетических построениях склеродермической ангиопатии. Изложенное стало целью и задачами данного исследования.
Объект и методы исследования
Под наблюдением находились 57 больных ССД в возрасте от 15 до 67 лет (в среднем — 41,5±1,67 года), среди которых 10,5% составляли мужчины и 89,5% — женщины. Длительность от клинической манифестации заболевания составила 11,0±0,95 года. У всех обследованных отмечали хроническое течение ССД, активность патологического процесса І степени констатирована в 40,4% случаев, ІІ — в 36,9%, ІІІ — в 22,8%. Лимитированная форма кожного синдрома диагностирована у 47,4% больных, диффузная — у 29,8%, поражение скелетных мышц — у 43,9%, суставов — у 84,2%, сердца — у 82,5%, легких — у 61,4%, пищевода — у 59,7%, печени — у 31,6%, почек — у 35,1%, центральной нервной системы — у 28,1%, периферической — у 36,9%, склеродактилия выявлена в 24,6% наблюдений, синдром Рейно — в 87,7%, синдром Шегрена — в 15,8%, CREST-синдром — в 7,0%.
Больным выполняли электрокардиографию (аппараты «МІДАК-ЕК1Т», Украина, и «Bioset-8000», Германия), эхокардиографию («Acuson-Aspen-Siemens», Германия, и «HD-11-XE-Philips», Нидерланды), рентгенологическое исследование суставов и легких («Multix-Compact-Siеmens», Германия), эзофагогастроскопию (фиброскоп «Olympus-GIF-Q20», Япония), сонографию внутренних органов (сканер «Envisor-Philips» (Нидерланды), ультразвуковую допплерографию сосудов (ангиограф «Aplia-XG-Toshiba», Япония), биомикроскопию сосудов конъюнктивы (щелевая лампа «Haag-Streit-Bern-900», Швейцария). Определяли среднее периферическое артериальное давление (пАД) и давление в легочной артерии (лАД), периферическое и легочное сосудистое сопротивление (соответственно пСС и лСС), сосудистый вегетативный индекс (СВИ) интравазальный (ИВИ), вазальный (ВИ) и экстравазальный индексы (ЭВИ), исходный диаметр плечевой артерии (ДИ), степень ее вазодилатации (∆Д), диаметр во время вазодилатации (ДВ) и индекс сосудистого напряжения (ИСН), устанавливали исходный вегетативный тонус («вегетативный паспорт») больных, распределяя их на эйтоников, ваготоников и симпатотоников.
Изучали индекс клинического течения ангиопатии (Ω) по формуле:
{Ω=(Σ:E)·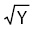 },
},
где Σ — сумма баллов всех клинических признаков ССД, E — число признаков, Y — степень активности заболевания. Определяли также инструментальный сосудистый индекс (Ψ), при этом каждый средний показатель у больного (Χ) c его стандартным отклонением (ς) оценивали в 1 балл в случаях {<Χ+ς}, при {Χ+ς↔Χ+2ς} — в 2 балла, при {Χ+2ς↔Χ+3ς} — в 3 балла, при {>Χ+3ς} — в 4 балла. Высчитывали Ψ на одного больного по формуле:
{Ψ=(A+2B+3Г+4∆):E},
где «A, B, G, ∆» — число больных соответствено с 1, 2, 3 и 4 баллами, «E» — число показателей. Интегральный индекс тяжести сосудистой патологии (Ξ) оценивали по формуле:
{Ξ=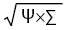 },
},
где Σ — сумма морфологических признаков изменений сосудов кожи и почек. Для определения интегрального показателя эндотелиальной дисфункции сосудов (Θ) сначала у больных определяли степень изменения (∆) показателей вазоконстрикторов — сосудистого эндотелиального фактора роста (VEGF), эндотелина-1 (ЕТ1 и тромбоксана А2 (ТхА2), а также вазодилататора простациклина (PgI2) по формуле:
{Χ=[(П1–П2):ς],
где П1 и П2 — показатели у больных и здоровых, ς — стандартное отклонение у здоровых. Затем высчитывали Θ по формуле:
{Θ = 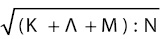 },
},
где «K» — VEGF, «Λ» — ET1, «M» — TxA2, «N» — PgI2 (эндотелиальную дисфункцию диагностировали при Q >5 у.е.). В качестве контроля лабораторные показатели исследованы у 30 практически здоровых людей (13 мужчин и 17 женщин в возрасте 18–65 лет).
С помощью биохимического анализатора «Olympus-AU-640» (Япония») исследовали в крови уровни креатинина, фибриногена (FG), С-реактивного протеина (CRP), циркулирующих иммунных комплексов (CIC) и ревматоидного фактора (RF). Иммуноферментным методом изучали уровни антител к нативной дезоксирибонуклеиновой кислоте (aDNA), кардиолипину (aCL), циклическому цитруллиновому пептиду (aCCP), показатели VEGF, ET1, TxA2, гомоцистеина (HCys), PgI2, циклического гуанозинмонофосфата (cGMP), Е-селектина (Esel), Р-селектина (Psel) (ридер «PR2100 Sanofi diagnostic pasteur», Франция). Иммуноблотовым методом определяли уровни антитопоизомеразных антител (aScl70) и антинуклеарного фактора (ANF) (аппарат «Euroline-Euroimmun», Германия). Серопозитивность по aScl70 установлена в 80,7% наблюдений, по ANF — в 64,9%, по aDNA — в 63,2%, по RF — в 57,9%, по aCCP — в 21,1%, по aCL — в 19,3%. Во время оценки функционального состояния почек использовали определение скорости клубочковой фильтрации по формуле Кокрофта — Голта через определение уровня креатининемии.
У 37 больных (32 женщины и 5 мужчин) в возрасте от 15 до 67 лет (в среднем — 42,8±2,03 года) выполнена микроинцизионная биопсия кожи, а у 8 из них с мочевым синдромом — пункционная нефробиопсия, которую осуществляли на фоне атаралгезии под контролем ультразвукового исследования почки. Использовали методику «True-Cut» («настоящего среза») с применением высокоскоростного пистолета «Biopty-Bard»). Гистологические срезы кожи и почек окрашивали гематоксилином-эозином, а только почек — альциановым синим (на гликопротеиды) и по ван Гизону (коллагеновые и эластические волокна), ставилась PAS-реакция. Кроме того, проводили иммуноферментный (с пероксидазной меткой) и иммунофлюоресцентный методы исследования тканей почек. Изучали отложения иммуноглобулинов (Ig) A, G, M, C3- и Cq1-компонентов комплемента. Микроскопическое исследование осуществляли на микроскопах «Olympus-AX40» и «Olympus-AX70-Provis» с цифровой видеокамерой «Olympus-DP50». Поражение отдельных почечных структур (клубочков, канальцев, стромы, сосудов) оценивали в баллах (от 0 до 3). При этом подсчитывали средний показатель повреждений (ϑ) по формуле:
{ϑ=(α+2β+3γ):(α+β+γ+δ)},
где «α, β, γ» — число больных соответствено с 1, 2 и 3 баллами, а «δ» — число больных с отсутствием данного признака.
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного, непараметрического, корреляционного, регрессионного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы «Microsoft Excel» и «Statistica-Stat-Soft», США). Определяли средние значения, их стандартные ошибки и отклонения, коэффициенты параметрической корреляции Пирсона и непараметрической Кендалла, критерии дисперсии Брауна — Форсайта, множественной регрессии, Стьюдента, Уилкоксона — Рао, Макнемара — Фишера и достоверность статистических показателей.
Результаты исследования
В процессе клинико-инструментального обследования признаки ангиопатии установлены у 87,7% больных ССД, которые включены в основную группу, а контрольную составили остальные пациенты. Распределение пациентов основной группы по частоте клинических признаков заболевания, тесно связанных с сосудистыми расстройствами, было следующим: синдром Рейно, периферическая нейропатия, артериальная гипертензия (пАД >15 мм рт. ст.), дисциркуляторная энцефалопатия, легочная гипертензия (лАД >20 мм рт. ст.), гломерулонефрит, телеангиэктазии, антифосфолипидный синдром, увеит, капилляриты кистей и стоп, лейкоцитокластическая энантема соотносились как 50:38:34:30:28:22:18:16: 12:10:8. Интегральный Ψ составил 2,1±0,20 о.е. Поражение устья аорты обнаружено у 52,6% от числа пациентов, левой общей сонной артерии — у 26,3%, правой — у 28,1%, левой внутренней сонной артерии — у 36,9%, правой — у 24,6%. Показатель пАД составил 108,8±2,71 мм рт. ст., лАД — 12,2±0,47 мм рт. ст., соотношения лАД/пАД — 11,7±0,67%, пСС — 2,3±0,10 дин·c·см, лСС — 222,3±10,65 дин·c·см, лСС/пСС — 9,0±0,52%, СВИ — 15,9±0,79 о.е., ИВИ — 1,7±0,07 балла, ВИ — 6,9±0,25 балла, ЭВИ — 4,3±0,17 балла, ДИ — 4,4±0,02 мм, ∆Д — 12,1±0,71%, ДВ — 5,5±0,04 мм, ИСН — 1,4±0,10 о.е.
По данным многофакторного анализа Уилкоксона — Рао, на интегральные клинико-инструментальные сосудистые показатели оказывают воздействие степень активности заболевания, тип вегетативный нервной системы, показатели aScl70 и aCL. Для оценки влияния тех или иных факторов на клинические признаки склеродермической ангиопатии нами отобраны те из них, которые одновременно достоверно соответствовали результатам однофакторного дисперсионного анализа Брауна — Форсайта и непараметрического корреляционного Кендалла. Оказалось, что со степенью активности ССД ассоциируются развитие увеита, лейкоцитокластической энантемы и параметры ЭВИ, с длительностью патологического процесса — значения пАД, лАД и ∆Д, с уровнем aScl70 — ИВИ, с aDNA — капилляриты кистей и стоп, с аССР — наличие телеангиэктазий и дисциркуляторной энцефалопатии.
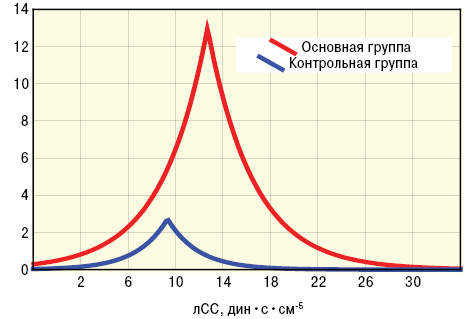
Больные основной и контрольной групп существенно отличались между собой по их «вегетативному паспорту» (при наличии ангиопатии превалировали симпатотоники, а среди остальных пациентов — ваготоники), что показал анализ Мак-немара — Фишера, хотя показатели квадратического вегетативного индекса Кердо были примерно равны, соответственно составляя ln6,2±0,27 о.е. и ln6,5±0,67 о.е. У представителей основной группы оказались достоверно (на 37%) большими параметры лАД и на 39% — лСС (рис. 1, 2). Несколько неожиданным оказался факт большего (на 36%) показателя ∆Д у представителей основной группы, а значит, и степени вазодилатации плечевой артерии, хотя отличия были недостоверными. На рис. 3–4 представлены различия трехмерных гистограмм интегральных показателей биомикроскопии бульбарной конъюнктивы и допплерографии плечевой артерии.
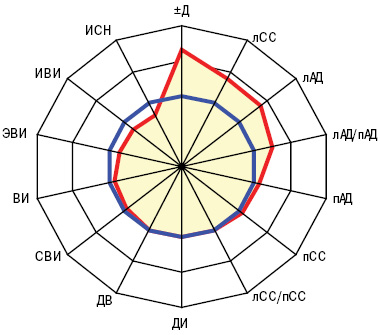
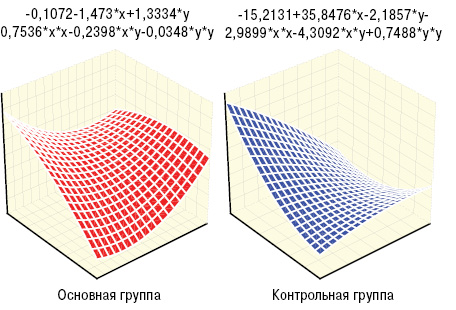
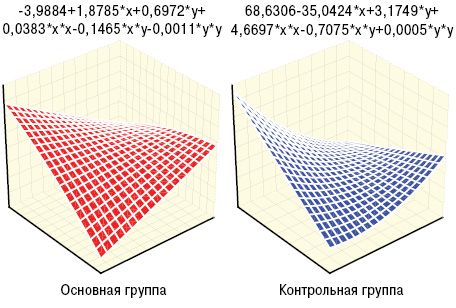
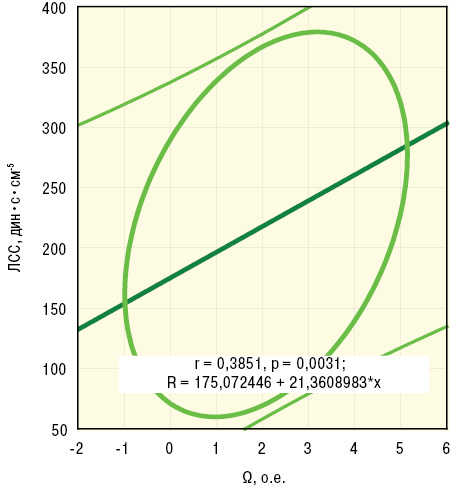
По данным дисперсионного анализа Брауна — Форсайта и корреляционного Пирсона, интегральный показатель Ω тесно связан с ∆Д. Кроме того, Ω прямо соотносится с параметрами пАД, лАД, лСС, ИВИ, ВИ и ЭВИ, что отражено на рис. 5–7, а анализ множественной регрессии демонстрирует прямую зависимость от Ω состояния сосудов конъюнктивы.
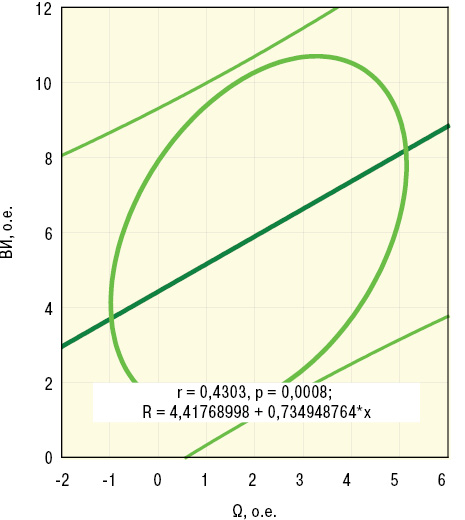
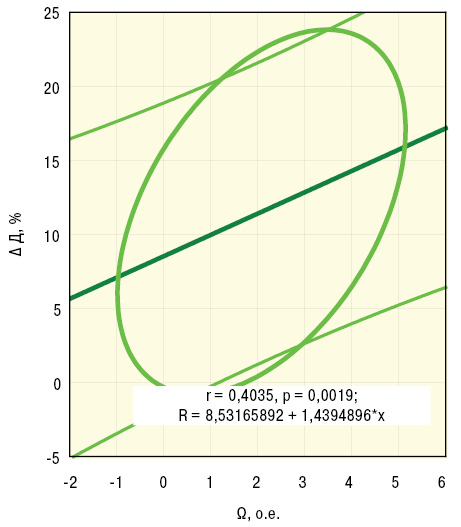
Обсуждение
По результатам выполненного вариационного, дисперсионного и корреляционного анализа, показатель ∆Д >4 о.е. (>Χ+ς больных основной группы) отражает тяжесть системной ангиопатии, что имеет определенную практическую значимость. От показателя лСС прямо зависит развитие синдрома Рейно и легочной гипертензии, от изменений сонных артерий — формирование периферической нейропатии, от значений ВИ — появление лейкоцитокластической энантемы. С учетом таких комплексных статистических выкладок сделаны следующие заключения: 1) наличие синдрома Рейно при ССД является фактором риска высокого лСС, а поражений периферической нервной системы — вовлечения в процесс сонных артерий; 2) показатель ВИ >9 баллов (>Χ+ς больных основной группы) относится к прогнознегативным признакам развития лейкоцитокластической энантемы.
Как показал дисперсионный анализ Брауна — Форсайта и корреляционный Кендалла, показатель фибриногенемии определяет у таких пациентов уровень пАД, концентрация в крови aScl70 — лАД. В этой связи значения FG >8 г/л являются фактором риска артериальной гипертензии, а позитивность по aScl70 — легочной.
Результаты морфологического исследования кожи представлены на рис. 8. По данным выполненного многофакторного дисперсионного анализа Уилкоксона — Рао, на интегральные морфологические признаки поражения сосудов кожи оказывают воздействие длительность заболевания, показатели aScl70 и aCL. Как свидетельствует однофакторный анализ Брауна — Форсайта, продолжительность болезни влияет на степень утолщения стенок сосудов, нейтрофильной периваскулярной инфильтрации, пролиферации интимы и появление экстравазации эритроцитов, значения aScl70 — на уровни лимфогистиоцитарной инфильтрации и фибриноидного набухания сосудистой стенки, параметр aCL — на пролиферацию эндотелия, лимфогистиоцитарную периваскулярную инфильтрацию, степень фибриноидного некроза и тромбозирования сосудов, aDNA — на характер мукоидного набухания.
Как свидетельствует анализ Макнемара — Фишера, вегетативный тип нервной системы больных ССД определяет развитие мукоидного набухания стенки сосудов, которое свойственно эйтоникам и ваготоникам, а также появление пролиферации интимы и эозинофильной сосудистой инфильтрации, характерных для симпатотоников. Только у пациентов с эндотелиальной дисфункцией появлялась гигантоклеточная инфильтрация сосудов. Содержание в крови aScl70 прямо коррелирует со степенью лимфогистиоцитарной периваскулярной инфильтрации и стенки сосудов, тогда как aCL — с пролиферацией интимы, нейтрофильной сосудистой инфильтрацией, фибриноидным некрозом и микротромбозированием сосудов.
Для ССД характерны нарушения эндотелиальной функции сосудов (Denton C.P., 2015; Ferrante A. et al., 2016), а в качестве примера можно привести вазоспастический синдром Рейно, в генезе которого участвует дисфункция сосудистого эндотелия с гиперпродукцией ЕТ1 и ЕSel (Overbury R. et al., 2015; Latuskiewicz-Potemska J. et al., 2016). В большей степени на изменения эндотелиальной дисфункции у таких больных реагируют сосуды легких и почек (Guo L. et al., 2015; González-Suárez I. et al., 2016) с развитием пульмональной гипертензии, поражением капилляров и артериол почек (Dimitroulas T. et al., 2010). Потенцирует эти процессы активация фибробластов и изменения дифференцировки миофибробластов, которые являются предикторами напряжения эндоплазматической сети и активации перицитов (Ho Y.Y. et al., 2014). Сосудистая эндотелиальная дисфункция при ССД проявляется закономерной дисрегуляцией ангиогенеза, обусловленной усиленным синтезом VEGF (Manetti M. et al., 2016).
Нами установлены прямые корреляционные связи Пирсона между уровнями в крови больных ССД aCL и TxA2, CRP и HCys, FG и PSel, ANF — и VEGF, и ET1 при обратных взаимоотношениях с показателем простациклинемии. Содержание VEGF прямо коррелирует со значениями Ω, Ψ и Ξ. Кроме того, параметры Ω и Ψ обратно соотносятся со значениями PgI2, только Ω имеет позитивные корреляции с ЕТ1 и ТхА2, Ψ — с cGMP, Ξ — с ESel, что продемонстрировал анализ Кендалла. Дисперсионно-корреляционные связи развития телеангиэктазий, гломерулонефрита и артериальной гипертензии касаются показателя Θ. Последний прямо коррелирует с пАД, лАД, степенью сужения общих сонных артерий, пролиферации эндотелия и фибриноидного набухания сосудов кожи, фибриноидного набухания и склероза артериол почек, уровня депозиций в них IgG.
Существуют разнообразные дисперсионные и корреляционные связи отдельных морфологических признаков сосудистой патологии кожи с экстрадермальными проявлениями ангиопатии у больных ССД, но на первый план выступают те из них, которые одновременно соответствуют достоверным критериям дисперсионного и корреляционного анализа. В отношении Ω к таковым относились лимфогистиоцитарная инфильтрация стенки сосудов, а касательно Ψ — пролиферация сосудистого эндотелия и интравазальная эритроцитарно-тромбоцитарная агрегация. В свою очередь, с интегральным Ξ тесно связаны поражение у больных легких и почек. При этом анализ множественной регрессии показал прямую зависимость клинических признаков ССД от Ξ.
Как известно, хроническую болезнь почек отмечают у ⅓ больных ССД (Visconti L. et al., 2014), причем для нее очень типичны, хотя и неспецифичны, изменения сосудов (De Groot K., 2014), а гистологически выявляют некротический гломерулонефрит с выраженной лимфогистиоцитарной инфильтрацией артериол и капилляров клубочков (Kubota K. et al., 2015). По нашим данным, хроническая склеродермическая нефропатия протекает с расщеплением и утолщением гломерулярных капиллярных петель, пролиферацией эндотелия капилляров и артериол, с лимфогистиоцитарной, плазмоцитарной и нейтрофильной их инфильтрацией, с фибриноидным набуханием и некрозом, дисмукоидозом, гиалинозом, эластофиброзом и склерозом сосудов, а также с периваскулярным склерозом, с депозицией в капиллярах и артериолах IgA, IgG, IgM, C3- и C1q-компонентов комплемента (рис. 9). ϑ сосудов составил 0,76±0,070 о.е., клубочков — 0,95±0,077 о.е., канальцев — 1,28±0,122 о.е., стромы почек — 1,25±0,107 о.е., при этом выявлена позитивная параметрическая корреляционная взаимосвязь критерия Пирсона между ϑ сосудов и клубочков. Кроме того, по результатам непараметрического анализа Кендалла, ϑ сосудов прямо соотносится с капилляритами кистей и стоп.
Дополнительная статистическая обработка полученных данных показала дисперсионно-корреляционную прямую зависимость от Ω пролиферации эндотелия капилляров и нейтрофильной их инфильтрации, а от Ψ — плазматического пропитывания и депозиции IgG. Показатель Θ оказывает воздействие на нейтрофильную инфильтрацию капилляров клубочков, фибриноидное набухание артериол, отложения в капиллярах IgG, a в артериолах IgA, IgM, C3 и C1q, что показывает анализ Брауна — Форсайта. При этом существуют прямые корреляционные связи Кендалла с Θ степени фибриноидного набухания артериол, склероза сосудов и депозиций в артериолах IgA. С учетом представленных статистических данных сделано следующее заключение: значения Θ >9 о.е. (>Χ±δ больных ССД) свидетельствуют о тяжести фибриноидного набухания стенок артериол и депозиции в них IgA.
Выводы
1. Манифестное поражение сосудов отмечают у 88% больных ССД, клинические, инструментальные и морфологические признаки которого тесно связаны со степенью активности патологического процесса и длительности болезни, с характером «вегетативного паспорта» (ваготонический и симпатотонический тип вегетативной нервной системы), с серопозитивностью заболевания по aScl, ANF, aDNA и aCL.
2. Ангиопатия при ССД сопровождается повышением лСС, развитием легочной гипертензии и изменениями процессов вазодилатации, при этом интегральные сосудистые параметры Ω, Ψ и Ξ влияют на тяжесть склеродермической пневмопатии и нефропатии, выраженность пролиферации эндотелия, лимфогистиоцитарной инфильтрации и микротромбозирования сосудов.
3. Показатели aScl, ANF и FG, наряду с интегральным уровнем эндотелиальной дисфункции Θ, участвуют в патогенетических построениях васкулопатии при ССД и обладают у таких пациентов прогностической значимостью.
Список использованной литературы
- 1. Ciccone M.M., Scicchitano P., Zito A. et al. (2015) Evaluation of differences in carotid intima-media thickness in patients affected by systemic rheumatic diseases. Intern. Emerg. Med., 10(7): 823–830.
- 2. Dadoniene J., Cypiene A., Ryliskyte L. et al. (2015) Skin autofluorescence in systemic sclerosis is related to the disease and vascular damage: a cross-sectional analytic study of comparative groups. Dis. Markers., 20(15): 837470.
- 3. De Groot K. (2014) Renal manifestations in rheumatic diseases. Internist, 48(8): 779–785.
- 4. Denton C.P. (2015) Systemic sclerosis: from pathogenesis to targeted therapy. Clin. Exp. Rheumatol., 33(4): 3–7.
- 5. Dimitroulas T., Sarafidis P., Roma V. (2010) Scleroderma renal crisis accompanied by new-onset pulmonary arterial hypertension: an acute systemic endothelial injury? Case report and literature. Inflamm. Allergy Drug. Targets., 9(4): 313–318.
- 6. Ferrante A., Guggino G., Di Liberto D. et al. (2016) Endothelial progenitor cells: Are they displaying a function in autoimmune disorders? Mech. Ageing. Dev., 3(5): 122–128.
- 7. González-Suárez I., Arpa J., Ríos-Blanco J.J. (2016) Brain microvasculature involvement in ANCA positive vasculitis. Cerebrovasc. Dis., 41(5–6): 313–321.
- 8. Guo L., Li M., Chen Y. et al. (2015) Anti-endothelin receptor type a autoantibodies in systemic lupus erythematosus-associated pulmonary arterial hypertension. Arthritis Rheumatol., 67(9): 2394–2402.
- 9. Hegner B., Schaub T., Catar R. et al. (2016) Intrinsic deregulation of vascular smooth muscle and myofibroblast differentiation in mesenchymal stromal cells from patients with systemic sclerosis. PLoS One., 11(4): 0153101.
- 10. Ho Y.Y., Lagares D., Tager A.M., Kapoor M. (2014) Fibrosis — a lethal component of systemic sclerosi. Nat. Rev. Rheumatol., 10(7): 390–402.
- 11. Karabay C.Y., Karaahmet T., Tigen K. et al. (2011) Cardiovascular involvement in patients with systemic sclerosis: insights from electromechanical characteristics of the heart. Anadolu Kardiyol. Derg., 11(7): 643–647.
- 12. Kubota K., Ueno T., Mise K. et al. (2015) ANCA-associated vasculitis in a patient with systematic sclerosis and sjögren’s syndrome: a case report. Case Rep. Nephrol. Dial., 5(2): 113–117.
- 13. Latuskiewicz-Potemska J., Chmura-Skirlinska A., Gurbiel R.J., Smolewska E. (2016) Nailfold capillaroscopy assessment of microcirculation abnormalities and endothelial dysfunction in children with primary or secondary Raynaud syndrome. Clin. Rheumatol., 35(8): 1993–2001.
- 14. Manetti M., Guiducci S., Matucci-Cerinic M. (2016) The crowded crossroad to angiogenesis in systemic sclerosis: where is the key to the problem? Arthritis Res. Ther., 18(5): 36–46.
- 15. Overbury R., Murtaugh M.A., Fischer A., Frech T.M. (2015) Primary care assessment of capillaroscopy abnormalities in patients with Raynaud’s phenomenon. Clin. Rheumatol., 34(12): 2135–2140.
- 16. Ramos-Casals M., Brito-Zerón P., Kostov B. (2015) Google-driven search for big data in autoimmune geoepidemiology: analysis of 394,827 patients with systemic autoimmune diseases. Autoimmun. Rev., 14(8): 670–679.
- 17. Sharma A., Dhooria A., Aggarwal A., Rathi M. (2016) Connective tissue disorder-associated vasculitis. Curr. Rheumatol. Rep., 18(6): 31–41.
- 18. Sharp C.A., Akram Q., Hughes M., Muir L. (2016) Differential diagnosis of critical digital ischemia in systemic sclerosis: Report of five cases and review of the literature. Semin. Arthritis Rheum., 46(2): 209–216.
- 19. Srivastava R., Jyoti B., Bihari M., Pradhan S. (2016) Progressive systemic sclerosis with intraoral manifestations: A case report and review. Indian J. Dent., 7(2): 99–104.
- 20. Visconti L., Atteritano M., Buemi M., Santoro D. (2014) Renal and extra-renal involvement in sclerodermia. G. Ital. Nefrol., 31(5): 120–126.
- 21. Wang Y.J., Huang X.L., Yan J.W. et al. (2015) The association between vibration and vascular injury in rheumatic diseases: a review of the literature. Autoimmunity, 48(1): 61–68.
- 22. Yang Z., Ren Y., Liu D. et al. (2016) Prevalence of systemic autoimmune rheumatic diseases and clinical significance of ANA profile: data from a tertiary hospital in Shanghai, China. APMIS, 124(9): 805–811.
Адрес для переписки:
Синяченко Олег Владимирович
Украина, 84404, Донецкая обл.,
Лиман, ул. Привокзальная, 27
Донецкий национальный медицинский
университет
Е-mail: synyachenko@ukr.net

Leave a comment