ДОКЛІНІЧНИЙ РЕВМАТОЇДНИЙ АРТРИТ
Головач И.Ю.1, Вершиніна Д.В.2
- 1Клінічна лікарня «Феофанія» Державного управління справами, Київ
- 2Івано-Франківський національний медичний університет
Резюме. У статті наведено дані про доклінічний період перебігу ревматоїдного артриту (РА), що охоплює 6 фаз: фазу генетичного ризику, екологічного ризику, фазу розвитку аутоімунних порушень, фазу появи симптомів без клінічних ознак артриту, фазу недиференційованого артриту і фазу власне РА. Загальновідомо, що ранній початок лікування при РА асоціюється зі зменшенням структурних пошкоджень суглобів і збільшенням шансів досягнення безмедикаментозної ремісії. Наслідком цього з’явилася зміна парадигми раннього РА: клінічна маніфестація артриту не є початком хвороби, а швидше за все, кульмінацією добре відомих патологічних подій. В оглядовій статті проаналізовано зміни, які відбуваються в кожній фазі розвитку доклінічного РА, особливу увагу приділено такому фактору, як тютюнопаління, а також аутоімунним порушенням, раннім магнітно-резонансним і ультразвуковим симптомам. Представлено також нові класифікаційні критерії артралгії, клінічно підозрюваної як РА.
Общеизвестно, что ранний старт терапии у пациентов с ревматоидным артритом (РА) приводит к лучшим клиническим и функциональным результатам, кроме того, раннее лечение связано с меньшими затратами на терапию и более высокими шансами достижения ремиссии, в том числе и безмедикаментозной [29, 44]. Однако возникает справедливый вопрос: что считать ранней стадией болезни? Ранний РА — условно выделенная клинико-патогенетическая стадия заболевания с длительностью активного синовита до 1 года. В зарубежной литературе также выделяют очень ранний РА (very early RA) при длительности болезни менее 3 мес и поздний ранний РА (late early RA) — от 6 до 12 мес течения. Ранний РА характеризуется преобладанием в пораженных суставах экссудативных изменений, частым атипичным течением и хорошим ответом на лечение. Однако недавние исследования подвергли сомнению данную теорию и предположили наличие длительного доклинического периода в развитии болезни. Следствием этого стал сдвиг парадигмы раннего РА: клиническая манифестация артрита не является началом болезни, а, скорее, кульминацией хорошо известных патологических событий [29, 46]. Соответственно, концепция, согласно которой болезнь — РА — начинается с момента клинической манифестации артрита, является неверной. В настоящее время выделяют несколько доклинических фаз РА, которые характеризуются, в первую очередь, отсутствием симптомов артрита как главнейшего критерия болезни, а во-вторых, специфическими для данной фазы биомаркерами или инструментальными симптомами. Для достижения однородности в терминологии в 2011 г. исследовательская группа по оценке факторов риска РА Постоянного комитета исследований в ревматологии Европейской антиревматической лиги (EULAR) сформулировала рекомендации по терминологии, которые используются в отношении доклинических и ранних фаз РА [15]. Выделено 6 фаз: фаза А — генетические факторы риска развития РА; фаза В — экологические факторы риска развития РА; фаза С — системные аутоиммунные факторы, связанные с РА; фаза D — симптомы без явлений клинического артрита; фаза E — недифференцированный артрит; фаза F — РА (рисунок).
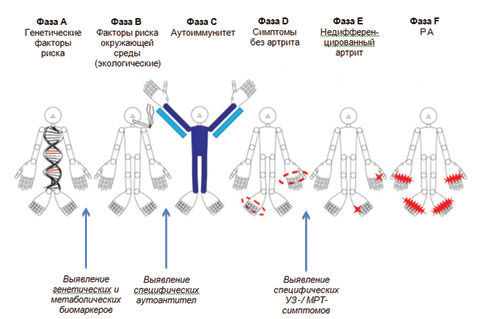
Хотя интерес к доклинической фазе РА значительно возрос в течение нескольких последних лет, однако еще более двух десятилетий назад исследователи указывали на особые процессы, связанные с РА и возникающие задолго до появления четкой клинической картины. Впервые ревматоидный фактор (РФ) в доклинической фазе РА был выявлен у финских и исландских пациентов с РА [6, 20]. Эти ученые тогда же впервые задали резонный вопрос: «Когда же дебютирует ревматоидный артрит?». Более высокие показатели распространенности антифиллагриновых и антиперинуклеарных антител были также выявлены у пациентов с артралгией, у которых впоследствии развился РА [5, 24]. Первое крупное исследование, результаты которого показали влияние наличия РФ на развитие РА, выполнено у населения высокого риска — у 2712 индейцев Пима (штат Аризона, США) [10]. Наличие РФ явилось фактором риска развития РА, и этот риск повышался параллельно с возрастанием титра РФ. Так, заболеваемость РА (в случаях на 1000 человеко-лет) в соответствии с титром РФ была: 2,4 (титр РФ <1: 2); 6,7 (титр 1:2–1:16); 11,0 (титр 1:32–1:256); 48,3 (титр >1:256) (р<0,001). Исследователи констатировали, что наличие РФ у субъектов без РА является фактором риска для развития этого заболевания, и что этот риск связан с титром РФ. Они также предположили, что РФ может представлять собой маркер ранних стадий патологического процесса при РА, которые могут быть выявлены еще до появления других признаков, позволяющих установить клинический диагноз. Именно эти исследования сформировали основу того, что теперь называют доклинический РА. Через 15 лет в известных исследованиях S. Rantapää-Dahlqvist и соавторов (2003) [35] и M.M. Nielen и соавторов (2004) [32] продемонстрировано, что задолго до развития РА у пациентов с артралгией возможно повышение титра IgA-РФ и антител к циклическому цитруллированному пептиду (анти-ССР); именно эти маркеры имеют наибольшую прогностическую ценность. Так, в образцах, полученных у пациентов до начала РА, распространенность аутоантител составила 33,7% для анти-ССР, 16,9% — для IgG-РФ, 19,3% — для класса IgM-РФ и 33,7% — для IgA-РФ (все маркеры значительно и достоверно повышены по сравнению с контрольной группой). Чувствительность выявления этих аутоантител в период >1,5 года и ≤1,5 года до появления каких-либо симптомов РА составила: 25 и 52% — для анти-ССР, 15 и 30% — для класса IgM-РФ, 12 и 27% — для IgG-РФ, 29 и 39% — для IgA-РФ.
По мнению многих авторов, первая доклиническая фаза РА начинается в момент зачатия, когда субъект наследует возможные аллели риска развития РА от своих родителей (фаза А) [48]. В настоящее время известно около 100 таких аллелей риска [33]. При оценке частоты этих аллелей риска в популяции вероятность того, что индивидуум не несет ни один из аллелей риска РА, составляет 7,1·10%. Другими словами — почти каждый человек несет один или несколько из этих аллелей риска. Эти генетические варианты имеют небольшие размеры эффектов, и у большей части населения, несущего аллели риска, никогда не развивается РA. Хотя многие гены лежат вне главного комплекса гистосовместимости, область HLA-DRB1, в частности эпитоп SE аллели HLA-SE, демонстрирует самые сильные ассоциации с РА. Один только HLA-SE является связанным с 3-кратным повышением риска возникновения РА [17]. Генетические факторы вносят весомый вклад в развитие РА; наследственность оценивается в 50–60% при серопозитивном РА, а риск развития РА повышается в 3 раза при первой степени родства.
Если роль наследственности в развитии РА оценена в 60% [45], то 40% риска развития болезни объясняется экологическими факторами риска (фаза В). Из нескольких факторов окружающей среды, исследованных в отношении РА, наибольшие доказательства причастности имеет курение. На сегодняшний день именно курение остается наиболее известным, значимым и весомым фактором риска развития РА [3]. Существует поразительная связь между курением, носительством HLA-SE и антителами к цитруллированному белку: у курильщиков с двумя аллелями HLA-SE отмечают 21-кратное повышение риска развития анти-ССР-позитивного РА [22]. На сегодняшний день принята гипотеза, что курение может выступать специфическим триггером РА-специфических иммунных реакций, связанных с цитруллированием белков, вызывая, возможно, цитруллирование поврежденных, «умирающих» клеток бронхоальвеолярного тракта. Риск развития РА в большей степени ассоциируется с длительностью курения, чем с интенсивностью, но одновременно пагубные воздействия курения относительно возможности развития артрита нивелируются только через 10–20 лет после прекращения курения [3].
Установлено также, что риск развития РА связан с такими факторами, как избыточная масса тела при рождении, ожирение, низкий социально-экономический статус. Среди экологических факторов выделяют избыточное ультрафиолетовое облучение и пыль кремнезема. В противоположность этому, такие факторы образа жизни, как более длительный период грудного вскармливания и умеренное употребление алкоголя, могут оказывать протекторное влияние [21, 29]. Генетические и экологические факторы риска концептуально представляют самые ранние доклинические фазы РА. Однако важно признать, что вышеуказанные факторы риска присутствуют у большого количества людей и могут никогда не привести к развитию РА. Прогрессирование болезни за пределами этих первых двух фаз (фазы А и В) является важным шагом, поскольку он представляет собой переход теоретического риска в первую патологическую фазу (фаза С), которая реально может привести к РА [29].
В настоящее время принято считать, что аутоиммунные процессы, связанные с РА, происходят задолго до клинической манифестации заболевания. То, что аутоантитела могут быть выявлены до момента появления клинической симптоматики, возможности инструментальной визуализации (УЗ-исследование или МРТ) или получения гистологических доказательств РА, указывает на их несуставное (!) происхождение. Перевод генетического и экологического рисков в патологические процессы сначала может происходить на поверхности слизистой оболочки, достаточно удаленной от синовиальных суставов, а только потом транспортироваться в синовиальные суставы, которые выступают основным плацдармом развития патологического процесса [7]. В этой связи под прицельным вниманием оказывается слизистая оболочка полости рта, бронхиального дерева/легких и кишечника.
Предполагаемая этиологическая связь между слизистой оболочкой полости рта и РА в значительной степени базируется вокруг двух ключевых положений. Во-первых, распространенность заболеваний пародонта существенно повышается при РА [4], кроме этого, описано сходство генетических (HLA-DR SE) и экологических (курение) факторов в развитии данных заболеваний [30, 38].
С другой стороны, обсуждается роль Porphyromonas gingivalis в патогенезе РА. Хорошо известно, что именно Porphyromonas gingivalis, который стал своеобразным синонимом пародонтальных заболеваний, имеет функциональный фермент PAD — пептидиларгинин деиминазу, участвующую в цитруллировании белков [3, 4, 50]. Многие белки содержат аргининовые остатки, которые поддаются посттрансляционной модификации в процессе цитруллирования под влиянием PAD. Суть цитруллирования сводится к потере позитивного заряда на аргинине, приводя к изменениям в третичной структуре белка [49]. Считается, что PAD Porphyromonas gingivalis может цитруллировать молекулярные мишени, которые обычно недоступны для эндогенных человеческих PAD [2]. Хорошо известно, что при контакте антигенов с иммунной системой слизистой полости рта провоспалительные эффекты подавляются, что получило название «оральной толерантности», формирующейся как результат воздействия высоких доз антигена, ведущих к супрессии иммунной системы через увеличение экспрессии TREG-клеток и их цитокинов [16]. Повреждение оральной толерантности способствует развитию иммунозависимых заболеваний, таких как РА, спондилоартрит, воспалительные заболевания кишечника. Таким образом, новые цитруллированные антигены, образовавшиеся под влиянием PAD Porphyromonas gingivalis в слизистой оболочке полости рта и в пародонтальных карманах, могут потенциально нарушать иммунную толерантность и инициировать развитие РА в ответ на образование цитруллированных антител. Так, в синовиальной жидкости больных РА и у некоторых пациентов со спондилоартритами выявлены DNA периодонтальных патогенов: Porphyromonas gingivalis, Prevotella intermedia, Tannerella forsythia, Treponema denticola, Prevotella nigrescens, Fusobacterium nucleatum [37]. Одновременно отмечено, что у пациентов без РА, но с заболеванием пародонта более высокие уровни анти-ССР и антитела к Porphyromonas gingivalis, по сравнению с теми, кто не имеет заболеваний пародонта [18, 26]. Выявлена также перекрестная реактивность антител к эколазе Porphyromonas gingivalis с человеческой эколазой, особенно с цитруллинированной α-эколазой — пептидом 1, что ведет к аутоиммунному ответу. Частота пародонтита повышается из-за курения, поэтому Porphyromonas gingivalis становится постоянным триггером у курящих по сравнению с некурящими.
Установленная связь между курением и развитием РА указывает на этиологическую роль бронхолегочной системы [3, 22]. У анти-ССР-позитивных пациентов существуют доказательства того, что курение связано с процессом цитруллирования в легких. Курение способствует локальному повышению цитруллирования белков в слизистой оболочке бронхов; данный процесс со временем приобретает системный характер, может генерировать продукцию новых антигенов, что предопределяет развитие анти-ССР-позитивного артрита. Активированные В-клетки бронхоальвеолярного тракта являются известными продуцентами IgA (так называемая система BALT — bronchus-associated lymphoid tissue — бронхоассоциированная лимфоидная ткань). Клетки бронхоассоциированной лимфоидной ткани значительно чаще определяют у курящих пациентов по сравнению с некурящими [36]. Этот факт, а также исследования, указывающие на более высокий процент цитруллирования белков в клетках курильщиков, полученных путем бронхоальвеолярного лаважа [22], подтверждают рабочую гипотезу, что IgA-анти-ССР будут чаще и в более высоких концентрациях присутствовать у курящих пациентов с РА, чем у некурящих. Различия в изотипах анти-ССР у курящих и некурящих пациентов, возможно, определяют характер течения патологических реакций, более быстрое прогрессирование РА и более быстрый переход недифференцированного артрита в РА. Кроме того, сообщалось о структурных и иммунологических нарушениях в легких, выявленных методом высокочувствительной мультиспиральной компьютерной томографии (МСКТ), у индивидуумов группы риска развития РА [11, 51]. Отметим, что пациенты без артрита, но позитивные по анти-ССР, имели аналогичные изменения в легких с теми пациентами, которые впоследствии прогрессировали до РА [12]. Таким образом, подобно пародонтальным заболеваниям, наличие аномалий слизистой оболочки бронхолегочного дерева повышает вероятность развития аутоиммунных заболеваний, а хроническая патология легких является своеобразным триггером данного процесса. Открытие и выявление аутоантител, свойственных РА, в мокроте пациентов без клинических признаков артрита указывает на роль легких как потенциального места, инициирующего аутоиммуногенность при РА [51].
В отношении кишечника, еще одного барьерного органа, активно продвигается теория патологической бактериальной колонизации. Микробиом человека представляет собой значительный антигенный резервуар, непосредственно контактирующий с иммунной системой человека на всех эпителиальных структурах, и играет важную роль в поддержании гомеостаза (здоровья) человека. Имеются предпосылки, что взаимосвязь между слизистой оболочкой кишечника и комменсальной микробиотой может иметь значение в патогенезе РА. Поверхность кишечника — это эффективный барьер, который предотвращает вход болезнетворных микроорганизмов и антигенов. Как известно, слизистая оболочка кишечника обладает собственной лимфоидной тканью, известной как GALT (gut-associated lymphoid tissue), которая является одним из значимых компонентов всей иммунной системы человека. В слизистой оболочке кишечника локализовано около 80% иммунокомпетентных клеток, 25% площади слизистой оболочки кишечника состоит из иммунологически активной ткани, обладающей уникальной способностью регулировать иммуноопосредованный ответ на бактериальные антигены с помощью лимфоидных фолликулов тонкой кишки, содержащих антигенпрезентирующие клетки [25]. Физиологическое состояние кишечника характеризуется сбалансированным взаимодействием эффекторных (Th1, Th2, Th17) и регуляторных (Tрег) клеток, определяющих наличие иммунной толерантности к антигенам резидентной микрофлоры кишечника. Существуют доказательства, что кишечные бактерии влияют на баланс Т-клеток, помогая сохранить нормальный иммунный гомеостаз [27]. Возможно, что дисбактериоз может играть дополнительную патогенную роль, способствующую нарушению местного иммунного гомеостаза, изменять локальный баланс Т-клеток, приводя таким образом к системным аутоиммунным реакциям. Поврежденная микробиота, гиперколонизация в микробиоме могут способствовать повышению кишечной проницаемости и потере «кишечной толерантности», транслокации бактериальных антигенов, появлению микробных фрагментов в системном кровотоке, а также повышению локальной продукции интерлейкина (ИЛ)-23. Некоторые исследования продемонстрировали, что при РА наблюдается дисбиоз кишечника с превалированием специфических бактерий, прежде всего Lactobacillus [28] и Prevotella copri [37]. Еще предстоит установить, является ли дисбиоз следствием системной воспалительной реакции кишечника на ранней стадии РА или же дисбиоз является основным толчком в развитии аутоиммунных реакций. С другой стороны, способность различных слизистых оболочек барьерных органов участвовать в цитруллировании белков может также иметь огромное значение в развитии анти-ССР-позитивного РА.
Системные аутоиммунные реакции, которые запускаются на поверхности слизистой оболочки полости рта, бронхолегочной системы и кишечника, формируют доклиническую фазу РА, когда у совершенно здоровых индивидуумов определяют высокие и клинически значимые титры РФ и анти-ССР. И многочисленные ретроспективные исследования указывают на этот факт [5, 6, 10, 20, 35]. Эти исследования также продемонстрировали нарастание титра, особенно анти-ССР, перед клинической манифестацией артрита. На сегодня установлено, что повышение концентрации анти-ССР с высокой специфичностью связано с увеличением сывороточных уровней цитокинов и хемокинов, играющих важнейшую роль в патогенезе РА [40]. Проспективные исследования подтвердили эти данные как у серопозитивных пациентов с артралгией [43], так и у пациентов без артрита, но имеющих родственников первой линии с РА [19]. Кроме того, высокие титры анти-ССР, наличие антител к нескольким цитруллированным белкам, двойная серопозитивность (РФ и анти-ССР) являются бесспорными предикторами развития РА [29].
Полученные результаты активировали следующий важный вопрос: является ли скрининг аутоантител клинически полезным для ранней верификации РА? Частично ответ на данный вопрос получен в голландском исследовании М.М. Nielen и соавторов (2004) [32]. Несмотря на то что 40% пациентов с РА оказались позитивными по анти-ССР в образцах крови, отобранных до установления диагноза, серопозитивность по анти-ССР в прогностической модели прогнозировала развитие РА только у 5% населения в целом. Таким образом, выявление только аутоантител у здоровых лиц не имеет достаточной прогностической силы в отношении верификации лиц с высокой степенью риска развития РА. Тем не менее, у пациентов с генетическим и экологическим риском дополнительное наличие аутоантител, присущих РА, может значительно увеличить их прогностическую силу и достигнуть клинически полезной стратификации риска.
На основании изучения частоты развития РА у индивидуумов с наличием аутоантител в доклинической фазе (чувствительность) и без аутоантител (специфичность) был оценен риск развития РА у населения в целом. Риск развития РА в течение 5 лет [32] и в любое время жизни [35] оценивали на уровне 1,5 и 4% соответственно у субъектов, которые были серопозитивными по IgM-РФ, и 5,3 и 16% соответственно — при наличии позитивности по анти-ССР.
Учитывая чрезвычайную важность ранней диагностики РА, усилия ученых были сосредоточены на выявлении новых, более чувствительных биомаркеров артрита. Так, недавно описаны аутоантитела против карбамилированных белков (анти-CarP) у пациентов с РА [13, 39]. Карбамилированные белки содержат гомоцитруллин, отличающийся от цитруллина наличием дополнительной метиленовой группы, присутствуют в организме в небольших количествах, однако их образование резко увеличивается при воспалении. Недавно продемонстрировано, что гомоцитруллинсодержащие белки присутствуют в суставах больных РА и могут вызвать образование антител. J. Shi и соавторы (2011) [39] проанализировали частоту выявления данных аутоантител у больных РА, а также оценили их взаимосвязь с анти-ССР. Авторы установили, что IgG-анти-CarP-антитела выявляют у 45% больных РА, а IgA-анти-CarP — у 43%. Выявлена низкая корреляция между анти-CarP-антителами и анти-ССР (r=0,27; р<0,001 для анти-CarP IgG или r=0,15; р<0,001 для IgA); у 16% анти-ССР-негативных больных выявлены анти-CarP IgG и у 30% — анти-CarP IgA. Также наличие анти-CarP-антител ассоциировалось с более выраженным рентгенологическим прогрессированием деструктивных изменений в суставах. Таким образом, анти-CarP-антитела являются новым семейством аутоантител, влияющих на клинические проявления РА. Анти-CarP-антитела могут быть новым маркером серонегативного варианта РА (по РФ и анти-ССР), а также быть полезными для прогнозирования развития РА у больных с недифференцированным артритом и на этапе доклинического РА.
Большинство ревматологов признают, что у некоторых больных в доклинической фазе возникают симптомы, при выявлении и анализе которых можно заподозрить будущий артрит. Пациенты описывают широкий спектр симптомов до момента развития артрита: боль, скованность, усталость, мышечная слабость; также ощущение жжения в суставах кистей, тепло и покраснение кожи [41]. Эти клинические симптомы, как правило, предшествуют опуханию суставов.
Поэтому чрезвычайно важными с клинических позиций явились сформулированные EULAR классификационные критерии артралгий, клинически подозреваемых как РА, и представленные на Конгрессе EULAR 2016 в Лондоне. Именно фазе D — артралгиям и симптомам без артрита — посвящены данные критерии. Фаза D не определена с точки зрения специфических симптомов и затрудняет соответствующее разграничение пациентов. Поэтому клинический опыт является наиболее ценным инструментом для очерчивания пациентов с артралгией, подверженных риску развития РА [47]. Целевая группа EULAR по созданию классификационных критериев артралгий, клинически подозреваемых как РА, включала 18 ревматологов, 2 пациентов, 3 медицинских специалистов из разных стран Европы.
Первоначально отобрано 55 симптомов, которые после статистического анализа были оформлены в 16 наиболее важных дифференциально-диагностических симптома. Наличие именно этих симптомов может указать, что артралгия является клинически значимой в аспекте развития РА:
- симптомы недавнего начала (продолжительность артралгии <1 года);
- локализация симптомов в пястно-фаланговых суставах;
- локализация симптомов в плюснефаланговых суставах;
- локализация симптомов в нескольких группах мелких суставов;
- симметричность симптомов;
- 4–10 суставов с симптомами;
- утренняя скованность ≥60 мин;
- наибольшая выраженность симптомов утром;
- улучшение симптомов в течение дня;
- увеличение количества болезненных суставов с течением времени;
- пациент отмечает опыт набухших мелких суставов кистей рук;
- трудности при сжатии кисти в кулак;
- локальная болезненность при обследовании вовлеченных в процесс суставов;
- наличие родственников первой степени родства с РА;
- положительный тест сжатия пястно-фаланговых суставов;
- положительный тест сжатия плюснефаланговых суставов.
Позже были отобраны 7 основных параметров, на которых может базироваться клиническая диагностика и дифференциальный диагноз в случае возникновения артралгии без явлений артрита (таблица). Данные симптомы со значительно большей частотой отмечают у пациентов с артралгией, клинически подозреваемой как РА.
Базируясь на этих симптомах и идентифицируя их у пациентов с артралгией, можно на доклинической стадии РА заподозрить данное заболевание. Чувствительность выделенных параметров (>90%): ≥3 параметров. Специфичность выделенных параметров (>90%): ≥4 параметров.
и клинически не подозреваемой как РА артралгией
| Симптом | Пациенты без клинически подозреваемой артралгии как РА | Пациенты с клинически подозреваемой артралгией как РА | OR |
|---|---|---|---|
| Недавнее начало суставного синдрома (длительность артралгии <1 года) | 45 | 82 | 8,8 |
| Локализация симптомом в пястно-фаланговых суставах |
55 | 87 | 1,5 |
| Утренняя скованность ≥ 60 мин | 10 | 51 | 7,3 |
| Наибольшая выраженность симптомов утром | 22 | 74 | 8,7 |
| Трудности при сжатии кисти в кулак | 10 | 34 | 1,9 |
| Наличие родственников первой степени родства с РА | 6 | 21 | 6,7 |
| Положительный тест сжатия пястно-фаланговых суставов |
15 | 61 | 14,5 |
Таким образом, идентификация генетического риска, выявление экологического риска, оценка аутоиммунитета и клиническая оценка артралгии и других симптомов может с высокой долей вероятности заподозрить развитие РА на ранней стадии, а иногда прогнозировать его развитие, выделив специфические симптомы на доклинической стадии.
Несмотря на то что у некоторых лиц первыми клиническими проявлениями может быть артралгия, что в принципе исключает наличие воспалительных изменений в тканях, некоторые методы визуализации могут быть достаточно чувствительными, чтобы идентифицировать эволюционирующие воспалительные изменения в доклинической/субклинической фазе РА.
Возможности и значение УЗ-диагностики в качестве биомаркера в субклинической фазе РА оценены в нескольких исследованиях [34, 42]. L.A. van de Stadt и соавторы (2010) [42] установили, что выпот в сустав и синовит, выявляемый в режиме серой шкалы и в допплер-режиме, были предикторами развития артрита. Именно сочетание визуализации синовита по серой шкале и в допплер-режиме было наиболее сильным предиктором артрита (OШ=12,9). Среди других ранних УЗ-симптомов доклинического воспаления можно выделить утолщение и снижение эхоплотности синовиальной оболочки, избыточное количество гипо- или анэхогенной жидкости, особенно в проксимальных межфаланговых, пястно-фаланговых и лучезапястных суставах, определение гипо- и анэхогенной жидкости вокруг сухожилий длинных разгибателей и сгибателей пальцев в пределах синовиальных влагалищ при продольном сканировании, увеличение объема и степени эхогенности самих сухожилий [31].
МРТ суставов также относится к важным биомаркерам неинвазивной оценки активности воспалительного процесса в суставах [1]. В одном из проспективных исследований не получено доказательств синовиального воспаления коленных суставов у серопозитивных пациентов с артралгией [8]. Однако визуализация суставов кистей может предоставить очень важную дополнительную информацию. Так, у анти-ССР-позитивных пациентов с артралгией выявляют высокие показатели счета отека костного мозга костей запястья и синовита (OMERACT-RAMRIS) по сравнению со здоровыми пациентами [23]. Полученные данные свидетельствуют, что местное субклиническое воспаление возникает у анти-ССР-позитивных пациентов с артралгией. Авторы подчеркивают, что воспалительные изменения более выражены в области запястья, чем в других отделах, поэтому именно этот отдел является наиболее предпочтительным для исследования при подозрении на доклинический/ранний РА. Аналогичные данные зафиксированы и в исследовании Y.Y. Gent и соавторов (2014) [14], в котором также выявлены МР-доказательства изменений мелких суставов кисти у 93% анти-ССР-позитивных пациентов с артралгией. Наиболее частым МР-симптомом был синовит, частота выявления которого повышалась с возрастом. При этом отек костного мозга выявлен только у 11% обследованных.
С помощью МРТ воспаление определено также у серонегативных пациентов с артралгией [48]. В наиболее крупном исследовании пациентов с артралгией с помощью МРТ выявлены симптомы воспаления (синовит) у 44% пациентов с артралгией, клинически подозрительной на РА. При этом у 53% пациентов воспалительные изменения отмечены именно в запястье. Баллы синовита были значительно выше у анти-ССР-негативных пациентов с артралгией по сравнению с контрольной группой здоровых лиц (р=0,046). Счет синовита был ассоциирован с уровнем С-реактивного белка (р=0,007) и болезненностью суставов (р=0,026). Несмотря на ограниченность исследования по продолжительности, у 5 пациентов установлен диагноз достоверного РА; именно у этих 5 пациентов наблюдался наиболее высокий счет синовита, отека костного мозга и общего счета воспаления при МРТ. Выявление субклинического синовита суставов кистей у серонегативных пациентов с артралгией позволяет предположить существование доклинической фазы у анти-ССР-негативных пациентов.
Выявление генетических и экологических факторов, ассоциированных с РА, повышение концентрации аутоантител и маркеров воспаления до начала симптомного заболевания, выявление значимых УЗ- и МР-симптомов привело к созданию общей модели развития аутоиммунного заболевания [9]. В этой модели развитие РА следует естественной эволюции, разделенной на фазы, где генетические и экологические взаимодействия изначально приводят к периоду бессимптомного аутоиммунитета, что подтверждается наличием РА-специфических аутоантител, что впоследствии перерастает в клинически очевидную болезнь. Начальные фазы риска (генетические и внешнесредовые) и бессимптомные нарушения иммунитета формируют фазы доклинического РА. Таким образом, проведенные исследования и накопленный клинический опыт подтверждают наличие длительной доклинической фазы РА, во время которой формируются группы пациентов с различным профилем рисков, что в дальнейшем может оказывать влияние на степень прогрессирования болезни. Исследование доклинических фаз развития РА обеспечит понимание факторов, которые приводят к развитию РА, а также будет способствовать разработке моделей прогнозирования для лечения больных и в конечном итоге — стратегии профилактики РА.
Список использованной литературы
- 1. Вершиніна Д.В. (2015) Ранній ревматоїдний артрит без рентгенологічних ерозій: можливості МРТ-діагностики. Боль. Суставы. Позвоночник, 2(18): 44–49.
- 2. Головач І.Ю. (2016) Діагностичне і прогностичне значення антицитрулінованих антитіл у ревматології. Укр. ревматол. журн., 1(63): 25–32.
- 3. Коваленко В.Н., Головач И.Ю., Борткевич О.П. (2012) Курение и развитие ревматоидного артрита: сложение патогенетического пазла. Укр. ревматол. журнал. 2(48): 5–13.
- 4. Сміян С.І., Мазур І.П., Білозецький І.І. (2014) Генералізований пародонтит і ревматоїдний артрит: імунологічні аспекти взаємообтяження. Патологія, 3(32): 16–21.
- 5. Aho K., von Essen R., Kurki P. et al. (1993) Antikeratin antibody and antiperinuclear factor as markers for subclinical rheumatoid disease process. J. Rheumatol., 20:1278–1281.
- 6. Aho K., Palosuo T., Raunio V. et al. (1985) When does rheumatoid disease start? Arthritis Rheum., 28: 485–489.
- 7. Bos W.H., van de Stadt L.A., Sohrabian A. et al. (2014) Development of anti-citrullinated protein antibody and rheumatoid factor isotypes prior to the onset of rheumatoid arthritis. Arthritis Res. Ther., 16: 405.
- 8. De Hair M.J., van de Sande M.G., Ramwadhdoebe T.H. et al. (2014) Features of the synovium of individuals at risk of developing rheumatoid arthritis: implications for understanding preclinical rheumatoid arthritis. Arthritis Rheum., 66: 513–522.
- 9. Deane K.D., Norris J.M., Holers V.М. (2010) Pre-Clinical Rheumatoid Arthritis: Identification, Evaluation and Future Directions for Investigation. Rheum. Dis. Clin. North. Am., 36(2): 213–241.
- 10. Del Puente A., Knowler W.C., Pettitt D.J., Bennett P.H. (1988) The incidence of rheumatoid arthritis is predicted by rheumatoid factor titer in a longitudinal population study. Arthritis Rheum., 31: 1239–1244.
- 11. Demoruelle M.K., Weisman M.H., Simonian P.L. et al. (2012) Airways abnormalities and rheumatoid arthritis–related autoantibodies in subjects without arthritis: early injury or initiating site of autoimmunity? Arthritis Rheum., 64:1756–1761.
- 12. Fischer A., Solomon J.J., du Bois R.M. et al. (2012) Lung disease with anti-CCP antibodies but not rheumatoid arthritis or connective tissue disease. Respir. Med.,106: 1040–1047.
- 13. Gan R.W, Trouw L.A., Shi J. et al. (2015) Anti-carbamylated protein antibodies are present prior to rheumatoid arthritis and are associated with its future diagnosis. J. Rheumatol., 42: 572–579.
- 14. Gent Y.Y., ter Wee M.M., Ahmadi N. et al. (2014) Three-year clinical outcome following baseline magnetic resonance imaging in anti–citrullinated protein antibody–positive arthralgia patients: an exploratory study. Arthritis Rheum., 66: 2909–2910.
- 15. Gerlag D.M., Raza K., van Baarsen L.G. et al. (2012) EULAR recommendations for terminology and research in individuals at risk of rheumatoid arthritis: report from the Study Group for Risk Factors for Rheumatoid Arthritis. Ann. Rheum. Dis., 71: 638–641.
- 16. Gilbert R.S., Kobayashi R., Sekine S., Fujihashi K. (2011) Functional transforming growth factor-beta receptor type II expression by CD4 T cells in Peyer’s patches is essential for oral tolerance induction. PLoS One., 6(11): e27501.
- 17. Gregersen P.K., Silver J., Winchester R.J. (1987) The shared epitope hypothesis: an approach to understanding the molecular genetics of susceptibility to rheumatoid arthritis. Arthritis Rheum., 30: 1205–1213.
- 18. Hendler A., Mulli T.K., Hughes F.J. et al. (2010) Involvement of autoimmunity in the pathogenesis of aggressive periodontitis. J. Dent. Res., 89: 1389–1394.
- 19. Hughes-Austin J.M., Deane K.D., Derber L.A. et al. (2013) Multiple cytokines and chemokines are associated with rheumatoid arthritis-related autoimmunity in first-degree relatives without rheumatoid arthritis: Studies of the Aetiology of Rheumatoid Arthritis (SERA). Ann. Rheum. Dis., 72: 901–907.
- 20. Jonsson T., Thorsteinsson J., Kolbeinsson A. et al. (1992) Population study of the importance of rheumatoid factor isotypes in adults. Ann. Rheum. Dis., 51: 863–868.
- 21. Karlson E.W., Deane K. (2012) Environmental and gene-environment interactions and risk of rheumatoid arthritis. Rheum. Dis. Clin. North Am., 38: 405–426.
- 22. Klareskog L., Stolt P., Lundberg K. et al., and the Epidemiological Investigation of Rheumatoid Arthritis Study Group (2006) A new model for an etiology of rheumatoid arthritis: smoking may trigger HLA-DR (shared epitope) — restricted immune reactions to autoantigens modified by citrullination. Arthritis Rheum., 54: 38–46.
- 23. Krabben A., Stomp W., van der Heijde D.M. et al. (2013) MRI of hand and foot joints of patients with anticitrullinated peptide antibody positive arthralgia without clinical arthritis. Ann. Rheum. Dis., 72(9): 1540–1544.
- 24. Kurki P., Aho K., Palosuo T., Heliovaara M. (1992) Immunopathology of rheumatoid arthritis: antikeratin antibodies precede the clinical disease. Arthritis Rheum., 35: 914–917.
- 25. Lakatos P.L. (2006) Pathogenesis of IBD. World J. Gastroenterol., 12(12): 235–240.
- 26. Lappin D.F., Apatzidou D., Quirke A.M. et al. (2013) Influence of periodontal disease, Porphyromonas gingivalis and cigarette smoking on systemic anti-citrullinated peptide antibody titres. J. Clin. Periodontol., 40: 907–915.
- 27. Lee Y.K., Menezes J.S., Umesaki Y., Mazmanian S.K. (2011) Proinflammatory T-cell responses to gut microbiota promote experimental autoimmune encephalomyelitis. Proc. Natl. Acad. Sci USA; 108(Suppl. 1): 4615–4622.
- 28. Liu X., Zou Q., Zeng B. et al. (2013) Analysis of fecal Lactobacillus community structure in patients with early rheumatoid arthritis. Curr. Microbiol., 67: 170–176.
- 29. Mankia K., Emery P. (2016) Preclinical Rheumatoid Arthritis Progress Toward Prevention. Arthritis Rheum., 68(4): 779–788. DOI 10.1002/art.39603.
- 30. Marotte H., Farge P., Gaudin P. et al. (2006) The association between periodontal disease and joint destruction in rheumatoid arthritis extends the link between the HLA-DR shared epitope and severity of bone destruction. Ann. Rheum. Dis., 65: 905–909.
- 31. Nam J.L., Hensor E.M., Hunt L. et al. (2016) ltrasound findings predict progression to inflammatory arthritis in anti-CCP antibody-positive patientswithout clinical synovitis. Ann. Rheum. Dis., 75(3): 519–523.
- 32. Nielen M.M., van Schaardenburg D., Reesink H.W. et al. (2004) Specific autoantibodies precede the symptoms of rheumatoid arthritis: a study of serial measurements in blood donors. Arthritis Rheum., 50: 380–386.
- 33. Okada Y., Wu D., Trynka G. et al. (2014) Genetics of rheumatoid arthritis contributes to biology and drug discovery. Nature, 506: 376–381.
- 34. Rakieh C., Nam J.L., Hunt L. et al. (2015) Predicting the development of clinical arthritis in anti-CCP positive individuals with non-specific musculoskeletal symptoms: a prospective observational cohort study. Ann. Rheum. Dis., 74: 1659–1666.
- 35. Rantapää-Dahlqvist S., de Jong B.A., Berglin E. et al. (2003) Antibodies against cyclic citrullinated peptide and IgA rheumatoid factor predict the development of rheumatoid arthritis. Arthritis Rheum., 48: 2741–2749.
- 36. Richmond I., Pritchard G.E., Ashcroft T. et al. (1993) Bronchus associated lymphoid tissue (BALT) in human lung: its distribution in smokers and non-smokers. Thorax, 48: 1130–1134.
- 37. Scher J.U., Sczesnak A., Longman R.S. et al. (2013) Expansion of intestinal Prevotella copri correlates with enhanced susceptibility to arthritis. Elife, 2: e01202.
- 38. Scher J.U., Ubeda C., Equinda M. et al. (2012) Periodontal disease and the oral microbiota in new-onset rheumatoid arthritis. Arthritis Rheum., 64: 3083–3094.
- 39. Shi J., Knevel R., Suwannalai P. et al. (2011) Autoantibodies recognizing carbamylated proteins are present in sera of patients with rheumatoid arthritis and predict joint damage. Proc. Natl. Acad. Sci USA, 108: 17372–17377.
- 40. Sokolove J., Bromberg R., Deane K.D. et al. (2012) Autoantibody epitope spreading in the preclinical phase predicts progression to rheumatoid arthritis. PloS One, 7: e35296.
- 41. Stack R.J., van Tuyl L.H., Sloots M. et al. (2014) Symptom complexes in patients with seropositive arthralgia and in patients newly diagnosed with rheumatoid arthritis: a qualitative exploration of symptom development. Rheumatology (Oxford), 53: 1646–1653.
- 42. van de Stadt L.A., Bos W.H., Meursinge Reynders M. et al. (2010) The value of ultrasonography in predicting arthritis in auto-antibody positive arthralgia patients: a prospective cohort study. Arthritis Res. Ther., 12: R98.
- 43. van de Stadt L.A., van der Horst A.R., de Koning M.H. et al. (2011) The extent of the anticitrullinated protein antibody repertoire is associated with arthritis development in patients with seropositive arthralgia. Ann. Rheum. Dis., 70: 128–133.
- 44. van der Linden M.P., le Cessie S., Raza K. et al. (2010) Long-term impact of delay in assessment of patients with early arthritis. Arthritis Rheum., 62: 3537–3546.
- 45. van der Woude D., Houwing-Duistermaat J.J., Toes R.E. et al. (2009) Quantitative heritability of anti-citrullinated protein antibody-positive and anti-citrullinated protein antibody-negative rheumatoid arthritis. Arthritis Rheum., 60: 916–923.
- 46. van Steenbergen H.W., Huizinga T.W.J., van der Helm-van Mil A.H.M. (2013) The Preclinical Phase of Rheumatoid Arthritis What Is Acknowledged and What Needs to Be Assessed? Arthritis Rheum., 65(9): 2219–2232.
- 47. van Steenbergen H.W., van Nies J.A., Huizinga T.W. et al. (2015) Characterising arthralgia in the preclinical phase of rheumatoid arthritis using MRI. Ann. Rheum. Dis., 74: 1225–1232.
- 48. van Steenbergen H.W., van Nies J.A., Huizinga T.W. et al. (2014) Subclinical inflammation on MRI of hand and foot of anticitrullinated peptide antibody-negative arthralgia patients at risk for rheumatoid arthritis. Arthritis Res. Ther., 16: R92.
- 49. van Venrooij W.J., Pruijn G.J. (2000) Citrullination: a small change for a protein with great consequences for rheumatoid arthritis. Arthritis Res., 2(4): 249–251.
- 50. Wegner N., Wait R., Sroka A. et al. (2010) Peptidylarginine deiminase from Porphyromonas gingivalis citrullinates human fibrinogen and a-enolase: implications for autoimmunity in rheumatoid arthritis. Arthritis Rheum., 62: 2662–2672.
- 51. Willis V.C., Demoruelle M.K., Derber L.A. et al. (2013) putum autoantibodies in patients with established rheumatoid arthritis and subjects at risk of future clinically apparent disease. Arthritis Rheum., 65: 2545–2554.
Адрес для переписки:
Головач Ирина Юрьевна
03680, Киев, ул. Академика Заболотного, 21
Клиническая больница «Феофания»
E-mail: golovachirina@yandex.ru

Leave a comment