Лікування болю та запалення: нові аспекти клінічної практики
Резюме. 2–6 лютого 2011 р. у місті Яремче відбулася ІV Міжнародна школа-семінар «Захворювання кістково-м’язовоїсистеми та вік», організована Національною академією медичних наук України, Міністерством охорониздоров’я України, Українською асоціацією остеопорозу, Українською асоціацією менопаузи, андропаузи та захворювань кістково-м’язової системи, Івано-Франківським національним медичним університетом та ДУ «Інститут геронтології НАМН України». Дві доповіді, які викликали інтерес учасників, президентаУкраїнської асоціації остеопорозу, Української асоціації менопаузи, андропаузи та захворювань кістковом’язової системи, заслуженого діяча науки і техніки України, доктора медичних наук, професора ВладиславаВолодимировича Поворознюка, прозвучали під час круглого столу «Біль у клінічній практиці».

У першій доповіді «НПЗП у лікуванні больового синдрому» професор В. Повороз-нюк звернув увагу аудиторії на те, що минулого року закінчилося десятиріччя (2000-2010), яке рішенням Організації Об’єднаних Націй та Всесвітньої організації охорони здоров’я було присвячене боротьбі із захворюваннями кісток і суглобів (Bone and Joint Decade). На українському ринку за останній час з’явилося багато нових препаратів для лікування цієї патології, зокрема — АЕРТАЛ (ацеклофенак). У Європі та в Російській Федерації* цей лікарський засіб відомий вже досить давно. Він відрізняється від багатьох інших нестероїдних протизапальних препаратів (НПЗП) особливостями впливу на хрящову тканину (Yamazaki R. et al., 1997). А серед препаратів цієї групи, як відомо, є хондронегативні, хондро-нейтральні та хондропозитивні (таблиця). Причому стимулюючий вплив НПЗП на суглобовий хрящ обумовлений, насамперед, впливом на синтез колагену та процеси проліферації хондроцитів.
Таблиця
Вплив НПЗП на біосинтез глікозаміногліканів (за: Dingle J.T., 1999; Blot L. et al., 2000)
| Біосинтез глікозаміногліканів | Лікарський засіб |
| Пригнічують (хондронегативні) | Ацетилсаліцилова кислота |
| Індометацин | |
| Фенопрофен | |
| Фенілбутазон | |
| Не впливають (хондронейтральні) | Німесулід |
| Піроксикам | |
| Диклофенак | |
| Мелоксикам | |
| Стимулюють (хондропозитивні) | Беноксапрофен |
| Тіапрофенова кислота | |
| Парацетамол | |
| Ацеклофенак | |
| Ніфлумова кислота |
*Препарат походить із Іспанії, де наприкінці 1990-х років серед НПЗП він був одним із найчастіше призначуваних; Burrull M. et al., 1996.
Серед симптомів ревматичних захворювань біль має чи не найбільший негативний вплив на якість життя пацієнта, зазначив професор В. По-ворознюк та нагадав висловлювання, що, як вважають, належить Юлію Цезарю: «Легше знаходяться люди, які готові йти на смерть, ніж ті, що терпляче переносять біль». Дійсно, пацієнтів, які звертаються до лікарів з приводу болю, стає все більше, причому ця скарга зазвичай виступає на першому місці, переважаючи за суб’єктивною значущістю обмеження функціональних можливостей.
Остеоартроз (OA) (за кордоном частіше використовують термін «остеоартрит» (osteoarthri-tis), бо вважають, що у будь-який період хвороби існує реактивний синовіт) є найбільш розповсюдженою патологією суглобів у людей похилого віку (Valdes A.M., Spector T.D., 2010). Розповсюдже-ність OA суттєво підвищується з віком, особливо серед жінок у період постменопаузи (Kerkhof H.J. et al., 2010). В Україні таких хворих також стає все більше, з огляду на те, що кількість осіб віком старше 50 років у загальній популяції у 2010 р. становила 33%, старше 60 років – 19% та старше 80 років — 2,8% (Держкомстат України, 2008-2011).
Як відомо, у патогенезі OA виділяють 2 основні стадії:
- біосинтетичну, під час якої переважають процеси відновлення хрящового матриксу;
- деградації, пов’язану з руйнуванням хряща під дією ферментів металопротеїназ, що продукують хондроцити.
Найтиповішою локалізацією OA є колінні, кульшові та міжфалангові суглоби, а виникнення больового синдрому при цій патології пов’язане із:
- дегенеративними процесами, що відбуваються у хрящі;
- крайовими кістковими розростаннями;
- капсулярним фіброзом;
- м’язовою атрофією;
- синовіальною гіперплазією та синовітом.
Тобто потенційними джерелами больового синдрому при OA є хрящ, синовіальна мембрана, субхондральна кістка та периартикулярні тканини. За характером виникнення розрізняють такі різновиди больового синдрому:
- механічний (під впливом денного фізичного навантаження);
- стартовий (на початку руху, що свідчить про наявніть реактивного синовіту);
- синдром гусячої лапки (біль у підколінній ділянці, що розвивається при тендобурситі);
- нічний (пов’язаний із погіршенням венозного відтоку);
- рефлекторний та віддзеркалений;
- пов’язаний із подразненням синовіальної оболонки остеофітами;
- блокадний (зумовлений защемленням секвестра хряща між суглобовими поверхнями).
Серед сучасних рекомендацій щодо лікування OA на особливу увагу заслуговують рекомендації, розроблені Європейською антиревматичною лігою (European League Against Rheumatism – EULAR). Так, у 2003 р. побачила світ настанова щодо діагностики, профілактики та лікування OA колінних суглобів (Jordan K.M. et aI., 2003), у 2005 р. – кульшових (Zhang W.
et aI., 2005), у 2007 р. – суглобів кистей рук (Zhang W. et aI., 2007).
Згідно з цими настановами препаратом першого вибору при терапії OA є парацетамол, а HПЗП слід використовувати у випадках недостатньої ефективності останнього. При підвищеному ризику розвитку чи загостренні патології шлунково-кишкового тракту HПЗП призначають разом із гастропротек-торами або вибирають циклооксигенази ^OT)-2-селективні HПЗП.
HПЗП при OA призначають дуже часто, у багатьох випадках їм віддають перевагу перед парацетамолом (Courtney P., Doherty M., 2002). Aле слід враховувати особливість HПЗП щодо безпечного впливу на організм. Так, експерти EULAR оцінили їх токсичність майже на одному рівні з опіоїдними
анальгетиками, психотропними засобами, остеотомією та повним протезуванням суглоба (рис. 1). При виборі НПЗП слід обов’язково враховувати:
- вплив на суглобовий хрящ;
- профіль безпеки відносно шлунково-кишкового тракту;
- >вікові особливості хворих;
- необхідність тривалого прийому препаратів;
- можливості підвищення їх ефективності й толерантності.
Традиційні НПЗП розрізняються за вираженістю притаманного їм протизапального, знеболювального та жарознижувального ефекту. Так, хорошу протизапальну дію виявляє індометацин, який, проте, має багато побічних ефектів та пригнічує синтез глікозаміногліканів хряща. В останні роки препаратом вибору серед НПЗП вважається диклофенак натрію, який має високі рейтинги за знеболювальним та протизапальним ефектами та є хондроней-тральним. Ні в чому не поступається перед дикло-фенаком за ефективністю НПЗП, який нещодавно з’явився на українському ринку — ацеклофенак (АЕРТАЛ виробництва угорської компанії «Ріхтер Гедеон Рт.»). Він вирізняється позитивним впливом на метаболізм суглобового хряща — здатністю стимулювати синтез глікозаміногліканів. Доведена ефективність ацеклофенаку при ОА, яка подібна до такої у диклофенаку натрію, піроксикаму та напроксену. При цьому профіль переносимості цього НПЗП більш сприятливий (І_едгапС Е., 2004).
Інша патологія, де ацеклофенак має доведену ефективність — біль у нижній ділянці спини (БНС).
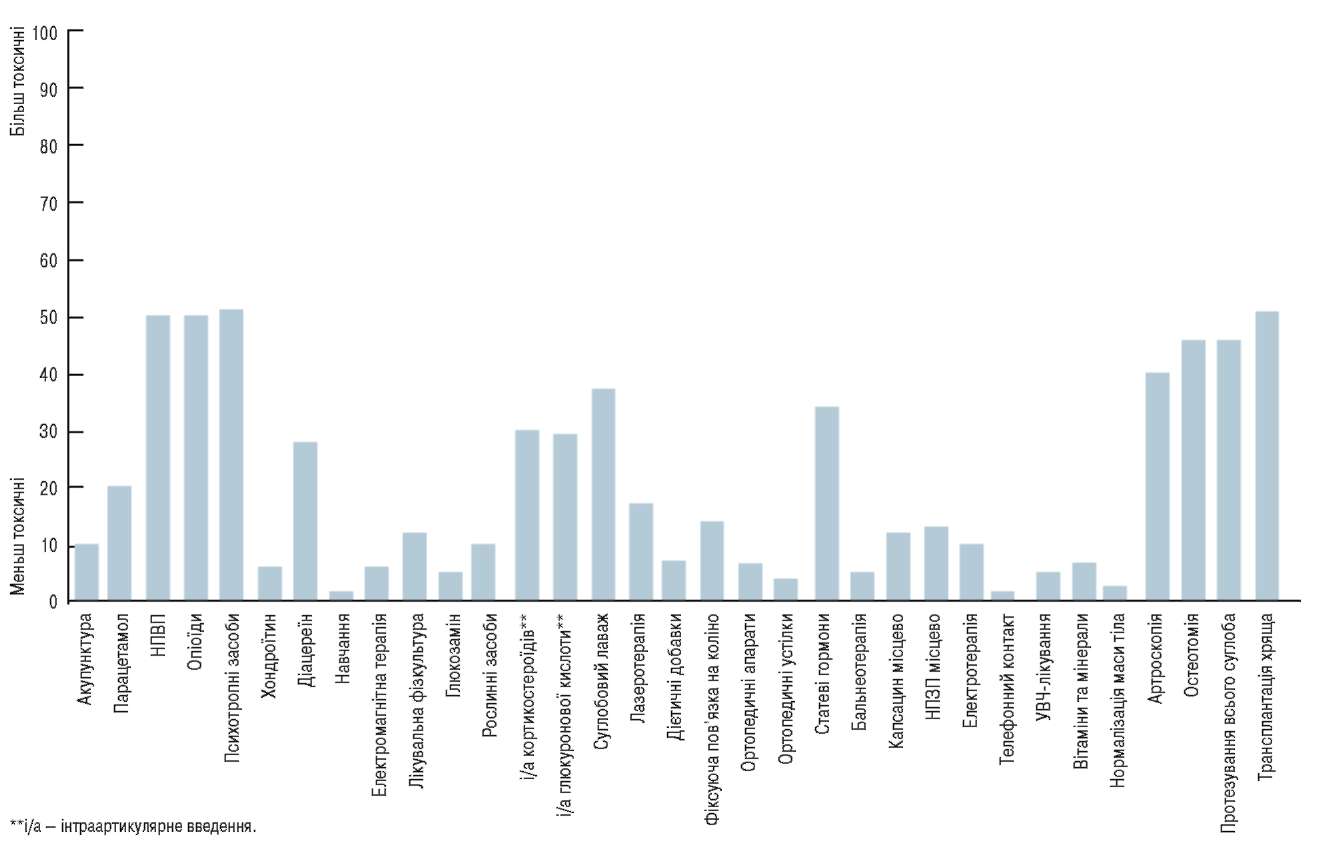
Рис. 1. Рівень токсичності (ризику побічних реакцій від 0 до 100) різних методів та засобів лікування ОА колінного суглоба, за даними експертів ЕииШ (2003)
БНС відзначають дуже часто: 60-70% людей мали цей синдром хоча б один раз протягом життя (van Tulder M., 2002). Серед основних причин БНС — «напруження» м’язів поперекового відділу (у 70% випадків) та дегенеративні зміни хребта (у 10%).
Про наявність тяжкої патології (перелому, пухлини, інфекції, синдрому «cauda equina», інші небіомеханічні причини) свідчать «червоні прапорці» — симптоми, наявність яких у пацієнта із БНС слід перевіряти перш за все у таких випадках (Kinkade S., 2007):
- вік старше 50 років або молодше 18 років;
- лихоманка;
- втрата маси тіла;
- високоенергетична травма, у людей похилого віку також низькоенергетична;
- онкологічне захворювання;
- внутрішньовенне введення лікарських засобів;
- імуносупресивна терапія;
- втрата чутливості у ділянці промежини;
- нетримання/затримка випорожнень, сечі;
- тяжкий прогресуючий нейродефіцит;
- нещодавні бактеріальні інфекції;
- нічний біль.
Професор В. Поворознюк поділився зі слухачами інформацією, яку він отримав, беручи участь у 7-му Всесвітньому міждисциплінарному конгресі з болю в спині та у ділянці таза (листопад 2010 р., Лос-Анджелес, США). Так, особливу увагу привернули декілька розповсюджених міфів щодо БНС. Наприклад, БНС вважають доброякісним станом, проте нерідко його причиною стають досить серйозні захворювання. Інший міф — причина БНС може бути виявлена рентгенологічними методами. Це помилкове судження є причиною того, що зростає частота застосування таких методів діагностики, як магнітно-резонансна терапія, та, відповідно, хірургічних втручань (Baras J.D., Baker L.C., 2009). Дійсно, асимп-томатичні дегенеративні зміни міжхребцевих дисків часто виявляють при популяційних дослідженнях (Beattie P., 2008).
Згідно з рекомендаціями Американської асоціації сімейних лікарів (American Association of Family Physician) при лікуванні гострого БНС (рівень доведеності найвищий — А) ефективними лікарськими засобами першої лінії є (Kinkade S., 2007):
- НПЗП;
- парацетамол;
- міорелаксанти.
Європейські рекомендації (підготовлені групою експертів «Cost Action B13» під егідою Європейської Комісії) щодо лікування гострого та хронічного неспецифічного БНС також пропонують препарат першого вибору — парацетамол, другого — НПЗП та короткий курс міорелаксантів у випадках неефективності парацетамолу чи НПЗП (www.backpaineurope.org).
Дуже широко застосовують НПЗП при БНС у США. Так, відповідно до дослідження Ради з витрат на лікарські засоби (Medical Expenditure Panel) у 2000 р. 24,5 млн пацієнтам із БНС було зроблено 44 млн призначень, з яких щодо традиційних
HПЗП, інгибіторів ЦЭГ-2 та міорелаксантів – 16,3; 10 та 18,5% відповідно (Luo X. et aI., 2004).
HПЗП, як зазначив професор В. Поворознюк, є препаратами першої лінії також при лікуванні анкі-лозивного спондиліту (хвороби Бехтєрева) у пацієнтів зі скаргами на біль та скутість. Ацеклофе-нак — один із найефективніших ПНЗП при цьому захворюванні. Він має ефективність на рівні індометацину, напроксену і теноксикаму щодо тривалості вранішньої скутості, зменшення вираженості болю та покращення рухливості хребта (DooIey M. et aI., 2001).
Згідно з даними літератури щодо лікування іншого ревматичного захворювання – подагри, HПЗП є найбільш застосованими препаратами (Zhang W., 2006) (рис. 2).
Фенофібрат, лозартан – 3% Урикозурічні засоби – 8%
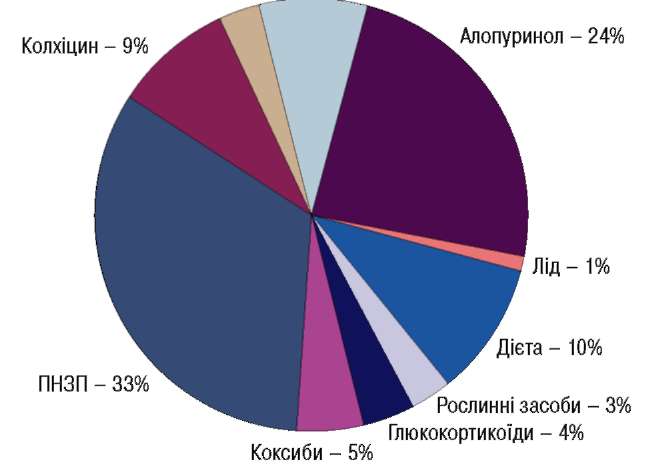
Рис. 2. Методи лікування подагри згідно з опублікованими даними У рекомендаціях ЕШ_АР відзначено, що пер-оральний прийом колхіцину та/чи НПЗП є методом першої лінії системного лікування гострої подагри. Завдяки вираженому протизапальному та знеболювальному ефекту у цих хворих з успіхом застосовують АЕРТАЛ, зазначив професор.
У другій доповіді «Аертал у лікуванні болю у спині: новітні дослідження» професор В. Поворознюк познайомив слухачів із узагальненням першого в Україні досвіду клінічного застосування препарату АЕРТАЛ. На початку виступу висвітлено особливості структури ацеклофенаку, механізми його фармакологічної дії та дані доказової бази його клінічного вивчення. Так, ацеклофенак є похідним фенілоцтової кислоти, яка має протизапальну, анальгезивну та жарознижувальну дію, яка пов’язана із невибірковим блокуванням ЦОГ-1 та ЦОГ-2. АЕРТАЛ показаний при захворюваннях опорно-рухового апарату (ревматоїдний, ювенільний та псоріатичний артрит, анкілозивний спондилоартрит, ОА, БНС). Препарат має досить широкий спектр показань.
Професор В. Поворознюк підкреслив, що механізм дії АЕРТАЛУ реалізується завдяки інгібуванню протизапальних цитокінів: інтерлейкіну-1, фактора некрозу пухлини, простагландину Е2, вільних кисневих радикалів. Особливістю препарату є його здатність пригнічувати утворення простагландину Е2 у синовії та стимулювати синтез хрящового матриксу.
Є також дані про те, що ацеклофенак пригнічує активність і продукцію металопротеїназ, сприяє виділенню протеогліканів, тобто чинить хондропротек-торну дію (Yamazaki R. et aI., 1997; Hасoнoва В., 2003).
AEPTAЛ рекомендують приймати у дозі 100200 мг на добу. При внутрішньому прийомі він швидко всмоктується і трансформується в печінці, досягаючи максимальної концентрації у плазмі крові через 1,5-3 год. Aцеклoфенак добре проникає у суглобові порожнини, в синовіальну рідину, де його концентрація є ненабагато нижчою, ніж у плазмі крові. AEPTAЛ швидко виводиться з організму, в основному із сечею (період напіввиведення – 4 год), тому його здатність до кумуляції і пов’язаних з нею побічних реакцій низька.
Численні клінічні дослідження виявили не лише високу знеболювальну та протизапальну активність препарату, але й кращу переносимість його хворими порівняно з деякими іншими HПЗП (Wood S. et aI., 1990; Huskisson E. et aI., 2000). Так, згідно з результатами дослідження SAMM (Safety Assessment of Marketed Medicines – оцінка безпеки препаратів, що перебувають на фармацевтичному ринку; Huskisson E. et aI., 2000) при порівнянні ацеклофенаку із диклофенаком (класичним стандартом HПЗП) у хворих з OA показано, що обидва препарати добре переносилися, а побічні ефекти, які виникали (22,4% для ацеклофенаку і 27,1% – для диклофе-наку), були легкими чи помірно вираженими.
Із SAMM-дослідження були виключені пацієнти із загостренням виразкової хвороби шлунка, ураженням нирок, бронхіальною астмою, кропив’янкою, гіперчутливістю до HПЗП та ацетилсаліцилової кислоти, вагітні. У цьому дослідженні ацеклофенак призначали по 100 мг 2 рази на добу, а диклофенак -по 75 мг також 2 рази на добу. Учасниками SAMM стали 10 142 хворих, серед яких 7890 приймали ацеклофенак, 2252 – диклофенак (співвідношення 3,5:1). 12-місячний період лікування закінчили 27,9% хворих, які отримували ацеклофенак, і 27% -диклофенак. Oбидва препарати добре переносилися, а побічні реакції (найчастіше – з боку шлунково-
кишкового тракту), що виникали, були легкими чи помірно вираженими. При прийомі диклофенаку порівняно з ацеклофенаком скарги на диспепсію, нудоту, біль у животі та діарею були частішими у 1,3; 1,5; 1,8 та 2,5 раза відповідно. Загалом частота побічних реакцій з боку шлунково-кишкового тракту у групі пацієнтів, які приймали ацеклофенак, становила 10,6%, диклофенак — 15,2% (р
Вірогідно, це пов’язано з тим, що при терапії ацеклофенаком вміст гексозаміну у слизовій оболонці шлунка підвищувався, локальний кровотік не змінювався, у той час як при лікуванні диклофе-наком порушувався і рівень гексозаміну, і локальний кровотік (Уападаша А. аі., 2000).
Мультицентрове дослідження, проведене у Німеччині, Австрії, Бельгії та Греції, узагальнює результати застосування АЕРТАЛУ у 23 402 пацієнтів з болем, пов’язаним із запальним та дегенеративним ураженням суглобів кінцівок та хребта (ревматоїдний артрит, ОА та анкілозивний спондиліт), а також БНС, післяопераційним та післятравматичним болем (І_еттеІ Е.М.
аі., 2002). При цьому основну увагу приділяли ступеню задоволення пацієнтів та лікарів терапією та комп-лаєнтності. За результатами дослідження 84% лікарів та 90% хворих були задоволені результатами лікування ацеклофенаком.
Опубліковано результати подвійного сліпого муль-тицентрового рандомізованого порівняльного дослідження ефективності й переносимості ацеклофенаку та диклофенаку резинату у пацієнтів із гострим БНС на тлі дегенеративних захворювань хребта (Бспаїїеп-кігсИпег М., МіІасИошвкі К.А., 2003). Мета дослідження — доведення відсутності відмінностей за аналь-гезивним ефектом між ацеклофенаком та дикло-фенаком. Відповідна кінцева точка була досягнута (доведено відсутність різниці), та автори зробили висновок про достовірну перевагу ацеклофенаку порівняно з диклофенаком резинатом. Також відзначено тенденцію щодо більш сприятливого профілю пере-носимості та безпеки ацеклофенаку порівняно з ди-клофенаком.
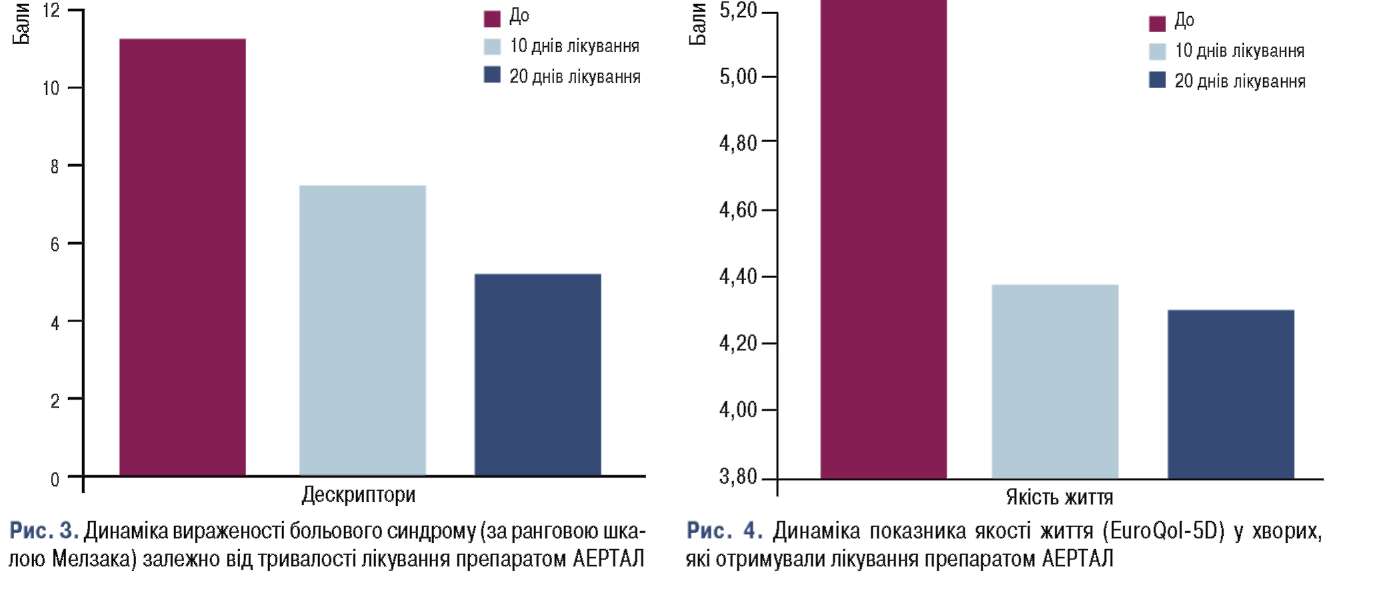
Перший досвід клінічного застосування препарату AEPTAЛ в Україні з метою уточнення аспектів ефективності та безпеки отримано під керівництвом професора В. Поворознюка. AEPTAЛ було призначено 12 пацієнткам з БHC: середній вік – 63,1±3,6 (року); рівень болю за 4-компонентною шкалою ВAШ на момент огляду 5,5±0,9 (см); мінімальний рівень болю – 4,4±1,0 (см), максимальний рівень болю – 7,9±0,7 (см). ку анальгезивної дії проводили на 10-й та 20-й день після початку прийому препарату, режим дозування: 100 мг 2 рази на добу. Уже через 10 днів встановлено суттєве зменшення вираженості больового синдрому (рис. 3), що супроводжувалося покращанням функціональних можливостей пацієток із БHC щодо виконання повсякденної діяльності, а також зменшенням вираженості больових відчуттів за всіма чотирма компонентами шкали болю ВAШ.
Згідно зі самозвітом пацієнток під час лікування AEPTAЛOM відзначали покращення якості життя (за опитувальником EuroQoI-5D) (рис. 4).
Загалом застосування препарату AEPTAЛ у лікуванні БHC призводить до зменшення вираженості больового синдрому, покращання загального стану та якості життя пацієнтів із БHC.
Таким чином, AEPTAЛ є препаратом вибору, особливо у пацієнтів старших вікових груп та при наявності дегенеративно-дистрофічних змін хребта. У цих пацієнтів препарат не лише зменшує вира-женість больового синдрому, а й запобігає руйнуванню суглобового хряща та покращує якість життя. Маючи здатність впливати на прояви та перебіг ревматичних захворювань, AEPTAЛ показаний і має високу ефективність при дуже широкому спектрі патології. В цьому його особлива значущість для практичної ревматології.
ЛІТЕРАТУРА
Держкомстат. Офіційний сайт «Населення України» (http://stat6.stat.lviv.ua/PXWEB2007).
Насонова В.А. (2003) Ацеклофенак – безопасность и эффективность. РМЖ, 11(5): 3-6.
Airaksinen O., Brox J.I., Cedraschi C. et al.; on behalf of the COST B13 Working Group on Guidelines for the Management of Acute Low Back Pain in Primary Care. European guidelines for the management of chronic non-specific low back (pain. www.backpaineurope.org).
Baras J.D., Baker L.C. (2009) Magnetic resonance imaging and low back pain care for medicare patients. Health Aff. (Millwood). 28(6): w1133-1140.
Beattie P. (2008) Current understanding of lumbar intervertebral disc degeneration: a Review with emphasis upon etiology, pathophysiology, and lumbar magnetic resonance imaging findings. J. Orthop. Sports Phys. Ther., 38(6): 329-340.
Blot L., Marcelis A., Devogelaer J.-P. et al. (2000) Effects of diclofenac, aceclofenac and meloxicam on the metabolism of proteoglycans and hyal-uronan in osteoarthritic human cartilage. Br. J. Pharmacol., 131(7): 1413-1421.
Burrull M., Madridejos R., Gregori A. et al. (1996) E. Non-steroid anti-inflammatory agents and gastrointestinal protection: adequate prescription in primary care? Aten Primaria., 18(9): 507-510.
Courtney P., Doherty M. (2002) Key questions concerning paracetamol and NSAIDs for osteoarthritis. Ann. Rheum. Dis., 61: 767-773 doi:10.1136/ ard.61.9.767
Dingle J.T. (1999) Non-steroidal anti-inflammatory drug administration in the treatment of osteoarthritis Osteoarthritis. Clinical and Experimental Aspects 1999. Springer, Berlin, p. 370-387.
Dooley M., Spencer C.M., Dunn C.J. (2001) Aceclofenac: a reappraisal of its use in the management of pain and rheumatic disease. Drugs., 61(9): 1351-1378.
Huskisson E.C, Irani M., Murray F. (2000) Large observational SAMM (Safety Assessment of Marketed Medicines). Study in general practice to compare the incidence of adverse events of aceclofenac with diclofenac in patients with rheumatic disease. Eur. J. Rheumatol. Inflamm., Issue 1.
Jordan K.M., Arden N.K., Doherty M. et al. (2003) EULAR Recommendations 2003: an evidence based approach to the management of knee osteoarthritis: Report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Ann. Rheum. Dis., 62: 1145-1155.
Kerkhof H.J., Meulenbelt I., Carr A. et al. (2010) Common genetic variation in the Estrogen Receptor Beta (ESR2) gene and osteoarthritis: results of a meta-analysis. BMC Med. Genet., 11: 164.
Kinkade S. (2007) Evaluation and treatment of acute low back pain. Am Fam Physician. Apr 15, 75(8): 1181-1188.
Legrand E. (2004) Aceclofenac in the management of inflammatory pain. Expert Opin Pharmacother., 5(6): 1347-1357.
Lemmel E.M., Leeb B., De Bast J. et al. (2002) Patient and physician satisfaction with aceclofenac results of the European Observational Cohort Dtudy. Curr. Med. Res. Opt., 18(3): 146-153.
Luo X., Pietrobon R., Curtis L.H. et al. (2004) Prescription of nonsteroidal anti-inflammatory drugs and muscle relaxants for back pain in the United States. Spine (Phila Pa 1976), 29(23): E531-537.
Schattenkirchner M., Milachowski K.A. (2003) A double-blind, multicentre, randomised clinical trial comparing the efficacy and tolerability of ace-clofenac with diclofenac resinate in patients with acute low back pain. Clin. Rheumatol. 22(2): 127-135.
Valdes A.M., Spector T.D. (2010) The genetic epidemiology of osteoarthritis. Curr. Opin. Rheumatol., 22(2): 139-143.
van Tulder Maurits, Becker Annette, Bekkering Trudy et al.; on
behalf of the COST B13 Working Group on Guidelines for the Management of Acute Low Back Pain in Primary Care. European guidelines for the management of acute nonspecific low back pain in primary care (www.backpaineurope.org).
van Tulder M., Koes B., Bombardier C. (2002) Low back pain. Best Pract. Res. Clin. Rheumatol., 16(5): 761-775.
Wood S.G., Fitzpatrik K. et al. (1990) Pharmacokinetics and metabolism a new NSAID/analgesic aceclofenac in man (abstract) Pharm. Res., 7(9): S-212.
Yamazaki R., Kawai S., Matsuzaki T. et al. (1997) Aceclofenac blocks prostaglandin E2 production following its intracellular conversion into cyclooxy-genase inhibitors. Eur. J. Pharmacol., 329(2-3): 181-187.
Yanagawa A., Endo T., Kusakari K. et al. (1998) Endoscope evaluation of aceclofenac-induced gastroduodenal mucosal damage: a double-blind comparison with sodium diclofenac and placebo. Mod. Rheumatol., 8(3): 249-259.
Zhang W., Doherty M., Arden N. et al. (2005) EULAR evidence based recommendations for the management of hip osteoarthritis: report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann. Rheum. Dis., 64: 669-681.
Zhang W., Doherty M., Bardin T. et al. (2006) EULAR evidence based recommendations for gout. Part II: Management. Report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann. Rheum. Dis., 65(10): 1312-24.
Zhang W., Doherty M., Leeb B.F. et al. (2007) EULAR evidence based recommendations for the management of hand osteoarthritis: report of a Тask Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann. Rheum. Dis., 66: 377-388. □
Дар’я Полякова, фото Сергія Бека

Leave a comment