ХАРАКТЕРИСТИКА ИММУНОПАТОЛОГИЧЕСКИХ РЕАКЦИЙ У ПАЦИЕНТОВ С ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ В ЗАВИСИМОСТИ ОТ НАЛИЧИЯ ИНСУЛИНОРЕЗИСТЕНТНОСТИ
Воронков Л.Г. , Гавриленко Т.И., Ільницька М.Р., Якушко Л.В. , Рижкова Н.О.
Резюме. Обследовано 107 пациентов с хронической сердечной недостаточностью (ХСН) II–IV функционального класса по NYHA без сахарного диабета со сниженной фракцией выброса левого желудочка и 15 практически здоровых лиц. Больных распределяли на две группы в зависимости от наличия инсулинорезистентности (ИР) (величина индекса НОМА ≥2,77). Методом иммуноферментного анализа определяли уровни инсулина, лептина, адипонектина в сыворотке крови, а также уровни фактора некроза опухоли (ФНО)-α, интерлейкина (ИЛ)-6 и -10 в сыворотке крови и супернатантах мононуклеарных клеток (МНК). Изучали содержание аутоантител (АТТ) и степень сенсибилизации лимфоцитов на антиген к тканям поджелудочной железы. У пациентов с ХСН независимо от наличия ИР выявляли активную иммуновоспалительную реакцию в виде интенсивной секреции МНК ФНО-α и ИЛ-6. У больных с ХСН с ИР установлены достоверно выраженные признаки аутоиммунизации, которая осуществлялась как по клеточному, так и гуморальному типу. Установлена корреляционная зависимость между уровнями ФНО-α, ИЛ-6 в сыворотке крови и степенью аутосенсибилизации лимфоцитов, АТТ на антиген к тканям поджелудочной железы. Также в этой группе пациентов отмечены достоверно более высокие уровни лептина и отношение лептин/адипонектин в сравнении с группой контроля.
ВСТУП
Прогресування хронічної серцевої недостатності (ХСН) опосередковується патофізіологічними механізмами, що розглядаються як з позицій нейрогуморальної моделі, так і активації системи про- та протизапальних цитокінів: фактора некрозу пухлини (ФНП)-α, інтерлейкінів (ІЛ)-1, -6, -10. Підвищення локального синтезу зазначених гормонів призводить до їх активації, що відіграє важливу роль у прогресуванні ХСН. Окрім цього, зазначені цитокіни стимулюють гіпертрофію кардіоміоцитів та пошкодження їх мембран, посилюють процес апоптозу кардіоміоцитів, що проявляється ремоделюванням міокарда та кахексичним процесом на тлі аутоімунізації, при якій спостерігається збільшення кількості аутоантитіл та сенсибілізованих лімфоцитів [3, 18, 22, 26].
Визначення про- та протизапальних факторів у сироватці крові хворих на ХСН дає змогу оцінити за їх кількістю розвиток системного запалення, оскільки у сироватку крові потрапляють цитокіни, що секретуються багатьма популяціями клітин крові (ендотеліоцити, моноцити, лімфоцити, нейтрофіли тощо, а також клітинами жирової тканини — адипоцитами), тоді як активність імунного запалення відображають імунокомпетентні клітини (ІКК) (нейтрофіли, моноцити, лімфоцити). У зв’язку з цим наявність про- та протизапальних цитокінів доцільно визначати також у супернатантах ІКК клітин (у чистій популяції). При вимірюванні рівня цитокінів ізольованими клітинами in vitro визначається їх функціональний стан і секреторна здатність [12].
Аутоімунні реакції розвиваються при порушенні розвитку та підтримці аутотолерантності. Прояви цих реакцій залежать від характеру імунних механізмів, які переважають при відповіді на аутоантиген. Це може бути клітинна реакція, яка супроводжується появою сенсибілізованих цитотоксичних Т-лімфоцитів, або гуморальна реакція, яка проявляється виробленням аутоантитіл, здатних залучати клітинні (фагоцити) та гуморальні (комплемент) ефекторні фактори [13]. При появі великої кількості аутоантитіл і сенсибілізованих лімфоцитів до тканини підшлункової залози (ПШЗ), факторів імунного запалення можна стверджувати про розвиток імунопатологічних реакцій, які на сьогодні не були детально та комплексно вивчені у хворих на ХСН.
Згідно з сучасними уявленнями, жирова тканина метаболічно дуже активна та синтезує велику кількість регуляторних речовин (лептин, адипонектин, резистин, ФНП-α, ІЛ-6, ІЛ-8, фактори росту тощо), а також відповідні розчинні рецептори, які впливають на патогенез серцево-судинних захворювань, зокрема у пацієнтів із ХСН [20, 27].
Лептин здатен стимулювати клітинну імунну відповідь за рахунок підвищення продукції прозапальних цитокінів, у тому числі шляхом активації секреції жировою тканиною ФНП-α, тоді як адипонектин виявляє протизапальні властивості. Це виражається у пригніченні продукції макрофагами прозапальних цитокінів, перш за все ФНП-α [5, 24].
Синтез лептину в адипоцитах стимулюється інсуліном, меншою мірою — катехоламінами. У свою чергу, лептин підвищує чутливість клітин печінки і м’язової тканини до дії інсуліну. Надлишок лептину призводить до пригнічення секреції інсуліну та сприяє розвитку інсулінорезистентності (ІР) інсулінозалежних тканин [1].
У зв’язку з вищенаведеним мета дослідження — вивчення деяких імунопатологічних реакцій — аутоімунних та імунозапальних, зіставлення цих проявів з гормонами жирової тканини та індексом НОМА, який характеризує наявність чи відсутність ІР у хворих на ХСН.
Об’єкти і методи дослідження
Досліджено 107 пацієнтів із ХСН II–IV функціонального класу (ФК) за NYHA (New York Heart Association Functional Classification) без цукрового діабету: 94 чоловіки, 13 жінок, середній вік становив (60,0±2,5) року. 84 пацієнти з ішемічною хворобою серця, 23 — з дилатаційною кардіоміопатією, зі зниженою фракцією викиду лівого шлуночка (≤40%). Контрольну групу становили 15 практично здорових осіб, зіставних за віком із хворими.
Клінічний діагноз встановлювали на пiдставi результатiв клiнiко-iнструментального обстеження пацієнтів із проведенням загальних клiнiчних та лабораторних досліджень, електрокардіограми, ехокардiографії, рентгенологiчного дослiдження органiв грудної клiтки.
Дослідження пацієнтів проводили після початкового етапу лікування, спрямованого на компенсацію серцевої недостатності та нівелювання ознак затримки рідини в організмі.
Матеріалом імунологічного дослідження, який дає можливість оцінити розвиток імунопатологічної реакції, що проявляється гіперреакцією клітинних та гуморальних факторів, що формують імунне запалення, а також прояви аутоімунізації (наявність сенсибілізованних Т-лімфоцитів і аутоантитіл до тканини ПШЗ), були периферична кров та супернатант ІКК. У сироватці крові та супернатантах визначали фактори імунного запалення (рівні ФНП-α, ІЛ-6 та ІЛ-10) методом імуноферментного аналізу (ІФА) з використанням тест-систем ООО «Цитокин» (Росія).
Для отримання супернатанту мононуклеарні клітини крові (МНК) виділяли шляхом центрифугування на градієнті щільності фікол-верографіну (1,076 г/см). Клітинну суміш МНК двічі відмивали середовищем 199 та доводили до концентрації (110) клітин/мл. Для подальшого культивування клітин готували живильне середовище, яке складалось із середовища 199, ембріональної телячої сироватки (10%) та розчину гентаміцину (80 мкг/мл). Інкубацію здійснювали при 37 ˚С протягом 24 год. Після інкубації супернатанти МНК відбирали, центрифугували та зберігали при –20 ˚С [6].
Розраховували індекс системного запалення (ІСЗ) та індекс імунозапальної реакції (ІЗР) за співвідношенням прозапальних цитокінів (ФНП-α + ІЛ-6) та протизапального ІЛ-10 у сироватці крові та супернатантах МНК відповідно.
Для характеристики аутоімунізації також визначали:
- інтенсивність сенсибілізації лімфоцитів до специфічного антигену із тканини ПШЗ у реакції бласттрансформації МНК (РБТЛ) [11];
- рівень аутоантитіл проти антигену ПШЗ (ААТ ПШЗ) в реакції споживання комплементу (РСК) [14].
- гормони жирової тканини та інсулін у сировтці крові за допомогою автоматичного імуноферментного аналізатора «IEMS» («LabSystems», Фінляндія), згідно з інструкціями до діагностичних наборів: інсулін та лептин — «DRG» («Diagnostics», Німеччина), адипонектин — (набір реагентів «AssayPro», США);
- глюкозу в сироватці крові на автоматичному біохімічному аналізаторі «А-25» («BioSystems», Іспанія) в лабораторії біохімії ДУ «ННЦ «Інститут кардіології ім. М.Д. Стражеска НАМН України».
Для встановлення наявності ІР визначали індекс НОМА за формулою:
Глюкоза натще (ммоль/л) · інсулін натще (мкОд/мл) .
22,5
ІР (НОМА ≥2,77) встановлювали згідно з чинними національними рекомендаціями [2].
Для кожного з визначених показників розраховано ступінь його відхилення від норми в балах за формулою В.М. Земськова [4].
При статистичній обробці результатів використовували програму Microsoft Excel. Для оцінки ступеня взаємозв’язку між парами незалежних ознак використовували коефіцієнт вибіркової кореляції K. Pearson (r). Вірогідність відмінностей розраховували за t-критерієм Стьюдента.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
Пацієнти з ХСН загалом мали достовірно вищий рівень лептину при незначно підвищеному рівні адипонектину (табл. 1).
Розраховували співвідношення рівнів лептину та адипонектину (Л/А), яке може служити маркером серцево-судинного ризику незалежно від індексу маси тіла [7]. Збільшення Л/А відповідало 5-му ступеню відхилення від норми. Також у цій групі пацієнтів вміст інсуліну перевищував у 1,6 раза цей показник при порівнянні з контрольною групою.
Важливим регулятором чинників запальної реакції є ФНП-α, який проявляє системні та локальні ефекти, що можуть мати значення у розвитку патології міокарда. Підвищення рівнів ФНП-α спостерігалося у пацієнтів із ХСН з більш тяжкими клінічними проявами, впливало на розвиток синдрому кардіальної кахексії (зниження скоротливої здатності міокарда, зменшення серцевого викиду), а також у більшості випадків корелювало із ФК за NYHA. Важливо, що ФНП-α сприяє більш швидкому вивільненню лептину з білої жирової тканини [8, 19].
| Показник | Контрольна група(n=15) |
Пацієнти з ХСН (n=107) |
Ступінь відхилення від норми,балів |
|---|---|---|---|
| Інсулін, мкМО/мл | 9,3±1,1 | 14,8±1,7* | 2 |
| Глюкоза, ммоль/л | 4,7±0,2 | 5,2±0,1 | 1 |
| Індекс HOMA | 1,5±0,2 | 3,5±0,4* | 4 |
| Лептин, нг/мл | 3,7±0,2 | 11,7±1,9* | 5 |
| Адипонектин, мкг/мл | 7,9±0,7 | 11,2±0,4* | 2 |
| Л/А | 0,5±0,1 | 1,7±0,3* | 5 |
У табл. 1–3 та 5:*вірогідні відмінності відносно контрольної групи (p<0,05).
Результати проведених нами досліджень свідчать (табл. 2), що у загальній групі обстежених рівень ФНП-α як у сироватці крові, так і в супернатантах МНК, був значно підвищеним.
| Показник | Контрольна група(n=15) |
Пацієнти з ХСН(n=107) | Ступінь відхилення від норми,балів |
|---|---|---|---|
| ФНП-α, пг/мл: сироватка крові супернатант МНК |
32,8±4,5 92,8±16,7 |
91,8±23,4* 343,3±51,5* |
45 |
| ІЛ-6, пг/мл: сироватка крові супернатант МНК |
1,8±0,54 59,6±92,2 |
14,1±4,1* 1665,2±241,9* |
95 |
| ІЛ-10, пг/мл: сироватка супернатант МНК |
1,3±0,2 82,8±17,9 |
8,8±2,5* 81,2±38,8 |
8 |
| ІСЗ (сироватка крові) ІЗР (супернатант МНК) |
7,7±1,6 6,7±2,3 |
90,0±11,3* 29,7±3,9* |
136 |
| РБТЛ до антигену ПШЗ, % | 1,5±0,6 | 5,1±0,5* | 5 |
| ААТ до антигену ПШЗ, ум. од. | 2,7±1,2 | 16,0±0,8* | 7 |
Прозапальний ІЛ-6 також бере активну участь у регуляції та формуванні запальних та імунних процесів. Останнім часом викликає особливий інтерес визначення ролі ІЛ-6 в регуляції обмінних процесів і розвитку запалення жирової тканини при метаболічних захворюваннях. Доведено, що при ожирінні, метаболічному синдромі та цукровому діабеті ІІ типу секреція ІЛ-6 зростає у крові, а ще більшою мірою — у жировій тканині. Джерелом ІЛ-6 при цьому є не лише адипоцити, а й макрофаги, які інфільтрують жирову тканину. Короткочасне підвищення концентрації ІЛ-6 у крові та тканинах може бути сигналом енергетичного дефіциту, який посилює дію інсуліну в м’язах та пригнічує його у тканинах. ІЛ-6 як шляхом пригнічення дії інсуліну, так і безпосередньої активації відповідних ензиматичних процесів сприяє продукції та вивільненню глюкози й ліпідів, а в клітинах скелетних м’язів — сприяє їх засвоєнню та утилізації [9, 15, 23].
Високий вміст ІЛ-6 асоційований із гіршим клінічним прогнозом при серцевій недостатності (СН). Так, існують відомості про кореляційний зв’язок рівнів ІЛ-6 та виживаності хворих із застійною ХСН III–IV ФК зі зниженою фракцією викиду лівого шлуночка [17, 21].
У наших пацієнтів (див. табл. 2) рівень ІЛ-6 як у сироватці крові, так і в супернатантах МНК, також був достовірно вищим, ніж у групі здорових донорів.
ІЛ-10 виявляє сильний протизапальний ефект. Він контролює та регулює продукцію прозапальних цитокінів. Існують дані, що рівень ІЛ-10 при СН та ремоделюванні лівого шлуночка низький. Водночас є повідомлення про високий рівень цього цитокіну у пацієнтів із СН [16]. Відомо також, що підвищені рівні ФНП-α при СН стимулюють секрецію ІЛ-10, а він, у свою чергу, пригнічує надмірну активність прозапальних цитокінів. При запальних процесах індукція ІЛ-10 відбувається одночасно із прозапальними цитокінами, а при СН продукція ІЛ-10 асоціюється зі зростанням рівня ФНП-α [10, 25].
Результати проведених нами досліджень свідчать, що в загальній групі пацієнтів із ХСН у сироватці крові спостерігаються високі рівні ІЛ-10 (p<0,05). У супернатантах МНК вміст ІЛ-10 був у межах норми (див. табл. 2). Рівні цих факторів впливають на активність запального процесу, який маніфестував як високими значеннями ФНП-α, так і ІЛ-6 у сироватці крові та супернатантах клітин за невисокого рівня ІЛ-10. Як видно (див. табл. 2), індекс запалення в сироватці крові становив (90,0±11,3), що відповідало 13-му ступеню відхилення від норми, в супернатантах МНК — 6-му ступеню. Високий ступінь системного запалення, ймовірно, залежить не лише від секреторної здатності клітин крові, а й від спроможності активованих адипоцитів.
При проведенні кореляційного аналізу нами отримано взаємозв’язок між активністю адипоцитів із деякими факторами запалення у пацієнтів із ХСН (рис. 1).
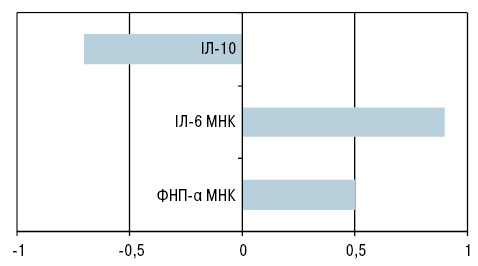
У загальній групі пацієнтів із ХСН (див. табл. 2) відзначали розвинуту аутоімунну реакцію, яка відбувалася як за клітинним, так і гуморальним типом. Значна сенсибілізація лімфоцитів до антигену ПШЗ супроводжувалася підвищеною продукцією ААТ. Кількість ААТ до тканин ПШЗ відповідала 7-му ступеню відхилення від норми. Таку саме картину спостерігали і при оцінці сенсибілізованих до цього антигену лімфоцитів. 5-й ступінь відхилення від норми свідчить про активну аутоімунну реакцію за клітинним типом.
Далі встановлено особливості імунопатологічних реакцій (аутоімунної та імунозапальної) у пацієнтів із ХСН з наявною ІР та без неї.
Обстежені пацієнти були розподілені на дві групи залежно від величини індексу НОМА: в 1-шу групу увійшли 62 хворих з ХСН без ІР (HOMA <2,77, що становило 58%), в 2-гу групу — 45 пацієнтів з ІР (HOMA ≥2,77, що становило 42%).
Як видно з табл. 3, більш значне підвищення рівня інсуліну спостерігається в 2-й групі пацієнтів, який в 3,5 раза перевищував цей показник у групі хворих без ІР (p<0,05). Рівень адипонектину був вище в обох групах порівняно з контролем, та вірогідної різниці за цим показником в 1-й та 2-й групах не виявлено. У пацієнтів з ХСН з ІР виявлено вірогідно більш високі рівні лептину та співвідношення Л/А порівняно з контрольною групою. Достовірних відмінностей цих показників у пацієнтів 1-ї та 2-ї груп не встановлено.
| Показники | Контрольна група (n=15) |
HOMA | |
|---|---|---|---|
| <2,77 (1-ша група, n=62) |
≥2,77 (2-га група, n=45) |
||
| Інсулін, мкМО/мл | 9,3±1,1 | 7,6±0,4 | 24,8±3,5* |
| Глюкоза, ммоль/л | 4,7±0,2 | 5,0±0,1 | 5,4±0,1* |
| Індекс HOMA | 1,5±0,2 | 1,7±0,1 | 6,0±0,9* |
| Лептин, нг/мл | 3,7±0,2 | 5,5±3,0* | 8,3±3,1* |
| Адипонектин, мкг/мл | 7,9±0,7 | 10,8±0,6* | 11,6±0,6* |
| Л/А | 0,5±0,1 | 0,7±0,1* | 1,1±0,4* |
У табл. 3 і 5: вірогідні відмінності між 1-ю та 2-ю групами пацієнтів (p<0,05).
Оцінивши показники в балах, ми встановили, що функціональна активність адипоцитів значно вища у хворих на ХСН та з індексом НОМА ≥2,77 (15 балів), тоді як при НОМА <2,77 загальна кількість балів дорівнювала 6 (табл. 4).
| Показник | НОМА | |
|---|---|---|
| <2,77 | ≥2,77 | |
| Інсулін, мкМО/мл | Норма | 4 |
| Глюкоза, ммоль/л | Норма | 1 |
| Лептин, нг/мл | 2 | 4 |
| Адипонектин, мкг/мл | 2 | 2 |
| Л/А | 2 | 4 |
| Загальна кількість балів | 6 | 15 |
У пацієнтів із ХСН з наявністю ІР та без неї в сироватці крові виявлено вірогідно підвищені рівні не тільки показників прозапальних ФНП-α та ІЛ-6, а також і протизапального ІЛ-10 порівняно з контрольною групою, який, як зазначено раніше, має регуляторний характер відносно синтезу прозапальних цитокінів (табл. 5). Але велика кількість ІЛ-10 не впливала на рівень ФНП-α та ІЛ-6, а також на ІСЗ, який становив 9 балів в 1-й групі та 17 — в 2-й (табл. 6). Як видно з табл. 5, встановлена вірогідна відмінність ІСЗ між 1-ю та 2-ю групами, що свідчить про більш активну запальну реакцію у хворих на ХСН з ІР.
| Показник | Контрольна група(n=15) |
HOMA | |
|---|---|---|---|
| <2,77(1-ша група, n=62) | ≥2,77 (2-га група, n=45) | ||
| ФНП-α, пг/мл: сироватка крові супернатант МНК |
32,8±4,5 92,8±16,7 |
50,9±32,9 349,3±83,2* |
144,8±75,6 320,8±155,8 |
| ІЛ-6, пг/мл: сироватка крові супернатант МНК |
1,8±0,5 459,6±92,2 |
10,4±2,4* 1777,3±286,9* |
20,5±11,1* 1244,9±391,5 |
| ІЛ-10, пг/мл: сироватка крові супернатант МНК |
1,3±0,2 82,8±17,9 |
7,2±1,7* 85,0±43,8 |
11,0±4,8* 51,3±19,8 |
| ІСЗ (сироватка крові) ІЗР (супернатант МНК) |
7,7±1,6 6,7±2,3 |
59,4±9,6* 29,6±4,4* |
127,6±18,3*22,8±6,4* |
| РБТЛ до антигену ПШЗ, % | 1,5±0,6 | 4,7±0,5* | 6,8±1,0* |
| ААТ до антигену ПШЗ, ум. од. | 2,7±1,2 | 14,5±1,0* | 18,0±1,2* |
Нами встановлено взаємозв’язки рівнів прозапальних цитокінів (ФНП-α, ІЛ-6) у сироватці крові із проявами аутоімунізації (високий рівень сенсибілізованих лімфоцитів та аутоантитіл до антигену із тканин ПШЗ), які посилюють системне запалення та розвиток імунозапального процесу у пацієнтів із ХСН та ІР (рис. 2).
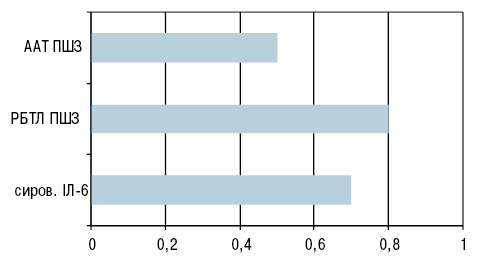
При бальному оцінюванні факторів системного запалення нами встановлена більш активна реакція у групі хворих з індексом НОМА ≥2,77 (див. табл. 6).
| Показник | Системне запалення | Імунне запалення | ||
|---|---|---|---|---|
| НОМА | ||||
| <2,77 | ≥2,77 | <2,77 | ≥2,77 | |
| ФНП-α, пг/мл | 2 | 6 | 5 | 5 |
| ІЛ-6, пг/мл | 7 | 13 | 5 | 4 |
| ІЛ-10, пг/мл | 7 | 10 | Норма | Норма |
| Індекс запалення | 9 | 17 | 6 | 5 |
| Усього балів | 25 | 46 | 16 | 14 |
У групах пацієнтів з ІР та без неї нами встановлена активна імунозапальна реакція, яка виражалася в інтенсивній секреції МНК ФНП-α та ІЛ-6 порівняно з контрольною групою, але вірогідної відмінності між 1-ю та 2-ю групами хворих не виявлено (див. табл. 5). За сукупністю факторів імунозапальної реакції загальна сума балів становила відповідно у групі пацієнтів із ХСН з ІР 14 балів, без ІР — 16 балів (див. табл. 6).
Як видно (див. табл. 5), у пацієнтів із ХСН виявлено ознаки аутоімунізації, які мали більш виражений характер у пацієнтів з ІР. У осіб 2-ї групи поряд зі значною аутосенсибілізацією лімфоцитів до тканини ПШЗ також виявлено високий вміст ААТ до цього антигену, який вірогідно відрізнявся як від показників групи донорів, так і від 1-ї групи. Прояви аутоімунізації у цих хворих реалізовувались як за клітинним, так і за гуморальним типами. У балах це виражалося у 1-й групі — 10 балів, у 2-й — 14 (табл. 7).
| Показник | НОМА | |
|---|---|---|
| <2,77 | ≥2,77 | |
| РБТЛ до антигену ПШЗ | 4 | 6 |
| ААТ до антигену ПШЗ | 6 | 8 |
| Усього балів | 10 | 14 |
ВИСНОВКИ
1. Пацієнтам із ХСН притаманні прояви імунопатологічних реакцій у вигляді як системного, так і імунного запалення з ознаками аутоімунізації.
2. Високий ступінь системного запалення у пацієнтів із ХСН та супутньою ІР залежить від секреторної здатності клітин крові та функціонального стану адипоцитів.
3. Незалежно від наявності феномену ІР у пацієнтів із ХСН виявлено активну імунозапальну реакцію.
4. Ознаки аутоімунізації мали більш виражений характер у пацієнтів із ХСН з ІР, в яких сенсибілізація лімфоцитів до антигену із тканин ПШЗ та рівень аутоантитіл вірогідно відрізнялися від таких у групі хворих без ІР та від практично здорових осіб.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- 1. Воронков Л.Г., Ільницька М.Р., Гавриленко Т.І. та ін. (2014) Стан гормонів жирової тканини, циркулюючого фактора некрозу пухлин-α та показників ліпідного обміну залежено від наявності інсулінорезистентності в пацієнтів з хронічною серцевою недостатністю і систолічною дисфункцією лівого шлуночка. Укр. кардіол. журн., 5: 80–87.
- 2. Мітченко О.І., Корпачов В.В. (2009) Робоча група з проблем метаболічного синдрому, цукрового діабету, предіабету і серцево-судинних захворювань. Українська асоціація кардіологів, Українська асоціація ендокринологів. Діагностика і лікування метаболічного синдрому, цукрового діабету, предіабету і серцево-судинних захворювань. Метод. рекомендації. Київ, 42 с.
- 3. Васюк Ю.А., Дударенко О.П., Ющук Е.Н. и др. (2006) «Цитокиновая» модель патогенеза хронической сердечной недостаточности и возможности нового терапевтического подхода в лечении декомпенсированных больных. Рацион. фармакотер. кардиолог., 4: 63–70.
- 4. Земсков В.М., Земсков А.М. (1996) Принципы дифференцировки иммунокоррекции. Иммунология, 3: 4–6.
- 5. Кобалава Ж.Д., Виллевальде С.В., Исикова Х.В. (2009) Роль адипонектина в развитии и прогрессировании сердечно-сосудистых заболеваний. Кардиология, 49(1): 51–58.
- 6. Мазуров В.И., Лила А.М., Шелухин В.А. (1991) Продукция интерлейкина-2 мононуклеарными клетками периферической крови у больных ревматоидным артритом. Клин. медицина, 3: 89–90.
- 7. Митченко Е.И., Романов В.Ю., Яновська К.О. и др. (2012) Индекс лептин/адипонектин как дополнительный суррогатный маркер атеросклеротического повреждения. Укр. кадіол. журн., 2: 40–47.
- 8. Осипова О.А., Суязова С.Б., Власенко М.А., Годлевская О.М. (2013) Роль провоспалительных цитокинов в развитии хронической сердечной недостаточности. Рос. медико-биол. вестн. им. акад. И.П. Павлова, 2: 130–135.
- 9. Парахонский А.П. (2011) Роль интерлейкина-6 в развитии инсулинорезистентности. Успехи современ. естествознан., 1: 105–106.
- 10. Серик С.А., Ченчик Т.А., Сердобинская-Канивец Э.Н., Бондарь Т.Н.(2012) Интерлейкин-10 и про-/противовоспалительный цитокиновый баланс при сердечной недостаточности у больных сахарным диабетом 2 типа. Укр. терапевт. журн., 3–4: 58–63.
- 11. Стефани Д.Ф., Вельтищев Ю.Е. (1996) Клиническая иммунология и иммунопатология детского возраста. Медицина, Москва, 372 с.
- 12. Хаитов Р.М., Пинегин Б.В., Ярилин А.А. (2009) Руководство по клинической иммунологии. Диагностика заболеваний иммунной системы: Руковод. для врачей. ГЭОТАР, Медиа, Москва, 352 с.
- 13. Чернушенко Е.Ф. (2007) Аутоиммунизация и ее клиническое значение. Мистецтво лікування, 6: 53–57.
- 14. Чернушенко Е.Ф. (1985) Методы выявления аутоиммунизации. В кн.: Е.Ф.Чернушенко (ред.) Аутоиммунные процессы и их роль в клинике внутренних болезней. Здоров’я, Київ, с. 150–151.
- 15. Шварц В. (2009) Регуляция метаболических процессов интерлейкином-6. Цитокины и воспаление, 8(3): 3–10.
- 16. Amir O., Rogowski J., David M. et al. (2010) Circulating interleukin-10: association with higher mortality in systolic heart failure patients with elevated tumor necrosis factor-alpha. Isr. Med. Assoc. J., 12(3): 158–162.
- 17. Askevold E.T., Gullestad L., Dahi C.P. et al. (2014) Interleukin-6 signaling, solube glycoprotein 130, and inflammation in heart failure. Curr. Heart Fail. Rep., 11(2): 146–155.
- 18. Gullestad L., Ueland T., Vinge L.E. et al. (2012) Inflammatory cytokines in heart failure: mediators and markers. Cardiology, 122(1): 23–35.
- 19. Hedayat M., Mahmoudi M.J., Rose N.R., Rezaei N. (2010) Proinflammatory cytokines in heart failure: double-edged swords. Heart Fail. Rev., 15(6): 543–562.
- 20. Hyvönen M.T., Spalding R.L. (2014) Maintenance of white adipose tissue in man. Int. J. Biochem. Cell Biol., 56: 123–132.
- 21. Jug B., Salobir B.G., Vene N. et al. (2009) Interleukin-6 is a stronger prognostic predictor than high-sensitive C-reactive protein in patients with chronic stable heart failure. Heart Vessels, 24(4): 271–276.
- 22. Kalogeropoulos A.P., Georgiopoulou V.V., Butler J. (2012) From risk factors to structual heart disease: the role of inflammation. Heart Fail. Clin. 8(1): 113–123.
- 23. Krook A. (2008) IL-6 and metabolism — new evidence and new questions. Diabetologia, 51: 1097–1099.
- 24. Kyriazi E., Tsiotra P.C., Boutati E. (2011) Effects of adiponectin in TNF-α, IL-6, and IL-10 cytokine production from coronary artery disease macrophages. Horm. Metab. Res., 43(8): 537–544.
- 25. Saraiva M., O’Garra A. (2010) The regulation of IL-10 production by immune cells. Nat. Rev. Immunol., 10(3): 170–181.
- 26. Sinagra E., Perricone G., Romano C., Cottone M. (2013) Heart failure and anti tumor necrosis factor-alpha in systemic chronic inflammatory diseases. Eur. J. Intern. Med., 24(5): 385–392.
- 27. Yin W.H., Wei J., Huang W.P. et al. (2012) Prognostic value of circulating adipokine levels and expression of adipokines in the myocardium of patients with chronic heart failure. Circ. J., 76(9): 2139–2147.
Адреса для листування:
Якушко Людмила Василівна
03680, Київ, вул. Народного ополчення, 5
ДУ «ННЦ «Інститут кардіології
ім. М.Д. Стражеска НАМН України»,
відділ імунології
E-mail: medlabref08@mail.ru

Leave a comment