ЗМІНИ МЕТАБОЛІЗМУ ЛІПІДІВ І ПРОЦЕСІВ ЇХ ПЕРЕКИСНОГО ОКИСНЕННЯ ПРИ ХРОНІЧНІЙ РЕВМАТИЧНІЙ ХВОРОБІ СЕРЦЯ
Резюме. Резюме. Вивчали роль змін обміну ліпідів, їх перекисного окиснення (ПОЛ) та системи антиоксидантного захисту (АОЗ) у патогенетичних побудовах хронічної ревматичної хвороби серця (ХРХС). Біохімічними, імуноферментними, фізико-хімічними, атомно-абсорбційними та інструментальними методами обстежено 105 осіб із ХРХС. При ХРХС відзначають значні порушення ліпідного обміну у бік атерогенних складових, посилення процесів ПОЛ і послаблення системи АОЗ, показники яких залежать від клінічного перебігу захворювання, корелюють із параметрами адсорбційно-реологічних властивостей крові, ендотеліальної функції судин, кардіопротекторних і кардіотоксичних мікроелементів. Встановлено: зміни ліпідного обміну, ПОЛ і АОЗ беруть участь при ХРБС у патогенезі порушень збудливості міокарда, електричної провідності серця, збільшення розмірів його камер, респіраторних функцій та розвитку легеневої гіпертензії.
Введение
Хроническая ревматическая болезнь сердца (ХРБС) продолжает занимать ведущие позиции среди наиболее актуальных проблем современной медицины (Saikia U.N. et al., 2011; Коваленко В.М., 2012). Ревматические пороки сердца являются одной из наиболее частых кардиальных патологий (Birincioglu C.L. et al., 2014), а при снижении распространенности ревматизма в ряде европейских государств наблюдается увеличение численности ХРБС среди населения многих развивающихся стран (Saxena A. et al., 2012; Boudoulas K.D. et al., 2013). Существует четкая связь появления заболевания с социально-экономическими факторами (Joseph N. et al., 2013; Viali S., 2014). В процессе обследования практически здоровых детей и подростков ревматические пороки сердца выявлены в 1% случаев (Ba-Saddik I.A. et al., 2011), причем последующая распространенность ХРБС у взрослых людей в 2 раза выше (Paar J.A. et al., 2010).
В патогенезе ХРБС участвуют сдвиги адсорбционно-реологических свойств крови и эндотелиальной функции сосудов, тесно связанные с состоянием в организме липидного метаболизма, с процессами перекисного окисления липидов (ПОЛ) и системой антиоксидантной защиты (АОЗ) (Думанский Ю.В. (ред.), 2011; Синяченко О.В. (ред.), 2011), но подобные сопоставления у такой категории больных не проводились, к тому же требует уточнения значимость изменений обмена липидов, ПОЛ и АОЗ в патогенетических построениях ХРБС, в частности нарушений гемодинамики в малом круге кровообращения, вентиляционной, влаговыделительной кондиционирующей, диффузионной и сурфактантобразующей функций легких. Это стало целью и задачами данной работы.
Объект и методы исследования
Под наблюдением находились 105 больных ХРБС в возрасте от 15 до 60 лет (в среднем — 40±1,2 года). Среди обследованных — 28% мужчин и 72% женщин. Длительность выявленного порока сердца в среднем составила 17±1,2 года. Митральная недостаточность (МН) установлена у 96% больных, митральный стеноз (МС) — у 48%, аортальная недостаточность (АН) — у 63%, аортальный стеноз (АС) — у 11%, трикуспидальная недостаточность (ТН) — у 12%. Частота комбинаций отдельных пороков сердца была следующей: изолированная АН, АН + ТН, АН + ТН + МН имели место в 2% наблюдений, МН и МН + МС + АН — в 21%, МН + АН — в 17%, МН + МС — в 15%, МН + АН + АС — в 9%, МН + МС + АН + ТН — в 6%, МН + МС + АН + АС — в 4%, МН + ТН и МН + АН + АС + ТН — в 1%. Индекс прогрессирования болезни составил 8±0,9 о.е., который определяли по формуле:
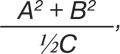
где А — функциональный класс сердечной недостаточности (ФКСН), В — сумма клинических проявлений ХРБС — нарушений возбудимости, проводимости, изменений камер сердца и т.п. (всего 20 электро- и эхокардиографических параметров), С — установленная (манифестная) длительность порока сердца. III ФКСН у женщин выявлен в 3,8 раза чаще, чем у мужчин, а фракция выброса крови левым желудочком сердца была у них на 8% меньше. У 43% больных выполнена хирургическая коррекция порока сердца, в том числе протезирование митрального клапана — у 27% из них, аортального — у 33%, митральная комиссуротомия — у 40%.
Пациентам выполняли электрокардиографию (аппараты «МІДАК-ЕК1Т», Украина; «Bioset-8000», Германия), эхокардиографию (аппараты «Acuson-Aspen-Siemens», Германия; «Еnvisor C-Philips», Нидерланды; «HD-11-XE-Philips», Нидерланды; «SSA-270A-Toshiba», Япония), холтеровское мониторирование (аппарат «Кардиотехника-04–08», Россия). Спирографическое исследование проводили на аппарате «Master-Scope-Jaeger» (Германия), исследование диффузионной способности легких — на «Master-Screen-Body-Jaeger» (Германия). Кондиционирующую функцию дыхательного аппарата оценивали пневмотермоколориметрически. Определяли скорость респираторного влаговыделения, поверхностно-активные, релаксационные и вязкоэластичные свойства экспиратов (аппарат «ADSA-Toronto», Германия — Канада), характеризующие сурфактантобразующую способность легких.
Используя биохимический анализатор «Olympus-AU-640» (Япония), в сыворотке крови изучали показатели общих липидов (ОЛ), фосфолипидов (ФЛ), холестерина (ХС), триглицеридов (ТГ), липопротеидов высокой (ЛПВП) и низкой плотности (ЛПНП), аполипопротеидов А1 и В (Апо-А1, Апо-В), ферритина (Фер), глутатиона (ГТ) и церулоплазмина (ЦП). Параметры диеновых конъюгатов (ДК),
малонового диальдегида (МД), α-токоферола (ТФ), активности ксантиноксидазы (КО), супероксиддисмутазы (СОД) и каталазы (Кат) исследовали спектрофотометрически («СФ-46», Россия), а активность глутатионпероксидазы (ГТПО) в гепаринизированной крови — колориметрическим методом с использованием наборов «Ransel-Randox» (Великобритания). Иммуноферментным методом в плазме крови изучали показатели эндотелиальной функции сосудов — уровни эндотелина-1, тромбоксана-А2, простациклина, циклического гуанозинмонофосфата, Р-селектина, Е-селектина и гомоцистеина (ридер «PR2100 Sanofi diagnostic pasteur», Франция). В контексте оценки адсорбционно-реологических свойств крови оценивали объемную вязкость плазмы крови с помощью ротационного вискозиметра «Low-Shear-30» (Швейцария), проводили межфазную тензиореометрию сыворотки крови с использованием компьютерного аппарата «ADSA-Toronto» (Германия — Канада). При этом изучали модуль вязкоэластичности, поверхностную релаксацию и поверхностное натяжение крови. С помощью метода атомно-абсорбционной спектрометрии с электрографитовым атомизатором (аппарат «SolAAr-Mk2-MOZe», Великобритания) в сыворотке крови изучали содержание кардиопротекторных (Cu, Zn) и кардиотоксичных (Cd, Co, Pb) микроэлементов.
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного, непараметрического, корреляционного, регрессионного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы «Microsoft Excel» и «Statistica-Stat-Soft», США). Оценивали средние значения (M), их стандартные ошибки (m), стандартные отклонения (SD), коэффициенты корреляции, критерии дисперсии, множественной регрессии, Стьюдента, Уилкоксона — Рао, Макнемара — Фишера и достоверность статистических показателей.
Результаты исследования
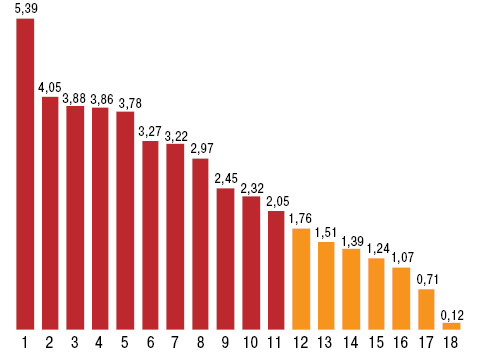
У пациентов с ХРБС уровень ОЛ составляет 4,8±0,15 ммоль/л, ФЛ — 3,6±0,13 ммоль/л, ХС — 5,0±0,11 ммоль/л, ТГ — 2,0±0,13 ммоль/л, ЛПВП — 0,5±0,02 ммоль/л, ЛПНП — 0,7±0,02 ммоль/л, Апо-А1 — 1,1±0,05 г/л, Апо-В — 1,1±0,04 г/л, ДК — 5,7±0,12 Е/мл, МД — 9,6±0,21 мкмоль/л/час, КО — 5,1±0,20 мкмоль/л/мин, Фер — 95,0±6,44 мкг/мл, ТФ — 5,9±0,13, ЦП — 355,9±14,36 мг/л, ГТ — 922,2±74,00 мг/л, ГТПО — 59,7±0,79 у.е., СОД — 76,2±2,76 Е/мг, Кат — 22,4±0,77 мкат/л. По сравнению со здоровыми людьми контрольной группы (рис. 1), наблюдается достоверное повышение содержания ХС на 14%, ТГ — на 67%, ЛПНП — на 75%, ДК — на 33%, МД —на 32%, активности КО — на 82% и параметров Фер — в 2,1 раза при снижении концентрации ФЛ на 32%, ЛПВП — на 37%, Апо-А1 — на 31%, ТФ — на 19%, ЦП — на 35%, активности ГТПО — на 13%, СОД — на 27% и Кат — на 31%, что соответственно установлено (больше или меньше M±SD здоровых) в 43% наблюдений, в 45; 91; 71; 73; 78; 76; 87; 34; 70; 72; 74; 77; 75 и 74% (рис. 2). Отметим, что показатели ОЛ, Апо-В и ГТ не отличались от аналогичных в контроле.
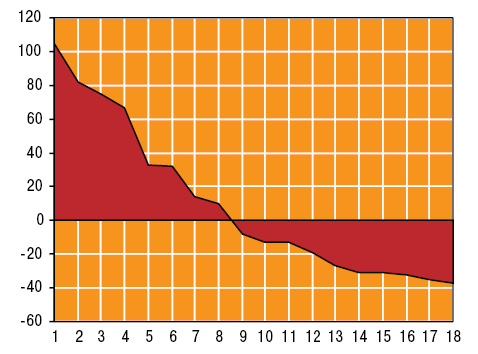
1 — Фер, 2 — КО, 3 — ЛПНП, 4 — ТГ, 5 — ДК, 6 — МД, 7 — ХС, 8 — Апо-В, 9 — ОЛ, 10 — ГТ, 11 — ГТПО, 12 — ТФ, 13 — СОД, 14 — Кат, 15 — Апо-А1, 16 — ФЛ, 17 — ЦП, 18 — ЛПВП.
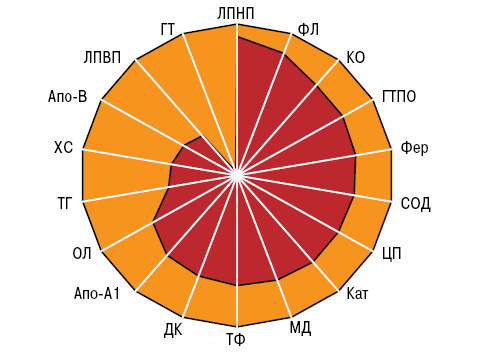
По данным ANOVA/MANOVA, пол больных ХРБС не оказывает влияния на интегральное состояние липидного обмена, ПОЛ + АОЗ. Многофакторный дисперсионный анализ Уилкоксона — Рао демонстрирует воздействие на параметры липидного обмена наличия у пациентов МС, на ПОЛ + АОЗ — МС и АС. Кроме того, интегральное состояние липидного обмена зависит от количества пороков на одного больного, выполненных в прошлом оперативных вмешательств на сердце и ФКСН.
Как свидетельствует ANOVA/MANOVA, липидный обмен при ХРБС тесно связан с наличием у больных фибрилляции/трепетания предсердий, с выраженностью фиброзирования митрального и трикуспидального клапанов, с массой миокарда левого желудочка и с размером полости правого желудочка. На интегральное состояние ПОЛ + АОЗ влияют степень гипертрофии левого предсердия и дилатации полости правого желудочка.
Обсуждение результатов
В патогенезе развития ТН нарушения липидного обмена, ПОЛ + АОЗ не участвуют, что демонстрирует ANOVA. В свою очередь, содержание в крови ХС оказывает влияние на формирование АН, ХС и ОЛ — МН, ХС, ОЛ, ТГ, ЛПНП, ДК и активность СОД — МС, ГТ — АС. Общий характер изолированного, комбинированного и сочетанного порока сердца зависит от показателей ХС, ТГ, ГТПО и СОД, а количество пороков на одного больного — только от содержания в крови ХС и ТГ. ФКСН тесно связан с уровнями Апо-В, ДК и СОД, фракция выброса крови левым желудочком сердца — с ГТ, ЦП и активностью Кат, индекс прогрессирования ХРБС — с Апо-А1. В формировании нарушений возбудимости миокарда и электрической проводимости сердца участвуют ХС, ЛПНП, ДК, Фер и КО, в процессах фиброзирования клапанного аппарата — ХС и ТГ. Результаты дисперсионного анализа свидетельствуют об отсутствии связей с отдельными составляющими течения ХРБС таких показателей, как ФЛ, ТФ, ГТПО и Кат. Вместе с тем наличие у больных МС оказывает воздействие на уровни ОЛ, ХС, ТГ и ДК, АС — ХС, ТГ, МД и активность, число пороков у одного пациента — на параметры ОЛ, ТГ и ГТ, характер порока сердца — на активность КО и концентрацию Фер, ФКСН — на значения ОЛ, ХС, Апо-В, ДК, Фер и ЦП, темпы прогрессирования порока — на ХС, Апо-А1 и СОД (рис. 3).
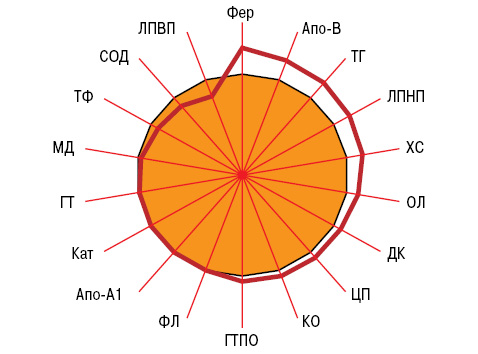
Однофакторный дисперсионный анализ не выявил влияния параметров липидного обмена и ПОЛ + АОЗ на показатели вентиляционной, диффузионной, влаговыделительной, кондиционирующей и сурфактантобразующей функций легких у больных ХРБС. Вместе с тем систолическое давление в легочной артерии зависит от содержания в крови атерогенных ХС, ТГ и ЛПНП, диастолическое давление — от антиатерогенных Апо-А1, легочное сосудистое сопротивление — от значений Апо-В, ДК и МД. Размер передней стенки правого желудочка и конечно-диастолического размера правого желудочка в диастолу тесно связаны с уровнями ХС, ФЛ, Фер и c активностью антиоксидантного фермента СОД, резерв вдоха и жизненная емкость легких с ФЛ, объем форсированного выдоха за 1-ю секунду — с активностью прооксидантной КО. На показатели диффузионной способности легких оказывает достоверное воздействие ЦП, на параметры кондиционирующей функции — ДК, МД, ТФ и ЦП, на скорость респираторного влаговыделения — ХС и Апо-В, на вязкоэластичные свойства конденсата влаги выдыхаемого воздуха — значения триглицеридемии, на поверхностно-активные свойства экспиратов — активность Кат, на релаксационные — СОД (рис. 4).
1 — ГТПО, 2 — ЛПНП, 3 — ДК, 4 — ХС, 5 — МД, 6 — Кат, 7 — ОЛ, 8 — ТФ, 9 — ФЛ, 10 — СОД, 11 — ТГ, 12 — Апо-В, 13 — Фер, 14 — ЛПВП, 15 — Апо-А1, 16 — КО, 17 — ЦП, 18 — ГТ.
С учетом выполненного вариационного, корреляционного, регрессионного и дисперсионного анализа сделаны некоторые практические рекомендации (учитывали M±SD показателей у больных). Прогнознегативными критериями являются в отношении: 1) легочной гипертензии — показатели ХС >6 ммоль/л + ЛПНП >850 мкмоль/л; 2) вентиляционных нарушений — показатели ФЛ <5 ммоль/л + КО >4 мкмоль/л; 3) увеличения размеров правого желудочка сердца — показатели ХС >6 ммоль/л + СОД <100 Е/мг; 4) нарушений влаговыделительной функции легких — показатели Апо-В >1300 мг/л и Фер >50 мкг/мл; 5) нарушений кондиционирующей функции — показатели ТГ >1500 мкмоль/л + ЦП <500 мг/л; 6) нарушений диффузионной способности легких — показатели ЦП 500 мг/л + СОД <100 Е/мл.
Следующим этапом нашей работы стали корреляционные сопоставления показателей липидного обмена и ПОЛ + АОЗ при ХРБС с параметрами адсорбционно-реологических свойств крови, эндотелиальной функции сосудов и микроэлементного статуса. Оказалось, что уровни в крови ОЛ и ХС прямо, а активность ГТПО — обратно коррелируют с объемной вязкостью крови. Релаксационные свойства сыворотки крови позитивно соотносятся с содержанием Апо-А1, которые, в свою очередь, разнонаправленно коррелируют с Е-селектином и гомоцистеином. С Апо-В имеeт прямые корреляционные связи, а с уровнем Фер — обратные концентрации Р-селектина. С межфазной активностью сыворотки крови, когда поверхностное натяжение приближается к равновесию, коррелируют концентрации ЛПВП и МД, с содержанием циклического гуанозинмонофосфата — ХС, Фер и ГТ, с эндотелином-1 — ТГ и активность СОД, с эндотелиальным сосудистым фактором роста — параметры ХС, ГТ и активность Кат. Уровень нитритемии имеет позитивные корреляции с концентрацией МД. Антиоксидантная ГТПО прямо соотносится с уровнем кардиопротекторных микроэлементов Cu и Zn в крови, ЛПНП — с кардиотоксичными Cd и Со, ТФ — с Pb. Таким образом, атерогенные липиды при ХРБС в основном имеют прямые связи с гипервискозными свойствами крови, вазоконстрикторными составляющими эндотелиальной дисфункции сосудов (ЭДС) и кардиотоксичными микроэлементами, а антиатерогенные жиры и факторы системы АОЗ — с вазодилататорами и кардиопротекторными микроэлементами.
Как известно, ЛПНП участвуют в развитии ЭДС на начальных этапах кардиальной патологии, стимулируя продукцию молекул клеточной адгезии, хемокинов и факторов роста, увеличивая пролиферацию гладкомышечных клеток и вызывая вазотромбозы (Фуштей И.М. и соавт., 2007). Фермент пуринового обмена КО как мощный оксидант способствует развитию у больных ЭДС, чему препятствует стимуляция в организме активности антиоксидантных энзимов СОД и Кат (Ishihara Y. et al., 2011). При ХРБС усиленный синтез в тканях сердца провоспалительных цитокинов изменяет состояние аденозиновых рецепторов и стимулирует активацию КО (Zhang C. et al., 2012). 8-Циклопентил-1,3-дипропилксантин значительно усиливает чувствительность аденозиновых рецепторов, а 3,7-диметил-1-пропаргилксантин определяет аденилатциклазный путь в эндотелиоцитах сосудов (Sato A. et al., 2015). Известно, что ингибиторы КО способствуют протекции систолической и диастолической дисфункции левого желудочка сердца (Mellin V. et al., 2009). В условиях оксидативного стресса сердце при ревматических пороках возвращается к аэробному дыханию и таким образом еще больше генерирует токсичные кислородные радикалы, замыкая порочный круг (Shohet R.V., Garcia J.A., 2011). На мышах линий С57В1/6 и LDLR и пациентов с ХРБС показано, что оксидативный стресс способствует развитию и прогрессированию ЭДС (Ketonen J., Mervaala E., 2008; Guazzi M., Arena R., 2009).
Выводы
Таким образом, при ХРБС наблюдаются значительные нарушения липидного обмена в сторону атерогенных составляющих, усиления процессов ПОЛ и ослабления системы АОЗ, показатели которых зависят от клинического течения заболевания (характер порока сердца, темпы его прогрессирования, ФКСН), участвуют в патогенезе нарушений возбудимости миокарда, электрической проводимости сердца, увеличения размеров его камер, коррелируют с параметрами адсорбционно-реологических свойств крови (объемная вязкость, поверхностная межфазная активность), эндотелиальной функции сосудов, кардиопротекторными и кардиотоксичными микроэлементами (Cu, Zn, Cd, Co, Pb). Патогенез легочной гипертензии при ХРБС тесно связан с гиперпродукцией атерогенных ХС и ЛПНП, нарушения вентиляционной функции легких — с содержанием в крови ФЛ и с активностью прооксидантной КО, влаговыделительной — с показателями ХС, Апо-В и Фер, кондиционирующей — с ТГ, ДСЛ — с ЦП и активностью СОД, причем эти параметры имеют прогностическую значимость.
Список использованной литературы
- Думанский Ю.В. (ред.) (2011) Физико-химические адсорбционно-реологические исследования в медицине. Донеччина, Донецк, 480 с.
- Коваленко В.М. (2012) Ревматичні захворювання в Україні: стан проблеми та шляхи вирішення. Укр. ревматол. журн., 49(3): 5–9.
- Синяченко О.В. (ред.) (2011) Адсорбционно-реологические свойства биологических жидкостей в ревматологии. Донеччина, Донецк, 286 с.
- Фуштей И.М., Подсевахина С.Л., Ткаченко О.В.и др. (2007) Иммунологические аспекты развития эндотелиальной дисфункции у больных ишемической болезнью сердца и определение роли факторов риска в их формировании. Внутр. мед., 4: 57–61.
- Ba-Saddik I.A., Munibari A.A., Al-Naqeeb M.S. et al. (2011) Prevalence of rheumatic heart disease among school-children in Aden, Yemen. Ann. Trop. Paediatr., 31(1): 37–46.
- Birincioglu C.L., Unal E.U., Celik I.H. et al. (2014) Surgery for rheumatic valve disease in pregnancy: what about the newborn? Heart Lung Circ., 23(1): 63–67.
- Boudoulas K.D., Ravi Y., Garcia D. et al. (2013) Type of valvular heart disease requiring surgery in the 21 century: Mortality and length-of-stay related to surgery. Open Cardiovasc. Med. J., 4(7): 104–109.
- Guazzi M., Arena R. (2009) Endothelial dysfunction and pathophysiological correlates in atrial fibrillation. Heart, 95(2): 102–106.
- Ishihara Y., Sekine M., Hatano A. et al. (2011) Sustained contraction and endothelial dysfunction induced by reactive oxygen species in porcine coronary artery. Biol. Pharm. Bull., 31(9): 1667–1672.
- Joseph N., Madi D., Kumar G.S. et al. (2013) Clinical spectrum of rheumatic Fever and rheumatic heart disease: a 10 year experience in an urban area of South India. N. Am. J. Med. Sci., 5(11): 647–652.
- Ketonen J., Mervaala E. (2008) Effects of dietary sodium on reactive oxygen species formation and endothelial dysfunction in low-density lipoprotein receptor-deficient mice on high-fat diet. Heart Vessels, 23(6): 420–429.
- Mellin V., Isabelle M., Oudot A. et al. (2009) Transient reduction in myocardial free oxygen radical levels is involved in the improved cardiac function and structure after long-term allopurinol treatment initiated in established chronic heart failure. Eur. Heart J., 26(15): 1544–1550.
- Paar J.A., Berrios N.M., Rose J.D. et al. (2010) Prevalence of rheumatic heart disease in children and young adults in Nicaragua. Am. J. Cardiol., 105(12): 1809–1814.
- Saikia U.N., Kumar R.M., Pandian V.K. et al. (2011) Adhesion molecule expression and ventricular remodeling in chronic rheumatic heart disease: a cause or effect in the disease progression — a pilot study. Cardiovasc. Pathol., 13(10): 55–62.
- Sato A., Terata K., Miura H. et al. (2015) Mechanism of vasodilation to adenosine in coronary arterioles from patients with heart disease. Am. J. Physiol. Heart Circ. Physiol., 288(4): 1633–1640.
- Saxena A. (2012) Strategies for the improvement of cardiac care services in developing countries: what does the future hold? Future Cardiol., 8(1): 29–38.
- Shohet R.V., Garcia J.A. (2011) Keeping the engine primed: HIF factors as key regulators of cardiac metabolism and angiogenesis during ischemia. J. Mol. Med., 85(12): 1309–1315.
- Viali S. (2014) Rheumatic heart disease in Samoa and the pacific nations. J. Prim. Health Care., 6(1): 84–85
- Zhang C., Hein T.W., Wang W. et al. (2012) Activation of JNK and xanthine oxidase by TNF-alpha impairs nitric oxide-mediated dilation of coronary arterioles. J. Mol. Cell. Cardiol., 40(2): 247–257.
Адрес для переписки:
Такташов Гемадий Саитович
84404, Красный Лиман, ул. Кирова, 27
Донецкий национальный медицинский
университет им. Максима Горького,
кафедра внутренней медицины № 1
Е-mail: doc-tgs@yandex.ru

Leave a comment