ПЕРЕКИСНЕ ОКИСнЕННЯ ЛІПІДІВ: ПРОТИРІЧЧЯ ПРОБЛЕМИ
Казимирко В.К., Иваницкая Л.Н. , Кутовой В.В., Дубкова А.Г. , Силантьева Т.С.
Резюме. Резюме. Уявлення про перекисне окиснення ліпідів (ПОЛ), що в основному базуються на дослідженнях in vitro, не відповідають вимогам, які ставляться для визнання існування метаболічного процесу чи метаболічного шляху. Відсутні критерії, методологічні підходи, які дозволяють визначити параметри вираженості ПОЛ in vivo. Наявність у крові фізіологічного (фонового) рівня малонового діальдегіду, дієнових кон’югатів, інших продуктів ПОЛ свідчить про існування чіткого контролю за окисненням ліпідів з боку ієрархічної системи регуляції та на завершення — ДНК. Тому твердження про існування у клітинах неконтрольованих вільнорадикальних реакцій у великих масштабах є необґрунтованим. При деяких захворюваннях самоокиснення може мати місце, викликаючи утворення в ряді тканин аномальних ліпідних включень.
За несколько десятков лет, прошедших с момента появления концепции перекисного окисления липидов (ПОЛ), она так и не подтверждена практикой, являющейся критерием истинности науки. Возникает ряд вопросов, требующих ответа. Если этот феномен так важен, например для развития атеросклероза (как утверждают авторы), то почему антиоксиданты не предупреждают, не останавливают патологический процесс, а в то же время меры по снижению уровня холестерина в крови являются эффективными? В каких исследованиях in vivo подтверждены «лавинообразные», «цепные» разрушения клеточных мембран в процессе ПОЛ? Как могут существовать нормальные показатели продуктов ПОЛ в крови при хаотическом процессе? Возможны ли такие разрушительные не подконтрольные ДНК процессы в клетке, организме вообще? Почему распространенные представления о ПОЛ не соответствуют современным биохимическим требованиям для заключения о подлинности существования изучаемого метаболического процесса в организме? Нужно ли витамины Е, С, А (бета-каротин) именовать антиоксидантными? Ведь они имеют большое количество других не менее важных биологических функций, а их дефицит приводит к нарушениям различных видов обмена в организме. Эти факты, а также, что самое важное, — отсутствие эффекта от применения антиоксидантов при различных заболеваниях (например при атеросклерозе) и не редко возникновение антиэффекта, требуют переосмысления теории ПОЛ [1, 2]. Многие положения теории ПОЛ вступают в противоречие с фундаментальными законами биохимии. Возникает, в частности, вопрос, как выражена степень реакций ПОЛ в детском возрасте, когда преобладают анаболические процессы, или в среднем возрасте, в условиях практического равновесия анаболической и катаболической фаз метаболизма. Ответ на эти вопросы в литературе отсутствует. Для суждения о степени изменений ПОЛ клиницисты часто определяют в крови диеновые конъюгаты и малоновый диальдегид. При этом дают нормативы этих показателей, что противоречит самой концепции, поскольку существование нормальных параметров процесса свидетельствует о его генетической обусловленности, а не стихийности.
Реакции окисления происходят в клетке в соответствующих структурах: митохондриях, эндоплазматическом ретикулуме (микросомальное окисление). В митохондриях в цепи переноса электронов возможно неполное восстановление кислорода и образование перекиси водорода, супероксидного радикала [3]. Образование активных форм кислорода (АФК) в митохондриях, по мнению А. Ленинджера, является нормальным физиологическим явлением, что, однако, требует объяснения предназначения и биологической целесообразности этого процесса. (В фагоцитах «дыхательный взрыв» играет важную роль в обезвреживании бактерий и разрушении неинфекционного материала). Уменьшение движения потока электронов по окислительно-восстановительной цепи митохондрий приводит к уменьшению образования АФК. АФК постоянно производятся при взаимодействии кислорода с коферментами флавиновых ферментов. Они образуются в эндоплазматическом ретикулуме в коротких цепях переноса электронов. В цикле реакций микросомального окисления с участием цитохрома Р450 в качестве промежуточных продуктов возникают супероксидные радикалы и перекись водорода. Супероксид образуется и в других электронно-транспортных клеточных системах. Образование АФК происходит под действием ионизирующего и ультрафиолетового излучения, гипербарической оксигенации, токсических веществ [4]. В пероксисомах продуцируется перекись водорода, которая эффективно обезвреживается. Перекись водорода может восстановиться супероксидом с образованием гидроксильного радикала. Гидроксильный радикал, взаимодействуя с супероксидом, может образовать синглетный кислород, хотя течение этой реакции in vivo не доказано [5]. Считают [6], что синглетный кислород в обычных биологических условиях организма не играет существенной роли. Благодаря тому, что ферменты, образующие перекись водорода, и каталаза локализованы внутри пероксисом, остальное содержимое клетки защищено от разрушающего воздействия перекиси. Все АФК нестабильны и короткоживущие.
В соответствии с концепцией, образующиеся свободные радикалы инициируют так называемое ПОЛ — свободнорадикальное окисление ненасыщенных жирных кислот (НЖК) в биомембранах, приводящее к образованию гидроперекисей липидов. Следствием предполагаемых цепных реакций является возрастание продуктов ПОЛ, способных вызывать нарушение структуры различных биосубстратов и тем самым повреждать белки и липиды биомембран, инактивировать ферменты, изменять строение макромолекул, целостность клетки и внутриклеточных органелл. Таким образом, постулируется некая глобальная система окисления, возможная во всех клеточных образованиях, содержащих в своем составе НЖК, хаотический процесс, в основе которого лежат «цепные, лавинообразные» реакции. И в то же время приводятся нормы промежуточных продуктов ПОЛ — например малонового диальдегида, диеновых конъюгатов, других продуктов. Возникает первое противоречие: внутриклеточный хаос, разрушительный процесс генетически запрограммирован, что противоречит биологическим законам. В качестве второго противоречия можно отметить, что ПОЛ как системное явление не соответствует требованиям, предъявляемым к изучению метаболических процессов [7] (таблица).
| ↓ | Вывод о существовании биохимического процесса или метаболического пути, сделанный на основании наблюдений над целым организмом |
| ↓ | Анализ механизмов, контролирующих процесс in vivo |
| ↓ | Анализ нарушений процесса, вызванных специфическими болезнями (врожденные ошибки метаболизма, рак и т.д.) |
| ↓ | Локализация процесса в одном или нескольких органах |
| ↓ | Локализация процесса в одной или нескольких клеточных органеллах или субклеточных фракциях |
| ↓ | Рассмотрение процесса в виде отдельных реакций |
| ↓ | Очистка его индивидуальных субстратов, продуктов, ферментов, кофакторов и других компонентов |
| ↓ | Анализ механизмов, контролирующих процесс in vitro |
| ↓ | Изучение механизмов отдельных реакций |
| ↓ | Реконструкция процесса |
| ↓ | Изучение процесса на генетическом уровне методом рекомбинантных ДНК |
Применение такого подхода позволяет обычно выяснить детали биохимических процессов или метаболических путей. В общем виде эта схема использовалась для изучения главных метаболических путей в организме. Организация метаболических процессов в организме контролируется генетической программой на всем протяжении жизни. Поэтому утверждение «хаоса» ПОЛ противоречит вышеназванному постулату.
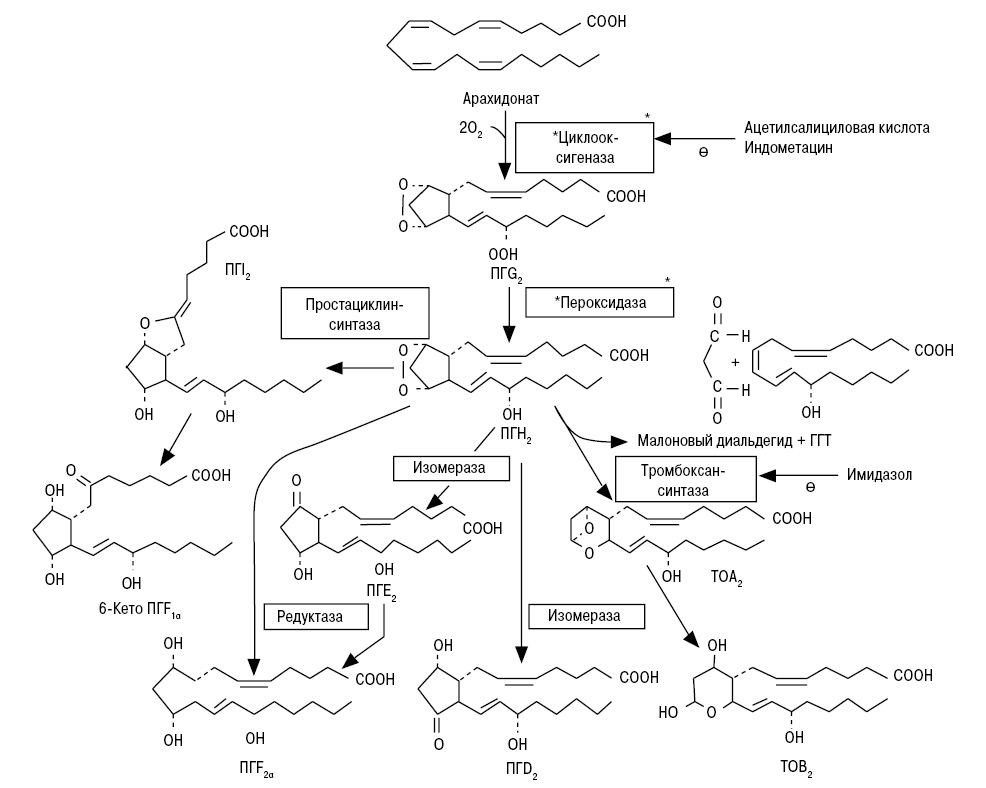
Третье противоречие заключается в том, что в организме существует ферментная система, подконтрольная геному, осуществляющая синтез эйкозаноидов (простагландинов, лейкотриенов, тромбоксанов), играющих важнейшую роль в функционировании организма. В этом процессе промежуточными продуктами являются малоновый диальдегид, гидроперекиси липидов [7] (схема). И здесь действительно речь может идти о нормативах этих и других показателей. Образование эйкозаноидов является элементом проявления общего неспецифического адаптационного синдрома. Поэтому увеличение количества различных продуктов ПОЛ (в том числе малонового диальдегида и диеновых конъюгатов) выявляют при большинстве заболеваний [8]. Их уровень зависит от нейроэндокринных сдвигов как следствия развития неспецифического адаптационного синдрома. В стрессовой катаболической (адренергически-кортикоидной) фазе одновременно с распадом органических молекул протекают синтетические процессы — образуются эйкозаноиды, позволяющие преодолевать стресс. Перекиси липидов, образующиеся в процессе синтеза эйкозаноидов, полностью метаболизируются, нейтрализуются (а не накапливаются, как считают сторонники теории ПОЛ).
Из третьего противоречия вытекает четвертое: если интенсивный самопроизвольный процесс окисления НЖК (ПОЛ) происходит, то как определить, какая часть перекисных продуктов образуется в процессе ПОЛ, инициируемом АФК, а какая — в процессе синтеза эйкозаноидов? В настоящее время определяемые перекисные продукты сторонниками концепции приписываются ПОЛ при отсутствии каких-либо доказательных исследований.
В свете сказанного становится понятным отсутствие даже упоминания о ПОЛ в известном учебнике Д.М. Фаллера и Д. Шилдса «Молекулярная биология клетки» [9], монографии известных биохимиков Я. Кольмана и К.Г. Рема [10]. В то же время детально представлены сведения об эйкозаноидах, их роли в функции клетки. Сама теория ПОЛ изначально базируется на результатах исследований in vitro. Возможность существования подобных разрушительных процессов in vivo вызывает большие сомнения, исходя из того, что период полужизни белков, интенсивность клеточного деления, апоптоз запрограммированы ДНК. Как показал с помощью изотопов Шёнхаймер, обмен липидов в организме протекает поразительно быстро. Очень быстрым процессом является обновление жирных кислот. Период биологической полужизни жирных кислот в различных органах животных составляет от 1,5 до 8 сут. На наш взгляд, ошибочным является утверждение, что перекиси липидов накапливаются в организме и оказывают токсическое действие. Известно, что образующиеся в процессе окисления НЖК гидроперекиси и циклические перекиси не могут накапливаться в организме: они разлагаются до жирных альдегидов, например: капронового, малонового, полуальдегида капроновой кислоты [11]. Линолевая кислота образует 1 молекулу малонового диальдегида, линоленовая — 2, арахидоновая — 3, клупанодоновая — 4. Продукты расщепления линолевой кислоты подвергаются дальнейшему окислению с образованием капроновой, азелаиновой и малоновой кислот, которые в конечном итоге подвергаются окислению до СО2 и Н2О2 в цикле Кребса. Подобному превращению подвергаются промежуточные продукты линоленовой, арахидоновой и клупанодоновой кислот.
По заключению известного биохимика А. Ленинджера [3], в клетках человека в обычных условиях самоокисление НЖК полностью заторможено благодаря наличию витамина Е, различных ферментов и аскорбиновой кислоты. Исследования доказательного характера, которые бы опровергли эту точку зрения, до сих пор отсутствуют. А. Ленинджер допускает, что при некоторых заболеваниях самоокисление может иметь место, вызывая образование в ряде тканей аномальных липидных включений. Тот факт, что ПОЛ, инициируемое в гидрофобном пространстве клеточных мембран, способно прерываться витамином Е, подтверждают другие биохимики. Высокая концентрация витамина Е в биологических мембранах препятствует их повреждению свободными радикалами [12]. Дефицит же витамина Е у человека отмечается чрезвычайно редко [13]. Следует думать, что многочисленные публикации клинического характера, авторы которых определяли диеновые конъюгаты, малоновый диальдегид, гидроперекиси и другие метаболиты при самых различных заболеваниях и состояниях, отражают не ПОЛ, а другой конкретный ферментативный, генетически обусловленный процесс — синтез эйкозаноидов. В процессах синтеза эйкозаноидов участвует целый ряд ферментов (фосфолипаза А2, циклооксигеназы, липооксигеназы и др.). Из свободных полиненасыщенных жирных кислот и, прежде всего, арахидоновой (линолевой, линоленовой после их превращения в арахидоновую кислоту) образуются простагландины [14]. Перечисленные полиненасыщенные жирные кислоты входят в состав фосфолипидов, в молекуле которых эфирной связью связаны с С-2-концом глицерола. Из фосфолипидов они высвобождаются под действием фосфолипазы А2 и становятся субстратом биосинтеза простагландинов. Продукты окисления выводятся с мочой. В мембранах клеток различных тканей имеются рецепторы, на которые действуют простагландины. Иными словами, образование перекисей липидов в различных тканях является нормальным процессом и осуществляется под контролем ферментов. Все полиеновые кислоты (линолевая, линоленовая, арахидоновая) при участии липооксигеназы окисляются до гидроперекисей, гидроксипроизводных жирных кислот, из которых в результате последовательных реакций образуются лейкотриены [15]. При участии простагландин-синтазы (циклооксигеназа + пероксидаза) арахидоновая кислота превращается в ее метаболиты — простагландины, простациклины, тромбоксаны, лейкотриены, то есть локальные гормоны, обладающие различной физиологической активностью [16]. Поскольку образование эйкозаноидов является элементом общего неспецифического адаптационного синдрома, рост количества различных продуктов ПОЛ определяется при самых различных заболеваниях [8]. Уровень продуктов ПОЛ зависит от нейроэндокринных сдвигов как следствия развития стресса.
Выводы
Имеющиеся на сегодняшний день представления о ПОЛ, в основном базирующиеся на исследованиях in vitro, не соответствуют требованиям, предъявляемым для признания существования изучаемого метаболического процесса или метаболического пути. Нет критериев, методологических подходов, позволяющих судить о параметрах выраженности ПОЛ in vivo. Оценивать выраженность ПОЛ (инициируемом АФК) в организме по содержанию в крови продуктов ПОЛ не представляется адекватным, поскольку эти метаболиты образуются в процессе биосинтеза эйкозаноидов — ферментативного, генетически детерминированного процесса. Тот факт, что в крови определяется физиологический (фоновый) уровень малонового диальдегида, диеновых конъюгатов, других продуктов ПОЛ, свидетельствует о существовании строгого контроля за окислением липидов со стороны иерархической системы регуляции, и в конечном итоге ДНК. (ДНК осуществляет контроль метаболизма посредством синтеза ферментов и клеточных белков.) Поэтому утверждение о существовании в клетках неконтролируемых свободнорадикальных реакций в больших масштабах является необоснованным. По мнению А. Ленинджера, «…в клетках в обычных условиях самоокисление ненасыщенных жиров полностью заторможено благодаря наличию витамина Е, различных ферментов, а также, по-видимому, аскорбиновой кислоты. Однако при некоторых заболеваниях оно может иметь место, вызывая в ряде тканей образование аномальных липидных включений [3] (Т. 1, с. 331)». Существенные повреждения свободными радикалами липидов клеточных мембран, нуклеиновых кислот происходят при лучевой болезни, влиянии канцерогенных, токсических факторов.
Список использованной литературы
- 1. Грацианский Н.А. (2002) Очередное (окончательное) подтверждение неэффективности антиоксидантных витаминов в профилактике коронарной болезни сердца и ее осложнений. Кардиология, 42(2): 85–86.
- 2. Грацианский Н.А. (2001) Статины как противовоспалительные средства. Кардиология, 12: 14–26.
- 3. Ленинджер А.(1985) Основы биохимии: В 3 т. Мир, Москва, Т. 1.
- 4. Хорст А. (1982) Молекулярные основы патогенеза болезней.: Пер. с польск. Медицина, Морсква, 456 с.
- 5. Stadtman E.R., Oliver C.N. (1991) Metal-catalyzed oxidation of proteins: physiological consequences. J. Biol. Chem., 266: 2005–2008.
- 6. Уайт А., Хендлер Ф., Смит Э. и др. (1981) Основы биохимии: В 3 т. Мир, Москва. Т. 2, 617 с.
- 7. Марри Р., Греннер Д., Мейес П. и др. (2004) Биохимия человека. Пер. с англ.: В 2 т. Мир, Москва. Т. 2, 414 с.
- 8. Казимирко В.К., Мальцев В.И., Бутылин В.Ю. и др. (2004) Свободнорадикальное окисление и антиоксидантная терапия. МОРИОН, Киев, 160 с.
- 9. Фаллер Д.М., Шилдс Д. (2006) Молекулярная биология клетки. Руководство для врачей. Пер. с англ. Издательство БИНОМ, Москва, 256 с.
- 10. Кольман Я., Рем К.Г. (2000) Наглядная биохимия: Пер. с нем. Мир, Москва, 469 с.
- 11. Савицкий И.В.(1981) Биологическая химия. Вища школа, Київ, 488 с.
- 12. Березов Т.Т., Коровкин Б.Ф. (1990) Биологическая химия: Учеб. под ред. С.С. Дебова, Медицина, Москва, 528 с.
- 13. Ерин А.Н., Скрыпин В.И., Прилипко Л.Л. (1988) Витамин Е. Молекулярные механизмы действия в биологических мембранах. Кислородные радикалы в химии, биологии и медицине. Рига. С. 180–208.
- 14. Владимиров Ю.А. (1989) Роль нарушений липидного слоя мембран в развитии патологических процессов. Патолог. физиол. и эксперим. терапия. 4: 7–17.
- 15. Halliwell B., Gutteridge J.M.C. (1989) Free radicals in biology and medicine. 2 ed. Clarendoln Press, Oxford.
- 16. Halliwell B., Gross C.E. Gutteridge J.M.C. (1992) Free radicals, antioxidants and human disease: where are we now? Lab. Clin. Med., 119: 598–620.
Адрес для переписки:
Казимирко Виталий Казимирович
04112, Киев, ул. Дорогожицкая, 9
Национальная медицинская академия
последипломного образования
имени П.Л. Шупика

Leave a comment