Значущість і принципи фармакологічної корекції активності ренін-ангіотензинової системи в терапії при фібриляції передсердь
Резюме. Резюме. Мета проведеного дослідження — вивчення впливу супутньої терапії лізиноприлом на морфофункціональні характеристики пацієнтів із фібриляцією передсердь (ФП). У дослідженні брали участь 46 пацієнтів віком 50–70 років (середній вік — 57,4±1,82 року) з такими діагнозами: ішемічна хвороба серця (стабільна стенокардія напруження I—III функціонального класу) (80,7% пацієнтів), серцева недостатність I–IIA ступеня (90,3% пацієнтів), гіпертонічна хвороба серця I–II стадії (87,1%), міокардіофіброз (12,9%). Порушення ритму серця були такі: суправентрикулярна екстрасистолія у 19,6%, пароксизмальна і персистуюча форми ФП — у 47,8%, постійна форма ФП — у 32,6% пацієнтів. Усі хворі приймали базову терапію + лізиноприл. Усі дослідження проводили двічі: при госпіталізації хворого і через 4 тиж прийому лізиноприлу. Встановлено, що лізиноприл сприятливо впливає на діастолічну функцію лівого шлуночка. Достовірне зменшення величин коригованого інтервалу Q–T і дисперсії інтервалу Q–T дозволяє пов’язати ефект лізиноприлу з його позитивним впливом на вегетативну регуляцію серця. При добовому моніторуванні артеріального тиску встановлено, що 4-тижневий прийом препарату зумовлює позитивний вплив на середні, максимальні й мінімальні величини артеріального тиску (як систолічного, так і діастолічного).
Фибрилляция предсердий (ФП) — наиболее частое нарушение сердечного ритма. Распространенность этой аритмии удваивается с каждым десятилетием жизни от 0,5% в возрасте 50–59 лет до 9% у 80–89 летних [2]. ФП в 1,5 раза чаще отмечают у мужчин, чем у женщин. Несмотря на значительные достижения в понимании электрофизиологических и патогенетических механизмов этой аритмии, лечение при ФП в основном носит симптоматический характер [5, 11]. В качестве патофизиологических механизмов рассматриваются острые и хронические гемодинамические, метаболические и электрофизиологические процессы. Все вышеперечисленные факторы приводят к структурному ремоделированию предсердий. Патологические изменения со стороны предсердий являются ведущими факторами в поддержании аритмии. В генезе ФП имеют большое значение следующие структурные изменения: гипертрофия, фиброз, некроз, жировая и амилоидная инфильтрация миокарда предсердий [3, 4] (табл. 1). При электронно-микроскопическом исследовании биопсийного материала предсердий больных с ФП выявлено нарушение межклеточных контактов и апоптоз кардиомиоцитов предсердий. Эти изменения обеспечивают возникновение и увеличивают продолжительность эпизодов ФП [10]. В исследованиях последних лет выявили взаимосвязь между анатомическими структурными изменениями предсердий и уровнем воспалительных цитокинов, что вызвало интерес к воспалительной теории аритмогенеза. Наиболее определяемые острофазовые показатели крови, сопровождающие воспалительные процессы в организме и исследуемые при ФП: С-реактивный белок, фибриноген, фактор некроза опухоли (TNF)-α, интерлейкин-1, интерлейкин-6.
| Анатомические факторы |
Электрофизиологические факторы |
|---|---|
|
|
Впервые роль воспаления как причины развития аритмий продемонстрирована в работе с участием 14 пациентов с идиопатической ФП, продолжительностью от 1 до 18 мес. В связи с неэффективностью антиаритмической терапии пациентам была выполнена эндомиокардиальная биопсия. При гистологическом исследовании у 3 из 14 пациентов выявлен активный миокардит, у 3 — признаки кардиомиопатии и у 8 — неспецифические изменения в виде очагового некроза или фиброза [8]. В дальнейшем продолжили изучать идиопатическую форму ФП и получили данные, которые свидетельствовали о наличии изменений сердечной мышцы, подобное таковому при миокардите. Данные результаты получены в 66% образцов тканей предсердий у больных с идиопатической формой ФП [4]. Проведенные исследования доказывают роль воспаления в формировании анатомического субстрата при возникновении и поддержании пароксизма ФП.
В настоящее время основные принципы антиаритмической терапии основаны на изменении электрофизиологических свойств кардиомиоцитов, в то время как влияние на анатомический субстрат является одним из самых важных способов профилактики пароксизмов ФП [5].
В поисках новой стратегии лечения ФП наиболее перспективным считается направление лечения основного заболевания, которое приводит к возникновению аритмии путем дезорганизации гемодинамики и развитию предсердной патологии. В настоящее время большое значение придается «UPSTREAM»-терапии, направленной на предотвращение или отсрочивание ремоделирования, связанного с наличием артериальной гипертензии (АГ), сердечной недостаточности или воспаления (например после кардиологической операции), которая может задержать возникновение ФП (первичная профилактика) или снизить частоту рецидивирования уже возникшей ФП или ее прогрессирование с переходом в постоянную форму (вторичная профилактика).
Одной из составляющих этой терапии является применение ингибиторов ангиотензинпревращающего фермента (иАПФ).
В последнее время получены данные, что применение иАПФ приводило к значительному снижению частоты возникновения пароксизмов ФП. Так, в эксперименте [13] показано, что интерстициальный фиброз при сердечной недостаточности способствует возникновению ФП, замедляя предсердное проведение и способствует возникновению rе-entri. Развившийся интерстициальный фиброз повреждает механизмы ионного транспорта, приводит к появлению предсердной эктопической активности. Активация ренин-ангиотензиновой системы (РАС) оказывает важную роль в аритмогенном ремоделировании (рисунок). Установлено, что у лиц с АГ риск развития ФП в 1,42 раза выше, чем у нормотензивных пациентов. В ряде исследований выявлено, что ФП является одним из осложнений неконтролируемой АГ, и эффективный контроль артериального давления (АД) значительно снижает риск ее развития.
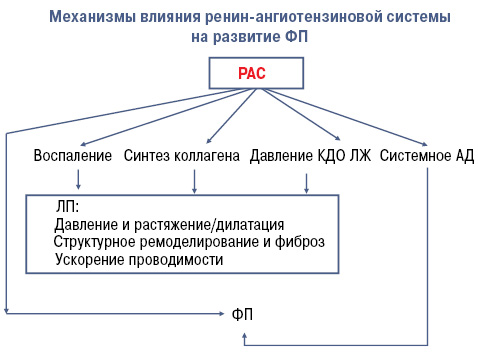
Рисунок. Механизмы влияния РАС на развитие ФП.
КДО ЛЖ — конечный диастолический объем левого желудочка
Длительное время этот эффект рассматривался как следствие ремоделирования левого предсердия (ЛП) в результате активации кардиальной РАС, усиленной экспрессии в предсердии АПФ и действия ангиотензина II (АII) в качестве ключевого фактора прогрессирующего фиброза миокарда. Полагали, что АII способствует усиленной локальной продукции альдостерона, сопровождающейся пролиферацией фибробластов, повышением содержания коллагена на фоне снижения активности коллагеназ, наряду с увеличением размера предсердия. Однако полученные в последние годы данные свидетельствуют о том, что при равном влиянии карведилола и телмисартана на размеры предсердия и уровень АД, способность к профилактике возникновения пароксизмов ФП более выражена у телмисартана. У лиц, получавших телмисартан, на протяжении 1 года отмечено достоверно более редкое развитие эпизодов ФП (14,3% по сравнению с 37,1%) при том, что размер ЛП (3,4 и 3,6 см) и средние величины АД (как до, так и после лечения) были аналогичными у пациентов обеих групп [9].
В исследовании Val-HeFT применение блокаторов АI-рецепторов (БРА) дополнительно к стандартной терапии сердечной недостаточности (включая в 92,5% иАПФ) сопровождалось снижением частоты развития ФП на 37% [14]. Это сочеталось не только с предупреждением или устранением ремоделирования сердца, но и повышением активности парасимпатической нервной системы, восстановлением баланса между симпатической и вагусной активностью, уменьшением гетерогенности желудочковой реполяризации. Установлено, что в этих условиях телмисартан не только влиял на нормализацию скорости проведения импульса по предсердиям, но и способствовал ослаблению дисперсии Р-волны даже по сравнению с рамиприлом.
Так, при ретроспективном анализе исследования SOLVD было показано, что у пациентов с дисфункцией левого желудочка (ЛЖ) применение эналаприла, по сравнению с плацебо, привело к снижению риска возникновения ФП. У 5,4% пациентов, получавших эналаприл, и у 24% — в группе плацебо (р<0,0001) (относительный риск 0,22 (0,11–0,44) р<0,0001). По мнению авторов этого исследования, эналаприл был наиболее значимым предиктором снижения риска возникновения ФП [15]. В другом исследовании [12] у пациентов с инфарктом миокарда и дисфункцией ЛЖ применение трандолаприла по сравнению с плацебо ассоциировалось с 47% относительным снижение риска ФП.
В исследовании L. Yin и соавторов (2006) [16] и трех работах R. Fogari и соавторов (2008; 2012) продемонстрирован антиаритмический эффект иАПФ и БРА у больных с пароксизмальной ФП [5–7]. Авторы показали, что применение препаратов, блокирующих РАС, значительно снижает частоту рецидивов ФП и необходимость в применении нагрузочных доз антиаритмических препаратов. В настоящее время имеется недостаточно данных, позволяющих однозначно рекомендовать применение иАПФ и БРА исключительно для профилактики ФП. Антиаритмический эффект препаратов этих групп наиболее очевиден у пациентов с факторами риска ФП: АГ, гипертрофией стенок ЛЖ или хронической сердечной недостаточностью. Результаты клинических исследований продемонстрировали эффективность иАПФ и БРА (как для первичной, так и вторичной профилактики ФП), что обусловлено их способностью предупреждать развитие структурного и электрофизиологического ремоделирования предсердий. Исследование роли РАС в патогенезе ФП является наиболее актуальным вопросом современной кардиологии.
Поэтому было запланировано исследование, цель которого — изучение влияния сопутствующей терапии лизиноприлом на морфофункциональные характеристики пациентов с ФП.
Объект и методы исследования
В исследование были включены 46 пациентов в возрасте от 50 до 70 лет (средний возраст составил 57,4±1,82 года) со следующими диагнозами: ишемическая болезнь сердца (стабильная стенокардия напряжения I–III функционального класса) (наблюдалось у 80,7% пациентов), сердечная недостаточность I–IIA степени (отмечено у 90,3% пациентов), гипертоническая болезнь сердца I–II стадии (у 87,1%), миокардиофиброз (у 12,9%). Нарушения ритма сердца были следующие: суправентрикулярная экстрасистолия — у 19,6%, пароксизмальная и персистирующая формы ФП — у 47,8%, постоянная форма ФП — у 32,6% пациентов, которые были включены в исследование. Все больные принимали базовую терапию, к которой был добавлен лизиноприл. Все исследования проводили дважды: при поступлении больного в стационар и через 4 нед применения лизиноприла.
Для решения поставленных задач использовали комплекс современных методик, включающих, кроме клинического наблюдения, контроля электрокардиограммы (ЭКГ) с измерением интервала Q–T и АД, инструментальные исследования: 24-часовой холтеровский ЭКГ-мониторинг (ХМ) с анализом вариабельности сердечного ритма, эхокардиография (эхоКГ) (на аппарате SA-9900, «Medison», Южная Корея), суточное мониторирование АД (на аппарате ABPM-02, «MEDITECH»). 24-часовое ХМ было проведено с помощью рекордеров «Солвейг» (Украина). Запись подвергалась последующему компьютерному анализу. Оценка результатов осуществлялась на основании трендов — суммарных кривых отклонений сегмента ST, частоты сердечных сокращений (ЧСС), а также таблиц с почасовой распечаткой наблюдавшихся нарушений ритма. При анализе суточной ЭКГ определяли часовые и спектральные показатели вариабельности сердечного ритма.
Оценивали такие временные показатели вариабельности сердечного ритма:
- rMSSD — среднеквадратичное расхождение между длительностью соседних синусовых интервалов R–R;
- pNN50 — часть соседних синусовых интервалов R–R, которые различаются на >50 мс;
- SDANN — стандартное отклонение от средней продолжительности синусовых интервалов R–R, среди всех NN-сегментов длительностью 5 мин;
- SDNN index — средняя для стандартных отклонений от всех средних значений длительности синусовых интервалов R–R на всех 5-минутных участках записей ЭКГ.
Нами также оценены спектральные показатели вариабельности сердечного ритма: HF — мощность в диапазоне высоких частот (High Frequency — 0,15–0,40 Гц); LF — мощность в диапазоне низких частот (Low Frequency — 0,04–0,15 Гц); LF/HF — соотношение мощностей.
Обработку полученных результатов проводили после образования баз данных с помощью программы «Excel». Полученные величины сравнивали с помощью программы «Statistica».
Результаты и их обсуждение
В ходе исследования у больных, применяющих лизиноприл на протяжении 4 нед, отмечено достоверное влияние на сердечный ритм. Средняя ЧСС, по данным ХМ, снизилась на фоне лечения с 78,06±1,2 до 65,76±1,49 уд./мин, максимальная ЧСС — с 125,0±3,23 до 102,43±3,76 уд./мин (р<0,001) и минимальная ЧСС — с 51,6±1,05 до 46,71±0,99 уд./мин (р<0,001) соответственно. Данные представлены в табл. 2. Кроме того, число суправентрикулярных экстрасистол уменьшилось с 417,97±133,26 до 216,78±89,9 (р<0,001). Уменьшилось также количество пробежек ФП с 32,35±6,3 до 16,38±7,93 (р<0,001). В нескольких небольших проспективных рандомизированных исследованиях показано, что иАПФ и БРА в сочетании с антиаритмическими средствами (обычно амиодароном) оказывают дополнительное благоприятное влияние на риск возникновения рецидивов ФП после кардиоверсии по сравнению с антиаритмической терапией [16].
| Показатель | Исход | После лечения | р |
|---|---|---|---|
| ЧСС средняя, уд./мин | 78,06±1,20 | 65,76±1,49 | <0,001 |
| ЧСС максимальная, уд./мин | 125±3,23 | 102,43±3,76 | <0,001 |
| ЧСС минимальная, уд./мин | 51,6±1,05 | 46,71 ±0,99 | <0,001 |
| Суправентрикулярная экстрасистолия, n | 417,97±133,26 | 216,78±89,90 | <0,001 |
| Пробежки ФП, n | 32,35±6,30 | 16,38±7,93 | <0,002 |
| SDNN, мс | 99,26±9,25 | 127,37±12,86 | <0,001 |
| SDANN, мс | 123,32±11,77 | 127,95±11,10 | НД |
| SDNNi, мс | 59,06±6,12 | 61,6±7,89 | НД |
| RMSSD, мс | 48,82±8,83 | 5 8,3 8± 14,95 | <0,002 |
| pNN50, % | 15,79±3,89 | 18,05±5,06 | <0,002 |
| LF, мс | 2124,74±708,82 | 1322,0±517,06 | <0,001 |
| HF, мс | 1641,32±620,52 | 1281,5±614,77 | <0,001 |
| Q–Tc, мс | 418,4±14,95 | 414,08±40,28 | <0,01 |
| DQT, мс | 17,26±1,68 | 16,48±2,15 | НД |
В последнее время много внимания уделяют изучению особенностей нервной регуляции сердца, для чего используют метод вариабельности сердечного ритма [1]. Дисбаланс вегетативной нервной системы, который влияет на вариабельность сердечного ритма, обусловливает риск развития тяжелых осложнений. Анализ показателей вариабельности сердечного ритма до начала лечения свидетельствует о наличии дисбаланса вегетативной нервной системы у больных с нарушениями ритма сердца. Так, в исходе у пациентов были пониженные временные показатели вариабельности сердечного ритма (SDNN, SDАNN) и повышены показатели тонуса симпатической и парасимпатической нервной системы (RMSSD, pNN50, LF, HF) (см. табл. 2). В ходе лечения лизиноприлом все показатели вариабельности сердечного ритма изменились в лучшую сторону у всех больных без исключения. Так, временные показатели (SDNN, SDNNi, SDANN) после 4-недельного приема лизиноприла достоверно практически нормализовались SDNN с 99,26±9,25 до 127,37±12,86 (р<0,001), SDANN с 123,32±11,77 до 127,95±11,1 (недостоверно — НД), SDNNi с 59,06±6,12 до 61,6±7,89 (НД). Показатели rMSSD и pNN50 возросли соответственно с 48,82±8,83 до 58,38±14,95 мс (р<0,001) и с 15,79±3,89 до 18,05±5,06 мс (р<0,002).
Спектральные же показатели вариабельности сердечного ритма под влиянием терапии снизились. Так, LF уменьшился с 2124,74±708,82 до 1322,0±517,06 (р<0,001), а HF уменьшился с 1641,32±620,52 до 1281,5±614,77 (р<0,001). Все это свидетельствует о том, что у пациентов с нарушениями ритма сердца в исходе был повышен тонус симпатической нервной системы и снижен тонус парасимпатической нервной системы. В ходе же 4-недельного приема лизиноприла отметилась тенденция к снижению тонуса симпатической нервной системы и повышению тонуса парасимпатической нервной системы. То есть действие препарата можно расценивать как благоприятное для поддержания нормального автономного баланса.
Благоприятное влияние лизиноприла на вегетативный баланс также привело к тому, что у обследованных больных уменьшились величины корригированного интервала Q–T с 418,4±14,95 до 414,08±40,28 мс (р<0,01) и дисперсии интервала Q–T с 17,26±1,68 до 16,48±2,15 мс (НД) (см. табл. 2).
Полученные в ходе проведенного нами исследования данные показали, что 4-недельное применение лизиноприла не оказало достоверного влияния на структурно-функциональные показатели сердца по данным эхоКГ (табл. 3). Не получено достоверной разницы размеров ЛП, ЛЖ и правого желудочка. Однако, как видно из данных (см. табл. 3), отмечается тенденция к уменьшению размеров сердца и увеличению фракции выброса у больных, применявших лизиноприл. Единственный показатель, по которому была получена достоверная разница, это показатель максимальной скорости раннего наполнения ЛЖ (Е). Он повысился с 48,29±5,76 до 52,58±5,06 (р<0,01), что свидетельствует о тенденции к нормализации диастолической функции ЛЖ, и это является благоприятным влиянием, поскольку, как известно, у ряда больных симптомы сердечной недостаточности могут возникать вследствие диастолической дисфункции при нормальной величине фракции выброса.
| Показатель | До назначения лизиноприла | После лечения | р |
|---|---|---|---|
| ЛП, мм | 42,36±1,44 | 42,25±1,24 | НД |
| Фракция выброса ЛЖ, % | 56,9±1,36 | 57,26±1,55 | НД |
| КДО, мл | 146,86±9,35 | 146,69±8,28 | НД |
| КСО, мл | 66,79±6,30 | 66,53±7,42 | НД |
| Правый желудочек, мм | 25,59±1,04 | 25,25±0,87 | НД |
| Е, у.е. | 48,29±5,76 | 52,58±5,06 | 0,0003 |
| А, у.е. | 43,85±5,20 | 45,5±5,37 | НД |
| Среднее САД, мм рт. ст. | 133,85±2,98 | 121,39±2,92 | 0,00001 |
| Среднее ДАД, мм рт. ст. | 81,93±1,92 | 72,71±2,05 | 0,00001 |
| Максимальное САД, мм рт. ст. | 176,18±4,28 | 153,43±3,99 | 0,00001 |
| Максимальное ДАД, мм рт. ст. | 109,88±2,43 | 96,79±2,58 | 0,00001 |
| Минимальное САД, мм рт. ст. | 104,55±2,58 | 93,5±3,00 | 0,00001 |
| Минимальное ДАД, мм рт. ст. | 61,15±2,33 | 52,0±2,05 | 0,00001 |
КДО — конечный диастолический объем; КСО — конечный систолический объем. Здесь и далее: САД — систолическое артериальное давление; ДАД — диастолическое артериальное давление.
Главным результатом завершившихся рандомизированных клинических исследований при АГ являются убедительные доказательства того, что снижение риска развития сердечно-сосудистых заболеваний и их осложнений у пациентов с АГ пропорционально степени снижения АД. Накоплены данные о благоприятном влиянии блокады РАС на важные для улучшения прогноза нарушения: дисфункцию эндотелия, толщину комплекса интима-медиа, гипертрофию ЛЖ, микроальбуминурию. Снижение АД, регресс гипертрофии ЛЖ или признаков атеросклеротической бляшки в сонной артерии являются теми положительными аспектами лечения, которые могут играть важную роль в повышении приверженности пациентов лечению.
При анализе результатов, полученных в ходе исследования у больных, применяющих лизиноприл на протяжении 4 нед, отмечено достоверное снижение АД. Так, среднее САД, по данным суточного мониторирования АД, снизилось с 133,85±2,98 до 121,39±2,92 мм рт. ст. (р<0,001), а среднее ДАД — с 81,93±1,92 до 72,71±2,05 мм рт. ст. (р<0,001). Кроме того, отмечено достоверное снижение как максимального, так и минимального АД, по данным суточного мониторирования (см. табл. 3). Эффективность антигипертензивной терапии оценивают не только по степени снижения АД, но и по тому, как она влияет на органы-мишени, в первую очередь на сердечную деятельность.
Таким образом, в ходе исследования установлено, что лизиноприл благоприятно влияет на диастолическую функцию ЛЖ. Достоверное уменьшение величин корригированного интервала Q–T и дисперсии интервала Q–T позволяет связать эффект лизиноприла с его положительным влиянием на вегетативную регуляцию сердца. 4-недельное применение препарата оказывает положительное влияние на средние, максимальные и минимальные величины САД и ДАД при суточном мониторировании АД.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Остроумова О.Д., Недогода С.В., Мамаев В.И. и др. (2003) Фармакоэкономические аспекты эффективности ингибиторов ангиотензипревращающего фермента при артериальной гипертонии и сердечной недостаточности. Русский медицинский журнал, 11(5).
2. Alan S. Go, Elaine M. Hylek, Kathleen A. Phillips et al. (2001) Prevalence of Diagnosed Atrial Fibrillation in Adults. JAMA. 285(7): 2370–2375.
3. Engelmann M.D., Svendsen J.H. (2005) Inflammation in the genesis and perpetuation of atrial fibrillation. Eur. Heart J., 26: 2083–2092.
4. Falk R.H. (1995) Atrial fibrillation. Inbook: Girdiac Arrhythmia. Podnd P.J., Kowey P.R. (Es) Williams&Wilkins, Baltimore, р. 803–828.
5. Fogari R., Derosa G., Ferrari I. et al. (2008) Effect of valsartan and ramipril on atrial fibrillation recurrence and P-wave dispersion in hypertensive patients with recurrent symptomatic lone atrial fibrillation. Am J Hypertens.; 21(9): 1034–1039.
6. Fogari R., Zoppi A., Maffioli P. et al. (2012) Effect of telmisartan on paroxysmal atrial fibrillation recurrence in hypertensive patients with normal or increased left atrial size. Clin. Cardiol., 35(6): 359–364.
7. Fogari R., Zoppi A., Mugellini A. et al. (2008) Comparative evaluation of effect of valsartan/amlodipine and atenolol/amlodipine combinations on atrial fibrillation recurrence in hypertensive patients with type 2 diabetes mellitus. J. Cardiovasc. Pharmacol., 51(3): 217–222.
8. Galzerano D., Di Michele S., Paolisso G. et al. (2012) A multicentre, randomized study of telmisartan versus carvedilol for prevention of atrial fibrillation recurrence in hypertensive patients. J. Renin Angiotensin Aldosterone Syst., 13(4): 496–503.
9. Gerdts E., Wachtell K., Omvik P. et al. (2007) Left atrial size and risk of major cardiovascular events during antihypertensive treatment: losartan intervention for end-point reduction in hypertension trial. Hypertension., 49: 311–316.
10. Jong Ph., Yusuf S., Roussean M.F. et al. (2003) Effect of enalapril on 12-year survival and life expectancy in patients with left ventricular systolic dysfunction: a follow-up study. Lancet., 361: 1843–1848.
11. Kannel W.B., Wolf P.A., Benjamin E.J. et al. (1998) Prevalence, incidence, prognosis and predisposing conditions for atrial fibrillation: population based estimates. Am. J. Cardiol., 82: 2N–9N.
12. Li D., Karen S., Leung T.K. et al. (1999) Promotion of atrial fibrillation by heart failurein dogs: atrial remodeling of a different sort. Circulation, 100: 87–95.
13. Li D., Shinagawa K., Pang L. (2001) Effects of angiotensin converting enzyme inhibition on the development of the atrial fibrillation substrate in dogs with ventricular tachypacing induced congestive heart failure. Circulation, 104: 2608–2614.
14. Philbin Е., Rocco Т. (1997) Use of angiotensin-converting enzyme inhibitors in heart failure with preserved left ventricular systolic function. Am. Heart. J., 134: 188–195.
15. White W.B. (1998) Guidelines on the clinical utility of ambulatory blood pressure. Blood Press. Monit., 3: 181–184.
16. Yue L., Feng J., Gaspo R. et al. (1997) Ionic remodeling under lying action potential changesin a canine model of atrial fibrillation. Circ. Res., 815: 12–25.
Адрес для переписки:
Гетьман Таисия Вячеславовна
03680, Киев, ул. Народного ополчения, 5
ГУ «ННЦ «Институт кардиологии
им. Н.Д. Стражеско» НАМН Украины»
E-mail: taisiyagetman@mail.ru

Leave a comment