Роль про- і протизапальних цитокінів у розвитку запального процесу при ювенільному ревматоїдному артриті
Марушко Т.В.1, Бережний В.В. 2, Гавриленко Т.І.3, Клубова Г.Ф.4
- 1Національна медична академія післядипломної освіти ім. П.Л.Шупика
- 2Київська медична академія післядипломної освіти Інститут кардіології, Київ
- 3HHЦ «Институт кардиологии им. HM. Стражеско» HAMH Украины
- 4Международный центр информационных технологий и систем, Киев-Институт кардиологии, Киев-LUM GmbH, Берлин
Резюме. Проведено аналіз рівнів неоптерину, фактора некрозу пух-лини-а, інтерлейкіну-10 в сироватці крові у пацієнтів з ювенільним ревматоїдним артритом у період загострення та в період клінічної ремісії. Отримано дані про зв 'язок змін їх рівня зі ступенем активності патологічного процесу.
Одне з перших місць серед захворювань у дітей, які неухильно прогресують і призводять до інвалідності, займає ювенільний ревматоїдний артрит (ЮРА). Ревматоїдний артрит (РА) – аутоімунне захворювання нез’ясованої етіології, патологічний процес при якому характеризується генералізова-ним аутоімунним запаленням, у результаті чого розвиваються внутрішньосуглобові патологічні зміни і широкий спектр зовнішньосуглобових системних проявів та катаболічних порушень (Балабанова Р.М., 1997; Wise C.A. et at., 2000; Костромина r.H. и соавт., 2002; Казмірчук В.Є., Мальцев Д.С., 2004). Для РА характерне прогресуюче неконтрольо-ване запалення синовіальної оболонки суглобів, зумовлене синовіальними клітинами: фібробластами, макрофагами, дентритними, тучними, ендотеліальними клітинами, Т- та В-лімфоцитами (Коваленко В.К, 2001). Hейтрoфiльнi гранулоцити накопичуються в синовіальних структурах, мігруючи з кров’яного русла, та звільнюючи різні хемотаксич-ні, біологічно активні компоненти – компонент комплемента, фактор активації томбоцитів тощо. Активація нейтрофільних гранулоцитів супроводжується вивільненням різних прозапальних факторів: протеїназ, лейкотрієнів, простагландинів, інтерлейкінів – Ш ^етяженко В.З., Мальчевсь-ка Т.Й., 1998). При цьому в синовіальній рідині та тканинах суглоба міститься велика кількість цито-кінів макрофагального походження – Ш, фактора некрозу пухлини – ФHП (Oppenheim J. et aI., 1993). Цитокіни – низькомолекулярні білкові молекули, які забезпечують процес міжклітинних комунікацій, і до яких належать колонієстимулювальний фактор, фактори росту, Ш, хемокіни, ФHП (BIum A., MiIIer H., 1998). Ці медіатори беруть участь у регуляції нормальних біологічних процесів – у рості та диференціації гемопоетичних, лімфоїдних, мезенхімальних клітин, імунних реакціях, регенерації тканин, ангіо-генезі та в процесі запалення (Arai K. et aI., 1990). Кожен цитокін виявляє синергічну або інгібувальну активність щодо інших цитокінів. Ця властивість цитокінів зумовлює оптимальний розвиток імунної відповіді у межах так званої цитокінової сітки, яка проявляється як саморегулююча система. Дуже
умовно вони поділяються на декілька груп, у межах яких виділяють прозапальні та протизапальні цитокіни (Oppenheim J. et al., 1993). В основі більшості хронічних запалень, незалежно від їх органної належності, лежить порушення балансу між синтезом прозапальних та протизапальних медіаторів (Feldman M. et al., 1996; Dinarello C.A., Moldawer L.L., 1999).
Основне значення в патогенезі РА надають двом взаємопов’язаним процесам: антигенспе-цифічній активації СД4 Т-лімфоцитів за Thl-типом, який характеризується багатокількісним синтезом ІЛ-2, інтерферону-у, ІЛ-17, ІЛ-18 та дисбаланс між продукцією прозапальних цитокінів (ФНП-а, ІЛ-1, ІЛ-6, ІЛ-8 та ін.) та протизапальних цитокінів (ІЛ-10, розчинного антагоніста ІЛ-1, ІЛ-4) з перевагою продукції перших над другими (Horneff G. et al., 1993; Lacki J.K. et al., 1997). Особливого значення надають вивченню прозапального цитокіну — ФНП-а (Bazzoni F., Beutler B., 1996) — прототипу колонії молекул, які відіграють важливу роль у регуляції нормальної диференціації, росту та метаболізму різних клітин, а також медіаторів патологічних імуно-запальних процесів (Tracey K.J., Cerami A., 1994). ФНП-а синтезується клітинами, які виявляють у великій кількості на межі між панусом та суглобовим хрящем, у тій зоні, з якої починається деструкція суглоба при РА. ФНП-а та ІЛ-1 — індуктори синтезу ще одного прозапального цитокіну — ІЛ-6, який призводить до гіперпродукції гострофазових білків — С-реактивного протеїну (СРП), фібриногену (Schroecksnadel K. et al., 2003). Вивчення біологічної активності ФНП-а дозволило стверджувати, що саме ФНП-а — ключовий медіатор імунозапального процесу при РА, в тому числі і в дітей (Verbruggen A. et al., 1998; Wise C.A. et al., 2000).
Додаткові підтвердження ролі ФНП-а в патогенезі РА були отримані при вивченні неоптерину — низькомолекулярної гетероциклічної стабільної молекули, яка утворююється в моноцитах/макрофагах та деяких інших клітинах у процесі біотрансформації гуанозинтрифосфату (Насонов Е.Л., 2000). Основним індуктором ситезу неоптерину є інтерферон (ІФН)-у, але ФНП-а суттєво посилює продукцію неоптерину. Підвищення продукції неоптерину
УКРАЇНСЬКИЙ РЕВМАТОЛОГІЧНИЙ ЖУРНАЛ • № 1 (23) • 2006
зз
виявляють при захворюваннях, які супроводжуються активацією клітинного імунітету (Sfriso P. et al., 2003). Оскільки ІФН-у сприяє ефективному транспортуванню антигенів і аутоантигенів до Т-лімфоцитів, цьому цитокіну надають особливого значення в ініцююванні аутоімунної патології, якою є РА (Насонов Е.Л. и соавт., 1998). Також виявлено, що екзогенний неоптерин стимулює синтез ФНП-а макрофагами людини, що особливо важливо в імунопатології аутоімунних ревматичних захворювань (Фукс Д. и соавт., 1993; Wiedermann C.J. et al., 1993). У опрацьованій нами літературі ми не знайшли даних про вміст неоптерину в крові та інших біологічних середовищах у дітей з ЮРА, що є важливим для оцінки стадії та активності патологічного процесу у цих хворих.
Однією з актуальних проблем сучасної ревматології є розроблення та оцінка застосування серологічних методів, які б дозволили з високим ступенем достовірності оцінити активність і характер прогресування імунозапального процесу в організмі хворої дитини, мати маркери достовірного контролю процесу лікування.
Мета роботи — вивчення вмісту ФНП-а, ІЛ-10 та рівня неоптерину в крові дітей з РА залежно від активності запального процесу.
матеріали та методи
До основної групи входили 62 пацієнти (20 хлопців і 42 дівчини): 43 хворих на ЮРА у період загострення (1-ша група), 19 — у період ремісії (2-га група). Вік дітей — від 5 до 15 років. Контрольну групу становили 9 дітей того ж віку без запальних процесів в організмі.
Серед хворих 1 -ї групи у 7 (16,3± 5,6%) відзначали субфебрильну температуру тіла, у 2 (4,7±3,3%) — підвищення температури до фебрильних цифр. У 100% пацієнтів був виражений суглобовий синдром, який проявлявся вранішньою скутістю тривалістю до 1 год у 32 (74,4±6,7%) дітей, понад 1 год — у 11 (25,6±6,7%), вираженим суглобовим болем (больовий індекс за шкалою Річі — 1,88±0,12 ум. од.), болем при пальпації (суглобовий індекс за шкалою Річі — 1,93 ±0,12 ум. од.), припухлістю суглобів (запальний індекс за шкалою Річі — 1,88±0,11 ум. од.). Середня кількість уражених суглобів у одного хворого становила 3,6±0,31. Серед уражених суглобів найчастіше виявляли колінні — 86±5,3%, гомілкові — 48,8±7,6%, променезап’ясткові — 44,2±7,6%, міжфалангові — 39,5±7,5%, ліктьові — 23,3±6,4%, кульшові — 7,0±3,9%, нижньощелепові — у 2 (4,7±3,2%), міжхребцеві суглоби стовбура хребта — у 2 (4,7±3,2%) дітей. У 2 (4,7±3,2%) пацієнтів виявлено ревматоїдні вузлики в ділянці кистей рук і стоп, непостійне геморагічне висипання на початку захворювання — у 3 (7,0±3,9%) хворих. Серед усіх обстежених у 8 (12,0±4,3%) виявлено ознаки ревматоїдного увеїту.
Окрім ураження суглобів, при обстеженні пацієнтів основної групи діагностовано такі ураження внутрішніх органів: міокарда — вторинна кардіоміопатія (79,1±6,2%), легенів — альвеоліт
(4,7±3,2%), печінки — токсична вторинна гепато-патія (9,3±4,4%), нирок — вторинна нефропатія (7,0±3,9%) хворих.
Результати аналізу лабораторних показників свідчать, що позитивний ревмофактор на піку активності аутоімунного запального процесу виявлено у 13,9± 5,3%, підвищений СРП — у 97,7±2,3%, лейкоцитоз — у 62,8±7,4% хворих, причому завжди (100% випадків) супроводжувався зміщенням нейтрофіль-них гранулоцитів вліво, підвищене ШОЕ становило від 15 до 50 мм/год у 69,8±7,8% хворих. Анемію І-ІІ ступеня виявлено у 27,9±6,8% пацієнтів.
Концентрацію цитокінів та неоптерину в сироватці крові визначали імуноферментним методом за допомогою тест-систем фірми «РгоСоп» (Санкт-Петербург) та «Immunotech» (Франція). У дітей контрольної групи вміст неоптерину в сироватці крові становив 3,4±0,8 нмоль/л, ФНП-а — 28,8 ±6,0 пг/мл, ІЛ-10 — 2,3±0,75 пг/мл.
Дані досліджень проаналізовано згідно з рекомендаціями щодо статистичної обробки результатів медико-біологічних досліджень (Иванов Ю.И., По-горелюк О.Н., 1990). Для кожної групи показників визначали середнє арифметичне (М), середнє квадратичне відхилення (а), середню помилку (т). Достовірність різниці між середніми значеннями оцінювали за таблицею критеріїв (Стьюдента). Різницю вважали достовірною при р
результати та їх обговорення
Порівняльні дані про вміст ФНП-а, ІЛ-10, неопте-рину в сироватці крові у пацієнтів 1 -ї та контрольної груп наведено в табл. 1.
Таблиця 1
Вміст ФНП-a, ІЛ-10, неоптерину в сироватці крові у пацієнтів І-Ї та контрольноЇ груп
| Група | Рівень неоптерину, нмоль/л М±т | ІЛ-10, пг/мл М±п | ФНП-a, пг/мл М±п |
| 1-ша | 5,08±0,41* +69,89° | 2,03±0,45 +53,78° | 40,38±2,26* +69,09° |
| Контрольна | 2,99±0,32 | 1,32±0,15 | 23,88±2,31 |
*р
У осіб 2-ї групи виявлено достовірне зниження показників неоптерину порівняно з таким у дітей контрольної групи. Показники ФНП-а у сироватці крові у дітей 2-ї групи достовірно знизилися порівняно з такими у 1 -й групі, але залишалися достовірно вищими порівняно з контрольною групою. Показники рівня протизапального цитокіну ІЛ-10 у дітей 2-ї групи достовірно підвищилися порівняно з такими у осіб 1-ї групи, наблизившись до показників у контрольній групі.
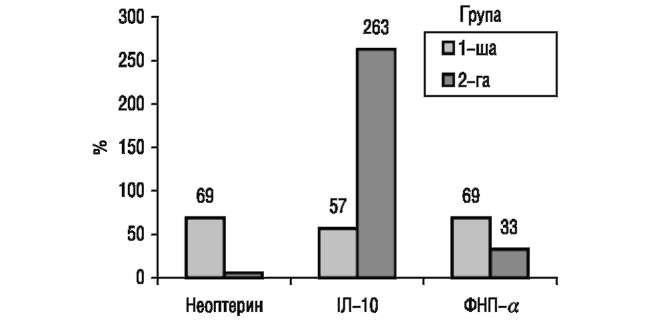
Рисунок. Динаміка відхилення показників рівня неоптерину, ФНП, ІЛ-10 у сироватці крові у дітей 1-ї та 2-ї груп порівняно з показниками у осіб контрольної групи згідно з формулою Земскова
Показники (рисунок) свідчить, що у дітей 2-ї групи рівень неоптерину знизився і залишився дещо підвищеним — I ступінь підвищення імунологічних показників (+28,42%) — щодо контрольної групи, рівень ФНП-а (+39,99%) продовжував відповідати II ступеню підвищення, а ІЛ-10 підвищився (+263,63%) і перевищив III ступінь підвищення.
Таким чином, у період загострення ЮРА нами виявлені достовірні зміни рівнів неоптерину, ФНП-а в сироватці крові, що має значення для встановленя активності патологічного процесу. В період ремісії ЮРА спостерігається достовірне зниження рівня неоптерину до рівня показників у осіб контрольної групи, рівень ФНП-а значно знизився, але не досяг рівня показників у групі практично здорових людей. При цьому рівень протизапального цитокіну ІЛ-10 у процесі виздоровлення значно підвищився і відносно початку захворювання, і відносно осіб контрольної групи. Цей факт можна використовувати як для поглиблення уявлень про профіль синтезу цитокінів при аутоімунних ревматичних захворюваннях, так і для прогнозу перебігу цього патологічного процесу.
висновки
1. Визначення рівня ФНП-а, неоптерину, про-запального цитокіну ІЛ-10 має важливе значення для комплексної оцінки імунопатологічних реакцій у хворих на ЮРА. В період загострення захворювання в сироватці крові виявляють високі рівні неоптерину та ФНП-а, рівень протизапального цитокіну ІЛ-10 достовірно не підвищувався, що свідчить про дисбаланс у системі про- і протизапальних цитокінів у гострий період захворювання і може бути використаним для оцінки активності запального процесу.
2. При досягненні клінічної та лабораторної ремісії у хворих на ЮРА в сироватці крові виявляють достовірну нормалізацію вмісту неоптерину, а рівень ФНП-а залишається достовірно підвищеним відносно групи контролю. Це свідчить про те, що визначення рівня неоптерину — більш чутливий тест при ранній оцінці зниження активності запального процесу та ефективності лікування пацієнтів із ЮРА.
3. Рівень протизапального цитокіну ІЛ-10 у процесі одужання був достовірно підвищеним, що свідчить про встановлення балансу в системі про- і протизапальних цитокінів і перехід клітинної імунної відповіді на гуморальний тип.
література
Балабанова Р.М. (1997) Ревматоидный артрит. В кн.: Ревматические болезни / Под ред. В.А. Насоновой, Н.В. Бунчука. Медицина, Москва, с. 257—294.
Иванов Ю.И., Погорелюк О.Н. (1990) Статистическая обработка результатов медико-биологических исследований на микрокалькуляторах по программам. Медицина, Москва, 224 с.
Передерий В.Г., Земсков А.М., Бычкова Н.Г., Зем-сков В.М. (1995) Иммунный статус, принципы его оценки и коррекции иммунных нарушений. Здоров’я, Київ, 211 с.
Казмірчук В.Є., Мальцев Д.С. (2004) Роль цитокінів у виявленні функціональних порушень іммунітету. Ліки України, 2: 15-18.
Костромина Г.Н., Лебец И.С., Коломиец А.М. и др. (2002) Хронические артриты у детей и подростков. Основа, Харьков, 170 с.
Насонов Е.Л., Самсонов М.Ю, Тилз Г., Фукс Д. (2000) Неоптерин: новый иммунологический маркер аутоиммунных ревматических заболеваний. Клин. медицина, 8: 43-46.
Насонов Е.Л., Самсонов М.Ю., Чичасова Н.В. и др. (1998) Неоптерин: лабораторный маркер активации клеточного иммунитета при ревматоидном артрите. Тер. архив, 5: 26-32.
Нетяженко В.З., Мальчевська Т.Й. (1998) Основні сучасні погляди на патогенез, діагностику та лікування в ревматології. Клінічна фармакологія, фізіологія, біохімія, 3: 76-124.
Коваленко В.Н. (ред.) (2001) Ревматоидный артрит. Диагностика и лечение. МОРИОН, Киев, 270 с.
Фукс Д., Самсонов М.Ю., Нассонов Е.Л., Беленков Ю.Н. (1993) Клиническое значение неоптерина при заболеваниях человека. Тер. архив, 5: 80-87.
Arai K., Lee F., Miyajima A. et al. (1990) Cytokines: coordinators of immune and inflammatory responses. Ann. Rev. Biochem., 59: 783.
Bazzoni F., Beutler B. (1996) Tumor necrosis factor ligand and receptor families. N. Engl. J. Med., 334: 1717-1725.
Blum A., Miller H. (1998) Role of cytokines in heart failure. Am. Heart. J., 135: 181-186.
Dinarello C.A., Moldawer L.L. (1999) Proinflammatory and antiinflammatory cytokines in rheumatoid arthritis. Amgen. Inc., 190 p.
Feldman M., Brennan F., Maini R.N. (1996) Role of cytokines in rheumatoid arthritis. Ann. Rev. Immunol., 14: 397-440.
Horneff G., Sack U., Kalden J.R., Emmrich F., Burmester G.R. (1993) Reduction of monocyte-macrophage activation markers upon anti-CD4 treatment. Decreased levels of IL-1, IL-6, neopterin and soluble CD14 in patients with rheumatoid arthritis. Clin. Exp. Immunol., 91(2):
207-213.
Lacki J.K., Samborski W., Mackiewics S.N. (1997) Inter-leukin-10 and interleukin-6 in lupus erythematosus and rheumatoid arthritis, correlations with acute phase proteins. Clin. Rheumatol., 16(3):
275-278.
Oppenheim J., Rossio J., Gearing A.J.H. (1993) Clinical applications of cytokines: Role in diagnosis, pathogenesis, and therapy. Oxford University Press, 33: 115-118.
Schroecksnadel K., Kaser S., Ledochowski M. et al. (2003) Increased degradation of tryptophan in blood of patients with rheumatoid
arthritis. J. Rheumatol., 30(9): 1935-1939
Sfriso P., Ostuni P., Botsios C. et al. (2003) Serum and salivary neopterin and interferon-gamma in primary Sjogren’s syndrome. Correlation with clinical, laboratory and histopathologic features. Scand. J.
Rheumatol., 32(2): 74-78.
Tracey K.J., Cerami A. (1994) Tumor necrosis factor: a pleiotropic cytokine and therapeutic agent. Ann. Rev. Immunol., 45: 491-503
Verbruggen A., De Clerck L.S., Vereecke I. F. et al. (1998) Flow cytometrical determination of intracellular interleukin-1 p (IL-1 p), inter-leukin-6 (IL-6) and tumor necrosis factor-alpha (TNF-a) in monocytes: a comparision between rheumatoid arthritis and controls. J. Allergy Clin. Immunol., 101(1): 74.
Wiedermann C.J., Beimpold H., Herold M. et al. (1993) Increased levels of serum neopterin and decreased production of neutrophil superoxide anions in chronic heart failure with elevated levels of tumor
necrosis factor-alpha. J. Am. Coll. Cardiol., 22: 897-1901.
Wise C.A., Bennett L.B., Pascual V., Gillum J.D., Bow-cock A.M. (2000) Localization of a gene for familial recurrent arthritis. Arthritis Rheum., 43(9): 2041-2045.
Рівень інтерлейкіну (ІЛ)-18 у плазмі крові у пацієнтів з хворобою Бехчета. Чи пов’язана його експресія з активністю захворювання та клінічними проявами?
Musabak U., Pay S., Erdem H., SimsekI., PekelA., DincA., SengulandA. (2006)
Serum interleukin-18 levels in patients with Behcet’s disease. Is its expression associated with disease activity or clinical manifestations? Rheumatol. Intern., 26(6): 545-550.
ІЛ-18 — прозапальний цитокін, що відіграє вирішальну роль у Т-хелперній (Th 1) імунній відповіді. Мета дослідження — вивчити відношення рівня ІЛ-18 у плазмі крові до активності захворювання та клінічних проявів у пацієнтів з хворобою Бехчета (ХБ). У дослідженні взяли участь 20 здорових донорів та
60 пацієнтів із ХБ, розподілених на групи залежно від активного чи неактивного захворювання згідно з індексом активності Лідда. Виокремили системне ураження і ураження лише зі слизово-шкірними симптомами. Пацієнтів з системними проявами згруповали за наявністю очного, суглобового та судинного ураження. Рівень Ш-18 був достовірно вищим у субгрупах пацієнтів порівняно до групи контролю і корелював з активністю захворювання у пацієнтів з активним захворюванням. Участь ци-токіну в патогенезі хвороби Бехчета та його рівень корелює з активністю захворювання. Підвищений рівень U1-18 у пацієнтів з неактивним захворюванням підтверджує, що активація Th1 і субклінічне запалення персистує навіть у неактивний період захворювання.
Т.В. Марушко, В.В. Бережной, Т.И. Гавриленко, А.Ф. Клубова
Проведен анализ уровней нео-птерина, фактора некроза опухоли-a, интер-лейкина-10 в сыворотке крови у пациентов с ювенильным ревматоидным артритом в период обострения и в период клинической ремиссии. Получены данные о связи изменений их уровня со степенью активности патологического процесса.
Ключевые слова: ювенильный ревматоидный артрит, неоптерин, фактор некроза опухоли-a, интерлейкин-10.

Leave a comment