ОСОБЛИВОСТІ СУБКЛІНІЧНОГО ПЕРЕБІГУ ХРОНІЧНОЇ РЕВМАТИЧНОЇ ХВОРОБИ СЕРЦЯ
Резюме. У 54 дітей віком від 8 до 17 років та у 30 дорослих із хронічною ревматичною хворобою серця вивчали особливості клінічних, біохімічних та імунологічних показників залежно від перебігу хвороби. Встановлено нижчі показники активності протизапального цитокіну інтерлейкіну-10 у сироватці крові у дітей та дорослих із субклінічним перебігом хронічної ревматичної хвороби серця та вірогідно вищі показники фактора некрозу пухлини-α у дітей, що свідчить про їх патогенетичну роль у формуванні фіброзних змін у клапанах серця. Показано доцільність проведення допплерографії в осіб жіночої статі з частими запальними інфекціями носоглотки (ангіною, фарингітом) стрептококової етіології з метою вчасного виявлення ревматичної вади серця.
ВСТУП
Проблема хронічної ревматичної хвороби серця (ХРХС) залишається актуальною у всьому світі, незважаючи на значне зниження захворюваності на гостру ревматичну лихоманку (ГРЛ). Понад 15 млн людей у світі страждають від ХРХС, щороку реєструється 282 тис. нових випадків захворювання, та 233 тис. людей помирають від цієї хвороби та її ускладнень щорічно (Carapetis J.R. et al., 2005а). Проведений аналіз захворюваності на ГРЛ та поширеності ХРХС на різних континентах показав тенденції до зниження захворюваності на ГРЛ в останні 40 років (Seckeler M.D., 2011). Лише в Австралії та Новій Зеландії показники залишаються стабільно високими, з тенденцією до зростання. Водночас тенденція до зниження поширеності ХРХС спостерігається лише у високорозвинутих країнах Європи, на всіх інших континентах відзначено зростання поширеності хвороби за останні 20 років. Тому на сьогодні знову посилилася увага науковців до проблеми ХРХС. На думку деяких дослідників, зростання захворюваності пов’язане, в тому числі, і з поліпшенням діагностики, враховуючи впровадження ехокардіографічних методів (Marijon E. еt al., 2009; Bhaya M. et al., 2010). Вказується на поширеність випадків субклінічного кардиту, який не діагностується клінічно, при цьому можуть бути відсутні критерії Джонса для діагностики ГРЛ, відповідно в таких осіб не проводиться вторинна профілактика стрептококової інфекції, що в результаті призводить до формування вади серця (Tubridy-Clark M., Carapetis J.R., 2007; Ramakrishnan S., 2009).
В Україні щорічно реєструють близько 6 тис. людей з ревматизмом (Коваленко В.М. та співавт., 2006), ⅓ яких — пацієнти молодого і працездатного віку. Відзначається зниження абсолютних та відносних показників захворюваності та поширеності ГРЛ та ХРХС за останні роки (Дорогой А.П., 2005). Проте динаміка зниження цих показників при ГРЛ у 5 разів більша, ніж при ХРХС, що в цілому свідчить про підвищення захворюваності на ХРХС і часто призводить до інвалідності та передчасної смертності. У 30–50% пацієнтів із ХРХС в анамнезі не виявляють даних про перенесену ГРЛ (Ильяш М.Г., 2005).
Мета виконаної нами роботи — аналіз особливостей перебігу ХРХС у дітей та дорослих із субклінічним перебігом ревматичного кардиту для вчасного виявлення хвороби та запобігання ускладненню.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
Під спостереженням перебували 54 дітей віком від 8 до 17 років та 30 дорослих віком від 24 до 42 років із ХРХС.
Діагностику ХРХС проводили за наявності вади серця чи післязапального крайового фіброзу стулок клапанів серця. У 21 (38,9%) дітини та 14 (46,7%) дорослих в анамнезі не було даних про перенесену ГРЛ. Для виявлення особливостей субклінічного перебігу ХРХС всіх дітей та дорослих осіб розподілили на дві групи. І групу становили 33 дітей та 16 дорослих (Іа група) із ревматичним анамнезом, вада серця сформувалася після перенесеної ГРЛ чи повторних ревматичних атак. До ІІ групи увійшли 21 дитина та 14 дорослих (ІІа група) з ХРХС, в яких відсутні анамнестичні дані про перенесену ГРЛ, у них ймовірно був перенесений субклінічний ревматичний кардит.
Усім хворим було проведено загальноприйняте клініко-лабораторне обстеження, електрокардіографію та ехокардіографію серця. Клітинну ланку імунітету визначали за субпопуляціями Т- і В-лімфоцитів за допомогою реакції розеткоутворення з еритроцитами, на яких адсорбовані моноклональні антитіла проти рецепторів СD3+, СD4+, СD8+, СD22+, СD16+, використовуючи еритроцитарні діагностикуми ТОВ НВЛ «Гранум» (Харків). Гуморальну ланку імунітету визначали за вмістом імуноглобулінів (Іg) А, М, G, Е за методом двосайтового імуноферментного аналізу з використанням специфічних антиглобулінових кон’югатів. Вміст прозапальних цитокінів (фактор некрозу пухлини (ФНП)-α, інтерлейкін (ІЛ)-8, інтерферон (ІФН)-γ) та протизапальних цитокінів (ІЛ-4, ІЛ-10) визначали в сироватці крові методом твердофазного імуноферментного аналізу з використанням тест-наборів ТОВ «Укрмед Дон», Донецьк, результати виражали в пг/мл.
Статистичну обробку результатів проводили з використанням програми «Microsoft Exel» та «Statistica — 6.0». Достовірність середніх величин визначали за допомогою критерію Стьюдента.
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ ТА ЇХ ОБГОВОРЕННЯ
В обох групах дітей та дорослих переважали жителі сільської місцевості, які становили загалом 64,8 та 80,0% відповідно. Хоча вірогідної різниці між процентним співвідношенням мешканців міста та села обох груп у дитячого населення не встановлено, у І групі жителі сільської місцевості переважали над жителями міста в 1,5 раза, тоді як у ІІ групі — в 2,5 раза (рис. 1). Серед дорослих в обох групах мешканці сільської місцевості переважали над жителями міста у 4 рази. Це свідчить про нижчу обізнаність мешканців села щодо методів первинної профілактики ГРЛ та менший їх доступ до висококваліфікованої медичної допомоги.
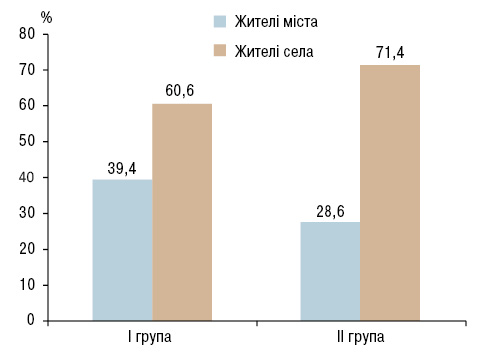
Рис. 1. Розподіл дітей із ХРХС за місцем проживання
Якщо в І групі дітей переважали хлопчики, які становили >⅔ дітей цієї групи (рис. 2), то в ІІ групі дітей явної переваги не встановлено (10 — 47,6% хлопчиків та 11 — 52,4% дівчаток). У дорослих в обох групах переважали жінки: в Іа групі — 10 (62,5%); у ІІа групі — 9 (64,3%).
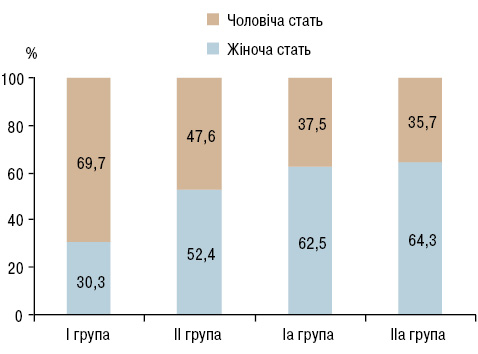
Рис. 2. Розподіл пацієнтів із ХРХС за статтю
За віком в обох групах дітей переважали пацієнти препубертатного та пубертатного віку (від 13 до 17 років), яких було 51 (94,4%). Суттєвої різниці за віком між обома групами у дітей та дорослих не встановлено.
Вади серця у дітей ІІ групи частіше виявляли випадково, при госпіталізації з приводу інших захворювань. В окремих випадках патологію з боку серця було запідозрено при оформленні у спортивну секцію чи при плановому медичному огляді. У дорослих ІІ групи у більшості випадків хворі зверталися за допомогою з вираженими змінами з боку серцево-судинної системи, з ознаками серцевої недостатності (СН). Пацієнти зверталися після втрати свідомості, з приводу вираженої задишки, прискореного серцебиття, відчуття перебоїв y роботі серця. Кілька хворих лікувалися з приводу пневмонії чи тяжкого перебігу респіраторної вірусної інфекції. В окремих випадках ваду серця виявлено випадково при обстеженні у період вагітності.
У ⅓ дітей як І, так і ІІ групи відзначали часті запальні захворювання носоглотки (ангіну, фарингіт).
У 47 (87,0%) дітей із ХРХС (ІІ група) спостерігалося ураження мітрального клапана. Недостатність мітрального клапана (НМК) діагностована у 38,9% пацієнтів: ⅓ дітей І групи та у ½ хворих ІІ групи. Недостатність аортального клапана (НАК) виявляли у 1 (3,0%) дитини І групи та у 3 (14,3%) хворих ІІ групи. Комбіновані вади серця у 2 рази частіше спостерігали у хворих І групи (відповідно у 7 (21,2%) — І групи та у 2 (9,5%) дітей ІІ групи). Частіше виявляли комбіновані мітральні вади серця з перевагою недостатності. У 16 (29,6%) виявляли поєднане ураження мітрального й аортального клапанів (у 9 (27,3%) дітей І групи та у 7 (33,3%) хворих ІІ групи відповідно), частіше також виявляли НМК та НАК. Пролапс мітрального клапана, в основному ІІ ступеня з регургітацією, відзначено у 7 (21,2%) дітей І групи. Післязапальний фіброз стулок клапанів серця з однаковою частотою відзначався в обох групах (відповідно у 4 (12,1%) та 3 (14,3%)).
При ХРХС (ІІ група) у дорослих у 28 (93,3%) були комбіновані вади серця. Найчастіше — мітральні вади з перевагою стенозу ІІІ–ІV ступеня — у 18 (60,0%) хворих, у 5 (16,7%) пацієнтів вони поєднувалися з НАК та у 7 (23,3%) — з відносною недостатністю трикуспідального клапана. Лише у 4 (13,3%) хворих мала місце мітральна вада з перевагою недостатності. Аортальні вади рідше — у 8 (26,7%) хворих, дещо частіше з перевагою недостатності клапана. Ураження двох клапанів (мітрального і аортального) діагностовано у більшості хворих — у 16 (53,3%). Суттєвої різниці між обома групами дорослих пацієнтів щодо частоти уражень певних клапанів серця не спостерігалося.
Таким чином, топіка і характер уражень клапанів серця мало залежить від перебігу хвороби. При латентному перебігу вальвуліту у дітей у 2 рази рідше спостерігали комбіновані вади серця, для формування яких, очевидно, необхідний час. В цій групі в 1 дитини вперше було діагностовано комбіновану мітральну ваду серця з вираженою мітральною недостатністю та мінімальним стенозом, яка поєднувалася з помірною до значної аортальною недостатністю та супроводжувалась значною легеневою гіпертензією. У цьому разі ваду серця було запідозрено лікарями районної лікарні кілька років тому, проте мама відмовлялася від обстежень та лікування. Дівчинка була доставлена в обласну лікарню у тяжкому стані, з вираженими ознаками СН. У другому випадку формування комбінованої аортальної вади серця з перевагою стенозу мало місце у дитини з двостулковим аортальним клапаном. Набуту ваду серця виявлено 3 роки тому, вторинна профілактика не проводилась у зв’язку з алергічною реакцією на біцилін, що призвело до прогресування хвороби. У дорослих комбіновані вади серця виявляли з однаковою частотою як при латентному перебігу, так і у хворих із ревматичним анамнезом.
Якщо у дітей переважають вади серця з недостатністю клапанів, то у дорослих при прогресуванні хвороби у більшості випадків формується стеноз.
У дітей вади серця тривалий період мають компенсований характер, про що свідчить відсутність ознак СН у 12 (36,4%) хворих І групи та у 9 (42,8%) дітей ІІ групи. Відповідно у 14 (42,4%) та у 9 (47,6%) пацієнтів обох груп спостерігалися прояви хронічної СН І ступеня, у решти — ІІа ступеня, в 1 дитини — ІІб ступеня. У дорослих пацієнтів переважали ознаки СН ІІа ступеня (у 14–87,5% та у 10–71,5% відповідно), більшість (60,0%) із них було віднесено до ІІІ функціонального класу.
При порівнянні окремих показників загального та біохімічного аналізів крові (табл. 1) вірогідну різницю відзначено лише у підвищенні рівня церулоплазміну у дорослих із ХРХС з ревматичним анамнезом, що може свідчити про вищу активність запального процесу в цій групі. Враховуючи відсутність достовірної різниці у показниках лейкоцитів, швидкості осідання еритроцитів (ШОЕ), рівня оксипроліну та церулоплазміну у дорослих та дітей контрольної групи, ми порівняли ці показники у дорослих та дітей аналогічних груп. Відзначено вірогідно вищі показники рівня лейкоцитів у дорослих ІІа групи порівняно з дітьми ІІ групи (р<0,05), зростання показників ШОЕ (р<0,05) у дорослих у порівнянні з дітьми, що може свідчити про посилення запального патологічного процесу при прогресуванні хвороби. У дорослих із ХРХС поглиблюються процеси дезорганізації сполучної тканини, на що вказують вищі показники оксипроліну (р<0,01). У дорослих із субклінічним перебігом вальвуліту спостерігаються нижчі показники супероксиддисмутази (СОД) порівняно з аналогічною групою дітей (р<0,05), що може свідчити про декомпенсацію адаптаційних механізмів та подальше зниження антиоксидантного захисту.
| Показник | Діти (n=54) | Дорослі (n=30) | ||
|---|---|---|---|---|
| І група | ІІ група | Іа група | ІІа група | |
| Лейкоцити, 10/л | 6,04±0,28 | 6,63±0,35 | 7,10±1,05 | 8,97±0,93* |
| ШОЕ, мм/год | 5,11±0,48 | 4,50±0,47 | 16,69±4,18* | 14,36±3,12* |
| Церулоплазмін, мг/л | 361,56±15,62 | 397,00±29,63 | 521,19±30,30 | 423,23±27,95^ |
| Оксипролін, мкмоль/л | 44,63±5,66 | 42,53±4,95 | 70,26±4,14** | 63,56±4,70** |
| СОД, ум. од. акт. | 49,13±2,81 | 55,66±3,94 | 48,51±2,45 | 45,04±1,94* |
^р<0,05 порівняно з показниками Іа та ІІа груп; *р<0,05 порівняно з показниками дорослих та дітей відповідних груп; **р<0,01 порівняно з показниками у дорослих та дітей відповідних груп.
При порівнянні імунологічних показників у дітей обох груп (табл. 2) встановлено вірогідне зростання рівня Іg A (р<0,05) у пацієнтів ІІ групи та суттєве підвищення концентрації ІgЕ (р<0,05) у хворих І групи. При цьому також суттєво підвищувався рівень ФНП-α (р<0,01) у дітей ІІ групи. Відзначено достовірно нижчі показники ІЛ-10 (р<0,05) у дітей та дорослих із ХРХС, в яких не було даних про перенесену ГРЛ, що може свідчити про його патогенетичне значення у формуванні ХРХС.
| Показник | Діти (n=54) | Дорослі (n=30) | ||
|---|---|---|---|---|
| І група | ІІ група | Іа група | ІІа група | |
| CD3+, % | 50,89±1,48 | 50,90±2,33 | 44,81±0,95 | 48,57±1,98* |
| CD22+, % | 14,72±0,95 | 14,40±1,03 | 12,13±0,86 | 10,93±0,44 |
| CD16+, % | 13,33±0,34 | 13,50±0,58 | 10,75±0,39 | 11,57±0,41 |
| CD4+, % | 34,17±0,88 | 33,22±1,55 | 31,44±0,79 | 33,93±1,31 |
| CD8+, % | 15,83±0,58 | 16,56±0,95 | 13,00±0,35 | 14,07±0,63 |
| CD4+/CD8+ | 2,18±0,06 | 2,02±0,07 | 2,41±0,06 | 2,40±0,05 |
| ІgA, г/л | 1,80±0,14 | 2,22±0,12* | 2,74±0,23 | 2,62±0,18 |
| ІgM, г/л | 1,30±0,05 | 1,29±0,05 | 1,48±0,09 | 1,79±0,12* |
| ІgG, г/л | 14,13±1,29 | 15,00±0,92 | 19,01±2,18 | 19,46±2,11 |
| ІgE, 10 Од/л | 398,58±106,47 | 134,50±37,70* | 249,90±95,75 | 221,40±58,48 |
| ЦІК, ум. од. | 156,93±17,18 | 166,38±16,90 | 226,81±11,54 | 221,79±21,01 |
| ФНП-α, пг/мл | 82,57±7,64 | 143,88±10,97** | 121,99±20,40 | 115,13±20,17 |
| ІЛ-4, пг/мл | 103,38±15,21 | 107,13±20,05 | 184,69±30,56 | 147,16±30,90 |
| ІЛ-8, пг/мл | 38,78±2,10 | 45,30±2,87 | 81,01±26,13 | 75,32±14,91 |
| ІЛ-10, пг/мл | 137,34±42,11 | 38,73±3,90* | 141,42±23,35 | 71,27±11,02* |
| ІФН-γ, пг/мл | 7,54±1,53 | 10,38±0,88 | 118,24±51,84 | 25,07±7,21 |
*р<0,05 порівняноз показниками І та ІІ; Іа та ІІа груп; **р<0,01 порівняно з показниками І та ІІ груп.
У дорослих виявлено вірогідно вищі показники CD3+ (р<0,05) та ІgM (р<0,05) у ІІа групі хворих дорослих пацієнтів із ХРХС. Можливо, вищий рівень загальних Т-клітин забезпечує легший перебіг стрептококової інфекції, що, з іншого боку, має і негативні наслідки, оскільки такі хворі не звертаються за допомогою і не отримують адекватної терапії, а вищі показники ІgM свідчать про зростання антитілоутворення.
ДИСКУСІЯ
У багатьох популяціях ГРЛ та ХРХС частіше відзначаються у жіночої статі, ніж у чоловічої, оскільки, як вважається, вони сприйнятливіші до стрептококів групи А (Carapetis J.R. et al., 2005б), інші це пов’язують з генетичними факторами (Guilherme L., Kalil J., 2007). E. Marijon та співавтори (2009) показали, що при класичному перебігу ГРЛ, коли діагноз можна встановити на основі критеріїв Джонса, не було встановлено переваги осіб жіночої статі. Водночас серед дітей із субклінічним перебігом ревматичної хвороби серця переважали дівчатка. Наші результати також показують, що у дітей із латентним перебігом вальвуліту зростає частка осіб жіночої статі, тоді як у дітей з перенесеною ГРЛ переважають хлопчики. Цей факт опосередковано підтверджує велику кількість латентного перебігу ревматизму в дитячому віці. У дорослих, коли ХРХС має виражені клінічні прояви, з ознаками СН, перевага осіб жіночої статі стає очевидною, з нівелюванням різниці між групами.
Термін «субклінічний кардит» (ехокардит, асимптоматичний кардит) в основному використовується в контексті ГРЛ (Vijayalakshmi I.B. et al., 2008). Він діагностується до 53% (Ramakrishnan S., 2009), в середньому у 15–17% дітей з ГРЛ. Субклінічний кардит віднесено до великих критеріїв ГРЛ у Австралії та Новій Зеландії у дітей групи високого ризику (Carapetis J.R. et al., 2007). Інші автори використовують цю термінологію і до ХРХС (Figueroa F.E. et al., 2001; Marijon E. еt al., 2009), особливо за наявності морфологічних змін клапанів, які більше характерні для хронічного ревматичного ураження клапанів. Автори вважають, що в цьому разі важливіше значення має вибір правильної тактики введення цих хворих, із призначенням засобів вторинної профілактики. Результати проведеного дослідження (Figueroa F.E. et al., 2001) свідчать про однакову частоту формування вад серця у дітей із клінічною картиною ГРЛ відповідно до критеріїв Джонса та у дітей із субклінічним кардитом протягом 1 та 5 років спостереження.
Можливо, у формуванні вад серця у дітей та дорослих із ревматичним анамнезом більше значення мають повторні ревматичні гарячки, тоді як при латентному перебігу мають місце інші тригери, що призводить до розростання фіброзної тканини у клапанах серця. Показано ключову роль цитокінів в активації імунологічних та запальних реакцій при ГРЛ, де основна роль відводиться ФНП-α (Guilherme L. et al., 2011). P. Chorpa та H. Gulwani (2007) вказують на роль про- та протизапальних цитокінів у прогресуванні фіброзу клапанів серця внаслідок їх ревматичного ураження. Показано недостатню продукцію регуляторного цитокіну ІЛ-4 у сполучній тканині клапанів серця при високих показниках продукції ІЛ-10 тканинами клапанів та міокарда, що також свідчить про складну імунну відповідь та порушення регуляції цитокінів у клапанах серця, що може призводити до їх ураження (Guilherme L., Kalil J., 2007). ІЛ-10 є одним із найважливіших протизапальних цитокінів. Він діє через трансмембранний рецепторний комплекс та регулює функції багатьох різних імунних клітин (Sabat R. et al., 2010). Встановлено генотип ІL-10–1082G/A, який часто виявлявся у єгипетських пацієнтів із ХРХС, що асоціювалося зі множинним ураженням клапанів і тяжким перебігом хвороби (Settin A. et al., 2007). Високі показники ІЛ-10 у тканинах клапанів серця при відносно нижчих у сироватці крові можуть свідчити про їх міграцію до серцевих тканин у відповідь на запальний процес.
Отже, недостатня активність протизапального цитокіну ІЛ-10 при високій активності прозапальних цитокінів у дітей із частими запальними інфекціями носоглотки (ангіною, фарингітом) стрептококової етіології завжди має насторожити лікаря щодо можливого субклінічного перебігу ХРХС. Це ще раз підтверджує доцільність проведення допплерографічного обстеження у дітей групи ризику ревматизму, особливо у осіб жіночої статі, в яких частіше спостерігали субклінічний перебіг.
ВИСНОВКИ
1. У дітей із ХРХС частіше проявляється НМК (у 38,9%), тоді як у дорослих у 93,3% виявляли комбіновані вади серця, найчастіше мітральні, з перевагою стенозу ІІІ–ІV ступеня. Топіка та характер уражень клапанів серця мало залежaть від перебігу хвороби.
2. У дорослих із ХРХС із ревматичним анамнезом встановлено вищу активність запального процесу, яка проявлялася підвищенням рівня церулоплазміну.
3. Підвищення рівня лейкоцитів, зростання показників ШОЕ у дорослих із ХРХС свідчить про посилення запального патологічного процесу, а зростання рівня оксипроліну — про поглиблення процесів дезорганізації сполучної тканини при прогресуванні хвороби.
4. У дітей та дорослих із субклінічним перебігом ХРХС встановлено нижчі показники активності протизапального цитокіну ІЛ-10 у сироватці крові та вірогідно вищі показники ФНП-α у дітей, що свідчить про їх патогенетичну роль у формуванні фіброзних змін у клапанах серця.
5. Особи жіночої статі з частими запальними інфекціями носоглотки (ангіною, фарингітом) стрептококової етіології мають проходити ретельне обстеження з метою вчасного виявлення ревматичної вади серця.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- Дорогой А.П. (2005) Динаміка показників поширення гострої ревматичної гарячки і хронічних ревматичних хвороб серця серед населення України. Укр. ревматол. журн., 4(22): 7–9.
- Ильяш М.Г. (2005) Новое в лечении пороков сердца. ДСГ Лтд, Киев, 80 с.
- Коваленко В.М., Дорогой А.П., Борткевич О.П. (2006) Ревматизм. Украинская медицинская газета, 7–8: 8–9.
- Bhaya M., Panwar S., Beniwal R. et al. (2010) High prevalence of rheumatic heart disease detected by echocardiography in school children. Echocardiography, 27: 448–453.
- Carapetis J.R., Steer A.C., Mulholland E.K. et al. (2005а) The global burden of group A streptococcal diseases. Lancet Infect Dis., 5: 685–694.
- Carapetis J.R., Mc Donald M., Wilson N.J. (2005b). Acute rheumatic fever. Lancet, 366: 155–168.
- Carapetis J.R., Brown A., Wilson N.J. et al. (2007) Rheumatic Fever Guidelines Writing Group. An Australian guideline for rheumatic fever and rheumatic heart disease: an abridged outline. Med. J. Aust.,186: 581–586.
- Chorpa P., Gulwani H. (2007) Pathology and pathogenesis of rheumatic heart disease. Indian J. Pathol. Microbiol, 50(4): 685–697.
- Figueroa F.E., Fernandes M.S., Valdes P. et al. (2001) Prospective comparison of clinical and echocardiographic diagnosis of rheumatic carditis: long term follow up of patients with subclinical disease. Heart, 85: 407–410.
- Guilherme L., Kalil J. (2007) Rheumatic fever: from innate to acquired immune response. Ann. N.Y. Acad. Sci., 1107: 426–433.
- Guilherme L., Kohler K.F., Postol E. et al. (2011) Genes, autoimmunity and pathogenesis of rheumatic heart disease. Ann. Pediatric Rheumatology, 4(1): 13–21.
- Marijon E., Celermajer D., Tafflet M. et al. (2009) Rheumatic heart disease screening by Echocardiography: the inadequacy of world health organization criteria for optimizing the diagnosis of subclinical disease. Circulation, 120(8): 663–668.
- Ramakrishnan S. (2009) Echocardiography in acute rheumatic fever. Ann. Pediatr. Cardiol., 2(1): 61–64.
- Sabat R., Grutz G., Warszawska K. et al. (2010) Biology of interleukin-10. Cytokine Crowth Factor Rev., 21: 331–344.
- Seckeler M.D. (2011) The worldwide epidemiology of acute rheumatic fever and rheumatic heart disease. Clinical Еpidemiology, 3: 67–84.
- Settin A., Abdel-Hady H., El-Baz R., Saber I. (2007) Gene polymorphisms of TNF-alpha (-308), IL-10(-1082), IL-6(-174), and IL-1Ra(VNTR) related to susceptibility and severity of rheumatic heart disease. Pediatr. Cardiol., 28: 363–371.
- Tubridy-Clark M., Carapetis J.R. (2007) Subclinical carditis in rheumatic fever: A systematic review. Int. J. Cardiol., 119: 54–58.
- Vijayalakshmi I.B., Vishnuprabhu R.O., Chitra N. et al. (2008) The efficacy of echocardiographic ctiterions for the diagnosis of carditis in acute rheumatic fever. Cardiol. Young, 18(6): 586–592.
ОСОБЕННОСТИ СУБКЛИНИЧEСКОГО ТЕЧЕНИЯ ХРОНИЧЕСКОЙ РЕВМАТИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА
Резюме. У 54 детей в возрасте от 8 до 17 лет и 30 взрослых с хронической ревматической болезнью сердца изучали особенности клинических, биохимических и иммунологических показателей в зависимости от течения болезни. Установлены более низкие показатели противовоспалительного цитокина интерлейкина-10 в сыроватке крови у детей и взрослых с субклиническим течением хронической ревматической болезни сердца и достоверно выше показатели фактора некроза опухоли-α у детей, что свидетельствует об их патогенетической роли в формировании фиброзных изменений в клапанах сердца. Показана необходимость проведення допплерографии у лиц женского пола с частыми воспалительными инфекциями носоглотки (ангиной, фарингитом) стрептококковой этиологии для своевременного выявления ревматического порока сердца.
хроническая ревматическая болезнь сердца, субклинический кардит, цитокины.
Адреса для листування:
Боярчук Оксана Романівна
46000, Тернопіль, вул. Лесі Українки, 18/134
Е-mail: boyarchuk_oksana@mail.ru

Leave a comment