Нові аспекти патогенезу остеоартрозу та шляхи корекції
Шуба Н.М., Воронова Т.Д., Тарасенко Т.М. , Крилова А.С.
Резюме. На сьогодні встановлено нові механізми розвитку остеоартрозу (ОА), які обґрунтовують механізм дії та безпеку як протизапальних, так і структурно-модифікуючих препаратів. Серед протизапальних препаратів препаратом вибору можна вважати німесулід, враховуючи його не-ЦОГ-залежний ефект. У представлених даних показано, що найбільш адекватним препаратом (який має як протизапальний, так і структурно-модифікуючий ефект) можна вважати хондроїтин сульфат-4 та -6, з метою вивчення дії якого проведена найбільша кількість досліджень з доказовою базою. В окремих дослідженнях показана плейотропна дія хондроїтин сульфату-4 та -6, що надзвичайно важливо у пацієнтів із ОА, у яких досить часто наявна супутня патологія. У дослідженні із застосуванням найбільш інформативного методу, яким є магнітно-резонансна терапія, підтверджено сповільнення втрати хряща через 6 і 12 міс та зменшення розмірів пошкодження кісткової тканини через 12 міс. Доведене сповільнення втрати хрящової тканини і кістки має важливе значення у прогресуванні ОА, оскільки ці механізми є спільними в розвитку пошкодження обох тканин. Тому при виборі препаратів для терапії ОА необхідно керуватися їх впливом на механізми розвитку ОА та їх безпекою.
Остеоартроз (ОА) — найчастіше захворювання суглобів у багатьох популяціях земної кулі, яке зазвичай маніфестує у осіб віком старше 40 років. Велике епідеміологічне дослідження у США виявило рентгенографічні ознаки ОА, принаймні, однієї суглобової групи в ⅓ дорослих віком 25–75 років, а розповсюдженість його підвищувалася з віком. Так, серед осіб віком 65 років захворювання діагностували у 50% випадків, а старше 75 років — у 80%. За оцінками епідеміологів встановлений лікарями діагноз ОА мають понад 20 млн дорослих США. Діагноз ОА раніше обґрунтовували лише рентгенологічними критеріями. Частота болю в колінних суглобах за наявності рентгенологічного ОА, за даними різних досліджень, становила від 40 до 80%, а підвищення частоти болю спостерігалось у осіб віком ≥50 років (Zhang W., 2010).
ОА — гетерогенна група дегенеративних захворювань суглобів різної етіології з подібними біологічними, морфологічними та клінічними проявами і наслідками. До патологічних проявів ОА належать пошкодження суглобового хряща, ураження субхондральної кістки, запальні процеси в синовіальній оболонці, ураження зв’язок та капсули суглоба, ураження м’язів.
Важливими факторами ризику розвитку ОА вважають генетичну схильність, а саме — порушення синтезу колагену II типу та зміни гена колагену II типу, статеві відмінності (вплив естрогенів), вікові, расові відмінності, ожиріння, щільність кісткової тканини, нестабільність суглобів, травми.
Крім того, на сьогодні важливе значення у прогнозуванні ОА має рівень С-реактивного білка. Так, високий рівень С-реактивного білка, незважаючи на низький рівень запального процесу, асоціюється з тяжким перебігом ОА навіть при нетривалому терміні захворювання. Тому необхідно проводити моніторинг С-реактивного білка як показника перебігу ОА (Sturmer T. et al., 2004).
Слід відзначити, що колаген II типу — найбільш http://essaybuyersclub.com/ характерний головний структурний компонент матриксу хряща. Екскреція метаболіту колагену II типу (С-телопептиду колагену II типу) з сечею є важливим маркером деградації хряща. С-телопептид колагену II типу є раннім, специфічним і чутливим критерієм розвитку ОА. Екскреція С-телопептиду колагену II типу з сечею залежить від: віку, статі, менопаузи, маси тіла (Mouritzen U. et al., 2003).
Максимальна екскреція С-телопептиду колагену II типу спостерігається у віці 20–25 років, а мінімальна — у віці 40–45 років незалежно від статі. У жінок у віці 50–55 років рівень екскреції С-телопептиду колагену II типу вищий вдвічі ніж у 40–45 років. У чоловіків підвищення екскреції С-телопептиду колагену II типу спостерігається після 55 років, а потім і у чоловіків, і у жінок підвищення — аналогічне. Екскреція рівня С-телопептиду колагену II типу корелює зі збільшенням маси тіла (Mouritzen U. et al., 2003). Тому, визначення екскреції С-телопептиду колагену II типу має велике значення у діагностиці, прогресуванні ОА та в контролі ефективності лікування.
ОА — патологія з досить складним патогенезом, за участю різних медіаторів, що призводять до імунних порушень з розвитком запалення та деструкції хрящової тканини.
З кожним роком розширюються уявлення про патогенез ОА.
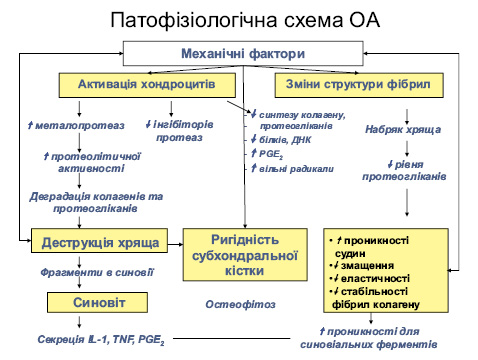
Важливе значення у розвитку ОА належить механічним факторам. Так, при ідіопатичному ОА навіть незначні фізичні навантаження можуть призводити до розвитку ОА, а при вторинному ОА — лише значні фізичні навантаження спричиняють його розвиток.
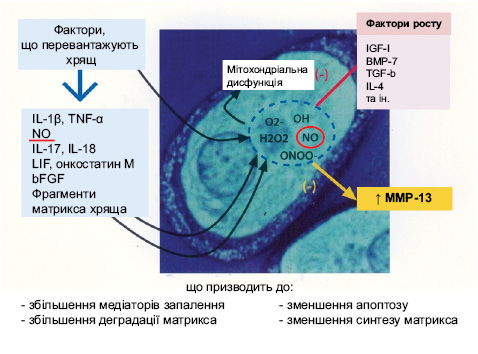
Значення механічних факторів та запуск інших факторів та медіаторів у розвитку ОА представлені на рис. 1.
На сьогодні у розвитку ОА надається велике значення цитокінам.
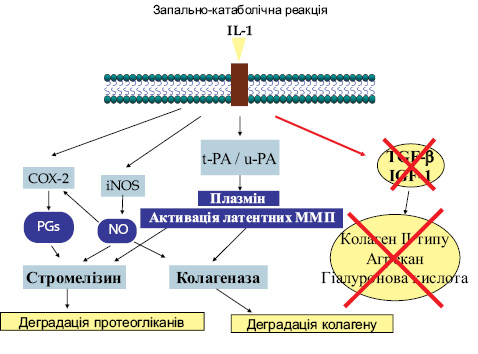
На рис. 2 показана роль IL-1β у патогенезі ОА.
Відзначаються особливості механізмів розвитку ОА у пацієнтів з ожирінням (Richette P., Funk-Brentano T., 2010). Недавні спостереження показали зв’язок між ожирінням та розвитком ОА через системне запалення. Встановлено, що підвищення індексу маси тіла >27 кг/м підвищує ризик ОА на 15%. Крім того, стало відомо, що жирова тканина, як ендокринний орган, синтезує різноманітні прозапальні медіатори та адипокіни (зокрема лептин), які призводять до пошкодження хряща у пацієнтів із ожирінням.
Збільшення маси жирової тканини призводить до акумуляції клітин запалення та особливо — макрофагів, які секретують прозапальні цитокіни, такі як — IL-6, TNF-α і сироватковий амілоїд А.
Встановлено також зв’язок між підвищенням рівня лептину, IL-6, конституцією та коксартрозом у людей похилого віку (рис. 3).
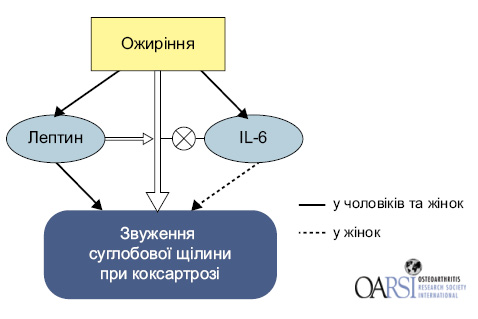
Відзначимо, що IL-6, який переважно синтезується у жировій тканині у пацієнтів із ожирінням, також може продукуватися жировою тканиною надколінника та підколінника всередині суглоба (Richette P., Funk-Brentano T., 2010). На сьогодні встановлено взаємозв’язок змін у кістковій тканині та деградації хряща, також встановлено зв’язок мікротравм субхондральної кістки з пошкодженням хряща (Richette P., Funk-Brentano T., 2010).
Т. Saito та співавтори (2010) встановили центральну роль фактора, індукуючого гіпоксію (HIF-2α) у патогенезі ОА, який накопичується внаслідок різноманітних стресів, запалення, біомеханічного пошкодження, що призводить до гіпертрофії хондроцитів. Підвищення HIF-2α призводить до збільшення протеаз, які зумовлюють деградацію хряща, в той час як дефіцит HIF-2α захищає хрящ від деградації та утворення остеофітів.
На ранніх стадіях ОА гіпертрофія хондроцитів є ключовим фактором його прогресування.
Гіпертрофія хондроцитів пов’язана з мітоген-активованою протеїнкіназою, яка модулюється ЕРК1/2 і р38 (Richette P., Funk-Brentano T., 2010) (рис. 4).
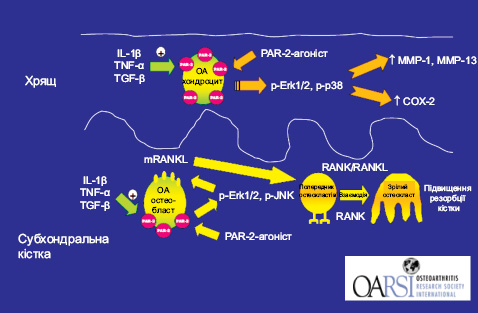
У результаті механічної компресії остеобластів субхондральної кістки підвищується продукція IL-6 та знижується рівень остеопротегерину.
Зниження співвідношення остеопротегерину/RANKL (ліганд рецепторів активаторів нуклеарного фактора (NF)-κβ) призводить як до пошкодження кістки, так і хряща.
Ін’єкції остеопротегерину інтраартикулярно та інтраперитонеально запобігають деградації хряща (Richette P., Funk-Brentano T., 2010).
Kwan Tat та співавтори (2009) показали, що хондроцити також експресують остеопротегерин, RANK, RANKL. Дослідники встановили, що зниження співвідношення остеопротегерин/RANKL значно прискорює прогресування ОА.
Результати останніх досліджень свідчать, що між кістковою та хрящовою тканинами існують спільні та залежні між собою механізми взаємодії.
Велике значення в пошкодженні субхондральної кістки має порушення WNT/бета-катенінового шляху, який зумовлює відновлення кісткової тканини (Richette P., Funk-Brentano T., 2010).
Недавні дослідження британських, китайських та японських вчених підтвердили генетичні аспекти ОА, а саме, що фактор гена росту і диференціації (GDF)-5 пов’язаний із ризиком розвитку ОА дрібних суглобів рук, колінних суглобів, ризиком переломів у жінок похилого віку, а також зі зростом пацієнтів (низький зріст) (Valdes A.M. et al., 2009).
В останні роки показана також провідна роль у патогенезі ОА супероксидних order essay радикалів кисню, індуцибельної NO-синтази (іNOS), NF-κβ.
Роль супероксидних радикалів кисню зображено на рис. 5.
Окрім супероксидних радикалів кисню в патогенезі ОА значна роль належить ідуцибельній NO-синтазі.
На сьогодні відомо три ізоформи NO-синтази:
- нейронна NO-синтаза (nNOS), яка здійснює метаболічні процеси в нервовій тканині;
- ендотеліальна NO-синтаза (eNOS), якій належить основна роль у вазодилатації;
- індуцибельна NO-синтаза (iNOS), якій притаманна значна роль у здійсненні фагоцитозу (рис. 6) та в запаленні.
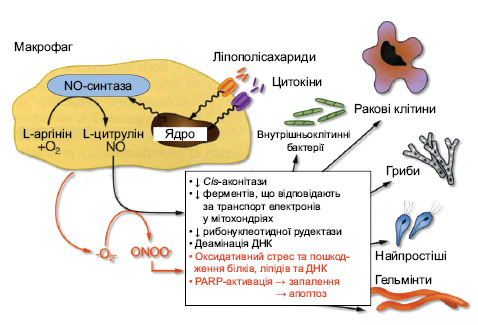
В останні роки встановлена роль оксиду азоту (NO) в патогенезі ОА (Lotz M. 1999; Abramson S.B., et al., 2001; Abramson S.B., Amin A., 2002; Fermor B. et al., 2007), а саме:
1. iNOS через NO може призводити безпосередньо до патологічних змін у суглобах.
2. У хондроцитах iNOS індукується цитокінами, особливо IL-1β та TNF-α, стимулюючи їх власну продукцію, що призводить до прогресуючої деструкції суглобового хряща.
3. Надмірна продукція NO в суглобі пригнічує матриксний синтез та викликає його руйнацію.
4. NO викликає пошкодження клітин внаслідок утворення пероксинітриту (ONOO), а також апоптоз хондроцитів.
5. Застосування інгібіторів NOS в експериментальному артриті викликало зменшення запалення синовії, деструкції хряща та кістки.
Яким чином можна впливати на утворення супероксидних радикалів кисню, іNOS, ONOO та апоптоз хондроцитів?
Враховуючи суттєву роль нестероїдних протизапальних препаратів (НПЗП) у лікуванні пацієнтів із ОА, а саме в усуненні больового синдрому та запалення, особливо важливим є вибір НПЗП з урахуванням їх безпеки та впливу на хрящову тканину.
Враховучи не-ЦОГ-залежні механізми дії німесуліду, а саме: блокування супероксидних радикалів кисню, активності iNO-синтази і, відповідно, утворення NO та ONOO, інгібіцію IL-6, які є ключовими медіаторами у процесі руйнування хряща та розвитку запального процесу, а також відміну апоптозу хондроцитів, блокування колагенази та стромелізину, що приводить до зменшення деградації колагену II типу та протеогліканів, тобто хондропротекторну дію німесуліду, його можна вважати препаратом вибору при ОА.
Оскільки ОА частіше діагностується у осіб похилого віку зі супутньою кардіоваскулярною патологією, то такі властивості німесуліду, як активація синтезу інгібітора тканинного активатора плазміногену, блокування синтезу тромбоцитактивуючого фактора є надзвичайно важливими у запобіганні тромбоемболічним ускладненням (Rainsford K.D., 2006).
Третій важливий фактор у патогенезі ОА — NF-kB (рис. 7) — один із провідних регуляторів процесу запалення в різних тканинах при різних патологіях. Він контролює експресію генів запалення, імунної відповіді та апоптозу. NF-kB міститься в цитоплазмі в неактивній формі, а під дією IL-1β, TNF-α відбувається активація супероксидних радикалів і транслокація NF-kB в ядро. NF-kB змінює транслокацію понад 150 генів, що викликає запалення, апоптоз та аутоімунні захворювання.
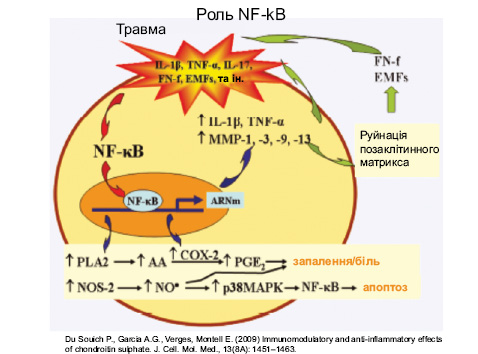
Вивчення патогенезу ОА має важливе значення в обґрунтуванні вибору структурно-модифікуючої терапії.
В останні роки отримані важливі результати, які відображають механізми дії хондроїтин сульфату, зокрема хондроїтин сульфату (ХС)-4 та ХС-6.
Слід враховувати терапевтичну активність та переносимість хондроїтин сульфатів різної якості та походження (Volpi N., 2009).
Якість препарату, що містить хондроїтин сульфат, визначається:
- кількістю сульфатованих та несульфатованих хондроїтинів;
- ХС-4;
- ХС-6;
- співідношенням ХС-4 і ХС-6;
- співвідношенням хондроїтин сульфату та домішок;
- очисткою діючої речовини;
- молекулярною масою та біодоступністю.
ХС-4 відіграє важливу роль у метаболізмі як хрящової, так і кісткової тканини, а його втрата має важливе значення у розвитку ОА. У відновленні ХС-4 важливу роль відіграє препарат ХС-4 та ХС-6. ХС-4 та ХС-6 (Структум) — єдиний хондроїтин сульфат пташиного походження визначається високим вмістом ХС-4 (72%), сульфатованістю (100%), низькою молекулярною масою (13 кДа), високим вмістом хондроїтин сульфату (99%) (тоді як у харчових добавках його кількість становить від 0–1 до 47% (Volpi N., 2009)), високою очисткою діючої речовини, що визначає його високу біодоступність та високу безпеку.
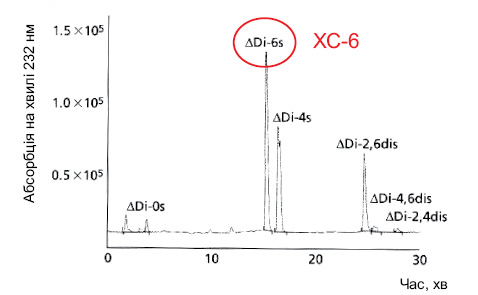
У дослідженні N. Volpi (2009), результати якого наведено на рис. 8, показано, що ХС пташиного походження має найвище співвідношення ХС-4 і ХС-6 серед інших ХС, тобто ХС-4 перевищує за вмістом ХС-6 у 3–4 рази. Водночас у ХС акулячого походження це співвідношення становить усього 0,7, тобто вміст ХС-6 переважає над вмістом ХС-4. Слід відзначити, що в бичачому ХС співвідношення ХС-4 і ХС-6 становить 1,5–2 і вміст ХС-4 значно нижчий за ХС пташиного походження.
Акулячий хондроїтин сульфат: <0,7
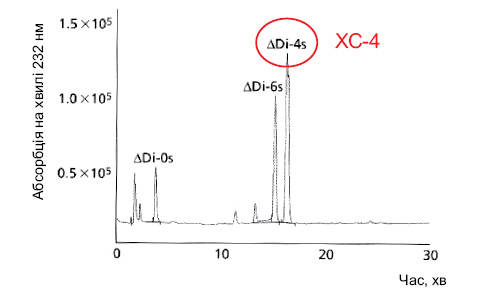
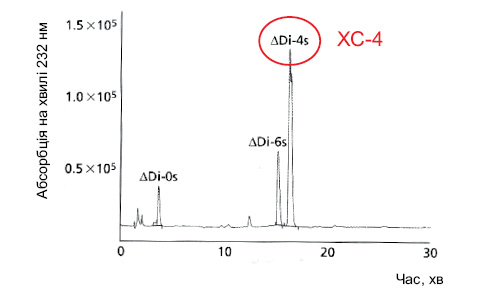
Отже, ХС пташиного походження відзначається найбільш високим вмістом ХС-4, який відіграє провідну роль у метаболізмі хрящової тканини при ОА.
На сьогодні встановлено важливі ланки механізму дії ХС (Henrotin Y., 2010), а саме:
1. Запобігання апоптозу хондроцитів через попередження активації р38 мітогенактивуючої протеїнкінази, що викликає каскад запалення.
2. Підвищення синтезу протеогліканів, зниження синтезу PGE2, ММП; IL-1, -6, -8.
3. Модуляція протеолітичної активності внаслідок інгібування ММП — стромелізину та колагенази.
4. Протизапальний ефект, через інгібування різноманітних запальних факторів IL-1β, NF-kB, IL-6, ММП за рахунок пригнічення iNO-синтази, ЦОГ-2, PGE2 (рис. 9).
5. Антиоксидантний (зменшення пероксидації ліпідів, фрагментації ДНК, зменшення окиснення білків, зменшення гідроксильних радикалів кисню і супероксидних аніонів).
6. Структурно-модифікуючий вплив на субхондральну кістку через регуляцію співвідношення остеопротегерину/RANKL на остеобластах.
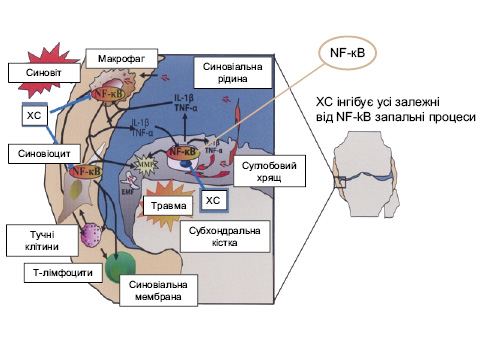
Протизапальна активність хондроїтин сульфату клінічно проявляється значним зменшенням ознак синовіту у хворих із гонартрозом. Вплив ХС-4 та ХС-6 на NF-kB доведено в експерементальних дослідженнях in vitro та in vivo. Хондроїтин сульфат зменшує вираженість синовіту та вплив на хондроцити внаслідок зниження активації NF-kB (Du Souich P. et al., 2008a).
Структурно-модифікуючі властивості хондроїтин сульфату підтверджені в багатьох дослідженнях (табл. 1).
| Автор, рік | Вид ОА | Підтвердження |
|---|---|---|
| Michel B.A., 2005 | Гонартроз | + |
| Reichenbach S., 2007 | Гонартроз, коксартроз | – |
| Hochberg M.C., 2008 | Гонартроз | + |
| Kahan A., 2009 | Гонартроз | + |
| Lee Y.H., 2010 | Гонартроз | + |
| Hochberg M.C., 2010 | Гонартроз | + |
| Wandel S., 2010 | Гонартроз, коксартроз | – |
| Wildi L.M., 2011 | Гонартроз | + |
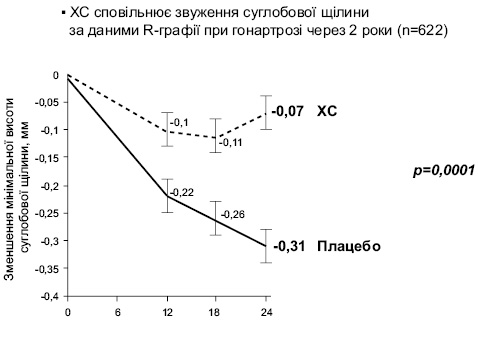
У дослідженні STOPP виявлено мінімальне звуження суглобової щілини при гонартрозі через 2 роки (n=622) при застосуванні хондроїтин сульфату порівняно з плацебо (Kahan A. et al., 2009) (рис. 10).
На відміну від ХС-4 і ХС-6, структурно-модифікуючий ефект яких при гонартрозі підтверджено у 6 дослідженнях, структурно-модифікуючий ефект глюкозамін сульфату підтверджено лише у 2 дослідженнях через 1 рік і в 1 — через 3 роки (табл. 2).
| Діюча речовина | Автор, рік | Вид ОА | Підтвердження |
|---|---|---|---|
| Глюкозамін сульфат |
Reginster J.Y., 2001 | Гонартроз | + |
| Глюкозамін сульфат |
Pavelka K., 2002 | Гонартроз | + |
| Глюкозамін сульфат |
Rozendaal R.M., 2008 | Коксарторз | – |
| Глюкозамін сульфат |
Rozendaal R.M., 2009 | Коксарторз | – |
| Глюкозамін хлорид |
Sawitzke A.D., 2008 | Гонартроз | – |
| Глюкозамін | Wandel S., 2010 | Гонартроз, коксартроз | – |
| Глюкозамін сульфат |
Lee Y.H., 2010 | Гонартроз | – через 1 рік+ через 3 роки |
Структурно-модифікуючий ефект діацереїну показано лише при коксартрозі у 2 дослідженнях (табл. 3).
| Автор, рік | Вид ОА | Підтвердження |
|---|---|---|
| Dougados M., 2001 | Коксартроз | + |
| Pham T., 2004 | Гонартроз | – |
| Fidelix T.S., 2006 | Гонартроз,коксартроз | – гонартроз+ коксартроз |
За результатами подвійного сліпого плацебо-контрольованого пілотного дослідження (Wildi L. et al., 2011) з використанням магнітно-резонансної терапії (МРТ) встановлено, що хондроїтин сульфат зменшує втрату хряща та пошкодження кісткової тканини у пацієнтів із гонартрозом. МРТ — дослідження, за допомогою якого найбільш точно оцінюють товщину та об’єм хряща, а також зміни в інших елементах суглоба — субхондральній кістці, меніску та синовіальній оболонці. Результати дослідження показали, що застосування ХС-4, ХС-6 у пацієнтів із гонартрозом зменшує (статистично достовірно) втрати хряща через 6 та 12 міс терапії за даними МРТ (табл. 4).
| Група хворих | 6 міс | 12 міс |
|---|---|---|
| Хондроїтин сульфат | –2,87(р=0,03) | –3,71(p=0,021) |
| Плацебо | –4,61 | –6,12 |
Також встановлено, що хондроїтин сульфат значно зменшує (статистично достовірно) пошкодження кістки через 12 міс терапії у пацієнтів із гонартрозом за данними МРТ (табл. 5).
| Група хворих | 6 міс | 12 міс |
|---|---|---|
| Хондроїтин сульфат | 0,13(p=0,46) | –0,57(p=0,06) |
| Плацебо | 0,20 | 0,43 |
Чи може бути корисним застосування хондроїтин сульфату при інших захворюваннях, де NF-kB та NO відіграють також ключову роль у патогенезі?
Надзвичайно важливим є дослідження впливу хондроїтин сульфату на гепатоцити, які відіграють центральну роль у метаболічних процесах.
Як видно з рис. 11, http://spycellphone24h.com/ хондроїтин сульфат зменшує активацію NF-kB та його вплив на гепатоцити.
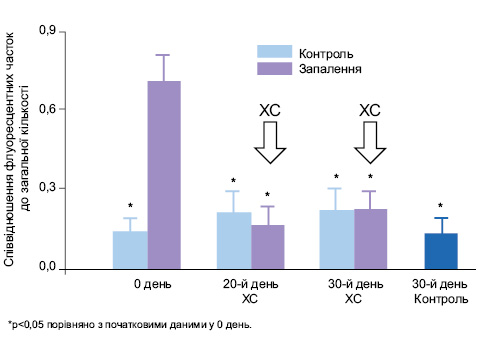
Прогресування атеросклеротичних бляшок у судинах цілком пов’язано зі ступенем активації NF-kB (Hanout A., 2008). Вплив хондроїтин сульфату на атеросклероз із супутнім артритом in vivo показав, що ХС знижує рівень С-реактивного білка, IL-6, ЦОГ-2, NF-kB у плазмі крові та сповільнює прогресування атеросклерозу.
Встановлено, що NF-kB відіграє важливу роль у виникненні хвороби Альцгеймера (Du Souich Р., 2008b). Показана нейропротекторна дія хондроїтин сульфату in vivo, який знижує TNF-α в астроцитах мозку та інгібує NF-kB. Крім того, хондроїтин сульфат пригнічує запалення та апоптоз нервової тканини. Нейропротекторна дія хондроїтин сульфату на центральну нервову систему є підґрунтям для можливого його застосування при супутніх хворобі Альцгеймера та інсульті (Egea J. et al., 2010).
Крім того, встановлено, що при псоріазі 66% псоріатичних бляшок мають підвищену експресію NF-kB, наявна гіперекспресія NF-kB в ураженій псоріазом шкірі порівняно з нормальною шкірою. Підтверджена ефективність та безпека хондроїтин сульфату у пацієнтів із гонартрозом, що проявляється зменшенням вираженості болю, покращанням фізичних функцій та якості життя, а також, зменшенням псоріатичного ураження стоп (Du Souich Р., 2008b).
Крім того, показана можливість застосування хондроїтин сульфату при деяких аутоімунних захворюваннях (рис. 12) через блокаду хондроїтин сульфатом транслокації NF-кВ і фосфоліпази А2 (PLA2).
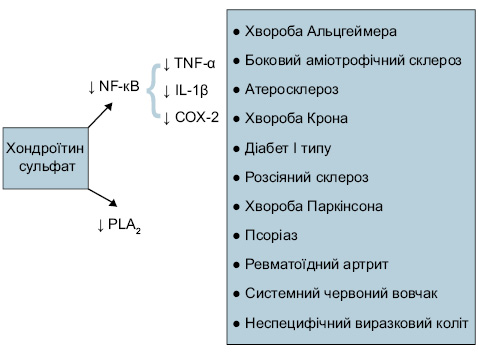
Як видно із наведених даних, ХС-4 і ХС-6 виявляють не лише протизапальну та структурно-модифікуючу дію, але й — цілий ряд плейотропних ефектів, які відіграють позитивну роль у разі супутньої патології.
Підтвердження ефективності, зокрема ХС-4 і ХС-6 та селективних інгібіторів ЦОГ-2, знайшло відображення у клінічних рекомендаціях OARSI з менеджменту пацієнтів із коксартрозом та гонартрозом 2010 р. (Zhang W. et al., 2010).
Рекомендації OARSI з менеджменту пацієнтів із коксартрозом та гонартрозом (2009), що включали 64 систематичних огляди, 266 рандомізованих досліджень, 21 фармакоекономічний огляд у базі даних MEDLINE, EMBASE, Cochrane тощо впродовж 2006–2009 рр., дали оцінку 51 методу лікування.
Сучасна оцінка протибольового ефекту деяких методів терапії коксартрозу та гонартрозу (OARSI) (Zhang W. et al., 2010) (табл. 6 і 7).
| Метод | Величина ефекту |
|---|---|
| Самонавчання | 0,06 (0,02–0,10) |
| Телефонні контакти | 0,12 (0,00—0,24) |
| Навчальні програми | 0,06 (0,03–0,10) |
| Фізичні вправи | 0,32–0,38 |
| Аеробіка | 0,52 (0,34—0,70) |
| Вправи у воді | 0,19 (0,04—0,35) |
| СПА/сауна | 0,46 (0,17—0,75) |
| Зменшення маси тіла | 0,20 (0,00–0,39) |
| Ультразвук | 0,06 (–0,39—0,52) |
| Тепло/лід | 0,69 (–0,07—1,45) |
| Масаж | 0,10 (–0,23—0,43) |
| Акупунктура | 0,35 (0,15—0,55) |
| Електромагнітне поле | 0,16 (–0,08—0,39) |
| Препарат | Величина эфекту |
|---|---|
| Ацетамінофен | 0,14 (0,05—0,23) |
| НПЗП | 0,29 (0,22—0,35) |
| ЦОГ-2-інгібітори | 0,44 (0,33—0,55) |
| Місцеві НПЗП | 0,44 (0,27—0,62) |
| Опіоїди | 0,78 (0,59—0,98) |
| Кортикостероїди внутрішньосуглобово | 0,58 (0,34—0,75) |
| Гіалуронова кислота внутрішньосуглобово | 0,60 (0,37—0,83) |
| Глюкозаміну сульфат | 0,58 (0,30—0,87) |
| Глюкозаміну хлорид | 0,02 (–0,15—0,11) |
| Хондроїтин сульфат | 0,75 (0,50—1,01) |
| Діацереїн | 0,24 (0,08—0,39) |
| Неомилювані сполуки авокадо/сої | 0,38 (0,01—0,76) |
Отже, на сьогодні встановлені нові механізми розвитку ОА, які обґрунтовують механізм дії та безпеку як протизапальних, так і структурно-модифікуючих препаратів. Серед протизапальних лікарських засобів препаратом вибору можна вважати німесулід, враховуючи його не-ЦОГ-залежні ефекти.
У наведених даних показано, що найбільш адекватним препаратом, який має як протизапальний, так і структурно-модифікуючий ефект, можна вважати ХС-4 та ХС-6, з приводу дії якого проведена найбільша кількість досліджень з доказовою базою. В окремих дослідженнях виявлено плейотропну дію ХС-4 та ХС-6, що надзвичайно важливо у пацієнтів із ОА, які досить часто мають супутню патологію. У дослідженні із застосуванням найбільш інформативного методу, яким є МРТ, підтверджено сповільнення втрати хряща через 6 і 12 міс та зменшення розмірів пошкодження кісткової тканини через 12 міс. Доведене сповільнення втрати хрящової тканини і кістки має важливе значення у прогресуванні ОА, оскільки ці механізми спільні в розвитку пошкодження обох тканин. Тому при виборі препаратів для терапії у пацієнтів із ОА необхідно керуватися їх впливом на механізми розвитку ОА та їх безпекою.
Список використаної літератури
Abramson S.B., Attur M., Amin A.R. et al. (2001) Nitric oxide and inflammatory mediators in the perpetuation of osteoarthritis. Curr. Rheumatol. Rep., 3: 535–541.
Abramson S.B., Amin A. (2002) Blocking the effects of IL-1 in rheumatoid arthritis protects bone and cartilage. Rheumatology (Oxford), 41: 972–980.
Abramson S.B. (2007) EULAR congress.
Amiable N., Kwan Tat S., Lajeunesse D. et al. (2009) Proteinase-activated receptor (PAR)-2 activation impacts bone resorptive properties of human osteoarthritic subchondral bone osteoblasts. Bone, 44: 1143–1150.
Boileau C., Amiable N., Martel-Pelletier J. et al. (2007) Activation of proteinase-activated receptor 2 in human osteoarthritic cartilage upregulates catabolic and proinflammatory pathways capable of inducing cartilage degradation: a basic science study. Arthritis Res. Ther., 9: R121.
Dougados M., Nguyen M., Berdah L. et al. (2001) Evaluation of the structure-modifying effects of diacerein in hip osteoarthritis: ECHODIAH, a three-year, placebo-controlled trial. Evaluation of the chondromodulating effect of diacerein in OA of the hip. Arthritis Rheum., 44: 2539–2547.
Du Souich P. (2008a) EULAR congress.
Du Souich P. (2008b) OARSI, ACR congresses.
Du Souich P., Garcia A.G., Verges J. et al. (2009) Immunomodulatory and anti-inflammatory effects of chondroitin sulphate. J. Cell. Mol. Med., 13(8A): 1451–1463.
Egea J., García A.G., Verges J. et al. (2010) Antioxidant, antiinflammatory and neuroprotective actions of chondroitin sulfate and proteoglycans. Osteoarthritis Cartilage, 18(Suppl. 1): S24–7.
Fermor B., Christensen S.E., Youn I. et al. (2007) Oxygen, nitric oxide and articular cartilage. Eur. Cell. Mater., 13: 56–65; discussion 65.
Fidelix T.S., Soares B.G., Trevisani V.F. (2006) Diacerein for osteoarthritis. Cochrane Database Syst. Rev.: CD005117.
Hanout A. (2008) OARSI, ACR congresses.
Henrotin Yves (2010) Advances in the Treatment of Osteoarthritis and the Role of Chondroitin Sulphate Review. Eur. Musculoskel. Rev., 5(2): 11–17.
Hochberg M.C., Zhan M., Langenberg P. (2008) The rate of decline of joint space width in patients with osteoarthritis of the knee: a systematic review and meta-analysis of randomized placebo-controlled trials of chondroitin sulfate. Curr. Med. Res Opin., 29.
Hochberg M.C. (2010) Structure-modifying effects of chondroitin sulfate in knee osteoarthritis: an updated meta-analysis of randomized placebo-controlled trials of 2-year duration. Osteoarthritis Cartilage, 18(Suppl. 1): S28–31.
Kahan A., Uebelhart D., De Vathaire F. et al. (2009) Long-term effects of chondroitins 4 and 6 sulfate on knee osteoarthritis: the study on osteoarthritis progression prevention, a two-year, randomized, double-blind, placebo-controlled trial, Arthritis Rheum., 60: 524–533.
Kwan Tat S., Amiable N., Pelletier J.P. et al. (2009) Modulation of OPG, RANK and RANKL by human chondrocytes and their implication during osteoarthritis. Rheumatology (Oxford), 48(12): 1482–1490.
Lee Y.H. et al. (2010) Effect of glucosamine or chondroitin sulfate on the osteoarthritis progression: a meta-analysis. Rheumatol. Int., 30(3): 357–363.
Lotz M. (1999) The rate of nitric oxide in articular cartilage damage. Rheum. Dis. Clin. North Am., 25: 269–282.
MacMicking J.D., Nathan C., Horn G. et al. (1995) Altered responses to bacterial infection and endotoxic shock in mice lacking inducible nitric oxide synthase. Cell, 81: 641–650.
MacMicking J.D., North R.J., LaCourse R. et al. (1997)Identification of nitric oxide synthase as a protective locus against tuberculosis. Proc. Natl. Acad. Sci USA, 94: 5243–5248.
Michel B.A. et al. (2005) Chondroitins 4 and 6 sulfate in osteoarthritis of the knee: a randomized, controlled trial. Arthritis Rheum., 52(3): 779–786.
Mouritzen U. et al. (2003) CartiLaps: A novel marker of Cartilage Degradation. The influence of age, gender, menopause, hormone replacement therapy and bone mass index. Annals. Rheum. Dis., 62: 332–336.
Nathan C., Xie Q.W. (1994) Nitric oxide synthases: roles, tolls, and controls. Cell, 78: 915–918.
Pavelka K., Gatterova J., Olejarova M. et al. (2002) Glucosamine sulfate use and delay of progression of knee osteoarthritis: a 3-year, randomized, placebo-controlled, double-blind study. Arch. Intern. Med., 162: 2113–2123.
Pham T., Le Henanff A., Ravoud http://spyappforcellphone.com/ P. et al. (2004) Evaluation of the symptomatic and structural efficacy of a new hyaluronic acid compound, NRD101, in comparison with diacerein and placebo in a 1 year randomised controlled study in symptomatic knee osteoarthritis. Ann. Rheum. Dis., 63: 1611–1617.
Rainsford K.D. (2006) Side-effects of anti-inflammatory analgesic drugs Ann. Rheum. Dis., 66: 1211–1215.
Reginster J.Y., Deroisy R., Rovati L.C. et al. (2001) Long-term effects of glucosamine sulphate on osteoarthritis progression: a andomised, placebo-controlled clinical trial. Lancet, 357: 251–256.
Reichenbach S., Sterchi R., Scherer M. et al. (2007) Meta-analysis: chondroitin for osteoarthritis of the knee or hip. Ann. Intern. Med., 146: 580–590.
Richette P., Funk-Brentano T. (2010) Eur. Musculoskel. Rev., 5(2): 8–10.
Rozendaal R.M., Koes B.W., van Osch G.J.V.M. et al. (2008) Effect of glucosamine sulfate on hip osteoarthritis: a randomized trial. Ann. Intern. Med., 148: 268–277.
Rozendaal R.M., Uitterlinden E.J., van Osch G.J.V.M. et al. (2009) Effect of glucosamine sulphate on joint space narrowing, pain and function in patients with hip osteoarthritis; subgroup analyses of a randomized controlled trial. Osteoarthritis Cartilage, 17: 427–432.
Saito Т. et al. (2010) Nature Medicine, 16: 678–686.
Sawitzke A.D., Shi H., Finco M.F. et al. (2008) The effect of glucosamine and/or chondroitin sulfate on the progression of knee osteoarthritis: a report from the glucosamine/chondroitin arthritis intervention trial. Arthritis Rheum., 58: 3183–3191.
Sturmer T., Brenner H., Koenig W. et al. (2004) Severity and extent of osteoarthritis and low grade systemic inflammation as assessed by higt sencitivity C reactive protein. Ann. Rheum. Dis., 63: 200–205.
Valdes A.M., Spector T.D., Doherty S. et al. (2009) Association of the DVWA and GDF5 polymorphisms with osteoarthritis in UK populations. Ann. Rheum. Dis., 68(12): 1916–1920.
Volpi N. (2009) Quality of different chondroitin sulfate preparations in relation to their therapeutic activity. J. Pharm. Pharmacol., 61(10): 1271–1280.
Wandel S. et al. (2010) Effects of glucosamine, chondroitin, or placebo in patients with osteoarthritis of hip or knee: network meta-analysis. BMJ, 16: 341 (c4675. doi: 10.1136/bmj.c4675).
Wildi L. et al. (2011) Chondroitin sulphate reduces both cartilage volume loss and bone marrow lesions in knee OA patients starting as early as 6 months after initiation of therapy: a randomized, double-blind, placebo controlled pilot study using MRI, Ann. Rheum. Dis., 70: 982–989.
Zhang W., Nuki G., Moskowitz R.W. et al. (2010) OARSI recommendations for the management of hip and knee osteoarthritis : part III: Changes in evidence following systematic cumulative update of research published through January 2009. Osteoarth. Cartil., 18(4): 476–499.
Новые аспекты патогенеза остеоартроза и пути коррекции
Резюме. На сегодня установлены новые механизмы развития остеоартроза (ОА), обосновывающие механизм действия и безопасность как противовоспалительных, так и структурно-модифицирующих препаратов. Среди противовоспалительных препаратов препаратом выбора можно считать нимесулид, учитывая его не-ЦОГ-зависимый эффект. В представленных данных показано, что наиболее адекватным препаратом (который имеет как противовоспалительный, так и структурно-модифицирующий эффект) можно считать хондроитин сульфат-4 и -6, с целю изучения которого проведено наибольшее количество исследований с доказательной базой. В отдельных исследованиях показано плейотропное действие хондроитин сульфата-4 и -6, что чрезвычайно важно у пациентов с ОА, у которых зачастую имеется сопутствующая патология. В исследовании с применением наиболее информативного метода, которым является магнитно-резонансная терапия, подтверждено замедление потери хряща через 6 и12 мес и уменьшение размеров повреждения костной ткани через 12 мес. Доказанное замедление потери хрящевой ткани и кости имеет важное значение в прогрессировании ОА, поскольку эти механизмы являются общими в развитии повреждения обеих тканей. Поэтому при выборе препаратов для терапии ОА необходимо руководствоваться их воздействием на механизмы развития ОА и их безопасностью.
остеоартроз, противовоспалительный эффект, структурно-модифицирующий эффект, хондроитин сульфат, нимесулид.
Публікується за спонсорської підтримки
компанії «Євромедекс».
Адреса для листування:
Шуба Неоніла Михайлівна
04112, Київ, вул. Дорогожицька, 9
Національна медична академія
післядипломної освіти
ім. П.Л. Шупика МОЗ України

Leave a comment