ВПЛИВ ЛІПОПОЛІСАХАРИДУ ТА ДЕКСАМЕТАЗОНУ НА КУЛЬТУРАЛЬНІ ВЛАСТИВОСТІ МУЛЬТИПОТЕНТНИХ СТРОМАЛЬНИХ КЛІТИН КІСТКОВОГО МОЗКУ, ТИМУСА І ЖИРОВОЇ ТКАНИНИ МИШЕЙ
Нікольський І.С.1, Нікольська В.В.1, Семенова Я.-М.О.1, Тарануха Л.І.1, Подпрятов С.С.2
- 1ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска НАМН України, м. Київ
- 2Київська міська клінічна лікарня № 1, м. Київ
Резюме. Мета дослідження: вивчити культуральні, клоногенні та секреторні властивості мультипотентних стромальних клітин (МСК) кісткового мозку, тимуса і жирової тканини мишей та оцінити їхню реакцію на дію ліпополісахариду (ЛПС) і дексаметазону (ДМ). Матеріали та методи. МСК отримували зі стегнових кісток, тимуса та підшкірної жирової тканини дорослих нелінійних мишей методами вимивання, експлантації та ферментативної дисоціації відповідно. Для оцінки проліферативної активності визначали тривалість подвоєння популяції (PDT), ефективність клонування оцінювали за кількістю колонієутворювальних одиниць фібробластів (CFU-F), здатність МСК до контактної взаємодії — за утворенням фібробласто-лімфоцитарних розеток (ФЛР), секрецію цитокінів — інтерлейкіну (IL)-6 та IL-10 — за їх вмістом у культуральному середовищі. МСК інкубували з ЛПС (0,1 мкг/мл), ДМ (0,1 мкг/мл) або їх комбінацією. Статистичну обробку здійснювали з використанням непараметричного критерію Манна — Уїтні. Результати. Встановлено, що ЛПС активує проліферацію та клоногенну активність МСК, стимулює утворення ФЛР і секрецію IL-6, тоді як ДМ виявляє переважно гальмівний ефект на проліферацію і знижує продукцію IL-6 при збереженні рівня IL-10. Найвищі показники колонієутворення, проліферації та цитокінової активності відзначено у МСК тимуса та жирової тканини. Висновки. Отримані результати свідчать про наявність тканинно-специфічних відмінностей у біологічних властивостях МСК із різних джерел і підтверджують різноспрямований вплив ЛПС та ДМ на їх функціональну активність. Виявлені закономірності можуть бути використані для створення клітинних терапевтичних препаратів, спрямованих на контроль системного запалення і стимуляцію регенеративних процесів.
DOI: 10.32471/rheumatology.2707-6970.20160
Мультипотентні стромальні клітини (МСК) різного походження розглядаються як перспективна біологічна основа для клітинної терапії запальних і автоімунних захворювань, зокрема серонегативних спондилоартритів — анкілозивного спондиліту, псоріатичного артриту, реактивного артриту, а також запальних захворювань кишечнику [3, 7, 10]. Відомо, що терапевтичний ефект МСК пов’язаний насамперед із їхньою імуномодулювальною активністю — здатністю регулювати баланс прозапальних і протизапальних цитокінів, впливати на поляризацію макрофагів, проліферацію Т-лімфоцитів та активацію Т-регуляторних клітин [8, 22].
Серед джерел МСК, що активно вивчаються, найчастіше використовують кістковий мозок (BM-MSC), жирову тканину (AT-MSC) та, відносно недавно — тимус (T-MSC) як джерело фібробластоподібних клітин, здатних підтримувати тимоцитогенез і виявляти імунорегуляторні властивості [12, 18, 23]. Тимусні МСК є особливо цікавими у контексті дослідження взаємодії з лімфоцитами та моделювання автоімунних процесів [1].
Для оцінки потенціалу МСК як регуляторних клітин доцільно вивчати їхню реакцію на дію сигнальних стимулів різної природи. Ліпополісахарид (ЛПС) — компонент клітинної стінки грамнегативних бактерій — викликає активацію рецепторів TLR4 та запуск внутрішньоклітинних сигнальних каскадів NF-κB, PI3K/Akt, що призводить до посилення секреції прозапальних цитокінів і модуляції клітинної поведінки [13, 24]. Дексаметазон (ДМ), навпаки, є потужним глюкокортикоїдом із протизапальними властивостями, який впливає на експресію генів через зв’язування з глюкокортикоїдним рецептором і взаємодію з NF-κB-залежними шляхами, знижуючи продукцію інтерлейкіну (IL)-6, фактора некрозу пухлин (ФНП)-α, COX-2 та інших медіаторів [15, 21]. Комбіноване застосування ЛПС і ДМ дозволяє оцінити баланс між про- та протизапальною активацією, що важливо для подальшого використання МСК у клітинних моделях системного запалення.
Таким чином, дослідження властивостей МСК різного походження після дії ЛПС і ДМ є важливим етапом у розробленні патогенетично обґрунтованих клітинних стратегій для контролю запалення при серонегативних спондилоартритах.
Матеріали та методи
Дослідження виконано на культурах МСК, отриманих із кісткового мозку, тимуса та підшкірної жирової тканини дорослих нелінійних мишей. Вилучення тканин проводили у стерильних умовах відповідно до етичних принципів Європейської конвенції з охорони хребетних тварин.
МСК кісткового мозку ізолювали шляхом вимивання клітин із порожнини стегнових кісток; МСК тимуса — методом експлантації фрагментів капсули й паренхіми; МСК жирової тканини — ферментативною дисоціацією із використанням колагенази І. Первинні культури підтримували у середовищі DMEM-F12 з 10% ембріональної сироватки теляти, антибіотиками та 2 мМ L-глутаміну при 37 °C у 5% CO₂.
Для вивчення впливу стимуляторів клітини інкубували 48 год за наявності ЛПС (0,1 мкг/мл); ДМ (0,1 мкг/мл); ЛПС+ДМ (комбінована дія); контроль — нативні МСК.
Після інкубації визначали життєздатність — методом виключення трипанової сині; проліферативну активність — за показником population doubling time (PDT); клоногенну активність — за кількістю колонієутворювальних одиниць фібробластів (CFU-F); контактну активність — за кількістю фібробласто-лімфоцитарних розеток (ФЛР) [2]; секрецію IL-6 та IL-10 — за допомогою комерційних ELISA-наборів (IBL International, Німеччина).
Статистичний аналіз проводили у STATISTICA 10.0 з використанням непараметричного критерію Манна — Уїтні; вірогідними вважали відмінності при p<0,05.
Результати та їх обговорення
Отримані культури МСК кісткового мозку, тимуса та жирової тканини мали типовий фібробластоподібний фенотип. У фазовому контрасті відзначали клітини веретеноподібної або полігональної форми. На рис. 1 представлена фотографія нативної культури МСК тимуса першого пасажу.
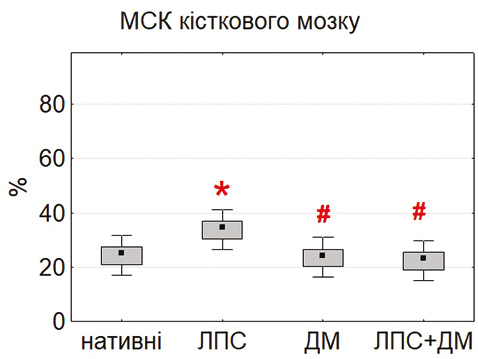
Вивчення проліферативної активності продемонструвало виражені відмінності між культурами МСК різного походження (рис. 2). Найкоротшу тривалість подвоєнь популяції (PDT) виявлено у МСК тимуса та жирової тканини, тоді як для МСК кісткового мозку цей показник був достовірно вищим (p<0,05). Отримані дані свідчать про більший проліферативний потенціал немедулярних популяцій, що узгоджується з повідомленнями про високу метаболічну активність і швидкість росту МСК тимуса та адипозної тканини [18–20].
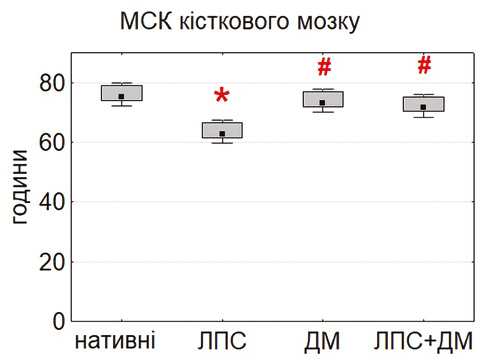
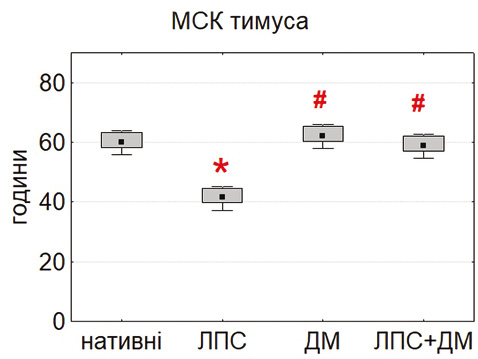
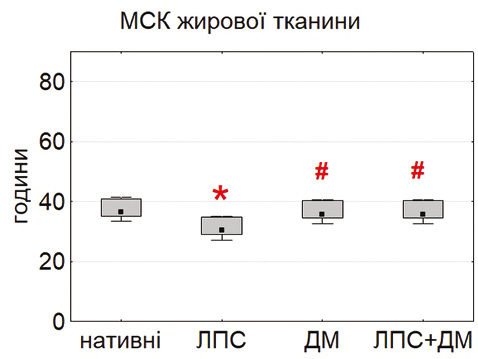
Після інкубації з ЛПС (0,1 мкг/мл) відмічали достовірне зниження PDT у всіх типах культур, що вказує на стимуляцію проліферації. Найбільш виражений ефект відзначено у тимусних МСК (p<0,05). Це узгоджується з літературними даними про активацію TLR4-залежних сигнальних шляхів, які стимулюють виживання і проліферацію клітин [16, 24, 25]. ДМ (0,1 мкг/мл) не викликав достовірних змін показника PDT, хоча у деяких серіях відмічалася тенденція до помірного зниження проліферації, що відповідає описаним раніше даним про дозозалежний інгібувальний вплив глюкокортикоїдів [15, 21].
Аналіз ефективності клонування (CFU-F) показав, що у базових умовах найвищий рівень колонієутворення властивий МСК тимуса та жирової тканини, тоді як клітини кісткового мозку формували значно менше колоній (p<0,05) (рис. 3). Це свідчить про різний ступінь самооновлення та проліферативної активності залежно від джерела походження клітин, що узгоджується з повідомленнями про більшу здатність до колонієутворення тимусних і адипозних МСК [6, 18].
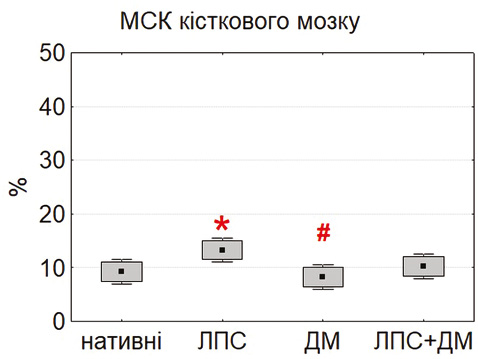
Після інкубації з ЛПС ефективність клонування достовірно підвищувалася, особливо у МСК тимуса та жирової тканини, що, ймовірно, пов’язано з активацією сигнального шляху PI3K/Akt [16, 24]. Водночас ДМ не впливав істотно на цей показник, хоча у поєднанні з ЛПС частково зменшував вираженість стимулювального ефекту останнього, що може свідчити про конкурентну взаємодію прозапальних і глюкокортикоїдних сигналів у регуляції проліферації МСК [4, 15].
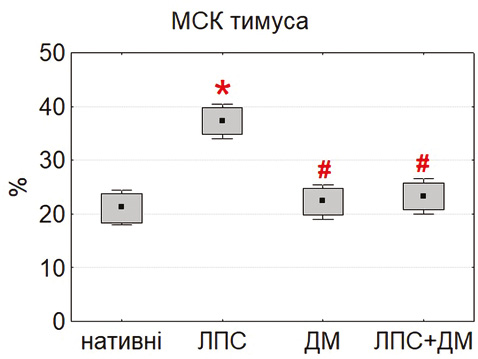
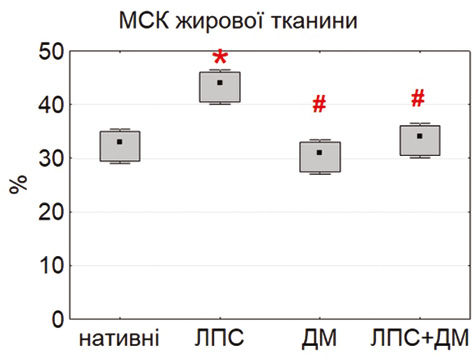
Здатність МСК до міжклітинних контактів оцінювали за формуванням фібробласто-лімфоцитарних розеток (ФЛР). Найбільшу кількість розеток у нативних умовах виявили у МСК тимуса та жирової тканини, тоді як у культурах МСК кісткового мозку цей показник був значно нижчим (p<0,05) (рис. 4). Така закономірність відображає тканинно-специфічні відмінності у функціональній активності клітин, зокрема у рівні експресії молекул адгезії (ICAM-1, VCAM-1, PD-L1), що забезпечують контакт із лімфоцитами [18, 23].
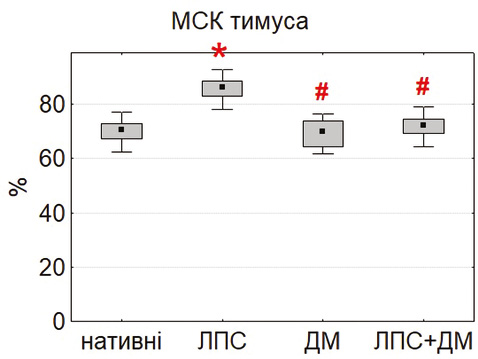
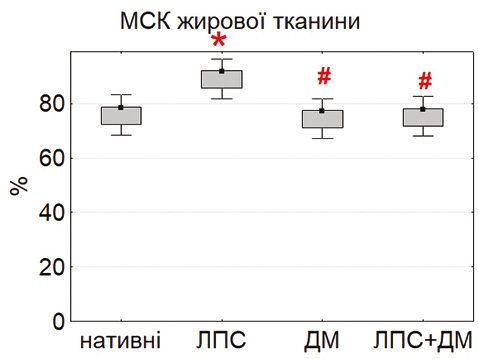
Під впливом ЛПС кількість ФЛР достовірно зростала у всіх типах культур, особливо у МСК тимуса. Це узгоджується з даними Kurte та співавторів (2020) про активацію TLR4-залежних механізмів [13], що підвищують експресію міжклітинних молекул і хемокінів. Натомість ДМ зменшував кількість ФЛР, імовірно, через гальмування NF-κB-залежної транскрипції [21]. Комбінована дія ЛПС і ДМ зумовлювала проміжні значення, що свідчить про регуляторний ефект глюкокортикоїду.
Отримані дані підтверджують, що формування ФЛР може бути чутливим функціональним тестом, який відображає баланс між прозапальною активацією та протизапальною регуляцією МСК. Висока контактна активність тимусних і адипозних МСК підкреслює їх потенціал щодо модифікації імунної відповіді через прямі клітинно-клітинні взаємодії.
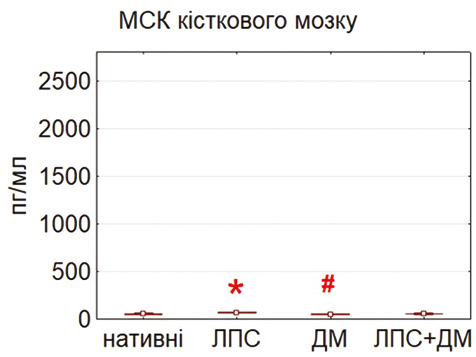
У базових умовах найвищий рівень IL-6 виявлено в культурах МСК жирової тканини та тимуса, тоді як у МСК кісткового мозку секреція цього цитокіну була істотно нижчою (p<0,05) (рис. 5). Після інкубації з ЛПС рівень IL-6 зростав у всіх культурах, що підтверджує активацію TLR4/NF-κB сигнального шляху [5, 11]. ДМ достовірно знижував продукцію IL-6, реалізуючи свій протизапальний потенціал через гальмування NF-κB-залежної транскрипції [4].
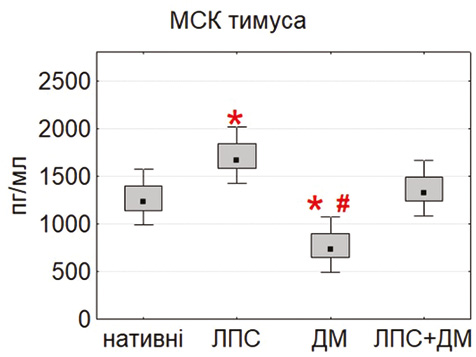
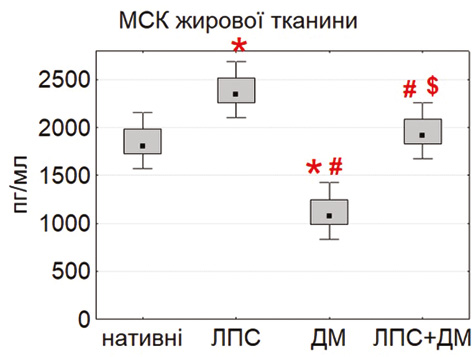
У випадку IL-10 виявили іншу закономірність: базова продукція цього цитокіну була найвищою у МСК тимуса та жирової тканини (рис. 6). Після стимуляції ЛПС секреція IL-10 ще більше зростала, особливо в адипозних МСК (p<0,05), що свідчить про активацію протизапальних механізмів. Подібні результати описані Nguyen та співавт. (2025) і Yang та співавт. (2024) [17], які показали, що мікробні стимули можуть підвищувати продукцію IL-10, посилюючи імуномодулювальну дію МСК. ДМ не викликав достовірних змін рівня IL-10, що узгоджується з його селективною дією переважно на прозапальні шляхи.
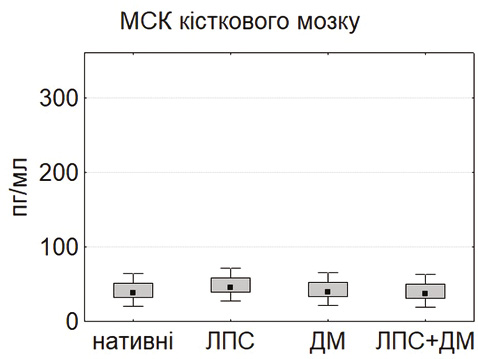
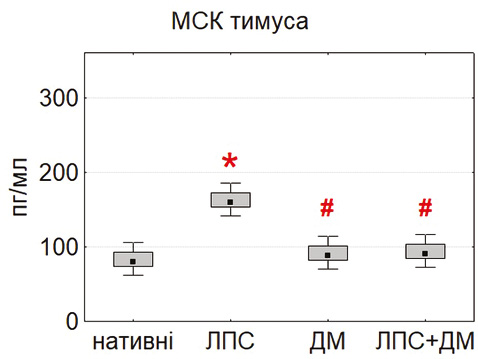
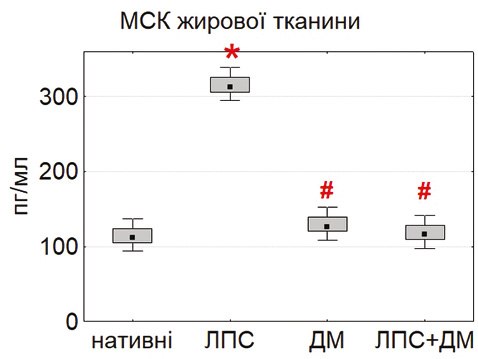
Отримані результати вказують на виражені тканинно-специфічні відмінності між МСК різного походження. Клітини тимуса та жирової тканини характеризуються вищою проліферативною активністю, ефективністю колонієутворення, контактною здатністю та вищим цитокінсекреторним потенціалом порівняно з МСК кісткового мозку. ЛПС стимулює більшість функціональних показників МСК, тоді як ДМ чинить протилежний, регуляторно-гальмівний ефект. Такий взаємозв’язок між прозапальними та протизапальними стимулами визначає пластичність МСК і може бути використаний для оптимізації клітинних терапевтичних стратегій при системному запаленні.
Висновки
- 1. МСК кісткового мозку, тимуса та жирової тканини зберігають високу життєздатність після кріоконсервування та відрізняються за рівнем проліферації і клоногенності.
- 2. ЛПС стимулює проліферативну та секреторну активність МСК, тоді як ДМ чинить гальмівний та регуляторний вплив.
- 3. МСК тимуса та жирової тканини характеризуються вищою імунорегуляторною активністю порівняно з МСК кісткового мозку.
- 4. Отримані дані свідчать про необхідність диференційованого підходу до вибору джерела МСК для моделювання запалення та створення клітинних терапевтичних препаратів.
Фінансування та етичне схвалення
Роботу виконано в межах науково-дослідної теми
«Удосконалення методів патогенетично обґрунтованої терапії у військовослужбовців та цивільних осіб із серонегативним спондилоартритом на основі клінічних та експериментальних даних» (№ держреєстрації 0125U001203), що фінансується за кошти Державного бюджету України.
Усі експериментальні дослідження проведені згідно з Етичним кодексом для експериментів на тваринах (EU Directive 2010/63/EU) та схвалені локальною комісією з біоетики ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини ім. акад. М.Д. Стражеска НАМН України».
Список використаної літератури
- 1. Нікольська Є.І., Бутенко Г.М. (2016) Структурно-функціональна організація кістковомозкових ніш гемопоетичних стовбурових клітин. Клітинна та органна трансплантологія, 4(1): 82–100.
- 2. Нікольський І.С., Нікольська В.В., Зубов Д.О. та ін. (2013) Спосіб одержання фібробласто-лімфоцитарних розеток (ФЛР) як модельного аналогу тимічної ніші ex vivo. Пат. 80076 Україна, МПК C12N5/00; заявл. 04.12.2012; опубл. 13.05.2013, бюл. № 9.
- 3. Abdolmohammadi K., Pakdel F.D., Aghaei H. et al. (2019) Ankylosing spondylitis and mesenchymal stromal/stem cell therapy: a new therapeutic approach. Biomed. Pharmacother., 109: 1196–1205. doi: 10.1016/j.biopha.2018.10.137.
- 4. Adly E.M., Diab T., Hessien M. (2025) Dexamethasone-boosted mesenchymal stem cell secretome: insight into hepatic protection. BMC Biotechnol., 25(1): 44. doi: 10.1186/s12896-025-00980-8.
- 5. Areny-Balagueró A., Camprubí-Rimblas M., Campaña-Duel E. et al. (2024) Priming mesenchymal stem cells with lipopolysaccharide boosts the immunomodulatory and regenerative activity of secreted extracellular vesicles. Pharmaceutics, 16(10): 1316. doi: 10.3390/pharmaceutics16101316.
- 6. Ceccarelli S., Pontecorvi P., Anastasiadou E. et al. (2020) Immunomodulatory effect of adipose-derived stem cells: the cutting edge of clinical application. Frontiers in Cell and Developmental Biology, 8: 236. doi.org/10.3389/fcell.2020.00236.
- 7. Cheng L., Wang S., Peng C. et al. (2022) Human umbilical cord mesenchymal stem cells for psoriasis: a phase 1/2a, single-arm study. Signal Transduct. Target Ther., 7(1): 263. doi: 10.1038/s41392-022-01059-y.
- 8. Fan X.L., Zhang Y., Li X., Fu Q.L. (2020) Mechanisms underlying the immunomodulatory effects of mesenchymal stem cells. Signal Transduct. Target Ther., 5: 22. doi: 10.1038/s41392-020-0154-9.
- 9. Hu Y., Liao L., Wang J. et al. (2018) Challenges in isolation and purification of murine mesenchymal stem cells: a review. Stem. Cells Int., 2018: 4723450. doi: 10.1155/2018/4723450.
- 10. Ke M., Liu W., Lu H. et al. (2025) Breaking boundaries in ankylosing spondylitis: how innovative cell therapies reshape immunity, drive cutting-edge advances, and face future challenges. Front. Immunol., 16: 1613502. doi: 10.3389/fimmu.2025.1613502.
- 11. Kim S.H., Choi H.I., Choi M.R. et al. (2020) Epigenetic regulation of IFITM1 expression in lipopolysaccharide-stimulated human mesenchymal stromal cells. Stem Cell Res. Ther., 11(1): 16. doi: 10.1186/s13287-019-1531-3.
- 12. Krampera M., Sartoris S., Liotta F. et al. (2007) Immune regulation by mesenchymal stem cells derived from adult spleen and thymus. Stem Cells Dev., 16(5): 797–810.
- 13. Kurte M., Vega-Letter A.M., Luz-Crawford P. et al. (2020) Time-dependent LPS exposure commands MSC immunoplasticity through TLR4 activation leading to opposite therapeutic outcome in EAE. Stem. Cell Res. Ther., 11(1): 416.
- 14. Li H., Ghazanfari R., Zacharaki D. et al. (2016) Isolation and characterization of murine mesenchymal stem cells. Ann. N. Y. Acad. Sci., 1370(1): 54–64. doi: 10.1111/nyas.13001.
- 15. Ma L., Feng X., Wang K. et al. (2020) Dexamethasone promotes mesenchymal stem cell apoptosis and inhibits osteogenesis by disrupting mitochondrial dynamics. FEBS Open Bio., 10(2): 211–220. doi: 10.1002/2211-5463.12744.
- 16. Mei S., Qin S., Tang R. et al. (2024) Lipopolysaccharide alters VEGF-A secretion of mesenchymal stem cells via the integrin β3–PI3K–Akt pathway. Mol. Cell Toxicol., 20: 59–66. doi: 10.1007/s13273-022-00315-0.
- 17. Nguyen P.T., Seo Y., Ahn J.S. et al. (2025) De novo interleukin-10 production primed by Lactobacillus sakei CVL-001 amplifies the immunomodulatory abilities of mesenchymal stem cells to alleviate colitis. Biomed. Pharmacother., 182: 117745. doi: 10.1016/j.biopha.2024.117745.
- 18. Nitta T. (2022) Mesenchymal stromal cells in the thymus. Inflamm. Regen., 42(1): 33. doi: 10.1186/s41232-022-00219-5.
- 19. Patenaude J., Perreault C. (2016) Thymic mesenchymal cells have a distinct transcriptomic profile. Journal of Immunology, 196(11): 4760–4770. doi.org/10.4049/jimmunol.1502499.
- 20. Ramsperger-Gleixner M., Li C., Wallon N. et al. (2025) Characterisation of mesenchymal stromal cells (MSCs) from human adult thymus as a potential cell source for regenerative medicine. Journal of Clinical Medicine, 14(10): 3474. doi.org/10.3390/jcm14103474.
- 21. Rimando M.G., Wu H.H., Liu Y.A. et al. (2016) Glucocorticoid receptor and histone deacetylase 6 mediate the differential effect of dexamethasone during osteogenesis of mesenchymal stromal cells (MSCs). Sci. Rep., 6: 37371. doi: 10.1038/srep37371.
- 22. Song N., Scholten D., Rosenblum J., Prockop D.J. (2020) Mechanisms of immunomodulation by mesenchymal stromal cells and clinical translation. Front. Immunol., 11: 711. doi: 10.3389/fimmu.2020.00711.
- 23. Su X., Li X., Wang S. et al. (2023) Nitric oxide-dependent immunosuppressive function of thymus-derived mesenchymal stromal/stem cells. Biol. Direct., 18(1): 59. doi: 10.1186/s13062-023-00415-4.
- 24. Wang Z.J., Zhang F.M., Wang L.S. et al. (2009) Lipopolysaccharides can protect mesenchymal stem cells from oxidative stress-induced apoptosis and enhance proliferation via Toll-like receptor 4 and PI3K/Akt. Cell Biol. Int., 33(6): 665–674. doi: 10.1016/j.cellbi.2009.03.006.
- 25. Zhou A., Li M., He B. et al. (2016) Lipopolysaccharide treatment induces genome-wide pre-mRNA splicing pattern changes in mouse bone marrow stromal stem cells. BMC Genomics, 17(Suppl. 7): 509. doi.org/10.1186/s12864-016-2898-5.
Відомості про авторів
Нікольський Ігор Сергійович — доктор медичних наук, професор, завідувач лабораторії експериментальної імунології відділу імунології ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска НАМН України».
E-mail: prof.nikolsky@gmail.com
ORCID ID: 0009-0007-4165-5088
Нікольська Валентина Василівна — кандидатка біологічних наук, старша наукова співробітниця, провідна наукова співробітниця лабораторії експериментальної імунології відділу імунології ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска НАМН України».
E-mail: nikolskaya.kiev@gmail.com
ORCID ID: 0000-0002-0412-1366
Семенова Яніна-Марія Олексіївна — кандидатка біологічних наук, старша наукова співробітниця лабораторії експериментальної імунології відділу імунології ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска НАМН України»
E-mail: yanina-mariya@ukr.net
ORCID ID: 0009-0000-9093-5085
Тарануха Люба Іванівна — кандидатка медичних наук, провідна наукова співробітниця лабораторії експериментальної імунології відділу імунології ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска НАМН України»
E-mail: li_taranukha@ukr.ne
ORCID ID: 0009-0003-0524-2789
Подпрятов Сергій Сергійович — доктор медичних наук, хірург, проктолог Київської міської клінічної лікарні № 1.
E-mail: sspodpr@gmail.com
ORCID ID: 0000-0001-5942-6311
Надійшла до редакції/Received: 21.10.2025
Прийнято до друку/Accepted: 30.10.2025

Leave a comment