Гіперурикемія та подагра у пацієнтів із серцевою недостатністю
Воронков Л.Г. , Ткач Н.А., Мітченко О.І., Ляшенко А.В.
Резюме. Гіперурикемія при серцевій недостатності (СН) демонструє пряму залежність від серцево-судинної смертності з будь-якої причини та ризику госпіталізацій з приводу СН. Сечова кислота (СК) є продуктом метаболізму пуринів, за фінальний етап якого відповідальною є ксантиноксиредуктаза, — ензим, що існує у двох взаємоперетворювальних формах — відновленій (ксантиндегідрогеназа) та окисненій — (ксантиноксидаза). У нормі в тканинах домінує експресія ксантиндегідрогенази, тоді як рівень ксантиноксидази у плазмі крові є низьким, а у міокарді вона взагалі не визначається. В умовах гіпоксії, запалення й оксидативного стресу ксантиндегідрогеназа активно переходить у ксантиноксидазу з відповідним підвищенням рівня останньої у плазмі крові та появою у міокарді. Високі рівні ксантиноксидази характерні для патологічних станів, що асоціюються з системним запаленням та оксидативним стресом, — ожиріння, цукрового діабету і СН. За даними оприлюдненого у 2024 р. метааналізу 10 клінічних досліджень, в які увійшло 17 328 пацієнтів із СН, застосування інгібіторів ксантиноксиредуктази супроводжувалося статистично вірогідним зростанням загальної смертності. Відомо, що петльові та тіазидні діуретики підвищують концентрацію СК у плазмі крові за рахунок зростання реабсорбції уратів. Спіронолактон зменшує виведення СК у пацієнтів із хронічною хворобою нирок. Інгібітори ангіотензинперетворювального фермента (АПФ) та деякі сартани виявляють ефект помірного зниження рівня СК за рахунок м’якої урикозуричної дії. Сакубітрил / валсартан знижує СК у плазмі крові внаслідок як урикозуричного ефекту, так і пригнічення синтезу СК. Вплив блокаторів бета-рецепторів на рівень СК лишається невизначеним, але існують дані щодо здатності карведилолу знижувати її рівень. Тривале застосування емпагліфлозину (дослідження EMPEROR-Reduced) асоціювалося зі зниженням порівняно з групою плацебо комбінованої «подагричної» точки (гостра подагра, виникнення подагричного артриту або ініціація інгібіторів ксантиноксидази чи колхіцину) на 32%. В об’єднаному аналізі двох великих клінічних випробувань іншого інгібітора НЗКТГ2 — дапагліфлозину (DAPA-HF та DELIVER) застосування цього препарату було однаково ефективним у зниженні ризику досягнення первинної кінцевої точки (серцево-судинна смерть або погіршення перебігу СН) у пацієнтів без подагри та з подагрою. Інгібітори НЗКТГ2 виглядають сьогодні найбільш перспективними із засобів сучасної фармакотерапії СН, які покращують клінічний прогноз пацієнтів, знижують ризик маніфестування подагри та потреби в антиподагричній терапії.
DOI: 10.32471/rheumatology.2707-6970.20031
Гіперурикемія (ГУ) є частим явищем у пацієнтів із серцевою недостатністю (СН). Порівняно з її поширеністю в популяції, яка нині у розвинених країнах коливається у межах 20–25% [22], у пацієнтів із СН цей показник є щонайменше вдвічі вищим [9, 34]. Наявність та вираженість ГУ при СН демонструє пряму залежність від серцево-судинної (СС) смертності з будь-якої причини та ризику госпіталізацій з приводу СН [1, 9]. Серед обстежених нами 376 пацієнтів із хронічною СН (ХСН) ГУ виявилася найбільш вагомим предиктором настання летального наслідку впродовж наступних 6 міс (рис. 1): її високі рівні асоціювалися з достовірно гіршим виживанням пацієнтів впродовж наступних 3 років (рис. 2).
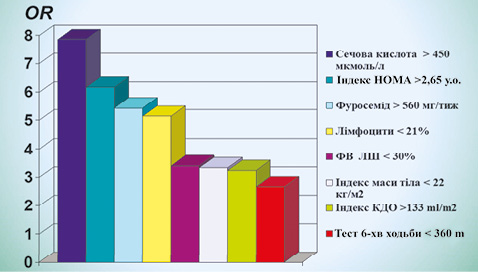
КДО — кінцевий діастолічний об’єм.
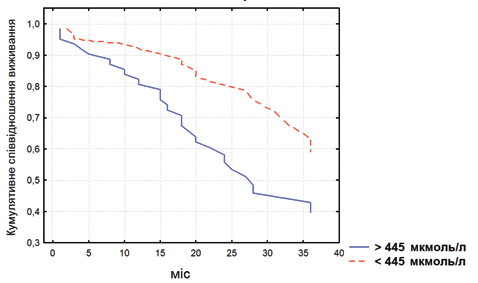
Розуміння природи взаємозв’язку між ГУ та гіршими патернами клінічного перебігу ХСН вбачається важливим з позицій формування сучасних терапевтичних стратегій при цьому синдромі.
Як відомо, сечова кислота (СК) є продуктом метаболізму пуринів, за фінальний етап якого відповідальною є ксантиноксиредуктаза (XOR) — ензим, що існує у двох взаємоперетворювальних формах — відновленій (ксантиндегідрогеназа — ХDН) та окисненій — (ксантиноксидаза — ХО). Обидві каталізують перетворення гіпоксантину в ксантин і далі у СК, причому ХDН відповідає, головним чином, за деградацію пуринів до СК, а ХО, поряд з утворенням СК, — за генерування вільних радикалів (супероксидний аніон та пероксид водню) [3]. Недругорядною деталлю є те, що XOR і, зокрема, ХО, діє як нитрат-нітрит-редуктаза, утворюючи в результаті відповідної двоетапної реакції оксид азоту — NO– [6].
У нормі в тканинах і, зокрема, у здоровому міокарді) домінує експресія ХDН, тоді як рівень ХО у плазмі крові є низьким, а у міокарді вона взагалі не визначається [32]. Втім, в умовах гіпоксії, запалення й оксидативного стресу ХDН активно переходить у ХО з відповідним підвищенням рівня останньої у плазмі крові та появою у міокарді [12, 31, 37]. Високі рівні ХО характерні для патологічних станів, що асоціюються із системним запаленням та оксидативним стресом, — ожиріння, цукрового діабету і, звичайно, СН [2, 20, 37].
Кардіоміопатії різної природи характеризуються високою активністю ХО в міокарді [8, 15], причому її плазмовий рівень є найвищим у пацієнтів з низькою фракцією викиду (ФВ) лівого шлуночка (ЛШ) та високими рівнями натрійуретичних пептидів (НУП) [13].
Наведені дані стали передумовою для планування клінічних досліджень з випробуванням інгібіторів XOR при СС-патології. Втім, попри очікування, жодне з подібних досліджень не виявилося успішним. Так, у випробуванні OPT-CHF оксипуринол у пацієнтів із ХСН та зниженою ФВ підвищував, порівняно з плацебо, комбінований ризик СС-смерті та госпіталізації з приводу СН в 1,8 раза [16], а у дослідженні EXACT, в яке увійшли пацієнти із СН та супутньою ГУ, алопуринол не чинив жодного позитивного впливу на клінічну симптоматику, якість життя та систолічну функцію ЛШ [14]. Ба більше, у дослідженні CARES, в яке включали пацієнтів із подагрою та супутніми СС-захворюваннями, прийом інгібітора ХОR фебуксостату характеризувався достовірним зростанням СС-смертності та смертності з будь-яких причин порівняно з алопуринолом [39]. За даними оприлюдненого у 2024 р. метааналізу 10 клінічних досліджень, у який увійшло 17 328 пацієнтів із СН, попри те, що підвищені рівні СК асоціювалися з підвищенням ризику СС-смерті, смерті з будь-яких причин та госпіталізації з приводу СН, застосування інгібіторів XOR супроводжувалося хоча і помірним (відносний ризик (relative risk — RR = 1,15), але статистично вірогідним (р=0,04) зростанням загальної смертності [30].
Отже, ГУ, з одного боку, виступає інформативним прогностичним маркером при ХСН, але в той самий час не є патофізіологічним чинником її прогресування, оскільки зниження рівня СК шляхом прямої блокади її синтезу не тільки не покращує, й навіть може погіршувати перебіг СН. Для пояснення цієї, на перший погляд, парадоксальної ситуації висунута робоча гіпотеза [27], яка полягає у наступному. Поряд із генеруванням таких вільних радикалів, як супероксидний аніон та гідропероксид водню, ХО, з її високим вмістом в ендотелії, є важливим альтернативним джерелом утворення ендотеліального оксиду азоту (NO–) [7], який, як відомо, має фундаментальне значення для судинного і міокардіального захисту [38]. В умовах притаманного СН дефіциту ендотелійпродукованого NO блокування ХО може поглиблювати його, ступінь якого корелює з погіршенням перебігу СН [11]. На користь такого припущення може свідчити те, що фебуксостат, який, на відміну від алопуринолу, пригнічує як ХО, так і XDH, зумовлює підвищення СС-смертності (див. вище).
Викладені дані не позбавляють сенсу пошук інших стратегій, спрямованих на зниження рівня СК при СН із супутньою ГУ. Підставою для такого твердження є, зокрема, значно вища поширеність подагри у пацієнтів із СН — 10–16% [4, 10], ніж у загальній дорослій популяції (0,7–2,9%) [26]. Окрім зниження якості життя, наявність подагри породжує й чинники, здатні негативним чином впливати на перебіг СН у вигляді застосування нестероїдних протизапальних препаратів (а часом і глюкокортикоїдів), обмеження у лікуванні діуретиками, а також погіршення ниркової функції внаслідок формування уратної нефропатії [9].
У світлі викладеного важливо розуміти, яким чином можуть впливати на утворення та екскрецію СК сучасні засоби рекомендованої фармакотерапії ХСН. Відомо, що петльові та тіазидні діуретики підвищують концентрацію СК у плазмі крові за рахунок зростання реабсорбції уратів [34]. Спіронолактон зменшує виведення СК у пацієнтів із хронічною хворобою нирок [5], поширення якої при СН сягає 50% [25]. Інгібітори ангіотензинперетворювального фермента (АПФ) та деякі сартани виявляють ефект помірного зниження СК за рахунок м’якої урикозуричної дії [21,19]. Сакубітрил / валсартан знижують рівень СК у плазмі крові внаслідок як урикозуричного ефекту, так і пригнічення синтезу СК [33]. Вплив блокаторів бета-адренорецепторів на рівень СК залишається невизначеним, але існують дані щодо здатності карведилолу знижувати її рівень [18].
Публікації останніх років свідчать, що інгібітори НЗКТГ2, які з 2023 р. набули статус універсального терапевтичного стандарту для усіх фенотипів СН [23], демонструють їх серйозний потенціал щодо зниження ризику, пов’язаного з ГУ та подагрою у таких пацієнтів. У відомому дослідженні EMPEROR-Reduced, що охопило 3730 пацієнтів з ХСН та ФВ ≤40%, які отримували стандартне лікування нейрогуморальними антагоністами (інгібітори ренін-ангіотензинової системи (РАС), блокатори бета-адренорецепторів, антагоністи мінералокортикоїдних рецепторів), високий рівень СК асоціювався з гіршими патернами тяжкості СН (клас за New York Heart Association (NYHA), рівень НУП, госпіталізація за останні 6 міс) та вищою смертністю. Тривале (у середньому 16 міс) застосування емпагліфлозину супроводжувалося суттєвим достовірним (р<0,0001) зниженням рівня СК порівняно з групою застосування плацебо, причому у кластері пацієнтів з її найвищими рівнями прийом емпагліфлозину асоціювався із достовірним зниженням ризику як госпіталізації з приводу СН, так і СС-смертності й смертності з будь-яких причин. Важливо, що застосування емпагліфлозину асоціювалося зі зниженням комбінованої «подагричної» точки (гостра подагра, виникнення подагричного артриту або ініціація інгібіторів ХО чи колхіцину) на 32% (р=0,004) порівняно з групою плацебо [9].
В об’єднаному аналізі двох великих клінічних випробувань іншого інгібітора НЗКТГ2 — дапагліфлозину (DAPA-HF та DELIVER, які охопили більше ніж 11 000 пацієнтів СН в усьому спектрі значень ФВ ЛШ) застосування цього препарату було однаково ефективним у зниженні ризику досягнення первинної кінцевої точки (СС-смерть або погіршення перебігу СН) у пацієнтів без подагри та з подагрою. Поряд із тим, у групі дапагліфлозину зафіксовано суттєво нижчий ризик ініціації інгібіторів синтезу СК та терапії колхіцином — на 57 та 46% відповідно, порівняно з групою плацебо [4]. Ці дані корелюють з раніше встановленим у дослідженні DAPA-HF фактом статистично вірогідного (р<0,0001) зниження рівня СК під впливом дапагліфлозину [24].
Важлива особливість уратзнижувального ефекту інгібіторів НЗКТГ2 полягає у тому, що він реалізується двома шляхами. Перший з них визначається фізіологічною взаємодією між транспортерами глюкози (GLUT-9) та уратів (UТ-1), яка здійснюється в проксимальних канальцях, наслідком чого є зростання екскреції СК у відповідь на зниження реабсорбції глюкози [26]. Інший шлях має системний характер та визначається фундаментальним механізмом терапевтичної дії ІНЗКТГ2, а саме активацією (у відповідь на первинне зниження реабсорбції глюкози) ключового регуляторного білка SIRT1, який, у числі інших біологічних ефектів, пригнічує активність ХО, знижуючи у такій спосіб генерування вільних радикалів та рівень СК [28]. Втім, на відміну від класичних інгібіторів ХО, пригнічення останньої під впливом інгібіторів НЗКТГ2 не супроводжується зниженням утворення ендотелієм оксиду азоту, оскільки одним із наслідків активації SIRT1 є стимулювання ендотеліальної NO-синтази [29]. Цікаво, що SIRT1 також стимулює кишкову екскрецію уратів [36].
Отже, викладені дані дозволяють констатувати подвійну роль ГУ при СН: з одного боку, як інформативного прогностичного біомаркера, а з іншого — як фактора ризику прогресування у таких пацієнтів подагри, яка погіршує їх якість життя та може негативним чином впливати на ефективність рекомендованої при ХСН фармакотерапії. Наявна доказова база, з одного боку, свідчить про доцільність зваженого застосування класу інгібіторів XOR з метою лікування подагри у пацієнтів з СН, з іншого — має застерегти від практики їх застосування з метою лікування ГУ як такої у пацієнтів без подагри. У ключі обговорюваної теми інгібітори НЗКТГ2 виглядають сьогодні найбільш перспективними серед засобів сучасної фармакотерапії СН — здатних одночасно з покращенням клінічного прогнозу пацієнтів знижувати ризик маніфестації подагри та потреби в антиподагричній терапії.
Список використаної літератури
- 1. Anker S., Doehner W., Rauchhaus M. et al. (2003) Uric acid and Survival in Chronic Heart FailureValidation and Application in Metabolic, Functional, and Hemodynamic Staging. Circulation: 1991–1997. doi. org: 10.1161/01.CIR.0000065637.10517.
- 2. Battelli M., Bortolotti M., Polito L. et al. (2018) The role of xanthine oxidoreductase and uric acid in metabolic syndrome. Molecular Basis of Disease: 2557–2565. doi.org/10.1016/j.bbadis.2018.05.003.
- 3. Bortolotti M., Polito L., Battelli M. et al. (202) Xanthine oxidoreductase: One enzyme for multiple physiological tasks. Redox Biology, 41: 1–6. doi.org/10.1016/j.redox.2021.101882.
- 4. Butt J., Docherty K., Claggett B. et al. (2023) Association of Dapagliflozin Use with Clinical Outcomes and the Introduction of Uric Acid–Lowering Therapy and Colchicine in Patients With Heart Failure With and Without Gout. A Patient-Level Pooled Meta-analysis of DAPA-HF and DELIVER. JAMA Cardiology, 22. doi:10.1001/jamacardio.2022.5608.
- 5. Cabrera S., Edwards N., Steeds R. et al. (2014) Spironolactone increases serum uric acid levels in patients with chronic kidney disease. Journal of HumanHypertension, 28: 210–211. doi.org/10.1038/jhh.2013.66.
- 6. Cantu-Medellin N., Kelley E. (2013) Xanthine oxidoreductase-catalyzed reactive species generation: A process in critical need of reevaluation. Redox Biology, 1: 353–358. dx.doi.org/10.1016/j.redox.2013.05.002.
- 7. Cantu-Medellin N., Kelley E. (2013) Xanthine oxidoreductase-catalyzed reduction of nitrite to nitric oxide: Insights regarding where, when and how. Nitric. Oxide, 34: 19–26.
- 8. Jong J., Schoemaker R., Jonge R. (2000) Enhanced Expression and Activity of Xanthine Oxidoreductase in the Failing Heart.
Journal of Molecular and Cellular Cardiology, 32 (11): 2083–2089. doi.org/10.1006/jmcc.2000.1240. - 9. Doehner W., Anker S., Butler J. et al. (2022) Uric acid and sodium-glucose cotransporter-2 inhibition with empagliflozin in heart failurewith reduced ejection fraction: the EMPEROR-reduced trial. European Heart Journal, 43: 3435–3447. doi.org/10.1093/eurheartj/ehac320.
- 10. Dzudie A., Kengne A., Mbahe S. et al. (2008) Chronic heart failure, selected risk factors and co-morbidities among adults treated for hypertension in a cardiac referral hospital in Cameroon. European Journal of Heart Failure, 10: 367–372.
- 11. Falls R., Wang B., Vogrin S. et al. (2025) Decreased endogenous nitric oxide production in acute decompensated heart failure with a reduced ejection fraction. ESC Heart Failure: 1–20. doi: 10.1002/ehf2.15253.
- 12. Friedl S., Smith D., Till G. et al. (1990) Rapid Communication Ischemia-Reperfusion in Humans Appearance of Xanthine Oxidase Activity. American Journal of Pathology,136: 3–10.
- 13. Fujimura Y., Yamauchi Y., Murase T., et al. (2023) Relationship between plasma xanthine oxidoreductase activity and left ventricular ejection fraction and hypertrophy among cardiac patients. PLoS ONE, 12(8): 1-12 https://doi.org/10.1371/journal.pone.0182699
- 14. Givertz Y., Anstrom M., Kevin J. et al. (2015) Effects of xanthine oxidase inhibition in hyperuricemic heart failure patients: The xanthine oxidase inhibition for hyperuricemic heart failure patients (EXACT-HF) study. Circulation, 23: 12–23. doi: 10.1161/Circulationaha.114.014536.
- 15. Gladden J., Zelickson B.,Wei C. et al. (2011) Novel insights into interactions between mitochondria and xanthine oxidase in acute cardiac volume overload. Free Radical Biology and Medicine, 51 (11): 1975–1984. doi.org/10.1016/j.freeradbiomed.2011.08.022.
- 16. Hare J., Mangal B., Brown J. et al. (2008) Impact of Oxypurinol in Patients With Symptomatic Heart Failure. Results of the OPT-CHF Study. Journal of the American College of Cardiology, 51 (24): 2301–2309. doi:0.1016/j.jacc.2008.01.068.
- 17. Jin Z., Wang Z., Wang R. et al. (2024) Global burden and epidemic trends of gout attributable to high body mass index from 1990 to 2019. Arch. Med. Sci., 1: 71–80. doi.org/10.5114/aoms/175469.
- 18. Karabacak M., Dogan A., Tayyar S. et al. (2015) The effects of carvedilol and nebivolol on oxidative stress status in patients with non-ischaemic heart failure. Kardiol. Pol., 73(3): 6–21. doi: 10.5603/KP.a2014.0190.
- 19. Kim H., Lee S., Kim J. (2020) Comparative analysis of the efficacy of angiotensin II receptor blockers for uric acid level change in asymptomatic hyperuricaemia. J. Clin. Pharm. Ther., 45(6): 1264–1270. doi:10.1111/jcpt.13202.
- 20. Kuppusamy U., Indran M., Rokiah P. (2005) Glycaemic control in relation to xanthine oxidase and antioxidant indices in Malaysian Type 2 diabetes patients. Diabetic Medicine, 22 (10): 1343–1346. doi.org/10.1111/j.1464-5491.2005.01630.x.
- 21. Leary W., Phil D., Reyes A. et al. (1992) Effects of angiotensin-converting enzyme inhibitors on urinary excretions: Interactions with diuretics. The American Journal of Medicine, 92 (4): 264–S68. doi.org/10.1016/0002-9343(92)90150-A.
- 22. Li1 L., Zhang Y., Zeng C. (2020) Update on the epidemiology, genetics, and therapeutic options of hyperuricemia. Am. J. Transl. Res., 12(7): 3167–3181. http://www.ajtr.org /ISSN:1943-8141/AJTR0109399.
- 23. McDonagh T., Metra M., Adamo M. et al. (2023) Focused Update of the 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. European Heart Journal, 1: 1–13. doi.org/10.1093/eurheartj/ehad195.
- 24. McDowell K., Welsh P., Docherty K. et al. (2022) Dapagliflozin reduces uric acid concentration, an independent predictor of adverse outcomes in DAPA-HF. European Journal of Heart Failure, 24: 1066–1076. doi:10.1002/ejhf.2433.
- 25. Mullens W., Damman K., Testani J. et al. (2020) Evaluation of kidney function throughout the heart failure trajectory — a position statement from the Heart Failure Association of the European Society of Cardiology. European Journal of Heart Failure, 22: 584–603. doi:10.1002/ejhf.1697.
- 26. Novikov A., Fu Y., Huang W. et al. (2019) SGLT2 inhibition and renal urate excretion: role of luminal glucose, GLUT9, and URAT1. Am. J. Physiol. Renal. Physiol., 316: 173–185. doi:10.1152/ajprenal.00462.2018.
- 27. Packer M. (2020) Uric Acid Is a Biomarker of Oxidative Stress in the Failing Heart:Lessons Learned from Trials With Allopurinol and SGLT2 Inhibitors. Journal of Cardiac Failure, 26 (11): 112–120. doi.org/10.1016/j.cardfail.2020.08.015.
- 28. Packer M. (2020) Role of Deranged Energy Deprivation Signaling in the Pathogenesis of Cardiac and Renal Disease in States of Perceived Nutrient Overabundance. Circulation, 141: 2095–2105. doi: 10.1161/CIRCULATIONAHA.119.045561.
- 29. Park S., Farooq M., Bruckert C. et al. (2020) Empagliflozin improved systolic blood pressure, endothelial dysfunction and heart remodeling in the metabolic syndrome ZSF1 rat. Cardiovasc. Diabetol., 19: 1–14. doi.org/10.1186/s12933-020-00997-7.
- 30. Qin S., Xiang M., Gao L. et al. (2024) Uric acid is a biomarker for heart failure, but not therapeutic target: result from a comprehensive metaanalysis. ESC Heart Failure, 11: 78–90. doi: 10.1002/ehf2.14535.
- 31. Sakuma S., Fujimoto Y., Sakamoto Y. et al. (1997) Peroxynitrite Induces the Conversion of Xanthine Dehydrogenase to Oxidase in Rabbit Liver. Biochemical and Biophysical Research Communications, 230 (2): 476–479.
- 32. Sarnesto A., Linder N., Raivio K. (1996) Organ distribution and molecular forms of human xanthine dehydrogenase/xanthine oxidase protein. Lab Invest, 74(1): 48-56
- 33. Selvaraj S., Claggett B., Pfeffer M. et al. (2020) Serum uric acid, influence of sacubitril–valsartan, and cardiovascular outcomes in heart failure with preserved ejection fraction: PARAGON-HF. European Journal of Heart, 22: 2093–2101. doi:10.1002/ejhf.1984.
- 34. Sica D., Carter B., Cushman W. et al. (2011) Thiazide and Loop Diuretics. The Journal of Clinical Hypertension, 13 (9): 639–643. doi: 10.1111/j.1751-7176.2011.00512.x.
- 35. Stone M., Richardson M., Guevara L. et al. (2019) Elevated Serum Uric Acid and Self-Reported Heart Failure in US Adults: 2007–2016. National Health and Nutrition Examination Survey. Cardiorenal. Med., 9 (6): 344–353. doi.org/10.1159/000502438.
- 36. Wang J., Zhu X., Liu L. et al. (2016) SIRT1 prevents hyperuricemia via the PGC-1α/PPARγ-ABCG2 pathway. Endocrine, 53: 443–452. doi.org/10.1007/s12020-016-0896-7.
- 37. Washio K., Kusunoki Y., Murase T. et al. (2017) Xanthine oxidoreductase activity is correlated with insulin resistance and subclinical inflammation in young humans. Metabolism, 5: 51–56. doi: 10.1016/j.metabol.2017.01.031.
- 38. Widmer R., Lerman A. (2014) Endothelial dysfunction and cardiovascular disease. Widmer and Lerman. Global Cardiology Science and Practice, 43: 291–308. doi.org/10.5339/gcsp.2014.43.
- 39. White W., Saag K., Becker M. et al. (2018) Cardiovascular Safety of Febuxostat or Allopurinol in Patients with Gout. N. Engl. J. Med., 378: 1200–1210. doi: 10.1056/NEJMoa1710895.
Відомості про авторів
Воронков Леонід Георгійович — доктор медичних наук, професор, завідувач відділу серцевої недостатності, поєднаної з патологією внутрішніх органів, ДУ «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені акад. М.Д. Стражеска» НАМН України»
E-mail: lgvoronkov@gmail.com
ORCID ID: 0000-0002-9339-7427
Мітченко Олена Іванівна — докторка медичних наук, професорка, завідувачка відділу ендокринної кардіології та дисліпідемій, ДУ «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені акад. М.Д. Стражеска» НАМН України»
E-mail: olenamitchenko54@gmail.com
ORCID ID: 0000-0001-6692-6883
Ляшенко Аліна Вікторівна — кандидатка медичних наук, старша наукова співробітниця відділу серцевої недостатності, поєднаної з патологією внутрішніх органів, ДУ «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені акад. М.Д. Стражеска» НАМН України»
E-mail: Lyashenko2007@ukr.net
ORCID ID: 0009-0004-8152-673X
Ткач Наталія Альбертівна — кандидатка медичних наук, старша наукова співробітниця відділу серцевої недостатності, поєднаної з патологією внутрішніх органів, ДУ «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені акад. М.Д. Стражеска» НАМН України»
E-mail: natalia.tkach@ukr.net
ORCID ID: 0000-0002-6340-5860
Надійшла до редакції/Received: 15.08.2025
Прийнято до друку/Accepted: 04.09.2025

Leave a comment