Функція зовнішнього дихання та дифузійна здатність легень у пацієнтів із ЛАГ, асоційованою із системними захворюваннями сполучної тканини, порівняно з іншими формами ЛГ
Прогонов С.О.1, Радченко Г.Д.2, Борткевич О.П. 2
- 1ДУ «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені акад. М.Д. Стражеска» НАМН України», м. Київ
- 2ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска Національної академії медичних наук України», м. Київ
Резюме. Мета дослідження: порівняти показники функції зовнішнього дихання (ФЗД) та дифузійної здатності легень за монооксидом вуглецю (ДЗЛМВ) у пацієнтів із легеневою артеріальною гіпертензією (ЛАГ), асоційованою із системними захворюваннями сполучної тканини (СЗСТ), з іншими формами легеневої гіпертензії (ЛГ). Матеріали і методи. Залучено 60 пацієнтів 4 статистично зіставних груп: 15 пацієнтів з ідіопатичною ЛАГ, 15 — з ЛАГ, асоційованою із вродженою вадою серця (ЛАГ-ВВС), 15 — із хронічною тромбоемболічною ЛГ (ХТЕЛГ), 15 — з ЛАГ-СЗСТ. Оцінювали ФЗД (життєва ємність легень (ЖЄЛ), форсована життєва ємність легень (ФЖЄЛ), об’єм форсованого видиху за 1 с (ОФВ1)), ДЗЛМВ і загальну ємність легень (ЗЄЛ), проводили обстеження згідно зі стандартами діагностики ЛГ. Результати. Найбільше статистично значуще зниження показників ФЗД зафіксовано в групі пацієнтів із ЛАГ-ВВС, ДЗЛМВ — із ЛАГ-СЗСТ. Виявлено незалежні достовірні кореляції — між ЖЄЛ (р=0,037), ОФВ1 (р=0,027) та наявністю ВВС; між ФЖЄЛ та індексом правого передсердя (p=0,009); між ДЗЛМВ та дистанцією, пройденою під час 6-хвилинного тесту (р=0,009), середнім тиском у легеневій артерії (р=0,040), середнім тиском у правому шлуночку (р=0,002), наявністю системного склерозу (р<0,001); між ЗЄЛ та індексом правого передсердя (р=0,003), наявністю системного склерозу (р=0,006). Висновки. Значне зниження ДЗЛМВ та ЗЄЛ у пацієнтів із СЗСТ на фоні майже нормальних показників ФЗД підтвердило необхідність їх визначення у всіх хворих з ЛАГ-СЗСТ, окрім стандартних показників спірометрії. ДЗЛМВ та ЗЄЛ достовірно асоціювалися із функціональним станом пацієнтів та порушенням гемодинаміки.
DOI: 10.32471/rheumatology.2707-6970.19793
УДК: 616.12-008.331.1:616.24-005-004-033.1:616-036.12
Легенева гіпертензія (ЛГ) — це стан, який характеризується підвищенням середнього тиску в легеневій артерії більше 20 мм рт.ст. ЛГ може виникати як під впливом інших хвороб (наприклад захворювання лівих відділів серця, легень тощо), так і формуватися як окрема патологія, що характеризується первинним розвитком ремоделювання (гіпертрофія інтими та медії, плексиформне пошкодження, мікротромбоз) легеневих артерій малого калібру. Тригерами цього ремоделювання можуть бути інші хвороби (наприклад вроджені вади серця (ВВС), захворювання печінки тощо), але патогенез однаковий незалежно від етіології, що дозволяє об’єднувати ці ЛГ у групу легеневої артеріальної гіпертензії (ЛАГ), що належить до рідкісних захворювань, прогресування яких супроводжується високою смертністю, значними порушеннями функціонального стану пацієнтів та інвалідизацією в працездатному віці. Без відповідного лікування середня тривалість життя пацієнтів із ЛАГ може становити лише 2,8 року [1].
Системні захворювання сполучної тканини (СЗСТ) характеризуються ураженням багатьох органів і систем, а особливо легень та судин. Одним із найбільш серйозних ускладнень СЗСТ є розвиток ЛГ. Серед усіх СЗСТ найбільша частка (8–12%) ЛГ виявляється при системному склерозі, що становить майже 75% від усіх випадків ЛГ, зумовленої СЗСТ. Крім того, ЛГ може бути виявлена у 1–5% пацієнтів із системним червоним вовчаком, у близько 3–4% — зі змішаним захворюванням сполучної тканини, вкрай рідко — при первинному синдромі Шегрена, ідіопатичних запальних міопатіях, ревматоїдному артриті [2].
Усі ЛГ, в тому числі при СЗСТ, поділяються на 5 великих груп залежно від їхнього типу (пре- або посткапілярна) та етіопатогенезу [1]. За даними катетеризації правих відділів серця (КПС), ЛАГ (1-ша група) та хронічна тромбоемболічна легенева гіпертензія (ХТЕЛГ) (4-та група) характеризуються наявністю прекапілярної ЛГ (тиск заклинювання в легеневій артерії (ТЗЛА) — ≤15 мм рт. ст.) та опором легеневих судин (ОЛС) — >2 одиниць Вуда (од. Вуда) [1]. ЛГ, асоційована із лівими відділами серця (посткапілярна), характеризується підвищеним ТЗЛА (>15 мм рт ст.). При ураженні легень, як правило, розвивається прекапілярна ЛГ та виявляються значні структурні і функціональні зміни паренхіми та/або бронхів, що відображається при візуалізуючих обстеженнях та/або оцінці показників дихання. Найчастіше при СЗСТ розвивається ЛАГ, але можуть формуватися й інші форми (рисунок) [3].
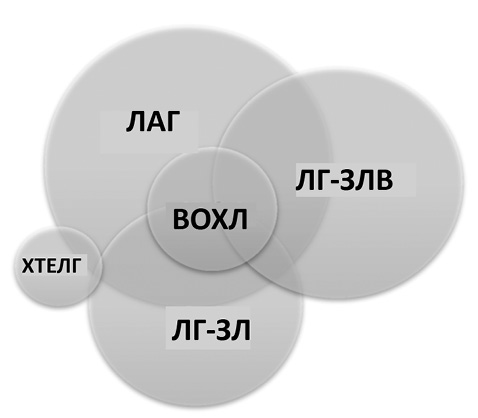
Через ендотеліальну дисфункцію, запалення, викликане аутоімунними процесами, порушення коагуляції при СЗСТ можуть розвиватись ураження легеневих артерій малого калібру або капілярів та венул за вено-оклюзивним типом (1-ша група ЛГ). При прогресуючому легеневому фіброзі формується ЛГ, асоційована із захворюванням легень (3-тя група ЛГ). Якщо домінує ураження міокарда та коронарних артерій, може формуватися ЛГ, асоційована із захворюванням лівих відділів серця (2-га група ЛГ) [4]. Окрім того, у пацієнтів із СЗСТ часто виявляється антифосфоліпідний синдром [5–8], що підвищує ризик виникнення тромбоемболії легеневої артерії та формування ХТЕЛГ (4-та група ЛГ). Слід зауважити, що вказані форми ЛГ можуть бути при СЗСТ окремими. Але нерідко у пацієнтів можуть відмічати ознаки усіх 4 груп. Наприклад, пацієнт з переважним ураженням легень при системному склерозі може перенести гострий коронарний синдром або тромбоемболію легеневих артерій. Усі пацієнти з ЛГ та СЗСТ, а особливо такі, обов’язково мають обстежуватися у спеціалізованому відділенні для встановлення домінуючої причини ЛГ, що дозволяє правильно призначити лікування. Адже різні форми ЛГ-СЗСТ мають різні рекомендації щодо лікування [3–8]. Критерії для правильного визначення фенотипу ЛГ при системному склерозі представлено в табл. 1 [3].
| Тип ЛГ | Поширеність при системному склерозі | Основні характеристики | КПС | Лікування |
| ЛАГ (1-ша група) | 60%, частіше при лімітованій | СерТЛА > 35 мм рт. ст.
КТ: немає значних змін паренхіми ЕхоКГ: немає змін або мінімальні зміни лівих відділів |
Прекапілярна ЛГ
СерТЛА >20 мм рт. ст. ТЗЛА <15 мм рт. ст. ЛСО >2 од. Вуда |
Терапія ЛГ
Трансплантація легень |
| ВОХЛ (1-ша група) | Дуже рідко, мало діагностується | ДЗЛМВ < 50%
КТ: септальні лінії, матове скло, збільшення лімфатичних вузлів |
Прекапілярна ЛГ
СерТЛА >20 мм рт. ст. ТЗЛА <15 мм рт. ст. ЛСО > 2 од. Вуда |
Діуретики
Обережна терапія ЛГ Трансплантація легень |
| ЛГ-ЗЛВ (2-га група) | 21% | Анамнез: старший вік, ожиріння, АГ, цукровий діабет, ФП.
ЕКГ: БЛНПГ або гіпертрофія ЛШ. ЕхоКГ: дилатація ЛП або недостатність / стеноз клапанів лівих відділів серця |
Посткапілярна ЛГ
СерТЛА >20 мм рт. ст. ТЗЛА >15 мм рт. ст. ЛСО <3 од. Вуда (ізольована), або ≥3 од. Вуда (комбінована) |
Діуретики
Лікування захворювання лівих відділів серця |
| ЛГ-ЗЛ (3-тя група) | 19%, частіше при дифузній з ураженням шкіри | ФЖЄЛ <70%
Зміни паренхіми легень |
Прекапілярна ЛГ
СерТЛА >20 мм рт. ст. (зазвичай <35 мм рт. ст.) ТЗЛА <15 мм рт. ст. ЛСО >2 од. Вуда |
Імуносупресивна терапія
Нінтеданіб Трансплантація легень |
| ХТЕЛГ (4-та група) | Невідома | ТГВ в анамнезі
КТ-ознаки ТЕЛА |
Прекапілярна ЛГ
СерТЛА >20 мм рт. ст. ТЗЛА <15 мм рт. ст. ЛСО >2 од. Вуда |
Антикоагулянти
ТЕ БА Ріоцигуат |
Так, до 3-ї групи ЛГ належить така, що розвивається при поширеній формі інтерстиціального ураження легень при системному склерозі (табл. 1). При цьому виявляються >20% фіброзу при комп’ютерній томографії (КТ) високої роздільної здатності або форсована життєва ємність легень (ФЖЄЛ) <70% за даними оцінки функції зовнішнього дихання (ФЗД) при невизначених результатах КТ. Такий фенотип ЛГ характеризується гіршою виживаністю (35 проти 56%, за результатами метааналізу Lefèvre та співавторів [9]) порівняно з ЛАГ (1-ша група), потребує дорожчого та більш специфічного лікування, яке може включати імуносупресивні препарати [10] та таргетовану антифібротичну терапію [11]. Застосування препаратів для лікування ЛАГ залишається дискутабельним питанням, адже переважно в рандомізовані дослідження з оцінки ефективності специфічної терапії ЛАГ не включали пацієнтів зі значним ураженням легень при СЗСТ. Є окремі спостереження, які демонструють кращий прогноз на фоні застосування препаратів для лікування ЛАГ [12], але є й ті, що свідчать про відсутність ефекту [13].
Посткапілярна ЛГ (2-га група), як правило, не потребує специфічного лікування ЛГ, а лише прийому препаратів для симптомного лікування серцевої недостатності, аритмій, ішемії міокарда тощо. При СЗСТ може формуватися, як наслідок фіброзу міокарда, недостатність як систолічної (серцева недостатність із помірно зниженою фракцією викиду — близько 2% пацієнтів із системним склерозом), так і діастолічної функції (серцева недостатність зі збереженою фракцією викиду — близько 18% пацієнтів із системним склерозом) [5, 14]. Згідно з даними Bourji та співавторів [15], наявність діастолічної дисфункції лівих відділів серця у пацієнтів із системним склерозом характеризується вдвічі вищим ризиком смерті порівняно із пацієнтами з ЛАГ, які при визначенні гемодинаміки не мають посткапілярної ЛГ.
Венооклюзійна хвороба легень також може сформуватися у пацієнтів із системним склерозом. Її характерними проявами є збільшення лімфатичних вузлів, центрилобулярні помутніння за типом матового скла і септальні лінії на КТ легень, зниження дифузійної здатності легень за монооксидом вуглецю (ДЗЛМВ) <50% та тяжка гіпоксемія. Як правило, такі пацієнти починають отримувати специфічну терапію, але в них відмічають або резистентність до лікування, або прогресуюче погіршення стану. Для цих пацієнтів характерне найгірше виживання, вони потребують направлення на трансплантацію легень першочергово з моменту встановлення діагнозу [16, 17].
У контексті диференціації форм ЛГ особливу цінність мають вже згадані вище дослідження ФЗД та ДЗЛМВ як неінвазивні інструменти для оцінки характеру й вираженості ураження легень. Ці методи, згідно з останньою настановою Європейського товариства кардіологів (ESC) та Європейського респіраторного товариства (ERS) 2022 р. з діагностики та лікування ЛГ (ESC/ERS 2022) [1], входять до складу обов’язкових обстежень пацієнтів із ЛГ. ФЗД — це фізіологічний тест із фіксуванням об’ємів та потоків повітря, які пацієнт здатний вдихати або видихати зі звичайним або максимальним зусиллям, що характеризує стан нижніх дихальних шляхів. ДЗЛМВ — метод діагностики порушень газообміну в легеневій тканині. При цьому порушення переносу дихальних газів (О2 та СО2) із вдихуваного повітря до артеріальної крові може бути спричинене як погіршанням структурних та/або функціональних властивостей альвеолярно-капілярної мембрани, так і іншими анатомо-фізіологічними факторами. Адже процес перенесення монооксиду вуглецю (СО) з навколишнього середовища у кров легеневих капілярів має декілька етапів, з яких ключове значення мають транспортування СО до дихальних шляхів і альвеол; перенесення СО через межу між газоподібним та рідинним середовищем альвеолярно-капілярної мембрани; дифузія СО всередину еритроцитів і хімічна реакція з компонентами гемоглобіну крові.
При ЛАГ та ХТЕЛГ у майже 70 % пацієнтів відмічають зниження ДЗЛМВ (<80%). Це може відбуватися як внаслідок потовщення альвеолярно-капілярної мембрани через проліферацію ендотелію, так і через зменшення капілярного об’єму, яке виникає через ремоделювання малих артерій (гіпертрофія, плексиформне пошкодження), що супроводжується збільшенням ОЛС, зменшенням хвилинного об’єму крові (ХОК) та виникненням локального тромбозу [18]. Окрім того, на показник ДЗЛМВ можуть впливати куріння, наявність інтралегеневих або інтракардіальних шунтів, концентрація гемоглобіну [19]. ДЗЛМВ <50 % є значущим маркером наявності ураження легеневих судин (частіше при венооклюзійній хворобі легень) або паренхіми легень [20]. У пацієнтів із системним склерозом ДЗЛМВ <60 % асоціюється з наявністю ЛАГ у пацієнтів із незначними клінічними симптомами [21], а відношення ДЗЛМВ / альвеолярний об’єм <60 % є предиктором виникнення ЛГ протягом наступних 36 міс [22, 23].
Існують дані, що ДЗЛМВ може бути також прогностичним маркером для пацієнтів з ІЛАГ [24, 25], ХТЕЛГ [26] та при системному склерозі [27]. Цей показник доданий у калькулятор REVEAL (Registry to Evaluate Early and Long-term PAH Disease Management) 1.0 та REVEAL 2.0 для визначення виживання пацієнтів із ЛАГ або ХТЕЛГ [27–29]. Однак незважаючи на поширеність використання ДЗЛМВ для оцінки прогнозу у пацієнтів із системним склерозом і його обов’язковість застосування у пацієнтів із ЛГ, наразі існує критично малий обсяг досліджень, які порівнювали б його відмінності, проводячи пошук їх імовірних причин в асоціації з функціональним статусом та гемодинамікою, особливо у пацієнтів з ЛГ, пов’язаною із СЗСТ.
Мета дослідження: оцінити показники ФЗД та ДЗЛМВ у пацієнтів із ЛАГ-СЗСТ та порівняти їх із показниками при інших формах ЛГ. Окрім того, провести визначення кореляційних зв’язків між основними показниками ФЗД та ДЗЛМВ та параметрами, які характеризують функціональний стан пацієнта та порушення внутрішньосерцевої гемодинаміки.
Матеріали та методи
У дослідження залучено 60 пацієнтів, які були госпіталізовані у відділення вторинних та легеневих гіпертензій ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска НАМН України», і яким після проведення всіх необхідних досліджень згідно з уніфікованим протоколом з діагностики та лікування ЛГ [30] та рекомендаціями ESC/ERS 2022 [1], діагностовано ЛАГ або ХТЕЛГ: 15 пацієнтів з ІЛАГ, 15 — з ЛАГ-ВВС, 15 — із ХТЕЛГ, 15 — з ЛАГ-СЗСТ.
Вказані групи пацієнтів були статистично зіставними між собою за віком, зростом, статтю, масою та індексом маси тіла (табл. 2). Усі пацієнти перед визначенням ФЗД та ДЗЛМВ були компенсовані, перебували в еуволюмічному стані та не приймали специфічної терапії ЛГ. У групу ЛАГ-ВВС увійшли пацієнти, у яких вада серця не була коригована (вперше виявлена або визнана неоперабельною через високий тиск у легеневій артерії). Критеріями незалучення були клінічно значущі супутні захворювання (хронічна хвороба нирок 3–4-ї стадії, значуща дисфункція печінки, декомпенсований цукровий діабет, психічні розлади, скелетно-м’язові порушення розвитку грудної клітки).
| Показник | ЛГ загалом (n=60) | ІЛАГ (n=15) | ЛАГ-СЗСТ (n=15) | ЛАГ-ВВС (n=15) | ХТЕЛГ (n=15) |
| Вік, роки | 48,65±1,34 | 46,87±2,26 | 50,93±2,83 | 45,93±2,44 | 50,87±3,09 |
| Зріст, см | 168,92±1,06 | 169,40±2,23 | 167,27±2,03 | 168,47±2,17 | 170,53±2,20 |
| Маса тіла, кг | 72,09±2,03 | 77,47±5,64 | 69,80±3,14 | 67,54±3,64 | 73,53±3,25 |
| ІМТ, кг/м2 | 25,15±0,58 | 26,65±1,27 | 25,07±1,29 | 23,70±1,12 | 25,18±0,85 |
| Жінки/чоловіки, n (%) | 39 (65) / 21 (35) | 10 (66,7) / 5 (33,3) | 10 (66,7) / 5 (33,3) | 11 (73,3) / 4 (26,7) | 8 (53,3) / 7 (46,7) |
| ЖЄЛ, % | 79,85±1,84 | 87,53±3,88*^ | 75,73±4,14 | 71,73±3,97 | 83,00±4,52 |
| ФЖЄЛ, % | 76,64±2,01 | 85,93±4,15^ | 73,09±5,47 | 70,13±4,04 | 79,00±4,48 |
| ОФВ1, % | 77,61±1,99 | 86,67±4,54*^ | 73,13±4,21 | 67,80±4,06$ | 83,20±4,89^ |
| ОФВ1 / ФЖЄЛ, % | 107,13±1,01 | 106,20±2,45 | 106,00±2,31 | 102,67±1,94$ | 110,47±2,88^ |
| ОФВ1 / ЖЄЛ, % | 102,09±0,86 | 102,73±2,01 | 101,67±2,08 | 99,00±2,03 | 103,27±2,22 |
| ПШВ, % | 67,56±2,29 | 74,87±4,19^ | 61,53±5,17 | 56,80±3,65 | 70,00±6,06 |
| МОШ-75, % | 65,75±2,59 | 72,87±5,69^ | 60,40±5,65 | 57,07±4,07 | 69,87±6,43 |
| МОШ-50, % | 72,00±2,99 | 84,73±8,24^ | 70,00±6,83 | 55,73±5,55$ | 78,53±6,52^ |
| МОШ-25, % | 76,25±4,25 | 71,75±7,26 | 72,87±7,15 | 58,33±6,56 | 75,36±7,21 |
| ДЗЛМВ, % | 55,92±2,34 | 60,40±3,59** | 30,47±3,37$$^^ | 63,07±6,14** | 57,20±4,18** |
| ЗЄЛ, % | 80,88±2,32 | 90,93±3,67* | 83,13±4,24 | 70,07±4,87 | 79,40±4,38 |
Усім пацієнтам проводилися тест 6-хвилинної ходьби (6-ХТ), спірометрія, визначення ДЗЛМВ та газів у крові, аналіз крові на N-кінцевий мозковий натрійуретичний пептид (N-КМНУП), ехокардіографія (ЕхоКГ) та КПС.
6-ХТ проводився за стандартною методикою, базуючись на протоколі Американського торакального товариства (American Thoracic Society) [31]. Визначали дистанцію, яку пацієнт проходить протягом 6 хв, та ступінь задишки за Borg.
Зразки для визначення рівня НКМНУП брали вранці натще з плазми венозної крові, транспортували у вакутайнерах із літій-гепарином і гелем, після центрифугування, у холодильнику у температурному режимі 2–25 °С, та надалі обробляли методом хемілюмінесцентного аналізу.
ЕхоКГ обстеження пацієнтів проводилося на апараті Aplio Artida SSH-880 CV (Toshiba, Японія) з використанням секторального датчика PST-30ВТ (2–4 МГц). Протокол включав визначення та обчислення параметрів, рекомендованих для оцінки за останніми рекомендаціями ESC/ERS 2022: площа правого передсердя (ПП), співвідношення базальних розмірів правого та лівого шлуночка (ПШ/ЛШ), екскурсія кільця трикуспідального клапана (TAPSE — tricuspid annular plane systolic excursion), пікова систолічна швидкість руху трикуспідального кільця (S’), визначена за допомогою тканинної допплерографії, швидкість регургітації на трикуспідальному клапані, розмір та колабування нижньої порожнистої вени (НПВ), систолічний тиск на легеневій артерії (СТЛА), індекс ексцентричності лівого шлуночка під час систоли та діастоли, а також наявність чи відсутність перикардіального випоту [1].
КПС проводилася за стандартним протоколом із вимірюванням тиску у правому передсерді та шлуночку, ЛА та ТЗЛА. Для оцінки газового складу крові брали зразки із ЛА, стегнової артерії та, за необхідності, із верхньої та нижньої порожнистої вени. Оцінка гемодинаміки включала вимірювання методом термодилюції хвилинного об’єму крові (ХОК) з використанням термодилюційного катетера Свана — Ганца (Edwards LifeSciences, Argon, США, або B. Braun, Німеччина) розміром 7F та реанімаційно-хірургічного монітора ЮМ 300 І15 виробництва «Ютас» (Україна) із вбудованими електронними блоками інвазивного вимірювання артеріального тиску (АТ) та термодилюції, з наступною калькуляцією серцевого індексу (СІ), ударного об’єму (УО), ударного індексу (УІ), ОЛС, загального легеневого опору (ЗЛО) та системного судинного опору (ССО) [1]. У пацієнтів із ЛАГ-ВВС ХОК визначали за допомогою методу Фіка після прямого визначення мінімального поглинання кисню за допомогою системи для комплексної оцінки легеневої функції ErgostikTM (Geratherm Respiratory, Німеччина) та програмного забезпечення Blue Cherry V1.3.2.0 (Geratherm Respiratory, Німеччина).
Вимірювання величин параметрів ФЗД та ДЗЛМВ проводили за допомогою спірометра з дифузією DiffustikTM (Geratherm Respiratory, Німеччина) та програмного забезпечення Blue Cherry V1.3.2.0 (Geratherm Respiratory, Німеччина). Оцінювали такі показники: ЖЄЛ, ФЖЄЛ, ОФВ1, ПШВ, максимальні об’ємні швидкості видиху (МОШ-75, МОШ-50, МОШ-25), ДЗЛМВ, загальну ємність легень (ЗЄЛ). У разі зниження рівнів показників, що характеризують обструктивні зміни (ОФВ1, МОШ-75, МОШ-50, МОШ-25) додатково проводили бронходилатаційну пробу із сальбутамолом для подальшого визначення їх зворотності чи незворотності.
Було створено єдину базу даних пацієнтів, залучених у дослідження. Статистичний аналіз виконувався за допомогою статистичного пакета для соціальних наук (IBM SPSS Statistics, версія 27.0, SPSS Inc., США). Усі досліджувані показники були відображені як частка у відсотках або як середнє значення і середньоквадратична похибка (СКП). Проведено оцінку відмінностей між групами за допомогою t-критерію незалежної вибірки та оцінку асоціацій між показниками, що вимірювалися, за допомогою кореляційного аналізу Спірмена. Статистично значущими вважали показники р<0,05 — їх у подальшому оцінювали за допомогою багатофакторного регресійного аналізу. Доцільність обраної моделі для регресійного аналізу оцінювали за допомогою тесту ANOVA.
Результати дослідження
Середній вік пацієнтів загалом у когорті становив 48,65±1,34 року. За статтю переважали жінки (серед усіх пацієнтів — 65%, ІЛАГ — 66,7%, ЛАГ-СЗСТ — 66,7%, ЛАГ-ВВС — 73,3%, ХТЕЛГ — 53,3%).
Найгірші показники ФЗД виявлені у пацієнтів із ЛАГ-ВВС (табл. 3). Проте ЖЄЛ і ФЖЄЛ в середньому перевищували порогове значення 70%. У пацієнтів із ЛАГ-ВВС ЖЄЛ була меншою на 15,8%, ніж у групі ІЛАГ; ФЖЄЛ — на 15,8%, ніж у групі ІЛАГ; ОФВ1 — на 18,87 і 15,4%, ніж у групах ІЛАГ та ХТЕЛГ відповідно; відношення ОФВ1 / ФЖЄЛ — на 7,8%, ніж у групі ХТЕЛГ; ПШВ — на 18,07%, ніж у групі ІЛАГ; МОШ-75 — на 15,8%, ніж у групі ІЛАГ; МОШ50 — на 29 і 22,8%, ніж у групах ІЛАГ та ХТЕЛГ.
| Показник | ЖЄЛ, % | ФЖЄЛ, % | ОФВ1, % | ||||||
| r | р1 | p2 | r | р1 | p2 | r | р1 | p2 | |
| Вік, роки | 0,050 | 0,702 | НЗ | 0,086 | 0,530 | НЗ | 0,051 | 0,698 | НЗ |
| Маса тіла, кг | 0,130 | 0,321 | НЗ | 0,171 | 0,212 | НЗ | 0,266 | 0,040* | 0,172 |
| SpO2, % | 0,143 | 0,308 | НЗ | 0,109 | 0,456 | НЗ | 0,174 | 0,212 | НЗ |
| Дистанція 6ХТ, м | 0,080 | 0,553 | НЗ | 0,090 | 0,527 | НЗ | 0,127 | 0,345 | НЗ |
| Гемоглобін, г/л | -0,010 | 0,942 | НЗ | –0,024 | 0,865 | НЗ | 0,031 | 0,813 | НЗ |
| N-КМНУП, пг/мл | 0,004 | 0,974 | НЗ | -0,006 | 0,966 | НЗ | -0,003 | 0,983 | НЗ |
| Індекс ПП, мл/м2 | -0,260 | 0,053 | НЗ | -0,320 | 0,022* | 0,009* | -0,215 | 0,111 | НЗ |
| TAPSE, мм | –0,098 | 0,458 | НЗ | –0,076 | 0,582 | НЗ | –0,088 | 0,506 | НЗ |
| СерТЛА, мм рт. ст. | 0,139 | 0,327 | НЗ | 0,129 | 0,388 | НЗ | 0,122 | 0,389 | НЗ |
| СТПШ, мм рт. ст. | 0,030 | 0,839 | НЗ | 0,008 | 0,959 | НЗ | 0,039 | 0,792 | НЗ |
| ЗЛО, од. Вуда | 0,245 | 0,105 | НЗ | 0,231 | 0,147 | НЗ | 0,246 | 0,103 | НЗ |
| SaО2, % | 0,005 | 0,974 | НЗ | –0,014 | 0,926 | НЗ | 0,092 | 0,529 | НЗ |
| Наявність ВВС | –0,287 | 0,026* | 0,037* | –0,268 | 0,048* | 0,150 | –0,370 | 0,004* | 0,027* |
| Наявність системного склерозу | –0,114 | 0,384 | НЗ | –0,067 | 0,629 | НЗ | –0,100 | 0,449 | НЗ |
| Тест ANOVA | p=0,037 | p=0,012 | p=0,021 | ||||||
ДЗЛМВ була найнижчою у хворих із ЛАГ-СЗСТ (30,47±3,37%), що було статистично значущим порівняно з усіма іншими досліджуваними групами ЛГ. Загалом, у всіх групах ЛГ ДЗЛМВ була в середньому меншою, ніж показник норми (вище ніж 70–80% за різними рекомендаціями [32]). Найнижча ЗЄЛ (70,07±4,87%) відмічена у пацієнтів із ЛГ-ВВС, однак таке зниження не було статистично достовірним відносно інших досліджуваних груп ЛГ. Статистична достовірність зниження виявлена при порівнянні ЛГ-СЗСТ із групою ІЛАГ (83,13± 4,24% проти 90,93±3,67%).
Кореляційний аналіз за Спірменом проведений між основними показниками ФЗД, ДЗЛМВ, ЗЄЛ та всіма показниками клініко-лабораторного та інструментального обстеження пацієнтів із ЛГ (табл. 3, 4). Встановлено, що ЖЄЛ мала статистично значущий кореляційний зв’язок з наявністю ВВС. ФЖЄЛ статистично значущо асоціювалася з дистанцією, пройденою під час 6ХТ, індексом ПП, виміряним при ЕхоКГ, та наявністю ВВС. ОФВ1 статистично значущо корелював із масою тіла та наявністю ВВС. Багатофакторний регресійний аналіз продемонстрував, що незалежні статистично значущі кореляції були між ЖЄЛ (р=0,037) і ОФВ1 (р=0,027) та наявністю ВВС, між ФЖЄЛ та індексом ПП (p=0,009), між ДЗЛМВ та дистанцією, пройденою під час 6ХТ (р=0,009), СрТЛА (р=0,040) і середнім тиском у ПШ (р=0,002) та наявністю системного склерозу (р<0,001), між ЗЄЛ та індексом ПП (р=0,003) та наявністю системного склерозу (р=0,006). При проведенні кореляційно-регресійного аналізу окремо в групі ЛГ-СЗСТ виявлено незалежні статистично значущі кореляції між рівнем рСО2 в артеріальній крові та ЖЄЛ (beta=0,629, р=0,021, ANOVA p=0,021), ФЖЄЛ (beta=0,964, р=0,008, ANOVA p=0,015), ОФВ1 (beta=0,562, р=0,046, ANOVA p=0,046). Окрім того, ДЗЛМВ достовірно корелювала із середнім тиском у правому передсерді (beta=–0,590, р=0,026, ANOVA p=0,026), а ЗЄЛ із ступенем колабування НПВ, визначеним під час ЕхоКГ (beta=0,542, р=0,037, ANOVA p=0,037).
| Показник | ДЗЛМВ, % | ЗЄЛ,% | ||||
| r | р1 | p2 | r | р1 | p2 | |
| Вік, роки | –0,269 | 0,037* | 0,745 | –0,197 | 0,132 | НЗ |
| Маса тіла, кг | 0,200 | 0,125 | НЗ | 0,138 | 0,294 | НЗ |
| SpO2, % | 0,534 | <0,001* | 0,072 | 0,337 | –0,014* | 0,832 |
| Дистанція 6ХТ, м | 0,315 | 0,017* | 0,009* | 0,220 | 0,100 | НЗ |
| Гемоглобін, г/л | 0,084 | 0,527 | НЗ | –0,041 | 0,759 | НЗ |
| N-КМНУП, пг/мл | –0,257 | 0,051 | НЗ | –0,078 | 0,558 | НЗ |
| Індекс ПП, мл/м2 | –0,085 | 0,535 | НЗ | –0,294 | 0,028* | 0,003* |
| TAPSE, мм | 0,146 | 0,264 | НЗ | 0,163 | 0,214 | НЗ |
| СерТЛА, мм рт. ст. | 0,305 | 0,028* | 0,040* | 0,063 | 0,658 | НЗ |
| СТПШ, мм рт. ст. | 0,400 | 0,004* | 0,002* | 0,105 | 0,473 | НЗ |
| ЗЛО, од. Вуда | 0,119 | 0,435 | НЗ | 0,023 | 0,879 | НЗ |
| SaО2, % | 0,222 | 0,125 | НЗ | 0,183 | 0,208 | НЗ |
| Наявність ВВС | 0,238 | 0,067 | НЗ | –0,057 | 0,667 | НЗ |
| Наявність СС | –0,597 | <0,001* | <0,001* | –0,302 | 0,019* | 0,006* |
| Тест ANOVA | p=0,037 | p=0,002 | ||||
Таким чином, у пацієнтів з ЛАГ найбільш виражені порушення ФЗД зафіксовані за наявності ВВС, а найбільш виражені зміни ДЗЛМВ та ЗЄЛ — за наявності СЗСТ (особливо системного склерозу). При цьому у пацієнтів з СЗСТ показники ФЗД були майже в межах норми, що свідчить про необхідність проведення оцінки саме ДЗЛМВ всім пацієнтам з цією патологією, адже в нашому дослідженні саме ДЗЛМВ асоціювалась із функціональним станом пацієнтів (дистанцією 6ХТ) та порушенням гемодинаміки (вищим тиском в легеневій артерії та ПП).
Обговорення
Наше дослідження підтвердило результати інших спостережень, в яких показано, що у пацієнтів із ЛАГ та ХТЕЛГ може відмічатися порушення ФЗД [33, 34, 35]. У попередньому нашому дослідженні [36], в якому, однак, в аналіз не було включено пацієнтів із ЛАГ-ССЗТ, відзначали схожі зміни. За даними літератури, це пояснюється:
1) наявністю системного запалення [37], при якому відбувається периваскулярна інфільтрація дихальних шляхів прозапальними клітинами (Т-, В-клітинами та макрофагами), інтерлейкінами, фактором некрозу пухлин-α [38, 39, 40], яка у подальшому може викликати обструкцію дихальних шляхів [41];
2) бронхоконстрикцією під дією ендотеліну-1 [42];
3) зниженням продукції та вмісту оксиду азоту, який зумовлює бронходилатацію;
4) рефлексом Ейлера — Лілєстранда зі спазмуванням бронхів при локальному погіршанні кровоплину в альвеолах для кращої вентиляції тих ділянок, які мають кращу перфузію;
5) порушеннями дихання, що виникають в бронхах малого калібру [41], не проявляються у стані спокою при звичайній спірометрії, але визначають зниження толерантності до фізичних навантажень.
У пацієнтів із ЛАГ-ВВС відмічають найгірші показники ФЗД, що збігається з результатами інших досліджень [41, 43]. Окрім вищезгаданих механізмів, причинами цього можуть слугувати такі додаткові фактори, як деформація грудної клітки та часті респіраторні захворювання в анамнезі. Саме тому, вірогідно, і відмічали статистично значущі й незалежні кореляції ЖЄЛ та ОВФ1 із наявністю ВВС. Іншими важливими причинами таких змін можуть бути супутня деформація грудної клітки, затримка розвитку легень у дитячому віці (особливо при ліво-правих шунтах [44], а також супутня анатомічна функціональна гіповентиляція, зумовлена тривалим порушенням вентиляційно-перфузійного співвідношення у дорослих пацієнтів із ВВС [45] та особливо виражена при фізичних навантаженнях. За даними літератури, рестриктивні порушення дихальної функції у таких пацієнтів також можуть бути зумовлені перенесеними кардіохірургічними втручаннями [33], але жоден з обстежених нами пацієнтів не мав у анамнезі хірургічної корекції вади.
Вважається, що пацієнти з ЛАГ, особливо з ІЛАГ, мають показники ФЗД в межах норми [46–50]. Проте багато даних свідчать, що хворі з ЛАГ та ХТЕЛГ мають значно гірші показники ФЗД, ніж особи без цих хвороб. Так, за даними G.E. Dalonzo і співавторів (1984) та C.V. Burke і співавторів (1987) [50, 51], 20–40% пацієнтів з ІЛАГ можуть мати обструкцію дихальних шляхів, яку оцінювали за відношенням ОФВ1 до ЖЄЛ <70%. Дослідження Meyer (2002) показало, що середній показник ОФВ1 / ЖЄЛ був статистично значущо нижчим, ніж у контрольній групі — 76 проти 84% [52]. Наявність протилежних результатів досліджень, ймовірно, пов’язана з тим, що спірометрія є неінформативним методом оцінки периферичної обструкції дихальних шляхів, яка може виникати в пацієнтів із ЛАГ, адже її порушення вносять лише 10% в тотальний опір дихальних шляхів [41]. Виявлені зміни у групі ЛАГ-СЗСТ у показниках, що характеризують дрібний калібр бронхів (знижений МОШ-75), хоч і відповідали даним літератури щодо звичного імовірного прояву інтерстиціального ураження, однак не були статистично достовірними відносно інших форм ЛГ [53].
У дослідженні V. Arunthari і співавторів (2010) не виявлено кореляції між показниками ФЗД та гемодинаміки [54], що відповідає результатам нашого дослідження. Встановлена нами незалежна кореляція між ФЖЄЛ та ЗЄЛ з одного боку та розміром ПП з іншого — потребує подальших досліджень для інтерпретації отриманих даних, оскільки збільшення площі ПП може залежати від ступеня підвищення тиску в легеневій артерії, розміру та варіанту внутрішньосерцевого шунта у пацієнтів з ЛАГ-ВВС, ступеня та характеру недостатності тристулкового клапана тощо.
Зниження ДЗЛМВ рано чи пізно відзначали у всіх пацієнтів із ЛГ. Це пояснюється сукупністю різних механізмів: ремоделюванням артерій малого калібру та їх мікротромбування зі звуженням або обструкцією, дисфункцією ендотелію капілярів зі зміною проникності і розвитком набряку, формуванням пульмобронхіальних шунтів, наявністю внутрішньосерцевих шунтів. Результати кореляційно-регресійного аналізу ДЗЛМВ частково збігались із такими у раніше проведених дослідженнях. Так, у дослідженні M. Szturmowicz і співавторів (2016) при ДЗЛМВ <55 % виявлена кореляція цього показника із функціональним класом та коротшою дистанцією 6ХТ [55]. На противагу загальновідомому зв’язку патогенезу зниження дифузійної здатності легень із порушенням гемодинаміки, що підтвердилося виявленими незалежно статистично значущими кореляціями із середнім тиском у легеневій артерії та ПШ, у дослідженні V. Arunthari і співавторів не виявили цієї кореляції [54]. Автори пояснювали це обмеженням дослідження, коли оцінка функції дихання та КПС проводилася в різні дні, та тим, що вони обстежували тяжку категорію пацієнтів із супутньою патологією.
При проведенні багатофакторного регресійного аналізу незалежним предиктором низької ДЗЛМВ та ЗЄЛ була наявність системного склерозу. У нашому дослідженні серед пацієнтів із СЗСТ частка хворих із системним склерозом становила 73,3% (11 пацієнтів із 15). Дані раніше проведеного дослідження Bernstein та співавторів [56] свідчать, що з чутливістю 95% пацієнти із системним склерозом з ФЖЄЛ <80% та ДЗМВ <80% мають інтерстиціальне захворювання легень, яке є найважливішою причиною респіраторних порушень. За наявності інтерстиціального ураження зменшується альвеолярний об’єм та/або потовщується альвеолокапілярна мембрана. Окрім того, відбувається судинне ремоделювання з потовщенням судинної стінки та підвищенням жорсткості артерій [57]. При ЛГ порушується легенева гемодинаміка, що асоціюється із погіршенням ДЗЛМВ. У нашому дослідженні параметри гемодинаміки мали незалежні статистично значущі кореляційні зв’язки з ДЗЛМВ як у всіх пацієнтів з ЛГ, так і при аналізі конкретно групи ЛАГ-СЗСТ. Раніше проведене дослідження Guillén-Del-Castillo та співавторів [58] підтвердило значення як порушення гемодинаміки, так і ураження паренхіми в зниженні ДЗМВ.
Незалежна статистично значуща кореляція показників ФЗД (ЖЄЛ, ФЖЄЛ, ОФВ1) із насиченням вуглекислого газу (рСО2) в артеріальній крові, визначеним прямим методом газового аналізу під час КПС, у групі ЛАГ-СЗСТ, може пояснюватися затримкою СО2, пов’язаною із гіповентиляцією, викликаною ураженням легеневого інтерстицію або ж дихальних м’язів унаслідок супутнього локального запального процесу у них. Набагато важливішим видається визначення колабування НПВ у якості предиктора зниження ЗЄЛ. Такий зв’язок можна пояснити залежністю ступеня колабування НПВ від центрального венозного тиску та якістю дихальної механіки у згаданої групи пацієнтів. Згідно з результатами нещодавнього дослідження Chaigne та співавторів (2025), ЗЄЛ вважається кращим прогностичним фактором для пацієнтів із системним склерозом, ніж ФЖЄЛ [59].
Висновки
1. Серед обстежених груп пацієнти із ЛАГ-ВВС мали найгірші показники ФЗД, а хворі із ЛАГ-СЗСТ — найнижчу ДЗЛМВ.
2. Значне зниження ДЗЛМВ та ЗЄЛ у пацієнтів із СЗСТ на фоні майже нормальних показників ФЗД підтвердило необхідність їх визначення у всіх хворих із СЗСТ, які мають ЛГ.
3. У пацієнтів із СЗСТ показники саме ДЗЛМВ та ЗЄЛ достовірно асоціювалися з функціональним станом пацієнтів (дистанцією 6ХТ) та порушенням гемодинаміки (вищим тиском в легеневій артерії та ПП).
Автори повідомляють про відсутність конфлікту інтересів.
Участь авторів: концепція та проєкт дослідження — Г. Радченко, О. Борткевич; збір матеріалу, статистичне опрацювання даних, огляд літератури — С. Прогонов; написання статті та редагування — С. Прогонов, Г. Радченко, О. Борткевич.
Список використаної літератури
- 1. Humbert M., Kovacs G., Hoeper M.M. et al. (2022) 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. European Heart Journal, 43(38). doi.org/10.1093/eurheartj/ehac237.
- 2. Zanatta E., Polito P., Famoso G. et al. (2019) Pulmonary arterial hypertension in connective tissue disorders: Pathophysiology and treatment. Journal of Clinical Rheumatology, 25(1): 1–7. doi.org/10.1177/1535370218824101.
- 3. Almaaitah S., Highland K.B., Tonelli A.R. (2020) Management of Pulmonary Arterial Hypertension in Patients with Systemic Sclerosis. Integrated Blood Pressure Control, 13: 15–29. doi.org/10.2147/IBPC.S232038.
- 4. Launay D., Sobanski V., Hachulla E., Humbert M. (2017) Pulmonary hypertension in systemic sclerosis: different phenotypes. European Respiratory Review, 26(145): 170056. doi.org/10.1183/16000617.0056-2017.
- 5. Lambova S. (2014) Cardiac manifestations in systemic sclerosis. World Journal of Cardiology, 6(9): 993–1005. doi.org/10.4330/wjc.v6.i9.993.
- 6. Schoenfeld S.R., Choi H.K., Sayre E.C., Aviña-Zubieta J.A. (2016) Risk of Pulmonary Embolism and Deep Venous Thrombosis in Systemic Sclerosis: A General Population-Based Study. Arthritis Care & Research, 68(2): 246–253. doi.org/10.1002/acr.22673.
- 7. Ungprasert P., Srivali N., Kittanamongkolchai W. (2015) Systemic sclerosis and risk of venous thromboembolism: A systematic review and meta-analysis. Modern Rheumatology, 25(6): 893–897. doi.org/10.3109/14397595.2015.1038456.
- 8. Chung W.S., Lin C.L., Sung F.C. et al. (2014) Systemic sclerosis increases the risks of deep vein thrombosis and pulmonary thromboembolism: a nationwide cohort study. Rheumatology, 53(9): 1639–1645. doi.org/10.1093/rheumatology/keu133.
- 9. Lefèvre G., Dauchet L., Hachulla E. et al. (2013) Survival and prognostic factors in systemic sclerosis-associated pulmonary hypertension: a systematic review and meta-analysis. Arthritis and Rheumatism, 65(9): 2412–2423. doi.org/10.1002/art.38029.
- 10. Cappelli S., Bellando Randone S., Camiciottoli G. et al. (2015) Interstitial lung disease in systemic sclerosis: where do we stand?. European Respiratory Review, 24(137): 411–419. doi.org/10.1183/16000617.00002915.
- 11. Distler O., Highland K.B., Gahlemann M. et al.; SENSCIS Trial Investigators (2019) Nintedanib for Systemic Sclerosis-Associated Interstitial Lung Disease. The New England Journal of Medicine, 380(26): 2518–2528. doi.org/10.1056/NEJMoa1903076.
- 12. Young A., Vummidi D., Visovatti S. et al. (2019) Prevalence, Treatment, and Outcomes of Coexistent Pulmonary Hypertension and Interstitial Lung Disease in Systemic Sclerosis. Arthritis & Rheumatology, 71(8): 1339–1349. doi.org/10.1002/art.40862.
- 13. Le Pavec J., Girgis R.E., Lechtzin N. et al. (2011) Systemic sclerosis-related pulmonary hypertension associated with interstitial lung disease: impact of pulmonary arterial hypertension therapies. Arthritis and Rheumatism, 63(8): 2456–2464. doi.org/10.1002/art.30423.
- 14. D’Alto M., Romeo E., Argiento P. et al. (2017) Clinical Relevance of Fluid Challenge in Patients Evaluated for Pulmonary Hypertension. Chest, 151(1): 119–126. doi.org/10.1016/j.chest.2016.08.1439.
- 15. Bourji K.I., Kelemen B.W., Mathai S.C. et al. (2017) Poor survival in patients with scleroderma and pulmonary hypertension due to heart failure with preserved ejection fraction. Pulmonary Circulation, 7(2): 409–420. doi.org/10.1177/2045893217700438.
- 16. Günther S., Jaïs X., Maitre S. et al. (2012) Computed tomography findings of pulmonary venoocclusive disease in scleroderma patients presenting with precapillary pulmonary hypertension. Arthritis and Rheumatism, 64(9): 2995–3005. doi.org/10.1002/art.34501.
- 17. Simonneau G., Montani D., Celermajer D.S. et al. (2019) Haemodynamic definitions and updated clinical classification of pulmonary hypertension. The European Respiratory Journal, 53(1): 1801913. doi.org/10.1183/13993003.01913-2018.
- 18. Moreno-Macías H., Dockery D.W., Schwartz J. et al. (2013) Ozone exposure, vitamin C intake, and genetic susceptibility of asthmatic children in Mexico City: a cohort study. Respiratory Research, 14(1): 14–4. doi.org/10.1186/1465-9921-14-14.
- 19. Hughes J.M.B., Pride N.B. (2001) In defence of the carbon monoxide transfer coefficient KCO (TL/VA). European Respiratory Journal, 17(2): 168–174. doi.org/10.1183/09031936.01.17201680.
- 20. Hyatt R.E., Scanlon P.D., Nakamura M. (2014) Interpretation of Pulmonary Function Tests (p. 41). Lippincott Williams & Wilkins.
- 21. Coghlan J.G., Denton C.P., Grünig E. et al. (2014) Evidence-based detection of pulmonary arterial hypertension in systemic sclerosis: the DETECT study. Annals of the Rheumatic Diseases, 73(7): 1340–1349. Доступно з: ard.bmj.com/content/73/7/1340. doi.org/10.1136/annrheumdis-2013-203301.
- 22. Allanore Y., Borderie D., Avouac J. et al. (2007) High N-terminal pro–brain natriuretic peptide levels and low diffusing capacity for carbon monoxide as independent predictors of the occurrence of precapillary pulmonary arterial hypertension in patients with systemic sclerosis. Arthritis & Rheumatism, 58(1): 284–291. doi.org/10.1002/art.23187.
- 23. Khanna D., Gladue H., Channick R. et al. (2013) Recommendations for screening and detection of connective tissue disease-associated pulmonary arterial hypertension: Pulmonary hypertension in connective tissue diseases. Arthritis Rheum, 65(12): 3194–3201. doi.org/10.1002/art.38172.
- 24. Chandra S., Shah S.J., Thenappan T. et al. (2010) Carbon monoxide diffusing capacity and mortality in pulmonary arterial hypertension. The Journal of Heart and Lung Transplantation, 29(2): 181–187. doi.org/10.1016/j.healun.2009.07.005.
- 25. Trip P., Nossent E.J., de Man F.S. et al. (2013) Severely reduced diffusion capacity in idiopathic pulmonary arterial hypertension: patient characteristics and treatment responses. European Respiratory Journal, 42(6): 1575–1585. doi.org/10.1183/09031936.00184412.
- 26. Blanquez-Nadal M., Piliero N., Guillien A. et al. (2021) Exercise hyperventilation and pulmonary gas exchange in chronic thromboembolic pulmonary hypertension: Effects of balloon pulmonary angioplasty. Journal of Heart and Lung Transplantation. doi.org/10.1016/j.healun.2021.09.009.
- 27. Benza R.L., Gomberg-Maitland M., Miller D.P. et al. (2012) The REVEAL Registry Risk Score Calculator in Patients Newly Diagnosed With Pulmonary Arterial Hypertension. Chest, 141(2): 354–362. doi.org/10.1378/chest.11-0676.
- 28. Benza R.L., Farber H.W., Frost A. et al. (2018) REVEAL risk scores applied to riociguat-treated patients in PATENT-2: Impact of changes in risk score on survival. The Journal of Heart and Lung Transplantation, 37(4): 513–519. doi.org/10.1016/j.healun.201.
- 29. Benza R.L., Gomberg-Maitland M., Elliott C.G. et al. (2019) Predicting Survival in Patients With Pulmonary Arterial Hypertension. Chest, 156(2): 323–337. doi.org/10.1016/j.chest.2019.02.004.
- 30. Міністерство охорони здоров’я України (2016) Уніфікований клінічний протокол екстреної, первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги (УКПМД) «Легенева гіпертензія у дорослих» (Наказ від 21 червня 2016 р. № 614). Доступно з: moz.gov.ua/uk/nakazi-moz (Дата звернення: [20.05.2025]).
- 31. American Thoracic Society (2002) ATS Statement: Guidelines for the Six-Minute Walk Test. American Journal of Respiratory and Critical Care Medicine, 166(1): 111–117. doi.org/10.1164/ajrccm.166.1.at1102.
- 32. Modi P., Goldin J., Cascella M. (2024) Diffusing capacity of the lungs for carbon monoxide. StatPearls Publishing. pubmed.ncbi.nlm.nih.gov/32310609.
- 33. Kwi Y.K., Chan H.J., Sung J.C. et al. (2017) Survival and prognostic factors in patients with connective tissue disease‐associated pulmonary hypertension diagnosed by echocardiography: results from a Korean nationwide registry. International Journal of Rheumatic Diseases, 20(9): 1227–1236. doi.org/10.1111/1756-185X.12645.
- 34. Meyer F.J. (2002) Peripheral airway obstruction in primary pulmonary hypertension. Thorax. Jun 1; 57(6): 473–6. doi.org/10.1136/thorax.57.6.473.
- 35. Yanagisawa A., Naito A., Jujo-Sanada T. et al. (2021) Vascular involvement in chronic thromboembolic pulmonary hypertension is associated with spirometry obstructive impairment. BMC Pulmonary Medicine, 21(1). doi.org/10.1186/s12890-021-01779-x.
- 36. Прогонов С., Торбас О., Кушнір С. та ін. (2024) Функція зовнішнього дихання та дифузійна здатність легень у пацієнтів із різними формами легеневої гіпертензії. Кардіохірургія та інтервенційна кардіологія, 13(3): 53–63. doi.org/10.31928/2664-3790-2024.3.5363.
- 37. Price L.C., Wort S.J., Perros F. et al. (2012) Inflammation in Pulmonary Arterial Hypertension. Chest, 141(1): 210–221. doi.org/10.1378/chest.11-0793.
- 38. Humbert M., Monti G., Brenot F. et al. (1995) Increased interleukin-1 and interleukin-6 serum concentrations in severe primary pulmonary hypertension. American Journal of Respiratory and Critical Care Medicine, 151(5): 1628–1631. dx.doi.org/10.1164/ajrccm.151.5.7735624.
- 39. Soon E., Holmes A.M., Treacy C.M. et al. (2010) Elevated Levels of Inflammatory Cytokines Predict Survival in Idiopathic and Familial Pulmonary Arterial Hypertension. Circulation, 122(9): 920–927. doi.org/10.1161/CIRCULATIONAHA.109.933762.
- 40. Schober A., Zernecke A. (2007) Chemokines in vascular remodeling. Thrombosis and Haemostasis, 97(5): 730–737. pubmed.ncbi.nlm.nih.gov/17479183.
- 41. Low A.T., Medford A.R.L., Millar A.B., Tulloh R.M.R. (2015) Lung function in pulmonary hypertension. Respiratory Medicine, 109(10): 1244–1249. doi.org/10.1016/j.rmed.2015.05.022.
- 42. Nally J.E., McCall R., Young L.C. et al. (1994) Mechanical and biochemical responses to endothelin-1 and endothelin-3 in human bronchi. European Journal of Pharmacology — Molecular Pharmacology Section, 288(1): 53–60. doi.org/10.1016/0922-4106(94)90009-4.
- 43. Hock J., Willinger L., Pozza R.D. et al. (2023) Abnormalities in pulmonary function and volumes in patients with CHD: a systematic review. Cardiology in the Young, 33(2): 169–181. doi.org/10.1017/S1047951122004103.
- 44. Amedro P., Picot M.-C., Moniotte S. et al. (2021) Respiratory morbidity in children with congenital heart disease. European Journal of Pediatrics, 180(9): 2751–2759. doi.org/10.1007/s00431-021-03950-0.
- 45. Perloff J.K. et al. (1997) Role of right ventricular and pulmonary functional abnormalities in limiting exercise capacity in adults with congenital heart disease. American Journal of Cardiology, 80(11): 1454–1458. doi.org/10.1016/S0002-9149(97)00352-4.
- 46. Sun X.G., Hansen J.E., Oudiz R.J., Wasserman K. (2003) Pulmonary function in primary pulmonary hypertension. Journal of the American College of Cardiology, 41(6): 1028–1035. doi.org/10.1016/s0735-1097(02)02964-9.
- 47. Horn M., Ries A., Neveu C., Moser K. (1983) Restrictive Ventilatory Pattern in Precapillary Pulmonary Hypertension. American Review of Respiratory Disease, 128(1): 163–165. doi.org/10.1164/arrd.1983.128.1.163.
- 48. Jing Z.-C., Xu X.-Q., Badesch D.B. et al. (2009) Pulmonary function testing in patients with pulmonary arterial hypertension. Respiratory Medicine, 103(8): 1136–1142. doi.org/10.1016/j.rmed.2009.03.009.
- 49. Rich S., Dantzker D.R., Ayres S.M. et al. (1987) Primary pulmonary hypertension. A national prospective study. Annals of Internal Medicine, 107(2): 216–223. doi.org/10.7326/0003-4819-107-2-216.
- 50. Burke C.M., Glanville A.R., Morris A.J. et al. (1987) Pulmonary function in advanced pulmonary hypertension. Thorax, 42(2): 131–135. doi.org/10.1136/thx.42.2.131.
- 51. D’Alonzo G.E., Bower J.S., Dantzker D.R. (1984) clinical investigations. Chest, 85(4): 457–461. doi.org/10.1378/chest.85.4.457.
- 52. Meyer F.J. (2002) Peripheral airway obstruction in primary pulmonary hypertension. Thorax, 57(6): 473–476. doi.org/10.1136/thorax.57.6.473.
- 53. Panagopoulos P.K., Goules A.V., Georgakopoulou V.E. et al. (2022) Small airways dysfunction in patients with systemic sclerosis and interstitial lung disease. Frontiers in Medicine, 9: 1016898. doi.org/10.3389/fmed.2022.1016898.
- 54. Arunthari V., Burger C.D., Lee A.S. (2011) Correlation of pulmonary function variables with hemodynamic measurements in patients with pulmonary arterial hypertension. The Clinical Respiratory Journal, 5(1): 35–43. doi.org/10.1111/j.1752-699X.2010.00188.x.
- 55. Szturmowicz M., Kacprzak A., Franczuk M. et al. (2016) Low DLCO in idiopathic pulmonary arterial hypertension — clinical correlates and prognostic significance. Pneumonologia i Alergologia Polska, 84(2): 87–94. doi.org/10.5603/PiAP.2016.0006.
- 56. Bernstein E.J., Jaafar S., Assassi S. et al. (2020) Performance Characteristics of Pulmonary Function Tests for the Detection of Interstitial Lung Disease in Adults With Early Diffuse Cutaneous Systemic Sclerosis. Arthritis & Rheumatology, 72(11): 1892–1896. doi.org/10.1002/art.41415.
- 57. Mulkoju R., Saka V.K., Rajaram M. et al. (2020) Pulmonary Manifestations in Systemic Sclerosis: Hospital-Based Descriptive Study. Cureus, 12(6): e8649. doi.org/10.7759/cureus.8649.
- 58. Guillén-Del-Castillo A., Meseguer M.L., Fonollosa-Pla V. et al.; REHAP Consortium (2022) Impact of interstitial lung disease on the survival of systemic sclerosis with pulmonary arterial hypertension. Scientific Reports, 12(1): 5289. doi.org/10.1038/s41598-022-09353-z.
- 59. Chaigne B., Bense A., Aubourg F. et al.; French Systemic Sclerosis Network (2025) Total lung capacity is predictive of disease severity and survival in systemic sclerosis: A longitudinal analysis in 2347 patients from the French National Cohort Study. Journal of Autoimmunity, 152: 103391. doi.org/10.1016/j.jaut.2025.103391.
Відомості про авторів
Прогонов Сергій Олександрович — аспірант відділу вторинних та легеневих гіпертензій ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені акад. М.Д. Стражеска» НАМН України», м. Київ.
E-mail: prohonov.physician@gmail.com
ORCID ID: 0009-0000-8851-3115
Радченко Ганна Дмитрівна — завідувачка відділу вторинних та легеневих гіпертензій, професорка, докторка медичних наук, ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені акад. М.Д. Стражеска» НАМН України»,м. Київ.
E-mail: rganna1970@ukr.net
ORCID ID: 0000-0002-3651-3014
Борткевич Олег Петрович — головний науковий співробітник відділу некоронарних хвороб серця та ревматології, професор, доктор медичних наук, ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені акад. М. Д. Стражеска» НАМН України», м. Київ.
E-mail: bortkevych@yahoo.com
ORCID ID: 0009-0000-0620-626X
Надійшла до редакції/Received: 21.05.2025
Прийнято до друку/Accepted: 04.06.2025

Leave a comment