CAR T-клітинна терапія — нова технологія в лікуванні аутоімунних захворювань. Огляд технології, принципів застосування, перших результатів та перспектив
Коваленко В.М.1, Гнилорибов А.М.2
- 1Державна установа «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д.Стражеска» НАМН України, Київ, Україна
- 2Національний інститут серцево-судинної хірургії імені М.М. Амосова НАМН України, м. Київ, Україна
Резюме. CAR T-клітинна терапія є абсолютно новим методом лікування як онкологічних, так і аутоімунних захворювань. Цей інноваційний підхід кардинально змінює терапевтичні стратегії шляхом використання аутологічних Т-клітин — клітин, отриманих від самого пацієнта, — які генетично модифікуються для експресії химерних антигенних рецепторів (CAR). На відміну від традиційних методів лікування, що базуються на конвенційних препаратах та тривалій імуносупресії, терапія CAR T-клітинами використовує принципово новий підхід, перепрограмовуючи імунні клітини пацієнта для знищення специфічних клітин, пов’язаних із розвитком хвороби. У статті обговорюється історія та технологія CAR T-терапії, наведені перші приклади успішного лікування різних типів аутоімунних захворювань, зокрема рефрактерного системного червоного вовчака (СЧВ). Підкреслено, що терапія CAR T-клітинами означає перехід на новий рівень лікування завдяки застосуванню «живих» ліків — Т-клітин, які здатні не лише викликати ремісію, але й зумовити повне одужання. Цей підхід виходить за межі тимчасового контролю симптомів, орієнтуючись на досягнення тривалого та потенційно повного лікування. Проаналізовано перші дані щодо ефективності CAR Т-клітинної терапії у хворих на СЧВ та інші системні ревматичні та аутоімунні захворювання. Показано, що у поки ще невеликої кількості пацієнтів з аутоімунними захворюваннями, яких проліковано CAR T-клітинами, виявлена хороша переносимість терапії, без випадків синдрому вивільнення цитокінів вище 1-го ступеня та без синдрому нейротоксичності, асоційованої з імунними ефекторними клітинами. Рецидиву хвороби у цих пацієнтів не відмічено, що вказує на те, що CD19 CAR T-клітини можуть мати довготривалу терапевтичну потенцію для досягнення стійкої ремісії. Також перші дослідження свідчать про те, що рівень антитіл, пов’язаних із вакцинацією, залишався у хворих незмінним. Ще одне ключове відкриття щодо ефективності терапії CAR T-клітинами — відсутність тривалої аплазії В-клітин, які відновлювалися приблизно через 100 днів після лікування. CAR T-клітинна терапія представляє новаторський терапевтичний рубіж з потенціалом для революційних змін у лікуванні як злоякісних пухлин, так і аутоімунних захворювань. Цей підхід пропонує персоналізоване лікування, яке може впливати на основні причини цих захворювань. У статті також обговорюються можливі побічні ефекти CAR T-клітинної терапії та її перспективи в ревматології та при інших тяжких аутоімунних розладах.
DOI: 10.32471/rheumatology.2707-6970.97.18953
Аутоімунні захворювання — це гетерогенна група розладів, що характеризуються порушенням імунної толерантності [1]. Сенсибілізація до власних антигенів призводить до формування аутореактивних Т- і В-клітин, а також аутоантитіл, що спричиняють пошкодження тканин і органів. Усі аутоімунні захворювання супроводжуються появою аутореактивних В-клітинних клонів та аутоантитіл задовго до клінічних проявів. Проте не всі хронічні запальні хвороби є аутоімунними. Наприклад, такі захворювання, як псоріаз, хвороба Крона або анкілозуючий спондиліт, хоча й характеризуються хронічним запаленням, не мають патофізіологічних механізмів, опосередкованих В-клітинами. Генетично ці хвороби частіше асоціюються з алелями основного комплексу гістосумісності (МНС) класу I, тоді як аутоімунні хвороби — зі специфічними алелями МНС класу II [2].
Сучасне лікування аутоімунних захворювань. Потреба в нових терапевтичних підходах
Станом на 2024 р. кількість людей з аутоімунними захворюваннями у світі становить близько 4% від загальної чисельності населення, що становить близько 300 млн осіб. Ці захворювання, до яких належать ревматоїдний артрит, системний червоний вовчак, розсіяний склероз та інші, змушують імунну систему атакувати здорові тканини. Реальна кількість хворих може бути ще більшою, враховуючи складнощі з діагностикою, особливо в країнах, що розвиваються [3]. Більше ніж 80 відомих аутоімунних захворювань не мають ефективного лікування, що робить їх однією з основних причин смертності та інвалідності. Незважаючи на досягнення у лікуванні, значна частина пацієнтів не відповідають на існуючі методи терапії.
Контроль зміненої функції Т- і В-клітин є ключовим аспектом лікування. Традиційні імунодепресанти, такі як азатіоприн і мікофенолат, блокують певні етапи клітинного метаболізму або активації. Однак навіть коли досягається ремісія, захворювання часто рецидивує після припинення терапії. Прорив стався у 2004 р., коли дослідження показало, що «виснаження» В-клітин за допомогою ритуксимабу, антитіла до CD20, виявилося ефективним у лікуванні ревматоїдного артриту [3]. Проте захворювання зазвичай рецидивує після припинення прийому ритуксимабу, що потребує повторного застосування для належного контролю [4]. Це спостереження також стосується лікування, яке пригнічує активацію В-клітин, наприклад, белімумабу, моноклонального антитіла, що блокує фактор активації В-клітин, який застосовується при системному червоному вовчаку [5].
Ритуксимаб чинить свою дію через антитілозалежну цитотоксичність [6]. Проте його лікувальна ефективність може бути обмежена, оскільки цей препарат не завжди повністю усуває циркулюючі В-клітини. Це часто пов’язано з рівнем терапевтичної ефективності при системному червоному вовчаку [7]. Циркулюючі В-клітини більш чутливі до виснаження, яке опосередковується антитілами, оскільки ефекторні клітини (такі як моноцити і природні кілери) та фактори комплементу легко доступні для взаємодії. Однак ефекторні клітини, що медіюють антитілозалежну клітинну токсичність, не завжди наявні в тканинах, а концентрація антитіл може знижуватися через їх поглинання макрофагами маргінальної зони [8], що зумовлює недостатнє очищення клітин-мішеней.
Дослідження показали, що В-клітини пам’яті можуть уникати виснаження ритуксимабом. Наприклад, у черевних лімфовузлах кількість CD19+ В-клітин залишалася незмінною після лікування ритуксимабом, коли препарат застосовували для запобігання відторгненню ниркових трансплантатів [9]. Крім того, В-клітини виявлені в синовіальній мембрані пацієнтів з ревматоїдним артритом після лікування ритуксимабом, навіть тоді, коли периферичні В-клітини були виснажені [10]. Відомо також, що в мигдалинах пацієнтів із системним червоним вовчаком В-клітини пам’яті можуть перебувати у нішах після лікування ритуксимабом, що свідчить про здатність тканинних В-клітин уникати спрямування антитіл [11]. Ці результати свідчать про те, що виснаження тканиннорезидентних В-клітин є значно складнішим завданням порівняно з виснаженням їх циркулюючих аналогів, і що В-клітини пам’яті у тканинах можуть бути більш стійкими до виснаження. Пацієнти, у яких вдалося досягти повного виснаження периферичних В-клітин, продемонстрували кращі результати лікування порівняно з тими, у кого було лише часткове виснаження [12]. Нові антитіла проти CD20 з підвищеною активністю антитілозалежної клітинної цитотоксичності, такі як гуманізований окрелізумаб і, особливо глікоінженерний IgG1 2-го типу обінутузумаб, продемонстрували клінічну ефективність при системному червоному вовчаку [13, 14]. Однак лікування окрелізумабом було пов’язане з підвищеним ризиком розвитку тяжких інфекцій [14].
Ще одним відкритим питанням є ідеальний антиген-мішень. Наприклад, антиген CD20 не експресується на плазмобластах і плазматичних клітинах [15]. Спрямоване усунення CD38+ плазматичних клітин за допомогою моноклонального антитіла проти CD38, даратумумабу, показало свою ефективність у пацієнтів із рефрактерним системним червоним вовчаком [16, 17].
Сучасні методи лікування аутоімунних захворювань часто виявляються недостатньо ефективними, оскільки більшість пацієнтів потребують довічної терапії, що пов’язано з серйозними побічними ефектами та ризиками токсичності. Це підкреслює нагальну потребу у нових терапевтичних стратегіях, які зможуть забезпечити стійку ремісію без постійного медикаментозного втручання. Такими стратегіями можуть стати методи, здатні кардинально вплинути на імунну систему та її поведінку.
Клітинна та CAR Т-клітинна терапія. Історія створення химерних антигенних рецепторів (CAR)
Клітинна терапія є новим підходом у лікуванні аутоімунних захворювань, який не потребує використання радикальних методів, таких як трансплантація кісткового мозку чи стовбурових клітин. Вона полягає у модифікації імунних клітин пацієнта або донора, які потім вводяться для виправлення дефектних або патологічних процесів. Завдяки цьому імунна система пацієнта може бути «перезавантажена», що надає можливість досягти тривалої ремісії та зменшити потребу в тривалому лікуванні. Цей піхід відкриває нові горизонти в лікуванні складних хронічних захворювань, забезпечуючи пацієнтам більш безпечні та тривалі результати.
Технологія CAR (chimeric antigen receptor) базується на створенні химерних антигенних рецепторів — спеціальних рецепторів, які інженеруються у лабораторних умовах для того, щоб розпізнавати і зв’язуватися з певними білками на поверхні ракових або патологічно змінених клітин (рис. 1). Ці рецептори вживлюються у Т-клітини пацієнта, які після модифікації отримують здатність знаходити і знищувати клітини-мішені. Ідея створення CAR бере свій початок з початку 1990-х років, а останніми роками технологія зазнала значного розвитку, що зумовило її успішне застосування спочатку у лікуванні онкологічних захворювань, а тепер і в боротьбі з аутоімунними хворобами.
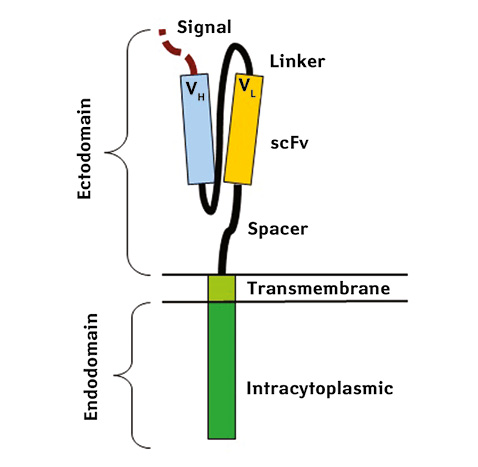
Термін «химерний» у назві химерних антигенних рецепторів (CAR) відображає змішане походження різних компонентів цього рецептора: позаклітинний домен, який розпізнає антигени, походить від антитіл, а трансмембранний і внутрішньоклітинний сигнальні домени — від Т-клітинного рецептора. ДНК, що кодує CAR, може бути перенесена в екзовітальні Т-клітини для створення «CAR T-клітин», які потім застосовуються в терапії.
Перші CAR розроблені у 1987 р. Yoshihisa Kuwana та його командою [19], а в 1989 р. Гідеон Гросс і Зеліг Ешхар незалежно від них описали ці структури, які поєднували антитіла та Т-клітинні рецептори, що стало початком для розробки CAR T-клітин [20]. Перші рецептори включали лише CD3-zeta домен (І покоління) [21], а наступні модифікації додали костимулюючі домени, такі як CD28 і 4-1BB (ІІ покоління), що значно підвищило ефективність лікування [22]. CAR ІІІ покоління поєднують кілька костимулюючих доменів, таких як CD28-41BB або CD28-OX40, для посилення активності Т-клітин.
CAR T-клітини діють як «живий препарат» [23]. Після інфузії вони знаходять та знищують клітини, що експресують цільовий антиген, використовуючи механізми цитотоксичності [2], стимуляції проліферації Т-клітин і секреції прозапальних цитокінів [3].
Терапія CAR T-клітинами стала проривом у лікуванні гематологічних злоякісних новоутворень, зокрема у пацієнтів з рефрактерними формами лімфом і лейкемій [8]. Після вражаючих успіхів у лікуванні онкопатології та отримання обнадійливих результатів у моделях системного червоного вовчака на мишах [9], CAR T-клітини почали розглядатися як потенційний метод для боротьби з аутоімунними захворюваннями, зокрема тими, що опосередковані аутоантитілами, такими як системний червоний вовчак, міастенія та інші [7, 10, 11].
Історія розвитку лікування CAR T-клітинами, спрямованими на CD19
У 2017 р. Управлінням з контролю за харчовими продуктами та лікарськими засобами США (Food and Drug Administration — FDA) схвалено першу CAR T-терапію, спрямовану на CD19 на В-клітини. Першою пацієнткою стала 6-річна Емілі Вайтхед, яка після інфузії CAR T-клітин досягла ремісії, хоча пережила тяжкий синдром вивільнення цитокінів, який успішно проліковано тоцилізумабом [14, 17]. Вона двічі перенесла рецидив після хіміотерапії, і місцеві лікарі вичерпали всі варіанти лікування. Після інфузії CD19-специфічні CAR T-клітини поширилися в її організмі, що вказувало на те, що пухлинні клітини CD19 виявлені, і CAR T-клітини правильно активувалися.
Таким чином, розробка CAR T-клітин стала революційним підходом до лікування як онкологічних, так і аутоімунних захворювань, з перспективою значного покращення терапевтичних результатів для пацієнтів, які не відповідають на традиційне лікування.
Основи для розробки CAR були закладені в 1980-х роках, коли імунологічні науково-дослідні групи розширили розуміння імунних клітин, зокрема Т-клітин. Ці вчені виявили, що Т-клітинний рецептор зв’язується з чужорідними пептидами, представленими на молекулах людського лейкоцитарного антигену (HLA) на поверхні клітин [12]. У наступні роки були ідентифіковані внутрішньоклітинні компоненти Т-клітинного рецептора, які передавали сигнал активації Т-клітин [13].
Принцип спрямування на злоякісні клітини, що походять від В-клітин, за допомогою CAR T-клітин полягає в тому, щоб спрямовувати терапію на специфічні антигени, експресовані на поверхні цих клітин [14]. Найчастіше для цього використовують антигени, такі як CD19, CD20 та CD22, які є маркерами В-клітин. CAR T-клітини, модифіковані для розпізнавання цих антигенів, активуються після їх розпізнавання і знищують злоякісні клітини за допомогою різних механізмів, включаючи цитотоксичність, активацію імунної відповіді та секрецію прозапальних цитокінів.
CAR T-терапія стала ключовим інструментом для лікування гематологічних злоякісних новоутворень, таких як гостра лімфобластна лейкемія та неходжкінська лімфома. Специфічність CAR T-клітин дозволяє їм інфільтрувати тканини, знищуючи не тільки циркулюючі, але й тканиннорезидентні пухлинні клітини, що є важливим для уникнення рецидиву хвороби. Перед інфузією CAR T-клітин пацієнтам зазвичай проводять хіміотерапію для виснаження лімфоцитів (зазвичай використовуються циклофосфамід і флударабін), що сприяє їхній експансії і тривалому збереженню в організмі.
Проте для досягнення таких результатів потрібні індивідуальні аутологічні CAR T-клітини, що потребує тривалої та дорогої процедури. Універсальні алогенні продукти знаходяться на стадії клінічних досліджень, і вони можуть зробити терапію доступнішою для більшої кількості пацієнтів. Однак зараз більшість комерційних CAR T-продуктів спрямовані саме проти злоякісних В-клітин, і вже демонструють тривалу ремісію у значної частини пацієнтів.
Терапія CAR T-клітинами для лікування аутоімунних захворювань демонструє вражаючі результати, особливо у пацієнтів з рефрактерними формами захворювань. CAR T-клітини, спрямовані на В-клітини (наприклад на CD19), здатні ефективно виснажувати патологічні В-клітини та плазмобласти, що виробляють аутоантитіла, і таким чином допомагають контролювати аутоімунний процес. У пацієнтів з такими захворюваннями, як системний червоний вовчак, міастенія гравіс та розсіяний склероз, терапія зумовила значне покращення, включаючи тривалі ремісії без прийому ліків.
Так, дослідження у пацієнтів із системним червоним вовчаком продемонстрували, що інфузія CD19 CAR T-клітин може призвести до повної елімінації В-клітин і навіть до «перезавантаження» В-клітинного компартменту, що сприяє ремісії без рецидиву патологічних плазмобластів. Водночас цей підхід не викликав серйозних побічних ефектів, таких як синдром вивільнення цитокінів (CRS) або нейротоксичність (ICANS), що підтверджує безпеку терапії.
Цікаво, що після терапії у пацієнтів відмічали поступове відновлення нормальних В-клітин, що свідчить про потенціал CAR T-клітин забезпечувати довготривалу ремісію. Хоча в деяких випадках рецидив захворювання не виявляли до 2 років, потрібні подальші дослідження, щоб визначити тривалість ремісії та можливість повного вилікування від аутоімунних захворювань.
Цей підхід є багатообіцяючим, але залишається чимало невивчених аспектів, зокрема роль різних субтипів В-клітин та плазмобластів у патогенезі аутоімунних захворювань, що може вплинути на ефективність терапії у конкретних пацієнтів.
Принцип спрямування на злоякісні клітини, що походять від В-клітин, за допомогою CAR T-клітин
Дослідники намагаються розробити стратегії для перезавантаження аутоімунних захворювань таким чином, щоб призвести до припинення хвороби шляхом глибокого перезавантаження імунної системи та дозволити пацієнтам назавжди припинити прийом імуносупресивних препаратів. Такі концепції перезавантаження імунної системи при аутоімунних захворюваннях раніше намагалися реалізувати за допомогою аутологічної трансплантації гемопоетичних стовбурових клітин (auto-HSCT) після високодозової хіміотерапії. Однак значні токсичні ефекти обмежили використання auto-HSCT при системному червоному вовчаку [18]. Клітинна терапія зазнала швидкої еволюції завдяки розвитку генетично-інженерних рецепторів CAR [19]. Після інфузії CAR T-клітин у пацієнта ці клітини розпізнають антиген, активуються та знищують клітини-мішені.
При злоякісних новоутвореннях, таких як гостра лімфобластна лейкемія, що походить від В-клітин, або неходжкінська лімфома, надзвичайно важливо усунути злоякісні клони для запобігання рецидивам. Для досягнення цієї мети необхідно спрямовуватися на важкодоступні тканиннорезидентні пухлинні клітини. CAR T-клітини є підходящим інструментом завдяки природній здатності Т-клітин інфільтрувати тканини, високій афінності до специфічних антигенів і їхнім протипухлинним ефекторним функціям [20, 21]. Взаємодія CAR, який експресується на плазматичній мембрані Т-клітин або альтернативно натуральних кілерів [22], з антигеном-мішенню призводить до їхньої активації та подальшого знищення пухлинних клітин. Поверхневі молекули, обмежені лінією В-клітин, такі як CD19, CD20 і CD22, слугують пухлиноасоційованими антигенами. Ці антигени розпізнаються позаклітинним доменом CAR, який являє собою одноланцюговий варіабельний фрагмент антитіла, специфічний щодо відповідного антигену. Цитоплазматична частина CAR містить сигнальні (CD3-ζ ланцюг Т-клітинного рецептора) та костимулюючі (4-1BB або CD28) домени для забезпечення належної експансії та активації CAR T-клітин [23], а також для знищення клітин-мішеней [24].
CAR T-клітини розмножуються та виживають у тканинах, де вони піддаються дії антигенів [25]. Ще одним ключовим фактором для експансії та тривалого збереження CAR T-клітин є хіміотерапія для виснаження лімфоцитів (зазвичай циклофосфамід і флударабін) перед інфузією CAR T-клітин. Результуюча лімфопенія призводить до компенсаторної гомеостатичної проліферації CAR T-клітин і переважного формування фенотипу пам’яті [26]. За ідеальних умов клітини, що експресують CAR, можуть виживати у тканинах протягом багатьох років [27]. CAR T-клітини стали потужним інструментом у терапії раку, призводячи до глибокого та тривалого знищення клітин, що експресують антиген-мішень [28]. Найбільш розвиненими є види CAR T-терапії, спрямовані проти злоякісних В-клітин, що дозволяє досягти тривалої ремісії у близько 50% пацієнтів [29]. Насправді всі CAR T-продукти, спрямовані проти CD19 і схвалені FDA (такі як аксикабтаген цілюцел/акси-сел, тизагенлеклецел/тиза-сел, лісокабтаген маралецел/лісо-сел та брексукабтаген аутолеуцел/брексу-сел), спрямовані проти злоякісних пухлин, що походять від В-клітин, таких як гостра лімфобластна лейкемія, дифузна В-великоклітинна лімфома, фолікулярна лімфома та мантійна клітинна лімфома [30, 31, 32, 33, 34, 35]. У лікуванні рефрактерних і рецидивуючих захворювань CAR T-клітини перевершують стандартні методи лікування, сприяючи довготривалим ремісіям (до 10 років), що вказує на потенціал CAR T-клітин як лікувального засобу [26]. Як наслідок, CAR T-клітини, спрямовані проти CD19, стали визнаним інструментом у гематологічній практиці.
На сьогодні клінічне лікування CAR T-клітинами при раку обмежене аутологічними клітинами (вилученими у того ж пацієнта), які потребують виготовлення індивідуального лікарського продукту передової терапії. Універсальні алогенні CAR T-продукти (клітини, вилучені в іншого донора), поки що недоступні комерційно, але показують обнадійливі результати в ході поточних клінічних досліджень [38, 39]. Виробництво аутологічних CAR T-клітин потребує лейкаферезу достатньої кількості функціональних лімфоцитів, трансфекції клітин за допомогою вірусних векторів і експансії CAR T-клітин in vitro з дотриманням суворих контрольних показників для кожного пацієнта. Важливо правильно ідентифікувати пацієнтів, які можуть отримати найбільшу користь від такого складного втручання і найбільше потребують CAR T-клітин.
Схема проведення CAR Т-клітинної терапії представлена на рис. 2 [36, модифіковано авторами].
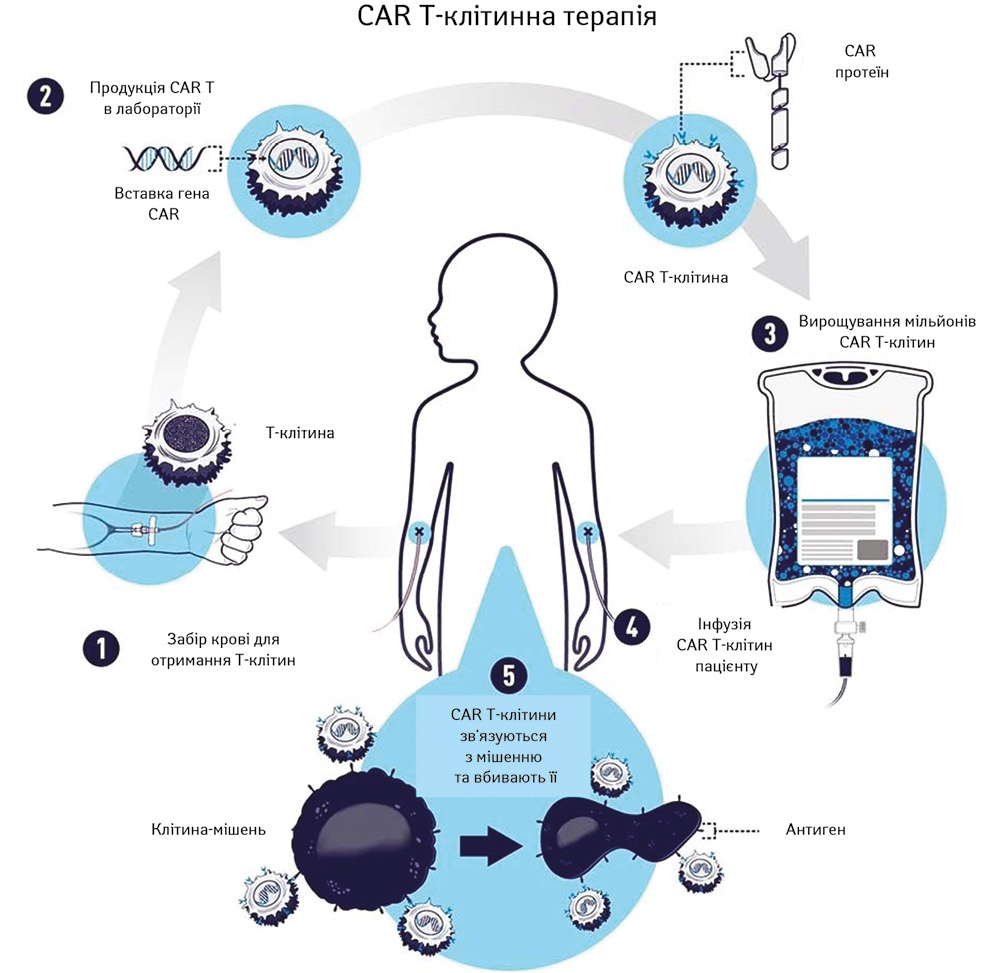
Т-клітинна терапія CAR — це тип лікування, при якому Т-клітини пацієнта створюють генетично в лабораторії, щоб вони зв’язувалися зі специфічними білками (антигенами) ракових клітин-мішеней (наприклад ракових клітин) і вбивали їх. Як показано на рис. 2, (1) Т-клітини пацієнта видаляються з крові. Потім (2) ген спеціального рецептора CAR вставляється в Т-клітини в лабораторії. Ген кодує сконструйований білок CAR, який експресується на поверхні Т-клітин пацієнта, створюючи Т-клітину CAR. (3) Мільйони Т-клітин CAR вирощуються в лабораторії. (4) Потім вони вводяться пацієнту шляхом внутрішньовенної інфузії. (5) Т-клітини CAR зв’язуються з антигенами ракових клітин і вбивають їх.
Аутоімунні захворювання, при яких можна отримати користь від терапії на основі CAR T-клітин: Вплив виснаження В-клітин на аутоімунні захворювання та результати терапії CAR T-клітинами у пацієнтів із системним червоним вовчаком
Т-клітини активно мігрують для ліквідації цільових клітин і можуть проникати в тканини, які можуть бути недосяжними для антитіл. Важливе спостереження у ключових дослідженнях пацієнтів з лімфомою, які отримували CAR T-клітини, спрямовані проти В-клітин, полягало в глибокому виснаженні В-клітин у всьому тілі [37]. Це спостереження стало вагомим обґрунтуванням для вивчення терапії CAR T-клітинами у пацієнтів із аутоімунними захворюваннями.
Аутоантитіла, такі як антитіла до двоспіральної ДНК (anti-dsDNA), є значним патогенетичним механізмом у розвитку аутоімунних захворювань. Спрямування на власні антигени може призвести до хронічного запалення та серйозних, загрозливих для життя пошкоджень багатьох органів, включаючи нирки, легені та серце, як у разі системного червоного вовчака. Виходячи з цих спостережень, виснаження В-клітин, що виробляють антитіла, шляхом інфузії антитіл проти CD20 (ритуксимаб) було запропоновано як лікування для пацієнтів із системним червоним вовчаком. Проте незважаючи на здатність ритуксимабу значно знижувати кількість В-клітин у периферичній крові, клінічної ефективності не досягнуто в плацебо-контрольованому подвійно сліпому багатоцентровому дослідженні пацієнтів із системним червоним вовчаком [38].
Нещодавно кілька клінічних випадків продемонстрували, що лікування аутологічними CAR T-клітинами, спрямованими на CD19, призводить до глибокого виснаження В-клітин і плазмобластів у пацієнтів з аутоімунними захворюваннями, такими як системний червоний вовчак, ідіопатичний запальний міозит та системний склероз, всі з яких були стійкими до щонайменше двох стандартних імуномодулюючих схем лікування [39]. Важливо, що повна, але тимчасова ліквідація CD19+ клітин призвела до «перезавантаження» В-клітинного компартменту. Нормальні В-клітини з’явилися знову без рецидиву патологічних плазмобластів, що продукують аутоантитіла, та без значної втрати титрів антитіл, пов’язаних із вакцинацією. Також виявлено суттєве зниження прозапального сигналінгу інтерферону 1-го типу [40]. Це зумовило сприятливу клінічну відповідь та тривалу ремісію без необхідності подальшого прийому ліків у всіх пролікованих пацієнтів [41].
Патофізіологічна роль В-клітин у різних аутоімунних захворюваннях не є повністю зрозумілою, окрім їх участі у формуванні аутоантитіл. Активація В-клітин та утворення аутоантитіл можуть бути лише епіфеноменом Т-клітинноопосередкованої аутоімунності, а не первинним механізмом, що запускає захворювання. У таких випадках навіть повна елімінація В-клітин може бути неефективною, оскільки залишкові аутоагресивні Т-клітини можуть підтримувати захворювання. Крім того, не зовсім зрозуміло, чи є В-клітинні плазмобласти або довгоживучі плазматичні клітини основним джерелом аутоантитіл при окремих аутоімунних захворюваннях [24]. Оскільки плазматичні клітини мають інші антигени, ніж В-клітини і плазмобласти, вони можуть уникнути лікування CAR T-клітинами, спрямованими проти В-клітин, і, таким чином, продовжувати підтримувати процес аутоімунного захворювання.
Цю невдачу було пізніше пояснено дослідженнями, які показали, що ритуксимаб не може виснажити субпопуляцію плазмобластів, які виробляють аутоантитіла, оскільки ці клітини не експресують CD20, але експресують CD19 [42].
Досвід застосування CAR T-клітин при різних типах аутоімунних захворювань та докази ефективності терапії
Протягом останнього року перші 20 пацієнтів отримали лікування в різних партнерських клініках Німеччини та США за трьома основними клінічними умовами:
- індивідуальне застосування у пацієнтів із тяжкими рефрактерними аутоімунними захворюваннями, для яких не залишилося інших варіантів лікування;
- клінічні дослідження за участю пацієнтів із вовчаковим нефритом у США (KYSA-1) та Німеччині (KYSA-3);
- ініційовані дослідниками клінічні дослідження, що зосереджуються на потребах наукової спільноти.
Серед пацієнтів з ревматичними аутоімунними захворюваннями 6 мали вовчаковий нефрит, 1 — системний склероз. До групи пацієнтів із неврологічними аутоімунними захворюваннями увійшли 3 пацієнти із розсіяним склерозом, 8 — з міастенією або її підтипами, 1 — із синдромом ригідної людини та 1 — із аутоімунним енцефалітом анти-DAGLA.
Важливо відзначити, що жоден із 20 пацієнтів, які отримали терапію CAR T-клітинами, не зазнав серйозних побічних ефектів у вигляді тяжкого (>3) синдрому вивільнення цитокінів або ICANS, що підтверджує профіль безпеки та переносимості, виявлений у попередніх випадках терапії CAR T-клітинами при аутоімунних захворюваннях [43].
Нещодавно опубліковані дані про клінічну ефективність у 2 пацієнтів [44, 45]. Лікування пацієнта з рефрактерною міастенією за допомогою нового продукту CAR T-клітин другої генерації — KYV-101 призвело до зниження рівня патогенних антитіл до ацетилхолінових рецепторів (AchR) на 70% з 0-го дня до 62-го дня після інфузії, при цьому рівень антитіл, пов’язаних із вакцинацією, залишався незмінним. Ці серологічні показники супроводжувалися підвищенням м’язової сили та зменшенням втоми пацієнта протягом перших 62 днів після введення KYV-101 [46].
У 2 пацієнтів із первиннопрогресуючим і вториннопрогресуючим розсіяним склерозом, які отримали KYV-101, на 14-й день виявлено таргетну експансію CAR T-клітин у спинномозковій рідині порівняно з периферичною кров’ю. Це свідчить про здатність терапії CAR T-клітинами проникати в імунні відсіки, які були недоступні для системного застосування антитіл, що виснажують В-клітини [46]. Крім того, в 1 з 2 пацієнтів кількість ізольованих олігоклональних смуг, маркера наявності клонально обмежених імуноглобулінів, що виробляються В-клітинами спиномозкової рідини і менінгеальними або паренхімальними В-клітинами, зменшилася з 13 до 6 на 14-й день і залишалася такою до 64-го дня. Кількісна оцінка інтратекальних імуноглобулінів показала суттєве зниження від початкового рівня [46].
Терапія CAR T-клітинами при аутоімунних захворюваннях є перспективною [47]. За останні 2 роки досягнуто значного прогресу у наданні цієї терапії пацієнтам з аутоімунними захворюваннями. Визначні дослідження на доклінічних моделях показали ефективність використання CAR T-клітин, що спрямовані на В-клітини при аутоімунних захворюваннях, демонструючи, що CD19 CAR T-клітини пригнічують В-клітинну аутоімунність і запалення органів (наприклад нирок) у мишачих моделях системного червоного вовчака [48, 49].
У 2021 р. CD19-спрямовані CAR T-клітини вперше були застосовані у лікуванні 20-річної жінки з тяжким рефрактерним системним червоним вовчаком [50]. Цей підхід продемонстрував, що виробництво CAR T-клітин з клітин пацієнтів з аутоімунними захворюваннями є реальним, забезпечуючи стабільну трансфекцію Т-клітин CAR-конструктом і створення достатньої кількості CAR T-клітин для терапії. Інфузія CAR T-клітин була добре перенесена пацієнткою і не викликала серйозних токсичних ефектів. Перше застосування CAR T-клітин при лікуванні аутоімунних захворювань призвело до швидкого знищення В-клітин in vivo, що супроводжувалося швидкою та потужною експансією CAR T-клітин у периферичній крові. Щодо проявів аутоімунного захворювання, було досягнуто повної клінічної ремісії, включаючи припинення протеїнурії через 3 міс, а також сероконверсію аутоантитіл проти двоспіральної ДНК. Крім того, прийом всіх імуносупресивних засобів, включаючи глюкокортикоїди, було успішно припинено без ознак рецидиву хвороби протягом 18 міс [51].
Глибший аналіз ефектів терапії CD19 CAR T-клітинами при системному червоному вовчаку проведений у групі з 5 пацієнтів із тяжкою резистентністю до лікування [52]. Це дослідження показало стабільне виробництво CD19 CAR T-клітин з периферичної крові, незважаючи на попереднє лікування препаратами, що спрямовані на Т-клітини, такими як мікофенолат і глюкокортикоїди [53]. Тимчасова динаміка експансії CAR T-клітин in vivo була подібною в усіх пацієнтів, з піком циркуляції CAR T-клітин приблизно через тиждень після введення. Клінічні прояви системного червоного вовчака швидко зникали у всіх 5 пацієнтів, що досягнули ремісії відповідно до критеріїв DORIS [54].
Ще одне ключове відкриття щодо впливу терапії CAR T-клітинами на цих пацієнтів — відсутність тривалої аплазії В-клітин, оскільки В-клітини відновлювалися приблизно через 100 днів після інфузії. Рецидиву хвороби у цих пацієнтів не відзначали, що вказує на те, що CD19 CAR T-клітини можуть мати довготривалу терапевтичну потенцію для досягнення стійкої ремісії.
Пацієнт з тяжким резистентним дерматоміозитом (антисинтетазний синдром) також успішно пролікувався CD19 CAR T-клітинами [55].
Тривалість ремісії після терапії CAR T-клітинами для аутоімунних захворювань ще не визначена, але спостереження без рецидивів тривали до 2 років у деяких пацієнтів із системним червоним вовчаком, з повною реконституцією В-клітин протягом більшої частини цього періоду. Це може свідчити про те, що деякі пацієнти можуть бути повністю вилікувані від аутоімунних захворювань після терапії CAR T-клітинами, хоча потрібні довші періоди спостереження.
Т-клітинна терапія CAR, спрямованим на CD19, може забезпечити тривалу ремісію без прийому ліків у пацієнтів з аутоімунними захворюваннями. Ефективність Т-клітинної терапії CD19-CAR, ймовірно, базується на глибокому виснаженні В-клітин у тканинах; однак цей ефект не був остаточно доведений на людях in vivo. У новому дослідженні, опублікованому у вересні 2024 р. [56], проведені біопсії до терапії Т-клітинами CD19-CAR (до кондиціонуючої терапії) і після терапії Т-клітинами CD19-CAR (до повторної появи В-клітин) з пахового лімфатичного вузла. Оцінювалися нелімфоїдні тканини 3 додаткових пацієнтів, які отримували лікування Т-клітинами CD19-CAR.
Це дослідження показало, що терапія Т-клітинами CD19-CAR повністю виснажує В-клітини в тканинах пацієнтів із аутоімунними захворюваннями і змінює фолікулярну структуру лімфатичних вузлів. Глибоке виснаження В-клітин у тканинах після терапії Т-клітинами CD19-CAR, ймовірно, зумовлено тим, що зв’язування антигену та ефекторна функція інтегровані в одну клітину. Т-клітини CD19-CAR мігрують до будь-якої тканини тіла і мають потенціал серійно вбивати B-клітини. Лімфодеплетивна терапія, що проводиться разом із CD19-CAR T-клітинами, може збільшити глибину виснаження В-клітин у тканинах. Ці дані підкреслюють важливість аналізу тканини після терапії для кількісної оцінки глибини ефекту лікування.
Чи необхідне лімфоцитарне виснаження для CAR T-клітинної терапії у пацієнтів з аутоімунними захворюваннями?
У онкології CAR T-клітинна терапія включає етап лімфоцитарного виснаження, який зазвичай досягається через короткий курс флударабіну та циклофосфаміду перед введенням CAR T-клітин. У терапії раку крові лімфоцитарне виснаження виконує кілька функцій, включаючи зменшення та модулювання ендогенних лімфоцитів, підготовку мікрооточення для покращення експансії та персистенції CAR T-клітин, а також зниження пухлинного навантаження. Однак більшість режимів лімфоцитарного виснаження призводять до широкого та неспецифічного пригнічення Т-клітин та інших гемопоетичних клітин, що може зумовити цитопенію та підвищений ризик інфекцій на короткий час.
Оскільки у пацієнтів з аутоімунними захворюваннями не потрібно зменшувати кількість пухлинних клітин, існує питання щодо необхідності лімфоцитарного виснаження перед проведенням CAR T-клітинної терапії.
Лімфоцитарне виснаження є важливим у контексті онкології, але його необхідність і оптимальна доза для пацієнтів з аутоімунними захворюваннями наразі не визначені. Сьогодні існує консенсус щодо випробування CAR T-клітинної терапії при різних аутоімунних захворюваннях із встановленими режимами лімфоцитарного виснаження, перш ніж досліджувати альтернативні підходи.
Забезпечення ефективного впровадження CAR T-клітинної терапії при аутоімунних захворюваннях
Порівняно з використанням CAR T-клітин в онкології, анти-CD19 CAR T-клітини демонструють хорошу переносимість при аутоімунних захворюваннях. Незважаючи на тривале імуносупресивне лікування, зазвичай вдається отримати високоякісні аутологічні CAR T-клітини від пацієнтів. Щоб забезпечити якісну продукцію CAR T-клітин, важливо впроваджувати періоди «вимивання», специфічні для ліків, перед проведенням лейкаферезу для оптимізації фітнесу Т-клітин.
Зважаючи на складність CAR T-клітинної терапії, рекомендується міждисциплінарна співпраця між спеціалістами в галузі захворювань (наприклад ревматологами, неврологами) та експертами з CAR T-клітинної терапії (наприклад гематологами). Включення мультидисциплінарних команд також стало основою для створення спеціалізованих академічних центрів клітинної терапії для лікування аутоімунних захворювань.
Побічні ефекти CAR T-клітинної терапії
Синдром вивільнення цитокінів є значною проблемою як токсичний ефект CAR T-терапії. Легкі форми синдрому вивільнення цитокінів проявляються лихоманкою, головним болем, артралгією та міалгією. У тяжких випадках він може призвести до гіпотензії і навіть цитотоксичного шоку. Частота виникнення синдрому вивільнення цитокінів, включно з легкими формами, коливається у діапазоні 42–93% для всіх терапевтичних клітинних продуктів. У деяких випадках це може бути життєзагрозливим станом або навіть призводити до летальних наслідків [57]. Іншим типовим побічним ефектом є нейротоксичний синдром, пов’язаний з ефекторними імунними клітинами, який може проявлятися порушенням дрібної моторики, дисграфією та змінами мовлення. Лікування цього синдрому базується на застосуванні антипіретиків, глюкокортикоїдів та блокаторів рецепторів інтерлейкіну (ІЛ)-6, таких як тоцилізумаб.
Виклики щодо безпеки та економічної ефективності
Питання безпеки терапії CAR T-клітинами при аутоімунних захворюваннях відрізняється від онкологічних міркувань. Небезпечні для життя або летальні ускладнення, такі як синдром вивільнення цитокінів і нейротоксичність (синдром нейротоксичності, асоційований з імунними ефекторними клітинами), є неприпустимими для пацієнтів з аутоімунними захворюваннями. Тому низький рівень серйозних побічних ефектів, зокрема гематотоксичності, гіпогамаглобулінемії та інфекційних ускладнень, є критично важливим для впровадження терапії CAR T-клітинами в майбутньому. У невеликої кількості пацієнтів з аутоімунними захворюваннями, яких лікували CAR T-клітинами, відмічена хороша переносимість терапії без випадків синдрому вивільнення цитокінів вище 1-го ступеня (лише лихоманка) та без синдрому нейротоксичності, асоційованої з імунними ефекторними клітинами.
Існує ймовірність посилення Т-клітинної аутоімунності через коекспансію аутоімунних Т-клонів у пацієнтів під час виробництва CAR T-клітин. Однак цей ризик є низьким, оскільки CAR T-клітини, ймовірно, швидко виснажаться через одночасне стимулювання Т-клітинного рецептора і CAR, як було показано для алореактивних Т-клітин, отриманих від донорів, які не викликають хвороби «трансплантат проти хазяїна» [58].
Висока вартість виробництва CAR T-клітин може обмежити доступність цієї терапії на початкових етапах, переважно для пацієнтів з особливо тяжкими формами аутоімунних захворювань. Проте CAR T-клітини можуть забезпечити припинення застосування всіх інших імуносупресивних засобів у пацієнтів із системним червоним вовчаком, лікування якого пов’язане зі значними витратами на ліки (до 100 000 дол. США на рік). Це може зробити CAR T-клітини економічно ефективними протягом кількох років. Оскільки цей тип клітинної терапії має потенціал для досягнення довготривалого або навіть постійного перезавантаження імунної системи при аутоімунних захворюваннях, CAR T-клітини можуть стати економічно вигідним рішенням для лікування аутоімунних захворювань.
Перспективи та майбутні стратегії терапії CAR T-клітинами при аутоімунних захворюваннях
CD19 є перспективною мішенню для CAR T-клітин, оскільки він специфічний для лінії В-клітин і експресується на різних етапах диференціації В-клітин, включаючи плазмобласти та, ймовірно, невелику частину плазматичних клітин [59]. Наразі невідомо, CD20 чи CD22 є кращими мішенями порівняно з CD19, оскільки їх експресія перекривається CD19, але є низькою або відсутньою в плазмобластах та плазматичних клітинах. CAR T-клітини, спрямовані проти CD38 або антигену дозрівання В-клітин (BCMA), також можуть бути перспективними для терапії аутоімунних захворювань, враховуючи перші докази ефективності антитіл до CD38 при системному червоному вовчаку [60]. Лікування CD19 CAR T-клітинами зазвичай зберігає більшість плазматичних клітин, що може бути перевагою, оскільки цей підхід вже виявився ефективним в усуненні антитіл до дволанцюгової ДНК і нуклеосом.
Новіші конструкції CAR T-клітин, що спрямовуються на В-клітини та плазмобласти через CD19 і на плазматичні клітини через CD38, можуть бути перспективними у лікуванні аутоімунних захворювань [61]. Окрім доменів, що зв’язуються з мішенню, інші особливості вектора CAR можуть також вплинути на терапевтичну ефективність. Перші покоління CAR T-клітин без ко-стимулювальних доменів мали обмежену здатність до розмноження in vivo і короткий період ефективності [62]. Затверджені CAR T-клітини другого покоління CD19 використовують костимулювальні домени CD28 або 4-1BB. Який з них є кращим для лікування як злоякісних пухлин, так і аутоімунних захворювань, наразі не встановлено.
Ще однією важливою складовою CAR T-терапії є підготовча хіміотерапія, що зазвичай складається з короткого курсу циклофосфаміду та флударабіну. Поточні дози циклофосфаміду (зазвичай близько 1 г/м²), що застосовуються разом із CAR T-клітинами, є нижчими, ніж ті, що використовуються для лікування аутоімунних захворювань. Загалом хіміотерапія може мати короткостроковий ефект у лікуванні аутоімунних захворювань, оскільки вона знижує кількість імунних клітин (включаючи В-клітини) приблизно на тиждень [52].
Висновки
CAR T-клітини були успішно впроваджені в лікування аутоімунних захворювань [63, 64]. Цей підхід унікальний не тільки завдяки складному процесу виготовлення персоналізованого генетично модифікованого аутологічного клітинного продукту, але й тим, що він задуманий як одноразова інтервенція для досягнення тривалої ремісії без застосування лікарських засобів. Такий амбітний підхід може стати початком нової ери в лікуванні аутоімунних захворювань, трансформуючи поточний принцип довготривалої імуносупресії в стратегію, яка перезавантажує імунну систему без необхідності в подальшому лікуванні [64].
Список використаної Літератури
- 1. Wang L., Wang F.S., Gershwin M.E. (2015) Human autoimmune diseases: a comprehensive update. Journal of internal medicine, 278(4): 369–395. doi.org/10.1111/joim.12395.
- 2. Fernando M.M., Stevens C.R., Walsh E.C. et al. (2008) Defining the role of the MHC in autoimmunity: a review and pooled analysis. PLoS genetics, 4(4): e1000024. doi.org/10.1371/journal.pgen.1000024.
- 3. http://www.niehs.nih.gov/health/topics/conditions/autoimmune.
- 4. Edwards J.C., Szczepanski L., Szechinski J. et al. (2004) Efficacy of B-cell-targeted therapy with rituximab in patients with rheumatoid arthritis. The New England journal of medicine, 350(25): 2572–2581. doi.org/10.1056/NEJMoa032534.
- 5. Smith R.M., Jones R.B., Specks U. et al. RITAZAREM co-investigators (2020) Rituximab as therapy to induce remission after relapse in ANCA-associated vasculitis. Annals of the rheumatic diseases, 79(9): 1243–1249. doi.org/10.1136/annrheumdis-2019-216863.
- 6. Furie R., Petri M., Zamani O. et al.; BLISS-76 Study Group (2011) A phase III, randomized, placebo-controlled study of belimumab, a monoclonal antibody that inhibits B lymphocyte stimulator, in patients with systemic lupus erythematosus. Arthritis and rheumatism, 63(12): 3918–3930. doi.org/10.1002/art.30613.
- 7. Weiner G.J. (2010) Rituximab: mechanism of action. Seminars in hematology, 47(2): 115–123. doi.org/10.1053/j.seminhematol.2010.01.011.
- 8. Oddis C.V., Reed A.M., Aggarwal R. et al.; RIM Study Group (2013) Rituximab in the treatment of refractory adult and juvenile dermatomyositis and adult polymyositis: a randomized, placebo-phase trial. Arthritis and rheumatism, 65(2): 314–324. doi.org/10.1002/art.37754.
- 9. Herrmann M., Voll R.E., Zoller O.M. et al. (1998) Impaired phagocytosis of apoptotic cell material by monocyte-derived macrophages from patients with systemic lupus erythematosus. Arthritis and rheumatism, 41(7): 1241–1250. doi.org/10.1002/1529-0131(199807)41:7<1241::AID-ART15>3.0.CO;2-H.
- 10. Kamburova E.G., Koenen H.J., Borgman K.J. et al. (2013) A single dose of rituximab does not deplete B cells in secondary lymphoid organs but alters phenotype and function. American journal of transplantation : official journal of the American Society of Transplantation and the American Society of Transplant Surgeons, 13(6): 1503–1511. doi.org/10.1111/ajt.12220.
- 11. Thurlings R.M., Teng O., Vos K. et al. (2010) Clinical response, pharmacokinetics, development of human anti-chimaeric antibodies, and synovial tissue response to rituximab treatment in patients with rheumatoid arthritis. Annals of the rheumatic diseases, 69(2): 409–412. doi.org/10.1136/ard.2009.109041.
- 12. Anolik J.H., Barnard J., Owen T. et al. (2007) Delayed memory B cell recovery in peripheral blood and lymphoid tissue in systemic lupus erythematosus after B cell depletion therapy. Arthritis and rheumatism, 56(9): 3044–3056. doi.org/10.1002/art.22810.
- 13. Gomez Mendez L.M., Cascino M.D., Garg J. et al. (2018) Peripheral Blood B Cell Depletion after Rituximab and Complete Response in Lupus Nephritis. Clinical journal of the American Society of Nephrology: CJASN, 13(10): 1502–1509. doi.org/10.2215/CJN.01070118.
- 14. Mysler E.F., Spindler A.J., Guzman R. et al. (2013) Efficacy and safety of ocrelizumab in active proliferative lupus nephritis: results from a randomized, double-blind, phase III study. Arthritis and rheumatism, 65(9): 2368–2379. doi.org/10.1002/art.38037.
- 15. Furie R.A., Aroca G., Cascino M.D. et al. (2022) B-cell depletion with obinutuzumab for the treatment of proliferative lupus nephritis: a randomised, double-blind, placebo-controlled trial. Annals of the rheumatic diseases, 81(1): 100–107. doi.org/10.1136/annrheumdis-2021-220920.
- 16. Forsthuber T.G., Cimbora D.M., Ratchford J.N. et al. (2018) B cell-based therapies in CNS autoimmunity: differentiating CD19 and CD20 as therapeutic targets. Therapeutic advances in neurological disorders, 11: 1756286418761697. doi.org/10.1177/1756286418761697.
- 17. Ostendorf L., Burns M., Durek P. et al. (2020) Targeting CD38 with Daratumumab in Refractory Systemic Lupus Erythematosus. The New England journal of medicine, 383(12): 1149–1155. doi.org/10.1056/NEJMoa2023325.
- 18. en.wikipedia.org/wiki/CAR_T_cell.
- 19. Kuwana Y., Asakura Y., Utsunomiya N. et al. (1987) Expression of chimeric receptor composed of immunoglobulin-derived V regions and T-cell receptor-derived C regions. Biochemical and biophysical research communications, 149(3): 960–968. doi.org/10.1016/0006-291x(87)90502-x.
- 20. Eshhar Z., Bach N., Fitzer-Attas C.J. et al. (1996) The T-body approach: potential for cancer immunotherapy. Springer seminars in immunopathology, 18(2): 199–209. doi.org/10.1007/BF00820666.
- 21. Yalcin Mutlu M., Wacker J., Tascilar K. et al. (2023) Effective and safe treatment of anti-CD38 therapy in systemic lupus erythematosus-associated refractory cerebral vasculitis induces immune tolerance. Rheumatology (Oxford, England), 62(2): e21–e23. doi.org/10.1093/rheumatology/keac393.
- 22. Motte J., Sgodzai M., Schneider-Gold C. et al. (2024) Treatment of concomitant myasthenia gravis and Lambert-Eaton myasthenic syndrome with autologous CD19-targeted CAR T cells. Neuron, 112(11): 1757–1763.e2. doi.org/10.1016/j.neuron.2024.04.014.
- 23. Sadelain M., Brentjens R., Rivière I. (2013) The basic principles of chimeric antigen receptor design. Cancer discovery, 3(4): 388–398. doi.org/10.1158/2159-8290.CD-12-0548.
- 24. Benmebarek M.R., Karches C.H., Cadilha B.L. et al. (2019) Killing Mechanisms of Chimeric Antigen Receptor (CAR) T Cells. International journal of molecular sciences, 20(6): 1283. doi.org/10.3390/ijms20061283.
- 25. Cazaux M., Grandjean C.L., Lemaître F. et al. (2019) Single-cell imaging of CAR T cell activity in vivo reveals extensive functional and anatomical heterogeneity. The Journal of experimental medicine, 216(5): 1038–1049. doi.org/10.1084/jem.20182375.
- 26. Neelapu S.S. (2019) CAR-T efficacy: is conditioning the key?. Blood, 133(17): 1799–1800. doi.org/10.1182/blood-2019-03-900928.
- 27. Melenhorst J.J., Chen G.M., Wang M. et al. (2022) Decade-long leukaemia remissions with persistence of CD4+ CAR T cells. Nature, 602(7897): 503–509. doi.org/10.1038/s41586-021-04390-6.
- 28. Boyiadzis M.M., Dhodapkar M.V., Brentjens R.J. et al. (2018) Chimeric antigen receptor (CAR) T therapies for the treatment of hematologic malignancies: clinical perspective and significance. Journal for immunotherapy of cancer, 6(1): 137. doi.org/10.1186/s40425-018-0460-5.
- 29. Neelapu S.S., Locke F.L., Bartlett N.L. et al. (2017) Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma. The New England journal of medicine, 377(26): 2531–2544. doi.org/10.1056/NEJMoa1707447.
- 30. Schuster S.J., Bishop M.R., Tam C.S. et al.; JULIET Investigators (2019) Tisagenlecleucel in Adult Relapsed or Refractory Diffuse Large B-Cell Lymphoma. The New England journal of medicine, 380(1): 45–56. doi.org/10.1056/NEJMoa1804980.
- 31. Abramson J.S., Palomba M.L., Gordon L.I. et al. (2020) Lisocabtagene maraleucel for patients with relapsed or refractory large B-cell lymphomas (TRANSCEND NHL 001): a multicentre seamless design study. Lancet (London, England), 396(10254): 839–852. doi.org/10.1016/S0140-6736(20)31366-0.
- 32. Jacobson C.A., Chavez J.C., Sehgal A.R. et al. (2022) Axicabtagene ciloleucel in relapsed or refractory indolent non-Hodgkin lymphoma (ZUMA-5): a single-arm, multicentre, phase 2 trial. The Lancet. Oncology, 23(1): 91–103. doi.org/10.1016/S1470-2045(21)00591-X.
- 33. Berdeja J.G., Madduri D., Usmani S.Z. et al. (2021) Ciltacabtagene autoleucel, a B-cell maturation antigen-directed chimeric antigen receptor T-cell therapy in patients with relapsed or refractory multiple myeloma (CARTITUDE-1): a phase 1b/2 open-label study. Lancet (London, England), 398(10297): 314–324. doi.org/10.1016/S0140-6736(21)00933-8.
- 34. Wang M., Munoz J., Goy A. et al. (2020) KTE-X19 CAR T-Cell Therapy in Relapsed or Refractory Mantle-Cell Lymphoma. The New England journal of medicine, 382(14): 1331–1342. doi.org/10.1056/NEJMoa1914347.
- 35. Maude S.L., Laetsch T.W., Buechner J. et al. (2018) Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. The New England journal of medicine, 378(5): 439–448. doi.org/10.1056/NEJMoa1709866.
- 36. http://www.cancer.gov/about-cancer/treatment/research/car-t-cells.
- 37. Porter D.L., Levine B.L., Kalos M. et al. (2011) Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia. The New England journal of medicine, 365(8): 725–733. doi.org/10.1056/NEJMoa1103849.
- 38. Grupp S.A., Kalos M., Barrett D. et al. (2013) Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. The New England journal of medicine, 368(16): 1509–1518. doi.org/10.1056/NEJMoa1215134.
- 39. Haghikia A., Hegelmaier T., Wolleschak D. et al. (2023) Anti-CD19 CAR T cells for refractory myasthenia gravis. The Lancet. Neurology, 22(12): 1104–1105. doi.org/10.1016/S1474-4422(23)00375-7.
- 40. Wilhelm A., Chambers D., Müller F. et al. (2024) Selective CAR T cell-mediated B cell depletion suppresses IFN signature in SLE. JCI insight, 9(12): e179433. doi.org/10.1172/jci.insight.179433.
- 41. Müller F., Taubmann J., Bucci L. et al. (2024) CD19 CAR T-Cell Therapy in Autoimmune Disease — A Case Series with Follow-up. The New England journal of medicine, 390(8): 687–700. doi.org/10.1056/NEJMoa2308917.
- 42. Kamburova E.G., Koenen H.J., Borgman K.J. et al. (2013) A single dose of rituximab does not deplete B cells in secondary lymphoid organs but alters phenotype and function. American journal of transplantation : official journal of the American Society of Transplantation and the American Society of Transplant Surgeons, 13(6): 1503–1511. doi.org/10.1111/ajt.12220.
- 43. Müller F., Taubmann J., Bucci L. et al. (2024) CD19 CAR T-Cell Therapy in Autoimmune Disease — A Case Series with Follow-up. The New England journal of medicine, 390(8): 687–700. doi.org/10.1056/NEJMoa2308917.
- 44. Haghikia A., Hegelmaier T., Wolleschak D. et al. (2023) Anti-CD19 CAR T cells for refractory myasthenia gravis. The Lancet. Neurology, 22(12): 1104–1105. doi.org/10.1016/S1474-4422(23)00375-7.
- 45. Fischbach F., Richter J., Pfeffer L.K. et al. (2024) CD19-targeted chimeric antigen receptor T cell therapy in two patients with multiple sclerosis. Med (New York, N.Y.), 5(6): 550–558.e2. doi.org/10.1016/j.medj.2024.03.002.
- 46. Haghikia A., Hegelmaier T., Wolleschak D. et al. (2023) Anti-CD19 CAR T cells for refractory myasthenia gravis. The Lancet. Neurology, 22(12): 1104–1105. doi.org/10.1016/S1474-4422(23)00375-7.
- 47. Orvain C., Boulch M., Bousso P. et al. (2021) Is There a Place for Chimeric Antigen Receptor-T Cells in the Treatment of Chronic Autoimmune Rheumatic Diseases?. Arthritis & rheumatology (Hoboken, N.J.), 73(11): 1954–1965. doi.org/10.1002/art.41812.
- 48. Kansal R., Richardson N., Neeli I. et al. (2019) Sustained B cell depletion by CD19-targeted CAR T cells is a highly effective treatment for murine lupus. Science translational medicine, 11(482): eaav1648. doi.org/10.1126/scitranslmed.aav1648.
- 49. Jin X., Xu Q., Pu C. et al. (2021) Therapeutic efficacy of anti-CD19 CAR-T cells in a mouse model of systemic lupus erythematosus. Cellular & molecular immunology, 18(8): 1896–1903. doi.org/10.1038/s41423-020-0472-1.
- 50. Mougiakakos D., Krönke G., Völkl S. et al. (2021) CD19-Targeted CAR T Cells in Refractory Systemic Lupus Erythematosus. The New England journal of medicine, 385(6): 567–569. doi.org/10.1056/NEJMc2107725.
- 51. Mougiakakos D., Krönke G., Völkl S. et al. (2021) CD19-Targeted CAR T Cells in Refractory Systemic Lupus Erythematosus. The New England journal of medicine, 385(6): 567–569. doi.org/10.1056/NEJMc2107725.
- 52. Mackensen A., Müller F., Mougiakakos D. et al. (2022) Anti-CD19 CAR T cell therapy for refractory systemic lupus erythematosus. Nature medicine, 28(10): 2124–2132. doi.org/10.1038/s41591-022-02017-5.
- 53. Kretschmann S., Völkl S., Reimann H. et al. (2023) Successful Generation of CD19 Chimeric Antigen Receptor T Cells from Patients with Advanced Systemic Lupus Erythematosus. Transplantation and cellular therapy, 29(1): 27–33. doi.org/10.1016/j.jtct.2022.10.004.
- 54. van Vollenhoven R.F., Bertsias G., Doria A. et al. (2021) 2021 DORIS definition of remission in SLE: final recommendations from an international task force. Lupus science & medicine, 8(1): e000538. doi.org/10.1136/lupus-2021-000538.
- 55. Müller F., Boeltz S., Knitza J. et al. (2023) CD19-targeted CAR T cells in refractory antisynthetase syndrome. Lancet (London, England), 401(10379): 815–818. doi.org/10.1016/S0140-6736(23)00023-5.
- 56. Tur C., Eckstein M., Velden J. et al. (2024) CD19-CAR T-cell therapy induces deep tissue depletion of B cells. Annals of the rheumatic diseases, ard-2024-226142. Advance online publication. doi.org/10.1136/ard-2024-226142.
- 57. Chohan K.L., Siegler E.L.,Kenderian S.S. (2023) CAR-T Cell Therapy: the Efficacy and Toxicity Balance. Current hematologic malignancy reports, 18(2): 9–18. doi.org/10.1007/s11899-023-00687-7.
- 58. Locatelli F., Quintarelli C. (2018) The EURE-CART project as a prototype model for CAR T-cell immunotherapy in Europe. European Journal of Immunology, 48: 216–219. doi.org/10.1002/eji.201870029.
- 59. Mei H.E., Wirries I., Frölich D. et al. (2015) A unique population of IgG-expressing plasma cells lacking CD19 is enriched in human bone marrow. Blood, 125(11): 1739–1748. doi.org/10.1182/blood-2014-02-555169.
- 60. Forsthuber T.G., Cimbora D.M., Ratchford J.N. et al. (2018) B cell-based therapies in CNS autoimmunity: differentiating CD19 and CD20 as therapeutic targets. Therapeutic advances in neurological disorders, 11: 1756286418761697. doi.org/10.1177/1756286418761697.
- 61. Lim W.A., June C.H. (2017) The Principles of Engineering Immune Cells to Treat Cancer. Cell, 168(4): 724–740. doi.org/10.1016/j.cell.2017.01.016.
- 62. Kawalekar O.U., O’Connor R.S., Fraietta J.A. et al. (2016) Distinct Signaling of Coreceptors Regulates Specific Metabolism Pathways and Impacts Memory Development in CAR T Cells. Immunity, 44(2): 380–390.
- 63. Tsokos G.C. (2022) Engineered T cells to treat lupus arrive on the scene. Nature, 611(7936): 456–458. doi.org/10.1038/d41586-022-03563-1.
- 64. Schett G., Mackensen A., Mougiakakos D. (2023) CAR T-cell therapy in autoimmune diseases. Lancet (London, England), 402(10416): 2034–2044. doi.org/10.1016/S0140-6736(23)01126-1.
Відомості про авторів:
Коваленко Володимир Миколайович — академік, професор, завідувач відділу некоронарних хвороб серця, ревматології та терапії державної установи «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска» НАМН України.
ORCID: 0000-0003-3802-9207
Гнилорибов Андрій Михайлович, доктор медичних наук, професор науково-навчального відділу, Національний інститут серцево-судинної хірургії імені М.М. Амосова НАМН України.
E-mail: andriy.gnylorybov@gmail.com
ORCID ID: 0000-0001-5989-5548.

Leave a comment