АНТИФОСФОЛІПІДНИЙ СИНДРОМ, АСОЦІЙОВАНИЙ З ТРОМБОФІЛІЄЮ, В МЕЖАХ ПРОТРОМБОТИЧНОГО ФЕНОТИПУ
Резюме. Антифосфоліпідний синдром (АФС) залишається актуальним для лікарів усіх спеціальностей, адже має різноманітну кількість маніфестацій. Крім того, оновлені класифікаційні критерії АФС 2023 Американського коледжу ревматології (American College of Rheumatology — ACR)/Європейського альянсу ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR)) мають чіткі домени, що надає лікарям можливість своєчасного встановлення діагнозу. Мета цього дослідження — окреслити особливості першої тромботичної події у пацієнтки молодого віку з АФС, асоційованим зі змішаним захворюванням сполучної тканини. Рання діагностика АФС і комплексне лікування асоційованих процесів дозволило загальмувати пролонгацію хвороби та своєчасно відновити життєво важливі функції пацієнтки. Аналіз даних клінічних та лабораторних проявів дозволяє персоніфіковано розрахувати предиктори наступних подій: рівні антифосфоліпідних антитіл, показники аутоімунної панелі та коагуляційного дисбалансу.
DOI: 10.32471/rheumatology.2707-6970.96.18810
ВСТУП
Антифосфоліпідний синдром (АФС), являє собою аутоімунну тромбофілію, викликану циркулюючими антифосфоліпідними антитілами (аФЛ) (вовчаковий антикоагулянт (LAC), антитіла до кардіоліпіну (aCL), антитіла до β2-глікопротеїну I (β2-GPI)), здатну спричинити розвиток тромботичних подій. Пошкодження клітин та індукування протромботичного фенотипу призводять до тромбозу й ускладнень. Різноманіття тромбофілічних наслідків залежно від варіантів, комбінацій та титрів аФЛ викликає труднощі в поясненні раптового розвитку негативної судинної події у пацієнта. На наш погляд, саме протромботичний фенотип є основою для розуміння подій, пов’язаних із АФС. Оновлені останнім часом класифікаційні критерії АФС 2023 Американського коледжу ревматології (American College of Rheumatology — ACR)/Європейського альянсу ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR) (рис. 1) надали лікарям можливість своєчасного встановлення діагнозу [1, 2].

З огляду на тромбофілічні наслідки, слід розглядати включений до класифікаційних критеріїв — макросудинний. Він являє собою венозну тромбоемболію (ВТЕ) з високим профілем ризику і без нього. На відміну від цього критерію, макроваскулярний — це артеріальний тромбоз з високим профілем ризику розвитку серцево-судинних захворювань і без нього. При АФС домінує (≈⅔ випадків) венозний тромбоз, головним чином нижніх кінцівок, набагато рідше — шийних вен, вен верхніх кінцівок або вісцеральних вен. Артеріальний тромбоз зазвичай стосується судин головного мозку. При АФС відзначають часті рецидиви тромбозу, характерною рисою яких є поява в тому самому руслі, в якому виник перший епізод. До факторів ризику, особливо артеріального тромбозу, належать артеріальна гіпертензія, гіпергомоцистеїнемія і застосування гормонозамісної терапії або контрацептивів [1, 3]. Навпаки, венозний тромбоз пов’язаний з наявністю гіпертригліцеридемії, спадкової тромбофілії або aCL IgG >40 МО. Для стратифікації ризику набуває клінічного значення об’єднаний аналіз АФС — Шкала ризику клінічних проявів АФС (Global APS Score — GAPSS). У пацієнтів, які перенесли тромбоз та/або легеневу тромбоемболію, порівняно з пацієнтами без клінічних подій (GAPSS 9,3 (4,8) (діапазон 1–19) та 5,3 (4) (діапазон 0–16), р<0,001) GAPSS може бути корисним інструментом для оцінки ризику тромбозу або втрати вагітності у aФЛ-позитивних пацієнтів, переходячи від концепції aФЛ як єдиного діагностичного антитіла до aФЛ як фактора ризику розвитку клінічних подій. Глобальна шкала АФС GAPSS є показником ризику його клінічних проявів. Вона враховує комбінацію незалежних факторів серцево-судинного ризику та профіль позитивності aФЛ: гіперліпідемія, артеріальна гіпертензія, aCL, анти-β2-GPI і LAС. Високі рівні GAPSS виявлені у пацієнтів з артеріальним тромбозом (середнє значення GAPSS 12,2 (5,2)) та з рецидивуючими клінічними проявами АФС, включаючи тромбоз та/або захворюваність у період вагітності (середнє значення GAPSS 13,7) [4, 5].
Стратифікація ризику є однією з основ сучасних медичних досліджень, спрямованих на виявлення осіб з високим ризиком розвитку несприятливого результату протягом певного періоду, щоб на них можна було спрямувати стратегії ранньої профілактики та можливі методи лікування. Широко розроблені моделі прогнозування ССЗ, більшість з яких зосереджені на серцевих або цереброваскулярних подіях [6]. β2-Глікопротеїнзалежні аCL класу IgG є значущим предиктором майбутнього гострого інфаркту міокарда (ІМ) у чоловіків. Зокрема, тому що ізотип IgA був підвищений при нестабільній стенокардії та ІМ з підйомом сегмента ST. Тромботична мікроваскулопатія серця викликає ішемію міокарда, яка провокує утворення тромбів. Доведена взаємодія мікросудинних та внутрішньосерцевих тромботичних подій при АФС. Тяжка дисфункція міокарда сама по собі може становити ризик тромбу лівого шлуночка. Однак дані первинного внутрішньосерцевого тромбозу в інших камерах серця свідчать про можливу роль аФЛ у цьому процесі. У деяких повідомленнях описується поява тромбів у всіх 4 камерах серця. Встановлено, що високі рівні aCL IgG пов’язані з утворенням внутрішньосерцевих тромбів (р=0,007). Ехокардіографія виявляє великий рухомий апікальний тромб, нормальні клапани та зниження систолічної функції лівого шлуночка. Незважаючи на антикоагулянтну терапію, пацієнт згодом переносить масивний інсульт, і тромб зворотно зникає при повторному дослідженні [7, 8]. У пацієнтів із вторинним АФС відмічали більш виражену систолічну дисфункцію лівого шлуночка порівняно з пацієнтами з первинним АФС. Існує сильна кореляція між тромбофілічними станами та ІМ у пацієнтів з АФС, але не для інших тромбофілічних захворювань. Аутоантитіла можуть дати унікальне уявлення про імунну активацію, а також охарактеризувати фенотипи захворювання та прогноз. Слід пам’ятати про залежність маніфестації АФС від вмісту аФЛ (табл. 1) [9, 10].
Таблиця 1. Відповідність проявів АФС вмісту аФЛ
| Маніфестація | LAС | IgG aCL | IgM aCL | IgG aнти-β2-гліко-протеїн | IgM aнти-β2-гліко-протеїн |
|---|---|---|---|---|---|
| Хвороба клапанів | NA | NA | |||
| Легенева гіпертензія | NA | ||||
| Livedo reticularis | NA | ||||
| Нефропатія | NA | ||||
| Тромбоцитопенія | |||||
| Гемолітична анемія |
Ключову роль у процесі коагуляції і гемостазу відіграє ендотелій судин, який відповідає за вироблення фактора фон Віллебранда (vWF). vWF опосередковує адгезію між рецепторами поверхні тромбоцитів і стінкою судини, підвищується у випадках тромботичної мікроангіопатії, пов’язаної з синдромом внутрішньосудинного згортання крові (ДВЗ-синдром). Порушення контролю експресії тромбомодуліну ендотеліальних клітин може призвести до полегшення генерації тромбіну, що згодом зумовлює підвищення активації тромбоцитів і перетворення фібриногену на фібрин [9, 10].
Метою цього дослідження було окреслити особливості першої тромботичної події у пацієнтки молодого віку з АФС, асоційованим зі змішаним захворюванням сполучної тканини (ЗЗСТ).
У цій статті ми представляємо випадок пацієнтки з України, яка має АФС, асоційований із ЗЗСТ. Отримано згоду пацієнтки на публікацію даних.
Дослідження проводилося відповідно до принципів біоетики, викладених у Гельсінській декларації, — «Етичні принципи медичних досліджень за участю людей» та «Загальна декларація з біоетики та прав людини» (ЮНЕСКО).
Клінічний випадок
Пацієнтка О., 37 років з історією хвороби 6 міс.
Діагноз: гострий мозковий інсульт: інфаркт головного мозку в басейні лівої мозкової артерії (06.01.2024 р.), криптогенний підтип, легкий правобічний геміпарез, дизартрія легкого ступеня. MIHSS-5. Mrs-1.
Cкарги при зверненні на нестерпний головний біль, слабкість у правій руці, відчуття закладеності у вухах. Бригадою швидкої допомоги зафіксовано артеріальний тиск — 120/80 мм рт.ст., частота серцевих скорочень (ЧСС) — 72 уд./хв, температура тіла 37,3 °С. Доставлена в стаціонар відділення цереброваскулярної патології міської клінічної лікарні в тяжкому стані, де проведено обстеження і лікування. За даними анамнезу захворювання відомо, що у пацієнтки останніми роками відзначалися частий головний біль, загальна слабкість, біль в суглобах, зниження працездатності. За допомогою не зверталася, приймала знеболювальні препарати. Вагітність — 3, викидні — 2, пологи — 1. Менопауза 2 роки (не уточнена причина).
Об’єктивно при госпіталізації рівень свідомості 15 балів за шкалою Глазго. Орієнтована. Емоційно лабільна, фіксована на своїх відчуттях. Менінгеальні симптоми відсутні. Черепно-мозкові нерви (ЧМН): щілі очей, зіниці D=S, рух обох очей в повному обсязі. Ністагм відсутній. Носогубні складки симетричні. Язик по середній лінії. Фонація, акт ковтання не порушений, дизартрія. Тонус м’язів кінцівок не порушений. Проба Баре (+) в правих кінцівках. Сила правих кінцівок знижена до 4,0–4,5 бала. Сух.-пер. рефлекси D>S, високі, патологічні знаки ступні (+) справа. У позі Ромберга нестійка. Пальценосову пробу виконує задовільно. Черевні рефлекси торпедні. Порушення функції тазових органів заперечує.
У ділянці спини та бічних поверхнях тіла на шкірі численні прояви сітчастого ліведо. Щитоподібна залоза та периферичні лімфовузли не збільшені. Пульс 82 уд./хв, задовільних властивостей, артеріальний тиск 125/80 мм рт. ст. У ділянці каротидних артерій вислуховується слабкий шум. Аускультативно: дихання везикулярне, хрипів не виявлено. Частота дихання 22 за 1 хв. Перкуторно відмічається лише помірне (до 1 см вліво від лівої середньо-ключичної лінії) зміщення межі серця; аускультативно — ослаблення першого тону на верхівці та помірний систолічний шум там само і в точці Боткіна; акценту тонів на основі серця не виявлено. Живіт м’який, печінка і селезінка у краю реберної дуги.
Під час перебування у стаціонарі в пацієнтки відмічали тривожний синдром. З часом зростали сила і обсяги рухів у кінцівках. Зменшилися чутливі порушення. Покращилося мовлення. У неврологічному статусі зберігається пірамідна недостатність та тривожний синдром. Логопед визначив дизартрію легкого ступеня тяжкості.
Результати лабораторного обстеження:
1. Загальний аналіз крові: еритроцити — 3,4·1012/л; гемоглобін — 106 г/л; лейкоцити — 5,5·109/л, тромбоцити — 120·109/л, е-2%, п-1%, с-60%, л-24%, м-14%, швидкість осідання еритроцитів (ШОЕ) — 23 мм/год.
2. С-реактивний білок 12,8 г/л.
3. Аутоімунна панель. Позитивні антинуклеарні антитіла Ds-DNA, ANA (1:1200), анти-Sm (Smith антиген), SS-A/Ro, SS-B/La. Розглядається діагноз ЗЗСТ, який відповідає серологічному критерію ANA (1:1200), Ds-DNA SS-A/Ro, SS-B/La та ≥4 клінічним критеріям (синдром Рейно, артрит, міалгія, сітчасте ліведо). Встановлено позитивність до аФЛ (LAC, aCL >150 SGU, β2-глікопротеїн >150 SGU).
4. Діагностовано генетично зумовлену схильність до тромбофілії, асоційовану з варіантами генів: серпін-1PAI-1-антагоніст тканинного активатора плазміногену, ген FGB-фібриноген (гетерозиготне носійство).
Результати інструментального обстеження:
1. Ультразвукове дослідження (УЗД) екстракраніальних артерій: carotis int. dex. просвіт діаметром 4,5 мм. V. sist. — 82,9 cм/с. Ri 0,55. Комплекс інтима-медіа: ЗСА 0,5–0,6 мм. По хребцевих артеріях кровоплин антеградний, симетричний. Праворуч просвіт діаметром 3,5 мм. V. sist. — 40,0 cм/с. Ri 0,51 сегмент V2. Ліворуч просвіт діаметром 3,1 мм. V. sist. — 44,9 cм/с. Ri 0,59 сегмент V2. Артерії хребта білатерально деформовані в V2. Висновок: УЗД-ознаки вертеброгенної деформації хребетних артерій з обох боків.
2. Ехокардіографія: аорта не ущільнена. Діаметр на рівні ФК — 17 мм. Синусів — 29 мм. Ліве передсердя: 35х47 мм. Індекс об’єму лівого передсердя — 28 мл/м². Правий шлуночок — середній діаметр 28 мм. Праве передсердя — 11 мм. Лівий шлуночок — кінцево-діастолічний розмір (КДР) 47 мм, кінцево-систолічний розмір (КСР) 32 мм, кінцевий діастолічний об’єм (КДО) 102 мл, кінцевий систолічний об’єм (КСО) 41 мл, товщина задньої стінки лівого шлуночка — 10 мм. Фракція викиду 60%. Ударний об’єм 71 мл. Індекс маси міокарда (ІММ) лівого шлуночка 93 г/м². Мітральний клапан: стулки в систолу повністю зімкнуті. МАЕ 1,9. Пролапс стулок — 5 мм. Аортальний клапан — стулки замкнуті повністю. Трикуспідальний клапан: стулки в систолу неповністю змикаються. TAPSE — 2,7 cм. Е/А — 1,4. Вихідний тракт правого шлуночка: над клапанами легеневої артерії 20 мм. Мітральний клапан — UmaxE 82 cм/с. UmaxА 60 cм/с. Е/А 1,3. Градієнт тиску Р — 4,2 мм рт.ст. Регургітації немає. Тристулковий клапан: регургітація до 1/3 правого передсердя. Легенева артерія: систолічний тиск 31 мм рт. ст. Регургітація на мітральному клапані — trivial, на трикуспідальному клапані — mild.
3. УЗД черевної порожнини. Підшлункова залоза: голівка 2,3 см, тіло 1,0 см, хвіст 1,5 см. Структура однорідна. Ехогенність: середня. Вірсунговий протік не розширений. Заочеревні лімфатичні вузли не визначаються. Печінка: права частка 14,4 см, ліва частка 8,0 см. Структура дрібнозерниста. Середня ехогенність, аваскулярне утворення діаметром 8 мм. Жовчний міхур: 6,7×2,9 см², грушоподібної форми. Стінки — 2,4 мм. Паренхіма праворуч 1,7 см, середньої ехогенності. Паренхіма ліворуч 2,0 см, середньої ехогенності. Селезінка: 10,0×4,7 см. Вільної рідини в порожнині не виявлено. Висновок: ознаки ураження правої частки печінки: гемангіома.
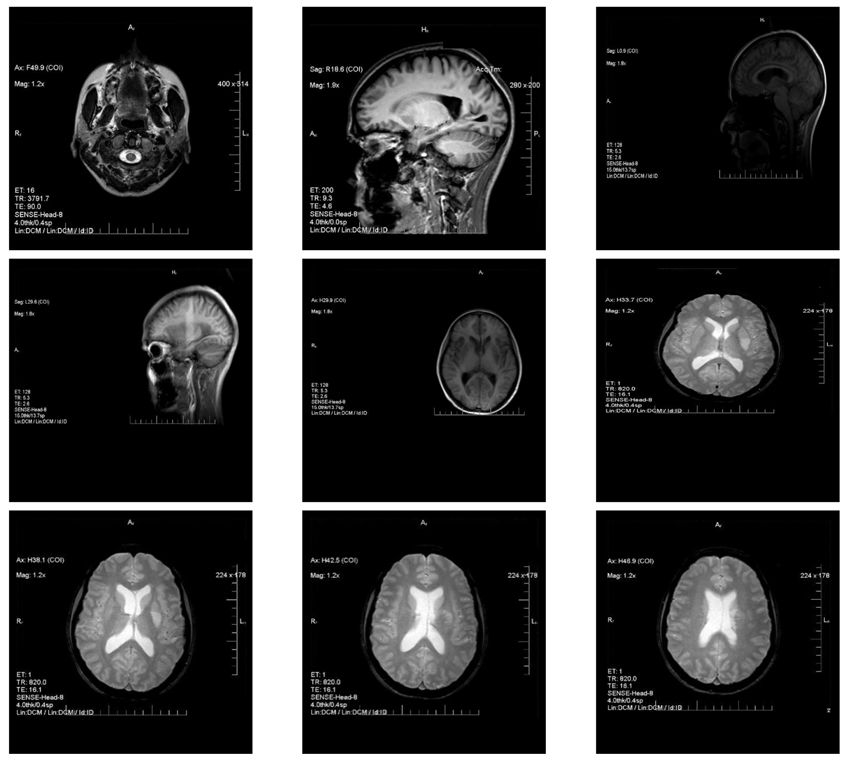
4. Магнітно-резонансна томографія (МРТ) головного мозку. МРТ-ознаки підгострого ішемічного інфаркту в зоні базальних ядер, зліва, підгострих лакунарних ішемічних інфарктів у лівій ділянці лоба, лівій тім’яній частці (рис. 2). Ознаки поодиноких вогнищевих змін в обох лобових частках.
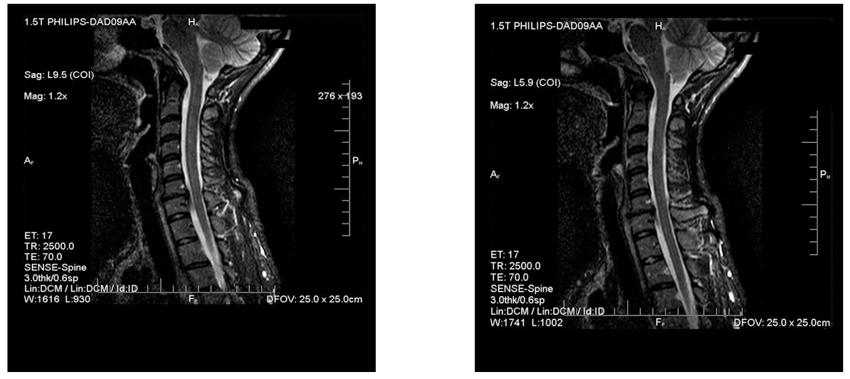
5. МРТ шийного відділу хребта. Кили хребцевого диска С7-С7 з відносним стенозом каналу хребта. Спондилоартрит, спондильоз шийного відділу (рис. 3).
Така сукупність ознак дала підстави запідозрити АФС, достовірність якого встановлена з отриманням позитивних результатів аналізу крові на аФЛ. Продовжується дообстеження на виключення неопластичних процесів, васкуліту великих судин. Динаміка зниження рівня D-димеру загальмована від 1500 до 540 протягом 6 міс. З огляду на класифікаційні критерії АФС (2023 ACR/EULAR) у цієї пацієнтки макросудинний прояв (домен 2) з ураженням церебральних судин з інфарктом головного мозку. Щодо livedo reticularis (мікросудинний домен 3), то таку ознаку слід розглядати в рамках змішаного або недиференційованого аутоімунного захворювання. Дисфункція центральної нервової системи: новий головний біль, який не реагує на ліки та не пояснюється альтернативним діагнозом, був першим проявом патології, але, з огляду на класифікаційні критерії, він лише знаходить місце в акушерському анамнезі. За даними ехокардіографії, клапанна дисфункція серця не відповідає класифікаційним критеріям домена 5 — «серцевий клапан». На наш погляд, це прояв мезенхімальної дисплазії. Наступний домен 6 (гематологія): тромбоцитопенія. Найнижча кількість тромбоцитів в цієї пацієнтки 120·109/л, підтверджена мазком периферичної крові та повторним аналізом потребує виключення «рівно ймовірних» або «більш ймовірних» причин, а також потребує подальшого моніторингу за цим показником у цієї пацієнтки.
У хворої, яку ми спостерігаємо, з першим епізодом тромбозу в басейні лівої мозкової артерії, наслідком якого є інфаркт головного мозку, визначено відмінності від інших клінічно подібних ситуацій.
Доведено, що тромбоцитопенія зумовлена тромбоцитарним фактором (FT4) за умови персистенції з позитивними аФЛ. аФЛ часто виявляються у пацієнтів з початковим діагнозом ідіопатична тромбоцитопенічна пурпура (ІТП), проспективно пов’язана з тромбозом (рівень доказовості I). Це може свідчити про те, що аФЛ спричиняє високий ризик тромбозу у пацієнтів з ІТП, або що ІТП є першим симптомом АФС, як і системного червоного вовчака. Тромбоцитопенія частіше відмічається у пацієнтів з АФС та системним червоним вовчаком, ніж у пацієнтів лише з АФС (рівень доказовості II). Антитіла, спрямовані проти глікопротеїнів тромбоцитів, асоціюються з тромбоцитопенією (але не з тромбозом) у хворих з аФЛ, а також у пацієнтів з АФС, порівняно з хворими на ІТП (рівень доказовості III). Cаме пацієнт з таким хворобливим навантаженням, як тромбоцитопенія, з персистуючими аФЛ, за відсутності клінічних проявів АФС, повинен розглядатися як відмінний від ІТП: такі пацієнти мають підвищений тромботичний ризик і потребують більш ретельного спостереження [11, 12].
Клінічна значущість aФЛ, включаючи підвищений ризик тромбозу у пацієнтів з aCL, анти-β2-глікопротеїном та LAС, добре відома. Хоча aФЛ беруть безпосередню участь у патогенезі та пов’язані з тромботичним ризиком, вони відмічаються нечасто, що вказує на те, що для цього зв’язку потрібні додаткові фактори. «Другий поштовх» також вважається необхідним для провокації утворення згортання крові у носіїв аФЛ (табл. 2) [9, 12].
Таблиця 2. Визначення aФЛ-асоційованої тромбоцитопенії
|
aФЛ‐асоційована тромбоцитопенія — це співіснування лабораторних критеріїв АФС поряд з наступними:
|
| Перевагою є підкласифікація хворих за наявністю або відсутністю системного червоного вовчака. |
| Пацієнти, які відповідають клінічним критеріям АФС, виключаються з наведеного вище визначення. |
З моменту першого повідомлення про АФС було показано, що деякі мікробні та вірусні агенти впливають на генерацію аФЛ та клінічні прояви АФС. Однак обмежена увага приділяється механізму підтримки хронічного аутоімунітету при АФС. Деякі з цих потенційних механізмів, що беруть участь у патогенезі АФС, можуть мати терапевтичні наслідки. aФЛ спрямовані проти фосфоліпідзв’язувальних білків, таких як β2-глікопротеїн, і може бути як непатогенним, так і патогенним. У той час як низькі рівні aФЛ, особливо підкласу IgM, можуть відмічатися у зовні здорових осіб і мати захисну силу, IgG aФЛ можуть бути пов’язані з патогенністю [11, 12].
Антипротромбінові антитіла, виявлені методом імуноферментного аналізу, є гетерогенною популяцією, що включає антитіла проти протромбіну (aPT‐A) та антитіла до фосфатидилсериново-протромбінового комплексу (aPS/PT). Дані про клінічні асоціації aPT‐A суперечливі і свідчать про низьку специфічність цих антитіл для діагностики АФС (рівень доказовості II). Систематичний огляд антипротромбінових антитіл та ризику тромбозу при АФС не виявив зв’язку, незалежно від ізотипу, локалізації та типу явища або наявності системного червоного вовчака. Як чутливість, так і специфічність aPS/PT вищі, ніж для aPT‐A, тоді як 95% пацієнтів з aPS/PT також є LAС позитивними, що свідчить про те, що aPS/PT також може слугувати підтверджувальним аналізом для LAС (рівень доказовості II); ці результати, однак, отримані лише в одному дослідженні, і занепокоєння щодо aPS/PT виникає через зв’язування полівалентних антитіл. Проспективні дослідження, що вивчають зв’язок aPT‐A або aPS/PT з клінічними ознаками АФС, все ще відсутні [11, 12].
ВИСНОВКИ
Рання діагностика АФС і комплексне лікування асоційованих процесів дозволили загальмувати пролонгацію хвороби та своєчасно відновити життєво важливі функції хворої. Розуміння того, що наступний епізод тромбозу повториться у макросудинному басейні (артеріальному), ставить перед нами завдання визначити предиктори загострення. Аналіз даних клінічних та лабораторних проявів дає змогу персоніфіковано розрахувати предиктори наступних подій: першочергово це стосується рівня аФЛ (aCL, анти-β2-глікопротеїну, aPS-PT і LAС), а також показників аутоімунної панелі та коагуляційного дисбалансу.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- 1. Barbhaiya М., Zuily S., Naden R. et al. (2023) 2023 ACR/EULAR Antiphospholipid Syndrome Classification Criteria. Arthritis Rheumatol. doi: 10.1002/art.42624.
- 2. Knight J.S., Branch D.W., Ortel T.L. (2023) Antiphospholipid syndrome: advances in diagnosis, pathogenesis, and management. BMJ, 380: e069717. doi: 10.1136/bmj-2021-069717.
- 3. Sayar Z., Moll R., Isenberg D. et al. (2021) Thrombotic antiphospholipid syndrome: A practical guide to diagnosis and management. Thromb. Res., 198: 213–221. doi: 10.1016/j.thromres.2020.10.010.
- 4. Knight J.S., Kanthi Y. (2022) Mechanisms of immunothrombosis and vasculopathy in antiphospholipid syndrome. Semin. Immunopathol., 44(3): 347–362. doi: 10.1007/s00281-022-00916-w.
- 5. Aibar J., Schulman S. (2021) Arterial Thrombosis in Patients with Antiphospholipid Syndrome: A Review and Meta-Analysis. Semin. Thromb. Hemost., 47(6): 709–723. doi: 10.1055/s-0041-1725057.
- 6. Mezhov V., Segan J.D., Tran H. et al. (2019) Antiphospholipid syndrome: a clinical review. Med. J. Aust. 211(4): 184–188. doi: 10.5694/mja2.50262.
- 7. Salet D.M., Bekkering S., Middeldorp S. et al. (2023) Targeting thromboinflammation in antiphospholipid syndrome. J. Thromb. Haemos., 21(4): 744–757. doi: 10.1016/j.jtha.2022.12.002.
- 8. Krilis M., Qi M., Ioannou Y. et al. (2021) Clinical relevance of nitrated beta 2-glycoprotein I in antiphospholipid syndrome: Implications for thrombosis risk. J. Autoimmun., 122: 102675. doi: 10.1016/j.jaut.2021.102675.
- 9. Mittal P., Quattrocchi G., Tohidi-Esfahani I. et al. (2023) Antiphospholipid syndrome, antiphospholipid antibodies, and stroke. Int. J. Stroke., 18(4): 383–391. doi: 10.1177/17474930221150349.
- 10. Qi M., Weaver J.C., Krilis S.A. et al. (2019) Quantitation of Total and Free Thiol β2-Glycoprotein I Levels for Diagnostic and Prognostic Purposes in the Antiphospholipid Syndrome. Methods Mol. Biol., 1967: 275–283. doi: 10.1007/978-1-4939-9187-7_17.
- 11. Tohidi-Esfahani І., Mittal Р., Isenberg D. et al. (2024) Platelets and Thrombotic Antiphospholipid Syndrome. J. Clin. Med., 13 (3): 741. doi: 10.3390/jcm13030741.
- 12. Windisch S., Ash J.Y., Frishman W.H. (2023) Antiphospholipid Syndrome: Thrombotic and Vascular Complications. Cardiol. Rev. doi: 10.1097/CRD.0000000000000590.
Відомості про авторів:
Кузьміна Ганна Петрівна — доктор медичних наук, професор кафедри терапії, кардіології та сімейної медицини факультету післядипломної освіти Дніпровського державного медичного університету, 50056, м. Кривий Ріг, майдан 30-річчя Перемоги, 2.
E-mail: revmatologymedd@gmail.com
ORCID ID: 0000-0003-4556-4013
Лазаренко Ольга Миколаївна, асистент кафедри терапії, кардіології та сімейної медицини факультету післядипломної освіти Дніпровського державного медичного університету.
ORCID ID: 0000-0002-7806-2661

Leave a comment