Системна склеродермія та інтерстиціальне захворювання легень (оновлені рекомендації ACR 2023)
- 1Національний медичний університет імені О.О. Богомольця, м. Київ
- 2Івано-Франківський національний медичний університет
Резюме. Рекомендації присвячені діагностиці, моніторингу та лікуванню інтерстиціального захворювання легень при системній склеродермії (ССД-ІЗЛ). Уніфікація термінології та підходів до діагностики та клінічного моніторингу пацієнтів з ССД-ІЗЛ може покращити тактику ведення та підвищити виживаність таких пацієнтів. Велика увага приділяється різним підходам до патогенетичного лікування ССД-ІЗЛ, в тому числі призначення протифіброзних препаратів, та їх можливим перспективам. Для стандартизації підходів до діагностики та лікування ССД-ІЗЛ необхідно провести масштабні багатоцентрові дослідження та створити спеціальні реєстри хворих. Для виявлення пацієнтів із високим ризиком інтерстиціального захворювання легень, в тому числі і легеневого фіброзу, що прогресує, у пацієнтів з ССД та кандидатів на трансплантацію легень найбільш перспективним є створення спеціальних баз даних таких пацієнтів.
DOI: 10.32471/rheumatology.2707-6970.94.18297
Інтерстиціальне захворювання легень (ІЗЛ) є однією з основних форм ураження легень у пацієнтів із системною склеродермією (ССД) [3, 6]. ІЗЛ, асоційоване з ССД, складається з різних гістопатологічних підтипів, найчастіше неспецифічної інтерстиціальної пневмонії та звичайної інтерстиціальної пневмонії. У таких пацієнтів прогноз гірший, ніж у пацієнтів із ССД без ураження легень.
ССД-ІЗЛ асоційоване з такими генетичними та імунологічними маркерами, як HLA-B62, HLA-C06, DR-B1-11, DR51,CD226, MMP12, SFTRE, GTGF, HGF, TRAKI, TCRBV, IRF5, CD 247 [7].
Відомо, що дифузна ССД, яка характеризується великим ураженням шкіри та поширенням склерозу шкіри проксимальніше ліктів, є фактором ризику розвитку ІЗЛ на ранніх стадіях ССД. Пацієнти з обмеженою ССД, у яких склероз шкіри зазвичай обмежується руками, дистальними відділами кінцівок і, меншою мірою, обличчям і шиєю, менш схильні до розвитку ІЗЛ на ранніх стадіях захворювання, але у них може розвинутися ІЗЛ як пізній прояв [6, 10]. Поширеність ІЗЛ наближається до 50% пацієнтів із дифузною ССД (обширне ураження шкіри проксимальніше зап’ястків, особливо над проксимальними відділами кінцівок і тулуба) [12].
Термін «ІЗЛ» широко використовується для опису гетерогенної групи розладів, які класифікуються разом через подібні клінічні, рентгенологічні, фізіологічні або патологічні прояви.
У переважної більшості пацієнтів із ССД-ІЗЛ ураження легень характеризується картиною, яка називається неспецифічною інтерстиціальною пневмонією (НСІП). Гістопатологічно НСІП характеризується різним ступенем легеневого запалення та фіброзу, причому деякі форми є в основному запальними (клітинна НСІП), а інші переважно фіброзними (фіброзна НСІП). Пацієнти з більш фіброзною формою НСІП мають гірші результати порівняно з пацієнтами з клітинною НСІП [1, 2].
У меншості пацієнтів із ССД-ІЗЛ відмічають гістопатологічну картину звичайної інтерстиціальної пневмонії (ЗІП), а також ознаки, пов’язані з ідіопатичним легеневим фіброзом (ІЛФ), який характеризується наявністю розрізнених вогнищ проліферації фібробластів («вогнища фібробластів»), нерівномірним розподілом ділянок щільного фіброзу, мізерним запаленням і стільниковими змінами. У той час як гістопатологічна картина звичайної інтерстиціальної пневмонії (ЗІП) є менш поширеною, ніж НСІП, у сполучнотканинних асоційованих ІЗЛ за наявності ознак ЗІП (гістопатологічно або рентгенографічно) забезпечує гіршу виживаність порівняно з НСІП [10].
Незалежними факторами ризику ССД-ІЗЛ є чоловіча стать, афро-карибське походження, дифузний патерн ураження шкіри, антитіла до топоізомерази-1 (Scl-70) та виражений гастроезофагеальний рефлюкс [3].
ІЗЛ часто має безсимптомний перебіг.
Найбільш поширеними симптомами ССД-ІЗЛ є такі:
- втома;
- задишка (спочатку задишка при фізичному навантаженні);
- сухий кашель.
Біль у грудній клітці відмічають рідко.
У той час як у більшості пацієнтів фіксують шкірні прояви ССД під час виявлення ІЗЛ, іноді у пацієнтів спочатку діагностують ІЗЛ, а потім виявляють ССД на підставі наявності таких ознак, як феномен Рейно, склеродактилія, позитивні аутоантитіла (наприклад антинуклеарні антитіла, антитопоізомераза — анти-Scl70), або аномальна капілярна мікроскопія нігтьової складки) [3, 6, 12].
Найхарактернішою знахідкою ІЗЛ під час фізикального обстеження є бібазилярні дрібні інспіраторні хрипи (тобто хрипи на «липучках») біля основи легень. Ознаки легеневого серця можна відмічати при ІЗЛ, але частіше пов’язані з легеневою гіпертензією, яка може виникати при ССД як окремий процес або разом із ІЗЛ [4].
ІЗЛ, асоційоване з ССД, зазвичай підозрюють, коли у пацієнта зі встановленою ССД розвиваються задишка при фізичному навантаженні, кашель, хрипи при аускультації або відхилення при тестуванні функції легень (легеневі функціональні тести — ЛФТ) або рентгенограмі грудної клітки. Оцінка підозри на ІЗЛ у пацієнта із ССД подібна до оцінки інших пацієнтів із підозрою на ІЗЛ. Однак біопсія легень майже ніколи не потрібна для встановлення діагнозу ССД-ІЗЛ. Окремо детально розглянуто загальний діагностичний підхід до хворого на ІЗЛ.
Лабораторні результати — наявність характерних аутоантитіл підтверджує діагноз ССД та може вказувати на підвищену ймовірність специфічних клінічних проявів, таких як ІЗЛ, але жодні з них не є діагностичними для ІЗЛ. Наприклад, антитіло до топоізомерази I (анти-Scl-70), яке зазвичай визначають у рамках діагностичного обстеження пацієнтів із підозрою на ССД, пов’язане з підвищеним ризиком ІЗЛ, пов’язаної з ССД (чутливість 45%, специфічність 81%). Також антитіла анти-U11/U12 RNP та анти-Th/T0 (рибонуклеопротеїн) пов’язані з розвитком ССД-ІЗЛ. Анти-Ro52 антитіла часто асоціюються з гіршим прогнозом ССД, а їх титри корелюють з тяжкістю ССД-ІЗЛ. Окремо обговорюються роль і доступність специфічних лабораторних досліджень у діагностиці та лікуванні ССД [6, 12].
ЛФТ — виконуються у пацієнтів із ССД під час первинної діагностики, щоб визначити наявність і ступінь ураження легень, пов’язаного з ССД. Згодом ЛФТ, як правило, проводять щорічно або за необхідності частіше, щоб оцінити новий початок задишки, кашлю або рентгенографічних відхилень [10].
Спірометрія — пропорційне зменшення об’єму форсованого видиху за одну секунду (ОФВ1) і форсованої життєвої ємності (ФЖЄЛ), тобто нормальне співвідношення ОФВ1/ФЖЄЛ, рекомендовано проводити кожному пацієнту з ІЗЛ. При спірометрії у пацієнтів із ССД-ІЗЛ зазвичай визначають рестриктивний тип порушення вентиляції: зниження показників ЖЄЛ, ФЖЄЛ та ОФВ1 відбувається пропорційно.
Показник ОФВ1/ФЖЄЛ залишається в межах норми (>70%). Однак ранню ІЗЛ у пацієнтів із ССД не можна виключити за допомогою звичайної спірометрії. Описані дослідження, в яких близько 60% пацієнтів із ССД-ІЗЛ, діагностованим за допомогою комп’ютерної томографії високої роздільної здатності (КТ-ВРЗ), мали показники спірометрії в межах норми [8, 10].
Об’єм легень — ФЖЄЛ, загальна ємність легень (ЗЄЛ), функціональна залишкова ємність (ФЗЄ) і залишковий об’єм легень (ЗОЛ) можуть бути знижені при ІЗЛ. Пацієнти з ССД, які мають майже нормальну ФЖЄЛ при первинному зверненні, мають низький ризик прогресування до тяжкої ІЗЛ. Спірометрія є важливою частиною діагностики ССД-ІЗЛ, проте недостатньо чутливою, щоб виявити раннє ІЗЛ. Однак нормальний об’єм легень не можна використовувати для виключення ранньої ІЗЛ. Пацієнти з раннім ССД-ІЗЛ можуть мати збережені об’єми легень, незважаючи на чіткі докази структурного захворювання легень на КТ-ВРЗ і зниження дифузійної здатності легень монооксиду вуглецю (DLCO).
Дифузійна здатність — DLCO є чутливим скринінговим тестом на ІЗЛ, хоча рідко пацієнти з ССД мають нормальний DLCO, незважаючи на рентгенологічні ознаки ІЗЛ. Зниження DLCO може бути першим відхиленням, що виявляється у пацієнтів з ССД-ІЗЛ при проведенні ЛФТ, хоча є неспецифічним; інші процеси (наприклад легенева гіпертензія, куріння сигарет, тромбоемболічні захворювання та анемія) також можуть викликати зниження DLCO. Серед пацієнтів із ІЗЛ, асоційованим із ССД, зниження DLCO зазвичай пропорційне зменшенню об’єму легень. Крім того, зниження DLCO корелює з тяжкістю ІЗЛ, виявленої за допомогою КТ-ВРЗ, і є предиктором поганого результату [8, 10].
Тест 6-хвилинної ходьби — тест 6-хвилинної ходьби (6-ХТзХ) оцінює як пройдену відстань (метри), так і ступінь десатурації кисню. Він використовується як міра субмаксимальних фізичних навантажень при різноманітних легеневих захворюваннях (наприклад ідіопатичний легеневий фіброз і легенева артеріальна гіпертензія). Оцінка пульсової десатурації кисню може бути проблематичною у пацієнтів із ССД через феномен Рейно та погану перфузію пальців. Якщо доступне відповідне кріплення, вимірювання пульсової сатурації киснем за допомогою кліпси для мочки вуха може бути більш надійним. Десатурація під час пересування характерна як для ІЗЛ, так і для легеневої гіпертензії [1, 2, 4].
Значення 6-ХТзХ дещо обмежене при ССД, оскільки пройдена відстань погано розрізняє пацієнтів із ураженням легень і без нього. Це може бути наслідком ускладнень з боку опорно-рухового апарату та периферичних судин.
Рентгенограма грудної клітки — відносно нечутлива для виявлення ранньої ІЗЛ і не рекомендована [1, 2]. Класичні рентгенологічні ознаки встановленої ІЗЛ, пов’язаної з ССД, включають симетричні, сітчасті або матові помутніння. Зазвичай вони найбільш виражені в основі легень.
Сканування КТ-ВРЗ — усі пацієнти з підозрою на ССД-ІЗЛ повинні пройти КТ-ВРЗ грудної клітки під час первинного обстеження [5]. Візуалізація як у положенні лежачи, так і на животі є важливою, оскільки ранні рентгенологічні зміни ІЗЛ, пов’язаної з ССД, зазвичай виявляються в залежних ділянках легень; сканування в положенні лежачи використовується для виключення можливості залежного ателектазу.
Патерни КТ-ВРЗ, виявлені при ССД-ІЗЛ, відображають загальні гістопатологічні моделі ідіопатичних інтерстиціальних пневмоній (наприклад НСІП, ЗІП та центрилобулярного фіброзу).
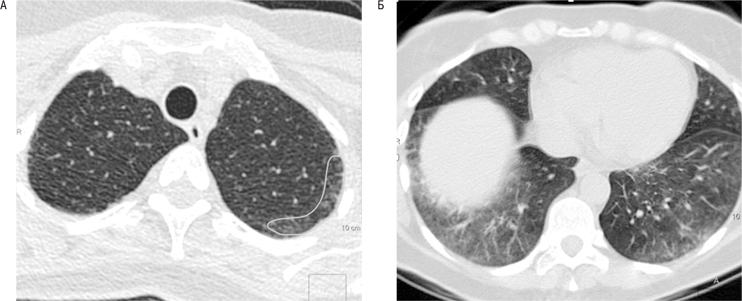
Серед пацієнтів із ССД-ІЗЛ найпоширеніший патологічний патерн, НСІП, пов’язаний із виявленням на КТ-ВРЗ помутніння за типом «матового скла» на периферії (фото 1-Б). Найбільш ранньою ознакою на КТ-ВРЗ зазвичай є зміни у вигляді вузької, часто погано окресленої субплевральної підвищеної щільності у вигляді півмісяця в задніх (залежних) сегментах нижніх часток (фото 1-А). У міру прогресування захворювання виявляють втрату об’єму, пов’язану з ретикулярними змінами і тракційними бронхоектазами. Стільниковий малюнок рідко відмічають при НСІП [5].
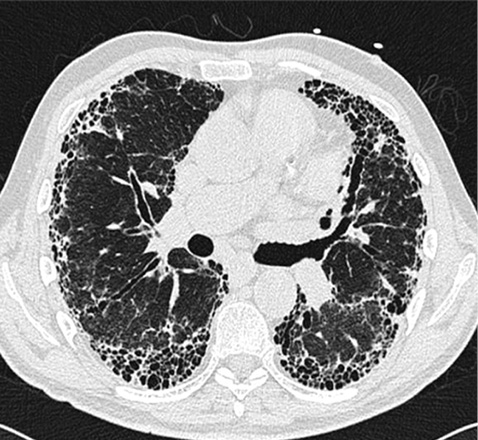
У підгрупі пацієнтів із гістологічною картиною ЗІП ознаки на КТ-ВРЗ зазвичай подібні до фіброзного НСІП. Однак іноді картина КТ-ВРЗ більш узгоджується з такою при ЗІП з бібазилярними ретикулярними помутніннями, пов’язаними з тракційними бронхоектазами та розвитком субплевральних стільникових повітряних просторів, які зрештою об’єднуються у великі кистозні повітряні простори (фото 2) [5].
Центрилобулярний фіброз — це рідкісна картина, яка пов’язана з плямистим «матовим склом» або консолідаційними помутніннями з центральним розподілом під час сканування КТ-ВРЗ. Центролобулярні вузлики та картина «дерева в бруньці» є ознаками рецидивуючої аспірації.
Ступінь ІЗЛ, який виявляють на КТ-ВРЗ, негативно корелює з ФЖЄЛ і є потужним предиктором виживання.
Бронхоальвеолярний лаваж (БАЛ) пацієнтам із ССД та підозрою на ІЗЛ показаний рідко [1, 2]. Його основна роль — виключити інші причини ІЗЛ. Однак пацієнтам із ССД із атиповими ознаками, такими як лихоманка, продуктивний кашель, кровохаркання, еозинофілія периферичної крові або вогнищева консолідація на знімку грудної клітки, може бути показана бронхоскопія з БАЛ.
Діагноз ІЗЛ, пов’язаної з ССД, як правило, базується на наявності характерних ознак ІЗЛ за допомогою КТ-ВРЗ у пацієнта з відомою ССД та виключення інших етіологій захворювань легеневої паренхіми, таких як серцева недостатність, медикаментозно-індукована легенева токсичність, повторна аспірація або захворювання легеневих судин.
Після того, як ІЗЛ ідентифіковано на КТ-ВРЗ, рентгенологічну картину можна використовувати, щоб визначити, чи є вона типовою для найпоширенішого типу ССД-ІЗЛ, фіброзної НСІП чи іншого типу ІЗЛ, наприклад ЗІП.
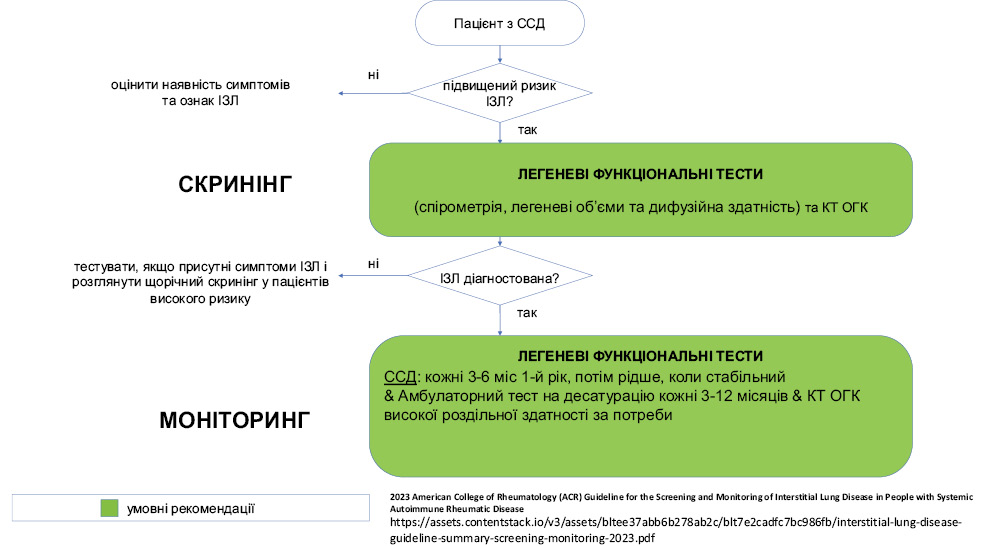
Скринінг пацієнтів із ССД із підвищеним ризиком розвитку ІЗЛ (умовні рекомендації) [1, 2] (рис. 1)
Рекомендуються:
- А. ЛФТ;
- Б. КТ-ВРЗ;
- В. Комбінації цих методів замість виконання лише ЛФТ;
- не проводити скринінг із застосуванням 6-ХТзХ.
Не рекомендується проводити рентгенографію органів грудної клітки (ОГК), амбулаторне визначення десатурації, бронхоскопію та хірургічну біопсію легень.
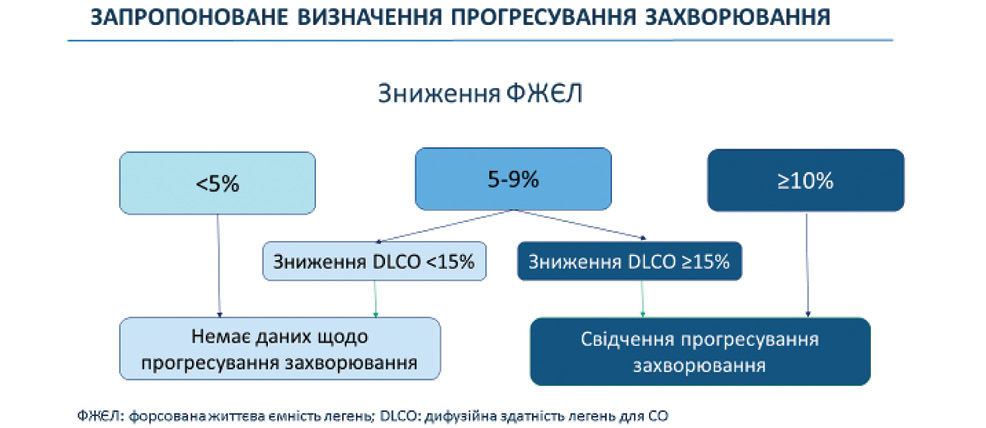
Прогресування ССД-ІЗЛ констатують за наявності таких ознак (рис. 2):
- збільшення вираженості симптомів або поява нових клінічних ознак ССД-ІЗЛ;
- зниження сатурації після тестів з навантаженням (6-ХТзХ);
- зниження ФЖЄЛ, DLCO (оцінка в динаміці);
- підвищення ступеня ураження легень або поява/прогресування фіброзу на КТ-ВРЗ.
У пацієнта з ІЗЛ (крім ІЛФ), який має рентгенологічні ознаки легеневого фіброзу, прогресуючий легеневий фіброз (ПЛФ) визначається як принаймні 2 з наступних 3 критеріїв, що виникли протягом останнього року без альтернативного пояснення: комбінація збільшення вираженості респіраторних симптомів, фізіологічних або рентгенологічних ознак прогресування захворювання [9].
Фізіологічні ознаки прогресування захворювання ґрунтуються на абсолютному зниженні ФЖЄЛ ≥5% протягом 1 року спостереження та/або абсолютному зниженні DLCO ≥10% протягом 1 року спостереження.
Радіологічні ознаки прогресування захворювання ґрунтуються на появі або збільшеному розмірі фіброзних ознак на КТ-ВРЗ, а саме[9]:
- підвищення ступеня або тяжкості тракційних бронхоектазів і бронхоектазів;
- нове матове помутніння з тракційними бронхоектазами;
- нова тонка сітка;
- збільшення або підвищення товщини ретикулярної аномалії;
- нові або збільшені соти.
ПОЧАТОК ТЕРАПІЇ
Оптимальне лікування ССД-ІЗЛ невідоме. Базуючись на наявних доказах, рекомендовано розпочати імуносупресивну терапію у пацієнтів із симптоматичною ССД-ІЗЛ та ознаками, які свідчать про високу ймовірність прогресування. Мофетилу мікофенолату (ММФ) надають перевагу в якості початкової терапії порівняно з циклофосфамідом через кращий профіль безпеки та порівнянну ефективність, як описано в наступних розділах. Азатіоприн є альтернативою, яку можна розглянути для пацієнтів з протипоказаннями або непереносимістю циклофосфаміду та ММФ.
Показання. Точні критерії для початку імуносупресивної терапії ССД-ІЗЛ не встановлено, і рішення про початок терапії може бути складним, оскільки переваги терапії є скромними, а токсичність — значною. Оскільки у багатьох пацієнтів із ССД-ІЗЛ відмічають стабільний перебіг або хворобу, що повільно прогресує, вибір відповідної терапії потребує балансу між уникненням потенційно токсичних засобів у цих пацієнтів і наданням терапії тим, у кого найімовірніше прогресування. Особливості, пов’язані з прогресуванням захворювання легень, описані нижче (табл. 1).
Таблиця 1. Особливості ССД-ІЗЛ з підвищеною ймовірністю прогресування захворювання
| 1. Тривалість захворювання <4 років |
| 2. Дифузний шкірний системний склероз |
| 3. Функціональні легеневі тести |
| ФЖЄЛ <65% |
| DLCO <55% |
| 4. КТ-ВРЗ |
| ІЗЛ, що уражує >20% легень |
| 5. Серологічні зміни |
| Антитіла до топоізомерази I (анти-Scl-70) |
Вважається, що пацієнти, швидше за все, отримають користь від терапії, якщо її розпочати на ранніх стадіях захворювання, до того, як виявлена суттєва втрата функції легень. Приблизно у половини пацієнтів із ССД, що прогресує, при ІЗЛ найшвидше зниження ФЖЄЛ відбувається протягом перших 3 років від початку захворювання, що вказує на те, що пошкодження легень і фіброз можуть бути ранніми ускладненнями.
Особливості, пов’язані з прогресуванням ІЗЛ, включають наступне:
- тривалість ІЗЛ. Згідно з даними спостережень, пацієнти з ранньою ССД-ІЗЛ частіше мають активне запалення та реагують на фармакологічне втручання імуносупресивними препаратами, ніж пацієнти з тривалим захворюванням. Хоча немає єдиної думки щодо того, як слід визначати раннє захворювання, зазвичай це стосується початкових 12–24 міс захворювання ССД до встановлення значного незворотного фіброзу органів;
- легенева функція. При ССД-ІЗЛ не підтверджено жодних специфічних показників ЛФТ як тригерів для початку терапії. Серії тестів, які демонструють погіршення легеневої функції (наприклад ≥10% зниження ФЖЄЛ або DLCO), є ознакою активного захворювання, для якого слід розглянути можливість початку лікування. ЛФТ, що демонструють рестриктивний вентиляційний дефект (тобто зниження ЖЄЛ, що часто супроводжується зниженням ФЖЄЛ, зі збереженим ОФВ1 до ФЖЄЛ) і зниження DLCO відповідають ССД-ІЗЛ;
- КТ-ВРЗ. Дає можливість виявити ІЗЛ та ступінь ураження легень, а також може вказувати на прогресування захворювання. Наявність радіологічного фіброзу легень у пацієнтів із ССД на початковому етапі підвищує ризик смерті навіть серед тих, у кого збережена примусова ЖЄЛ.
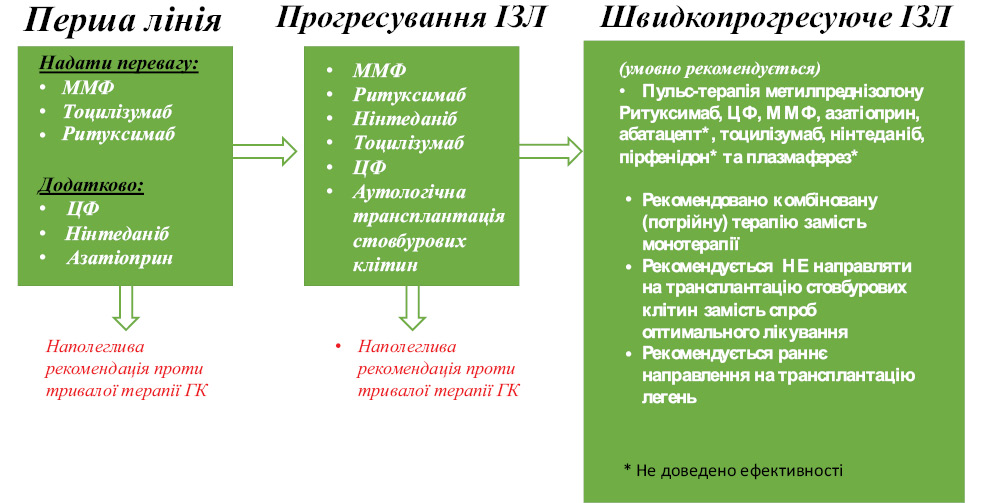
Початкова терапія [1, 2] — для пацієнтів із ССД-ІЗЛ, в яких відмічають респіраторні симптоми, аномальну та/або знижену легеневу функцію, візуалізаційні докази ІЗЛ та відсутність ознак активної інфекції, рекомендовано MMФ як початкову терапію, а не інші варіанти (ступінь 2C), виходячи з відносно хорошого профілю побічних ефектів і тривалості клінічного досвіду застосування цього засобу; однак тоцилізумаб і циклофосфамід є розумною альтернативою для окремих пацієнтів (табл. 2; рис. 3).
Таблиця 2. Препарати 1-ї лінії при лікуванні ССД-ІЗЛ
| Препарати 1-ї лінії | |
|---|---|
| Надати перевагу | Тоцилізумаб |
| ММФ | |
| Ритуксимаб | |
| Додатково | Азатіоприн |
| Циклофосфамід | |
| Нінтеданіб | |
| Наполеглива рекомендація проти глюкокортикоїдів | |
Вибір початкового засобу — після ухвалення рішення про початок терапії ІЗЛ рекомендовано використовувати ММФ замість циклофосфаміду як початкову терапію, ґрунтуючись на доказах порівнянної ефективності та кращого профілю побічних ефектів для ММФ.
Тоцилізумаб схвалений Управлінням з контролю за харчовими продуктами та лікарськими засобами США (Food and Drug Administration — FDA) для уповільнення темпів зниження легеневої функції у пацієнтів із ССД-ІЗЛ і має хороший профіль безпеки. Тоцилізумаб можна розглядати як альтернативу ММФ для початкової терапії.
Циклофосфамід — менш оптимальна альтернатива лікування ММФ або тоцилізумабом при ССД-ІЗЛ через підвищений ризик побічних ефектів, пов’язаних із циклофосфамідом. При застосуванні циклофосфаміду для лікування ССД-ІЗЛ рекомендовано надавати перевагу внутрішньовенному введенню щомісяця протягом 6 міс, а не пероральному щоденному дозуванні протягом 12 міс. Внутрішньовенна терапія дозволяє знизити кумулятивну дозу, рідше викликає побічні ефекти та має здатність забезпечити адекватну гідратацію перед введенням дози (щоб знизити ризик розвитку геморагічного циститу). Після завершення лікування циклофосфамідом пацієнти зазвичай переходять на схему підтримувального лікування менш токсичним препаратом (наприклад ММФ, тоцилізумабом або азатіоприном).
Ад’ювантні глюкокортикоїди — роль ад’ювантної низької дози пероральних глюкокортикоїдів (еквівалент ≤10 мг/добу преднізолону) у комбінації з циклофосфамідом остаточно не встановлена.
Рекомендовано уникати комбінування високих доз глюкокортикоїдів з циклофосфамідом через відсутність даних клінічних досліджень і супутні ризики розвитку ниркового кризу при ССД та опортуністичної інфекції [1, 2].
Азатіоприн. Азатіоприн менш ефективний як початкова терапія ССД-ІЗЛ, ніж циклофосфамід і, як наслідок, ММФ, хоча його не порівнювали прямо з ММФ. Азатіоприн безпосередньо не порівнювався з тоцилізумабом.
ПІДТРИМУвальнА ТЕРАПІЯ
Після курсу первинної терапії імуномодулюючу терапію зазвичай продовжують від місяців до років. Не відомі ні оптимальний вибір засобу для підтримувальної терапії, ні тривалість лікування.
Частково обґрунтування довгострокової терапії полягає в тому, що покращення функції легень, пов’язане з циклофосфамідом, здається, зникає через 12 міс після припинення проведення активної терапії [1, 2].
Тоцилізумаб є альтернативою ММФ для підтримувальної терапії, що ґрунтується на тривалому застосуванні при ревматоїдному артриті, хоча його тривале застосування при ССД-ІЗЛ офіційно не вивчалося. Підтримувальне лікування цим препаратом є доцільним у пацієнтів, які відчули початкову користь від тоцилізумабу та не мають жодних побічних ефектів.
Підтримувальну терапію, як правило, продовжують до тих пір, поки пацієнт не відчує тривалий період стабільності (принаймні 12–24 міс) респіраторних симптомів і функції або не розвинеться захворювання, що прогресує (що спонукає до розгляду альтернативного засобу). Однак оптимальна тривалість імуносупресивної терапії невідома. Під час підтримувальної терапії ад’ювантні глюкокортикоїди зазвичай призначаються пацієнтам, які мають позалегеневі показання до їх застосування, такі як артрит або свербіж.
ЗАХВОРЮВАННЯ, що прогресує [1, 2]
Таблиця 3. Лікування ІЗЛ, що прогресує, після недостатньо ефективної терапії препаратами 1-ї лінії
|
ММФ Ритуксимаб Нінтеданіб Тоцилізумаб Циклофосфамід Аутологічна трансплантація гемопоетичних стовбурових клітин |
| Направити для оцінки необхідності трансплантації легень у відповідний час при прогресуванні хвороби |
| Сильна рекомендація проти тривалої терапії глюкокортикоїдів |
Загальний підхід — для пацієнтів із ССД, у яких відмічена втрата легеневої функції, що проггресує, незважаючи на лікування вищезазначеними препаратами (табл. 3), рекомендовано використовувати декілька препаратів. Перед початком іншої терапії з приводу ССД-ІЗЛ цих пацієнтів слід повторно оцінити для потенційних причин відсутності клінічного поліпшення стану, таких як інші ускладнення захворювання (наприклад аспіраційний пневмоніт, захворювання плеври або перикарда, легенева гіпертензія) [4] або супутнє захворювання (наприклад тромбоемболія захворювання та хронічне обструктивне захворювання легень — ХОЗЛ).
Хвороба, що прогресує. Пацієнтам, в яких захворювання є резистентним до імуномодулюючих препаратів, рекомендовано додати нінтеданіб або ритуксимаб до поточної терапії (наприклад циклофосфамід або ММФ) (клас 2C). У пацієнтів, у яких домінують ознаки фіброзу за даними візуалізації легень, ефективнішим є нінтеданіб, тоді як у пацієнтів, у яких домінують ознаки запалення, вищий ефект слід очікувати від ритуксимабу. На практиці комбінація ММФ та нінтеданібу часто переноситься погано (зазвичай через діарею), тому часто використовують зниження дози.
Трансплантація гемопоетичних стовбурових клітин. Імуносупресивна терапія з наступною аутологічною трансплантацією гемопоетичних стовбурових клітин (ТГСК) показала користь у деяких пацієнтів із тяжкою дифузною ССД. Враховуючи смертність і захворюваність, пов’язані з ТГСК, ці процедури найкраще виконувати в спеціалізованих центрах зі значним досвідом проведення цієї процедури. Аутологічна ТГСК у пацієнтів із ССД більш детально розглядається окремо.
Трансплантація легень. Трансплантація легень може бути варіантом для ретельно відібраних пацієнтів ССД з тяжкою ІЗЛ, яка не реагує на фармакологічні втручання. Однак ретельна оцінка позалегеневого захворювання, пов’язаного з ССД (наприклад неконтрольована аспірація через захворювання стравоходу, нирок або серця), яке може погіршити переносимість трансплантації легені, є важливою. Хоча порушення моторики стравоходу та гастроезофагеальний рефлюкс потребують ретельної оцінки, вони не обов’язково є протипоказанням до трансплантації, якщо вони добре контролюються.
Рекомендації щодо ведення ССД із ІЗЛ, що швидко прогресує [1, 2]
Пацієнтам із ССД-ІЗЛ, що швидко прогресує, умовно рекомендуються:
- пульс-терапія метилпреднізолону;
- ритуксимаб, циклофосфамід, внутрішньовенні імуноглобуліни, ММФ;
- азатіоприн, абатацепт, тоцилізумаб, нінтеданіб, пірфенідон та плазмаферез;
- комбінована терапія замість монотерапії;
- рекомендується не направляти на ТГСК замість спроб оптимального медичного лікування;
- рекомендується раннє направлення на трансплантацію легень.
Профілактика. Рекомендовано проводити профілактику пневмонії, викликаної Pneumocystis jirovecii, у пацієнтів, які отримують циклофосфамід, як описано окремо. Така профілактика є менш необхідною та менш регулярною для пацієнтів, які отримують лише ММФ або тоцилізумаб.
Моніторинг. Зміни в симптомах пацієнта, суб’єктивній толерантності до фізичних навантажень і легеневій функції контролюються приблизно кожні 3–6 міс. Серійні КТ-ВРЗ не проводяться рутинно, лише за наявності клінічних показань. Для пацієнтів, у яких захворювання стабілізується або його вираженість зменшується, підтримувальну терапію продовжують, доки поліпшення не досягне плато, після чого можна розглядати поступове припинення терапії [1, 2].
Моніторинг:
- легеневі функціональні тести кожні 3–6 міс;
- відсутні рекомендації щодо частоти рутинної КТ-ВРЗ (лише за наявності клінічних показань);
- комбінація цих методів, замість виконання лише ЛФТ;
- амбулаторне тестування десатурації після 6-хвилинної ходи — кожні 3–12 міс;
- умовно НЕ рекомендуються рентгенографія ОГК, 6-ХТзХ та моніторинг за допомогою бронхоскопії.
МОНІТОРИНГ РЕАКЦІЇ НА ТЕРАПІЮ [1, 2]
Оптимальні інструменти та час для оцінки відповіді на лікування у пацієнтів із ССД-ІЗЛ невідомі. Рекомендовано спочатку принаймні щомісяця оцінювати стан пацієнтів на наявність побічних ефектів терапії. За відсутності побічних ефектів, пов’язаних із прийомом препарату, рекомендовано оцінювати респіраторні симптоми, суб’єктивну толерантність до фізичних навантажень, фізикальний огляд і тести легеневої функції (наприклад спірометрію, DLCO, 6-ХТзХ) щомісячно. КТ-ВРЗ грудної клітки рідко повторюється з метою моніторингу, оскільки немає даних, які підтверджують використання серійної КТ-ВРЗ у цій ситуації. Зазвичай слід проводити контрольну КТ-ВРЗ лише у відповідь на зміну симптомів або тестів легеневої функції, або коли виникає занепокоєння щодо легеневої інфекції чи раку легені.
Оцінка респіраторної відповіді на терапію є складною, оскільки:
- покращення, як правило, відбувається повільно;
- невеликі зміни в симптомах, функції легень та/або на рентгенограмі можуть бути замасковані ефектом наявного фіброзу;
- стабілізація функції легень, а не покращення, може бути найкращим результатом, якого можна очікувати [1, 2].
Кількісна КТ-ВРЗ, дослідницький інструмент, який використовує комп’ютерне моделювання для кількісної оцінки розміру ретикулярних змін, «матового скла» та стільникових структур, здається, є чутливим індикатором прогресування захворювання та відповіді на лікування.
Важливо пам’ятати, що збільшення вираженості респіраторних симптомів або показників легеневої функції при ССД може свідчити про розвиток іншого ускладнення захворювання, наприклад легеневої гіпертензії, аспірації або плеврального випоту [4]. Клінічні прояви та оцінка інших легеневих ускладнень ССД обговорюються окремо.
ПІДТРИМУвальнА ТЕРАПІЯ
Пацієнти з ССД-ІЗЛ повинні отримувати ту саму підтримувальну терапію, яка використовується для лікування інших типів ІЗЛ. Ці заходи включають:
- припинення куріння сигарет;
- додатковий кисень, залежно від пульсового насичення киснем;
- щорічна вакцинація проти грипу;
- вакцинація проти SARS-CoV-2 (COVID-19);
- вакцинація проти пневмококової інфекції відповідно до віку (PPS23 і PCV13).
Легенева реабілітація також може бути корисною для зменшення задишки та покращення переносимості фізичних вправ.
Гастроезофагеальний рефлюкс та аспірація. Шлунково-кишкові прояви склеродермії є поширеними і включають шлунково-кишковий рефлюкс (гастроезофагеальна рефлюксна хвороба — ГЕРХ) і порушення моторики стравоходу. Рекомендовано агресивне лікування ГЕРХ при ССД-ІЗЛ, особливо за наявності ознак або симптомів зі зміною способу життя (наприклад піднімати узголів’я ліжка на 30°, уникати прийому їжі та вживання алкоголю за 2 год до сну) для пацієнтів з підозрою на мікроаспірацію на підставі наявних симптомів або результатів КТ, що вказують на аспірацію [1, 2].
Підтримувальна терапія
Тривалість лікування ММФ точно не встановлена. Як правило, підтримувальне лікування триває щонайменше 24 міс, а часто — кілька років.
ПРОГНОЗ
У пацієнтів із ССД наявність ІЗЛ є прогнозом підвищення смертності. Це проілюстровано ретроспективним дослідженням за участю 953 пацієнтів із ССД; 9-річна виживаність пацієнтів із тяжким ІЗЛ становила близько 30%, у той час як у пацієнтів із ССД, які не мали серйозного ураження системи органів, цей показник становив 72%. ПЛФ — це основний предиктор несприятливих результатів госпіталізації у пацієнтів із ССД. Лікарняна смертність при ПЛФ становить 2,63 (95% довірчий інтервал 1,98–3,49) [11].
Невирішені питання та перспективи
Стосовно діагностики, прогнозування перебігу і лікування ССД-ІЗЛ донині залишається багато нерозв’язаних питань. КТ-ВРЗ та DLCO, залишаючись золотим стандартом верифікації діагнозу ІЗЛ, виконуються недостатньо часто або залишаються недоступними в більшості закладів в Україні, тоді як застосування гістологічних критеріїв є інвазивним та не завжди використовується в рутинній практиці.
З метою стандартизації діагностичних та терапевтичних підходів до ССД-ІЗЛ необхідні великі проспективні дослідження та створення масштабних регістрів. Для виявлення пацієнтів високого ризику і кандидатів на проведення трансплантації легень найбільш перспективним є створення спеціальних регістрів таких хворих. Необхідні дослідження, спрямовані на вивчення патогенних механізмів розвитку ураження легень при ССД. І, нарешті, уніфікація підходів до діагностики і клінічного моніторингу хворих на ССД-ІЗЛ може удосконалити тактику ведення і підвищити частоту виживання таких пацієнтів.
Список використаної Літератури
- 1. 2023 American College of Rheumatology (ACR) Guideline for the Screening and Monitoring of Interstitial Lung Disease in People with Systemic Autoimmune Rheumatic Disease. assets.contentstack.io/v3/assets/bltee37abb6b278ab2c/blt7e2cadfc7bc986fb/interstitial-lung-disease-guideline-summary-screening-monitoring-2023.pdf
- 2. 2023 American College of Rheumatology (ACR) Guideline for the Treatment of Interstitial Lung Disease in People with Systemic Autoimmune Rheumatic Disease. assets.contentstack.io/v3/assets/bltee37abb6b278ab2c/bltaedebda97a351d47/interstitial-lung-disease-guideline-summary-treatment-2023
- 3. Bellocchi et al. (2022) Predicting the Progression of Very Early Systemic Sclerosis: Current Insights. Research and Reviews,:14: 171–186.
- 4. Chang B., Wigley F.M., White B. et al. (2003) Scleroderma patients with combined pulmonary hypertension and interstitial lung disease. J. Rheumatol.; 30(11): 2398.
- 5. Goldin J.G., Lynch D.A., Strollo D.C. et al. Scleroderma Lung Study Research Group (2008) High-resolution CT scan findings in patients with symptomatic scleroderma-related interstitial lung disease.Chest.; 134(2): 358. Epub. 2008 Jul 18.
- 6. Khanna D., Tashkin D.P., Denton C.P. et al. (2020) Etiology, Risk. Factors and Biomarkers in Systemic Sclerosis with Interstitial Lung Disease. Am. J. Respir. Crit. Care Med.; 201(6): 650.
- 7. Liakouli V., Ciancio A., Del Galdo F. et al. (2023) Systemic sclerosis interstitial lung disease: unmet needs and potential solutions. Nat. Rev. Rheumatol., 20, 21–32 (2024). doi.org/10.1038/s41584-023-01044-x
- 8. Molberg Ø., Hoffmann-Vold A.M. (2016) Interstitial lung disease in systemic sclerosis: progress in screening and early diagnosis.Curr. Opin. Rheumatol.; 28: 613–618.
- 9. Raghu G., Remy-Jardin M., Richeldi L. et al. (2022) Idiopathic Pulmonary Fibrosis (an Update) and Progressive Pulmonary Fibrosis in Adults: An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am. J. Respir. Crit. Care Med. May 1; 205(9): e18-e47. doi: 10.1164/rccm.202202-0399ST. PMID: 35486072; PMCID: PMC9851481.
- 10. Showalter K., Hoffmann A., Rouleau G. et al. (2018) Performance of Forced Vital Capacity and Lung Diffusion Cutpoints for Associated Radiographic Interstitial Lung Disease in Systemic Sclerosis. J. Rheumatol.; 45(11): 1572. Epub 2018 Oct 1.
- 11. Steen V.D., Medsger T.A. (2007) Changes in causes of death in systemic sclerosis, 1972–2002. Ann. Rheum. Dis.; 66: 940–942.
- 12. Zanatta E., Huscher D., Ortolan A.et al. (2022) EUSTAR collaborators Phenotype of limited cutaneous systemic sclerosis patients with positive anti-topoisomerase I antibodies: data from the EUSTAR cohort. Rheumatology (Oxford); 61(12): 4786.
Адреса для листування:
dzhusm@yahoo.co.uk

Leave a comment