МОЖЛИВОСТІ ПРОГНОЗУВАННЯ РОЗВИТКУ КАРДІО- та ЦЕРЕБРОВАСКУЛЯРНИХ УСКЛАДНЕНЬ У ХВОРИХ НА РЕВМАТОЇДНИЙ АРТРИТ
Коваленко В.М.1, Лисенко Г.І.2, Хіміон Л.В.2, Гармиш О.О.3
- 1
- 2Інститут сімейної медицини Національної медичної академії післядипломної освіти ім. П.Л. Шупика МОЗ України
- 3Національний науковий центр «Інститут кардіології ім. М.Д. Стражеска» НАМН України
Резюме. Мета дослідження — визначити найбільш значимі фактори, які можуть використовуватися для прогнозування розвитку кардіо- та цереброваскулярних ускладнень у хворих на ревматоїдний артрит (РА). Розробити модель прогнозу розвитку судинних ускладнень для цього контингенту хворих. У 180 хворих на РА віком до 50 років визначено значення традиційних факторів ризику серцево-судинних захворювань та ряду показників імунного і цитокінового статусу, активності запального процесу та особливостей медикаментозної терапії для прогнозування розвитку кардіо- та цереброваскулярних ускладнень. Розроблено алгоритм прогнозування розвитку судинних ускладнень у хворих на РА шляхом оцінки визначених найбільш прогностично значимих факторів у балах. У хворих на РА віком до 50 років передчасне прискорене атеросклеротичне ураження судин, яке є компонентом системних проявів захворювання, приводить до значного підвищення частоти розвитку кардіо- та цереброваскулярних подій і захворювань, розвиток яких можна з достатньою достовірністю прогнозувати із використанням бальної оцінки найбільш впливових прогностичних факторів, виділених авторами.
Вступ
За даними світової медичної статистики, протягом останніх 25–30 років однією з основних причин смерті в популяції хворих на ревматоїдний артрит (РА) є розвиток серцево-судинної патології, патогенетично пов’язаної з атеросклеротичним ураженням судин і його ускладненнями (ішемічна хвороба серця (ІХС), гострий коронарний синдром (ГКС), інфаркт міокарда (ІМ); церебральні судинні катастрофи) (Watson D.J. et al., 2003; Solomon D.H. et al., 2004; Maradit-Kremers H. et al., 2005; 2008).
На сучасному етапі відзначається зменшення тривалості життя хворих на РА із коливанням стандартизованого показника смертності в межах 0,87–3,0 (van Doornum S. et al., 2002). Дані метааналізу за результатами 24 досліджень смертності в популяції хворих на РА, опублікованих між 1970 і 2005 р., свідчать, що смертність від усіх причин і від серцево-судинних захворювань (ССЗ) у пацієнтів із РА достовірно перевищує популяційні вікові показники, як у хворих чоловіків, так і у жінок (Avina-Zubeta J.A. et al., 2008), а частота раптової серцевої смерті серед хворих на РА майже в 2 рази перевищує популяційний показник (Maradit-Kremers H. et al., 2005).
ССЗ — основна причина смерті хворих на РА як у клінічних, так і популяційних дослідженнях (van Doornum S., et al., 2002; Solomon D.H. et al., 2003): судинні події (в тому числі, ІХС та інсульт) є причиною смерті близько 40% хворих на РА, ССЗ спричиняють понад 50% причин передчасної смерті в цій когорті хворих (Goodson N., Symmons D., 2002; Gabriel S.E. et al., 2003; Gonzalez A. et al., 2007).
Відносний ризик смерті від ССЗ при РА є найвищим у дорослих хворих жінок молодого віку (до 55 років) (Solomon D.H. et al., 2006; Holmqvist M.E. et al., 2010), при цьому ризик ще більше зростає у разі серопозитивного варіанта захворювання (як за наявністю ревматоїдного фактора (РФ) (Goodson N.J. et al., 2002; Naz S.M. et al., 2008), так і за наявністю антитіла до циклічного цитрулінового пептиду (антиССР-ат)) (Farragher T.M. et al., 2008).
Епідеміологічні дослідження вказують на підвищення ризику розвитку ІХС та будь-яких серцево-судинних подій у хворих на РА в 1,5 раза порівняно із середньопопуляційним показником (Solomon D.H. et al., 2003; Watson D.J. et al., 2003; Maradit-Kremers H. et al., 2005). У багатьох дослідженнях показано, що ризик зростає практично відразу після клінічної маніфестації РА і зберігається підвищеним надалі (Goodson N.J. et al., 2002; Avina-Zubieta J.A. et al., 2008; Radovits B.J. et al., 2010). Так, за даними проспективного популяційного дослідження Рочестер (Rochester Epidemiology Project, REP), за 2-річний період після встановлення діагнозу РА (за критеріями Американського коледжу ревматологів (АКР) 1987 р.) ризик госпіталізації з приводу ІМ, а також розвитку німого ІМ був достовірно вищим у хворих на РА, ніж у їх однолітків із загальної популяції (Melton L.J., 1996; Maradit-Kremers H. et al., 2005). Навпаки, за даними дослідження (Holmqvist M.E. et al., 2009), проведеного на двох великих когортах пацієнтів у Швеції, не виявлено підвищення захворюваності на ІМ, ССЗ, хронічну серцеву недостатність (ХСН) безпосередньо перед розвитком клінічної симптоматики РА, що підтверджує надзвичайно важливу патогенетичну роль факторів, асоційованих із РА, у розвитку прогресуючого атеросклерозу, ССЗ та їх ускладнень.
Аналіз смертності хворих на РА з когорти Рочестерського дослідження (Rochester Epidemiologic Study, REP) (Gabriel S.E. et al., 2003; Nicola P.J. et al., 2005) також продемонстрував, що за 40 років спостереження тривалість життя і смертність хворих практично не змінилися. Важливо відзначити, що за даними REP також показано, що при однаковій поширеності традиційних факторів ризику ССЗ у популяції хворих на РА і порівнюваній за віком популяції населення без РА і ССЗ на початку дослідження (за винятком тютюнопаління, яке було більш поширеним серед хворих) абсолютний ризик розвитку серцево-судинних подій (визначено в цьому дослідженні як проведення процедури реваскуляризації, розвиток ІМ, СН, кардіальна раптова смерть) був достовірно вищим серед хворих на РА, причому ризик у хворих на РА був приблизно таким, як у осіб групи контролю, які були на 10 років старші.
Опубліковані результати лікування і виживаності хворих на РА після перенесеного ІМ демонструють також підвищення ризику смерті та розвитку ХСН порівняно із особами без ревматичних захворювань (Sodergren A. et al., 2007), хоча, за даними деяких авторів, такі результати можуть бути пов’язані з нижчою частотою застосування у хворих на РА аортокоронарного шунтування і призначення лікарських засобів для вторинної профілактики ССЗ (van Doornum S. et al., 2010).
ХСН розвивається у хворих на РА частіше, ніж у популяції; подвійне підвищення ризику мають пацієнти із РА із серопозитивним варіантом захворювання (Watson D.J. et al., 2003; Maradi-Kremers H. et al., 2005; Nicola P.J. et al., 2005). При цьому, як і при ІМ, лікування ХСН у хворих на РА є менш ефективним, пацієнти одержують менш активну терапію, смертність від ХСН перевищує популяційні показники, причому подвійне підвищення ризику смерті реєструється відразу після встановлення діагнозу ХСН (Davis J.M. et al., 2008; Maradit-Kremers H. et al., 2008).
Таким чином, дані статистичних, клініко-епідеміологічних та популяційних досліджень однозначно свідчать, що хворі на РА мають підвищений ризик розвитку ССЗ та їх ускладнень, у тому числі летальних, що приводить до зменшення тривалості життя цих пацієнтів. Важливо відзначити, що незважаючи на успіхи ревматології в лікуванні РА, різниця у тривалості життя хворих на РА і загальної популяції продовжує зростати (Goodson N., Symmons D., 2002; Gabriel S.E et al., 2003; Gonzalez A. et al., 2007).
У такій ситуації надзвичайно важливим є визначення факторів, які впливають на формування і агресивний перебіг атеросклерозу, розвиток ССЗ та їх ускладнень у цих групах хворих, для вчасного виявлення осіб із підвищеним ризиком і проведення активних діагностичних, лікувально-профілактичних втручань.
Експертні групи EULAR, ACR, Британської асоціації ревматологів рекомендують проводити підвищення ризику, визначеного за допомогою системи SCORE при роботі з ревматологічними хворими у 1,5–2 рази або розглядати СЧВ як еквівалент діагностованої ІХС, хоча чіткі доказові рекомендації щодо такого підходу не розроблені (Simmons D., Bruce I., 2006; Peters M.J. et al., 2010), а результати опублікованих контрольованих клінічних досліджень в основному стосуються хворих із країн із низьким загальним ризиком розвитку серцево-судинної патології, до яких Україна, на жаль, не відноситься. Водночас встановлено, що і в загальній популяції серед населення віком 40–55 років, особливо жіночої статі, величина ризику, визначеного за SCORE погано корелює із реальним ризиком ІМ, визначеним за результатами підрахунку кальцинатів у коронарних артеріях за методом однофотонної комп’ютерної томографії (Mahoney L.T. et al., 2001; Mosca L. et al., 2004). Для населення віком до 40 років валідні системи оцінки кардіоваскулярного ризику взагалі не розроблені.
Водночас завдяки масштабним популяційним дослідженням накопичується все більше доказів участі ряду індикаторів запального процесу та прозапальних цитокінів (С-реактивного білка (СРБ), амілоїда А, інтерлейкіна (IL)-6, фактора некрозу пухлини (TNF)-α в патогенезі розвитку ССЗ, зокрема ІХС, ХСН та їх ускладнень; доведено роль СРБ як фактора ризику смерті від ІХС, виникнення симптомної ІХС, першого ІМ, інсульту, симптомного атеросклерозу периферичних артерій (Pearson T.A. et al., 2003; Ridker P.M., 2003; Willerson J.T., Ridker P.M., 2004; Martins T.B. et al., 2006). У дослідженні CARE, крім того, продемонстровано значне підвищення ризику повторного ІМ у осіб із більш високими рівнями СРБ (Ridker P.M. et al., 2000a), виявлено також 2-разове підвищення ризику всіх судинних подій у осіб із рівнем СРБ, що відповідав верхньому квартилю вимірювань, незалежно від наявності інших факторів ризику. Важливо відзначити, що СРБ показав однакову прогностичну значимість як для чоловіків, так і для жінок, навіть за відсутності гіперхолестеринемії. Схожі дані щодо підвищення ризику розвитку ІХС, ІМ, смерті від серцево-судинних подій одержані також щодо IL-6 (Ridker P.M. et al., 2000b) і TNF-α (Martins T.B. et al., 2006). Дослідження CARE (Ridker P.M. et al., 2000a) також продемонструвало, що збільшення кількості TNF-α у плазмі крові, навіть і в межах лабораторної норми (до 5 пг/мл) є незалежним фактором ризику повторних коронарних подій у загальній популяції. Підвищений ризик розвитку ССЗ при цьому не залежить від рівня загального холестерину (ЗХС) і холестерину ліпопроїдів низької щільності (ХС ЛПНЩ), рівня артеріального тиску (АТ), наявності цукрового діабету.
У ряді клінічних досліджень продемонстровані також інші негативні кардіоваскулярні ефекти TNF-α. Наприклад, показано, що кількість цього цитокіну в плазмі крові значно збільшується у пацієнтів із симптомною ХСН (Ridker P.M. et al., 2000a). За результатами дослідження STANISLAS показано можливість застосування TNF-α як маркера підвищеного ризику атеросклерозу разом із СРБ та IL-6. Продемонстровано роль IL-6 і TNF-α як незалежних предикторів смертності у хворих на ХСН (Dinh W. et al., 2009). У пацієнтів із ІХС та піддослідних тварин показано підвищення синтезу TNF-α та IFN-γ в міокарді у відповідь на ішемію; виявлено, що таке підвищення рівня TNF-α може бути причиною повторних ішемічних подій як в ранній період після перенесеного ІМ, так і пізніше (Ridker P.M. et al., 2000), а також фактором, що сприяє розвитку дисфункції лівого шлуночка (Dinh W. et al., 2009). Інші дослідники (von Haehling S. et al., 2004) вказують також на участь IL-1, IL-4, IL-6 у розвитку ГКС. Водночас залишається остаточно нез’ясованим, чи є підвищення рівня циркулюючих прозапальних цитокінів причиною виникнення або більш тяжкого перебігу ССЗ, чи наслідком формування патології.
Європейськими та українськими експертами в рекомендаціях щодо профілактики ССЗ рекомендується разом із традиційними факторами ризику враховувати ряд нетрадиційних — зокрема рівень СРБ, товщину комплексу інтима-медіа (ТКІМ) сонних артерій (Graham I. et al., 2007; Коваленко В.М., Лутай М.І. (ред.), 2011), водночас чітких рекомендацій щодо методики врахування цих факторів для визначення індивідуального ризику не надається.
Таким чином, визначення факторів, що впливають на прогресування субклінічного атеросклерозу і розвиток судинних ускладнень у пацієнтів із аутоімунними захворюваннями, зокрема РА, не лише дозволить розробити підходи до профілактики ССЗ у осіб із ревматичними захворюваннями але й надасть важливу наукову інформацію щодо ролі імунологічних, запальних та інших факторів у розвитку ССЗ та їх ускладнень у загальній популяцій населення.
Мета дослідження — визначити найбільш прогностично значимі фактори та розробити алгоритм прогнозування розвитку кардіо- і цереброваскулярних подій у хворих на РА.
Об’єкт і методи дослідження
Дослідження проведено у групі хворих на РА (180 осіб, жінок — 146, чоловіків — 34; середній вік — (27–49) 44,53 року), які лікувались і спостерігались у Київській обласній клінічній лікарні та на кафедрі сімейної медицини Національної медичної академії післядипломної освіти ім. П.Л. Шупика у період 2005–2009 рр. У дослідження включали осіб зі встановленим діагнозом РА віком до 50 років із тривалістю захворювання до 7 років без наявності супутніх ССЗ, СН, перенесених цереброваскулярних подій, нефротичного синдрому, цукрового діабету, порушень функції щитоподібної залози, артеріальної гіпертензії (АГ), тромбозу; інших запальних захворювань, онкологічної патології на момент початку дослідження; 5,6% хворих на РА в анамнезі мали ураження серця (міокардит).
Усім учасникам додатково до загальноклінічного і загальноревматологічного обстеження із визначенням індексу активності основного захворювання (DAS28) проводили анкетування для виявлення наявності спадкових факторів ризику атеросклерозу, стилю життя (рівень фізичної активності, харчові звички, тютюнопаління); антропометрію — визначення індексу маси тіла (ІМТ), вимірювання окружності талії (ОТ); визначення симптомів та ознак ІХС (опитувальник Роуза, ЕКГ, ехоКГ, черезстравохідна електрокардіостимуляція — за показаннями); визначали показники ліпідного обміну (ЗХС, холестерин ліпопротеїдів високої щільності — ХС ЛПВЩ, ХС ЛПНЩ, холестерин ліпопротеїдів дуже низької щільності — ХС ЛПДНЩ, індекс атерогенності — ІА). Визначали показники імунного (CD3, CD4, CD8, CD4/CD8-імунорегуляторний індекс (ІРІ), CD16, CD20, CD25, CD56, CD95) і цитокінового статусу (IL-1b, IL-4, IL-6, IL-10, TNF-α), кількість інтерферону (IFN)-γ; показники проліферативної активності лімфоцитів (в реакції бласттрансформації (РБТЛ) з різними мітогенами); показники фагоцитарної активності нейтрофілів у НСТ-тесті. Для оцінки ендотеліальної дисфункції та ушкодження визначали кількість молекул судинної адгезії VCAM-1; аутоімунних процесів — РФ, антиССР-ат, антинуклеарні антитіла (АНА). Для визначення стану судинної стінки і моніторингу прогресування атеросклеротичного ураження проводили УЗ-обстеження сонних артерій за загальноприйнятою методикою із візуалізацією шарів судинної стінки, вимірюванням TКІМ та визначенням середнього значення ТКІМ без урахування товщини на рівні атеросклеротичної бляшки (АБ) при їх наявності (локальне потовщення КІМ >1,2 мм розцінювалось як АБ).
Клініко-лабораторні обстеження проводили усім хворим кожні 3–6 міс. Період спостереження в середньому становив 2 роки.
Після початкового обстеження і включення в дослідження всім хворим проводили корекцію медикаментозної терапії відповідно до показників активності запального процесу та комплексної оцінки стану хворого в динаміці. Для статистичної обробки одержаних результатів дослідження із врахуванням особливостей медикаментозної терапії хворих на РА розподілили на підгрупи залежно від режиму застосованої медикаментозної терапії (всього 6 режимів) (табл. 1). Пацієнта включали до тієї чи іншої підгрупи, якщо протягом більшої частини часу участі в дослідженні (≥75% часу) він приймав саме таке лікування. Таким чином, 50% включених у дослідження хворих застосовували як препарат базисної терапії метотрексат (режими 1 і 2), 26,67% — лефлуномід (режими 3 і 4). Хворі, яким з різних причин (розвиток побічних явищ, недостатня ефективність, бажання хворого) проводили зміни у складі базисної терапії, відносилися до режимів 5 і 6 (23,33%).
| № з/п | Склад медикаментозної терапії | Кількість хворих, n/% |
|---|---|---|
| 1 | Метотрексат (10–20 мг/тиж із фолієвою ксилотою 5 мг/тиж) + глюкокортикостероїди (5–30 мг/добу за преднізолоном) + нестероїдні протизапальні препарати (НПЗП) | 30/16,67 |
| 2 | Метотрексат (10–20 мг/тиж із фолієвою кислотою 5 мг/тиж) + НПЗП | 60/33,33 |
| 3 | Лефлуномід (20 мг/добу) + глюкокортикостероїди (5–30 мг/добу за преднізолоном) + НПЗП | 25/13,89 |
| 4 | Лефлуномід (20 мг/добу) + НПЗП | 23/12,78 |
| 5 | Зміна препаратів базисної терапії + глюкокортикостероїди (5–30 мг/добу за преднізолоном) + НПЗП | 18/10,0 |
| 6 | Зміна препаратів базисної терапії + НПЗП | 24/13,33 |
Результати та їх обговорення
За 24 міс спостереження і лікування у групі хворих на РА зареєстровано ряд судинних подій і діагностовано ряд захворювань у 36 (20,0%) осіб. Так, АГ розвинулась у 21 (11,8%) хворого; діагноз ІХС (стенокардія напруження І–ІІ функціонального класу) встановлено у 7 (3,92%) пацієнтів; діастолічна дисфункція лівого шлуночка за даними ехоКГ виявлена у 26 (14,44%) учасників; 3 (1,76%) хворих перенесли транзиторну ішемічну атаку (ТІА), 1 (0,56%) хвора — ішемічний інсульт, 1 (0,56%) хворий — переніс ІМ, 12 (6,67%) пацієнтів —міокардит.
Результати порівняльного аналізу даних обстеження хворих на РА із подальшим розвитком судинних ускладнень і без діагностованих ускладнень наведено в табл. 2.
| Показник | Хворі на РА без ускладнень (n=144) | Хворі на РА з ускладненнями (n=36) | р |
|---|---|---|---|
| Вік, років | 40,52±1,24 | 42,33±1,16 | 0,22 |
| Тривалість РА на початку дослідження, міс | 29,74±0,07 | 32,2±0,19 | 0,41 |
| DAS28, балів | 3,89±0,10 | 4,72±0,19 | 0,0002 |
| СРБ, мг/л | 21,02±1,67 | 33,28±3,13 | 0,001 |
| Позасуглобові прояви РА, % хворих | 43,75 | 72,22 | <0,0001 |
| ТКІМ на початку дослідження, мм | 0,75±0,0005 | 0,79±0,001 | <0,0001 |
| Збільшення ТКІМ за 24 міс, мм | 0,13±0,01 | 0,18±0,01 | 0,004 |
| Поява АБ за 24 міс, % осіб | 3,47 | 36,1 | <0,0001 |
| Середня кількість неліпідних традиційних факторів ризику ССЗ | 1,69±0,007 | 2,64±0,02 | <0,0001 |
| ЗХС, ммоль/л | 4,87±0,05 | 5,22±0,11 | 0,003 |
| ТГ, ммоль/л | 1,21±0,04 | 1,54±0,09 | 0,0005 |
| ХС ЛПВЩ, ммоль/л | 1,33±0,02 | 1,23±0,01 | 0,002 |
| ХС ЛПНЩ, ммоль/л | 3,00±0,04 | 3,29±0,10 | 0,002 |
| ХС ЛПДНЩ, ммоль/л | 0,54±0,02 | 0,69±0,04 | 0,0005 |
| ІА, одиниць | 2,74±0,05 | 3,28±0,10 | <0,0001 |
| Тромбоцити, · 10/л | 374,39±8,57 | 416,98±13,95 | 0,02 |
| Лейкоцити, | 5,39±0,07 | 5,34±0,14 | 0,72 |
| Лімфоцити, % | 24,28±0,54 | 24,10±0,86 | 0,87 |
| Лімфоцити, мм | 1325,65±42,88 | 1286,12±71,16 | 0,67 |
| CD3, мм(відносна кількість, %) | 853,83±25,85(64,90±0,26) | 862,71±45,09(67,46±0,36) | 0,88<0,0001 |
| CD4, мм(відносна кількість, %) | 546,04±14,33(42,21±0,37) | 573,47±26,82(45,26±0,85) | 0,390,0001 |
| CD8, мм(відносна кількість, %) | 302,79±11,25(22,52±0,14) | 287,71±18,43(25,32±5,34) | 0,540,34 |
| IPI | 1,9±0,02 | 2,07±0,04 | 0,003 |
| CD20, мм(відносна кількість, %) | 153,20±4,67(11,77±0,16) | 168,95±7,40(13,45±0,24) | 0,12<0,0001 |
| CD16, мм(відносна кількість, %) | 199,65±6,07(15,56±0,33) | 244,07±13,40(19,77±0,76) | 0,002<0,0001 |
| CD25, мм(відносна кількість, %) | 185,67±6,36(14,14±0,24) | 151,78±8,70(11,88±0,22) | 0,01<0,0001 |
| CD56, мм(відносна кількість, %) | 175,15±6,54(13,14±0,16) | 157,88±15,30(11,81±0,48) | 0,260,01 |
| CD95, мм(відносна кількість, %) | 268,80±5,73(21,89±0,50) | 342,11±16,99(27,13±0,67) | <0,0001<0,0001 |
| Спонтанна проліферація лімфоцитів, % | 4,58±0,1 | 5,41±0,14 | 0,0002 |
| ФГА-викликана проліферація, % | 38,9±0,73 | 34,14±1,16 | 0,003 |
| Простагландинзалежна проліферація, % | 34,00±0,77 | 29,56±1,06 | 0,003 |
| В-мітоген-викликана проліферація, % | 56,47±0,75 | 61,49±1,33 | 0,003 |
| Спонтанна фагоцитарна активність нейтрофілів (у НСТ-тесті), ум. од. |
298,14±7,84 | 315,38±5,84 | 0,28 |
| Кількість ЦІК, ум. од. | 207,45±6,58 | 273,13±11,63 | <0,0001 |
| IL-1b, пг/мл | 176,85±11,85 | 257,58±21,90 | 0,002 |
| IL-4, пг/мл | 163,76±8,51 | 189,96±17,09 | 0,170 |
| IL-6, пг/мл | 12,14±0,47 | 16,33±0,85 | 0,0001 |
| IL-10, пг/мл | 156,40±8,61 | 184,83±17,21 | 0,145 |
| IFN-γ, пг/мл | 39,34±0,67 | 46,04±0,9 | <0,0001 |
| TNF-α, пг/мл | 22,00±0,73 | 31,18±1,36 | <0,0001 |
| VCAM-1, пг/мл | 32,27±2,02 | 52,55±4,11 | <0,0001 |
| АнтиССР-ат, ОД/мл | 509,32±36,23 | 1024,74±96,93 | <0,0001 |
| АНА, ОД/мл | 257,74±15,85 | 370,37±29,03 | 0,002 |
Як видно з наведених (див. табл. 2) даних, хворі на РА із розвитком судинних ускладнень мали в середньому більшу кількість традиційних неліпідних факторів ризику ССЗ за рахунок достовірно вищої частоти наявності в цій підгрупі абдомінального ожиріння, малорухомого способу життя і переважання харчових звичок без обмеження тваринних жирів та солі.
Кардіо- та цереброваскулярні ускладнення розвивались у хворих із вираженим субклінічним атеросклерозом: більшим вихідним показником ТКІМ сонних артерій, пришвидшеним прогресуванням ТКІМ за 24 міс та достовірно частішим формуванням АБ в сонних артеріях, ніж у пацієнтів без розвитку судинних ускладнень за період спостереження.
Кількість дисліпідемій (ДЛП) у підгрупі хворих із розвитком ускладнень також достовірно перевищувала показник підгрупи без ускладнень (відповідно 77,78 і 28,47%; p<0,0001), найчастіше реєструвалося незначне підвищення ЗХС, ХС ЛПНЩ і/або ХС ЛПДНЩ; середня кількість ТГ і ХС ЛПВЩ в обох групах не виходили за межі норми, хоча кількісно і відрізнялись у підгрупах (підвищений рівень ТГ і знижений — ХС ЛПВЩ були характерними для підгрупи із розвитком тих чи інших ускладнень), що супроводжувалося підвищенням індексу атерогенності в середньому до 3,28 у підгрупі з розвитком ускладнень.
Як видно з даних (див. табл. 2), у включених в дослідження пацієнтів із РА розвиток судинних ускладнень не залежав від віку і тривалості захворювання. Для хворих на РА із судинними ускладненнями характерними були позасуглобові прояви РА з вищим ступенем активності запального процесу та більшою вираженістю імунопатологічних реакцій, що проявлялося значним дисбалансом субпопуляцій лімфоцитів, накопиченням лімфоцитів у стані апоптозу, підвищенням ІРІ та вмісту аутоантитіл, прозапальних цитокінів і VCAM на фоні значимих змін функціональної активності лімфоцитів за результатами РБТЛ.
Більшість (55,55%) хворих на РА із подальшим розвитком кардіо- та цереброваскулярних ускладнень з тих чи інших причин змінювали режими базисної терапії; 25% — лікувались із застосуванням лефлуноміду; і 19,45% — із застосуванням метотрексату як базисної терапії; у 86,11% пацієнтів з ускладненнями відзначали недостатню відповідь на медикаментозну терапію.
На основі подальшого статистичного аналізу масиву одержаних у дослідженні даних проведено визначення прогностичної цінності аналізованих показників для прогнозування виникнення кардіо- та цереброваскулярних ускладнень у хворих на РА.
Дані щодо рівня інформативності вивчених показників, які впливали на розвиток ускладнень у хворих на РА наведено в табл. 3.
| № з/п | Показник | Рівень прогностичної цінності |
|---|---|---|
| 1 | Наявність позасуглобових проявів РА | 2,73 |
| 2 | DAS28 >5,2 | 2,3 |
| 3 | Наявність абдомінального ожиріння | 3,63 |
| 4 | Малорухомий спосіб життя | 1,84 |
| 5 | Харчування без обмеження кухонної солі і тваринних жирів |
1,67 |
| 6 | СРБ >25 мг/л | 2,34 |
| 7 | АНА >25 Од/мл | 1,45 |
| 8 | РФ >64 од. | 1,17 |
| 9 | АнтиССР-ат >1000 од. | 2,51 |
| 10 | Кількість тромбоцитів >360 · 10/л | 3,77 |
| 11 | ЗХС >5,0 ммоль/л | 2,16 |
| 12 | ТГ >2,0 ммоль/л | 2,08 |
| 13 | ХС ЛПНЩ >3,4 ммоль/л | 2,51 |
| 14 | ХС ЛПДНЩ >0,7 ммоль/л | 2,35 |
| 15 | ІА >3 | 4,40 |
| 16 | Відносна кількість CD3-лімфоцитів >65,0% | 3,84 |
| 17 | Відносна кількість CD4-лімфоцитів >35,0% | 2,49 |
| 18 | Відносна кількість CD20-лімфоцитів >10,0% | 6,71 |
| 19 | Відносна кількість CD16-лімфоцитів >20,0 | 2,98 |
| 20 | Відносна кількість CD25-лімфоцитів < 15,0% | 6,22 |
| 21 | Спонтанна проліферація лімфоцитів >2% | 1,42 |
| 22 | Кількість ЦІК >250 од. | 4,07 |
| 23 | Кількість IL-1b >150 пг/мл | 3,21 |
| 24 | Кількість IL-6 >150 пг/мл | 3,56 |
| 25 | Кількість IFN-γ >40 пг/мл | 6,20 |
| 26 | Кількість TNF-α >25 пг/мл | 6,66 |
| 27 | Кількість VCAM-1 >35 пг/мл | 2,22 |
| 28 | ТКІМ >0,9 мм | 1,96 |
| 29 | Збільшення ТКІМ >0,1 мм/рік | 2,22 |
Для подальшої роботи були відібрані такі найбільш інформативні фактори (табл. 4):
| Коефіцієнт ознаки | Показник | Інформативність (значимість), балів |
|---|---|---|
| х1 | Збільшення ТКІМ >0,1 мм/рік | 2,22 |
| х2 | Кількість VCAM-1 у плазмі крові >35 пг/мл | 2,22 |
| х3 | DAS28 >5,2 | 2,51 |
| х4 | Наявність системних проявів | 2,73 |
| х5 | Абдомінальне ожиріння | 3,63 |
| х6 | Індекс атерогенності >3 | 4,4 |
| х7 | Відносна кількість CD25-лімфоцитів плазми крові <15% | 6,22 |
| х8 | Кількість TNF-α у плазмі крові >25 пг/мл | 6,66 |
Використання методу найменших квадратів дозволило отримати таке рівняння:
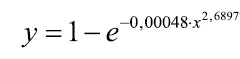
де у — імовірність розвитку ускладнень, х — сума балів ризику, яка вираховується за формулою:
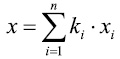
де n — кількість показників, ki — інформативність показника, xi — коефіцієнт ознаки, який приймає значення 1 — якщо ознака є, і значення 0 — якщо ознака відсутня.
Таким чином, для табл. 4, формула для визначення х може бути представлена таким чином:
x = 2,22•x1 + 2,22•x2 + 2,30•x3 + 2,73•x4 +
3,63•x5 + 4,40•x6 + 6,22•x7 + 6,66•x8 .
Рівень значимості моделі високий: R=0,998.
Для кожного пацієнта підраховували суму балів. Встановлено чітку залежність між величиною суми балів та імовірністю ризику розвитку серцево-судинних ускладнень у наступні 2 роки:
- при сумі балів ≤5 — <1%
- 6–11 балів — 20%
- 12–14 балів — 40%
- ≥15 балів — >40%
Подальші результати клінічних спостережень на екзаменаційній вибірці (n=31) показали достатньо високу точність правильних діагнозів і прогнозів (збіг із прогнозованим результатом спостерігався у 88% випадків; чутливість цього методу прогнозування — 0,74, специфічність — 0,86), що свідчить про доцільність застосування розробленого способу прогнозування виникнення атеросклероззалежних серцево-судинних ускладнень при веденні хворих на РА.
Висновки
1. Розвиток атеросклероззалежних кардіо- та цереброваскулярних ускладнень у дорослих пацієнтів із РА віком до 50 років із тривалістю захворювання до 7 років не залежить від віку хворих і тривалості захворювання, найчастіше є частиною системних проявів РА і пов’язаний із прискореним раннім субклінічним атеросклерозом, що є результатом дії традиційних факторів ризику ССЗ та факторів РА.
2. Найбільш прогностично значимими факторами, що впливають на розвиток судинних ускладнень у хворих на РА віком до 50 років є: збільшення ТКІМ сонних артерій >0,1 мм/рік, висока активність РА, наявність системних проявів РА і абдомінального ожиріння, підвищення індексу атерогенності, зменшення відносної кількості CD25-лімфоцитів <15%, значна системна активація ендотелію судин.
3. Застосування розробленого авторами алгоритму прогнозування є достатньо чутливим і специфічним для виявлення серед хворих на РА осіб із дуже високим ризиком виникнення судинних ускладнень у наступні 2 роки.
4. Хворі на РА, навіть молодого віку, потребують систематичного моніторингу наявності та контролю як традиційних факторів ризику ССЗ, так і факторів, пов’язаних із РА (вираженість запального та імунопатологічного процесу), а також вираженості й темпів прогресування субклінічного атеросклеротичного ураження судин.
5. Ефективна медикаментозна терапія РА із тривалим застосуванням препаратів базисної терапії з метою досягнення ремісії/значного тривалого зменшення активності захворювання супроводжується зниженим ризиком розвитку кардіо- та цереброваскулярних ускладнень.
Література
- Коваленко В.М., Лутай М.І. (ред.) (2011) Серцево-судинні захворювання. Рекомендації з діагностики, профілактики і лікування. МОРІОН, Київ, 407с.
- Avina-Zubieta J.A., Choi H.K., Sadatsafavi M. et al. (2008) Risk of cardiovascular mortality in patients with rheumatoid arthritis: a meta-analysis of observational studies. Arthritis Rheum., 59: 1690–1697.
- Davis J.M. 3, Roger V.L., Crowson C.S. et al. (2008) The presentation and outcome of heart failure in patients with rheumatoid arthritis differs from that in the general population. Arthritis Rheum., 58: 2603–2611.
- Dinh W., Futh R., Nickl W. et al. (2009) Elevated plasma levels of TNF-alpha and IL-6 in patients with diastolic dysfunction and glucose metabolism disorders. Cardiovasc. Diabetol., 8: 58–65.
- Farragher T.M., Goodson N.J., Nassem H. et al. (2008) Association of the HLA-DRB1 gene with premature death, particularly from cardiovascular disease, in patients with rheumatoid arthritis and inflammatory polyarthritis. Arthritis Rheum., 58: 359–369.
- Gabriel S.E., Crowson C.S., Kremers H.M. et al. (2003) Survival in rheumatoid arthritis: a population-based analysis of trends over 40 years. Arthritis Rheum., 48(1): 54–58.
- Gonzalez A. Kremers M.H. Crowson C.S. et al. (2007) The widening mortality gap between rheumatoid arthritis patients and the general population. Arthritis Rheum., 56(11): 3583–3587.
- Goodson N., Symmons D. (2002) Rheumatoid arthritis in women: still associated with increased mortality. Ann. Rheum. Dis., 61(11): 955–956.
- Goodson N.J., Wiles N.J., Barrett E.M. et al. (2002) Mortality in early inflammatory polyarthritis: cardiovascular mortality is increased in seropositive patients. Arthritis Rheum., 46: 2010–2019.
- Graham I., Atar D., Borh-Johanson K. et al. (2007) European Guidelines on cardiovascular disease prevention in clinical practice (Forth Joint Task Force). Eur. J. Cardiovasc. Dis. Prev. Rehabilitation, 14(2): 1–88.
- Holmqvist M.E., Werden S., Jacobsson L.T. et al. (2009) No increased occurrence of ischemic heart disease prior to the onset of rheumatoid arthritis: results from two Swedish population-based rheumatoid arthritis cohorts. Arthritis Rheum., 60: 2861–2869.
- Holmqvist M.E., Wedrén S., Jacobsson L.T. et al. (2010) Rapid increase in myocardial infarction risk following diagnosis of rheumatoid arthritis amongst patients diagnosed between 1995 and 2006. J. Intern. Med., 268: 578–585.
- Mahoney L.T., Burns T.L., Stanford W. et al (2001) Usefulness of the Framingham risk score and body mass index to predict early coronary artery calcium in young adults (Muscatine study) (2001) Am. J. Cardiol., 88: 509–515.
- Maradit-Kremers H., Crowson C.S., Nikola P.J. et al. (2005) Increased unrecognized coronary heart disease and sudden death in rheumatoid arthritis: a population-based cohort study. Athritis Rheum., 52(2): 402–411.
- Maradit-Kremers H., Crowson S.C., Thereneau T.M. et al. (2008) High 10-year risk of cardiovascular disease in newly diagnosed rheumatoid arthritis patients. Arthritis Rheum., 58(8): 2268–2274.
- Maradit-Kremers H., Nicola P.J., Crowson C.S. et al. (2005) Cardiovascular death in rheumatoid arthritis: a population-based study. Athritis Rheum., 52(3): 722–732.
- Martins T.B., Anderson J.L., Muhlestein J.B. et al. (2006) Risk factors analysis of plasma cytokines in patients with coronary artery disease by a multiplexed fluorescent immunoassay. Am. J. Clin. Pathol., 125(6): 906–913.
- Melton L.J. (1996) 3-d history of the Rochester Epidemiology Project. Mayo Clinic. Proc. 71: 266–274.
- Mosca L., Ferris A., Fabunmi R. et al. (2004) Tracking women’s awareness of heart disease: an American Heart Association national study. Circulation, 109: 573–579.
- Naz S.M., Farragher T.M., Bunn D.K. et al. (2008) The influence of age at symptom onset and length of followup on mortality in patients with resent-onset inflammatory polyarthritis. Arthritis Rheum., 58: 985–989.
- Nikola P.J., Maradit-Kremers H., Roger V.L. et al. (2005) The risk of congestive heart failure in rheumatoid arthritis: A population-based study over 46 years. Athritis Rheum., 52(2): 412–420.
- Pearson T.A., Menash G.A., Alexander R.W. et al. (2003) Markers of inflammation and cardiovascular disease: application to clinical and public health practice: a statement for healthcare professionals from the centers for disease control and prevention and the AHA. Circulation, 107: 499–511.
- Peters M.J., Symmons D.P., McCarey D. et al. (2010) EULAR evidence-based recommendations for cardiovascular risk management in patients with rheumatoid arthritis and other forms of inflammatory arthritis. Ann. Rheum. Dis., 69: 325–331.
- Radovits B.J., Fransen J., Shamma S.Al. et al. (2010) Excess mortality emerges after 10 years in an inception cohort of early rheumatoid arthritis. Arthritis Care Res., 62: 362–370.
- Ridker P.M. (2003) Clinical application of C-reactive protein for cardiovascular disease detection and prevention. Circulation, 107: 370–371.
- Ridker P.M., Rifai N., Pfeffer M. et al. (2000а) Elevation of TNF-α and increased risk of recurrent coronary events after myocardial infarction. Circulation, 101: 2149–2153.
- Ridker P.M., Rifai N., Stampfer M.J. et al. (2000b) Plasma concentration of IL-6 and the risk of future myocardial infarction among apparently healthy men. Circulation, 101: 1767–1772.
- Simmons D., Bruce I. (2006) Management of cardiovascular disease in Ra and SLE. Arthritis Research Campaign, 8: 1–4.
- Sodergren A., Stegmayr B., Lundberg V. et al. (2007) Increased incidence of and impaired prognosis after acute myocardial infarction among patients seropositive rheumatoid arthritis. Ann. Rheum. Dis., 66: 263–266.
- Solomon D.H., Curhan G.C., Rimm E.B. et al (2004) Cardiovascular risk factors in women with and without rheumatoid arthritis. Arthritis Rheum., 50: 3444–3449.
- Solomon D.H., Carlson E.W., Rimm E.B. et al. (2003) Cardiovascular morbidity and mortality in women diagnosed with rheumatoid arthritis. Circulation, 107: 1303–1307.
- Solomon D.H., Goodson N.J., Katz J.N. et al. (2006) Patterns of cardiovascular risk in rheumatoid arthritis. Ann. Rheum. Dis., 65: 1608–1612.
- van Doornum S., Brand C., Sundararajan V. et al. (2010) Rheumatoid arthritis patients receive less frequent acute reperfusion and secondary prevention therapy after myocardial infarction compared with general population. Arthritis Res. Ther., 12: R183.
- van Doornum S., McColl G., Wicks I.P. (2002) Accelerated atherosclerosis: an extraarticular feature of rheumatoid arthritis? Arthritis Rheum., 46: 862–873.
- von Haehling S., Jankowska E.A., Anker S.D. (2004) Tumor necrosis factor-alpha and the failing heart: pathphysiology and therapeutic implications. Basic. Res. Cardiol., 99: 18–28.
- Watson D.J., Rhodes T., Guess H.A. (2003) All-cause mortality and vascular events among patients with rheumatoid arthritis, osteoarthritis or no arthritis in the UK General Practice Research Database. J. Rheumatol., 30: 1196–1202.
- Willerson J.T., Ridker P.M. (2004) Inflammation as a cardiovascular risk factor. Circulation, 109(Suppl. II): 2–10.
- Wolf F., Freundlich B., Straus W.L. (2003) Increase in cardiovascular and cerebrovascular disease prevalence in rheumatoid arthritis. J. Rheumatol., 30: 36–40.
ВОЗМОЖНОСТИ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ КАРДИО- И ЦЕРЕБРОВАСКУЛЯРНЫХ ОСЛОЖНЕНИЙ У БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ
Резюме. Цель исследования — определить наиболее значимые факторы, которые могут использоваться для прогнозирования развития кардио- и цереброваскулярных осложнений у больных ревматоидным артритом (РА). Разработать модель прогноза развития сосудистых осложнений у данного контингента больных.
У 180 больных РА в возрасте до 50 лет изучено значение традиционных факторов риска развития заболеваний сердечно-сосудистой системы, а также ряда показателей иммунного и цитокинового статуса, активности воспалительного процесса и особенностей медикаментозной терапии для прогнозирования развития кардио- и цереброваскулярных осложнений.
Разработан алгоритм прогнозирования развития сосудистых осложнений у больных РА путем оценки выделенных наиболее прогностически значимих факторов в баллах.
У больных РА в возрасте до 50 лет преждевременное ускоренное атеросклеротическое поражение сосудов, являющееся компонентом системных проявлений заболевания, приводит к значительному возрастанию частоты кардио- и цереброваскулярных событий и заболеваний, развитие которых можно с достаточной достоверностью прогнозировать с использованием балльной оценки наиболее значимих прогностических факторов, выделенных авторами.
ревматоидный артрит, атеросклероз, прогнозирование развития сосудистых осложнений, факторы риска сердечно-сосудистых заболеваний, УЗИ-каротид, иммунный статус, цитокиновый статус, дислипидемии, медикаментозная терапия.
Адреса для листування:
Коваленко Володимир Миколайович
03680, Київ, вул. Народного ополчення, 5
ННЦ «Інститут кардіології ім. М.Д. Стражеска» НАМН України

Leave a comment