ОСОБЛИВОСТІ МОДЕЛЮВАННЯ СИСТЕМНОЇ СКЛЕРОДЕРМІЇ В УМОВАХ ЕКСПЕРИМЕНТУ
Доскалюк Б.В., Заяць Л.М., Яцишин Р.І.
Резюме. Мета дослідження: описати особливості патогенезу ураження респіраторного відділу легень при експериментальній індукції системної склеродермії (ССД). Об’єкт та методи. Для моделювання ССД сформовано дослідну групу тварин із 25 статевозрілих щурів лінії Wistar (220–240 г); група контролю налічувала 20 особин. Лабораторним тваринам дослідної групи вводили тричі на тиждень 0,5 мл 5% розчину гіпохлориту натрію (NaClO) підшкірно впродовж 6 тиж, контрольні особини отримували ізотонічний розчин за тією ж схемою. Тваринам обох груп проведено евтаназію через 8 тиж після початку експерименту. У ході дослідження визначено рівень оксипроліну, показники рівня каталази, ТБК-активних продуктів, молекул середньої маси (МСМ) та дієнових кон’югатів (ДК) в плазмі крові. За допомогою імуноферментного аналізу встановлено концентрацію сурфактантного протеїну D (Elabscience SP-D ELISA-Kit), молекули васкулярної адгезії-1 (Elabscience VCAM-1 ELISA-Kit) та інтерлейкіну-13 (Elabscience IL-13 ELISA-Kit). Для опису морфологічних змін зразки легеневої тканини досліджено за допомогою світлової (Leica DM750, збільшення х200) мікроскопії за стандартною методикою забарвлення (гематоксилін та еозин). Результати. У дослідній групі тварин рівень каталази був нижчим порівняно з контрольною (9,69±0,67 та 11,1±0,87 г/л відповідно, р<0,05). Натомість показник ТБК-активних продуктів був вищим у групі експерименту (4,3±0,26 та 3,85±0,23 нмоль/мл відповідно, р<0,05), як і рівень МСМ (0,261±0,027 та 0,247±0,031, р<0,05) та ДК (0,0139±0,0032 та 0,0060±0,0011, р<0,05). Концентрація оксипроліну в плазмі крові лабораторних тварин з дослідної групи була вірогідно вищою порівняно з контрольними тваринами (34,03±5,01 та 33,23±2,4 мкмоль/л, р<0,05). В експериментальній групі виявлено також вищі показники IL-13 (136,4±56,23 та 9,43±4,01, p<0,05), VCAM-1 (91,25 [міжквартильний розмах (IQR) 85,63–143,75] та 17,35±7,47, p<0,05) і SP-D (490,20 [IQR 228,75–568,73] та 70,13±33,21, p<0,05). Гістологічний аналіз легеневих біоптатів експериментальної групи тварин продемонстрував порушення морфологічної структури, характерні для неспецифічної інтерстиціальної пневмонії. Oцінка вираженості фіброзу за шкалою Ешкрофта була значно вищою у дослідній групі (3,7±0,6) порівняно з контрольними особинами (0,6±0,1), p<0,05. Висновки. Описана модель експериментальної індукції ССД дозволяє охарактеризувати патогенетичні механізми порушення морфо-функціонального стану респіраторного відділу легень, типові для цієї патології.
DOI: 10.32471/rheumatology.2707-6970.87.16517
УДК: 616-092+616.24+616–018.2+616–08+616-092.9
Вступ
Системна склеродермія (ССД) — орфанне аутоімунне захворювання, що провокує ураження як шкірних покривів, так і низки внутрішніх органів. Патогенез даного захворювання характеризується комплексним пошкодженням організму у зв’язку з розвитком механізмів аутоагресії. Визначну роль в даному процесі відіграють дисрегуляція імунних процесів, розвиток фіброзу і васкулопатії. У зв’язку з комплексним характером патологічних змін досі не розроблено етіотропної терапії ССД, а наявні методики не завжди здатні забезпечувати ефективну корекцію захворювання. Більше того, згідно з K. Morrisroe співавторами [22] ССД вважається патологією, що чинить найбільш несприятливий вплив на організм пацієнтів серед усіх системних захворювань сполучної тканини. Перелічені факти підтверджують важливість подальшого вивчення особливостей розвитку ССД та встановлення взаємозв’язків між різними ланками патогенезу.
Через складність встановлення причинно-наслідкових зв’язків у патогенезі ССД на різних стадіях розвитку захворювання в організмі пацієнтів, принаймні частковим вирішенням проблеми стає використання тваринних моделей. Попередньо нами описано характерні особливості низки експериментальних індукційних моделей ССД, що застосовуються найчастіше [4]. Безумовно, використання лабораторних тварин для відтворення такого комплексного за своїм патогенезом захворювання як ССД є непростим завданням. Жодна з існуючих на сьогодні моделей не здатна в повному обсязі охопити всі патологічні зміни в організмі, типові для прогредієнтного перебігу ССД. Проте, зважаючи на ключову роль у патогенезі ССД ураження легеневої системи, ми в своєму дослідженні взяли за основу гіпохлорну модель, розроблену А. Servettaz та співавторами [26].
Мета нашого дослідження — детально описати особливості відтворення ССД у організмі лабораторних тварин згідно з використаною методикою; дослідити морфо-функціональні зміни респіраторного відділу легень та встановити наявність маркерів васкулопатії та порушення метаболізму сполучної тканини в експериментальних тварин.
Об’єкт та методи дослідження
З метою проведення експериментального моделювання ССД сформовано дослідну групу лабораторних тварин, яка налічувала 25 статевозрілих щурів лінії Wistar масою 220–240 г. У групу контролю нами відібрано 20 особин. Лабораторні тварини впродовж усього часу проведення дослідження розміщувалися на базі віварію Івано-Франківського національного медичного університету (ІФНМУ) та отримували належний догляд. Проведення кожного з етапів дослідження здійснювалося відповідно до біоетичних принципів медико-біологічних експериментальних робіт, декларованих в положеннях Європейської конвенції про захист хребетних тварин, що використовуються для дослідних та інших наукових цілей (схвалено комісією з питань етики ІФНМУ, протокол № 117/20 від 19.11.2020 р.).
Безпосередня індукція ССД проводилася за наступною методикою: експериментальним тваринам здійснювали введення 0,5 мл 5% розчину гіпохлориту натрію (NaClO) тричі на тиждень підшкірно впродовж 6 послідовних тижнів. Лабораторним щурам контрольної групи вводили ізотонічний розчин за попередньо описаною схемою. Виведення обох груп експериментальних тварин проведено через 8 тиж з моменту першої ін’єкції методом декапітації під тіопенталовим наркозом (тіопентал вводили внутрішньом’язово в дозі 10 мг/100 г маси тіла щура). Для виключення впливу добового ритму та біологічної активності на метаболізм щурів забір матеріалу проводився вранці, до годування.
Для характеристики метаболічного стану структур сполучної тканини визначено рівень оксипроліну в плазмі крові. Дослідження виконано за стандартною схемою — колориметричним методом з парадиметиламіно-бензальдегідом. Стан оксидантно-антиоксидантного гомеостазу (ОАГ) оцінювали за кількісними показниками каталази (за А. Бахом і С. Зубковою), активних продуктів пероксидного окиснення ліпідів у реакції з тіобарбітуровою кислотою (ТБК-АП) за методикою Е. Коробейникової, [3] молекул середньої маси (МСМ) за скринінг-методом в модифікації Н. Габрієляна та співавторів [1] та дієнових кон’югатів (ДК) за В. Гавриловим та співавторами [2] в плазмі крові лабораторних тварин. Ферментний імуносорбентний аналіз (ELISA) застосовували для визначення рівня сурфактантного протеїну D (Elabscience SP-D ELISA-Kit), молекули васкулярної адгезії-1 (Elabscience VCAM-1 ELISA-Kit) та інтерлейкіну-13 (Elabscience IL-13 ELISA-Kit). Дослідження виконано на імуноферментному аналізаторі STAT FAX 303 plus.
Для гістологічного аналізу змін цитоархітектоніки респіраторного відділу легень використовували світлову мікроскопію (Leica DM750, збільшення х200). При виготовленні зрізів легеневої тканини для світлової мікроскопії застосовано стандартну методику забарвлення (гематоксилін та еозин). Морфологічні ознаки легеневого фіброзу оцінювали за допомогою морфометричного аналізу за шкалою Ешкрофтa [6] від 0 балів (повна відсутність ознак фіброзу) до 8 (тотальний фіброз без збереження альвеолярних просторів). У рамках морфометричного аналізу оцінювали 20 випадкових полів зору з препаратів легеневої тканини кожної досліджуваної тварини та визначали середнє значення ступеня фіброзу в балах.
Cтатистичні дані, наведені в роботі, представлені як M (середнє значення змінної) ±m (стандартне відхилення) або Mе (медіана) Q1–Q3 (міжквартильний інтервал). Нормальність розподілу даних була перевірена за допомогою критерію Шапіро — Уїлкса. Відмінності між показниками екcпериментальної та контрольної груп порівнювали методом однофакторного дисперсійного аналізу (ANOVA). Результати вважалися статистично достовірними при p<0,05. Аналіз статистичних даних проводився з використанням статистичного застосунку Statistical Package for the Social Sciences version 28.0 software (SPSS Inc., Chicago, IL, USA).
Результати дослідження
Прогнозовано порушення ОАГ виявлено у дослідної групи лабораторних тварин. Дисбаланс гомеостазу оксидантів та антиоксидантів проявлявся за рахунок підвищення в плазмі крові концентрації продуктів пероксидного окиснення ліпідів та зниження рівня речовин-антиоксидантів. За даними результатів лабораторних досліджень сформовано табл. 1. При проведенні порівняльного аналізу рівень каталази у контрольній групі був вищим порівняно з дослідною (р<0,05). Натомість значення ТБК-АП, МСМ та ДК були достовірно вищими в групі експерименту, ніж у контрольних особин.
Результати колориметричного аналізу з парадиметиламіно-бензальдегідом показали незначне підвищення показників оксипроліну в плазмі крові експериментальних тварин порівняно з представниками контрольної групи (р<0,05). В експериментальній групі відмічена також вища концентрація IL-13, VCAM-1 і SP-D (p<0,05).
Таблиця 1. Порівняльний аналіз лабораторних показників тварин дослідної та контрольної груп при експериментальній індукції ССД
| Показник | Дослідна група | Група контролю | p |
|---|---|---|---|
| Маркер структурного стану сполучної тканини | |||
|
Оксипролін, мкмоль/л M±m |
34,03±5,01 | 33,23±2,4 | p<0,05 |
| Показники оксидантно-антиоксидантного гомеостазу | |||
|
Каталаза, мг Н2О2/мл M±m |
9,69±0,67 | 11,1±0,87 | p<0,05 |
|
ТБК-АП, мкмоль/л M±m |
4,3±0,26 | 3,85±0,23 | p<0,05 |
|
ДК, ум. од./мл M±m |
0,0139±0,0032 | 0,0060±0,0011 | p<0,05 |
|
МСМ, ум. од. M±m |
0,261±0,027 | 0,247±0,031 | p<0,05 |
| Показники імуноферментного аналізу | |||
|
IL-13, пг/мл M±m |
136,4±56,23 | 9,43±4,01 | p<0,05 |
|
VCAM-1, пг/мл Ме (IQR) |
91,25 (85,63–143,75) | 17,35±7,47 | p<0,05 |
|
SP-D, пг/мл Ме (IQR) |
490,20 (228,75–568,73) | 70,13±33,21 | p<0,05 |
Гістологічне дослідження зразків легеневої тканини експериментальних тварин дослідної групи засвідчило характерні для ССД ознаки ремоделювання респіраторного відділу легень. Методом світлової мікроскопії вдалося встановити порушення цитоархітектоніки легеневих структур, що відповідає картині неспецифічної інтерстиціальної пневмонії (рис. 1). У біоптатах легень чітко прослідковується ремоделювання паренхіми за рахунок потовщення міжальвеолярних перегородок (див. рис. 1 (2)). Дані зміни були спричинені в основному розвитком продуктивного склеротичного процесу та інфільтрацією тканин лімфоцитарними клітинами. На додаток при мікроскопії зразків вдалося ідентифікувати появу поодиноких міофібробластів (див. рис. 1 (3)), а також відзначити потовщення базальної мембрани гемокапілярів (див. рис. 1 (1)). Морфометричний аналіз за методикою Ешкрофта показав очікувані результати. У тварин дослідної групи оцінка морфологічних ознак легеневого фіброзу коливалася в межах 3,7±0,6, що було значно вищим, ніж серед контрольної групи (0,6±0,1, p<0,05). Гістологічне дослідження зразків легеневої тканини контрольних тварин не встановило відхилень у цитоархітектоніці паренхіми та гемомікроциркуляторному руслі легень (рис. 2).
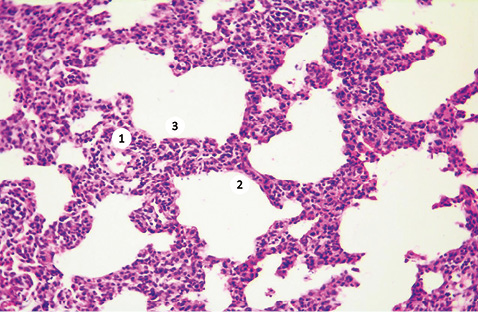
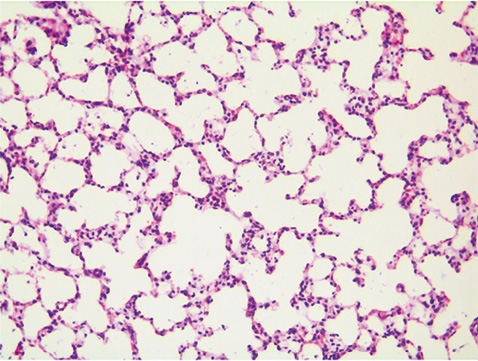
Обговорення
Індукція склеродермоподібного ураження легень за допомогою експериментальної моделі Е. Servettaz та співавторів [26] досягається шляхом повторюваного введення в організм лабораторних тварин гіпохлорної кислоти. Ця речовина була обрана розробниками даної моделі з огляду на її здатність стимулювати утворення активних форм кисню (АФК), які займають чільне місце у патогенезі ССД. Роль порушення ОАГ в патогенезі ССД була підтверджена на основі виявлення підвищених рівнів низки біомаркерів, що вказують на клітинне та молекулярне окисне пошкодження [24]. Окрім цього, відомо, що функціональна активність фібробластів може бути детермінована впливом АФК. Активовані фібробласти, в свою чергу, стають джерелом ендогенних АФК, утворюючи порочне коло та підтримуючи подальший дисбаланс ОАГ [10]. Описана модель була апробована та використана у низці експериментальних досліджень, зокрема і для перевірки потенційної ефективності різних препаратів та методик для корекції змін, спричинених ССД [7, 18, 19, 21].
Незважаючи на валідність даної моделі індукції ССД, неможливо оминути увагою певні складнощі у її репродукції. Гіпохлорна кислота — нестабільна молекула, і її синтез потрібно проводити кожного разу перед ін’єкцією лабораторній тварині. Утворення гіпохлорної кислоти в оригінальній роботі E. Servettaz та співавторів [26] здійснювалося додаванням NaClO до дигідрофосфату калію (KH2PO4) з використанням спектрофотометра для контролю результату хімічної реакції. Окрім цього, введення гіпохлорної кислоти проводили щодня впродовж 6 тиж. Саме тому нами запропонована низка модифікацій у проведенні експериментального моделювання за даною методикою. Насамперед ми вирішили використати як основну діючу речовину NaClO, а також знизили частоту ін’єкцій до трьох на тиждень, залишивши тривалість введення без змін.
Натрію гіпохлорит — сильний окисник [16], використовується в медичній практиці як дезінфектант, а в стоматології набув широкого використання для іригації кореневих каналів [12]. Таку антимікробну дію NaClO пов’язують зі здатністю цієї молекули розкладатися у водних розчинах з утворенням тієї ж гіпохлорної кислоти [9].
NaOCl+H2O→HOCl+NaOH
Більше того, в експериментальних дослідженнях виявлено здатність NaClO модифікувати структуру білків та підвищувати активність α2-макроглобуліну [5]. Саме NaClO застосовується також як основна діюча речовина у моделі індукції бронхіальної астми [15]. При інгаляційному введенні NaClO викликає розвиток гіперсенситивної імунної відповіді з активацією Th2-лімфоцитів та підвищенням концентрації таких прозапальних інтерлейкінів, як IL-1β, IL-4, IL-5 та IL-33. Зважаючи на те, що ССД є Th2-асоційованою аутоімунною патологією, а IL-4 відіграє значну роль в патогенезі цього захворювання [14], NaClO можна вважати належною речовиною для індукції ССД.
За результатами цього дослідження вдалося підтвердити наявність порушення ОАГ в організмі експериментальних тварин в ході застосування нашої модифікованої моделі індукції ССД. Особливу увагу слід приділити підвищенню показників ТБК активних продуктів у експериментальної групи тварин, адже зростання саме згаданого біомаркера відмічається і у пацієнтів із ССД та інтерстиціальним захворюванням легень (ІЗЛ) [23].
Оксипролін як маркер порушень метаболізму сполучної тканини є показником інтенсивності фіброзу [25]. У нашому дослідженні, як і при моделюванні ССД за допомогою блеоміцину, виявлено статистично достовірне підвищення концентрації оксипроліну в плазмі крові експериментальних тварин порівняно з групою контролю [28].
Безумовно, важливою складовою патогенезу ССД загалом і легеневих уражень, спричинених цією патологією, зокрема, є розвиток системної васкулопатії.
VCAM-1 — глікопротеїн, що опосередковує адгезію лімфоцитів, моноцитів, еозинофілів і базофілів до ендотелію судин та вважається біомаркером ендотеліальної дисфункції. Експресія даної молекули зростає у пацієнтів із ССД [20]. Ця типова ознака знайшла своє відображення і в результатах апробації експериментальної моделі з NaClO.
IL-13 є важливим цитокіном у патогенезі розвитку фіброзних змін при ССД [11]. При застосуванні нашої експериментальної моделі ми відмічали виражене підвищення концентрації вказаного цитокіну. Рівень IL-13 у експериментальної групи тварин був у 14 разів вищим порівняно з контрольними особинами.
Такі результати знаходять підтримку як у роботах, присвячених тваринним моделям [8], так і при дослідженні плазми крові пацієнтів із ССД [17].
SP-D — мультимерний колектин, який бере участь не лише в регулюванні поверхневого натягу в альвеолах, але й здатен відображати ступінь ушкодження гістогематичного бар’єру в легенях [13]. У низці досліджень виявлено, що рівень SP-D в плазмі крові пацієнтів з ССД-асоційованим ІЗЛ — підвищений і корелює з його тяжкістю [29]. Аналогічне зростання SP-D встановлене і в нашій експериментальній групі.
Звертаючи увагу на результати гістологічного аналізу зразків тканин експериментальних тварин, варто відзначити, що морфологічні зміни респіраторного відділу легень повністю відповідають раніше описаним у літературі. Ремоделювання респіраторного відділу легень за типом неспецифічної інтерстиціальної пневмонії відмічено як і в оригінальній моделі індукції ССД [26], так і в поширеній моделі з використанням блеоміцину [28]. Більше того, таке порушення цитоархітектоніки типове і для пацієнтів із ССД-асоційованим ІЗЛ [27].
Висновки
Модель індукції ССД за допомогою NaClO викликає порушення ОАГ, підвищення концентрації оксипроліну, IL-13, SP-D і VCAM-1 у плазмі крові лабораторних тварин. Окрім цього, гістологічна картина порушень морфологічної структури респіраторного відділу легень експериментальних особин відображає типові для ССД зміни.
Таким чином, описана експериментальна модель відповідає критеріям перебігу ССД та дає змогу вивчити патогенетичні механізми порушення морфо-функціонального стану респіраторного відділу легень при даній патології.
Примітка: елементи цієї статті були попередньо представлені на VIII Національному конгресі ревматологів, м. Київ, 2021 р., EULAR 2021 Annual European Congress of Rheumatology та European Respiratory Society Virtual Congress 2020.
Список використаної літератури
- 1. Габриэлян Н.И., Дмитриев А.А., Кулаков Г.П. (1981) Диагностическая ценность определения средних молекул в плазме крови при нефрологических заболеваниях. Клиническая медицина. 10:38–42.
- 2. Гаврилов В.Б., Гаврилова А.Р., Хмара Й.Ф. (1988) Вимірювання дієнових кон’югатів в плазмі крові по ІФ-поглинанню гептанових і ізопропанових екстрактів. Лабораторное дело. 2:60–3.
- 3. Коробейникова Е.Н. (1989) Модифікація визначення продуктів перекисного окислення ліпідів у реакції з тіобарбітуровою кислотою. Лаб. Дело. 7: 8–10.
- 4. Яцишин Р.І., Заяць Л.М., Доскалюк Б.В. (2020) Експериментальне моделювання системної склеродермії — досягнення та виклики: огляд літератури. Укр. ревматол. журн. 79(1): 65–69. doi.org/10.32471/rheumatology.2707–6970.79.14822.
- 5. Amy R. Wyatt, Janet R. Kumita, Richard W. Mifsud et al. (2014) Hypochlorite enhances human α2M chaperone activity. Proceedings of the National Academy of Sciences 111 (20): E2081–E2090. DOI: 10.1073/pnas.1403379111/
- 6. Ashcroft T., Simpson J.M., Timbrell V. (1988) Simple method of estimating severity of pulmonary fibrosis on a numerical scale. J. Clin. Pathol. 41(4): 467–470.
- 7. Bagnato G., Bitto A., Irrera N. et al. (2013) Propylthiouracil prevents cutaneous and pulmonary fibrosis in the reactive oxygen species murine model of systemic sclerosis. Arthritis research & therapy. 15(5): R120.
- 8. Brown Lobbins M.L., Scott I.S.O., Slominski A.T. et al. (2021) 17, 20S (OH) 2pD Can Prevent the Development of Skin Fibrosis in the Bleomycin-Induced Scleroderma Mouse Model. International Journal of Molecular Sciences, 22(16): 8926.
- 9. da Cruz Nizer W.S., Inkovskiy V., Overhage J. (2020) Surviving reactive chlorine stress: responses of Gram-negative bacteria to hypochlorous acid. Microorganisms, 8(8): 1220.
- 10. Doskaliuk B., Zaiats L., Yatsyshyn R. et al. (2020) Pulmonary involvement in systemic sclerosis: exploring cellular, genetic and epigenetic mechanisms. Rheumatology International, 40(10): 1555–1569.
- 11. Gasparini G., Cozzani E., Parodi A. (2020). Interleukin-4 and interleukin-13 as possible therapeutic targets in systemic sclerosis. Cytokine, 125, 154799.
- 12. Gu L.S., Huang X.Q., Griffin B. et al. (2017) Primum non nocere–The effects of sodium hypochlorite on dentin as used in endodontics. Acta biomaterialia, 61: 144–156.
- 13. Guiot J., Moermans C., Henket M. et al. (2017) Blood Biomarkers in Idiopathic Pulmonary Fibrosis. Lung 195: 273–280.
- 14. Higashioka K., Kikushige Y., Ayano M. et al. (2020). Generation of a novel CD30+ B cell subset producing GM‐CSF and its possible link to the pathogenesis of systemic sclerosis. Clinical & Experimental Immunology, 201(3): 233–243.
- 15. Kim S.H., Park D.E., Lee H.S. et al. (2014) Chronic low dose chlorine exposure aggravates allergic inflammation and airway hyperresponsiveness and activates inflammasome pathway. PloS one, 9(9): e106861.
- 16. Kirihara M., Okada T., Sugiyama Y. et al. (2017). Sodium Hypochlorite Pentahydrate Crystals (NaOCl· 5H2O): A Convenient and Environmentally Benign Oxidant for Organic Synthesis. Organic Process Research & Development. 21 (12): 1925–37. doi:10.1021/acs.oprd.7b00288/
- 17. Lescoat A., Lecureur V., Varga J. (2021). Contribution of monocytes and macrophages to the pathogenesis of systemic sclerosis: recent insights and therapeutic implications. Current Opinion in Rheumatology, 33(6): 463–470.
- 18. Maria A.T., Toupet K., Bony C. et al. (2016) Antifibrotic, antioxidant, and immunomodulatory effects of mesenchymal stem cells in HOCl‐induced systemic sclerosis. Arthritis & Rheumatology. 68(4): 1013–25.
- 19. Marut W., Kavian N., Servettaz A. et al. (2013) Amelioration of systemic fibrosis in mice by angiotensin II receptor blockade. Arthritis Rheum., 65:1367–1377.
- 20. Mauliūtė M., Rugienė R., Žėkas V. et al. (2020) Association of endothelin-1 and cell surface adhesion molecules levels in patients with systemic sclerosis. Journal of Laboratory Medicine, 44(6): 343–347.
- 21. Morin F., Kavian N., Nicco C. et al. (2016) Niclosamide prevents systemic sclerosis in a reactive oxygen species–induced mouse model. The Journal of Immunology. 15; 197(8): 3018–28.
- 22. Morrisroe K., Stevens W., Sahhar J. et al. (2017) Epidemiology and disease characteristics of systemic sclerosis-related pulmonary arterial hypertension: results from a real-life screening programme. Arthritis research & therapy, 19(1): 42.
- 23. Musellim B., Ikitimur H., Uzun H. et al. (2006) The oxidant-antioxidant balance in systemic sclerosis cases with interstitial lung involvement. Rheumatol. Int. 27: 163–167. doi: 10.1007/s00296–006–0184–6.
- 24. Piera-Velazquez S., Jimenez S.A. (2021) Oxidative Stress Induced by Reactive Oxygen Species (ROS) and NADPH Oxidase 4 (NOX4) in the Pathogenesis of the Fibrotic Process in Systemic Sclerosis: A Promising Therapeutic Target. J. Clin. Med. 10(20): 4791. doi:10.3390/jcm10204791.
- 25. Qiu B., Wei F., Sun X. et al. (2014) Measurement of hydroxyproline in collagen with three different methods. Molecular medicine reports, 10(2): 1157–1163.
- 26. Servettaz A., Goulvestre C., Kavian N. et al. (2009). Selective oxidation of DNA topoisomerase 1 induces systemic sclerosis in the mouse. The Journal of Immunology, 182(9): 5855–5864.
- 27. Solomon J.J., Olson A.L., Fischer A. et al. (2013). Scleroderma lung disease. European respiratory review: an official journal of the European Respiratory Society, 22(127): 6–19. doi.org/10.1183/09059180.00005512.
- 28. Watanabe T., Nishimoto T., Mlakar L. et al. (2017) Optimization of a murine and human tissue model to recapitulate dermal and pulmonary features of systemic sclerosis. PloS one, 12(6): e0179917.
- 29. Yamakawa H., Hagiwara E., Kitamura H. et al. (2017) Serum KL-6 and surfactant protein-D as monitoring and predictive markers of interstitial lung disease in patients with systemic sclerosis and mixed connective tissue disease. J. Thorac. Dis. 9(2): 362–371. /doi.org/10.21037 /jtd.2017.02.48.
ОСОБЕННОСТИ МОДЕЛИРОВАНИЯ СИСТЕМНОЙ СКЛЕРОДЕРМИИ В УСЛОВИЯХ ЭКСПЕРИМЕНТА
Ивано-Франковский национальный медицинский университет
Резюме. Цель исследования: описать особенности патогенеза поражения респираторного отдела легких при экспериментальной индукции системной склеродермии (ССД). Объект и способы. Для моделирования ССД сформирована опытная группа животных из 25 половозрелых крыс линии Wistar (220–240 г); группа контроля насчитывала 20 особей. Лабораторным животным опытной группы вводили трижды в неделю 0,5 мл 5% раствора гипохлорита натрия (NaClO), контрольные особи получали изотонический раствор по той же схеме. Животным обеих групп проведена эвтаназия через 8 нед после начала эксперимента.В ходе исследования определены уровень оксипролина, показатели уровня каталазы, ТБК-активных продуктов, молекул средней массы (МСМ) и диеновых конъюгатов (ДК), в плазме крови. С помощью иммуноферментного анализа установлена концентрация сурфактантного протеина D (Elabscience SP-D ELISA-Kit), молекулы васкулярной адгезии-1 (Elabscience VCAM-1ELISA-Kit) и интерлейкина-13 (Elabscience IL-1 Kit). Для описания морфологических изменений образцы легочной ткани исследованы с помощью световой (Leica DM750, увеличение х200) микроскопии по стандартной методике окраски (гематоксилин и эозин). Результаты. В исследовательской группе животных уровень каталазы был ниже по сравнению с контрольной (9,69±0,67 и 11,1±0,87 г/л соответственно, р<0,05). В то же время показатель ТБК-активных продуктов был выше в группе эксперимента (4,3±0,26 и 3,85±0,23 нмоль/мл соответственно, р<0,05), как и уровень МСМ (0,261±0,027 и 0,247± 0,031, р<0,05) и ДК (0,0139±0,0032 и 0,0060±0,0011, р<0,05). Концентрация оксипролина в плазме крови лабораторных животных из исследовательской группы была достоверно выше по сравнению с контрольными животными (34,03±5,01 и 33,23±2,4 мкмоль/л, р<0,05). В экспериментальной группе выявлены также более высокие показания IL-13 (136,4±56,23 и 9,43±4,01, p<0,05), VCAM-1 (91,25 [межквартильный размах (IQR) 85,63)–143,75] и 17,35±7,47, p<0,05) и SP-D (490,20 [IQR 228,75–568,73] и 70,13±33,21, p<0,05). Гистологический анализ легочных биоптатов экспериментальной группы животных показал нарушения морфологической структуры, характерные для неспецифической интерстициальной пневмонии. Оценка выраженности фиброза по шкале Эшкрофта была значительно выше в исследовательской группе (3,7±0,6) по сравнению с контрольными особями (0,6±0,1), p<0,05. Выводы. Описанная модель экспериментальной индукции ССД позволяет охарактеризовать патогенетические механизмы нарушения морфофункционального состояния респираторного отдела легких, типичные для этой патологии.
Ключевые слова: системная склеродермия, экспериментальное моделирование, гипохлорит натрия, интерстициальное заболевание легких, морфологический анализ.
Адреса для листування
Яцишин Роман Іванович
76018, м. Івано-Франківськ, вул. Галицька, 2
Івано-Франківський національний медичний університет

Leave a comment