ЕКСПЕРИМЕНТАЛЬНЕ МОДЕЛЮВАННЯ СИСТЕМНОЇ СКЛЕРОДЕРМІЇ — ДОСЯГНЕННЯ ТА ВИКЛИКИ: ОГЛЯД ЛІТЕРАТУРИ
Яцишин Р.І.1, Заяць Л.М.2, Доскалюк Б.В.2
- 1ДВНЗ «Івано-Франківський національний медичний університет»
- 2Івано-Франківський національний медичний університет
Резюме. Мета: проведення систематичного огляду літератури для здійснення аналізу доступної наукової інформації щодо методик моделювання захворювання автоімунного генезу, а саме системної склеродермії (ССД), в експериментальних умовах. Матеріали і методи: відбір наукових джерел виконувався згідно з усталеними вимогами до всебічного пошуку літератури, в ході якого використано можливості таких наукометричних баз даних: MEDLINE/PubMed, Cochrane Library, Google Scholar та HINARI. Критеріями включення публікацій до огляду були належне їх оформлення у вигляді оригінальних статей чи оглядів літератури та відповідність використаним пошуковим запитам: «моделювання», «системна склеродермія», «тваринні моделі», «автоімунна патологія»; наукові публікації у формі тез чи клінічних досліджень за участю пацієнтів із ССД були виключені з огляду. Результати. У цій статті наведено результати проведеного аналізу джерел літератури, що відповідали заданій тематиці. Представлено опис п’яти визнаних методик індукції ССД у лабораторних тварин та проаналізовано їхні патогенетичні концепти. У статті висвітлені сильні сторони та недоліки кожної з моделей, а також окреслено потребу їх удосконалення для забезпечення всебічного відтворення патогенетичних механізмів розвитку ССД. Висновки. Експериментальні методики не здатні повною мірою відтворити складні патогенетичні процеси, що лежать в основі ССД. Жодна з моделей не позбавлена певних недоліків, проте лише завдяки лабораторним методам дослідження науковці володіють ексклюзивною можливістю ґрунтовного аналізу цілого ряду вітальних показників на різних стадіях розвитку захворювання та здійснення безпечного пошуку нових потенційно ефективних агентів у боротьбі з ССД.
УДК: 616-092.9+612.75+616.5-004+616-092
DOI: 10.32471/rheumatology.2707-6970.79.14822
Вступ
Сучасна наукова медична спільнота все наполегливіше звертає увагу на проблему патологій автоімунного спектра. З огляду на збереження стійкої тенденції щодо зростання частки захворювань з автоімунним компонентом серед загальної популяції населення та, не в останню чергу, внаслідок значного соціоекономічного тягара, який вони спричиняють, такий інтерес є цілком виправданим (Doskaliuk B. et al., 2020). Кінець ХХ та початок ХІ століття ознаменував різкий стрибок у сфері впровадження ефективних стратегій діагностики та менеджменту автоімунних патологій. Ці досягнення стали можливими завдяки стрімкому розвитку таких, відносно молодих, галузей медицини, як ревматологія та імунологія. Чітке розуміння клітинних та молекулярних механізмів розвитку захворювань дозволило клініцистам впровадити у практику високоефективні таргетні методики терапії. Не слід, щоправда, забувати, що будь-які успіхи клінічної медицини були б неможливими без фундаментальних досліджень, які пролили світло на патогенетичні особливості автоімунної патології. З огляду на низку деонтологічних принципів, які обмежують дослідників при роботі з пацієнтами, стає зрозумілим, що глибинне дослідження основ розвитку захворювань неможливе без використання експериментальних методик.
Системна склеродермія (ССД) — це автоімунне захворювання, що характеризується імунною дисрегуляцією, що відображається у синтезі автоантитіл до тканин власного організму, посиленими процесами фіброзу шкірних покривів та внутрішніх органів, васкулопатією та високою гетерогенністю клінічних проявів (Ingegnoli F. et al., 2018). Це захворювання вважається орфанним, оскільки його поширеність і захворюваність є відносно низькою (Elhai M. et al., 2017). Незважаючи на рідкість зазначеної патології, вона вимагає прискіпливої уваги медичної спільноти. У разі прогредієнтного перебігу ССД із залученням внутрішніх органів кінець захворювання часто є летальним. Серед групи системних захворювань сполучної тканини ця патологія має найбільш виражений негативний вплив на тривалість життя (Morrisroe K. et al., 2017).
Основна мета виконаного нами дослідження — проведення пошуку та аналізу доступних джерел літератури для систематизації даних щодо експериментальних індуцибельних методик моделювання ССД.
Матеріали та методи
Збір та аналіз відповідних наукових джерел здійснено згідно з вимогами систематичного та всебічного пошуку літератури (Gasparyan A.Y. et al., 2011). З цією метою огляд та відбір наукових праць проведено за допомогою таких наукометричних баз даних: MEDLINE/PubMed, Cochrane Library, Google Scholar та HINARI. Окрім цього, для виявлення додаткових джерел виконано аналіз списків використаної літератури статей, відібраних для огляду. Пошук наукових джерел здійснений двома авторами незалежно один від одного з використанням таких ключових слів, як «моделювання», «системна склеродермія», «тваринні моделі», «автоімунна патологія». Жодних часових рамок при пошуку літератури не було встановлено, а перевага надавалась україномовним та англомовним джерелам. Критеріями включення до огляду літератури були: відповідність змісту статей заданій тематиці; оформлення наукових праць у вигляді оригінальних статей чи оглядів літератури. Тези конференцій та статті із залученням до досліджень пацієнтів із ССК не розглядалися.
За результатами пошуку нами розглянуто п’ять основних індуцибельних методик моделювання ССД, а короткий аналіз патогенетичних основ цих моделей відображений на рисунку.
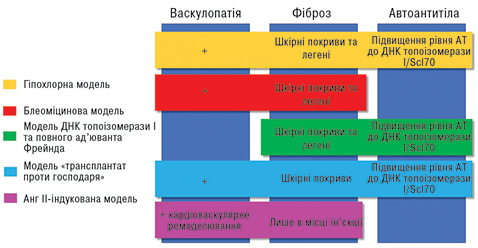
Блеоміцин-індукована модель
Блеоміцин — це глікопептидний хіміотерапевтичний препарат, що продукується Streptomyces verticillus та широко застосовується при лікуванні низки пухлинних захворювань (Raman V. et al., 2014). Хоча використання блеоміцину в онкології характеризується досить високим рівнем ефективності, ця терапія не позбавлена ризику появи виражених побічних ефектів, наприклад склеродермоподібного синдрому (Yamamoto T., 2006). Саме це наштовхнуло дослідників на думку про можливе застосування цього препарату в експериментальному моделюванні ССД, і у 1999 р. японськими вченими було вперше повідомлено про блеоміцинову модель, в якій фіброз шкіри був чітко підтверджений гістологічно та біохімічно (спостерігалося підвищення рівня гідроксипроліну) (Yamamoto T. et al., 1999). Ураження шкіри характеризувалося накопиченням запальних клітин (Т-клітин, моноцитів та гладких клітин), а також профіброгенних цитокінів (таких як трансформуючий фактор росту (TGF)-β та інтерлейкін (IL)-6, проте вартим уваги є також те, що характерні склеротичні зміни спостерігалися лише у ділянці введення препарату та були відсутні у віддалених ділянках тіла експериментальної тварини (Yamamoto T., Nishioka K., 2005). Важливою особливістю цієї моделі є залучення до патогенезу ураження легеневої тканини, яке характеризується розвитком її фіброзу. На противагу поширеній методиці індукції легеневого фіброзу шляхом одноразового інтратрахеального введення препарату, багаторазове підшкірне введення блеоміцину супроводжувалося розвитком відмінної морфологічної картини. Так, після інтратрахеальної інстиляції цього хіміотерапевтичного препарату переважно розвивався перибронхіальний і перибронхіолярний фіброз, а при описаній моделі Т. Ямамото — периваскулярне та субплевральне ураження легеневої тканини (Braun R.K. et al., 1996).
Молекулярною основою склеродермоподібних ефектів блеоміцину є індукція процесів оксидативного стресу в мітохондріях клітин (Yamamoto T. et al., 2005). Важливим результатом цього явища є активація NLRP3 інфламасоми, що призводить до збільшення вираженості синтетазних властивостей фібробластів та, відповідно, до підвищення продукції колагену (Artlett C.M. et al., 2011; Heid M.E. et al., 2013).
Щодо характеристики автоімунного профілю при блеоміциновій моделі ССД дані літератури неоднозначні: було описано як наростання титрів специфічних антитіл (АТ), так і їх відсутність (Yoshizaki A. et al., 2008; Ishikawa H. et al., 2009).
Гіпохлорна модель індукції ССД
Гіпохлорна модель ССД, описана А. Servettaz та співавторами у 2009 р., базується на повторюваному підшкірному введенні прооксидативного агента — гіпохлорної кислоти (HOCl) — і характеризується розвитком вираженого фіброзу шкіри та легень, а також залученням до патогенезу нирок. Однією з переваг цієї експериментальної методики є її відповідність до автоімунного профілю пацієнтів із ССД, а саме підвищення рівня автоантитіл до ДНК топоізомерази-1 у плазмі крові (Tsujino K., Sheppard D., 2016). Гістопатологічний аналіз зразків легеневої тканини виявив потовщення легеневих внутрішньоальвеолярних перегородок, що супроводжувалося значною клітинною інфільтрацією, яка, згідно з результатами імуногістохімічного дослідження, складалася переважно з Т-лімфоцитів. Окрім того, збільшення товщини комплексу інтими-медіа та звуження просвіту судин спостерігалися у дрібних ниркових артеріях експериментальних тварин.
Також детальний аналіз зразків тканин свідчить, що міофібробласти експериментальних тварин, які піддавалися впливу HOCl, виробляють велику кількість колагену, експресують a-SMA та проявляють високу проліферативну активність. Ін’єкція HOCl збільшує також кількість В-лімфоцитів та CD4+ Т-лімфоцитів у селезінці та загальний рівень IgG та IgM у сироватці крові (Batteux F. et al., 2011).
Ключовою ланкою у патогенезі описаних змін є підвищене утворення активних форм кисню (АФК). АФК відіграють безпосередню роль в індукції локального та системного фіброзу, процесі аутоімунної відповіді організму та ушкодженні судин.
У моделі HOCl гіперпродукція АФК стимулює металопротеїназу ADAM17 (disintegrin and metalloproteinase domain 17), що бере участь у протеолітичній активації NOTCH — комплексі рецепторів, головна роль яких полягає в регуляції процесів транскрипції у клітинах (Murthy A. et al., 2012; Artlett C.V. et al., 2014). Цей молекулярний механізм розвитку склеротичних змін наявний і в пацієнтів із ССД (Warde N., 2011), що робить цю модель максимально наближеною до патогенезу зазначеного захворювання у людей. Окрім цього, як і у пацієнтів, у експериментальних тварин, експонованих HOCl, визначають високі рівні активованих фосфорильованих тромбоцитарних (PDGF) та судинних факторів росту ендотелію (VEGF), а також їх рецепторів (PDGFR/VEGFR) (Bagnato G. et al., 2013). Сигнальний шлях PDGF/PDGFR може спричинити розвиток фіброзу, тоді як неконтрольована активація шляху VEGF/VEGFR може бути причиною мікроангіопатії.
Модель з використанням ДНК топоізомерази-1 та повного ад’юванта Фрейнда
А. Yoshizaki та співавтори у 2011 р. повідомили про нову модель індукції ССД, що забезпечувалась імунізацією рекомбінантною топоізомеразою-1 людини та повним ад’ювантом Фрейнда і викликала в експериментальних тварин склероподібний синдром. У ході апробації моделі виявляли шкірний та легеневий фіброз, що супроводжувався зростанням рівня запальних цитокінів у сироватці крові та змивах бронхоальвеолярного лаважу, а також підвищеними сироватковими автоантитілами до топоізомерази-1, що нагадує патологічні закономірності, виявлені у пацієнтів із ССД.
Зміни в цитокіновому балансі включали підвищений рівень IL-4, інтерферону-гамма, IL-10, TGF-β та фактора некрозу пухлини (ФНП)-α (Yoshizaki A. et al., 2011). У ході аналізу змивів бронхоальвеолярного лаважу вдалось встановити, що Т-клітинний профіль зміщений у напрямку Th2 та Th17.
Одним з основних недоліків цієї моделі є важкість її відтворення у лабораторних тварин та наявність джерел літератури, що свідчать про невдачу в моделюванні ССД при використанні цієї методики (Hu P.Q. et al., 2007).
Ангіотензинова модель
Хоча ангіотензин є однією з ключових ланок у регуляції гомеостазу артеріального тиску в людському організмі, проте також зафіксовано і його роль у розвитку фіброзу тканин різних органів та систем (Mezzano S.A. et al., 2001; Bataller R. et al., 2005; Uhal B.D. et al., 2012). Зважаючи на це, L. Stawski та його колегам вдалося розробили експериментальну модель індукції ССД з використанням підшкірної інфузії ангіотензину II (Анг ІІ) (Stawski L. et al., 2012). Введення препарату за цією методикою забезпечувалося підшкірно імплантованими осмотичними насосами, що дозволило доставляти Анг ІІ безперервно. У експериментальних тварин спостерігався помітний фіброз шкіри у ділянці, проксимальній до насоса, із підвищеним вмістом гідроксипроліну та профібротичних генів. Фіброз супроводжувався скупченням міофібробластів та активованих макрофагів у патологічно змінених шкірних покривах. Повідомлялося також, що Анг ІІ може сприяти розвитку ремоделювання судин (Heeneman S. et al., 2007). Попереднє дослідження показало, що застосування ангіотензину підвищувало місцеву експресію VEGF (Zhao Q. et al., 2004).
Гіпохлорна модель індукції ССД була використана для перевірки гіпотези про те, що блокада рецепторів Анг ІІ може знизити вираженість фіброзних змін. Встановлено, що ірбесартан, інгібітор рецепторів Анг II, зменшує товщину шкіри й загальний вміст колагену в ній та навіть знижує рівень антитіл до топоізомерази I (Marut W. et al., 2013). Це підтверджує той факт, що рівень Анг ІІ може відігравати критичну роль у розвитку фіброзного компонента у патогенезі ССД.
Модель «трансплантат проти господаря»
Хронічна реакція трансплантат проти господаря (ХРТПГ) виникає як алогенна агресія активованих Т-клітин та природних кілерів (NK) клітин донора на антигени реципієнта, внаслідок чого відбувається ураження різних тканин організму «господаря». Першими зазвичай маніфестують шкірні ураження, які нагадують прояви ССД (Schroeder M.A., DiPersio J.F., 2011). Модель ХРТПГ розвивається поступово і характеризується прогресуючим потовщенням шкіри. Гістологічне дослідження виявляє фіброз дерми, що супроводжується накопиченням лімфоцитів, NK-клітин, моноцитів і гладких клітин, імітуючи особливості уражень шкіри у деяких пацієнтів із ССД (Zhang Y. et al., 2002). Типовою ознакою ХРТПГ, індукованої ССД, є розвиток системної вазоконстрикції, а в сироватці крові — наростання антитіл до топоізомерази І (Ruzek M.C. et al., 2004). Ця модель характеризує багато особливостей патогенезу ССД і дає змогу відтворювати нирковий криз, що є одним із загрозливих ускладнень ССД (Artlett C.M., 2014).
Висновки
Зазначимо, що будь-які тваринні моделі ССД є лише спрощеними версіями складніших взаємопов’язаних механізмів розвитку цього захворювання в людському організмі. Проте, незважаючи на те що на сьогодні відсутня ідеальна методика індукції ССД, яка б повністю відповідала всім аспектам патогенетичних процесів, використання зазначених методів експериментального моделювання дасть змогу детальніше вивчити зміни морфофункціональних характеристик органів і тканин організму на різних стадіях розвитку ССД. Тваринні моделі є також незамінними інструментами для перевірки науково обґрунтованих гіпотез та розроблення нових методів терапії у пацієнтів із цією патологією.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- Artlett C.M., Sassi-Gaha S., Rieger J.L. et al. (2011) The inflammasome activating caspase-1 mediates fibrosis and myofibroblast differentiation in systemic sclerosis. Arthritis Rheum., 63: 3563–3574. doi: 10.1002/art.30568.
- Artlett C.M. (2014) Animal models of systemic sclerosis: their utility and limitations. Open access rheumatology: research and reviews, 6: 65–81 (https://doi.org/10.2147/OARRR.S50009).
- Bagnato G., Bitto A., Irrera N. et al. (2013) Propylthiouracil prevents cutaneous and pulmonary fibrosis in the reactive oxygen species murine model of systemic sclerosis. Arthritis Res. Ther., 15(5): R120. doi: 10.1186/ar4300.
- Bataller R., Sancho-Bru P., Gines P., Brenner D.A. (2005) Liver fibrogenesis: a newrole for the renin-angiotensin system. Antioxid Redox Signal., 7: 1346–1355.
- Batteux F., Kavian N., Servettaz A. (2011). New insights on chemically induced animal models of systemic sclerosis. Curr. Opin. Rheumatol., 23(6): 511–518.
- Braun R.K., Ferrick D.A., Sterner-Kock A. et al. (1996) Comparison of two models of bleomycin-induced lung fibrosis in mouse on the level of leucocytes and T cell subpopulations in bronchoalveolar lavage. Comp. Haematol. Int., 6: 141 (https://doi.org/10.1007/BF00368457).
- Doskaliuk B., Zimba O., Yatsyshyn R., Kovalenko V. (2020) Rheumatology in Ukraine. Rheumatol. Int., 40(2): 175–182 (https://doi.org/10.1007/s00296-019-04504-4).
- Elhai M., Meune C., Boubaya M. et al. (2017) Mapping and predicting mortality from systemic sclerosis. Ann. Rheum. Dis., 76(11): 1897–1905. doi: 10.1136/annrheumdis-2017-211448.
- Gasparyan A.Y., Ayvazyan L., Blackmore H., Kitas G.D. (2011) Writing a narrative biomedical review: considerations for authors, peer reviewers, and editors. Rheumatol. Int., 31(11): 1409–1417. doi: 10.1007/s00296-011-1999-3.
- Heeneman S., Sluimer J.C., Daemen M.J. (2007) Angiotensin-converting enzyme and vascular remodeling. Circ. Res., 101: 441–454.
- Heid M.E., Keyel P.A., Kamga C. et al. (2013) Mitochondrial reactive oxygen species induces NLRP3-dependent lysosomal damage and inflammasome activation. J. Immunol., 191: 5230–5238.
- Hu P.Q., Hurwitz A.A., Oppenheim J.J. (2007) Immunization with DNA topoisomerase I induces autoimmune responses but not scleroderma-like pathologies in mice. J. Rheumatol., 34: 2243–2252.
- Ingegnoli F., Ughi N., Mihai C. (2018) Update on the epidemiology, risk factors, and disease outcomes of systemic sclerosis. Best Pract. Res. Cl. Rh., 32(2): 223–240.
- Ishikawa H., Takeda K., Okamoto A. et al. (2009) Induction of autoimmunity in a bleomycin-induced murine model of experimental systemic sclerosis: an important role for CD4+ T cells. J. Invest. Dermatol., 129: 1688–1695.
- Marut W., Kavian N., Servettaz A. et al. (2013) Amelioration of systemic fibrosis in mice by angiotensin II receptor blockade. Arthritis Rheum., 65: 1367–1377.
- Mezzano S.A., Ruiz-Ortega M., Egido J. (2001) Angiotensin II and renal fibrosis. Hypertension, 38: 635–638.
- Morrisroe K., Stevens W., Sahhar J. et al. (2017) Epidemiology and disease characteristics of systemic sclerosis-related pulmonary arterial hypertension: results from a real-life screening programme. Arthritis Res. Ther., 19(1): 42. doi: 10.1186/s13075-017-1250-z.
- Murthy A.,Shao Y.W., Narala S.R. et al. (2012) Notch activation by the metalloproteinase ADAM17 regulates myeloproliferation and atopic barrier immunity by suppressing epithelial cytokine synthesis. Immunity, 36(1): 105–119.
- Raman V., Quillen K., Sloan J.M. (2014) Acquired Glanzmann thrombasthenia associated with Hodgkin lymphoma: rapid reversal of functional platelet defect with ABVD (adriamycin/bleomycin/ vinblastine/dacarbazine) chemotherapy. Clin. Lymphoma Myeloma Leuk.,14: e51–e54. doi: 10.1016/j.clml.2013.10.004.
- Ruzek M.C., Jha S., Ledbetter S. et al. (2004) A modified model of graft-versus-host-induced systemic sclerosis (scleroderma) exhibits all major aspects of the human disease. Arthritis Rheum., 50: 1319–1331.
- Schroeder M.A., DiPersio J.F. (2011) Mouse models of graft-versus-host disease: advances and limitations. Dis. Model. Mech., 4: 318–333.
- Servettaz A., Goulvestre C., Kavian N. et al. (2009) Selective oxidation of DNA topoisomerase 1 induces systemic sclerosis in the mouse. J. Immunol., 182: 5855–5864.
- Stawski L., HanR., Bujor A.M., Trojanowska M. (2012) Angiotensin II induces skin fibrosis: a novel mouse model of dermal fibrosis. Arthritis Res. Ther., 14: R194. doi: 10.1186/ar4028.
- Tsujino K., Sheppard D. (2016) Critical appraisal of the utility and limitations of animal models of scleroderma. Curr. Rheumatol. Rep., 18(1): 4 (https://doi.org/10.1007/s11926-015-0553-9).
- Uhal B.D., Li X., Piasecki C.C., Molina-Molina M. (2012) Angiotensin signalling in pulmonary fibrosis. Int. J. Biochem. Cell. Biol., 44: 465–468.
- Warde N. (2011) Notch signaling: an important player in SSc fibrosis. Nature Reviews Rheumatology., 7(6): 312. doi: 10.1038/nrrheum.2011.55.
- Yamamoto T., Nishioka K. (2005) Cellular and molecular mechanisms of bleomycin-induced murine scleroderma: current update and future perspective. Exp. Dermatol., 14: 81–95.
- Yamamoto T., Takagawa S., Katayama I. et al. (1999) Animal model of sclerotic skin. Local injections of bleomycin induce sclerotic skin mimicking scleroderma. J. Invest. Dermatol., 112: 456–462.
- Yamamoto T. (2006) Bleomycin and the skin. Br. J. Dermatol., 155: 869–875.
- Yoshizaki A., Iwata Y., Komura K. et al. (2008) CD19 regulates skin and lung fibrosis via Toll-like receptor signaling in a model of bleomycin-induced scleroderma. Am. J. Pathol., 172: 1650–1663.
- Yoshizaki A., Yanaba K., Ogawa A. et al. (2011) Immunization with DNA topoisomerase I and Freund’s complete adjuvant induces skin and lung fibrosis and autoimmunity via interleukin-6 signaling. Arthritis Rheum., 63: 3575–3585.
- Zhang Y., McCormick L.L., Desai S.R. et al. (2002) Murine sclerodermatous graft-versus-host disease, a model for human scleroderma: cutaneous cytokines, chemokines, and immune cell activation. J. Immunol., 168: 3088–3098.
- Zhao Q., Ishibashi M., Hiasa K. et al. (2004) Essential role of vascular endothelial growth factor in angiotensin II-induced vascular inflammation and remodeling. Hypertension., 44: 264–270.
ЭКСПЕРИМЕНТАЛЬНОЕ МОДЕЛИРОВАНИЕ СИСТЕМНОЙ СКЛЕРОДЕРМИИ — ДОСТИЖЕНИЯ И ВЫЗОВЫ: ОБЗОР ЛИТЕРАТУРЫ
Резюме. Цель: проведение систематического обзора литературы для осуществления анализа доступной научной информации о методиках моделирования заболевания аутоиммунного генеза, а именно системной склеродермии (ССД), в экспериментальных условиях. Материалы и методы: отбор научных источников выполнялся согласно устоявшимся требованиям к всестороннему поиску литературы, в ходе которого использованы возможности следующих наукометрических баз данных: MEDLINE/PubMed, Cochrane Library, Google Scholar и HINARI. Критериями включения статьи в обзор были должное их оформление в виде оригинальных статей или обзоров литературы и соответствие использованным поисковым запросам: «моделирование», «системная склеродермия», «животные модели», «аутоиммунная патология»; научные публикации в форме тезисов или клинических исследований с участием пациентов с ССД были исключены из обзора. Результаты. В данной статье приведены результаты анализа источников литературы, соответствующих заданной тематике. Представлено описание пяти признанных методик индукции ССД у лабораторных животных и проанализированы их патогенетические концепты. В статье освещены сильные стороны и недостатки каждой модели, а также обозначена необходимость их совершенствования для обеспечения всестороннего воспроизведения патогенетических механизмов развития ССД. Выводы. Экспериментальные методики не способны в полной мере воспроизвести сложные патогенетические процессы, лежащие в основе ССД. Ни одна из моделей не лишена определенных недостатков, однако только благодаря лабораторным методам исследования ученые обладают эксклюзивной возможностью детального анализа целого ряда жизненных показателей на разных стадиях развития заболевания и осуществления безопасного поиска новых потенциально эффективных агентов в борьбе с ССД.
Ключевые слова: системная склеродермия, аутоиммунная патология, моделирование, экспериментальные методики, лабораторные животные, патогенез.
Адреса для листування:
Доскалюк Богдана Вікторівна
76018, Івано-Франківськ, вул. Галицька, 2
Івано-Франківський національний медичний університет
E-mail: Doskaliuk_Bo@ifnmu.edu.ua

Leave a comment