ПОРІВНЯННЯ ЕФЕКТИВНОСТІ ТА БЕЗПЕКИ ПЕРЕХОДУ ВІД ОРИГІНАЛЬНОГО ІНФЛІКСИМАБУ ДО ЙОГО БІОСИМІЛЯРУ ФЛАММЕГІС®* В УМОВАХ РУТИННОЇ МЕДИЧНОЇ ПРАКТИКИ
Створення біологічних препаратів дозволило досягти значного прогресу в лікуванні при багатьох захворюваннях. Так, інгібітори фактора некрозу пухлини (ФНП), до яких належить інфліксимаб, поліпшують перебіг хвороби Крона, неспецифічного виразкового коліту, анкілозивного спондиліту, ревматоїдного артриту, псоріатичного артриту та бляшкового псоріазу [1, 2]. Однак біопрепарати є високотехнологічними продуктами, вартість розроблення і виробництва яких досить висока, що істотно підвищує витрати на лікування. Це, у свою чергу, призводить до відсутності доступу пацієнтів до сучасних ефективних видів терапії, що стає все актуальнішою проблемою в деяких країнах [3, 4].
Водночас закінчення терміну дії патентного захисту цих оригінальних препаратів відкриває для пацієнтів нові можливості лікування з використанням їх біосимілярів, які покликані розширити доступ хворих до сучасних терапевтичних підходів, оскільки вони зазвичай дешевші, ніж референтні препарати [5–9].
Регуляторні органи схвалюють біосиміляр на підставі широкого спектра даних, які покликані підтвердити його відповідність референтному препарату. Наприклад, Європейське агентство з лікарських засобів (European Medicines Agency — EMA) дає схвалення біосиміляру на підставі даних про високу фізико-хімічну та біологічну подібність до референтного препарату [10]. Для схвалення біосиміляру також часто потрібні статистично підтверджені еквівалентність фармакокінетичних характеристик, ефективність та профіль безпеки в ході клінічних досліджень [11].
Біосиміляр інфліксимабу CT-P13 було схвалено EMA у 2013 р. та Управлінням з контролю якості харчових продуктів і лікарських препаратів США (Food and Drug Administration — FDA) у 2016 р., а в Україні він доступний із серпня 2016 р. під торговою назвою Фламмегіс®. Біосиміляр інфліксимабу схвалений для тих же показань, що й референтний інфліксимаб, а саме для лікування при ревматоїдному артриті, хворобі Крона у дорослих і дітей, при виразковому коліті, анкілозивному спондиліті, псоріатичному артриті та псоріазі [12]. Схвалення біосиміляру інфліксимабу базувалося на даних, отриманих при проведенні широкого кола доклінічних і клінічних досліджень.
Біосиміляр інфліксимабу і референтний інфліксимаб — химерні (гібридні) мишачо-людські моноклональні антитіла імуноглобуліну G1, спрямовані проти ФНП, які виробляються за допомогою технології рекомбінантної ДНК в одній і тій же лінії гібридомних клітин миші. Природа біологічних продуктів така, що обидва препарати насправді становлять собою складні суміші ряду схожих форм, таким чином демонструючи мікрогетерогенність. Ці два лікарських засоби мають ідентичні фармацевтичну форму, силу впливу, склад і спосіб введення, таким чином, інструкції з дозування та введення для кожного препарату також ідентичні. Усі основні фізико-хімічні характеристики та біологічна активність біосиміляру і референтного інфліксимабу, які на сьогодні можна виміряти, були вивчені і є порівнянними [13–15].
При цьому питання взаємозаміни референтного препарату та його біосиміляру, особливо якщо пацієнт успішно лікується оригінальним лікарським засобом, часто залишаються предметом дискусії. Були висловлені побоювання щодо ефективності, безпеки та утворення антитіл до лікарських засобів при переході на біосиміляри у пацієнтів, які досягли успіху під час стабільної терапії оригінальним препаратом [16, 17]. Рандомізовані контрольовані дослідження у пацієнтів, які раніше не приймали інгібіторів ФНП, під час яких порівнювали оригінальний інфліксимаб із біосиміляром CT-P13, були проведені при діагностованому анкілозивному спондиліті (PLANETAS [18]) та ревматоїдному артриті (PLANETRA [19]). Додаткова інформація, взята з досліджень PLANETAS і PLANETRA, а також дані спостережень свідчать про те, що перехід від оригінального інфліксимабу до біосиміляру CT-P13 безпечний та не знижує ефективності терапії, незважаючи на те що незалежних і рандомізованих досліджень не проводилося. При цьому, згідно з рекомендацією щодо затвердження нормативних вимог до біосимілярів, CT-P13 був затверджений для всіх шести відповідних показань [20–22]. Ця екстраполяція показань щодо застосування обговорювалася у різних клінічних спільнотах, особливо в гастроентерології [23, 24], оскільки механізми дії інфліксимабу можуть відрізнятися залежно від показань [25, 26].
З огляду на вищесказане розглянемо питання порівнянності профілів ефективності та безпеки біосиміляру інфліксимабу та його референтного препарату й можливості переходу на біосиміляр при лікуванні всього спектра захворювань, при яких показано призначення цих препаратів: хвороби Крона, виразкового коліту, анкілозивного спондиліту, ревматоїдного артриту, псоріатичного артриту та бляшкового псоріазу. Саме цю проблему було покликане вирішити дослідження норвезьких вчених NOR-SWITCH [2]. Мета дослідження NOR-SWITCH — вивчення наслідків переходу з оригінального інфліксимабу на біосиміляр CT-P13 з нижчою вартістю щодо ефективності, безпеки та імуногенності.
Дослідження NOR-SWITCH — 52-тижневе рандомізоване подвійне сліпе паралельногрупове багатоцентрове порівняльне дослідження IV фази в умовах стаціонару, що охоплює всі шість відповідних діагнозів, для лікування при яких на сьогодні схвалений лікарський засіб інфліксимаб, та проводили його, щоб оцінити, чи не поступається біосиміляр CT-P13 оригінальному інфліксимабу в ефективності, безпеці та імуногенності в пацієнтів, яким вдалося стабілізувати перебіг хвороби при лікуванні оригінальним інфліксимабом протягом не менше 6 міс [2]. Пацієнти за інформованою згодою були рандомізовані у співвідношенні 1:1: 1-ша група продовжувала отримувати терапію оригінальним інфліксимабом, 2-га група була переведена з лікування оригінальним препаратом на терапію препаратом CT-P13 з незмінним режимом дозування. Дослідження проводили на базі 40 дослідних центрів у Норвегії.
Первинною кінцевою точкою дослідження було прогресування захворювання під час подальшого спостереження, зокрема погіршення специфічних для захворювання комплексних показників, або спільна думка дослідника та пацієнта про погіршення перебігу захворювання, що призводить до суттєвих змін у виборі лікування. Прогресування захворювання з урахуванням специфічних для захворювання комплексних показників визначали відповідно до динаміки перебігу хвороби, тобто від початкового рівня за індексом Харві — Бредшоу ≥4 бали та ≥7 балів — для хвороби Крона, зміни від початкового рівня за шкалою Майо ≥3 бали та ≥5 балів для виразкового коліту, зміни від початкового рівня за шкалою ASDAS (Ankylosing Spondylitis Disease Activity Score) ≥1,1 з досягненням мінімального рівня 2,1 для анкілозивного спондиліту, зміни від початкового рівня за шкалою активності захворювання (Disease Activity Score) у 28 суглобах ≥1,2 з досягненням мінімальної оцінки 3,2 для ревматоїдного артриту та псоріатичного артриту, а також зміни за шкалою Psoriasis Area and Severity Index ≥3 балів та ≥5 балів — для бляшкового псоріазу [27–31].
Вторинні кінцеві точки дослідження включали час до загострення захворювання, дострокове завершення терапії досліджуваним препаратом, загальний статус ремісії на базі основних комплексних показників, зміни в загальних оцінках дослідника та пацієнта, а також наявних змін у таких показниках, як швидкість осідання еритроцитів (ШОЕ) і рівень С-реактивного білка (СРБ).
У період з 24 жовтня 2014 р. по 8 липня 2015 р. було набрано 498 пацієнтів, з них 482 рандомізовані для дослідження у 40 центрах. 241 пацієнтові було призначено продовження лікування оригінальним інфліксимабом, 241 пацієнтові — перехід від оригінального інфліксимабу до його біосиміляру CT-P13. Пацієнти спостерігалися протягом 52 тиж у кожній терапевтичній групі. Повна вибірка для аналізу включала 481 пацієнта (241 — у групі оригінального інфліксимабу та 240 — у групі біосиміляру CT-P13; один рандомізований пацієнт відкликав свою згоду щодо проведення лікування), а вибірка учасників, які виконали вимоги протоколу, включала 408 пацієнтів (202 — у групі оригінального інфліксимабу та 206 — у групі CT-P13) (рис. 1).
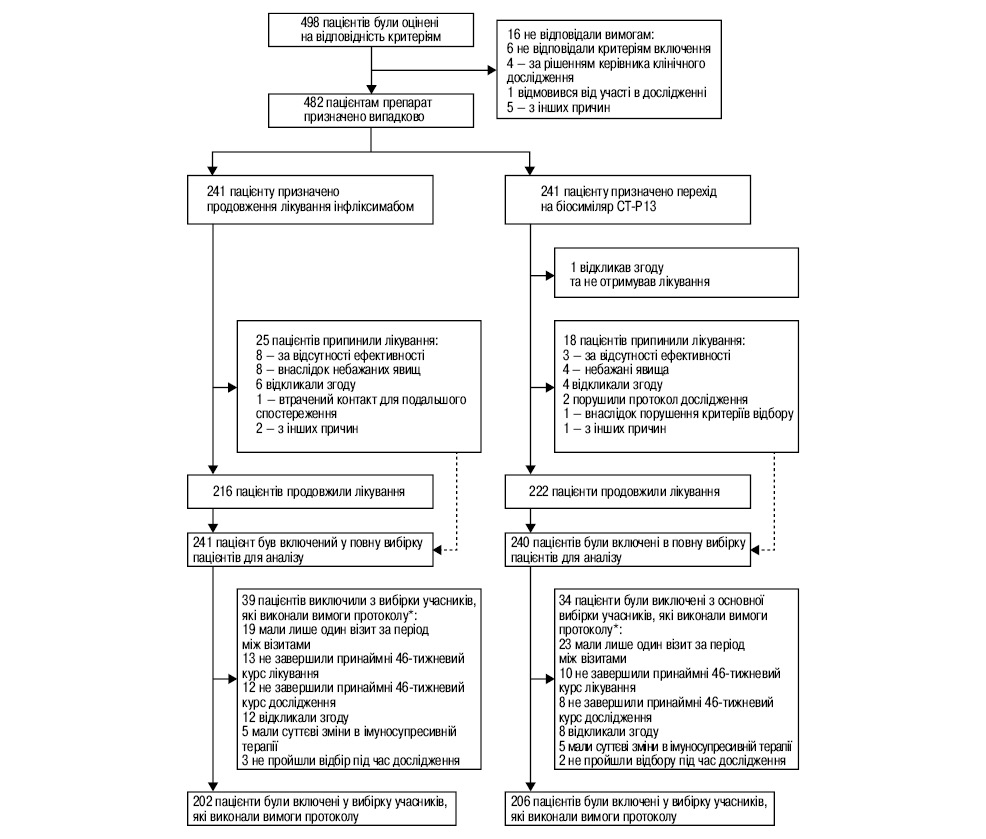
*У деяких пацієнтів було більше однієї причини для виключення з вибірки учасників, які виконали вимоги протоколу.
У повній вибірці пацієнтів для аналізу 186 (39%) учасників — жінки, середній вік становив 47,9 року (стандартне відхилення —14,8), а середня тривалість лікування оригінальним препаратом інфліксимабом до рандомізації становила 6,8 року (стандартне відхилення — 3,7). У 155 (32%) пацієнтів була хвороба Крона, у 93 (19%) — виразковий коліт, у 91 (19%) — спондилоартрит, у 77 (16%) — ревматоїдний артрит, у 30 (6%) — псоріатичний артрит і у 35 (7%) — хронічний плямистий (бляшкоподібний) псоріаз (повна вибірка пацієнтів для аналізу) (табл. 1). Ці дві експериментальні групи мали схожі характеристики в основних вихідних анкетних даних та показниках захворювання як в повній вибірці пацієнтів для аналізу (див. табл. 1), так і у вибірці учасників, які виконали вимоги протоколу. Як загальні, так і специфічні для захворювання комплексні показники свідчать про низьку активність захворювання на момент включення в дослідження (див. табл. 1).
| Показник | Оригінальний інфліксимаб (n=241) | CT-P13 (n=240) |
|---|---|---|
| Анкетні дані | ||
| Вік, років | 47,5 (14,8) | 48,2 (14,9) |
| Жінки | 99 (41%) | 87 (36%) |
| Тривалість захворювання, років | 16,6 (10,9) | 17,5 (10,5) |
| Тривалість безперервної терапії інфліксимабом, років | 6,7 (3,6) | 6,9 (3,8) |
| Попередня біологічна терапія | ||
| Інгібітори ФНП | ||
| Не застосовували | 188 (78%) | 188 (78%) |
| Застосовували один | 43 (18%) | 40 (17%) |
| Застосовували два | 10 (4%) | 9 (4%) |
| Застосовували три чи більше | 0 | 3 (1%) |
| Інші біологічні препарати | 2 (1%) | 1 (<1%) |
| Супутня імуносупресивна терапія* | 113 (47%) | 129 (54%) |
| Одночасне застосування преднізолону | 13 (5%) | 13 (5%) |
| Діагноз | ||
| Хвороба Крона | 78 (32%) | 77 (32%) |
| Виразковий коліт | 47 (20%) | 46 (19%) |
| Спондилоартрит | 45 (19%) | 46 (19%) |
| Ревматоїдний артрит | 39 (16%) | 38 (16%) |
| Псоріатичний артрит | 14 (6%) | 16 (7%) |
| Псоріаз | 18 (7%) | 17 (7%) |
| Основні базові характеристики | ||
| ШОЕ, мм/год | 8 (4–14) | 8 (5–16) |
| СРБ, мг/л | 2,2 (1,0–5,0) | 2,0 (1,0–5,0) |
| Сукупна оцінка перебігу захворювання пацієнтом (0–10) | 2,0 (1,9) | 2,2 (2,1) |
| Сукупна оцінка перебігу захворювання лікарем (0–10) | 1,2 (1,2) | 1,2 (1,3) |
| Оцінка стану здоров’я за індексом EQ-5D | 0,8 (0,2) | 0,8 (0,2) |
| Основні характеристики специфічних для захворювання комплексних показників | ||
| Хвороба Крона | ||
| Індекс Харві — Бредшоу | 2 (1–4) | 2 (0–4) |
| Виразковий коліт | ||
| Оцінка показників за шкалою Мейо | 0 (0–1) | 0 (0–1) |
| Хвороба Крона та виразковий коліт | ||
| Фекальний кальпротектин, мг/кг | 56 (25–17З) | 53 (22–210) |
| Анкілозивний спондиліт | ||
| Позитивний HLA-B27 | 31/33 (94%) | 33/З8 (87%) |
| BASDAI | 2,6 (1,5) | 3,6 (1,7) |
| ASDAS | 1,7 (0,7) | 2,1 (0,8) |
| Ревматоїдний артрит | ||
| Кількість пацієнтів, позитивних щодо антитіл до цитрулінованих пептидів† | 25/З0 (83%) | 20/27 (74%) |
| Кількість пацієнтів, позитивних щодо ревматоїдного фактора | 27/38 (71%) | 25/33 (76%) |
| Псоріатичний артрит | ||
| Оцінка активності захворювання у 28 суглобах за рівнем СРБ | 2,7 (1,1) | 2,2 (0,9) |
| Клінічний індекс активності захворювання | 5,7 (4,1) | 4,1 (3,2) |
| Спрощений індекс активності захворювання | 5,9 (4,1) | 4,5 (3,2) |
| Анкілозивний спондиліт, ревматоїдний артрит і псоріатичний артрит | ||
| Зміни у висновку щодо стану здоров’я згідно з опитуванням | 0,3 (0,3) | 0,3 (0,4) |
| Псоріаз | ||
| Індекс площі та тяжкості псоріазу | 2,3 (1,9) | 3,0 (1,7) |
Дані: n (%), середній показник (SD) або середній період спостереження (IQR). HLA — антиген лейкоцитів людини. EQ-5D — опитувальник якості життя «Євроквол груп» за п’ятьма аспектами (оснований на зважених даних Великобританії). *Супутнє імуносупресивне лікування, яке включає метотрексат, лефлуномід, сульфасалазин, азатіоприн та меркаптопурин. †Щодо деяких пацієнтів були відсутні дані.
Прогресування захворювання спостерігалося в 53 (26%) пацієнтів у групі оригінального інфліксимабу та у 61 (30%) пацієнта у групі CT-P13 (вибірка учасників, які виконали вимоги протоколу) (рис. 2). 95% довірчий інтервал (ДІ) для скоригованої різновидності ризику (–4,4%) становив від –12,7 до 3,9% та знаходився в діапазоні попередньо встановленої межі не нижчої ефективності 15%. Таким чином, отримані нами результати свідчать, що біосиміляр CT-P13 не поступається оригінальному інфліксимабу (тобто основна гіпотеза була відкинута). Скоригований відносний ризик прогресування захворювання у групі CT-P13 становив 1,17 (95% ДІ 0,82–1,52) порівняно з групою оригінального інфліксимабу.
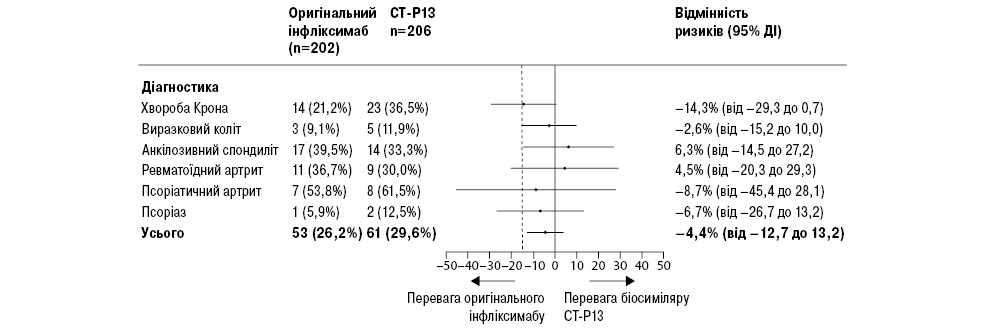
Ремісія спостерігалася у 123 (61%) пацієнтів у групі оригінального інфліксимабу та у 126 (61%) пацієнтів групи CT-P13, зі скоригованим коефіцієнтом тривалості впливу 0,6% (95% ДІ від –7,5 до 8,8%; вибірка учасників, які виконали вимоги протоколу).
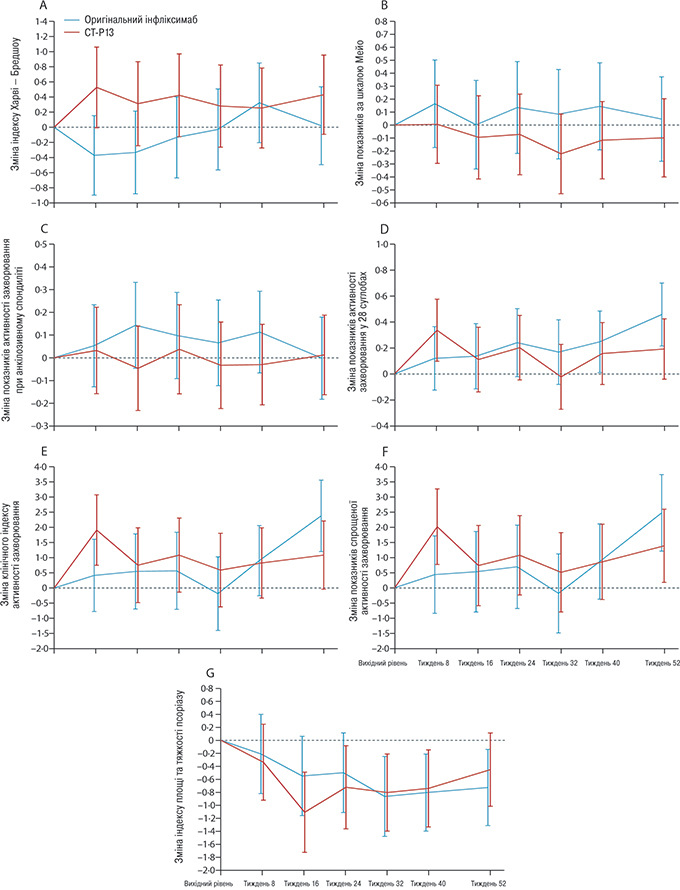
Стан захворювання на момент включення в дослідження та зміни у специфічних для захворювання комплексних показниках і специфічних для кожного захворювання показниках від початкового рівня до закінчення спостереження були в цілому однаковими в обох групах як у вибірці учасників, які виконали вимоги протоколу (табл. 2), так і в повній вибірці пацієнтів для аналізу. На рис. 3 представлені специфічні для цих шести захворювань комплексні показники, зафіксовані за період спостереження; не спостерігали відмінностей між двома терапевтичними групами пацієнтів. Як виявилося, зміни в показниках перебігу захворювання, про які повідомили пацієнти, були аналогічними у вибірці учасників, які виконали вимоги протоколу (див. табл. 2), та в повній вибірці пацієнтів для аналізу. Проте було відзначено статистично достовірні відмінності у двох кінцевих точках дослідження у вибірці учасників, які виконали вимоги протоколу (оцінка активності захворювання за MHAQ та підсумкова оцінка стану фізичного здоров’я за SF-З6), і обидва були на користь CT-P13 (див. табл. 2).
| Показники | Вихідний рівень | Через 52 тиж | Різниця 52 тиж (95% ДІ) | ||
|---|---|---|---|---|---|
| Оригінальний інфліксимаб (n=202) | CT-P13 (n=206) | Оригінальний інфліксимаб (n=202) | CT-P13 (n=206) | ||
| Зміни в показниках* | |||||
| Сукупна оцінка перебігу захворювання лікарем | 1,2 (1,2) | 1,2 (1,3) | 04 (1,6) | 0,1 (1,6) | –0,15 (від –0,39 до 0,09) |
| Сукупна оцінка перебігу захворювання пацієнтом | 2,0 (1,9) | 2,2 (2,0) | 0,4 (1,9) | 0,3 (2,2) | –0,04 (від –0,37 to 0,29) |
| ШОЕ, мм/год, log10 | 0,9 (0,4) | 0,9 (0,4) | 0 (0,3) | 0 (0,3) | –0,02 (від –0,06 до 0,03) |
| СРБ, мг/л, log10 | 0,4 (0,4) | 0,4 (0,4) | 0 (0,3) | 0 (0,4) | –0,02 (від –0,09 до 0,04) |
| Кальпротектин, мг/кг, log10 | 1,8 (0,6) | 1,9 (0,7) | 0 (0,5) | 0,1 (0,5) | 0–03 (від –0,12 до 0,18) |
| Індекс Харві — Бредшоу (хвороба Крона) | 2,6 (2,4) | 2,6 (2,4) | 0,3 (2,3) | 0,5 (3,1) | 0–41 (від –1,14 до 0,33) |
| Оцінка показників за шкалою Мейо (виразковий коліт) | 0,6 (1,3) | 0,6 (1,3) | 0,1 (1,3) | –0,2 (1,7) | 0,14 (від –0,30 до 0,59) |
| Оцінка активності захворювання за шкалою ASDAS (анкілозивний спондиліт) |
1,7 (0,7) | 2,1 (0,8) | 0,1 (0,6) | –0,2 (0,7) | –0,01 (від –0,27 до 0,24) |
| Оцінка активності захворювання за шкалою DAS28 (ревматоїдний артрит і псоріатичний артрит) |
2,5 (1,0) | 2,2 (0,9) | 0,3 (1,0) | 04 (0,9) | 0,27 (від –0,07 до 0,61) |
| Оцінка активності захворювання за індексом CDAI (ревматоїдний артрит і псоріатичний артрит) |
5,0 (3,5) | 4,0 (3,1) | 1,5 (5,5) | 0,7 (3,9) | 1,29 (від –0,35 до 2,94) |
| Оцінка активності захворювання за індексом SDAI (ревматоїдний артрит і псоріатичний артрит) |
5,4 (3,5) | 4,5 (3,1) | 1,6 (57) | 0,7 (4,4) | 1,09 (від –0,68 до 2,86) |
| Оцінка захворювання за індексом PASI (псоріаз) | 2,2 (1,9) | 3,1 (17) | –0,5 (1,9) | –0,4 (1,9) | –0,28 (від –1,10 до 0,55) |
| Змінна, яка відображає стан† | |||||
| Ремісія показників індексу Харві — Бредшоу (хвороба Крона) | 41 (62%) | 43 (68%) | 46 (70%) | 41 (65%) | 6,1% (від –9,6 до 21,9) |
| Ремісія показників індексу за шкалою Мейо (виразковий коліт) | 30 (91%) | 38 (90%) | 29 (88%) | 39 (93%) | –5,0% (від –18,6 до 8,6) |
| Оцінка активності захворювання за шкалою ASDAS (спондилоартрит) | 16 (37%) | 8 (19%) | 10 (23%) | 7 (17%) | 6,6% (від –10,3 до 23,5) |
| Оцінка стану ремісії захворювання за шкалою DAS28 (ревматоїдний артрит і псоріатичний артрит) | 26 (60%) | 30 (70%) | 23 (53%) | 25 (58%) | –5,9% (від –27,3 до 15,4) |
| Оцінка стану ремісії за індексом CDAI (ревматоїдний артрит і псоріатичний артрит) | 11 (26%) | 15 (35%) | 11 (26%) | 14 (33%) | –6,3% (від –26,0 до 13,4) |
| Оцінка стану ремісії за індексом SDAI (ревматоїдний артрит і псоріатичний артрит) | 17 (40%) | 18 (42%) | 15 (35%) | 17 (40%) | –1,4% (від –22,2 до 19,5) |
| Оцінка стану ремісії за ACR/EULAR (ревматоїдний артрит і псоріатичний артрит) | 14 (33%) | 12 (28%) | 9 (21%) | 11 (26%) | –2 ,4% (від –20,6 до 15,7) |
| Оцінка повного очищення за індексом PASI (хронічний плямистий (бляшкоподібний) псоріаз) | 1 (6%) | 0 | 4 (24%) | 2 (13%) | 11,0% (від –14,6 до 36,6) |
| Оцінка легкого та середнього ступеня тяжкості захворювання за індексом PASI (псоріаз) | 17 (100%) | 16 (100%) | 16 (94%) | 15 (94%) | 0,4% (від –15,9 до 16,6) |
| Оцінка ремісії за індексом PASI (псоріаз) | 15 (88%) | 12 (75%) | 15 (88%) | 14 (88%) | 0,7% (від –21,5 до 23,0) |
| Дострокове завершення дослідження препарату | – | – | 9 (4%) | 8 (4%) | 0,4% (від –3,4 до 4,3) |
| Показники результатів захворювання, про які повідомили пацієнти | |||||
| Оцінка фізичного функціонування за SF-З6 | 50,6 (11,3) | 50,5 (10,9) | –1,2 (7,0) | 0 (6,3) | –0,91 (від –2,08 до 0,27) |
| Роль обмеження фізичних функцій за SF-36 | 45,6 (11,6) | 46,9 (11,3) | –1,1 (11,2) | –0,4 (9,4) | –1,31 (від –2,99 до 0,37) |
| Оцінка болю за SF-З6 | 47,2 (8,5) | 47,8 (9,5) | –0,7 (7,3) | –0,5 (7,7) | –0,46 (від –1,69 до 0,78) |
| Оцінка загального стану здоров’я за SF-З6 | 43,5 (10,2) | 44,5 (10,2) | –1,1 (7,3) | –14 (7,1) | –076 (від –2,02 до 0,49) |
| Оцінка емоційного стану за SF-З6 | 50,0 (9,8) | 50,9 (8,9) | –1,3 (7,8) | –0,7 (7,8) | –0,47 (від –1,85 до 0,90) |
| Роль обмеження емоційного стану за SF-3 | 48,8 (108) | 50,0 (10,4) | –0,5 (12,2) | –2,4 (10,5) | 1,42 (від –0,36 до 3,20) |
| Оцінка соціального функціонування за SF-З6 | 48,0 (10,5) | 48,6 (9,5) | –0,2 (9,4) | –0,6 (10,4) | 076 (від –075 до 227) |
| Оцінка активності або втоми за SF-З6 | 47,1 (10,4) | 46,9 (10,2) | –1,9 (8,5) | 0,5 (8,3) | –1,40 (від –2,84 до 0,03) |
| Підсумкова оцінка стану фізичного здоров’я за SF-З6 | 46,4 (10,1) | 46,8 (10,3) | –1,2 (6,9) | 02 (6,6) | –1,60 (від –2,74 до ,0,46) |
| Підсумкова оцінка стану психічного здоров’я за SF-З6 | 49,1 (10,7) | 50,3 (9,3) | –0,7 (8,9) | –1,3 (8,9) | 0,74 (від –0,76 до 224) |
| Оцінка стану за індексом EQ-5D | 0,8 (0,2) | 0,8 (0,2) | 0 (0,2) | 0 (02) | –0,02 (від –0,05 до 0,01) |
| Частка пропущених робочих годин внаслідок зазначеної проблеми за WPAI (абсентеїзм) | 5,7 (15,6) | 7,6 (22,5) | 1,9 (19,5) | 1,4 (19,2) | 0,28 (від –4,91 до 5,46) |
| Частка порушення працездатності внаслідок зазначеної проблеми за WPAI (презентеїзм) | 15,1 (19,2) | 15,5 (20,4) | 3,6 (21,6) | 6,5 (21,3) | –3,68 (від –8,22 до 0,86) |
| Частка порушення повсякденної діяльності внаслідок зазначеної проблеми за WPAI | 19,0 (23,0) | 18,6 (25,0) | 3,5 (25,1) | 64 (24,2) | –1,60 (від –7,34 до 4,13) |
| Частка зниження повсякденної діяльності внаслідок зазначеної проблеми за індексом WPAI | 24,2 (24,4) | 24,3 (24,9) | 0,9 (21,8) | 1,6 (22,4) | –0,99 (від –4,49 до 2,51) |
| Загальний показник за IBDQ (хвороба Крона та виразковий коліт) | 189,5 (22,5) | 187,0 (24,9) | –1,4 (19,4) | 0,4 (182) | –0,72 (від –5,00 до 3,56) |
| Оцінка активності захворювання за MHAQ (анкілозивний спондиліт, ревматоїдний артрит і псоріатичний артрит) | 0,3 (0,3) | 0,3 (0,3) | 0,4 (0,2) | 0,0 (0,3) | 0,08 (від 0,01 до 0,45) |
| Оцінка активності захворювання за індексом BASDAI (анкілозивний спондиліт) | 2,7 (1,4) | 3,5 (1,7) | 0,3 (1,0) | –0,2 (1,4) | –0,02 (від –0,50 до 0,47) |
| Загальний показник захворювання за шкалою RAID (ревматоїдний артрит) | 2,2 (1,3) | 2,0 (1,6) | 0,6 (1,2) | 0,2 (1,4) | 0,47 (від –0,14 до 1,08) |
| Загальний показник за шкалою PsAID (псоріатичний артрит) | 2,9 (1,6) | 2,8 (1,5) | 0,5 (1,2) | 0,0 (1,4) | 0,41 (від –0,44 до 1,26) |
| Загальний показник захворювання за індексом DLQI (псоріаз) | 2,5 (3,4) | 3,2 (4,1) | –0,6 (2,0) | –0,5 (2,0) | –0,63 (від –1,83 до 0,58) |
MHAQ — модифікований опитувальний лист стану здоров’я. BASDAI — Батський індекс активності захворювання при анкілозивному спондиліті. ASDAS —шкала оцінки активності захворювання при анкілозивному спондиліті. DAS28 — оцінка активності захворювання у 28 суглобах за рівнем СРБ. CDAI — клінічний індекс активності захворювання. SDAI — спрощений індекс активності захворювання. ACR/EULAR— Американська колегія ревматологів/Європейська антиревматична ліга. PASI — індекс площі та тяжкості псоріазу. SF-36=RAND — короткий опитувальник оцінки загального стану здоров’я з t-пунктів із використанням норвезьких норм. EQ-5D — опитувальник якості життя «Євроквол груп» за п’ятьма аспектами, заснований на зважених даних Великобританії. WPAI — опитувальник порушення працездатності та повсякденної діяльності. IBDQ — опитувальник щодо запальних захворювань кишечнику. RAID — вплив ревматоїдного артриту на захворювання. PsAID — вплив псоріатичного артриту на захворювання. DLQI — індекс якості життя при захворюваннях шкіри. *Дані становлять собою середнє значення на момент включення в дослідження та середнє стандартне відхилення від початкового рівня (подальший результат мінус початковий рівень). Відмінність враховує показник різниці в методах лікування від початкового рівня з 95% ДІ. †Дані показують N (%) стану на момент включення в дослідження та в кінці дослідження. Відмінність враховує показник різниці в методах лікування в кінці дослідження.
(А) Індекс Харві — Бредшоу для хвороби Крона.
(B) Оцінка показників за шкалою Мейо для виразкового коліту.
(C) Оцінка активності захворювання анкілозивного спондиліту.
(D) Оцінка активності захворювання у 28 суглобах за рівнем СРБ для ревматоїдного артриту та псоріатичного артриту.
(E) Клінічний індекс активності захворювання при ревматоїдному артриті та псоріатичному артриті.
(F) Спрощений індекс активності захворювання при ревматоїдному артриті та псоріатичному артриті.
(G) Індекс площі та тяжкості псоріазу.
Стовпці представляють собою 95% ДІ зі змішаної моделі, з урахуванням початкового значення та тривалості лікування інфліксимабом на момент включення в дослідження.
Час від рандомізації до прогресування захворювання, випадки відміни препарату і час від рандомізації до відміни препарату були однаковими в обох терапевтичних групах.
В однакової кількості пацієнтів з обох терапевтичних груп спостерігалося щонайменше одне небажане явище, яке виникло у процесі лікування (168 [70%] у групі оригінального інфліксимабу та 164 [68%] — у групі CT-P13) (табл. 3). Найчастіші небажані явища, які виникли у процесі лікування, були пов’язані з інфекціями. 10 (4%) пацієнтів у групі оригінального інфліксимабу порівняно з 4 (2%) пацієнтами у групі CT-P13 мали реакції, пов’язані з інфузією. Аналогічно кількість пацієнтів із серйозними небажаними явищами, які виникли під час лікування, не відрізнялася між двома групами (24 [10%] у групі оригінального інфліксимабу та 21 [9%] — у групі CT-P13) (див. табл. 3). У 9 (4%) пацієнтів групи оригінального інфліксимабу порівняно з 8 (3%) пацієнтами у групі CT-P13 припинили дослідження препарату через появу небажаних явищ. Не зареєстровано жодного летального кінця та ніяких підозрілих несподіваних серйозних побічних реакцій.
| Дані дослідження | Оригінальний інфліксимаб (n=241) | CT-P13 (n=240) |
|---|---|---|
| SUSAR (підозра на розвиток несподіваної серйозної небажаної реакції) |
0 | 0 |
| Серйозні небажані явища | 32/24 (10%) | 27/21 (9%) |
| Небажані явища | 422/168 (70%) | 401/164 (68%) |
| Небажані явища, що призводять до дострокового завершення дослідження препарату* | 18/9 (4%) | 9/8 (3%) |
| Найчастіші небажані явища, що виникли у процесі лікування | ||
| Назофарингіт | 29/23 (10%) | 28/25 (10%) |
| Інфекції сечовивідних шляхів | 19/14 (6%) | 9/7 (3%) |
| Шкірний висип | 7/7 (3%) | 14/13 (5%) |
| Головний біль | 10/10 (4%) | 8/7 (3%) |
| Артралгія | 12/11 (5%) | 6/6 (3%) |
| Синусит | 13/13 (5%) | 4/3 (1%) |
| Реакція, пов’язана з інфузією | 10/10 (4%) | 5/4 (2%) |
| Грипоподібні захворювання | 7/7 (3%) | 7/7 (3%) |
| Інфекції дихальних шляхів | 4/4 (2%) | 11/10 (4%) |
| Гастроентерит | 7/7 (3%) | 6/6 (3%) |
| Серйозні небажані явища, що виникають під час лікування, за системою органів | ||
| Порушення роботи серця | Гострий інфаркт міокарда | Гострий інфаркт міокарда, фібриляція передсердь |
| Порушення зору | – | Відшарування сітківки |
| Шлунково-кишкові розлади | Мелена, панкреатит | Біль у животі |
| Загальні розлади та реакції в місці введення | – | Біль у грудній клітці |
| Порушення з боку гепатобіліарної системи | Холецистит, жовчнокам’яна хвороба | Холецистит |
| Інфекції | Абсцес ясен, перитоніт, гайморит | Анальний абсцес, гастроентерит, пієлонефрит, тонзиліт |
| Результати лабораторних та інструментальних досліджень | Біопсія нирки | – |
| Порушення метаболізму та розлади харчування | Подагра | – |
| Порушення опорно-рухового апарату та сполучної тканини | Артралгія | Артрит |
| Новоутворення (доброякісні, злоякісні та неуточнені) | Рак сечового міхура, рак молочної залози, дисплазія передміхурової залози | Рак сечового міхура |
| Розлади нервової системи | Інсульт, цефалгія, непритомність | – |
| Порушення функції нирок та сечовивідної системи | Нирково-кам’яна хвороба (нефролітіаз), кіста нирки | Нирково-кам’яна хвороба (нефролітіаз) |
| Респіраторні, торакальні та медіастинальні (середостінні) порушення | Ревматоїдна легеня | – |
| Хірургічні та терапевтичні процедури | Аноректальна хірургічна операція, аортальне шунтування, апендектомія, кесарів розтин, колектомія | Холецистектомія, фарингеальна хірургічна операція, фотонна променева терапія передміхурової залози, хірургічна операція на передміхуровій залозі, хірургічна операція на плечі |
| Судинні порушення | – | Емболія стегнової артерії |
Дані: кількість явищ/кількість пацієнтів (%). *Пацієнти мали іншу основну причину для дострокового завершення дослідження препарату.
Під час спостереження концентрація препарату в сироватці крові була однаковою в обох групах. Антитіла до лікарського засобу спостерігалися протягом усього періоду лікування у 26 (11%) пацієнтів у групі оригінального інфліксимабу та у 30 (13%) — у групі CT-P13 (повна вибірка пацієнтів для аналізу). Частка пацієнтів із виявленими у процесі дослідження антитілами до лікарських засобів (за винятком пацієнтів із виявленими антитілами до лікарських засобів на момент включення в дослідження) становила 17 (7%) для оригінального інфліксимабу та 19 (8%) — для біосиміляру CT-P13 (повна вибірка пацієнтів для аналізу).
У межах попереднього аналізу досліджено первинну кінцеву точку в кожній діагностичній групі. У жодній діагностичній підгрупі не показана нижча ефективність, за винятком анкілозивного спондиліту (рис. 2), тоді як для хвороби Крона ДІ був близький до нижчої ефективності для CT-P13. У повній вибірці пацієнтів для аналізу проведено дослідження на чутливість, яке не показало будь-яких істотних відмінностей у результатах.
Таким чином, результати дослідження NOR-SWITCH свідчать, що перехід від оригінального інгібітора ФНП на його біосиміляр не поступається безперервному лікуванню оригінальним препаратом, відповідно до попередньо визначеної межі не нижчої ефективності 15%. Дані, зібрані під час спостережних досліджень та продовженої фази досліджень PLANETRA і PLANETAS, не викликали жодних серйозних побоювань щодо ефективності або безпеки біосиміляру оригінального інфліксимабу, а саме CT-P13 [32–35]. Однак небажані явища, які виникли під час лікування, зареєстровано у 71,4% пацієнтів, які перейшли від застосування оригінального інфліксимабу до біосиміляру CT-P13, порівняно з 48,9% тих, хто приймав CT-P13 протягом другого курсу з метою продовження дослідження PLANETAS [34]. Крім того, близько 6% із 647 пацієнтів, зареєстрованих у DANBIO [36], припинили терапію приблизно через 3 міс після переходу від оригінального інфліксимабу до CT-P13 у зв’язку з появою небажаних явищ або з недостатньою ефективністю лікування. Пацієнти в середньому застосовували оригінальний інфліксимаб протягом 6–7 років до переходу, тому дослідники зробили висновок, що необхідно продовжувати проводити подальші дослідження, перш ніж можна буде рекомендувати перехід не за медичними показаннями (тобто перехід з метою зниження витрат) [36]. Дослідження NOR-SWITCH має ряд переваг щодо дизайну порівняно із більш ранніми дослідженнями, при цьому отримані результати підтримують стратегію переходу від оригінального інфліксимабу до його біосиміляру.
Кількість пацієнтів, які повідомляли про появу небажаних явищ або серйозних небажаних явищ, була однаковою в обох терапевтичних групах, і під час дослідження не зареєстровано жодного смертельного випадку або прогнозованих серйозних небажаних реакцій. Як і очікувалося, найчастіші небажані явища були пов’язані з інфекціями. У більшості пацієнтів із групи оригінального інфліксимабу спостерігалися реакції, пов’язані з інфузією, що ставало причиною припинення дослідження лікарського засобу, ніж у групі CT-P13. Ці результати підтверджують висновки попередніх спостережних досліджень та дозволяють припустити, що перехід на біосиміляр CT-P13 не пов’язаний із будь-яким побоюванням щодо безпеки [18, 19, 32–35].
Крім того, не відзначено суттєвих відмінностей в імуногенності щодо CT-P13 порівняно з оригінальним інфліксимабом. Концентрація препарату в сироватці крові та наявність антитіл до лікарського засобу були зіставні між двома групами протягом усього дослідження. Це спостереження узгоджується з результатами 2-річних досліджень PLANETRA і PLANETAS, де виявлено аналогічні рівні інфліксимабу в сироватці крові та утворення антитіл до лікарського засобу в процесі підтримувальної терапії та в групі із заміною препарату під час дослідження [18, 19, 34, 35].
Рандомізований дизайн дослідження NOR-SWITCH, включення достатньої кількості пацієнтів (згідно з розрахунками співвідношення сил) та залучення представників пацієнтів у планування і проведення дослідження є очевидними перевагами. Крім того, дослідження фінансувалося урядом Норвегії та контролювалося системою охорони здоров’я. Фармацевтичні компанії не брали участі в жодній частині планування чи проведення дослідження.
Пацієнти, які отримують довготривалу терапію інфліксимабом, імовірно, не схильні до високого ризику розвитку імуногенності до CT-P13. Проте під час дослідження NOR-SWITCH отримало майже повний набір зразків сироватки крові від усіх пацієнтів на всіх візитах, що дозволило нам оцінити концентрацію препарату в крові й титр антитіл до лікарського засобу у пацієнтів протягом усього періоду дослідження. Зазвичай попередні дослідження в цілому оцінювали концентрацію препарату і титр антитіл до лікарського засобу протягом обмеженого періоду [18, 19, 34, 35.].
Результати при різних захворюваннях були досить різними, з частотою прогресування захворювань від приблизно 10% при псоріазі та виразковому коліті до майже 60% — під час такого захворювання, як псоріатичний артрит. Однак визначення прогресування для кожного захворювання ґрунтувалося на чітко встановлених показниках активності захворювання із попередньо визначеними граничними точками для патологічного стану та динаміки захворювання.
Вибір правильної межі не нижчої ефективності є досить складним завданням у будь-якому дослідженні ефективності. Якщо межа занадто низька, дослідження стає неможливим, тоді як занадто висока межа може включати клінічно важливі відмінності. Вибір у 15% ґрунтувався на дослідженні PLANETRA, а також обговореннях з лікарями вузьких спеціальностей та Агентством з лікарських засобів Норвегії. До того ж, ЕМА розглядало межу не нижчої ефективності 15% як достатню у своєму звіті про оцінку біосиміляру CT-P13 [37]. Втім, дослідження NOR-SWITCH показало не нижчу ефективність біосиміляру порівняно із референтним препаратом як за рекомендацією ЕМА (95% ДІ та межа не нижчої ефективності 15%), так і за рекомендацією FDA (90% ДІ та межа не нижчої ефективності 12%).
Медична спільнота наразі бачить тільки початок ери біосимілярів. Через кілька років ми, ймовірно, матимемо доступ до кількох біосимілярів, що застосовуватимуться у пацієнтів з гастроентерологічними, ревматичними та дерматологічними захворюваннями. З цим пов’язана необхідність проведення подальших досліджень, які вивчатимуть можливість різних варіантів переходів (наприклад від одного біосиміляру до іншого, а також назад до оригінального препарату).
Таким чином, результати дослідження NOR-SWITCH переконливо довели, що перехід від оригінального інфліксимабу до CT-P13 (в Україні доступний під торговою назвою Фламмегіс®) не поступався за ефективністю терапії безперервному лікуванню оригінальним інфліксимабом відповідно до встановленої граничної межі не нижчої ефективності 15%. Не виявлено жодних суттєвих відмінностей щодо безпеки або імуногенності між двома терапевтичними групами. Таким чином, отримані дані підтвердили, що пацієнти можуть безпечно переходити з оригінального інфліксимабу на його біосиміляр.
Перелік використаної літератури
- Kuek A., Hazleman B.L., Ostor A.J. (2007) Immune‐mediated inflammatory diseases (IMIDs) and biologic therapy: a medical revolution. Postgrad Med. J., 83: 251–260.
- Jørgensen K.K., Olsen I.C., Goll G.L. et al. (2017) Switching from originator infliximab to biosimilar CT-P13 compared with maintained treatment with originator infliximab (NOR-SWITCH): a 52-week, randomised, double-blind, non-inferiority trial. Lancet, 389(10086): 2304–2316.
- Nast A., Mrowietz U., Kragballe K. et al. (2013) Barriers to the prescription of systemic therapies for moderate‐to‐severe psoriasis: a multinational cross‐sectional study. Arch. Dermatol. Res., 305: 899–907.
- Putrik P., Ramiro S., Kvien T.K. et al. (2014) Inequities in access to biologic and synthetic DMARDs across 46 European countries. Ann. Rheum. Dis., 73: 198–206.
- World Health Organization (2010) Expert Committee on Biological Standardization. Geneva, 19 to 23 October 2009. Guidelines on evaluation of similar biotherapeutic products (SBPs) Available at: http://www.who.int/biologicals/areas/biological_therapeutics/BIOTHERAPEUTICS_FOR_WEB_22APRIL2010.pdf (acc.essed 1 Oct. 2014).
- Abraham J. (2013) Developing oncology biosimilars: an essential approach for the future. Semin. Oncol., 40(1): S5–24.
- Lorenz H.M., Braun J., Kruger K., Schneider M. (2014) Implementation and use of biosimilars in the therapy of inflammatory rheumatic diseases: statement of the German Society of Rheumatology. Z. Rheumatol., 73: 784–786.
- Rinaudo-Gaujous M., Paul S., Tedesco E.D. et al. (2013) Review article: biosimilars are the next generation of drugs for liver and gastrointestinal diseases. Aliment Pharmacol. Ther., 38: 914–924.
- Yoo D.H. (2014) The rise of biosimilars: potential benefits and drawbacks in rheumatoid arthritis. Expert Rev. Clin. Immunol., 10: 981–983.
- European Medicines Agency (2014) Guideline on Similar Biological Medicine Products. Draft. 22 May 2013. Available at: http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2013/05/WC500142978.pdf (accessed 20 Oct. 2014).
- Ebbers H.C., Crow S.A., Vulto A.G., Schellekens H. (2012) Interchangeability, immunogenicity and biosimilars. Nat. Biotechnol., 30: 1186–1190.
- Isaacs J.D., Cutolo M., Keystone E.C. et al. (2016) Biosimilars in immune‐mediated inflammatory diseases: initial lessons from the first approved biosimilar anti‐tumour necrosis factor monoclonal antibody. J. Intern. Med., 279(1): 41–59.
- European Medicines Agency. Committee for Medicinal Products for Human Use (CHMP) (2014) Assessment report: Remsima (infliximab). 27 June 2013. Available at: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002576/WC500151486.pdf (accessed 2 Oct. 2014).
- European Medicines Agency. Remsima (infliximab) (2014) Summary of Product Characteristics. Available at: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/002576/WC500150871.pdf (accessed 22 Oct. 2014).
- European Medicines Agency. Remicade (infliximab) (2014) Summary of Product Characteristics. Available at: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/000240/WC500050888.pdf (accessed 22 Oct. 2014).
- Dorner T., Kay J. (2015) Biosimilars in rheumatology: current perspectives and lessons learnt. Nat. Rev. Rheumatol., 11: 713–724.
- Braun J., Kudrin A. (2016) Switching to biosimilar infiximab (CT-P13): evidence of clinical safety, effectiveness and impact on public health. Biologicals, 44: 257–266.
- Park W., Hrycaj P., Jeka S. et al. (2013) A randomised, double‐blind, multicentre, parallel‐group, prospective study comparing the pharmacokinetics, safety, and efficacy of CT‐P13 and innovator infliximab in patients with ankylosing spondylitis: the PLANETAS study. Ann. Rheum. Dis., 72: 1605–1612.
- Yoo D.H., Hrycaj P., Miranda P. et al. (2013) A randomised, double-blind, parallel-group study to demonstrate equivalence in efficacy and safety of CT-P13 compared with innovator infiximab when coadministered with methotrexate in patients with active rheumatoid arthritis: the PLANETRA study. Ann. Rheum. Dis., 72: 1613–1620.
- Schneider C.K. (2013) Biosimilars in rheumatology: the wind of change. Ann. Rheum. Dis., 72: 315–18.
- Dorner T., Strand V., Cornes P. et al. (2016) The changing landscape of biosimilars in rheumatology. Ann. Rheum. Dis., 75: 974–982.
- Weise M., Kurki P., Wolf-Holz E. et al. (2014) Biosimilars: the science of extrapolation. Blood, 124: 3191–3196.
- Danese S., Gomollon F., Governing Board and Operational Board of ECCO (2013) ECCO position statement: the use of biosimilar medicines in the treatment of inflammatory bowel disease (IBD). J. Crohns Colitis, 7: 586–589.
- Ben-Horin S., Vande-Casteele N., Schreiber S., Lakatos P.L. (2016) Biosimilars in inflammatory bowel disease: facts and fears of extrapolation. Clin. Gastroenterol Hepatol., 14: 1685–1696.
- Blauvelt A., Puig L., Chimenti S. et al. (2016) Biosimilars for psoriasis: clinical studies to determine similarity. Brit. J. Dermatol., 177(1): 23–33.
- Feagan B.G., Choquette D., Ghosh S. et al. (2014) The challenge of indication extrapolation for infiximab biosimilars. Biologicals, 42: 177–183.
- Harvey R.F., Bradshaw M.J. (1980) Measuring Crohn’s disease activity. Lancet, 315: 1134–1135.
- Schroeder K.W., Tremaine W.J., Ilstrup D.M. (1987) Coated oral 5-aminosalicylic acid therapy for mildly to moderately active ulcerative colitis: a randomized study. N. Engl. J. Med., 317: 1625–1629.
- Machado P., Landewe R., Lie E. et al. (2011) Ankylosing Spondylitis Disease Activity Score (ASDAS): defining cut-of values for disease activity states and improvement scores. Ann. Rheum. Dis., 70: 47–53.
- Prevoo M.L., van‘t Hof M.A., Kuper H.H. et al. (1995) Modified disease activity scores that include twenty-eight-joint counts. Development and validation in a prospective longitudinal study of patients with rheumatoid arthritis. Arthritis Rheum., 38: 44–48.
- Fredriksson T., Pettersson U. (1978) Severe psoriasis—oral therapy with a new retinoid. Dermatologica, 157: 238–244.
- Buer L.C., Moum B.A., Cvancarova M. et al. (2016) Switching from Remicade(R) to Remsima(R) is safe and feasible: a prospective, open-label study. J. Crohns Colitis, 11(3): 297–304.
- Smits L.J., Derikx L.A., de Jong D.J. et al. (2016) Clinical outcomes following a switch from Remicade(R) to the biosimilar CT-P13 in inflammatory bowel disease patients: a prospective observational cohort study. J. Crohns Colitis, 10: 1287–1293.
- Park W., Yoo D.H., Miranda P. et al. (2016) Efficacy and safety of switchingfrom reference infiximab to CT-P13 compared with maintenance of CT-P13 in ankylosing spondylitis: 102-week data from the PLANETAS extension study. Ann. Rheum. Dis., 76(2): 346–354.
- Yoo D.H., Prodanovic N., Jaworski J. et al. (2016) Efficacy and safety of CT-P13 (biosimilar infiximab) in patients with rheumatoid arthritis: comparison between switching from reference infiximab to CT-P13 and continuing CT-P13 in the PLANETRA extension study. Ann. Rheum. Dis., 76(2): 355–363.
- Glintborg B., Juul Sørensen I., Vendelbo Jensen D. et al. (2016) Three months’ clinical outcomes from a nationwide non-medical switch from originator to biosimilar infiximab in patients with inflammatory arthritis, results from the DANBIO registry. Ann. Rheum. Dis., 75(2): 142.
- European Medicines Agency. Assessment report: Remsima (2017) June 27, 2013. http://www.ema.europa.eu/docs/en_GB/document_ library/EPAR_-_Public_assessment_report/human/002576/ WC500151486.pdf (accessed Feb. 19, 2017).
Підготовлено за матеріалами, наданими ТОВ «ЕГІС УКРАЇНА»
*Виробництво СЕЛЛТРІОН, Інк., Республіка Корея, ЗАТ «Фармацевтичний завод ЕГІС», Угорщина.

Leave a comment