ДЕРМАТОМІОЗИТ ЯК ПАРАНЕОПЛАСТИЧНИЙ СИНДРОМ ПРИ РАКУ МОЛОЧНОЇ ЗАЛОЗИ У ПАЦІЄНТКИ МОЛОДОГО ВІКУ В ПЕРІОД ЛАКТАЦІЇ: КЛІНІЧНИЙ ВИПАДОК
Триполка С.А.1, Губченко Ю.Н.2
- 1Коммунальное некоммерческое предприятие Харьковского областного совета «Областная клиническая больница», Харьков
- 2Комунальний заклад «Луганська обласна клінічна лікарня», Сєвєродонецьк
Резюме. Представлені опис клінічного випадку розвитку паранеопластичного синдрому у вигляді дерматоміозиту при раку молочної залози у пацієнтки молодого віку, яка годувала грудьми. Захворювання дебютувало шкірним симптомокомплексом (геліотропна еритема, еритематозні висипання на шкірі), згодом приєднався суглобовий синдром, біль у м’язах, міокардит. При обстеженні в онколога виявлена низькодиференційована інвазивна протокова карцинома лівої молочної залози. Застосування комбінованого лікування з приводу онкологічної патології (поліхіміотерапії, радикальної лівобічної мастектомії, курсу телегамма-терапії на ділянку рубця лівої молочної залози, а також терапії преднізолоном) зумовило зниження активності дерматоміозиту, зменшення вираженості клінічних і лабораторних проявів міозиту та ураження шкіри. Однак рецидив злоякісного захворювання призвів до реактивації шкірно-суглобово-м’язової симптоматики і відсутності відповіді на терапію дерматоміозиту.
В последние годы опубликовано много данных о том, что существуют сложные двунаправленные связи между ревматическими заболеваниями и злокачественными новообразованиями. Некоторые ревматические болезни, такие как дерматомиозит, полимиозит, ревматоидный артрит (РА), системная красная волчанка, синдром Шегрена и системная склеродермия, ассоциированы с повышенным риском злокачественности, а в некоторых случаях могут быть результатом активации аутоиммунитета на фоне онкологической патологии [1, 3, 8, 19, 20]. Кроме того, лечение при ревматических заболеваниях может также повышать риск развития злокачественных новообразований.
Дерматомиозит (ДМ) и полимиозит (ПМ) представляют собой идиопатические воспалительные миопатии, характеризующиеся проксимальной слабостью скелетных мышц и признаками воспаления мышц. ДМ, в отличие от ПМ, характеризуется наличием различных кожных проявлений. Кроме этого, ДМ и ПМ проявляются воспалительным артритом, интерстициальным заболеванием легких, феноменом Рейно и наличием аутоантител [6].
Связь между воспалительной миопатией и раком была признана с момента сообщения о двух случаях ПМ и рака желудка в 1916 г. [22]. По данным литературы, ассоциация со злокачественными новообразованиями сильнее у пациентов с ДМ, чем с ПМ. Доказательства связи между раком и воспалительной миопатией включают в себя: эпидемиологические данные из больших популяционных исследований, временную связь между диагнозом рака и миопатии, улучшение или разрешение миопатии после лечения рака, рецидив или развитие миопатии, связанной с рецидивом рака.
С патофизиологической точки зрения регенерирующие клетки в мышцах больного воспалительной миопатией, в отличие от нормальных мышц, экспрессируют высокие уровни специфических для миозита аутоантигенов [4]. Эти же антигены продуцируются на высоком уровне при некоторых онкологических заболеваниях, о которых известно, что они связаны с развитием воспалительной миопатии. Эти наблюдения показывают, что связь между злокачественностью и воспалительной миопатией связана с экспрессией общих аутоантигенов между раковой и мышечной тканями у некоторых пациентов с ДМ или ПМ, и что иммунный ответ, направленный на опухолевые клетки, также может быть адресован аналогичным аутоантигенам в мышечной ткани, приводящим к повреждению мышц.
Приведенный B.E. Barnes и B. Mawr обзор 258 случаев ДМ и рака, о которых сообщалось в литературе с 1916 г. по середину 1970-х годов, показал, что заболеваемость раком у пациентов с ДМ была повышена в пять–семь раз по сравнению с общей популяцией [4]. Повышенный риск был впоследствии подтвержден в популяционных исследованиях из разных стран Дании [13], Австралии [7] и Тайваня [10]. Крупнейшее популяционное исследование, проведенное в Тайване, включало 1012 пациентов с ДМ и 643 пациента с ПМ из Национальной базы данных медицинского страхования за 1997–2007 гг. Среди пациентов с ДМ частота раковых заболеваний составила 9,4%, в группе ПМ — 4,4%.
Среди злокачественных опухолей преобладают аденокарциномы шейки матки, легкого, яичника, поджелудочной железы, мочевого пузыря, желудка и составляют приблизительно 70% злокачественных заболеваний, связанных с воспалительными миопатиями [4, 15, 20, 21, 23, 28]. Некоторые исследования показывают, что может быть особенно повышен риск рака яичника [13, 21].
По времени возникновения злокачественное новообразование может быть диагностировано до, одновременно или после верификации диагноза воспалительной миопатии [11, 18]. Пик заболеваемости злокачественными новообразованиями при ДМ и ПМ наблюдается одновременно с их возникновением и в течение первого года после диагностики мышечного заболевания и постепенно снижается в течение последующих пяти лет наблюдения [10, 11, 21, 24, 29], хотя может сохраняться некоторый повышенный риск после пяти лет [10, 24, 29].
У некоторых пациентов воспалительная миопатия диагностируется во время рецидива ранее диагностированного рака. В других случаях ранее диагностированное мышечное заболевание обостряется, когда появляется рак [16, 26].
Среди клинических факторов риска, связанных с повышенным риском развития злокачественности, необходимо отметить: свидетельство повреждения капилляров при биопсии мышц, кожный некроз, кожный лейкоцитокластический васкулит, пожилой возраст в начале заболевания, дисфагия [16, 26, 27]. Также некоторые сывороточные антитела: TIF (transcription intermediary factor)-1-gamma (anti-p155, anti-p155/140) повышают риск злокачественных новообразований. И наоборот, наличие специфических для миозита (антисинтетазных антител, анти-Mi-2, анти-SRP) и связанных с миозитом антител (анти-RNP, анти-PM-Scl, анти-Ku) может быть связано со снижением риска злокачественных новообразований. Необходимы дополнительные исследования, чтобы определить полезность этих аутоантител для скрининга рака у пациентов с миозитом [3, 12, 14, 25].
Всем пациентам с недавно диагностированным ПМ или ДМ следует оценивать возможность сочетания со злокачественным заболеванием. Такая коморбидность определяется при всесторонней оценке анамнеза и физикальном осмотре, включая обследование таза, а также следующие исследования: клинический анализ крови, мочи, пробы печени, рентгенограмма грудной клетки, самопроверка яичка, маммография и колоноскопия при необходимости. Дальнейшее обследование, включая компьютерную томографию (КТ) грудной клетки/брюшной полости/таза, может быть выполнено у тех пациентов, у которых высок риск развития злокачественной опухоли. Также необходимо отметить, что миозит, связанный с онкопатологией, хуже реагирует на лечение, чем миозит при отсутствии таковой. Следовательно, плохая реакция на лечение миозита должна приводить к настороженности и подозрению относительно наличия злокачественной опухоли.
Приводим собственное наблюдение сочетания воспалительной миопатии с неопластическим процессом.
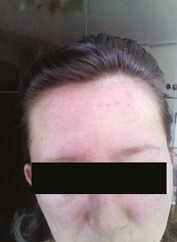
Больная С., 1979 г.р., обратилась на консультативный прием к врачу-ревматологу в Коммунальное учреждение здравоохранения «Луганская областная клиническая больница» в Северодонецке в марте 2016 г. с жалобами на выраженную слабость в мышцах конечностей (больше в проксимальных отделах), мышцах шеи, осиплость голоса, очаги покраснения и шелушения на коже лба и щек, поперхивание во время глотания твердой пищи, учащенное сердцебиение. Больная также отмечала зябкость кистей и стоп, онемение, покалывание и изменение окраски кожных покровов нескольких пальцев кистей. Из анамнеза известно, что первые признаки заболевания появились в январе 2016 г., когда через месяц после нормальных родов (при обращении находилась в декретном отпуске по уходу за ребенком) на фоне явлений острой респираторной вирусной инфекции отмечала общую и мышечную слабость, сердцебиение и эпизодическое повышение температуры тела до фебрильных показателей. Лечилась амбулаторно у врача-терапевта. В течение 1,5 мес мышечная слабость нарастала, а также больная отметила появление эритематозных высыпаний на коже лба и щек с элементами шелушения у волосистой части головы (рис. 1–3). Тогда же при самообследовании больная обнаружила наличие опухолевидного образования в левой молочной железе и увеличение подмышечных лимфатических узлов слева. После осмотра врачом-хирургом в участковой поликлинике пациентка была направлена на дообследование в Луганский областной онкологический диспансер (далее — КУ «ЛОКОД») и там обследована согласно унифицированному протоколу «Рак молочной железы» [2]. В период обследования в онкологическом диспансере состояние больной ухудшалось, у нее прогрессировала мышечная слабость в верхних и нижних конечностях, усиливалась гнусавость голоса, тахикардия, в связи с чем пациентка была направлена к врачу-ревматологу для исключения воспалительной миопатии.
 |
 |
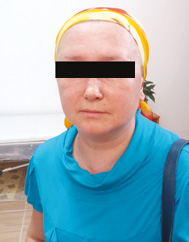 |
| Рис. 1. Гелиотропные высыпания кожи лба, носа и носогубных складок (март 2016 г.) | Рис. 2. Гелиотропные высыпания кожи лба, щек, носа и носогубных складок (апрель 2016 г.) | Рис. 3. Регресс эритематозных высыпаний на лице (май–июнь 2016 г.) |
Также из анамнеза известно, что это была третяя беременность, третьи нормальные роды 09.10.2015 р., беременность протекала нормально, ребенок находился на грудном вскармливании на протяжении всех предшествующих 4 мес до того момента, как онкологи не выявили новообразование. Лактация была достаточная, необходимости в дополнительном питании не было. Решение о прекращении грудного вскармливания было принято в связи с необходимостью оперативного лечения и применения химиотерапии.
При первичном обращении: состояние больной тяжелое, передвигалась с посторонней помощью, самостоятельно не могла сесть и встать со стула из-за мышечной боли и слабости в мышцах. Кожные покровы обычной окраски, на коже лба, носа и щек эритематозные высыпания. Суставы внешне не изменены, при пальпации безболезненные, пассивные движения в полном объеме, активные движения ограничены из-за слабости. Отмечалась слабость мышц шеи и плечевого пояса. Со слов больной, мышцы в течение последних нескольких месяцев уменьшились в объеме. При осмотре участков атрофии не выявлено. Тургор мышц снижен. Определяется умеренная болезненность при пальпации мышц шеи, верхних и нижних конечностей. При мануальном тестировании силы проксимальных и аксиальных мышц определялось уменьшение объема движения, что соответствовало 2 баллам по шкале Harrison. Голову удерживает с затруднением. Видимые слизистые оболочки без патологии. Пальпируются увеличенные лимфатические узлы в левой подмышечной области — округлые до 2,5 см в диаметре, умеренной плотности, чувствительные при пальпации, не спаянные с подлежащей тканью. В легких дыхание везикулярное, частота дыхания — 17/мин. Тоны сердца несколько приглушены, деятельность ритмичная, короткий систолический шум на верхушке, частота сердечного сокращения (ЧСС) — 104 уд./мин., артериальное давление — 125/75 мм рт. ст. Живот мягкий, безболезненный. Печень и селезенка не пальпируются. Стул регулярный, мочеиспускание в норме. Периферических отеков нет.
Из дополнительных методов обследования проведено следующее:
| Даты | Эритроциты, · 10/л | Hb, г/л | Лейкоциты, · 10/л | Тромбоциты, · 10/л | Палочкоядерные, % | Сегментоядерные, % | Эозинофилы, % | Базофилы, % | Лимфоциты, % | Моноциты, % | СОЭ, мм/ч |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 01.04.16 | 4,1 | 134 | 8,9 | 138 | 2 | 68 | 0 | 1 | 28 | 2 | 6 |
| 04.12.17 | 4,12 | 124 | 8,9 | 145 | 3 | 65 | 1 | 1 | 27 | 3 | 9 |
| Даты | Общий белок, г/л | АлАТ, ед./л | АсАТ, ед./л | Общий холестерин, ммоль/л | СРБ, ед./л | РФ | КФК (норма 0–170), ед./л |
|---|---|---|---|---|---|---|---|
| 10.04.16 | 68 | 22 | 18 | 3,8 | 0,2 | Отр. | 380,0 |
| 04.12.17 | 69 | 28 | 18 | 3,5 | 5,5 | Отр. | 60,1 |
Коагулограмма (23.05.2017). Протромбиновый индекс — 92%, тромбиновое время — 21 с, этаноловый тест негативный, β-нафтоловый тест (+), фибрин — 2,66 г/л.
В связи с недостатком материальных средств иммунологическое обследование не проведено.
ЭКГ (01.04.2016). Синусовая тахикардия, ЧСС 105 уд./мин. Умеренные изменения миокарда.
Электромиография верхних конечностей (11.03.2016). Полученные данные могут свидетельствовать в пользу аксональной невропатии кожно-мышечных нервов обеих верхних конечностей (игольчатая электромиография не проводилась в связи с отсутствием такого исследования в регионе).
Капилляроскопия не проводилась в связи с отсутствием исследования в регионе.
Ультразвуковое исследование (УЗИ) молочной железы (16.02.2016). Структура молочной железы смешанная. Междольковые промежутки повышенной эхогенности, не расширены. Протоки у сосков 2–3 мм расширены. Дополнительные образования выявлены, в левой молочной железе на 6 часов в нижних квадрантах определяется объемное образование с неровным контуром, диффузно неоднородное за счет множественных гиперэхогенных включений с акустической тенью и без тени. Подмышечные лимфоузлы слева визуализируются 25х14 мм, овальной формы с выраженным корковым гипоэхогенным слоем и умеренным мозговым.
Заключение. Объемное образование левой молочной железы. Cr левой молочной железы. Лимфаденопатия подмышечных лимфатических узлов слева.
УЗИ органов брюшной полости, малого таза (16.02.2016): патологии не выявлено.
Рентгенография органов грудной клетки (ОГК) (16.02.2016): патологии не выявлено.
17.02.2016 г. проведено патогистологическое исследование биоптата опухоли молочной железы.
Заключение: низкодифференцированная (G3) инвазивная протоковая карцинома молочной железы (ICD-O код 8500/3) (рис. 4).
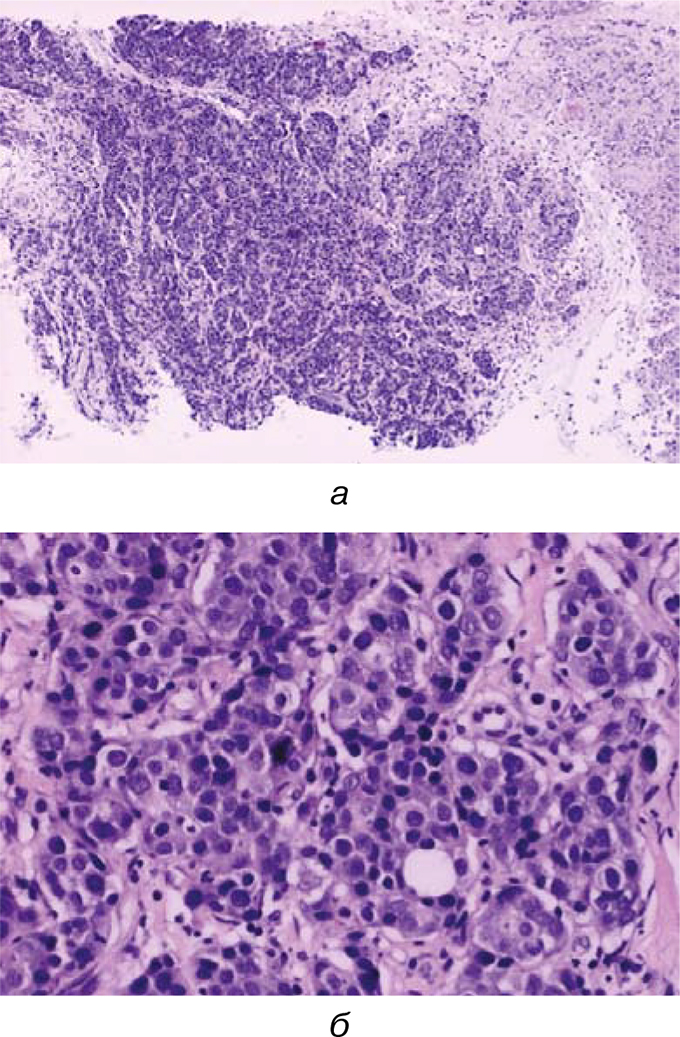
03.03.2016 г. Иммуногистохимическое исследование: эстрогеннегативная, прогестероннегативная, НЕR2/neu(1+)-негативная, Ki-50%.
Учитывая клинико-лабораторный симптомокомплекс, а также данные инструментального и иммуногистохимического обследования, пациентке был установлен следующий диагноз: Cr левой молочной железы T2N1M0 2В ст. (2016) 2 кл. гр. Паранеопластический синдром: Вторичный дерматомиозит, подострое течение, активная фаза, активность II ст., с поражением кожи (параорбитальный отек, гелиотропная эритема), мышц (миозит), суставов (полиартралгии, ФН I), феномен Рейно, сердца (миокардит, СН I), периферической нервной системы (периферическая нейропатия).
Пациентке была назначена следующая терапия: преднизолон 40 мг/сут, бисопролол 5 мг/сут, пантопразол 40 мг/сут, калия хлорид 750 мг/сут. В связи с применением глюкокортикоидов в высоких дозах был назначен комбинированный препарат кальция и витамина D (1000 мг/800 МЕ).
С марта 2016 г. по ноябрь 2017 г. больная прошла комбинированное лечение по поводу онкологической патологии: курсы неоадъювантной полихимиотерапии, радикальную левостороннюю мастэктомию по Маддену, курс телегамма-терапии на область рубца левой молочной железы суммарной очаговой дозой (СОД) 40 Гр, на парастернальные, надключичные лимфоузлы и подмышечную область слева — по СОД 40 Гр. В течение этого периода проходила химиотерапию (доксорубицин, циклофосфамид, доцетаксел, доксорубицин, гемцитабин, цисплатин, митоксантрон, капецитабин, винорелбин, флуороурацил) в условиях химиотерапевтического отделения КУ «ЛОКОД».
На фоне проводимой терапии в течение 2 мес состояние больной значительно улучшилось, уменьшилась мышечная слабость, увеличился объем активных и пассивных движений в верхних и нижних конечностях, исчезла гнусавость голоса, поперхивания при еде и эритематозные высыпания на лице. С учетом положительной динамики проявлений воспалительной миопатии доза глюкокортикоидов в течение 10 мес постепенно была снижена до 10 мг преднизолона. В этот период больная продолжала принимать бисопролол в дозе 2,5 мг/сут и комбинированный препарат кальция и витамина D. Курсы полихимиотерапии проводились до декабря 2017 г.
В декабре 2017 г. больная обратилась к ревматологу, поскольку вновь отметила появление отдышки и мышечной слабости после физической нагрузки, больше в левой верхней конечности, боли в спине, по ходу грудного отдела позвоночника. Учитывая появившиеся жалобы и данные анамнеза, 08.12.2017 г. больной проведена магнитно-резонансная томография грудного отдела позвоночного столба и выявлено очаговое поражение тела позвонка Th9, которое было интерпретировано как рецидив основного злокачественного заболевания.
Для уточнения характера распространенности 19.01.2018 г. проведена мультидетекторная (16-срезная) компьютерная томография ОГК с контрастированием. Заключение: состояние после левосторонней мастэктомии по поводу Са. Метастатическое (mts) поражение легких, печени, костного скелета. Массивный гидроторакс слева. Вторичные надключичные лимфоузлы слева, гиперперфузионные подмышечные лимфатические узлы справа. Неравномерное повышение перфузии правой молочной железы может быть обусловлено неопластическим процессом (рис. 5–8). В сравнении с исследованием от 21.07.2017 г. динамика резко отрицательная.
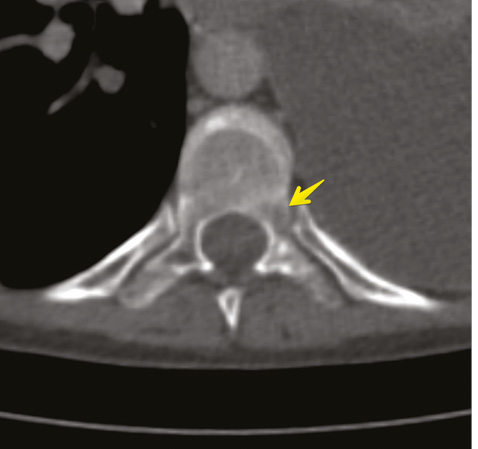
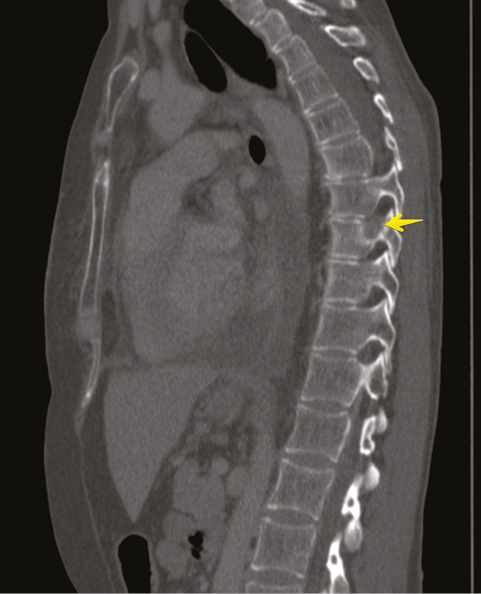
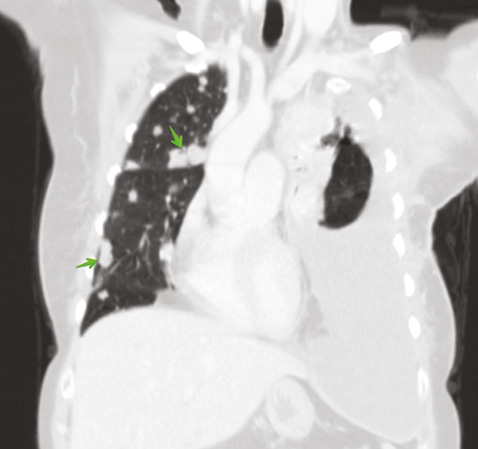
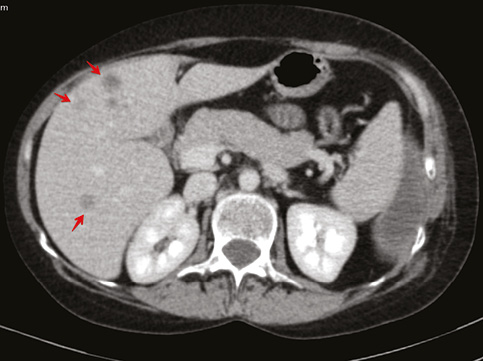
Консультирована невропатологом: паранеопластический процесс: вторичное (mts) поражение позвонка Th9 на фоне Cr левой молочной железы. Выраженный болевой синдром с нарушением функции левой верхней конечности.
Консультирована онкологом. Рак молочной железы (граница нижних квадрантов) T2N1aM0 ІІB стадия (G3; Er-; Pr-; HER2/neu-; Ki67–50%) (2016 г. после комплексного лечения), продолжение болезни, mts в печень, Th9 позвонок, легкие, mts-левосторонний плеврит, поражение надключичных, подключичных лимфатических узлов слева (2017) ІІ клиническая группа, назначена симптоматическая терапия.
В связи с тяжелым состоянием и отсутствием эффекта от проводимой терапии (химиотерапия 15.11.2017–20.11.2017) пациентка 20.11.2017 г. переведена в терапевтическое отделение по месту жительства для оказания паллиативной медицинской помощи. 07.02.2018 г. пациентка скончалась. Патологоанатомическое исследование не проводилось.
Анализируя данный клинический случай, необходимо акцентировать внимание на следующих аспектах.
Во-первых, ДМ является одним из самых частых ревматологических паранеопластических синдромов. В то же время у всех пациентов с ДМ суще ствует повышенный риск развития злокачественных новообразований, поэтому все пациенты с ДМ/ПМ должны быть тщательно скринированы по поводу онкологической патологии, особенно если пациент проявляет признаки и симптомы обоих состояний. Паранеопластические синдромы оказывают огромное клиническое влияние на диагностику и исход неопластических заболеваний. Недостаточный ответ на стандартную терапию воспалительной миопатии может расцениваться как неблагоприятный фактор и требовать дальнейшего диагностического поиска для исключения сопутствующей злокачественной патологии. Наличие паранеопластического синдрома является прогностически неблагоприятным для течения злокачественного новообразования.
Во-вторых, особенностью этого случая является факт развития рака у пациентки молодого возраста, кормящей грудью в ранний послеродовой период, с одновременным появлением симптомов мышечного аутоиммунного заболевания. Несмотря на редкость такого сочетания у пациенток молодого возраста после родов, оно имеет огромное клиническое влияние на диагностику и исход как ревматологического, так и онкологического заболевания. Ревматолог должен быть знаком с несколькими типичными мышечно-скелетными проявлениями злокачественных новообразований, чтобы как можно ранее диагностировать их для своевременного начала противоопухолевой терапии.
В-третьих, классически показательным является исчезновение симптомов ДМ на фоне стабилизации неопластического процесса и повторное нарастание симптоматики воспалительной миопатии при повторном рецидиве. Данный случай подтверждает многочисленные данные литературы о перекрестном влиянии этих двух заболеваний. В описанном случае, к сожалению, после проведения комплексного лечения карциномы молочной железы и стабилизации неопластического процесса, через год развился рецидив заболевания, что вызвало реактивацию воспалительной миопатии.
В-четвертых, несмотря на молодой возраст пациентки, беременность и кормление грудью, которые по данным литературы снижают риски развития новообразований молочной железы, указанный клинический случай иллюстрирует возможность развития такой патологии в наиболее неблагоприятном сочетании с воспалительной миопатией и устойчивостью к химиотерапии.
Таким образом, сочетание ДМ и опухоли представляет клинический интерес как для ревматологов, так и для онкологов. Это связано, с одной стороны, с трудностями как ранней диагностики болезни, так и подбора адекватной комплексной терапии с учетом многогранности патологических процессов. С другой стороны, известная резистентность (или недостаточная эффективность) терапии, связанная с реактивацией злокачественного процесса, не всегда позволяет купировать патологический процесс в мышечной ткани или замедлить его прогрессирование. Обсуждение подобных клинических случаев необходимо для поиска путей преодоления трудностей курации таких больных, часто резистентных к общепринятой терапии ПМ/ДМ.
Список использованной литературы
- 1. Ганьшина И.П., Жукова Л.Г., Бурневич Э.З. и др. (2018) Дерматомиозит и полимиозит у больных раком молочной железы: клинические случаи. Соврем. онкол., 1: 42–44.
- 2. Наказ Міністерства охорони здоров’я України від 30.06.2015 р. № 396.
- 3. Проценко Г.А. (2016) Паранеопластические синдромы в ревматологической практике. Укр. ревматол. журн., 63(1): 33–37.
- 4. Barnes B.E., Mawr B. (1976) Dermatomyositis and malignancy. A review of the literature. Ann. Intern. Med., 84: 68–76.
- 5. Bivalacqua T.J., Alphs H., Aksentijevich I. et al. (2007) Paraneoplastic polyarthritis from non-small-cell lung cancer metastatic to the bladder. J. Clin. Oncol., 25: 2621–2623.
- 6. Bohan A., Peter J.B. (1975) Polymyositis and dermatomyositis (first of two parts). N. Engl. J. Med., 292: 344–347.
- 7. Buchbinder R., Forbes A., Hall S. et al. (2001) Incidence of malignant disease in biopsy-proven inflammatory myopathy. A population-based cohort study. Ann. Intern. Med., 134: 1087–1095.
- 8. Carsons S. (1997) The association of malignancy with rheumatic and connective tissue diseases. Semin. Oncol., 24: 360–372.
- 9. Casciola-Rosen L., Nagaraju K., Plotz P. et al. (2005) Enhanced autoantigen expression in regenerating muscle cells in idiopathic inflammatory myopathy. J. Exp. Med., 201: 591–601.
- 10. Chen Y.J., Wu C.Y., Huang Y.L. et al. (2010) Cancer risks of dermatomyositis and polymyositis: a nationwide cohort study in Taiwan. Arthritis Res. Ther., 12: 70.
- 11. Chen Y.J., Wu C.Y., Shen J.L. (2001) Predicting factors of malignancy in dermatomyositis and polymyositis: a case-control study. Br. J. Dermatol., 144: 825–831.
- 12. Chinoy H., Fertig N., Oddis C.V. et al. (2007) The diagnostic utility of myositis autoantibody testing for predicting the risk of cancer-associated myositis. Ann. Rheum. Dis., 66: 1345–1349.
- 13. Chow W.H., Gridley G., Mellemkjaer L. et al. (1995) Cancer risk following polymyositis and dermatomyositis: a nationwide cohort study in Denmark. Cancer Causes Control., 6: 9–13.
- 14. Fiorentino D.F., Chung L.S., Christopher-Stine L. et al. (2013) Most patients with cancer-associated dermatomyositis have antibodies to nuclear matrix protein NXP-2 or transcription intermediary factor 1γ. Arthritis Rheum., 65: 2954–2962.
- 15. Hill C.L., Zhang Y., Sigurgeirsson B. et al. (2001) Frequency of specific cancer types in dermatomyositis and polymyositis: a population-based study. Lancet, 357: 96–100.
- 16. Hunger R.E, Dürr C., Brand C.U. (2001) Cutaneous leukocytoclastic vasculitis in dermatomyositis suggests malignancy. Dermatology., 202: 123–126.
- 17. Kaji K., Fujimoto M., Hasegawa M. et al. (2007) Identification of a novel autoantibody reactive with 155 and 140 kDa nuclear proteins in patients with dermatomyositis: an association with malignancy. Rheumatology (Oxford), 46: 25–28.
- 18. Lakhanpal S., Bunch T.W., Ilstrup D.M., Melton L.J. 3 (1986) Polymyositis-dermatomyositis and malignant lesions: does an association exist? Mayo Clin. Proc., 61: 645–653.
- 19. Naschitz J.E., Rosner I. (2008) Musculoskeletal syndromes associated with malignancy (excluding hypertrophic osteoarthropathy). Curr. Opin. Rheumatol., 20: 100–105.
- 20. Shah A.A., Casciola-Rosen L., Rosen A. (2015) Review: cancer-induced autoimmunity in the rheumatic diseases. Arthritis Rheumatol., 67: 317–326.
- 21. Sigurgeirsson B., Lindelöf B., Edhag O., Allander E. (1992) Risk of cancer in patients with dermatomyositis or polymyositis. A population-basedstudy. N. Engl. J. Med., 326: 363–367.
- 22. Stertz O. (1916) Polymyositis. Berl Klin Wochenschr., 53: 489.
- 23. Stockton D., Doherty V.R., Brewster D.H. (2001) Risk of cancer in patients with dermatomyositis or polymyositis, and follow-up implications: a Scottish population-based cohort study. Br. J. Cancer., 85: 41–45.
- 24. TargoffI N., Mamyrova G., Trieu E.P. et al. (2006) A novel autoantibody to a 155-kd protein is associated with dermatomyositis. Arthritis Rheum., 54: 3682–3689.
- 25. Trallero-Araguás E., Labrador-Horrillo M., Selva-O’Callaghan A. et al. (2010) Cancer-associated myositis and anti-p155 autoantibody in a series of 85 patients with idiopathic inflammatory myopathy. Medicine (Baltimore), 89: 47–52.
- 26. Urbano-Márquez A., Casademont J., Grau J.M. (1991) Polymyositis/dermatomyositis: thecurrentposition. Ann. Rheum. Dis., 50: 191–195.
- 27. Wang J., Guo G., Chen G. et al. (2013) Meta-analysis of the association of dermatomyositis and polymyositis with cancer. Br. J. Dermatol., 169: 838–847.
- 28. Whitmore S.E., Rosenshein N.B., Provost T.T. (1994)Ovarian cancer in patients with dermatomyositis. Medicine (Baltimore), 73: 153–160.
- 29. Yang Z., Lin F., Qin B. et al. (2015) Polymyositis/dermatomyositis and malignancy risk: a metaanalysis study. J. Rheumatol., 42: 282–291.
Адрес для переписки:
Триполка Светлана Анатольевна
61058, Харьков, просп. Независимости, 13
Коммунальное некоммерческое предприятие
Харьковского областного совета
«Областная клиническая больница»
E-mail: svtripolka@gmail.com

Leave a comment