Выбор оптимальной терапии для пациентов с анкилозирующим спондилоартритом: место и роль биосимиляра инфликсимаба
Biliavska Iu.V. , Lukianchuk E.V/
Анкилозирующий спондилоартрит (АС) — хроническое воспалительное заболевание, поражающее преимущественно осевой скелет, а именно позвоночник и крестцово-подвздошные суставы. Это заболевание чаще отмечается у мужчин молодого возраста с распространенностью 0,15–0,8% среди населения в целом [1, 2]. Характерными симптомами АС являются ригидность и потеря подвижности позвоночника, которые связаны с воспалительными процессами или/и структурным повреждением позвоночника из-за обширной остеопролиферации [3]. Пациенты, как правило, предъявляют жалобы на тупой характер боли в поясничном отделе позвоночника, отличительной особенностью которой является наличие болевого синдрома в состоянии покоя, особенно ночью и ранним утром, и которая сопровождается утренней скованностью. Внеосевое вовлечение также может присутствовать и включает периферический артрит (чаще всего асимметричный олигоартрит крупных суставов), энтезит и дактилит [4, 5]. Внесуставное вовлечение не является редкостью и включает передний увеит, воспалительное заболевание кишечника, псориаз и др. [6–8].
АС опасен тем, что может привести к развитию выраженного болевого синдрома и значительной деформации позвоночника на поздней стадии заболевания, что в конечном итоге может потребовать серьезного корригирующего оперативного вмешательства, что, в свою очередь, сопряжено с высокими рисками. Следовательно, очень важно контролировать симптомы и прогрессирование АС на ранних стадиях с помощью эффективных лекарственных средств [9].
Внедрение таргетной биологической терапии стало одним из огромных успехов современной медицины. Биологические агенты отличаются рядом очевидных преимуществ — скоростью и эффективностью действия по сравнению с традиционными базисными антиревматическими препаратами, предназначенными для лечения при АС [10]. Это особенно верно в случае ряда иммуноопосредованных воспалительных заболеваний, одним из которых является АС, лечение которого претерпело существенные изменения в последние годы [11, 12]. Появление ингибиторов фактора некроза опухоли-α (tumour necrosis factor (TNF)-α) в 2000 г. стало значительным достижением в лечении при АС. Ранние исследования инфликсимаба, а затем и других ингибиторов TNF-α показали значительное улучшение клинического ответа [13, 14]. В настоящее время доступны 6 анти-TNF-препаратов, показанных для лечения при АС — инфликсимаб и его биосимиляр, этанерцепт, адалимумаб, голимумаб [15]. Однако выбор конкретной схемы терапии при АС по-прежнему остается крайне сложным ввиду отсутствия достаточного количества прямых сравнительных исследований различных ингибиторов TNF. В этом случае практикующим врачам приходится руководствоваться результатами метаанализов, в которых изучена эффективность и профиль безопасности различных анти-TNF-агентов [9].
Так, согласно результатам метаанализа, в котором обобщены данные более чем 20 рандомизированных клинических исследований (более 3300 пациентов) [16], установлено, что наибольшей эффективностью обладает инфликсимаб, который продемонстрировал преимущество в отношении достижения ответа по шкале ASAS40, в улучшении физической функции и достижении частичной ремиссии по шкале ASAS через 6 мес лечения. Инфликсимаб превзошел голимумаб, этанерцепт и адалимумаб по указанным параметрам.
В другом метаанализе проанализированы данные 14 рандомизированных клинических исследований, включавших более 2600 пациентов с активным АС [9]. Согласно полученным результатам, большинство схем биологической терапии были более эффективными в сравнении с плацебо в отношении всех оцениваемых результатов, за исключением секукинумаба и тоцилизумаба. Также установлено, что инфликсимаб 5 мг/кг массы тела был наиболее эффективным относительно достижения ASAS20. На основе полученных результатов метаанализа исследователи пришли к выводу, что инфликсимаб 5 мг/кг является наилучшим вариантом биологической терапии при АС [9].
В недавнем метаанализе оценены результаты 18 исследований, в которых приняли участие 2900 пациентов, что позволило проанализировать сравнительную эффективность всех 6 режимов биологической терапии (5 оригинальных препаратов и 1 биосимиляр ингибитора TNF-α), доступных сегодня пациентам. Авторы этого метаанализа также пришли к выводу, что инфликсимаб является наиболее эффективным ингибитором TNF при АС в отношении индекса активности АС BASDAI (Bath Ankylosing Spondylitis Disease Activity Index — BASDAI) на 12-й неделе лечения [17]. Примечательно, что результаты данного метаанализа также показали, что эффективность биосимиляра инфликсимаба сопоставима с таковой оригинального препарата.
Таким образом, ряд метаанализов подтверждает преимущества терапии АС с применением инфликсимаба в контексте ее эффективности.
Оригинальный инфликсимаб и его биосимиляр
Как известно, биологические агенты являются высокотехнологичными продуктами, стоимость разработки и производства которых достаточно высока, что существенно повышает расходы на лечение иммуноопосредованных воспалительных артропатий, включая АС. Ввиду этого отсутствие доступа пациентов к современным эффективным видам терапии становится все более актуальной проблемой в некоторых странах [18, 19].
Сегодня многие референтные биологические препараты достигли или близки к истечению срока действия патентной защиты, и, таким образом, для пациентов уже доступен ряд их биосимиляров. Биосимиляры призваны расширить доступ пациентов к современным терапевтическим подходам, поскольку они, как правило, дешевле, чем референтные препараты [20–24]. В Европейском Союзе первый биосимиляр был одобрен в апреле 2006 г. Сегодня европейским пациентам доступен широкий спектр биосимиляров для лечения при различных заболеваниях.
Далее будут рассмотрены вопросы сопоставимости профилей эффективности и безопасности биосимиляра инфликсимаба (CT‑P13, в Украине доступный под торговым наименованием Фламмэгис(инфликсимаб)), который представляет собой моноклональное антитело против TNF. Референтным препаратом или препаратом сравнения в этом случае является оригинальный инфликсимаб. CT-P13 стал первым биосимиляром, одобренным для лечения при иммуноопосредованных воспалительных артропатиях Европейским агентством по лекарственным средствам (European Medicines Agency — EMA) [12].
Регуляторные органы одобряют биосимиляр на основании широкого спектра данных, которые призваны подтвердить его сопоставимость с референтным препаратом. Например, EMA дает одобрение биосимиляру на основании данных о высокой физико-химической и биологической подобности референтному препарату [25]. Для одобрения биосимиляра также часто требуются статистически подтвержденная эквивалентности фармакокинетических характеристик, эффективности и профиля безопасности в ходе клинических исследований [26].
CT-P13 одобрен EMA в сентябре 2013 г., а в Украине доступен с августа 2016 г. под торговым названием Фламмэгис. Биосимиляр инфликсимаба одобрен для тех же показаний, что и референтный инфликсимаб, а именно для лечения при ревматоидном артрите, болезни Крона у взрослых и детей, при язвенном колите у взрослых и детей, АС, псориатическом артрите и псориазе [12]. Одобрение биосимиляра инфликсимаба базировалось на данных, полученных при проведении широкого круга доклинических и клинических исследований, результаты которых будут рассмотрены далее.
Биосимиляр инфликсимаба: физико-химические характеристики и данные доклинических исследований
Биосимиляр инфликсимаба и референтный инфликсимаб представляют собой химерные (гибридные) мышино-человеческие моноклональные антитела иммуноглобулина G1, направленные против TNF, которые производятся с помощью технологии рекомбинантной ДНК в одной и той же линии гибридомных клеток мыши [27]. Природа биологических продуктов такова, что оба препарата на самом деле представляют собой сложные смеси ряда похожих форм, таким образом демонстрируя микрогетерогенность. Эти два лекарственных средства имеют идентичные фармацевтическую форму, силу воздействия, состав и способ введения [27], таким образом, инструкции по дозировке и введению для каждого препарата также идентичны [28, 29].
Все основные физико-химические характеристики и биологическая активность биосимиляра и референтного инфликсимаба, которые в настоящее время можно измерить, были изучены и являются сопоставимыми [27]. Аминокислотные последовательности двух препаратов идентичны, инфракрасная спектроскопия на основе преобразования Фурье и другие структурные анализы показали, что их вторичная и третичная структуры очень похожи, хотя и не идентичны [27]. Два препарата имеют схожие профили дезамидирования и окисления и, хотя наблюдается ряд различий относительно гликозилирования, общий тип и распределение гликанов, наблюдаемые в биосимиляре и референтном инфликсимабе, подобны [27, 30]. Аффинность связывания двух препаратов с TNF, а также с другими лигандами инфликсимаба (например рецепторы Fcγ и C1q), чрезвычайно сходна, и ни один из препаратов не связывает лимфотоксин [27].
Биологическая активность биосимиляра инфликсимаба изучена в ряде экспериментов in vitro. Так, показано, что уровень нейтрализации TNF при применении биосимиляра, что можно считать основным механизмом действия инфликсимаба [27], эквивалентен таковому для референтного инфликсимаба в линии клеток WEHI 164. Аналогично уровни апоптоза и комплементзависимой цитотоксичности были эквивалентны в клеточной линии Jurkat, экспрессирующей трансмембранный TNF [27, 30].
Сравнимая антителозависимая клеточная цитотоксичность (comparable antibody‐dependent cellular cytotoxicity — ADCC) изучалась при применении биосимиляра и референтного инфликсимаба in vitro в модели мононуклеарных клеток периферической крови (peripheral blood mononuclear cells — PBMC) или цельной крови пациентов с болезнью Крона [27]. Относительно более низкие уровни ADCC наблюдали при применении биосимиляра по сравнению с референтным инфликсимабом в модели, использующей NK-клетки в качестве эффекторных клеток и клетки линии Jurkat в качестве клеток-мишеней. Предполагается, что такой результат связан с рядом отличий в гликозилировании (в частности фукозилировании) и, следовательно, в уровне сродства относительно связывания с рецептором иммуноглобулина FcγRIIIa. Однако, как продемонстрировано на модели РВМС/цельная кровь, различия в фукозилировании и связывании FcγRIIIa между биосимиляром и референтным инфликсимабом вряд ли являются клинически значимыми. Следует отметить, что на моноцитах, стимулируемых липополисахаридами, и моделирующих воспалительную реакцию в кишечнике in vivo, показано, что инфликсимаб не индуцирует существенной ADCC-активности, что аналогично наблюдениям с другими таргетными лекарственными средствами, мишенью которых является TNF, такими как голимумаб [27, 31–33].
Клинические исследования биосимиляра инфликсимаба
Фармакокинетические свойства биосимиляра инфликсимаба изучали с участием здоровых добровольцев в ходе двойного слепого исследования I фазы с использованием двух серий референтных препаратов инфликсимаба с целью предоставить информацию о сопоставимости биосимиляра инфликсимаба (CT-P13) различными источниками или коммерческими партиями одного и того же препарата сравнения (из-за возможной межпартийной вариабельности) [34]. В общей сложности 213 добровольцев были случайным образом рандомизированы на три равные группы: в 1-й группе однократно применяли биосимиляр 5 мг/кг, во 2-й — референтный инфликсимаб из Европы, в 3-й — референтный инфликсимаб из США. Согласно полученным результатам, максимальная концентрация в сыворотке крови (Cmax), площадь под фармакокинетической кривой, описывающей зависимость «концентрация/время» (AUC) от нуля до времени последней измеримой концентрации и AUC от нуля до бесконечности были в пределах предварительно определенного уровня эквивалентности (80–125%) для всех групп сравнения.
Фармакокинетическая эквивалентность биосимиляра и референтного инфликсимаба доказана в ходе рандомизированного двойного слепого исследования I фазы с участием пациентов с АС — PLANETAS (Programme evaLuating the Autoimmune disease iNvEstigational drug cT-p13 in AS patients) [35]. Популяция пациентов с АС была выбрана после обсуждения с Комитетом по лекарственным средствам для применения у человека (Committee for Medicinal Products for Human Use — CHMP) при EMA его репрезентативности относительно чувствительности [27]. Пациенты с АС были выбраны как наиболее близкая популяция к здоровым добровольцам среди больных, которым показано лечение инфликсимабом. Кроме того, дозировка инфликсимаба при АС (монотерапия дозой 5 мг/кг) была выбрана как подходящая для сравнения фармакокинетики и иммуногенности.
В этом исследовании пациенты с активным АС рандомизированы на две равные группы (n=125 в каждой группе): пациенты получали биосимиляр инфликсимаба или референтный инфликсимаб 5 мг/кг путем внутривенной инфузии в течение 2 ч при включении в исследование (0 нед), через 2; 6 нед, а затем — каждые 8 нед. Первичной конечной точкой была выбрана фармакокинетическая эквивалентность, которая оценивалась как AUC и Cmax между 22-й и 30-й неделями (дозы 5 и 6). Профили концентрации в сыворотке крови и времени после введения доз 1–6 исследуемого препарата были одинаковыми в двух группах лечения. Фармакоэквивалентность биосимиляра референтному препарату по показателям AUC и Cmax была подтверждена, поскольку 90% доверительный интервал (ДИ) для отношений этих параметров находился в пределах заранее установленного запаса эквивалентности 80–125% (AUC 104,5%; 90% ДИ 94,3–115,8; Cmax 101,5%; 90% ДИ 94,7–108,9). Вторичные конечные точки фармакоэквивалентности, включая минимальные концентрации в сыворотке крови и период полувыведения, также были очень похожи между двумя группами лечения до 30-й недели [35]. Анализ данных 213 пациентов, пролеченных в течении 54 нед, подтвердил фармакокинетическую эквивалентность [36].
Эффективность
Эффективность биосимиляра инфликсимаба у пациентов с активным АС оценивали в исследовании PLANETAS [35, 36]. Как показано в таблице, доля пациентов с улучшением признаков и симптомов заболевания в соответствии с критериями, указанными в Рекомендациях Международного общества по оценке спондилоартрита (Assessment of Spondyloarthritis International Society Guidelines — ASAS), была сопоставимой в группах биосимиляра инфликсимаба и референтного инфликсимаба на 14-, 30- и 54-й неделе. Среднее изменение (±SD) по сравнению с исходным показателем активности болезни AS (ASDAS) — C-реактивного белка (CRP) также было подобным для биосимиляра и референтного инфликсимаба на 14-й неделе (–1,8±1,1 и –1,8±1,1 соответственно) и 30-й неделе (–1,8±1,2 и –1,7±1,2 соответственно). Кроме того, улучшение до 30-й недели в отношении всех других показателей эффективности (Индекс активности АС (Bath Ankylosing Spondylitis Disease Activity Index — BASDAI), Функциональный индекс BASFI (Bath AS Functional Index), (BASMI)), Метрологический индекс BASMI (Bath AS Metrology Index) и пр., а также качество жизни, оцененные по краткому опроснику, состоящему из 36 вопросов, были сопоставимы в двух группах лечения.
| Конечная точка | Биосимиляр инфликсимаба (n=125) | Референтный инфликсимаб (n=125) | Соотношение рисков (95% ДИ) | Значение p |
|---|---|---|---|---|
| Ответ по шкале ASAS20 (доля пациентов, %) | ||||
| Неделя 14-я | 62,6 | 64,8 | 0,91 (0,53–1,54) | 0,7162 |
| Неделя 30-я | 70,5 | 72,4 | 0,91 (0,51–1,62) | 0,7406 |
| Ответ по шкале ASAS40 (доля пациентов) | ||||
| Неделя 14-я | 41,7 | 45,9 | 0,85 (0,51–1,42) | 0,5353 |
| Неделя 30-я | 51,8 | 47,4 | 1,19 (0,70–2,00) | 0,5213 |
| Неделя 54-я | 54,7 | 49,1 | 1,26 (0,73–2,15) | 0,4084 |
| Частичная ремиссия по шкале ASAS (доля пациентов, %) | ||||
| Неделя 54-я | 19,8 | 17,6 | 1,20 (0,60–2,40) | 0,6122 |
Адаптировано по: Park W., Hrycaj P., Jeka S. et al., 2013; Park W., Jaworski J., Brzezicki J. et al., 2013 [35, 36].
Пациенты, завершившие 54-недельное лечение в исследовании PLANETAS, имели возможность продлить терапию с применением биосимиляра инфликсимаба и получали препарат в течение еще 1 года [37]. Напомним, что в ходе 54-недельного исследования пациенты были рандомизированы на две группы: в одной применяли референтный инфликсимаб, в другой — его биосимиляр. Всего 174 (82,4%) пациента из 210 лиц, закончивших 54-недельное исследование, приняли участие в дальнейшем исследовании. Всем участникам с 62-й по 102-ю неделю каждые 8 нед вводили биосимиляр инфликсимаба (5 мг/кг массы тела). Пациенты, которые в первые 54 нед получали референтный препарат, а затем с 62-й недели — биосимиляр, составили группу «переключения», а получавшие биосимиляр в течение первых 54 нед и затем продолжившие его применение — составили группу «продления». Эффективность лечения с применением биосимиляра инфликсимаба по показателям ASAS20 и ASAS40 сохранялась до конца исследования как в группе «продления» (n=88; 70,1 и 57,5% на 78-й неделе, 80,7 и 63,9% — на 102-й неделе соответственно), так и в группе «переключения» (n=86; 77,1 и 51,8% на 78-й неделе, 76,9 и 61,5% — на 102-й неделе соответственно) (рис. 1).
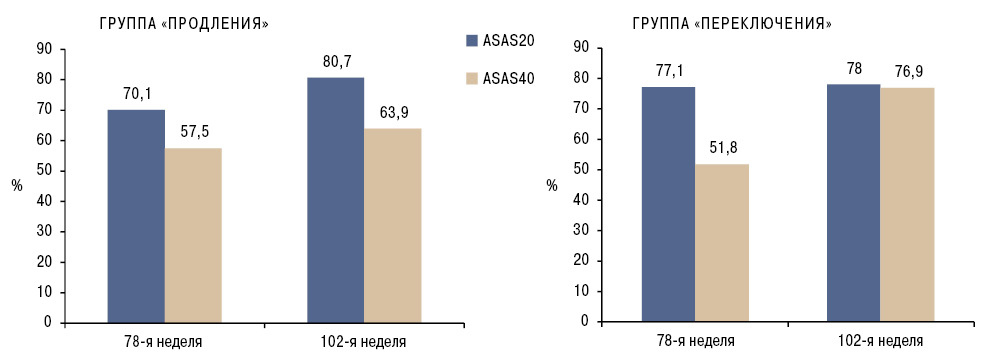
Результаты исследования PLANETAS подтверждены данными метаанализа, включающего информацию о 13 рандомизированных клинических исследованиях, в котором изучена эффективность различных ингибиторов TNF, в том числе инфликсимаба и его биосимиляра [38]. Согласно полученным результатам, инфликсимаб и его биосимиляр были наиболее эффективными по шкале ASAS20 по итогам 12 и 24 нед среди 5 анализируемых биологических агентов. Инфликсимаб и его биосимиляр показали самые высокие ОР по сравнению с плацебо — 7,2 (95% ДИ 3,68–13,19) и 6,25 (95% ДИ 2,55–13,14) соответственно.
Профиль безопасности
Данные исследования PLANETAS демонстрируют, что профиль безопасности биосимиляра инфликсимаба аналогичен таковому референтного инфликсимаба. До 30-й недели PLANETAS неблагоприятные события, возникающие во время лечения, были зарегистрированы у 64,8 и 63,9% пациентов с АС, получавших биосимиляр и референтный инфликсимаб соответственно [35]. В обеих группах наиболее распространенные неблагоприятные события, возникающие во время лечения, включали повышение уровней трансаминаз и развитие латентного туберкулеза. Считалось, что латентный туберкулез отмечался в том случае, если у пациента, у которого первоначально был отрицательный результат теста на туберкулез при анализе на высвобождение γ-интерферона (interferon γ-release assay — IGRA), впоследствии отмечен положительный результат. Случаев реактивации туберкулеза не было. Такие подробные оценки данных о туберкулезе были выполнены, поскольку известно, что пациенты, получающие лечение анти-TNF-препаратами, подвержены повышенному риску развития туберкулеза как de novo, так и реактивации заболевания [39]. Частота серьезных побочных реакций, отмеченных в ходе исследования PLANETAS, была сопоставима для биосимиляра и референтного инфликсимаба. Так, серьезные побочные реакции, связанные с лечением, зарегистрированы в 4 случаях на фоне лечения биосимиляром инфликсимаба, а именно — перфорация пищевода, диссеминированный туберкулез, легочный туберкулез и одышка после инфузии препарата, и в 5 случаях на фоне лечения референтным инфликсимабом (две реакции, связанные с инфузией, воспаление подкожной клетчатки, легочный туберкулез и раневая инфекция).
По результатам 54 нед исследования PLANETAS не выявлено существенных различий в профилях безопасности биосимиляра и референтного инфликсимаба [36]. За 54 нед в исследовании PLANETAS зарегистрировано 2 летальных случая (по одному в каждой группе лечения). Все случаи летального исхода произошли после 30 нед и не были связаны с исследуемыми препаратами. В течение последующего года терапии профили безопасности биосимиляра инфликсимаба были одинаковыми в группах «продления» и «переключения» [37].
Иммуногенность и целесообразность переключения с оригинального препарата на биосимиляр
Незначительные различия в составе биологического препарата могут повлиять на его профиль иммуногенности. Поэтому были высказаны опасения относительно потенциального влияния любых различий между биосимиляром и его референтным препаратом на иммуногенность [40]. В ходе исследования PLANETAS также определялся уровень антител против биосимиляра и референтного инфликсимаба (anti-drug antibodies — ADA). Результаты были сопоставимы для двух агентов. ADA выявлены у 9,1 и 11,0% пациентов с АС в группах биосимиляра и референтного инфликсимаба на 14-й неделе, 27,4 и 22,5% — на 30-й неделе и 22,9 и 26,7% — на 54-й неделе соответственно [12, 35, 36] (рис. 2). У пациентов, участвовавших в продолжении исследования PLANETAS, частота выявления ADA была сопоставимой между группами «продления» и «переключения» и не повышалась значительно в течение 2-го года исследования (54-я неделя — 22,2 и 26,2%; 78-я неделя — 24,4 и 31,3%; 102-я неделя — 25,0 и 30,7% соответственно) [12, 37] (рис. 3).
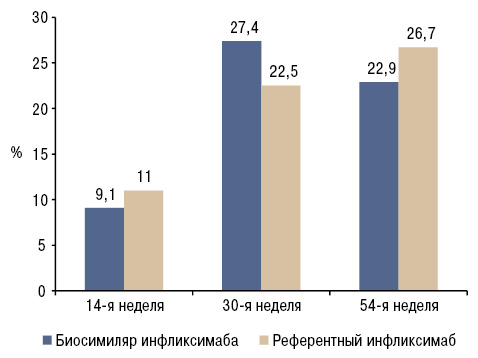
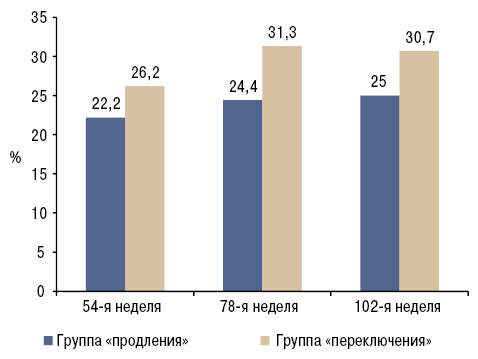
Известно, что продуцирование ADA может привести к снижению эффективности биологических препаратов, таких как инфликсимаб [41]. В исследовании PLANETAS установлено, что хотя эффективность препарата терапии была снижена у ADA-положительных пациентов в обеих группах лечения, общие межгрупповые отношения AUC и Cmax оставались около 100% [35]. Более того, хотя эффективность лечения была снижена у пациентов с ADA, это наблюдалось как у референтного препарата, так и у биосимиляра. Следует отметить, что не было статистически значимых различий между группами лечения в какой-либо конечной точке эффективности на 30-й неделе [35]. Влияние ADA на профиль безопасности было также сопоставимым в группах биосимиляра и референтного инфликсимаба [27]. Кроме того, ADA-ответ был сопоставим между теми пациентами, которые перешли на биосимиляр, и теми, которых лечили биосимиляром на протяжении всей продолжительности исследования PLANETAS.
Таким образом, клинические реакции на лечение в исследовании PLANETAS были ослаблены у пациентов с ADA по сравнению с пациентами без ADA. Однако такое снижение эффективности лечения было сопоставимым по величине в группах биосимиляра и референтного инфликсимаба.
Целесообразность замены референтного препарата на биосимиляр инфликсимаба
Широкое внедрение биосимиляров в клиническую практику дало начало серьезной дискуссии относительно того, в какой степени биосимиляр на практике может считаться эквивалентным его референтному лекарственному средству, и в частности целесообразно ли переключение или «автоматическая замена» референтного лекарственного средства биосимиляром [26, 42].
Так, в связи с более низкой стоимостью биосимиляров по сравнению с референтными препаратами, существует значительный интерес к решению вопроса, можно ли эффективно и безопасно лечить вновь диагностированных пациентов с помощью конкретного биосимиляра и можно ли проводить замену лекарственного средства для тех, кто уже проходит курс лечения референтным препаратом, на его биосимиляр без отрицательных последствий в отношении эффективности и профиля безопасности [26, 42].
В настоящее время во многих европейских странах решение о замене референтного препарата на его биосимиляр, как правило, принимает лечащий врач [26, 43].
Что касается биосимиляра инфликсимаба, то установлено, что его эффективность и безопасность (включая иммуногенность) сопоставимы с таковыми референтного препарата вплоть до 102-й недели исследования PLANETAS. Кроме того, замена референтного препарата в группе «переключения» после 54-й недели не повлияла на эффективность лечения [37]. Так, в продолжении исследования PLANETAS, в котором приняли участие 174 (82,9%) из 210 пациентов, завершивших лечение в течение первых 54 нед и согласившихся участвовать в продлении терапии, была доказана сопоставимая эффективность и профиль безопасности биосимиляра инфликсимаба [44]. Среди 174 пациентов, принявших участие в продолжении исследования, 88 больных продолжили применять биосимиляр инфликсимаба и 86 — были переведены с терапии референтным препаратом на лечение биосимиляром инфликсимаба. В этих группах «продления» и «переключения» частота ответов по шкале ASAS20 на 102-й неделе лечения составила 80,7 и 76,9% соответственно. Уровни частичной ремиссии по шкалам ASAS40 и ASAS также были сопоставимы между группами. Неблагоприятные события привели к прекращению лечения во время дополнительного исследования у 3 (3,3%) и 4 (4,8%) пациентов в группах «продления» и «переключения» соответственно.
Это первое исследование, которое показало, что переключение с референтного инфликсимаба на его биосимиляр возможно без негативного влияния на профиль безопасности или эффективности у пациентов с АС. В группе «продления» биосимиляр инфликсимаба был эффективен и хорошо переносился в течение 2 лет лечения.
Аналогичные результаты получены и для других заболеваний, при которых показан инфликсимаб [45, 46].
Сравнительная эффективность биосимиляра инфликсимаба при замене им референтного препарата в условиях рутинной практики
Сравнительная оценка эффективности и безопасности биосимиляра инфликсимаба и его референтного препарата у взрослых пациентов с АС проводилась в ряде исследований в условиях рутинной медицинской практики.
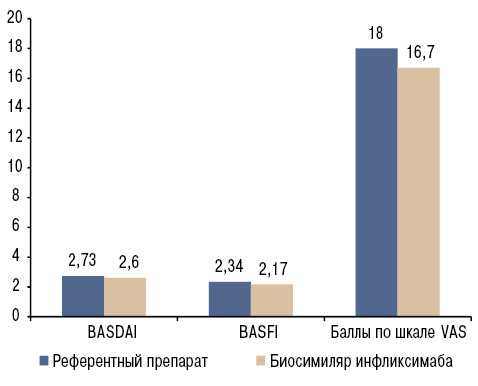
Так, в итальянском многоцентровом исследовании изучалась эффективность, профиль безопасности и иммуногенность перехода с референтного препарата на биосимиляр инфликсимаба у пациентов с АС в условиях рутинной клинической практики [47]. В исследовании принял участие 41 пациент, посещающий три ревматологических центра с диагнозом АС с клинически неактивной или умеренной активностью заболевания. Пациенты в течение более 6 мес получали референтный инфликсимаб и были переведены на биосимиляр по фармакоэкономическим причинам, после чего наблюдались еще в течение 6 мес. При проведении исследования анализировались такие показатели, как BASDAI, BASFI, показатель боли по VAS, продолжительность утренней скованности, частота и характер нежелательных явлений и др. На момент замены препарата средний возраст пациентов составил 50,9 года (диапазон — 23–80 лет), средняя продолжительность течения заболевания была 124,5 мес (диапазон — 14–372 мес) и средняя продолжительность лечения с применением референтного инфликсимаба — 73,7 мес (диапазон — 6–144 мес). После 6 мес терапии с применением биосимиляра инфликсимаба не отмечено статистически достоверных различий по сравнению с референтным препаратом относительно BASDAI (2,73±1,5 против 2,6±1,3; p=0,27), BASFI (2,34±1,3 против 2,17±1,2; p=0,051), баллов по шкале VAS (18±14,7 против 16,7±11,3; р=0,55) и других показателей. При этом необходимо подчеркнуть, что средняя продолжительность утренней скованности статистически достоверно уменьшилась при применении биосимиляра инфликсимаба (7,2±6,9 против 5,8±6; р=0,02). Кроме того, не было изменений уровня циркулирующего инфликсимаба (4,22±2,89 против 4,84±2,86 мкг/мл; р=0,80) или уровней антител против инфликсимаба (27,76±17,13 против 27,27±17,28 нг/мл; р=0,98) (рис. 4). Таким образом, замена референтного препарата на биосимиляр инфликсимаба в этом многоцентровом исследовании не была связана с какими-либо статистически значимыми различиями в эффективности, частоте побочных эффектов или уровне антител в крови против инфликсимаба.
Согласно результатам другого многоцентрового клинического исследования, проводившегося в Болгарии, Чехии и Румынии, выявлено, что биосимиляр инфликсимаба является эффективным и обладает благоприятным профилем безопасности при применении в условиях рутинной медицинской практики [48]. В данном исследовании приняли участие 70 пациентов с АС, получавшие лечение в течение 24 нед. Эффективность терапии оценивали с использованием показателя BASDAI. Безопасность оценивали по количеству отмен назначенного лечения и нежелательным явлениям. В анализ эффективности были включены 62 пациента. Применение биосимиляра инфликсимаба у пациентов с АС статистически достоверно улучшило показатели пациентов по индексу BASDAI через 12 и 24 нед (p=0,0001 по сравнению с исходным значением для обеих точек времени). Показатели профиля безопасности также были сопоставимы для обоих препаратов.
В исследовании, проведенном в Дании в условиях рутинной клинической практики, также изучали эффективность биосимиляра инфликсимаба по сравнению с референтным препаратом до/после замены последнего у пациентов с АС [49]. Для проведения данного исследования использовались данные Национального регистра DANBIO. В ходе исследования оценивали активность заболевания по шкале ASDAS (Ankylosing Spondylitis Disease Activity Score) за 3 мес до и через 3 мес после замены препарата у 279 пациентов в возрасте 44–66 лет. Замена препарата проведена для 199 пациентов с АС. Длительность наблюдения составила в среднем 413 дней. Пациенты получали референтный препарат в среднем в течение 6,8 (4,3–9,5) года до замены его на биосимиляр. Согласно результатам исследования, активность заболевания по шкале ASDAS за 3 мес до замены препарата составила 1,8 (1,2–2,6), во время замены препарата — 2,0 (1,4–2,6) и через 3 мес применения биосимиляра инфликсимаба сохранилась на том же уровне — 2,0 (1,2–2,9). Таким образом, установлено, что активность заболевания у пациентов с АС была сопоставима за 3 мес до/после замены референтного препарата на биосимиляр инфликсимаба. Аналогичные данные получены и для BASDAI.
Подобные результаты зарегистрированы в норвежском исследовании NOR-SWITCH, проведенном в 2014–2015 гг., в котором приняли участие в том числе и 91 пациент с АС [50]. NOR-SWITCH представляет собой рандомизированное двойное слепое клиническое исследование, сравнивающее безопасность и эффективность замены референтного инфликсимаба на биосимиляр и продолжения лечения референтным инфликсимабом у пациентов с АС и другими заболеваниями, при которых показан инфликсимаб. Так, риск ухудшения течения заболевания в группе референтного препарата составил 39,5%, а в группе замены на биосимиляр — 33,3%. Доказано, что замена референтного препарата на биосимиляр инфликсимаба не приводила к ухудшению эффективности или профиля безопасности лечения (в заданном для биосимиляра пределе 15%).
Результаты последних клинических исследований были объединены в ходе метаанализа, опубликованного в 2019 г., при проведении которого исследователи сравнивали профиль безопасности и эффективность препаратов при «переключении» между референтным препаратом и биосимиляром инфликсимаба у пациентов с воспалительными артропатиями, включая АС [51]. Всего проанализированы данные 113 статей и 149 тезисов, из них 70 признаны актуальными и включены в этот анализ. Большинство исследований были неконтролируемыми обсервационными. В финальный анализ вошли данные 6 рандомизированных контролируемых исследований. Анализ полученных результатов не выявил клинически значимых изменений эффективности или безопасности, связанных с заменой референтного препарата на биосимиляр инфликсимаба.
Таким образом, вышеприведенные данные позволяют говорить о том, что переход от референтного инфликсимаба к биосимиляру является приемлемым решением, которое должно приниматься лечащим врачом индивидуально для каждого пациента.
Выводы
Внедрение биологических агентов без сомнения оказало значительное влияние на лечение пациентов с АС. В некоторых странах, однако, это влияние уменьшено ввиду высокой стоимости иммунобиологической терапии. Поэтому очень актуальным шагом является внедрение в терапию при АС биосимиляров, в том числе инфликсимаба, эффективность и профиль безопасности которого сопоставимы с референтным препаратом не только в условиях клинических исследований, но и в рутинной клинической практике.
Список использованной литературы
- 1. Gran J., Husby G. (1993) The epidemiology of ankylosing spondylitis. Semin Arthritis Rheum., 22: 319–334.
- 2. Elalouf O., Elkayam O. (2015) Long-term safety and efficacy of infliximab for the treatment of ankylosing spondylitis. Therapeutics and clinical risk management, 11: 1719.
- 3. Wanders A., Landewe R., Dougados M. et al. (2005) Association between radiographic damage of the spine and spinal mobility for individual patients with ankylosing spondylitis: can assessment of spinal mobility be a proxy for radiographic evaluation. Ann. Rheum. Dis., 64: 988–994.
- 4. Braun J., Sieper J. (1996) The sacroiliac joint in the spondyloarthropathies. Curr. Opin. Rheumatol., 8: 275–287.
- 5. Lee J., Jun J., Jung S. et al. (2002) Higher prevalence of peripheral arthritis among ankylosing spondylitis patients. J. Korean. Med. Sci, 17: 669–673.
- 6. Peters M., van der Horst-Bruinsma I., Dijkmans B., Nurmohamed M. (2004) Cardiovascular risk profile of patients with spondylarthropathies, particularly ankylosing spondylitis and psoriatic arthritis. Semin. Arthritis Rheum., 34: 585–592.
- 7. Rosenbaum J. (1992) Acute anterior uveitis and spondyloarthropathies. Rheum. Dis. Clin. North Am., 18: 143–151.
- 8. Baeten D., De Keyser F., Mielants H., Veys E. (2002) Ankylosing spondylitis and bowel disease. Best Pract. Res. Clin. Rheumatol., 16: 537–549.
- 9. Chen C., Zhang X., Xiao L. et al. (2016) Comparative effectiveness of biologic therapy regimens for ankylosing spondylitis: a systematic review and a network meta-analysis. Medicine, 95(11): e3060.
- 10. Braun J., Baraliakos X., Heldmann F. et al. (2014) Tumor necrosis factor alpha antagonists in the treatment of axial spondyloarthritis. Expert Opin. Investig Drugs, 23: 647–659.
- 11. Kuek A., Hazleman B.L., Ostor A.J. (2007) Immune‐mediated inflammatory diseases (IMIDs) and biologic therapy: a medical revolution. Postgrad Med. J., 83: 251– 60.
- 12. Isaacs J.D., Cutolo M., Keystone E.C. et al. (2016) Biosimilars in immune‐mediated inflammatory diseases: initial lessons from the first approved biosimilar anti‐tumour necrosis factor monoclonal antibody. J. Intern. Med., 279(1): 41–59.
- 13. Brandt J., Haibel H., Cornely D. et al. (2000) Successful treatment of active ankylosing spondylitis with the anti-tumor necrosis factor α monoclonal antibody infliximab. Arthritis Rheum., 43: 1346–1352.
- 14. Braun J., Brandt J., Listing J. et al. (2002) Treatment of active ankylosing spondylitis with infliximab: a randomised controlled multicentre trial. Lancet, 359: 1187–1193.
- 15. Bell G.M., Reynolds G., Isaacs J.D. (2011) Biologic therapies in non-rheumatic diseases: lessons for rheumatologists? Nat. Rev. Rheumatol., 7: 507–516.
- 16. Maxwell L.J., Zochling J., Boonen A. et al. (2015) TNF-alpha inhibitors for ankylosing spondylitis. Cochrane Database of Systematic Reviews (4), CD005468.
- 17. Wang R., Dasgupta A., Ward M.M. (2018) Comparative efficacy of tumor necrosis factor-α inhibitors in ankylosing spondylitis: a systematic review and Bayesian network metaanalysis. J. Rheumatol., 45: 481–490.
- 18. Nast A., Mrowietz U., Kragballe K. et al. (2013) Barriers to the prescription of systemic therapies for moderate‐to‐severe psoriasis: a multinational cross‐sectional study. Arch. Dermatol. Res., 305: 899–907.
- 19. Putrik P., Ramiro S., Kvien T.K. et al. (2014) Inequities in access to biologic and synthetic DMARDs across 46 European countries. Ann. Rheum. Dis., 73: 198– 206.
- 20. World Health Organization. Expert Committee on Biological Standardization. Geneva, 19 to 23 October 2009. Guidelines on evaluation of similar biotherapeutic products (SBPs). Available at: http://www.who.int/biologicals/areas/biological_therapeutics/BIOTHERAPEUTICS_FOR_WEB_22APRIL2010.pdf (accessed 1 October 2014).
- 21. Abraham J. (2013) Developing oncology biosimilars: an essential approach for the future. Semin. Oncol., 40(1): S5–24.
- 22. Lorenz H.M., Braun J., Kruger K., Schneider M. (2014) Implementation and use of biosimilars in the therapy of inflammatory rheumatic diseases: statement of the German Society of Rheumatology. Z. Rheumatol., 73: 784–786.
- 23. Rinaudo-Gaujous M., Paul S., Tedesco E.D. et al. (2013) Review article: biosimilars are the next generation of drugs for liver and gastrointestinal diseases. Aliment Pharmacol. Ther., 38: 914–924.
- 24. Yoo D.H. (2014) The rise of biosimilars: potential benefits and drawbacks in rheumatoid arthritis. Expert Rev. Clin. Immunol., 10: 981–983.
- 25. European Medicines Agency. Guideline on Similar Biological Medicine Products. Draft. 22 May 2013. Available at: http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2013/05/WC500142978.pdf (accessed 20 October 2014).
- 26. Ebbers H.C., Crow S.A., Vulto A.G., Schellekens H. (2012) Interchangeability, immunogenicity and biosimilars. Nat. Biotechnol., 30: 1186– 190.
- 27. European Medicines Agency. Committee for Medicinal Products for Human Use (CHMP). Assessment report: Remsima (infliximab). 27 June 2013. Available at: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002576/WC500151486.pdf (accessed 2 October 2014).
- 28. European Medicines Agency. Remsima (infliximab). Summary of Product Characteristics. Available at: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/002576/WC500150871.pdf (accessed 22 October 2014).,
- 29. European Medicines Agency. Remicade (infliximab). Summary of Product Characteristics. Available at: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/000240/WC500050888.pdf (accessed 22 October 2014).
- 30. Jung S.K., Lee K.H., Jeon J.W. et al. (2014) Physicochemical characterization of Remsima. MAbs, 6: 1163– 1177.
- 31. Weise M., Kurki P., Wolff‐Holz E. et al. (2014) Biosimilars: the science of extrapolation. Blood, 124: 3191– 3196.
- 32. Kurki P., Bielsky M.C. (2014) Working Party on Similar Biological Medicinal Products of Committee for Medicinal Products for Human Use (CHMP). ECCO position challenged by European drug regulators. J. Crohns Colitis, 8: 258.
- 33. Shealy D.J., Cai A., Staquet K. et al. (2010) Characterization of golimumab, a human monoclonal antibody specific for human tumor necrosis factor alpha. MAbs, 2: 428–439.
- 34. Yoo D.-H., Park W., Shim S.-C. et al. (2014) A randomized, double‐blind, three‐arm, parallel group, single‐dose study to compare the pharmacokinetics, safety, and tolerability of three formulations of infliximab (CT‐P13, EU‐sourced infliximab and US‐sourced infliximab) in healthy volunteers. Arthritis Rheumatol., 11: 664.
- 35. Park W., Hrycaj P., Jeka S. et al. (2013) A randomised, double‐blind, multicentre, parallel‐group, prospective study comparing the pharmacokinetics, safety, and efficacy of CT‐P13 and innovator infliximab in patients with ankylosing spondylitis: the PLANETAS study. Ann. Rheum. Dis., 72: 1605– 1612.
- 36. Park W., Jaworski J., Brzezicki J. et al. (2013) A randomised, double‐blind, parallel‐group, phase 1 study comparing the pharmacokinetics, safety and efficacy of CT‐P13 and infliximab in patients with active ankylosing spondylitis: 54 week results from the PLANETAS study. Ann. Rheum. Dis., 72(3): 516.
- 37. Park W., Miranda P., Brzosko M. et al. (2013) Efficacy and safety of CT‐P13 (infliximab biosimilar) over two years in patients with ankylosing spondylitis: comparison between continuing with CT‐P13 and switching from infliximab to CT‐P13. Arthritis Rheum., 65: 3326.
- 38. Baji P., Péntek M., Szántó S. et al. (2014) Comparative efficacy and safety of biosimilar infliximab and other biological treatments in ankylosing spondylitis: systematic literature review and meta-analysis. Eur. J. Health Econom., 15(1): 45–52.
- 39. British Thoracic Society Standards of Care (2005) BTS recommendations for assessing risk and for managing Mycobacterium tuberculosis infection and disease in patients due to start anti‐TNF‐alpha treatment. Thorax, 60: 800–805.
- 40. Feagan B.G., Choquette D., Ghosh S. et al. (2014) The challenge of indication extrapolation for infliximab biosimilars. Biologicals, 42: 177–183.
- 41. van Schouwenburg P.A., Rispens T., Wolbink G.J. (2013) Immunogenicity of anti‐TNF biologic therapies for rheumatoid arthritis. Nat. Rev. Rheumatol., 9: 164–172.
- 42. Tothfalusi L., Endrenyi L., Chow S.C. (2014) Statistical and regulatory considerations in assessments of interchangeability of biological drug products. Eur. J. Health Econ., 15(1): 5–11.
- 43. European Commission. Consensus Information Paper 2013. What you need to know about biosimilar medicinal products. Available at: http://ec.europa.eu/enterprise/sectors/healthcare/files/docs/biosimilars_report_en.pdf (accessed 5 October 2014).
- 44. Park W., Yoo D. H., Miranda P. et al. (2017) Efficacy and safety of switching from reference infliximab to CT-P13 compared with maintenance of CT-P13 in ankylosing spondylitis: 102-week data from the PLANETAS extension study. Ann. Rheum. Dis., 76(2): 346–354.
- 45. Yoo D.H., Prodanovic N., Jaworski J. et al. (2013) Efficacy and safety of CT‐P13 (infliximab biosimilar) over two years in patients with rheumatoid arthritis: comparison between continued CT‐P13 and switching from infliximab to CT‐P13. Arthritis Rheum., 65: 3319.
- 46. Kang Y.S., Moon H.H., Lee S.E. et al. (2014) Clinical experience of the use of CT‐P13, a biosimilar to infliximab in patients with inflammatory bowel disease: a case series. Dig. Dis. Sci, 60: 951–956.
- 47. Benucci M., Gobbi F.L., Bandinelli F. et al. (2017) Safety, efficacy and immunogenicity of switching from innovator to biosimilar infliximab in patients with spondyloarthritis: a 6-month real-life observational study. Immunol. Res., 65(1): 419–422.
- 48. Codreanu C., Šírová K., Jarošová K., Batalov A. (2018) Assessment of effectiveness and safety of biosimilar infliximab (CT-P13) in a real-life setting for treatment of patients with active rheumatoid arthritis or ankylosing spondylitis. Curr. Med. Res. Opin., 34(10): 1763–1769.
- 49. Glintborg B., Sørensen I.J., Loft A.G. et al. (2017) A nationwide non-medical switch from originator infliximab to biosimilar CT-P13 in 802 patients with inflammatory arthritis: 1-year clinical outcomes from the DANBIO registry. Ann. Rheum. Dis., 76(8): 1426–1431.
- 50. Jørgensen K.K., Olsen I.C., Goll G.L. et al. (2017) Switching from originator infliximab to biosimilar CT-P13 compared with maintained treatment with originator infliximab (NOR-SWITCH): a 52-week, randomised, double-blind, non-inferiority trial. Lancet, 389(10086): 2304–2316.
- 51. Feagan B.G., Lam G., Ma C., Lichtenstein G.R. (2019) Systematic review: efficacy and safety of switching patients between reference and biosimilar infliximab. Aliment.Pharmacol. Therapeut., 49(1): 31–40.

Leave a comment