ГЕМОРАГІЧНИЙ ВАСКУЛІТ ШЕНЛЯЙНА — ГЕНОХА, ЩО РОЗПОЧАВСЯ В ДИТЯЧОМУ ТА ДОРОСЛОМУ ВІЦІ
Синяченко О.В.1, Егудина Е.Д.2, Чернышова О.Е.1, Герасименко В.В.1, Ермолаева М.В.1, Суярко В.И.1, Дядык Е.А.3
- 1Донецкий национальный медицинский университет, Лиман
- 2ДУ «Дніпровська медична академія» МОЗ України, Дніпро
- 3Национальная медицинская академия последипломного образования им. П.Л. Шупика, Киев
Резюме. Актуальність проблеми. Характерний початок геморагічного васкуліту (ГВ) Шенляйна — Геноха в дитячому віці входить до діагностичних критеріїв захворювання, хоча подальша його еволюція та особливості патологічного процесу з дебютом хвороби у дорослих пацієнтів залишаються нез’ясованими. Мета і завдання дослідження. Оцінити еволюцію клінічних, інструментальних та морфологічних ознак ураження шкіри, суглобів і нирок у пацієнтів з ювенільним ГВ і рецидивуючим перебігом захворювання, що почався в дитячому та дорослому віці, вивчити характер патогенетичних побудов хвороби в цих групах пацієнтів. Об’єкт і методи. Під наглядом перебували 174 хворих на ГВ (83% чоловіків і 47% жінок). У 92 пацієнтів захворювання дебютувало в дитячому віці (в середньому в 12 років), а у 82 — в дорослому (у 25 років). І, ІІ і ІІІ ступені активності патологічного процесу встановлено у співвідношенні 1:2:2. Результати. У процесі еволюції ювенільного ГВ стають рідшими шкірна, шкірно-суглобово-абдомінальна та шкірно-абдомінально-ниркова форми захворювання, ураження променезап’ясткових, гомілковостопних і колінних суглобів, але частішають нирковий варіант патологічного процесу, розвивається хронічна хвороба нирок, виникають сакроілеїт, спондилопатія, тендовагініт, ентезопатія, епіфізарний остеопороз. Захворюванню, що трансформоване з ювенільного ГВ, властива у дорослих уртикарна форма шкірного синдрому і невластива некротично-виразкова з інфільтрацією шкіри поліморфноядерними лейкоцитами та розвитком вазотромбозу. У дорослих пацієнтів перебіг артропатії важчий із приєднанням додаткових клінічних, рентгенологічних та сонографічних ознак, формуються IV і V морфологічні класи генохівського гломерулонефриту з тубулоінтерстиціальним компонентом в усіх випадках. Віковий диморфізм на початку ГВ проявляється нижчими рівнями у сироватці крові фібронектину, циркулюючих імунних комплексів, ревматоїдного фактора і ендотеліну-1, але вищими концентраціями тромбоксану А2, циклічного гуанозинмонофосфату та параметра поверхневої в’язкості, частотою еозинофільної інфільтрації та фібриноїдного некрозу судин шкіри, екстравазацією еритроцитів і депозицією фібриногену. Висновки. У разі переходу ювенільного ГВ у хронічну форму дорослих захворювання нерідко набуває прогресуючого перебігу, що, перш за все, стосується патології суглобів і нирок.
УДК 616.13/.14-002.77-053.2/.8-071-036-092
Введение
Геморрагический васкулит (ГВ), или пурпура Шенляйна — Геноха, является наиболее частым вариантом системного васкулита (Barut K. et al., 2016; Carman M., Forsman J., 2016; Gur G. et al., 2016), который у детей отмечают в 1,4 раза чаще, чем другие нозологические формы сосудистой патологии вместе взятые (васкулит Кавасаки, аортоартериит Такаясу, узелковый полиартериит Куссмауля — Майера, болезнь Бехчета, микроскопический полиангиит) (Mao Y. et al., 2016). Существуют данные, что соотношение распространенности ГВ у детей и взрослых составляет 8:1–9:1 (Jelusić M. et al., 2015). Ежегодная заболеваемость ГВ достигает 2 чeловек на 10 тыс. населения, причем наблюдается повсеместный рост численности этих больных (Khanna G. et al., 2015; Elfving P. et al., 2016). Необходимо отметить, что болезнь может либо дебютировать во взрослом возрасте (значительно реже), либо трансформироваться из ювенильного ГВ, при этом особенности дальнейшей эволюции патологического процесса остаются неизученными (Albaramki J., 2016; Calvo-Río V. et al., 2016; Gaskill N. et al., 2016).
Цель и задачи выполненной работы — оценка эволюции клинических, инструментальных и морфологических признаков поражения кожи, суставов и почек у пациентов с рецидивирующим течением заболевания, начавшимся в детском и взрослом возрасте, изучение характера патогенетических построений болезни в этих группах пациентов.
объект и методы исследования
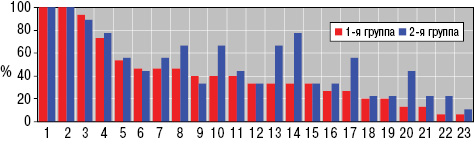
Под наблюдением находились 174 больных ГВ (52,9% мужчин и 47,1% женщин, средний возраст — 26,8±0,76 года). Длительность заболевания от дебюта его манифестации составила 8,9±0,62 года. Больных распределили на две группы: 1-ю составили 92 человека, у которых болезнь дебютировала в детском возрасте, а 2-ю — остальные 82 пациента с началом ГВ в более старшем возрасте. Средний возраст в начале болезни в 1-й группе составил 11,7±0,41 года, во 2-й — 24,9±0,63 года. І степень активности заболевания среди всех пациентов установлена в 24,2% случаев, ІІ и ІІІ степень — соответственно по 37,9%.
На предыдущих этапах течения ГВ кожные высыпания отмечали у всех без исключения больных, а на момент обследования — в 67,8% случаев. Поражение почек — геноховский гломерулонефрит (ГГН) — диагностировано в 70,7% наблюдений, суставов — в 48,3%, сердца — в 33,3%, печени — в 21,8%, центральной нервной системы — в 18,4%, желудочно-кишечного тракта — в 17,8%, скелетных мышц — в 16,1%, поджелудочной железы — в 10,9%, селезенки — в 8,1%, легких — в 5,8%, увеит — в 3,5%, лейкоцитокластная энантема — в 2,9%, хейлит — в 1,7%. Индекс интегральной тяжести ГВ (DSI) составил 6,3±0,25 о.е. Почечная форма заболевания диагностирована в 24,1% случаев, кожно-суставно-почечная — в 16,1%, кожно-почечная — в 13,2%, сугубо кожная и кожно-суставная — соответственно по 9,2%, кожно-суставно-абдоминально-почечная — в 6,9%, кожно-суставно-абдоминальная — в 4,0%, кожно-абдоминально-почечная — в 3,5%, суставно-абдоминальная — в 2,9%, суставно-абдоминально-почечная — в 2,3%, абдоминально-почечная — в 1,2% случаев.
Больным выполняли рентгенологическое исследование периферических костных, крестцово-подвздошных и позвонковых сочленений («Multix-Compact-Siеmens», Германия), сонографию суставов и внутренних органов (ультразвуковой сканер «Envisor-Philips», Нидерланды). Характер суставного синдрома оценивали по параметрам суставного счета, индексов Лансбури (LI), активности артрита (DAS) и интегральной тяжести поражения суставов (SAI) по формуле: ![]() Скорость клубочковой фильтрации (GF) определяли по формуле Кокрофта — Голта, высчитывали индекс прогрессирования нефропатии (PNI) по формуле:
Скорость клубочковой фильтрации (GF) определяли по формуле Кокрофта — Голта, высчитывали индекс прогрессирования нефропатии (PNI) по формуле: ![]() где S — стадия хронической болезни почек, Т — длительность ГГН. DSI оценивали по формуле:
где S — стадия хронической болезни почек, Т — длительность ГГН. DSI оценивали по формуле: ![]() где SN — число измененных признаков, n — общее число изученных признаков.
где SN — число измененных признаков, n — общее число изученных признаков.
Иммуноферментным методом в крови изучали уровни эндотелина-1 (ET1), тромбоксана А2 (TxA2), гомоцистеина (HCys), простациклина (PgI2), циклического гуанозинмонофосфата (cGMP), фибронектина (FN) и антител к кардиолипину (aCL) (ридер «PR2100-Sanofi diagnostic pasteur», Франция»). Для определения поверхностных вязкости (SV), упругости (SE), натяжения (ST), релаксации (SR) и модуля вязкоэластичности (VE) сыворотки крови использовали компьютерный тензиометр «PAT2-Sinterface» (Германия). С помощью биохимического анализатора «Olympus-AU-640» (Япония») исследовали в крови уровни креатинина, иммуноглобулинов (Ig) A, G, M, ревматоидного фактора (RF), фибриногена (FG), С-реактивного протеина (CRP), циркулирующих иммунных комплексов (CIC).
У 24 больных (15 мужчин и 9 женщин) в возрасте 27,5±2,19 года, длительностью болезни — 10,2±1,77 года и с І–ІІ стадией хронической болезни почек выполнены нефробиопсия и биопсия кожи. Для получения тканей использовали методику «True-Cut» («настоящего среза») с применением высокоскоростного пистолета «Biopty-Bard». Гистологические срезы почек окрашивали гематоксилином-эозином, альциановым синим (на гликопротеиды) и по ван Гизону (коллагеновые и эластические волокна), ставили PAS-реакцию. Кроме того, проводили иммуноферментный (с пероксидазной меткой) и иммунофлюоресцентный методы исследования тканей почек. Изучали отложения IgA, IgG, IgM, C3- и Cq1-компонентов комплемента. Микроскопическое исследование осуществляли на микроскопах «Olympus-AX40» и «Olympus-AX70-Provis» с цифровой видеокамерой «Olympus-DP50». Поражение отдельных почечных структур (клубочков, канальцев, стромы, сосудов) оценивали в баллах (от 0 до 3). При этом подсчитывали средний показатель повреждений (ID) по формуле: ![]() где «а», «b», «c» — число больных соответствено с 1, 2 и 3 баллами, а «d» — число больных с отсутствием данного признака.
где «а», «b», «c» — число больных соответствено с 1, 2 и 3 баллами, а «d» — число больных с отсутствием данного признака.
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного, непараметрического, корреляционного, регрессионного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы «Microsoft Excel» и «Statistica-Stat-Soft», США). Определяли средние значения, их стандартные ошибки и отклонения, коэффициенты параметрической корреляции Пирсона и непараметрической Кендалла, критерии дисперсии Брауна — Форсайта, множественной регрессии, Стьюдента, Уилкоксона — Рао, Макнемара — Фишера и достоверность статистических показателей.
Результаты
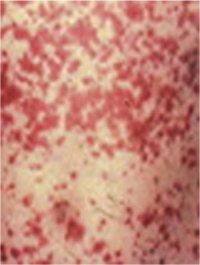
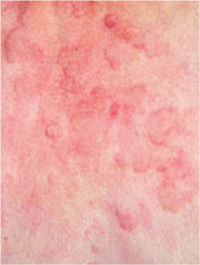
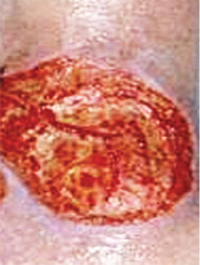
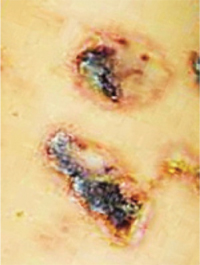
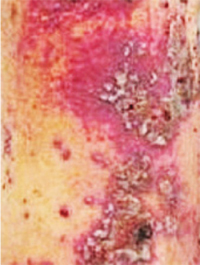
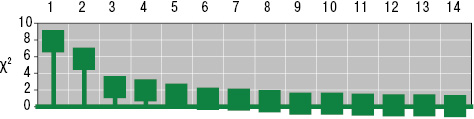
Геморрагический вариант кожного синдрома отмечали в 28,8% случаев ГВ, папуло-нодулярный — в 20,3%, уртикарный — в 18,7%, папуло-некротический — в 8,5%, некротически-язвенный — в 7,6%, полиморфный — в 5,9%, пустулезно-язвенный и узловато-язвенный — соответственно в 5,1% (рис. 1). В целом во 2-й группе больных поражение кожи выявлено достоверно чаще (на 48%). Если для 1-й группы, по данным критерия Макнемара — Фишера, был характерен уртикарный тип кожного синдрома, то для 2-й — некротически-язвенный, которые установлены соответственно в 4,4 и 6 раз чаще. ID сосудов кожи у больных ГВ составил 8,2±0,72 балла и прямо коррелировал с показателем экстрадермального DSI.
 |
 |
| а | б |
 |
 |
 |
| в | г | д |
Лимфогистиоцитарная периваскулярная инфильтрация выявлена во всех случаях биоптатов кожи, утолщение стенок сосудов — в 95,2%, пролиферация эндотелия — в 85,7%, нейтрофильная периваскулярная инфильтрация и фибриноидное набухание сосудистой стенки — соответственно в 71,4%, лимфогистиоцитарная инфильтрация сосудистой стенки — в 66,7%, пролиферация интимы — в 61,9%, экстравазация эритроцитов — в 57,2%, тромбозирование сосудов — в 47,6%, нейтрофильная инфильтрация сосудистой стенки — в 42,9%, фибриноидный некроз — в 38,1%, гигантоклеточная инфильтрация и депозиция FG — в 28,6%, эозинофильная инфильтрация — в 19,1% (рис. 2, 3). У больных 2-й группы наблюдали более частые (в 4,7 раза) инфильтрацию сосудистой стенки полиморфноядерными лейкоцитами и в 3,1 раза — тромбозирование сосудов, что показал анализ Макнемара — Фишера. Как свидетельствует анализ Брауна — Форсайта, возраст больных ГВ в дебюте заболевания влиял на параметры ID.
У детей вдвое чаще отмечали изменения плечезапястных костных сочленений, в 2,5 раза — коленных и на 35% — голеностопных. Отмечено, что для ювенильного ГВ нехарактерны вовлечения в процесс верхнечелюстных суставов, грудино-ключичных, межфаланговых кистей и стоп, пястнофаланговых, плечевых, тазобедренных, крестцовоподвздошных и позвонковых. Формирование отдельных рентгеносонографических проявлений суставного синдрома у взрослых пациентов в процессе трансформации болезни из ювенильного ГВ сопровождалось развитием субхондрального склероза в 29,3% случаев, тендовагинита и остеокистоза — соответственно в 26,8%, лигаментоза коленных суставов — в 24,4%, эпифизарного остеопороза — в 22,0%, энтезопатии — в 14,6%, изменений рогов менисков коленных суставов и появлением интраартикулярных жировых тел Гоффа — в 9,8%, кальциевых тел Штайди — в 7,3%, асептического остеонекроза и внутрисуставных хондромных тел — в 2,4%.
Поражение почек сопровождалось более редкой частотой изменений скелетных мышц и суставов (соответственно на 33%). Вместе с тем DSI экстраренальной патологии при наличии нефропатии был существенно выше, составляя 3,4±0,15 и 2,6±0,20 о.е. При наличии ГГН средние значения GF составили 102,7±2,68 мл/мин, а ID — 0,83±0,096 о.е. В случаях почечной патологии артериальная гипертензия зарегистрирована в 3,5 раза чаще, что указывает на ее ренальный генез. Показатели среднего артериального давления при ГГН были достоверно (на 8%) выше, чем у остальных пациентов, а периферического сосудистого сопротивления — на 11%. Нефротический синдром установлен у 5 больных (у 4,1% пациентов с ГГН), а соотношение II, III, IV и V стадий хронической болезни почек составило 10:5:1:1. На показатель PNI оказывали воздействие возраст больных в дебюте ГВ, степень активности заболевания, поражение кожи и желудочно-кишечного тракта.
Утолщение и расщепление капиллярных петель клубочков выявлено во всех случаях ГГН, пролиферацию эндотелия сосудов — в 54,2%, фибриноидное набухание их стенки, эластофиброз и лимфогистиоцитарную инфильтрацию — соответственно в 50,0%, инфильтрацию капилляров полиморфноядерными лейкоцитами и гиалиноз артериол — в 45,8%, плазматическое пропитывание почечных сосудов — в 37,5%, пролиферацию капиллярных эндотелиоцитов и периваскулярный склероз — в 33,3%, склероз сосудистых стенок — в 29,2%, их фибриноидный некроз и дисмукоидоз — в 20,5% случаев. Больные 1-й и 2-й групп совершенно не отличались между собой по частоте поражения почек, тогда как нефротический синдром и хроническая болезнь почек V стадии имели место только в случаях начала заболевания во взрослом возрасте. Артериальная гипертензия зарегистрирована в 1-й группе в 1,6 раза реже, а снижение GF — в 2,4 раза. Уровни PNI, среднего давления и сосудистого сопротивления у пациентов с трансформацией ГВ из ювенильного оказались достоверно меньшими на 64; 5 и 14%, а величина GF — на 20% большей.
Обсуждение
Как известно, у всех пациентов с ГВ в детском возрасте заболевание дебютирует пальпируемой пурпурой (Gaskill N. et al., 2016), а при первом рецидиве болезни кожные высыпания наблюдаются уже лишь в 90% случаев (Albaramki J., 2016; Calvo-Río V. et al., 2016). Диагностическая значимость при ГВ придается уртикарной и геморрагической сыпи, локализованной преимущественно на ногах и ягодице (Dalpiaz A. et al., 2015), тогда как варианты изменений кожи при ГВ во взрослом возрасте весьма разнообразны и часто совершенно неспецифичны (Duan X. et al., 2016; Hooper J.E. et al., 2016), в том числе в виде петехий, макулопапулезных высыпаний с буллами, язвами и сетчатым ливедо (Einhorn J., Levis J.T., 2015). Ощутимая пурпура, папулы и петехии констатируются соответственно в 70–75, 30–35 и 25–30% случаев ГВ (Yong A.M. et al., 2015).
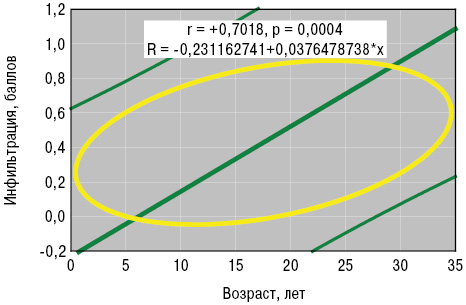
По данным выполненного нами анализа Уилкоксона — Рао, интегральные форма и вариант патологии кожи зависели от возраста больных в дебюте заболевания, степени активности процесса и поражения поджелудочной железы. Возраст больных в дебюте ГВ оказывал достоверное влияние на формирование в сосудах депозитов FG. Непараметрический анализ Кендалла и параметрический Пирсона (рис. 4, 5) установил прямые корреляционные связи возраста пациентов в начале заболевания со степенью нейтрофильной инфильтрации стенок сосудов и экстравазации эритроцитов.
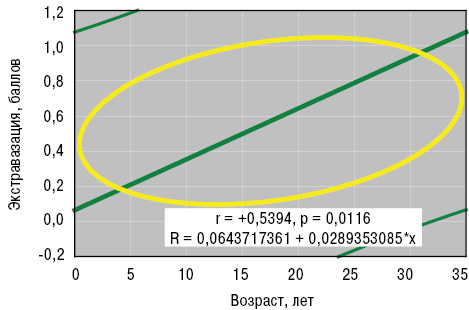
Артрит или артралгию диагностируют у 90% пациентов с ГВ в дебюте заболевания (Gaskill N. et al., 2016). Суставной синдром даже входит в диагностические критерии этого заболевания (Modi S. et al., 2016). Поражение суставов (обычно коленных, голеностопных, лучезапястных) чаще развивается у взрослых пациентов и сочетается с миалгией, а характер артрита после трансформации ГВ из ювенильного остается неизученным (Albaramki J., 2016; Mooij C.F. et al., 2016). Во взрослом возрасте суставная патология иногда носит вид мигрирующего интермиттирующего полиартрита, но эти сведения требуют уточнения (Sheth K. et al., 2015).
По данным корреляционного анализа Кендалла, с переходом больных детей во взрослый возраст с продолжительностью ГВ прямо соотносится частота изменений лучезапястных суставов, межфаланговых стоп, крестцово-подвздошных и позвонковых сочленений, развитие тендовагинита, энтезопатии, эпифизарного остеопороза и рогов коленных менисков. Помимо сказанного, связь с длительностью болезни изменений менисков показал и дисперсионный анализ Брауна — Форсайта. Следовательно, взрослый возраст является фактором риска возникновения менисцита у больных ГВ.
Нефропатию диагностируют у 30–60% больных ГВ (Aggarwal R. et al., 2016; Albaramki J., 2016), реже — у детей (Zhao Y.L. et al., 2015). Так называемый ГГН возникает у каждого четвертого больного уже в дебюте ГВ (Lardhi A.A., 2012) и с такой же частотой наблюдается при первом рецидиве заболевания (Albaramki J., 2016; Calvo-Río V. et al., 2016). Необходимо отметить, что за последние годы существенно возросла доля больных с такой формой гломерулярной патологии (Yin X.L. et al., 2013; Fidan K. et al., 2016). Поражение почек у пациентов с ГВ может протекать в виде минимальной протеинурии и гематурии (значительно чаще), нефротического синдрома и клинической картины злокачественного нефрита с быстропрогрессирующей почечной недостаточностью (Hahn D. et al., 2015; Park C.H. et al., 2016; Vogt B., 2016). В Китае среди детей с хронической болезнью почек на долю ГГН приходится 10%, а среди взрослых — 18% случаев (Guo Y.N. et al., 2013). Согласно результатам выполненных нефробиопсий у более чем 1500 детей, ГГН оказался самым частым вариантом вторичного гломерулонефрита (Yin X.L. et al., 2013).
На развитие ГГН у обследованных нами больных оказывала воздействие тяжесть мышечного синдрома. В свою очередь, ГГН влиял на развитие изменений межфаланговых суставов стоп и лигаментоза коленных сочленений, которые в случаях нефропатии отмечались чаще, что подтверждает анализ Макнемара — Фишера. По результатам анализа Кендалла, существуют прямые корреляции почечной патологии с поражением верхнечелюстных суставов, а также суставов пальцев стоп, формированием лигаментоза и тендовагинита. С учетом представленных данных сделано заключение, что при ГВ артрит межфаланговых сочленений пальцев ног и лигаментоз являются факторами риска развития ГГН.
Результаты дисперсионного анализа Брауна — Форсайта свидетельствуют о влиянии длительности ГГН на формирование фибриноидного некроза, гиалиноза, эластофиброза и лимфогистиоцитарной инфильтрации сосудистой стенки. Kорреляционный анализ Кендалла продемонстрировал прямую связь с последним морфологическим признаком почечной патологии. Считаем, что прогрессирование ГГН у взрослых пациентов прежде всего связано с усилением мононуклеарной клеточной инфильтрации артериол и стромы почек.
IV и V классы ГГН отмечали только у пациентов с началом ГВ во взрослом возрасте, а VI — исключительно в детском. От возраста в дебюте заболевания существовала дисперсионная зависимость Брауна —Форсайта тяжести поражения почечных канальцев, а с выраженностью сосудистых изменений имела место прямая корреляционная связь Пирсона. Если у больных 1-й группы ID сосудов, клубочков, стромы и канальцев соответственно составил 0,62±0,075; 0,96±0,061; 0,76±0,062 и 0,60±0,076 о.е., то в контрольной группе интегральные гломерулярные повреждения были достоверно бóльшими на 25%, а интерстициальные — на 30%. У пациентов 2-й группы в 2,3 раза чаще отмечали лимфогистиоцитарную инфильтрацию сосудов, а морфологическая картина ГГН напоминала первичный мезангиопролиферативный гломерулонефрит с тубулоинтерстициальным компонентом. Возраст начала болезни влиял на отложения в клубочках IgM, а в сосудах — IgA, IgG и IgM. При этом существовали прямые корреляции возраста больных в дебюте ГВ с гломерулярной депозицией IgA и сосудистой IgG.
Следует подчеркнуть, что ГВ является васкулитом с доминирующей депозицией IgA в капиллярах и артериолах кожи (Paydary K. et al., 2015; Cao Z. et al., 2016) и в почечных клубочках (Bernardino V. et al., 2015). При этом одновременная депозиция IgA в коже и тканях почек в большей степени характерна для взрослых больных ГВ (Sheth K. et al., 2015), именно у которых также определяют отложения IgG, IgM и C3 (Mysorekar V.V. et al., 2015).
Показатели системы иммунитета, эндотелиальной функции сосудов и реологии крови у больных ГВ представлены на рис. 6–8. Следует подчеркнуть, что вследствие иммунных воспалительно-некротических изменений в стенках сосудов возникают нарушения средней скорости кровотока, которые во многом определяются эндотелиальной дисфункцией сосудов (Macconi D. et al., 2013) и что в результате приводит к тромбозированию сосудов (Tatlican S. et al., 2010). С вазоконстрикторными процессами функции эндотелия при ГВ тесно взаимосвязана высокая объемная вязкость сыворотки крови, еще больше ухудшающая реологию крови (Baskurt O.K., 2011; Finke C. et al., 2011). Такие параметры межфазной активности крови, как SV и ST, влияют на состояние жесткости сосудистой стенки и периферическое сосудистое сопротивление (Martin E.M. et al., 2010; Lee J., Smith N., 2011), а VE — на состояние эндотелиального сосудистого гликокаликса (Nijenhuis Н.N. et al., 2009).
Как в 1-й, так и во 2-й группе больных только показатели SE не отличались от аналогичных у здоровых, а значения ET1, TxA2 и HCys представлены на рис. 9. Если уровень ЕТ1 в случаях дебюта болезни в детском возрасте составил 6,7±0,15 пг/мл, ТхА2 — 22,7±1,13 нг/мл, HCys — 15,5±0,65 мкмоль/л, PgI2 — 35,9±1,39 нг/мл, cGMP — 14,0±0,42 пкмоль/мл, SV — 12,8±0,28 мН/м, SE — 42,4±0,85 мН/м, ST — 45,4±0,85 мН/м, SR — 102,0±2,64 с, VE — 19,4±0,42 мН/м, то во 2-й группе оказались достоверно большими (на 17%) параметры ТхА2, на 10% — сGMP и на 8% — SV при снижении значений эндотелинемии на 6%. На рис. 10 отражены различия трехмерных гистограмм интегральных показателей вязкоэластичных свойств крови у здоровых лиц и больных ГВ с разным возрастным дебютом заболевания.
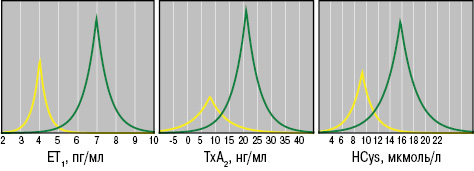
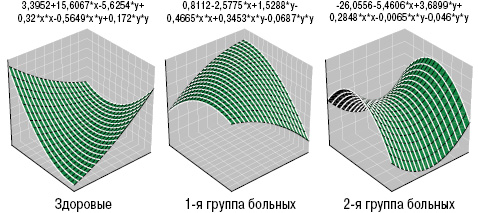
Выводы
1. ГВ чаще развивается в детском возрасте, а в случаях перехода в хроническую форму взрослых заболевание нередко приобретает прогрессирующее течение.
2. В процессе эволюции ювенильного ГВ становятся более редкими кожная, кожно-суставно-абдоминальная и кожно-абдоминально-почечная формы заболевания, поражение лучезапястных, голеностопных и коленных суставов, но учащаются почечный вариант патологического процесса, развивается хроническая болезнь почек, возникают сакроилеит, спондилопатия, тендовагинит, энтезопатия, эпифизарный остеопороз.
3. Заболеванию, трансформированному из ювенильного ГВ, свойственна у взрослых уртикарная форма кожного синдрома и несвойственна некротически-язвенная с инфильтрацией кожи полиморфноядерными лейкоцитами и развитием вазотромбоза, артропатия протекает более тяжело с присоединением дополнительных клинических, рентгенологических и сонографических признаков, формируются IV и V морфологические классы ГГН с тубулоинтерстициальным компонентом во всех случаях. 4. Возрастной диморфизм в начале ГВ проявляется более низкими уровнями FG, CIC, RF и ET1 в сыворотке крови, но более высокими концентрациями TxA2, cGMP и параметра SV, частотой эозинофильной инфильтрации и фибриноидного некроза сосудов кожи, экстравазацией эритроцитов и депозицией FG.
Список использованной литературы
- 1. Aggarwal R., Gupta A., Naru J. et al. (2016) HLA-DRB1 in Henoch-Schönlein purpura: A susceptibility study from North India. Hum. Immunol., 77(7): 555–558.
- 2. Albaramki J. (2016) Henoch-Schonlein purpura in childhood a fifteen-year experience at a tertiary hospital. J. Med. Liban., 64(1): 13–17.
- 3. Barut K., Sahin S., Kasapcopur O. (2016) Pediatric vasculitis. Curr. Opin Rheumatol., 28(1): 29–38.
- 4. Baskurt O.K. (2011) In vivo correlates of altered blood rheology. Biorheology, 45(6): 629–638.
- 5. Bernardino V., Mendes-Bastos P., Rodrigues A., Riso N. (2015) IgA vasculitis (formerly Henoch-Schönlein purpura) in an adult with systemic lupus erythematosus. BMJ Case. Rep., 9(9): 210121.
- 6. Calvo-Río V., Hernández J.L., Ortiz-Sanjuán F. (2016) Relapses in patients with Henoch-Schönlein purpura: Analysis of 417 patients from a single center. Medicine, 95(28): 4217.
- 7. Cao Z., Dahal R.A., Wang P., Petersen J.R. (2016) Skin rash and microscopic hematuria in a 10-year-old caucasian male. Lab. Med., 47(2): 158–162.
- 8. Carman M., Forsman J. (2016) Henoch-Schönlein purpura in the ED. Am. J. Nurs., 116(5): 57–60.
- 9. Dalpiaz A., Schwamb R., Miao Y. et al. (2015) Urological manifestations of Henoch-Schonlein purpura: A review. Curr. Urol., 8(2): 66–73.
- 10. Duan X., Yu D., Yu C., Wang B. (2016) Henoch-Schönlein purpura following high-voltage electric burn injury: A case report and review of the literature. Exp. Ther. Med., 11(2): 540–542.
- 11. Einhorn J., Levis J.T. (2015) Dermatologic diagnosis: leukocytoclastic vasculitis. Perm. J., 19(3): 77–78.
- 12. Elfving P., Marjoniemi O., Niinisalo H. et al. (2016) Estimating the incidence of connective tissue diseases and vasculitides in a defined population in Northern Savo area in 2010. Rheumatol. Int., 36(7): 917–924.
- 13. Fidan K., Isik Gonul I., Büyükkaragöz B. et al. (2016) Changing trends in pediatric renal biopsies: analysis of pediatric renal biopsies in national nephrology registry data. Ren. Fail., 38(8): 1228–1233.
- 14. Finke C., Schroeter J., Kalus U., Ploner C.J. (2011) Plasma viscosity in giant cell arteritis. Eur. Neurol., 66(3): 159–164.
- 15. Gaskill N., Guido B., Mago C. (2016) Recurrent adult onset Henoch-Schonlein purpura: a case report. Dermatol. Online J., 22(8): 163–169.
- 16. Guo Y.N., Wang Z., Lu J. (2013) The relationship between children kidney diseases and adult ESRD — an epidemiological investigation of 700 cases. Ren Fail., 35(10): 1353–1357.
- 17. Gur G., Cakar N., Kiremitci S. (2016) Preschool education impact on child development. Arch. Argent. Pediatr., 114(5): 366–369.
- 18. Hahn D., Hodson E.M., Willis N.S., Craig J.C. (2015) Interventions for preventing and treating kidney disease in Henoch-Schönlein Purpura (HSP). Cochrane Database Syst. Rev., 7(8): 005128.
- 19. Hooper J.E., Lee C., Hindley D. (2016) Case report: bullous Henoch-Schönlein purpura. Arch. Dis. Child., 101(2): 124–134.
- 20. Jelusić M., Kostić L., Frković M. (2015) Vasculitides in childhood: a retrospective study in a period from 2002 to 2012 at the department of paediatrics, university hospital centre Zagreb. Reumatizam, 62(2): 6–10.
- 21. Khanna G., Sargar K., Baszis K.W. (2015) Pediatric vasculitis: recognizing multisystemic manifestations at body imaging. Radiographics, 35(3): 849–865.
- 22. Lardhi A.A. (2012) Henoch-Schonlein purpura in children from the eastern province of Saudi Arabia. Saudi Med. J., 33(9): 973–978.
- 23. Lee J., Smith N. (2011) Development and application of a one-dimensional blood flow model for microvascular networks. Proc. Inst. Mech. Eng. H, 222(4): 487–511.
- 24. Macconi D., Zanoli A.F., Orisio S. (2013) Methylprednisolone normalizes superoxide anion production by polymorphs from patients with ANCA-positive vasculitides. Kidney Int., 44(1): 215–220.
- 25. Mao Y., Yin L., Xia H. (2016) Incidence and clinical features of paediatric vasculitis in Eastern China: 14-year retrospective study, 1999-2013. J. Int. Med. Res., 44(3): 710–717.
- 26. Martin E.M., Duck F.A., Ellis R.E., Winlove C.P. (2010) Ultrasound-induced contraction of the carotid artery in vitro. Ultrasound. Med. Biol., 36(1): 166–172.
- 27. Modi S., Mohan M., Jennings A. (2016) Acute scrotal swelling in Henoch-Schonlein purpura: Case report and review of the literature. Urol. Case Rep., 21(6): 9–11.
- 28. Mooij C.F., Hermsen R., Hoppenreijs E.P. et al. (2016) Fludeoxyglucose positron emission tomography-computed tomography scan showing polyarthritis in a patient with an atypical presentation of Henoch-Schönlein vasculitis without clinical signs of arthritis: a case report. J. Med. Case Rep., 10(1): 159–169.
- 29. Mysorekar V.V., Sumathy T.K., Shyam Prasad A.L. (2015) Role of direct immunofluorescence in dermatological disorders. Indian Dermatol. Online J., 6(3): 172–180.
- 30. Nijenhuis H.L., de Leeuw K., Smit A.J. et al. (2009) Enhanced endothelium-dependent microvascular responses in patients with Wegener’s granulomatosis. J. Rheumatol., 34(9): 1875–1881.
- 31. Park C.H., Han D.S., Jeong J.Y. et al. (2016) The optimal cut-off value of neutrophil-to-lymphocyte ratio for predicting prognosis in adult patients with Henoch-Schönlein purpura. PLoS One, 11(4): 0153238.
- 32. Paydary K., Emamzadeh Fard S., Mahboubi A.H. et al. (2015) Penile skin involvement as the first presentation of Henoch-Schonlein purpura report of nine cases and review of literature. Iran J. Pediatr., 25(4): 2177.
- 33. Sheth K., Bockorny M., Elaba Z., Scola C. (2015) Adult onset Henoch-Schönlein purpura: case report and review of literature. Conn. Med., 79(2): 81–85.
- 34. Tatlican S., Duran F.S., Eren C. et al. (2010) Reduced erythrocyte deformability in active and untreated Behçet’s disease patients. Int. J. Dermatol., 49(2): 167–171.
- 35. Vogt B. (2016) Nephrology update: glomerular disease in children. FP Essent., 444(5): 30–40.
- 36. Yin X.L., Zou M.S., Zhang Y. (2013) Twenty three-year review of disease patterns from renal biopsies: an experience from a pediatric renal center. J. Nephrol., 26(4): 699–707.
- 37. Yong A.M., Lee S.X., Tay Y.K. (2015) The profile of adult onset Henoch-Schönlein purpura in an Asian population. Int. J. Dermatol., 54(11): 1236–1241.
- 38. Zhao Y.L., Liu Z.J., Bai X.M. (2015) Obesity increases the risk of renal involvement in children with Henoch-Schönlein purpura. Eur. J. Pediatr., 174(10): 1357–1363.
Адрес для переписки:
Синяченко Олег Владимирович Украина,
84404, Донецкая обл., Лиман, ул. Привокзальная, 27
Донецкий национальный медицинский университет
Е-mail:synyachenko@ukr.net

Leave a comment