Діагностичне і прогностичне значення антицитрулінованих антитіл у ревматології
Резюме. У статті узагальнені останні відомості щодо діагностичної ролі антицитрулінованих білків у розвитку ревматичних захворювань, зокрема ревматоїдного артриту. Антитіла до цитрулінованих білків постають важливими й ранніми лабораторними показниками в діагностиці ревматоїдного артриту і перевищують за специфічністю і чутливістю ревматоїдний фактор-IgM. Антитіла до циклічного цитрулінованого пептиду і циклічного модифікованого віментину потужно корелюють з активністю ревматоїдного артриту, постають прогностичними чинниками швидкого прогресування і підходять для оцінки прогнозу захворювання на ранніх стадіях. Оскільки специфічність комбінації цих аутоантитіл наближається до 100%, їх одночасне визначення є особливо корисним у пацієнтів із недиференційованим артритом.
Ревматоїдний артрит (РА) належить до захворювань, що зумовлюють ранню втрату працездатності та зниження тривалості життя. Перспективи покращення прогнозу у хворих на РА безпосередньо пов’язані з вчасним початком адекватної базисної терапії на ранньому, додеструктивному етапі захворювання, мінімальна тривалість якого становить близько 3 міс. Добре відомо, що впродовж перших 5 років хвороби більше 40% пацієнтів стають інвалідами [9], крім того, численні автори зазначають, що РА знижує тривалість життя в середньому на 10 років [22]. Підвищення смертності зумовлено наростанням частоти супутніх захворювань (інфекції, атеросклероз, ураження серцево-судинної системи і нирок, остеопоротичні переломи тощо), розвиток яких патогенетично пов’язаний із погано/недостатньо контрольованим ревматоїдним запаленням і дефектами імунітету.
Відомі дані, імунопатологічний процес із субклінічним перебігом розвивається задовго до появи очевидних (клінічно окреслених) ознак хвороби. Дійсно, за даними біопсії синовіальної оболонки суглобів, ознаки синовіту виявляють вже на самому початку захворювання, навіть у клінічно неуражених суглобах. У ⅔ пацієнтів структурні зміни (ерозії) суглобів виявляються впродовж перших 2 років з моменту дебюту РА [3, 9]. Вже на самому початку захворювання «внесок» структурних ушкоджень у показник «втрата працездатності» є надзвичайно значущим (≈25%) і в подальшому з часом неухильно зростає. Доведено, що запобігання структурним пошкодженням на ранніх стадіях недуги сприяє збереженню функціональної активності пацієнтів у довготривалій перспективі. Однак період, упродовж якого навіть надактивна протизапальна терапія здатна дієво загальмувати ураження суглобів, вельми короткий та іноді становить усього декілька місяців від початку захворювання [5, 7, 39]. Ці положення свідчать, що РА постає яскравим прикладом захворювань, при яких віддалений прогноз багато в чому залежить від того, наскільки рано вдається встановити правильний діагноз і розпочати активну фармакотерапію. У цьому плані РА певною мірою нагадує інші хронічні захворювання, наприклад такі, як артеріальна гіпертензія та цукровий діабет [34]. Однак між цими захворюваннями є і суттєві відмінності. Якщо рання діагностика артеріальної гіпертензії і цукрового діабету здебільшого не становить труднощів, оскільки ґрунтується на оцінці добре відомих клінічних проявів і використання доступних (навіть рутинних) інструментальних і лабораторних методів, то діагностика РА в дебюті захворювання становить суттєвіше складніше завдання, іноді надто складне для розв’язання.
Добре відомо, що оцінка лабораторних показників запалення — швидкість осідання еритроцитів (ШОЕ), С-реактивний білок (СРБ), диспротеїнемія — має другорядне значення в діагностичному процесі, і відсутність цих змін не має повинно перешкоджати встановленню раннього діагнозу РА. У перші місяці захворювання ці параметри не менше ніж у 50% пацієнтів можуть не виходити за межі норми. Набагато більше значення має виявлення у крові ревматоїдного фактора (РФ-IgM) в діагностичних титрах [10].
Саме РФ був першим різновидом аутоантитіл, виявлених при РА, що відкрив E. Waaler у 1940 р. Основною мішенню РФ є епітоп Gа, розміщений у Сγ2–Сγ3-районі важкого ланцюга молекули IgG. До РФ належать антитіла проти IgG, представлені основними класами імуноглобулінів IgG, IgМ і IgА. Хоч РФ може бути представлений будь-яким класом імуноглобулінів, але турбодиметричний та аглютинаційний тести переважно виявляють РФ-IgM. Точне визначення класу імуноглобулінів може бути виконане за допомогою методу імуноферментного аналізу [8]. У 1987 р. РФ був включений до класифікаційних критеріїв РА та залишається важливим діагностичним маркером і досі.
При класичному РА можна виявити РФ-IgM у 70–80% пацієнтів, що дозволяє поділяти РА на серопозитивні й серонегативні варіанти. Відомо також, що у пацієнтів, позитивних за РФ-IgM, гірший прогноз перебігу захворювання. Натомість відомі випадки сероконверсії із серонегативного у серопозитивний варіант. Однак у фенотипу РФ-IgM існує два істотних обмеження. По-перше, часте виявлення цього фактора поза зв’язком із РА, що зумовлює низьку специфічність цього тесту. Необхідно враховувати, що РФ-IgM виявляють у приблизно 5% здорових осіб, у 5–25% — осіб похилого віку, а також у багатьох пацієнтів із хронічними ревматичними захворюваннями: класичний РФ-IgM виявляють у 30–35% хворих із системним червоним вовчаком і системною склеродермією, у 20% — пацієнтів із дерматоміозитом, вузликовим поліартеріїтом і анкілозивним спондилоартритом, у 10–15% — із псоріатичним артритом і хворобою Рейтера [13]. Досить часто РФ-IgM виявляють при хронічному вірусному гепатиті, туберкульозі, сифілісі, саркоїдозі, ендокардиті, пухлинному процесі тощо. По-друге, РФ-IgM-фенотип не є стабільним, частота його виявлення суттєво залежить від тривалості захворювання: у перші 6 міс тільки у 15–43% пацієнтів із РА ідентифікується цей фактор, у подальшому можлива сероконверсія у 20–35% пацієнтів. Під впливом лікування можлива й зворотна трансформація у серонегативний варіант захворювання. Недостатня чутливість і специфічність РФ-IgM для ранньої діагностики РА призвела до пошуку нових більш ефективних маркерів захворювання. Саме це вважається пріоритетним напрямком прикладної молекулярної генетики та імунології в ревматології. Тому в останні роки виділено ряд аутоантитіл, які тісно корелюють із РА: антикератинові антитіла (АКА), антиперинуклеарний фактор (АПФ), антитіла до РА-33-антигену, антицитруліновані антитіла тощо [7].
У 1964 р. R.L. Nienhuis та E. Mandema [33] описали АПФ. Цей антиген представлений у кератогіалінових гранулах, що оточують ядро клітин слизової оболонки порожнини рота людини. У 1979 р. B. Young та співавтори [43] в сироватці хворих на РА виявили АКА, що визначалися методом непрямої імунофлуоресценції в клітинах стравоходу щурів. Пізніше G.A. Schellekens та співавтори, використовуючи метод імуноблотингу на клітинах епідермісу людини, незалежно один від одного встановили, що і АПФ, і АКА специфічно зв’язує філагрин, в якому головною антигенною детермінантою для цих антитіл є цитрулін [8, 37]. Серед аутоантитіл, що виявляють при РА, антифілагринові аутоантитіла (АФА) — дуже специфічні й поступово стали визнаним лабораторним тестом для його діагностики.
Антигеном цих антитіл є білок філагрин, який бере участь в агрегації цитокератинових філаментів у клітинах епітелію, що ороговівають, точніше його попередника — профілагрину. Профілагрин синтезується як фосфорильований поліпептид, що містить до 10 філагринових повторів. Білок зберігається у гранулах і піддається деімінуванню та обмеженому протеолізу при утворенні цитокератинового скелета епітеліоцита [3, 12].
Однак у клінічній практиці визначення АФА не набрало значного поширення. Непопулярність цих тестів у практичних лабораторіях зумовлена їх низькою чутливістю, а також використанням реакції непрямої імунофлюоресценції, доступній обмеженій кількості лабораторій. Частота виявлення АКА в сироватці крові хворих на РА, за даними різних авторів, становить близько 45% при серопозитивному і 30% — при серонегативному варіантах РА, при специфічності близько 90% [1].
Встановлено, що АКА розпізнають лише цитруліновані форми білка філагрину, що входить до складу кератину. У числі можливих індукторів утворення антитіл до цитрулінованих пептидів у механізмі розвитку РА розглядається цитрулінований пептид, який у великій кількості нагромаджується в запаленій синовіальній оболонці [26, 39]. Оскільки у хворих на РА виявлено декілька аутоантитіл, спрямованих проти білків, які містять цитрулін, реакція цитрулінування привернула підвищену увагу ревматологів.
Відкриття аутоантигенів, що містять цитрулін, властивих РА, стало однією з найважливіших подій у ревматології останнього часу в галузі серологічної діагностики [26]. Цитрулін не належить до стандартних амінокислот, що вбудовуються в білки при їх синтезі, він утворюється внаслідок послідовної модифікації аргініну. Процес цитрулінування відзначається при природних фізіологічних і патологічних процесах та відіграє свою роль у процесах диференціації та апоптозу [39].
Сьогодні до цитрулінвмісних білків відносять [12, 39] АПФ, АКА, АФА, антитіла до циклічного цитрулінованого пептиду (АЦЦП), антитіла до Sa-антигену/цитрулінованого віментину і антитіла до цитрулінованого фібриногену (рис. 1).
| АПФ — зв’язується з перинуклеарними гранулами в клітинах слизової оболонки порожнини рота людини | } | Розпізнає цитрулінований філагрин |
| АКА — зв’язується з кератинізованими епітеліальними клітинами стравоходу щурів | ||
| Анти-Sa — зв’язується з плацентарною тканиною та панусом при РА | } | Розпізнає цитрулінований віментин |
У багатьох білках синовіальної рідини виявляють аргінінові залишки. Тому цитрулінові пептиди мають посттрансляційно модифіковані залишки аргініну. Цитрулінування — процес, в якому формуються цитрулінвмісні білки. Ці реакції відбуваються за участю ферменту пептидил-аргінін деімінази (PAD). Вони супроводжують, передусім, процеси апоптозу і запалення. На сьогодні відомо чотири типи цього ферменту: PAD1 та PAD3 виявлені переважно в епідермісі та волосяних фолікулах, PAD2 — у клітинах м’язової, мозкової та гемопоетичної тканин, а PAD4 — у макрофагах та моноцитах [14]. Останні два ізотипи є найвірогіднішими кандидатами для активації цитрулінування синовіальних білків при РА. У фізіологічних умовах PAD2 та PAD4 неактивні. Цитрулінування синовіальних білків є активним процесом, що виникає під час запалення. Для активації процесів цитрулінування необхідне значне підвищення рівня внутрішньоклітинного кальцію, яке також відзначають і при апоптозі [2]. Фізіологічна роль цитрулінування, найбільш ймовірно, полягає у виконанні важливої функції щодо підготовки внутрішньоклітинних білків до деградації під час апоптозу, а також у регуляції транскрипції внаслідок цитрулінування гістонів [12]. У дослідженні C. Masson-Bessière та співавторів продемонстровано, що у запальній синовіальній тканині цитрулінові білки представлені віментином, α- та β-ланцюгами фібрину [29]. Сутність цитрулінування зводиться до втрати позитивного заряду на аргініні, що приводить до змін у третинній структурі білка. На підставі цих даних розроблено доступний для клінічної практики метод імуноферментного визначення антитіл до білків, що містять цитрулін, — похідним філагрину, в якому як антигенну субстанцію використовують синтетичний циклічний цитрулінований пептид (ЦЦП).
Можливий механізм участі АЦЦП у патогенезі РА схематично представлено на рис. 2. На сьогодні існування такого патофізіологічного зв’язку не викликає сумнівів [42]. Зв’язок між РА, специфічними АЦЦП та ревматоїдасоційованими генетичними факторами зображено на рис. 3. Під впливом зовнішніх факторів можливий поліморфізм PAD-генів, що призводить до накопичення PAD4 і збільшення цитрулінування білків. За наявності HLA-DR4 відбувається активне зв’язування і презентування цитрулінованих пептидів. Надмірна продукція цитокінів асоціюється з підвищенням синтезу АЦЦП. Їх зв’язування з Fcg-рецепторами на макрофагах зумовлює продукцію прозапальних цитокінів, властивих для РА.
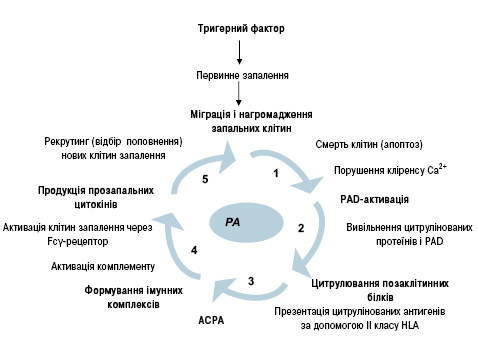
Відповідно до результатів одного з останніх досліджень, специфічність АЦЦП при діагностиці РА на ранніх стадіях становить 86%, комбінації АЦЦП + ШОЕ — 95%, АЦЦП + РФ-IgM — 91%, АЦЦП + СРБ — 97%, АЦЦП + поліартикулярний біль — 95%, АЦЦП + ранкова скутість — 99% [21]. При цьому на момент дослідження лише 27% пацієнтів відповідали діагностичним критеріям ACR’1987. Встановлено, що наявність цих антитіл є передвісником розвитку РА у здорових на момент обстеження осіб і прогресії недиференційованого артриту [32].
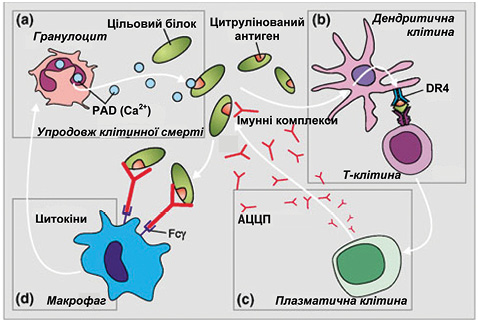
Також становлять інтерес дані про різну патогенетичну і прогностичну роль IgG-, IgA- та IgM-ізотипів АЦЦП при РА. Так, G. Lakos та співавтори [26], порівнявши ефективність, чутливість і специфічність визначення кожного з ізотопів, продемонстрували переваги визначення IgG-АЦЦП2, у тому числі для діагностики раннього РА. Зазначимо, що одночасне визначення двох або трьох ізотипів зумовило підвищення діагностичної специфічності щодо РА до 99,2%. За даними інших дослідників, IgM-АЦЦП2 може відображати активність аутоімунного процесу. Більше того, серед пацієнтів з одночасно підвищеними рівнями IgА-, IgM- та IgG-ізотипів АЦЦП через 7 років спостереження кількість осіб із високим рівнем IgA-АЦЦП значно зменшилася, тоді як кількість хворих із високими значеннями IgM-АЦЦП залишилася незмінною, що свідчить про тривалу активацію В-клітинної імунної відповіді [40].
У багатьох дослідженнях відзначено появу АЦЦП задовго до виявлення перших симптомів РА. Так, через 1 рік після спостереження пацієнтів із недиференційованим артритом достовірний РА розвинувся у 75% осіб, які були позитивними за АЦЦП, а ще через 3 роки — у 93% [38]. За даними інших дослідників, при недиференційованому артриті тривалістю <9,5 міс АЦЦП1- та АЦЦП2-позитивними на початку спостереження були 23% пацієнти. На момент встановлення діагнозу РА ці антитіла виявляли вже у 51% (АЦЦП2) та у 46% (АЦЦП1) обстежених [27]. При дослідженні сироватки крові здорових осіб, в яких у подальшому розвинувся РА, чутливість АЦЦП2 за 9 років до появи перших клінічних виявів захворювання становила 4%, а за 1,5 року — вже 25% при незмінно високій специфічності (98%) [35]. Безсумнівною є роль АЦЦП2 як предикативного маркера РА: відношення ризиків (ВР) розвитку РА у здорових осіб становило 15,9, а у хворих на недиференційований артрит — 37,8 [36]. При порівнянні чутливості та специфічності АЦЦП2 і «shared epitope» (SE) як предикторів розвитку РА вони становили 37 і 98% відповідно. При цьому АЦЦП2 виявляв більшу прогностичну значущість (ВР=15,9) порівняно зі SE (ВР=2,35) і РФ-IgA (ВР= 6,8) [15].
Важливо підкреслити, що АЦЦП не лише виявляють на ранніх стадіях РА, але й відмічають у хворих на РА зі швидким прогресуванням. Результати метааналізу джерел літератури демонструють, що АЦЦП є провісниками розвитку деструкцій приблизно у 80% пацієнтів з РА та в поєднанні з РФ становлять важливий інструмент для раннього розпізнавання і відокремлення пацієнтів із несприятливим прогнозом захворювання вже на етапі встановлення діагнозу [6]. У пацієнтів із високим рівнем АЦЦП, СРБ і РФ-IgM активність захворювання і кількість ерозій, за даними МРТ, у суглобах кистей були вірогідно вищими [5]. Комбіноване визначення АЦЦП і РФ-IgM є оптимальним для прогнозування характеру перебігу РА у групі пацієнтів із раннім недиференційованим синовітом [44].
Вважається, що в основі високої специфічності АЦЦП для РА лежить функціональний зв’язок між властивим для цього захворюванням гаплотипом HLA (зокрема HLA-DR4) і продукцією ACPA [42]. Комбінація генетичного статусу і позитивності за антигенами до цитрулінованих білків у конкретної особи вважається фактором високого ризику розвитку РА.
Виявлення РФ і АЦЦП у сироватці людей за декілька років до появи перших симптомів РА свідчить про змінений імунологічний статус цих пацієнтів. Ймовірно, генетична схильність (наприклад алелі системи HLA) і тригери (наприклад тривале тютюнопаління) здатні викликати імунопатологічні зрушення в організмі людини, тим самим детермінуючи розвиток РА [25]. Алелі HLA-DRB1*01 *0401, *0404, *0405, *0408, *10 і *1402 кодують схожу за будовою амінокислотну послідовність молекули Drb1 у позиції 67–74, що отримала назву «shared epitope» (загальний, схожий епітоп), і асоційовані з РА практично в усіх популяціях та етнічних групах.
Сьогодні активно обговорюється роль АЦЦП як предиктора розвитку більш вираженого ступеня суглобової деструкції та набагато тяжчої клінічної картини захворювання. При цьому доведено, що його прогностична цінність значно зростає при одночасному визначенні з SE HLA-DRB1*0101, *0104, *0404 [44]. За даними І.А. Гусєвої та співавторів (2009) [4], наявність HLA-DRB1*04 і АЦЦП у пацієнтів із РА постає несприятливим прогностичним фактором прогресуючої деструкції суглобів. Нагромаджені дані стали підґрунтям для гіпотези, що ACPA можуть відігравати важливу роль в етіології/патогенезі ревматоїдного процесу. Можливі аргументи на користь патогенетичної ролі цих антитіл охоплюють асоціацію цитрулінування з апоптозом клітин, появу АЦЦП задовго до появи перших клінічних симптомів РА, високу специфічність для РА та вірогідний генетичний фактор, який призводить до підвищеного цитрулінування, що асоціюється з РА [38].
Наявність АЦЦП на момент встановлення діагнозу віщує більш агресивний перебіг недуги і більш виражене рентгенологічне прогресування, незважаючи на лікування. Ані нестероїдні протизапальні препараті, ані глюкокортикоїди, ані більшість базисних хворобо-модифікуючих препаратів не впливають на рівень АЦЦП. Ймовірно, позитивні за АЦЦП пацієнти формують окрему клінічну і патофізіологічну групу, що потребує абсолютно нових підходів до курації. Водночас, за даними декількох досліджень, лікування інфліксимабом і етанерцептом — препаратами, що вибірково блокують біологічні ефекти фактора некрозу пухлин (ФНП)-α, — призводять до зниження рівня АЦЦП, що асоціюється зі зниженням активності ревматоїдного процесу [11, 18]. Однак в іншому дослідженні подібна дія інгібіторів ФНП-α не підтверджена [19]. Ще в одному нещодавньому дослідженні виявлено незначну позитивну динаміку АЦЦП під впливом 48-тижневого курсу лікування інфліксимабом, при цьому позитивна динаміка РФ-IgM була більш вираженою [17]. Різну відповідь при лікуванні адалімумабом відзначили й інші дослідники, підкресливши, що динаміка зниження РФ-IgM при 28-тижневому застосуванні адалімумабу асоціюється зі зниженням активності процесу, ШОЕ і СРБ, однак змін АЦЦП не встановлено [16]. Дослідники роблять висновок, що РФ-IgM є маркером активності запального процесу, а АЦЦП — якісно стабільною ознакою ревматоїдного процесу.
Таким чином, при обговоренні ролі цитрулінованих білків у ревматології підкреслюється їх важливе значення у діагностичному процесі — визначення титру АЦЦП вкрай дієве при ранній діагностиці РА, також його можна використовувати для планування тактики лікування, оскільки АЦЦП-позитивним пацієнтам властивий більш агресивний перебіг зі швидким ерозуванням суглобових поверхонь. Однак для контролю за ефективністю лікування цей тест не придатний, оскільки на фоні застосування більшості симптоматичних, базисних і біологічних препаратів не відбувається достовірного зниження рівня антитіл [5, 10].
До цитрулінованих антигенів синовіальних тканин відносять також цитрулінований віментин. Віментин є білком цитоскелета різних типів клітин, таких як клітини мезенхіми й ендотелію, фібробласти, хондроцити і остеоцити. Його застосовують як маркер пухлин м’яких тканин. Із 1994 р. віментин (раніше відомий як Sa-антиген) згадується у контексті РА. Цитрулінований віментин синтезується ендоплазматичним ретикулумом і комплексом Гольджі макрофагів під впливом прозапальних і протизапальних цитокінів у відповідь на запалення у хрящовій тканині суглобів і виявляється у синовіальній тканині пацієнтів з РА. Позитивно заряджена термінальна послідовність дозволяє віментину прямо зв’язуватися з фосфоліпідами мембрани ендоплазматичного ретикулума, а структура С-кінцевої послідовності — здійснювати транспорт з ендоплазматичного ретикулума безпосередньо до комплексу Гольджі. Цитрулінування віментину, що відбувається у процесі апоптозу клітин епітелію та синовіальної оболонки, супроводжується модифікацією власних білків організму у вигляді виявлення «прихованих» або формування нових епітопів, що призводить до зриву імунологічної толерантності та синтезу активованими В-клітинами аутоантитіл до нього.
На сьогодні відомо 5 білків, що підпадають під цитрулінування при патологічних процесах в організмі. Серед них лише віментин у найвищому ступені представлений у синовіальній оболонці та синовіальній рідині [23]. Його цитрулінування відображає ступінь апоптозу макрофагів. Тому визначення саме антитіл до модифікованого цитрулінованого віментину (АМЦВ або anti-MCV) є більш достовірним (до 98%) і специфічним тестом для РА.
На відміну від синтетичного білка ЦЦП, віментин є природним білком людини з розшифрованою структурою, виявленим у синовіальній тканині при РА. Тоді як ЦЦП має тільки 1 або 2 можливих для детекції епітопи, віментин має до 45 можливих доменів, здатних цитрулінуватися. Саме така значна кількість імунодомінантних епітопів забезпечує краще зв’язування аутоантитіл і вищу чутливість тест-системи.
Цитрулінований віментин виступає як антиатерогенний пептид, який з високою силою спорідненості вбудовується у зв’язуючі антигени комірки молекули HLA, переважно HLA-DRB1*04, що локалізований на поверхні макрофагів, активованих Т- і В-лімфоцитів, епітеліальних і ендотеліальних клітин, активованих γ-інтерфероном. За даними L. Innala та співавторів (2008) [24], визначально високий рівень АЦЦП1, АЦЦП2, АЦЦП3 і АМЦВ, а також носійство гена HLA-DRB1*04 асоціювалося з високою активністю РА, швидко прогресуючим перебігом захворювання в наступні 24 міс, вираженими деструктивними рентгенологічними змінами у 210 пацієнтів із РА.
Тест-системи для виявлення АМЦВ з’явилися на ринку в 2004 р. і виробниками була заявлена чутливість 85%, що трохи перевершує чутливість виявлення АЦЦП. Подальші дослідження різних груп хворих ревматичного профілю з використанням АМЦВ виявили, що ці антитіла наявні у 15–25% пацієнтів із системними захворюваннями, відзначають у 5–10% хворих на псоріатичний артрит, можливі у 20% осіб літнього віку без ознак РА. Таким чином, реальна специфічність при дослідженні змішаних популяцій для АМЦВ становить не більше 85–90%.
Компанія «ORGENTEC» (Німеччина) розробила тест-систему для визначення антитіл до цитрулінованого білка віментину (Anti-MCV ORG 548). Цитрулінування віментину ферментом PAD приводить до зміни структури білка і зростання можливих епітопів-мішеней аутоантитіл, пов’язаних із РА. Набір «ORGENTEC Anti-MCV ELISA» дозволяє визначати anti-MCV, завдяки чому досягається максимальна чутливість у діагностиці РА. «ORGENTEC» вибрав із багатьох модифікованих цитрулінованих форм віментину саме ті, на які пацієнти з РА дають максимально виражену відповідь продукцією антитіл. Для однієї з цих модифікованих цитрулінованих ізоформ доведено, що вона специфічна лише для РА [6, 36].
Підвищений титр anti-MCV є специфічним для РА. У зв’язку з цим в останні роки з’явилася велика кількість робіт щодо специфічності й чутливості відомих маркерів РА — АЦЦП, РФ-IgM, та маловивченого — АМЦВ [3]. Результати досліджень узагальнено в табл. 1.
| Дослідники, рік | АЦЦП | АМЦВ | ||
|---|---|---|---|---|
| Специфічність | Чутливість | Специфічність | Чутливість | |
| Bang H. et al., 2007 | 96 | 72 | 98 | 82 |
| Mathsson L. et al., 2008 | 96 | – | 95 | – |
| Wagner E. et al., 2009 | 97,6 | 69,4 | 81,3 | 71,5 |
| Sghiri R. et al., 2008 | 96,1 | 72,4 | 79 | 74,1 |
| Dejaco C. et al., 2006 | АЦЦП2 — 98,7 | АЦЦП2 — 70,1 | 90,8 | 69,5 |
| Ursum J. et al., 2008 | 92,1 | АЦЦП2 — 55,3 | 92,3 | 59,3 |
| Soös L. et al., 2007 | АЦЦП2 — 98,3 | 66,4 | 91,5 | 75,6 |
| Mutlu N. et al., 2009 | АЦЦП2 — 98,8 АЦЦП3 — 91,6 |
АЦЦП2 — 60,2 АЦЦП3 — 49,8 |
91,6 | 67,8 |
| P. Nicaise et al., 2008 | 94,2 | – | 90,9 | – |
На думку авторів, різниці в оцінках специфічності й чутливості можуть залежати від підбору хворих на РА, а також від вибраного рівня позитивності.
Різниця у виявленні специфічності АЦЦП і АМЦВ в одних і тих же пацієнтів з РА вказує на серологічну гетерогенність РА, а також різну патогенетичну участь цих молекул у розвитку і прогресуванні РА. Випадки виявлення АЦЦП і АМЦВ не завжди збігаються, а це означає, що у пацієнтів, негативних за АЦЦП, може бути позитивним тест на АМЦВ і навпаки. Різні цитруліновані білки можуть бути залучені в різні патофізіологічні процеси при РА, тому можуть бути корисними для прогнозування перебігу і стратифікації РА на підгрупи. Оскільки всі ревматологи налаштовані на якомога раннє виявлення РА, то застосування додаткових тестів (наприклад anti-MCV) є вкрай актуальним і доцільним, особливо у серонегативних пацієнтів за РФ і АЦЦП. Визначення АМЦВ у цих пацієнтів дозволить встановити високий ризик рентгенологічного прогресування. Водночас збільшувати кількість лабораторних аналізів у пацієнтів зі встановленим високим титром РФ-IgM і АЦЦП немає сенсу, оскільки це тільки підвищить вартість обстеження, однак нової додаткової інформації щодо прогнозування перебігу РА не надасть [28].
Однак визначення АМЦВ може виявитися корисним при оцінці ефективності лікування. Моноцити та їх тканинні форми — макрофаги — є антигенпрезентуючими клітинами і продукують прозапальні цитокіни — інтерлейкін (ІЛ)-1, ІЛ-6, ФНП-α. ІЛ-1 викликає проліферацію незрілих Т-лімфоцитів, дозрівання Т-лімфоцитів, що несуть рецептори, які розпізнають антиген, стимулюють вироблення Т-лімфоцитами ІЛ-2, -4, -7. У свою чергу, ІЛ-4 викликає проліферацію незрілих Т-лімфоцитів і їх диференціювання на Т-хелпери 2-го типу, що викликають проліферацію В-лімфоцитів і вироблення аутоантитіл плазматичними клітинами, зокрема до модифікованого цитрулінованого віментину. З урахуванням патогенезу утворення АМЦВ цей маркер можна використовувати для контролю ефективності лікування препаратами, спрямованими проти активованих Т-лімфоцитів і продукованих ними цитокінів. Так, у дослідженні P.R. Nicaise та співавторів (2008) [31] у 23 пацієнтів із РА концентрацію АЦЦП і АМЦВ визначали через 6; 12; 18; 24 міс від початку терапії інфліксимабом. Досягнуто зниження рівня АМЦВ через 18 і 24 міс від початку терапії інфліксимабом, водночас зниження рівня АЦЦП виявлено лише через 24 міс лікування.
У дослідженні L. Matrsson (2008) встановлено достовірний кореляційний зв’язок між модифікованим цитрулінованим віментином та клініко-лабораторними показниками активності запального процесу у хворих на РА, а також ослаблення цього зв’язку паралельно зі зниженням клініко-лабораторних показників активності при проведенні адекватної терапії. Водночас подібного взаємозв’язку й динаміки з боку ЦЦП не відзначали. На думку авторів, це зумовлено більш високою специфічністю і чутливістю цитрулінованого віментину [30].
Anti-MCV доведено корелює з ерозивним перебігом РА, тяжким пошкодженням суглобів, позасуглобовими проявами, а також раннім ураженням серцево-судинної системи. Вартий уваги також той факт, що АМЦВ корелює з активністю захворювання і стратифікацією ризику кардіоваскулярних ускладнень [20]. Основні діагностичні можливості головних маркерів РА підсумовані в табл. 2.
Незважаючи на значні досягнення в ревматології на зламі тисячоліть, проблема ранньої діагностики РА залишається надзвичайно актуальною, адже призначення базисної терапії на якомога ранньому етапі розвитку РА є запорукою успішного його лікування: уникнення деструкції хряща, анкілозів та ранніх деформацій у суглобах. Перспективним є широке впровадження у практичну медицину таких серологічних маркерів РА, як АЦЦП та АЦМВ, що дасть можливість верифікувати це захворювання на ранніх стадіях із високим ступенем точності [8].
| Показник | РФ-IgM | АЦЦП | Anti-MCV |
|---|---|---|---|
| Чутливість,% | 60 | 70–78 | 92 |
| Асоціація з екстрасуглобовою маніфестацією | + | + | + |
| Кореляція зі швидким рентгенологічним прогресуванням, ерозивним ураженням | + | + | + |
| Кореляція з активністю хвороби |
Лише РФ-IgA | – | + |
| Кореляція з відповіддю на лікування |
Лише РФ-IgM | – | + |
| Кореляція з кардіоваскулярними симптомами | – | – | + |
Узагальнюючи представлені дані, можна зробити висновки, що АЦЦП і АМЦВ постають важливими лабораторними показниками в діагностиці РА, які ні в чому не поступаються, а, на думку багатьох авторів, перевищують РФ-IgM за специфічністю і чутливістю. У зв’язку з тим, що специфічність комбінації цих аутоантитіл наближається до 100%, їх одночасне визначення особливо корисне у пацієнтів із недиференційованим артритом. АЦЦП і АМЦВ потужно корелюють з активністю РА, постають прогностичними факторами швидкого прогресування і підходять для оцінки прогнозу захворювання на ранніх стадіях. Сучасні дані щодо порівняльної специфічності АЦЦП і АМЦВ неоднозначні й суперечливі, що зумовлює необхідність подальшого вивчення. Родина цитрулінованих пептидів буде тільки розширюватися, тому зростає необхідність розроблення нових діагностичних стратегій після ретельної оцінки характеристик і кореляцій наявних аналізів.
Список використаної літератури
- 1. Беляева И.Б., Лапин С.В., Созина А.В. и др. (2007) Антитела к цитруллинсодержащим антигенам в диагностике и прогнозировании течения раннего ревматоидного артрита. Мед. иммунология, 9 (1): 7784.
- 2. Борткевич О.П., Білявська Ю.В. (2008) Клініко-діагностичне значення антитіл до циклічного цитрулінового пептиду у пацієнтів з різною тривалістю ревматоїдного артриту. Укр. ревматол. журн., 3: 58–64.
- 3. Гринь В.К., Гнилорыбов А.М., Хрещакова Т.П. (2004) Антицитруллиновые антитела и их роль в диагностике и клинике ревматоидного артрита. Журн. АМН України, 10 (3): 509–517.
- 4. Гусева И.А., Новиков А.А., Каратеев Д.Е. и др. (2009) HLA-DRB1*04, антитела к циклическим цитруллированным пептидам, РФ как факторы риска развития эрозивного процесса у больных ранним ревматоидным артритом через 1 год проспективного наблюдения. В кн.: Сб. матер. съезда ревматологов России, Москва, 35 с.
- 5. Каратеев Д.Е., Александрова Е.Н., Демидова Н.В. и др. (2008) Антицитруллиновые антитела и данные магнитно-резонансной томографии суставов кисти у больных ранним артритом. Терапевт. арх., 10: 71–77.
- 6. Лапин С.В., Маслянский А.Л., Мазуров В.И., Тотолян А.А. (2005) Сравнительные характеристики специфических аутоантител при ревматоидном артрите. Терапевт. арх., 77(12): 53–59.
- 7. Мурадянц А., Шостак Н., Логинова Т. и др. (2004) Ранний ревматоидный артрит: вопросы дифференциальной диагностики. Врачъ, 4: 37–39.
- 8. Нейко Є.М. (2010) Антитіла до циклічного цитрулінованого пепетиду та антитіла до модифікованого цитрулінованого віментину як сучасні діагностичні маркери раннього ревматоїдного артриту. Журн. АМН України, 16(1): 38–46.
- 9. Чичасова Н.В., Насонов Е.Л., Имметдинова Г.Р., Каневская М.З. (2007) Стратегия лечения раннего ревматоидного артрита. Клиницист, 2: 44–54.
- 10. Шилкина Н.П., Лузинова М.С., Виноградов А.А. (2011) Антицитруллиновые антитела — современные маркеры ревматоидного артрита. Терапевт. арх., 1: 70–75.
- 11. Alessandri C., Bombardieri M., Papa N. et al. (2004) Decrease of anti-cyclic citrullinated peptide antibodies and rheumatoid factor following anti-TNFalpha therapy (infliximab) in rheumatoid arthritis is associated with clinical improvement. Ann. Rheum. Dis., 63(10): 1218–1221.
- 12. Amri M., Sfar I., Ounallah H.S. et al. (2011) Anti-CCP antibodies, rheumatoid factors and anti-keratin antibodies: clinical value in established rheumatoid arthritis. Tunis Med., 89(3): 231–235.
- 13. Arnett F.C., Edworthy S., Bloch D.A. et al. (1988) The American rheumatism association 1987 revised criteria for the classification of rheumatoid arthritis. Arthritis Rheum., 31: 315–324.
- 14. Basu P.S., Majhi R., Ghosal S., Batabyal S.K. (2011) Peptidyl-arginine deiminase: an additional marker of rheumatoid arthritis. Clin. Lab., 57(11–12): 1021–1025.
- 15. Berglin E., Padyukov L., Sundin U. et al. (2004) A combination of autoantibodies to cyclic citrullinated peptide (CCP) and HLADRB1 locus antigens is strongly associated with future onset of rheumatoid arthritis. Arthritis Res. Ther., 6: 303–308.
- 16. Bos W.H., Bartelds G.M., Wolbink G.J. et al. (2008) Differential response of the rheumatoid factor and anticitrullinated protein antibodies during adalimumab treatment in patients with rheumatoid arthritis. J. Rheumatol., 35(10): 1972–1977.
- 17. Bruns A., Nicaise-Roland P., Hayem G. et al. (2009) Prospective cohort study of effects of infliximab on rheumatoid factor, anti-cyclic citrullinated peptide antibodies and antinuclear antibodies in patients with long-standing rheumatoid arthritis. Joint Bone Spine, 76(3): 248–253.
- 18. Chen H.A., Lin K.C., Chen C.H. et al. (2006) The effect of etanercept on anti-cyclic citrullinated peptide antibodies and rheumatoid factor in patients with rheumatoid arthritis. Ann. Rheum. Dis., 65(1): 35–39.
- 19. De Rycke L., Verhelst X., Kruithof E. et al. (2005) Rheumatoid factor, but not anti-cyclic citrullinated peptide antibodies, is modulated by infliximab treatment in rheumatoid arthritis. Ann. Rheum. Dis., 64(2): 299–302.
- 20. El-Barbary A.M., Kassem E.M., El-Sergany M.A. et al. (2011) Association of Anti-Modified Citrullinated Vimentin with Subclinical Atherosclerosis in Early Rheumatoid Arthritis Compared with Anti-Cyclic Citrullinated Peptide. J. Rheumatol., 138 (5): 828–834.
- 21. Gao I.K., Haas-Wohrle A., Mueller K.G. et al. (2005) Determination of anti-CCP antibodies in patients with suspected rheumatoid arthritis: does it help to predict the diagnosis before referral to a rheumatologist? Ann. Rheum. Dis., 64: 1516–1517.
- 22. Goodson N., Symmons D. (2002) Rheumatoid arthritis in women: still associated with an increased mortality. Ann. Rheum. Dis., 61: 955–956.
- 23. Hueber W., Hassfeld W., Smolen J.S., Steiner G. (1999) Sensitivity and specificity of anti-Sa autoantibodies for rheumatoid arthritis. Rheumatology, 38: 155–159.
- 24. Innala L., Kokkonen H., Eriksson C. et al. (2008) Antibodies against mutated citrullinated vimentin are a better predictor of disease activity at 24 months in early rheumatoid arthritis than antibodies against cyclic citrullinated peptides. Rheumatology, 35(6): 1002–1008.
- 25. Kallberg H., Padyukov L., Plenge R.M. (2007) Gene-gene and gene-environment interactions involving HLA-DRB1, PTPN22, and smoking in two subsets of rheumatoid arthritis. Am. J. Hum. Genet., 80: 867–875.
- 26. Lakos G., Soos L., Fekete A. et al. (2008) Anticiclic citrullinated peptide antibody isotypes in rheumatoid arthritis: association with disease duration, rheumatoid factor production and the presence of shared epitope. Ann. Rheum. Dis., 67(Suppl. II): 569.
- 27. Lоpez-Longo F., Rodriguez-Mahou M., Sanchez-Ramon S. et al. (2006) Anti-Cyclic Citrullinated Peptide versus Anti-Sa Antibodies in Diagnosis of Rheumatoid Arthritis in an Outpatient Clinic for Connective Tissue Disease and Spondyloarthritis. J. Rheumatol., 33: 1476–1481.
- 28. Luime J.J., Colin E.M., Hazes J.M., Lubberts E. (2010) Does anti-mutated citrullinated vimentin have additional value as a serological marker in the diagnostic and prognostic investigation of patients with rheumatoid arthritis? A systematic review. Ann. Rheum. Dis., 69 (2): 337–344.
- 29. Masson-Bessière C., Sebbag M., Girbal-Neuhauser E. et al. (2001) The major synovial targets of the rheumatoid arthritis-specific antifilaggrin autoantibodies are deiminated forms of the alpha- and beta-chains of fibrin. J. Immunol., 166(6): 4177–4184.
- 30. Mathsson L., Mullazehi M., Wick M.C. (2008) Antibodies Against Citrullinated Vimentin in Rheumatoid Arthritis. Arthritis Rheum., 58(1): 36–45.
- 31. Nicaise Roland P., Grootenboer Mignot S., Bruns A. et al. (2008) Antibodies to mutated citrullinated vimentin for diagnosing rheumatoid arthritis in anti-CCP-negative patients and for monitoring infliximab therapy. Arthritis Res. Ther., 10(6): 142.
- 32. Nielen M.M.J., van Schardenburg D., Reesink H.W. et al. (2004) Specific autoantibodies precede the symptoms of rheumatoid arthritis: a study of serial measurements in blood donors. Arthritis Rheum., 50: 380–386.
- 33. Nienhuis R.L., Mandema E. (1964) A new serum factor in patients with rheumatoid arthritis, the antiperinuclear factor. Ann. Rheum. Dis., 23: 302–305.
- 34. Pincus T., Gibofsky A., Weinblatt M.E. (2002) Urgent care and tight control of rheumatoid arthritis as in diabetes and hypertension: better treatment but shortage of rheumatology. Arthritis Rheum., 46: 851–854.
- 35. Rantapaa-Dahlqvist S., de Jong B., Berglin E. et al. (2003) Antibodies against cyclic citrullinated peptide and IgA rheumatoid factor predict the development of rheumatoid arthritis. Arthritis Rheum., 48: 2741–2749.
- 36. Riedemann J., Munoz S., Kavanaugh A. (2005) The use of second generation anti-CCP antibody (anti-CCP2) testing in rheumatoid arthritis — a systematic review. Clin. Exp. Rheumatol., 2: 69–76.
- 37. Schellekens G.A., de Jong B.A., van den Hoogen F.H. et al. (1998) Citrulline is an essential constituent of antigenic determinants recognized by rheumatoid arthritis specific autoantibodies. J. Clin. Invest., 101: 273–281.
- 38. van Gaalen F.A., Linn-Rasker S.P., van Venrooij W.J. et al. (2004) Autoantibodies to cyclic citrullinated peptides predict progression to rheumatoid arthritis in patients with undifferentiated arthritis: a prospective cohort study. Arthritis Rheum., 50(3): 709–715.
- 39. van Venrooij W.J., van Beers J.B.C., Pruijn G.J.M. (2011) Anti-CCP antibodies: the past, the present and the future. Nat. Rev. Rheumatol., 7 (7): 391–398.
- 40. Verport K.R., Jol-van der Zijde C.M., Papendrecht-van der Voort E.A. et al. (2006) Isotype distribution of anti-ciclic citrullinated peptides antibodies in undifferentiated arthritis and rheumatoid arthritis reflects an ongoing immune response. Arthritis Rheum., 54: 3799–808.
- 41. Vossenaar E.R., Zendman A.J., van Venrooij W.J. (2004) Citrullination, a possible functional link between susceptibility genes and rheumatoid arthritis. Arthritis Res. Ther., 6(1): 1–5.
- 42. Vossenaar E.R., Robinson W.H. (2005) Citrullination and autoimmune diseases: 8-th Bertine Koperberg Meeting. Ann. Rheum. Dis., 65: 1513–1515.
- 43. Young B., Mallya R.K., Leslie R.D. et al. (1979) Antikeratin antibodies in rheumatois arthritis. Br. Med. J., 2: 97–99.
- 44. Zendman A., van Venrooij W., Pruijn G. (2006) Use and significance of anti-CCP autoantibodies in rheumatoid arthritis. Rheumatology, 45: 20–25.
ДИАГНОСТИЧЕСКОЕ И ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ АНТИЦИТРУЛЛИроваНнЫХ АНТИТЕЛ В РЕВМАТОЛОГИИ
Резюме. В статье обобщены последние сведения о диагностической роли антицитруллированных белков в развитии ревматических заболеваний, в частности ревматоидного артрита. Антитела к цитруллированным белкам являются важными и ранними лабораторными показателями в диагностике ревматоидного артрита и превышают по специфичности и чувствительности ревматоидный фактор-IgM. Антитела к циклическому цитруллированному пептиду и циклическому модифицированному виментину мощно коррелируют с активностью ревматоидного артрита, являются прогностическими факторами быстрого прогрессирования и подходят для оценки прогноза заболевания на ранних стадиях. Поскольку специфичность комбинации этих аутоантител приближается к 100%, их одновременное определение будет особенно полезным у пациентов с недифференцированным артритом.
антицитруллированные антитела, диагностика, ревматоидный артрит, ревматоидный фактор, антитела к циклическому цитруллированному пептиду, антитела к циклическому модифицированному виментину, недифференцированный артрит.
Адреса для листування:
Головач Ірина Юріївна
03680, Київ, вул. Академіка Заболотного, 21
Клінічна лікарня «Феофанія» ДУС,
відділення ревматології і внутрішньої патології
E-mail: golovachirina@yandex.ru

Leave a comment