КЛІНІКО-ПАТОГЕНЕТИЧНЕ ЗНАЧЕННЯ ЗМІН ПУРИНОВОГО ОБМІНУ ПРИ СУЧАСНОМУ ПЕРЕБІГУ ПОДАГРИ
Синяченко О.В., Брыжатая Ю.О., Якубенко Е.Д.
Резюме. Резюме. Мета і завдання дослідження — провести оцінку клініко-патогенетичної значущості змін пуринового обміну при різних формах перебігу подагричного артриту й нефропатії. Об’єкт і методи. Обстежено 89 хворих на первинну подагру; інтермітуючий варіант артриту встановлено в 63% спостережень, хронічний — у 37%, уролітіазний тип нефропатії — у 39%, латентний — у 61%, зниження функції нирок — у 54% обстежених хворих. Легкий перебіг суглобового синдрому відзначали у 19% випадків, середньої тяжкості — у 51%, тяжкий — в 30%. Результати та їх обговорення. За даними багатофакторного дисперсійного аналізу, інтегральні зміни пуринового обміну залежать від статі хворих на подагру, характеру перебігу суглобового синдрому і типу нефропатії, наявності ниркової недостатності, артеріальної гіпертензії, кісткових тофусів, субхондрального склерозу, епіфізарного остеопорозу й остеокістозу, а окремі показники корелюють із віком пацієнтів, тривалістю захворювання, залежать від форми артриту і ниркової патології. Висновки. Параметри пуринового обміну щільно пов’язані з окремими ознаками подагри, мають прогностичну значущість, беруть участь у патогенезі кістково-деструктивних уражень суглобів та у змінах електролітовидільної функції нирок.
Введение
Повсеместно наблюдается увеличение численности больных подагрой (Hayward R.A. et al., 2013), распространенность которой среди всего населения достигает 5% (Richette P. et al., 2013; Singh J.A., 2013). Высказывается мысль о существовании некой новой эпидемии этого заболевания в начале ХХІ в. (Kedar E., Simkin P.A., 2012), наносящей большой медико-социальный и экономический урон государствам в связи с частой временной и стойкой нетрудоспособностью больных (Trieste L. et al., 2012). В среднем по Украине подагрой болеют 10 человек на 10 тыс. населения, а в Закарпатской, Харьковской и Хмельницкой областях распространенность заболевания превышает 15 человек на 10 тыс. (Коваленко В.М., Корнацький В.М., 2013).
В процессе наблюдения 690 больных первичной подагрой мы дали оценку изменениям характера течения заболевания в последние полстолетия, представили происходящий половой и возрастной диморфизм заболевания, наблюдаемые особенности динамики суставного и почечного синдромов (Синяченко О.В., 2005). Цель данной работы — исследование клинико-патогенетической роли нарушений пуринового обмена при современном течении заболевания.
Объект и методы исследования
Под наблюдением находились 89 больных первичной подагрой в возрасте от 26 до 76 лет (в среднем — 51,6±1,17 года), среди которых 91% составляли мужчины и 9% — женщины. Диагноз соответствовал существующим критериям (Dalbeth N. et al., 2013; Radak-Perovic M., Zlatkovic-Svenda M., 2013). Длительность заболевания составила 12,6±0,89 года, причем первым признаком патологического процесса у 89% пациентов был суставной криз, а у 11% — почечная колика. Интермиттирующий артрит констатирован в 63% наблюдений, хронический — в 37%, легкое течение — в 19%, средней тяжести — в 51%, тяжелое — в 30%. Периферические тофусы выявлены у 51% больных, костные — у 67%, уролитиазный тип нефропатии диагностирован в 39% случаев, латентный — в 61%. Снижение функции почек установлено у 54% больных, из них I стадия хронической почечной недостаточности (ХПН) — у 21% общего числа пациентов и 40% числа с ХПН, II — соответственно у 17 и 31%, III — у 12 и 23%, IV — у 3 и 6%.
Метаболический синдром диагностирован в 74% случаев, артериальная гипертензия (>140/90 мм рт. ст.) — в 49%, гиперурикемия (>420 мкмоль/л у мужчин и >360 мкмоль/л у женщин) — в 71%, гиперурикозурия (>700 мг/сут) — в 64%, метаболический тип гиперурикемии — в 43%, почечный — в 12%, смешанный — в 45%. Параметры среднего артериального давления составили 117,8±1,73 мм рт. ст., общего периферического сосудистого сопротивления — 2348,3±63,42 дин·с·см.
Выполняли рентгенологическое («Multix-Compact-Siеmens», Германия) и ультразвуковое («Envisor-Philips», Нидерланды) исследование суставов и почек, а у части больных проведена компьютерная томография (aппарат «Somazom-Emotion-6 Siemens», Германия). Оценивали следующие показатели, отражающие состояние пуринового обмена: уровни мочевой кислоты крови (UA(b)) и мочи (UA(u)), оксипуринола (OP) в крови, их почечные клиренсы (соответственно CUA и COP), соотношение к клиренсу креатинина (CCr), активности ксантиноксидазы (XO), ксантиндезаминазы (XD), аденозиндезаминазы (AD), 5-нуклеотидазы (NT), содержание свинца и молибдена в волосах (соответственно Pb(h) и Mo), а также свинца в крови (Pb(b)). Применяли биоанализаторы «ВS-200» (Китай) и «Olympus-AU-640» (Япония) тензиореометры «MPT2-Lauda» (Германия), «ADSA-Toronto» (Германия — Канада) и «PAT2-Sinterface» (Германия), спектрофотометр «СФ-46» (Россия), электрографитовый атомизатор «SolAAr-Mk2-MOZe» (Великобритания). Параметры ОР и СОР определяли расчетным методом (Hande K.R. et al., 1994).
Изучали физико-химические показатели сыворотки крови — адсорбционный урикемический критерий (AUC) и реологический урикемический критерий (RUC) по формулам:
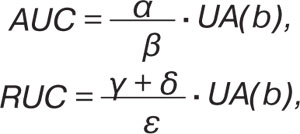 где α — статическое (равновесное) поверхностное натяжение, β — поверхностное натяжение при времени существования поверхности, равном 0,01 с, γ — поверхностная вязкость, δ — поверхностная упругость, ε — модуль вязкоупругости; UA(b) оценивали в ммоль/л. В контексте параметров функции почек определяли клиренсы электролитов — K, Na, Ca, Mg, Cl, P.
где α — статическое (равновесное) поверхностное натяжение, β — поверхностное натяжение при времени существования поверхности, равном 0,01 с, γ — поверхностная вязкость, δ — поверхностная упругость, ε — модуль вязкоупругости; UA(b) оценивали в ммоль/л. В контексте параметров функции почек определяли клиренсы электролитов — K, Na, Ca, Mg, Cl, P.
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного, непараметрического, корреляционного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы «Microsoft Excel» и «Statistica-Stat-Soft»). Оценивали средние значения (M), их стандартные отклонения (SD) и ошибки (m), коэффициенты корреляции, критерии дисперсии, Стьюдента, Уилкоксона — Рао, Макнемара — Фишера и отличия статистических показателей (p).
Результаты исследования
У обследованных больных подагрой показатели пуринового обмена оказались следующие: UA(b) — 523,2±15,01 мкмоль/л, UA(u) — 5,0±0,25 ммоль/л, CUA — 6,7±0,35 мл/мин, CUA/CCr — 9,9±0,85%, OP — 103,3±7,01 мкмоль/л, COP — 16,5±0,70 мл/мин, COP/CCr — 54,4±5,71%, XО — 6,9±0,45 нмоль/мл·мин, XD — 7,7±0,51 нмоль/мл·мин, АD — 12,4±1,77 нмоль/мл·мин, NТ — 6,0±0,11 нмоль/мл·мин, Pb(b) — 88,1±0,48 мкг/л, Pb(h) — 0,9±0,12 нг/г, Mo — 41,4±3,66 нг/г, АUС — 30,3±0,93 о.е., RUС — 1,8±0,07 о.е. По результатам выполненного многофакторного дисперсионного анализа Уилкоксона — Рао, из оцененных 34 клинико-лабораторных факторов на интегральное состояние пуринового обмена оказывают влияние пол больных, течение артрита, тип нефропатии, наличие ХПН, артериальной гипертензии, костных тофусов, субхондрального склероза, эпифизарного остеопороза и остеокистоза.
Как свидетельствует ANOVA, уровень урикемии зависит от характера течения артрита и наличия ХПН, урикурии — от пола и возраста больных, периферических и костных тофусов, CUA — от длительности заболевания, концентрация OP и активность XD — от степени снижения функции почек, активность XO — от формы артрита и нефропатии, AD — от наличия метаболического синдрома, NT — от метаболического синдрома и типа нефропатии, параметра AUC — от возраста пациентов и продолжительности болезни, RUC — от формирования периферических и костных тофусов.
Обсуждение
Как свидетельствуют результаты корреляционного анализа, с возрастом больных повышаются показатели UA(b) на фоне уменьшения COP и AUC, а соответственно увеличения длительности заболевания снижается активность XO и AD и значения AUC. Необходимо отметить, что, по нашим данным, 30 лет назад (Синяченко О.В., 1984) параметры урикемии и урикурии имели гендерные особенности и возрастной диморфизм, определялись типом подагрической нефропатии и степенью снижения функции почек, а не характером суставного синдрома, 20 лет назад (Синяченко О.В., Баринов Э.Ф., 1994) приоритет в отношении показателей UA(b), UA(u) и активности ферментов пуринового обмена (XO, AD) уже отдавался тяжести течения артрита с развитием костно-деструктивных изменений и тофусов, а на второй план выступала почечная патология. Факторы, определяющие пуриновый обмен при современном течении подагры, представлены выше.
Только содержание в организме пуринассоциированных микроэлементов (Mo, Pb) не связано с основными факторами течения суставного и почечного синдромов у больных подагрой. Одновременно на параметры CUA и COP оказывают достоверное дисперсионное влияние характер течения артрита, его тяжесть, тип нефропатии и функциональное состояние почек. Необходимо обратить внимание на зависимость концентрации ОР и активности AD от стадии ХПН. При этом между этими показателями существуют и достоверные корреляционные разнонаправленные связи. В этой связи мы считаем, что значения OP >170 мкмоль/л (>M+SD больных) являются прогнознегативными в отношении течения подагрической нефропатии с начавшимся снижением функции почек, а активность AD >30 нмоль/мл·мин — прогнозпозитивным критерием.
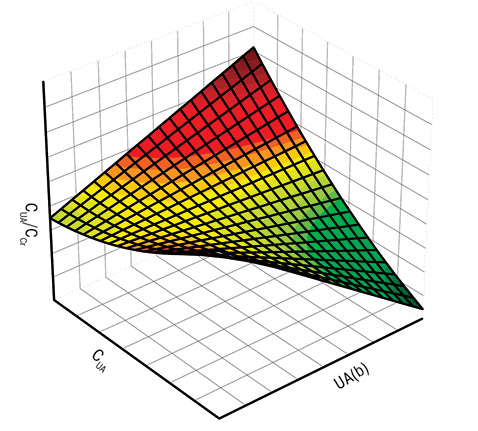
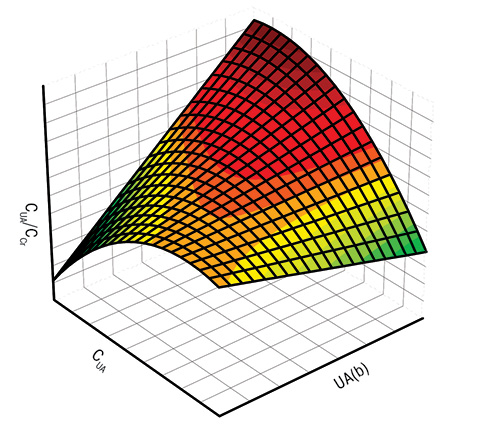
Хронический подагрический артрит, в отличие от интермиттирующего, сопровождается достоверным повышением (на 31%) показателя СОР и на 29% — активности XD при уменьшении соотношения CUA/CCr на 45% и СОР/СCr на 48%, что представлено в таблице. Гистограммы интегрального состояния обмена мочевой кислоты у больных с разными формами артрита нашли свое отражение на рис. 1.
Гистограммы интегральных показателей почечного выведения мочевой кислоты у больных с интермиттирующей (слева) и хронической (справа) формами подагрического артрита
| Показатель | Форма артрита | Форма нефропатии | ||
|---|---|---|---|---|
| интермиттирующая (n=56) | хроническая(n=33) | латентная(n=54) | уролитиазная(n=35) | |
| UA(b), мкмоль/л | 504,1±19,35 | 555,6±22,95 | 510,5±20,66 | 542,7±20,93 |
| UA(u), ммоль/л | 5,2±0,32 | 4,6±0,35 | 4,8±0,31 | 5,3±0,41 |
| CUA, мл/мин | 6,7±0,47 | 6,6±0,49 | 6,4±0,41 | 7,0±0,601 |
| CUA/CCr, % | 11,9±1,25 | 6,5±0,48 | 7,9±0,53 | 3,0±1,31 |
| OP, мкмоль/л | 110,4±8,14 | 91,3±12,81 | 91,9±9,07 | 121,0±10,50 |
| COP, мл/мин | 14,8±0,92 | 19,4±0,90 | 18,8±0,63 | 13,0±1,31 |
| COP/CCr, мл/мин | 66,0±8,57 | 34,6±2,90 | 38,5±3,47 | 78,8±12,52 |
| XO, нмоль/мл·мин | 6,8±0,50 | 7,1±0,87 | 6,4±0,44 | 7,7±0,91 |
| XD, нмоль/мл·мин | 7,0±0,57 | 9,0±0,94 | 6,7±0,46 | 9,3±1,03 |
| AD, нмоль/мл·мин | 14,1±2,68 | 9,3±0,98 | 14,5±2,77 | 9,0±0,90 |
| NT, нмоль/мл·мин | 5,8±0,15 | 6,2±0,14 | 6,2±0,14 | 5,6±0,17 |
| Pb(b), мкг/л | 88,2±0,61 | 88,0±0,78 | 87,2±0,64 | 89,6±0,55 |
| Pb(h), нг/г | 0,8±0,13 | 1,2±0,26 | 0,8±0,15 | 1,1±0,18 |
| Mo, нг/г | 40,6±3,98 | 44,5±9,64 | 35,6±4,28 | 47,6±5,73 |
| АUC, о.е. | 29,7±1,24 | 31,5±1,38 | 29,0±1,23 | 32,3±1,38 |
| RUC, о.е. | 1,8±0,08 | 1,9±0,11 | 1,8±0,09 | 1,8±0,09 |
Как видно (см. таблицу и рис. 2), уролитиазный тип подагрической нефропатии в сравнении с латентным проявляется достоверным повышением на 65% соотношения CUA/CCr и в 2,1 раза — COP/CCr, на 32% концентрации в сыворотке крови ОР, на 39% активности XD и на 3% содержания Pb(b) при уменьшении параметра СОР на 39% и активности NТ — на 10%. Снижение функции почек при подагрической нефропатии сопровождается повышением соотношения CUA/CCr на 92%, COP/CCr в 2,4 раза, концентрации в крови OP — на 96% и активности XO — на 52% при снижении показателя СОР на 46% и активности NТ — на 6%.
Следующим этапом нашей работы стала оценка участия отдельных параметров пуринового обмена в патогенетических построениях подагры. Уровень урикемии определяет развитие периферических тофусов, показатели UA(u) и CUA — формирование костных тофусов и состояние функции почек, что демонстрирует однофакторный дисперсионный анализ. Форма артрита, тяжесть его течения, тип нефропатии и функция почек зависят от параметров CUA/CCr, COP и COP/CCr. Активность молибденового фермента XО и сам Мо в организме больных оказались неспособными влиять на основные суставные и почечные проявления заболевания. В свою очередь, активность XD оказывает воздействие на форму артрита, тип нефропатии и функцию почек, AD — на появление периферических «подагрических шишек», NТ — только на развитие мочекаменной болезни. От содержания Pb в крови и волосах соответственно зависят тип нефропатии и костные тофусы.
Помимо сказанного, параметры урикемии и урикурии влияют на уровень артериального давления, определяя развитие у больных артериальной гипертензии, с активностью NТ тесно связаны показатели общего периферического сосудистого сопротивления, а концентрации Pb в крови и волосах участвуют в формировании инсулинорезистентности и других составляющих метаболического синдрома (гиперлипидемия, ожирение, сахарный диабет ІІ типа).
Степень сужения суставных щелей зависит от показателей СОР и Pb(b), субхондрального склероза — от Pb(b) и UA(b), эпифизарного остеопороза — от активности XD, остеокистоза — от UA(u), развитие остеоузураций — от содержания Pb(h) и Мо, изменений рогов менисков коленных суставов — от UA(b), UA(u), показателей OP и СОР. Если уровень AUC оказывает достоверное воздействие на развитие подхрящевого склероза и
повреждение суставных менисков, то параметры RUC не обладают каким бы то ни было негативным влиянием на рентгеносонографические признаки подагрического артрита. С составляющими пуринового метаболизма не связано формирование артрокальцинатов и кист Бейкера, которые выявлены соответственно у 17 и 16% обследованных больных. Костнодеструктивные суставные изменения не зависят от параметров CUA, CUA/CCr, COP/CCr, XO, AD и NT.
Показатель CUA/CCr обратно коррелирует с показателями CK, CNa, CCa, CMg. Помимо сказанного, скорость почечного выведения кальция прямо коррелирует с параметрами урикурии и активности XD, а магния — обратно соотносится с показателями оксипуринолемии.
В заключение прокомментируем некоторые последние данные литературы, касающиеся обсуждаемой проблемы. Как известно, через почки выделяется из организма около 70% мочевой кислоты, хотя процессы ее фильтрации, реабсорбции и секреции остаются не до конца изученными (Bobulescu I.A., Moe O.W., 2012). Нарушения ренального транспорта уратов являются основным механизмом развития подагрической нефропатии (George R.L., Keenan R.T., 2013; Mount D.B., 2013). Примерно ¼ столетия назад мы об этом тоже писали (Синяченко О.В. и соавт., 1988), но современное течение подагры те результаты исследований уже не подтверждают. Кроме того, мы не согласны с часто тиражируемым тезисом, что снижение функции почек у больных подагрой сопровождается накоплением в крови мочевой кислоты, содержание которой обратно пропорционально скорости клубочковой фильтрации (Whelton A. et al., 2011; Murea M., 2012), хотя 30 лет назад мы на этом также настаивали (Синяченко О.В. и соавт., 1984). Еще один факт. В эксперименте на гиперурикемических крысах линии Sprague Dawlеу установлено, что высокий уровень урикемии способен вызывать угнетение активности 1α-гидроксилазы и синтеза кальцитриола на фоне увеличения продукции паратиреоидного гормона и ядерного фактора kВ, что предрасполагает к развитию остеопороза (Chen W. et al., 2014). 20 лет назад мы описывали у больных подагрой гиперпаратиреоидный остеопороз, связанный с гиперурикемией (Синяченко О.В. и соавт., 1993), тогда как сейчас роль высокого уровня мочевой кислоты в крови такой категории пациентов уступает дефектам в системе пуринассоциированных ферментов.
Выводы
Каждое десятилетие сопровождается изменениями значимости отдельных показателей пуринового обмена в клиническом течении и патогенетических построениях подагры. В настоящее время, по данным выполненного вариационного, непараметрического, корреляционного, одно- и многофакторного дисперсионного анализа, интегральные изменения пуринового обмена зависят от пола больных, характера течения суставного синдрома и типа нефропатии, наличия ХПН, артериальной гипертензии, костных тофусов, субхондрального склероза, эпифизарного остеопороза и остеокистоза, а отдельные показатели коррелируют с возрастом пациентов (уровни UA(b), COP, AUC, RUC, активность AD), длительностью заболевания (показатели AUC, RUC, активности XO и AD), зависят от формы артрита и почечной патологии (CUA/CCr, COP, COP/CCr, активности XO, XD и NT, концентрация Pb(b)), имеют прогностическую значимость (содержание OP), участвуют в патогенезе костно-деструктивных поражений суставов и в изменениях электролитовыделительной функции почек.
Список использованной литературы
- Коваленко В.М., Корнацький В.М. (2013) Регіональні медико-соціальні проблеми хвороб системи кровообігу. Динаміка та аналіз. НАМНУ, Київ, 240 с.
- Синяченко О.В. (1984) Клиника поражения почек у больных подагрой. Врачеб. дело, 11: 48–51.
- Синяченко О.В. (2005) Как изменилось течение подагры за последние 50 лет? Укр. ревматол. журн., 22(4): 3–6.
- Синяченко О.В., Баринов Э.Ф. (1994) Подагра. Донеччина, Донецк, 248 с.
- Синяченко О.В., Дядык А.И., Василенко И.В. (1984) Подагрическая нефропатия. Лік. справа. Врачеб. дело, 7: 96–100.
- Синяченко О.В., Дядык А.И., Николенко Ю.И., Василенко И.В. (1988) Гиперурикемия как фактор риска нефропатии при подагре. Терапевт. арх., 60(1): 97–101.
- Синяченко О.В., Ткаченко Л.И., Толстой В.А., Мухин И.В. (1993) Микрокристаллические артропатии и гиперпаратиреоз. Лік. справа. Врачеб. дело, 2–3: 27–30.
- Bobulescu I.A., Moe O.W. (2012) Renal transport of uric acid: evolving concepts and uncertainties. Adv. Chronic Kidney Dis., 19(6): 358–371.
- Chen W., Roncal-Jimenez C., Lanaspa M. et al. (2014) Uric acid suppresses 1 alpha hydroxylase in vitro and in vivo. Metabolism., 63(1): 150–160.
- Dalbeth N., Fransen J., Jansen T.L. et al. (2013) New classification criteria for gout: a framework for progress. Rheumatology, 52(10): 1748–1753.
- George R.L., Keenan R.T. (2013) Genetics of hyperuricemia and gout: implications for the present and future. Curr. Rheumatol. Rep., 15(2): 309–312.
- Hande K.R., Noone S.M., Stone W.J. (1994) Severe allopurinol toxicity: dosiription and dnidelines for prevention in patients with renal insufficiency. Am. J. Med., 76: 47–51.
- Hayward R.A., Rathod T., Roddy E. et al. (2013) The association of gout with socioeconomic status in primary care: a cross-sectional observational study. Rheumatology, 52(11): 2004–2008.
- Kedar E., Simkin P.A. (2012) A perspective on diet and gout. Adv. Chronic. Kidney Dis., 19(6): 392–397.
- Mount D.B. (2013) The kidney in hyperuricemia and gout. Curr. Opin. Nephrol. Hypertens., 22(2): 216–223.
- Murea M. (2012) Advanced kidney failure and hyperuricemia. Adv. Chronic. Kidney Dis., 19(6): 419–424.
- Radak-Perovic M., Zlatkovic-Svenda M. (2013) Novelties in gout. Srp. Arh. Celok. Lek., 141(1–2): 109–115.
- Richette P., Clerson P., Perissin L. et al. (2013) Revisiting comorbidities in gout: a cluster analysis. Ann. Rheum. Dis., 9(10): 130–135.
- Singh J.A. (2013) Racial and gender disparities among patients with gout. Curr. Rheumatol. Rep., 15(2): 307–311.
- Trieste L., Palla I., Fusco F. et al. (2012) The economic impact of gout: a systematic literature review. Clin. Exp. Rheumatol., 30(4): 145–148.
- Whelton A., Macdonald P.A, Zhao L. et al. (2011) Renal function in gout: long-term treatment effects of febuxostat. J. Clin. Rheumatol., 17(1): 7–13.
Адрес для переписки:
Синяченко Олег Владимирович
E-mail: synyachenko@ukr.net

Leave a comment